1.本发明涉及治疗性药物组合物领域。尤其是,本发明涉及医药制剂领域,该药物组合物含有一种与covid-19rbd特异性结合的人源化抗体。
背景技术:
2.截至2020年6月9日,新型冠状病毒covid-19(2019-ncov)的全球确诊病例已超700万例,死亡病例累计已超40万例,对公众的生命和健康造成重大威胁。
3.然而,目前对于该病毒还没有特效药物。
4.引发此次疫情的元凶是covid-19属于冠状病毒。同属冠状病毒的重症急性呼吸综合征冠状病毒(sars-cov)以及中东呼吸综合征冠状病毒(mers-cov)也曾在分别在2002-2003年和2012年引发疫情。据世界卫生组织(who)统计sars-cov共引发8000人感染,794人死亡(https://www.who.int/)。自2012年至今,mers-cov感染病毒病例在持续增加,截至2019年底,全球确诊2499例感染病例,861例死亡病例。2020年1月12日,世界卫生组织正式将该新型冠状病毒命名为"2019新型冠状病毒(2019-ncov)",其后在2020年2月11-12日国际病毒分类委员会(international committee on taxonomy of viruses,ictv)宣布,新型冠状病毒的正式分类名为严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,sars-cov-2),世界卫生组织(who)同日在日内瓦举办全球研究和创新论坛上宣布,由这一病毒导致的疾病的正式名称为"covid-19"。
5.病毒要感染细胞,首先需要通过囊膜蛋白结合宿主的受体。抗体,尤其是中和活性抗体,通过结合到囊膜蛋白上,阻断病毒与细胞受体的结合,从而阻断病毒感染。同时,抗体结合到囊膜蛋白上,从而对游离的病毒或是被感染的细胞进行标记,通过抗体的fc区募集巨噬细胞或是补体等免疫细胞和免疫分子,从而清除游离的病毒以及被感染的细胞。因此,靶向受体结合区(rbd)的抗体,不但具有中和病毒感染的活性,还可以通过fc区发挥作用,促进病毒以及被感染细胞的清除。
6.基于对其它冠状病毒,尤其是sars-cov和mers-cov的研究,与受体结合的重要囊膜蛋白是刺突蛋白(s)。s可进一步分为s1和s2两部分。s2的作用是介导膜融合。s1的n端(ntd)和c端(ctd)都可能是rbd。通过对covid-19的研究,本发明发现ctd是covid-19的rbd,其结合受体ace2。因此靶向rbd的抗体,并且是阻断s与ace2结合的抗体,可能成为抑制病毒感染的中和抗体。本发明的目的是针对covid-19,提供了特异的具有保护效果的人源中和抗体。
技术实现要素:
7.本发明所述的药物组合物是一种含有与covid-19特异性结合的人源化单克隆抗体的高稳定性药物组合物。特别地,本发明发现与covid-19特异性结合的人源化单克隆抗体在组氨酸缓冲液体系和甘露醇、蔗糖或海藻糖的组合中具有出人意料的特征,即具有高稳定性。
8.本发明提供了一种药物组合物,包含:(1)缓冲液;(2)人源化单克隆抗体或其抗原结合片段,其中,所述人源化单克隆抗体特异性结合covid-19rbd。
9.在一些方案中,所述药物组合物中人源化单克隆抗体或其抗原结合片段的浓度约为1-300mg/ml,优选约为10-200mg/ml,更优选约为20-150mg/ml,更优选约为40-120mg/ml;更有选约为40-100mg/ml;更优选地,上述人源化单克隆抗体或其抗原结合片段浓度约为5mg/ml,10mg/ml,15mg/ml,20mg/ml,25mg/ml,30mg/ml,35mg/ml,40mg/ml,45mg/ml,50mg/ml,60mg/ml,70mg/ml,80mg/ml,90mg/ml,100mg/ml,110mg/ml,120mg/ml,130mg/ml,140mg/ml,150mg/ml,160mg/ml,170mg/ml,180mg/ml或200mg/ml,优选约为40mg/ml,60mg/ml,70mg/ml,80mg/ml,90mg/ml,100mg/ml,120mg/ml。
10.在一些方案中,上述缓冲液选自醋酸缓冲液、柠檬酸缓冲液和组氨酸缓冲液中一种或一种以上。
11.在一些方案中,上述缓冲液为组氨酸缓冲液,优选地,所述组氨酸缓冲液选自组氨酸-盐酸盐缓冲液或组氨酸-醋酸盐缓冲液,优选组氨酸-盐酸盐缓冲液。
12.在一些方案中,上述组氨酸-盐酸盐缓冲液由组氨酸和组氨酸盐酸盐制成,优选l-组氨酸和l-组氨酸单盐酸盐。在一些方案中,组氨酸缓冲液由1-30mm的l-组氨酸和1-30mm的l-组氨酸单盐酸盐制成。在一些方案中,组氨酸缓冲液由摩尔比为1:1到1:4的组氨酸和组氨酸盐酸盐制成。在一些方案中,组氨酸缓冲液由摩尔比为1:1组氨酸和组氨酸盐酸盐制成。在一些方案中,组氨酸缓冲液由摩尔比为1:3的组氨酸和组氨酸盐酸盐制成。在一些方案中,组氨酸制剂为:由4.5mm的l-组氨酸和15.5mm的l-组氨酸单盐酸盐制成的ph为5.5的组氨酸缓冲剂。在一些方案中,组氨酸制剂为:由7.5mm的l-组氨酸和22.5mm的l-组氨酸单盐酸盐制成的ph为5.5的组氨酸缓冲剂。在一些方案中,组氨酸制剂为:由10mm的组氨酸和10mm的组氨酸盐酸盐制成的ph为6.0的组氨酸缓冲液。在一些方案中,组氨酸制剂为:由15mm的组氨酸和15mm的组氨酸盐酸盐制成的ph为6.0的组氨酸缓冲液。
13.在一些方案中,上述组氨酸缓冲液为组氨酸-醋酸盐缓冲液,优选地,两者的摩尔比为1:1到1.5:1,优选地,此类缓冲液的ph为5.5
±
0.3,优选约为5.5,优选地,这类缓冲液含有15-20mm的组氨酸和12-15mm的醋酸。
14.在一些方案中,上述缓冲液为醋酸缓冲液,优选地,所述醋酸缓冲液为醋酸-醋酸钠缓冲液或醋酸-醋酸钾缓冲液,优选醋酸-醋酸钠缓冲液。
15.在一些方案中,上述缓冲液为柠檬酸缓冲液,优选地,所述柠檬酸缓冲液为柠檬酸-柠檬酸钠缓冲液。
16.在一些方案中,上述缓冲液为琥珀酸缓冲液,优选地,所述琥珀酸缓冲液为琥珀酸-琥珀酸钠缓冲液。
17.在一些方案中,上述缓冲液的浓度约为1-200mm,优选约为1-100mm,优选约为5-50mm,优选约为10-30mm;优选约为10-20mm;优选约为20-30mm;上述缓冲液浓度非限制性实施例约为5mm,10mm,15mm,20mm,25mm,30mm、40mm、45mm、50mm、60mm、70mm、80mm、90mm、100mm、105mm、110mm、115mm、120mm、130mm、140mm、150mm、160mm、170mm或180mm或这些范围内任意两个数值作为端点形成的范围,优选为10mm、15mm、20mm、25mm或30mm。
18.在一些方案中,上述缓冲液的ph约为5.0-6.5,优选约为5.0-6.0,优选约为5.5-6.5,优选约为5.0-5.5,优选约为5.5-6.0,优选约为6.0-6.5,上述缓冲液的ph非限制性实
施例约为5.0,5.1,5.2,5.3,5.4,5.5,5.6,5.7,5.8,5.9,6.0,6.1,6.2,6.3,6.4,6.5,优选约为5.5或6.0。
19.在一些方案中,上述的药物组合物还包括稳定剂。
20.在一些方案中,所述稳定剂选自盐酸精氨酸、脯氨酸、甘氨酸、氯化钠、甘露醇、山梨醇、蔗糖、麦芽糖、木糖醇和海藻糖中的一种或一种以上。
21.在一些方案中,上述稳定剂选自甘露醇、蔗糖和海藻糖中的一种或一种以上。
22.在一些方案中,上述稳定剂的浓度为约10mm~400mm,优选50mm~300mm,更优选100mm~300mm,更优选200mm~300mm。
23.在一些方案中,上述稳定剂为浓度约30-200mm的氯化钠;或所述稳定剂为浓度约100-300mm的甘露醇;或所述稳定剂为浓度约100-300mm的山梨醇;或所述稳定剂为浓度约100-300mm的蔗糖;或所述稳定剂为浓度约100-300mm的海藻糖;或所述稳定剂为浓度约30-200mm的盐酸精氨酸;或所述稳定剂为浓度约100-300mm的脯氨酸;或所述稳定剂为浓度约100-300mm的甘氨酸。
24.在一些方案中,上述稳定剂为氯化钠。在一些方案中,上述稳定剂为浓度约30-200mm的氯化钠,上述氯化钠的浓度优选约为50-190mm,优选约为100-180mm,优选约为120-170mm,优选约为130-150mm,上述氯化钠浓度的非限制性实施例为约100mm,110mm,120mm,125mm,130mm,135mm,140mm,145mm,150mm,155mm,160mm,170mm,180mm,190mm,200mm,优选135mm或140mm。
25.在一些方案中,上述稳定剂为甘露醇。在一些方案中,上述稳定剂为浓度约100-300mm的甘露醇,上述甘露醇的浓度优选约为150-300mm,优选约为180-280mm,优选约为200-260mm,上述甘露醇浓度的非限制性实施例为约200mm,210mm,220mm,225mm,230mm,235mm,240mm,245mm,250mm,260mm,270mm,280mm,优选为235mm。
26.在一些方案中,上述稳定剂为山梨醇。在一些方案中,上述稳定剂为浓度约100-300mm的山梨醇,上述山梨醇的浓度优选约为150-300mm,优选约为180-280mm,优选约为200-260mm,上述山梨醇浓度的非限制性实施例为约200mm,210mm,220mm,230mm,235mm,240mm,250mm,260mm,270mm,280mm,优选为235mm。
27.在一些方案中,上述稳定剂为蔗糖。在一些方案中,上述稳定剂为浓度约100-300mm的蔗糖,上述蔗糖的浓度优选约为150-300mm,优选约为180-280mm,优选约为200-260mm,上述蔗糖浓度的非限制性实施例为约200mm,210mm,220mm,230mm,235mm,240mm,250mm,260mm,270mm,280mm,优选为235mm。
28.在一些方案中,上述稳定剂为海藻糖。在一些方案中,上述稳定剂为浓度约100-300mm的海藻糖,上述海藻糖的浓度优选约为150-300mm,优选约为180-280mm,优选约为200-260mm,上述海藻糖浓度的非限制性实施例为约180mm,200mm,210mm,220mm,230mm,235mm,240mm,250mm,260mm,270mm,280mm,优选为235mm。
29.在一些方案中,上述稳定剂为盐酸精氨酸。在一些方案中,上述稳定剂为浓度约30-200mm的盐酸精氨酸,上述盐酸精氨酸的浓度优选约为50-190mm,优选约为100-180mm,优选约为120-170mm,优选约为130-150mm,上述盐酸精氨酸浓度的非限制性实施例为约100mm,110mm,120mm,125mm,130mm,135mm,140mm,145mm,150mm,155mm,160mm,170mm,180mm,190mm,200mm,优选135mm或140mm。
30.在一些方案中,上述稳定剂为脯氨酸。在一些方案中,上述稳定剂为浓度约100-300mm的脯氨酸,上述脯氨酸的浓度优选约为150-300mm,优选约为200-280mm,上述脯氨酸浓度的非限制性实施例为约180mm,200mm,210mm,220mm,230mm,240mm,250mm,260mm,270mm,280mm,优选为240mm。
31.在一些方案中,上述稳定剂为甘氨酸。在一些方案中,上述稳定剂为浓度约100-300mm的甘氨酸,上述甘氨酸的浓度优选约为150-300mm,优选约为200-280mm,上述甘氨酸浓度的非限制性实施例为约180mm,200mm,210mm,220mm,230mm,240mm,250mm,260mm,270mm,280mm,优选为260mm。
32.在一些方案中,上述药物组合物还包括表面活性剂,所述表面活性剂选自聚山梨醇酯80、聚山梨醇酯20或泊洛沙姆188。
33.在一些方案中,上述表面活性剂选自聚山梨醇酯80。
34.在一些方案中,上述表面活性剂选自聚山梨醇酯20。
35.在一些方案中,以w/v计算,上述表面活性剂浓度约为0.001%-0.1%,优选约为0.01%-0.1%,优选约为0.02%-0.08%;作为非限制性实施例,上述表面活性剂的浓度约为0.02%,0.04%或0.08%。
36.在一些方案中,上述人源化单克隆抗体或其抗原结合片段具有分别如seq id no:1、seq id no:2和seq id no:3所示的hcdr1、hcdr2和hcdr3,和分别如seq id no:4、seq id no:5和seq id no:6所示的lcdr1、lcdr2和lcdr3。
37.在一些方案中,上述人源化单克隆抗体具有如氨基酸序列如seq id no:7所示的重链可变区,和氨基酸序列如seq id no:8所示的轻链可变区。
38.在一些方案中,上述人源化单克隆抗体具有如seq id no:9所示的重链氨基酸序列,和如seq id no:10所示的轻链氨基酸序列。
39.在一些方案中,上述药物组合物,其包含如下(1)-(14)任一项所示的组分,其中,人源化单克隆抗体或其抗原结合片段如本发明任一实施方案所述:
40.(1)(a)约20mg/ml-150mg/ml的人源化单克隆抗体或其抗原结合片段;(b)约5-50mm组氨酸缓冲液,ph约为5.0-6.5;(c)约50-200mm的氯化钠;(d)以及约0.01%-0.1%的聚山梨醇酯80;或
41.(2)(a)约20mg/ml-150mg/ml的人源化单克隆抗体或其抗原结合片段;(b)约5-50mm组氨酸缓冲液,ph约为5.0-6.5;(c)约100-300mm的甘露醇;(d)以及约0.01%-0.1%的聚山梨醇酯80;或
42.(3)(a)约20mg/ml-150mg/ml的人源化单克隆抗体或其抗原结合片段;(b)约5-50mm组氨酸缓冲液,ph约为5.0-6.5;(c)约100-300mm的蔗糖;(d)以及约0.01%-0.1%的聚山梨醇酯80;或
43.(4)(a)约20mg/ml-150mg/ml的人源化单克隆抗体或其抗原结合片段;(b)约5-50mm组氨酸缓冲液,ph约为5.0-6.5;(c)约100-300mm的海藻糖;(d)以及约0.01%-0.1%的聚山梨醇酯80;或
44.(5)(a)约20mg/ml-150mg/ml的人源化单克隆抗体或其抗原结合片段;(b)约10-30mm醋酸缓冲液,ph约为5.5-6.0;(c)约100-300mm的甘露醇;(d)以及约0.01%-0.1%的聚山梨醇酯80;或
45.(6)(a)约20mg/ml-150mg/ml的人源化单克隆抗体或其抗原结合片段;(b)约10-30mm柠檬酸缓冲液,ph约为5.5-6.0;(c)约100-300mm的甘露醇;(d)以及约0.01%-0.1%的聚山梨醇酯80;
46.优选地,所述药物组合物包含:
47.(7)(a)约40mg/ml-120mg/ml的人源化单克隆抗体或其抗原结合片段;(b)约10-30mm组氨酸缓冲液,ph约为5.5-6.0;(c)约200-300mm的甘露醇;(d)以及约0.02%-0.08%的聚山梨醇酯80;或
48.(8)(a)约40mg/ml-120mg/ml的人源化单克隆抗体或其抗原结合片段;(b)约10-30mm组氨酸缓冲液,ph约为5.5-6.0;(c)约200-300mm的蔗糖;(d)以及约0.02%-0.08%的聚山梨醇酯80;或
49.(9)(a)约40mg/ml-120mg/ml的人源化单克隆抗体或其抗原结合片段;(b)约10-30mm组氨酸缓冲液,ph约为5.5-6.0;(c)约200-300mm的海藻糖;(d)以及约0.02%-0.08%的聚山梨醇酯80;
50.更优选地,所述药物组合物包含:
51.(10)(a)约40mg/ml的人源化单克隆抗体或其抗原结合片段;(b)约20mm组氨酸缓冲液,ph约为6.0;(c)约235mm的甘露醇;(d)以及约0.02%的聚山梨醇酯80;或
52.(11)(a)约40mg/ml的人源化单克隆抗体或其抗原结合片段;(b)约20mm组氨酸缓冲液,ph约为6.0;(c)约235mm的蔗糖;(d)以及约0.02%的聚山梨醇酯80;或
53.(12)(a)约40mg/ml的人源化单克隆抗体或其抗原结合片段;(b)约20mm组氨酸缓冲液,ph约为6.0;(c)约240mm的海藻糖;(d)以及约0.02%的聚山梨醇酯80;或
54.(13)(a)约80mg/ml的人源化单克隆抗体或其抗原结合片段;(b)约20mm组氨酸缓冲液,ph约为6.0;(c)约235mm的蔗糖;(d)以及约0.08%的聚山梨醇酯80;或
55.(14)(a)约80mg/ml的人源化单克隆抗体或其抗原结合片段;(b)约20mm组氨酸缓冲液,ph约为6.0;(c)约240mm的海藻糖;(d)以及约0.08%的聚山梨醇酯80。
56.在一些方案中,所述药物组合物为液体制剂或冻干制剂。
57.在一些方案中,所述药物组合物为液体制剂。
58.在一些方案中,上述液体制剂或冻干制剂于2-8℃稳定至少3个月,至少6个月,至少12个月,至少18个月或至少24个月。
59.在一些方案中,上述水溶液或冻干制剂于40℃稳定至少7天,至少14天或至少28天。
60.本发明还提供了上述药物组合物在制备治疗或预防covid-19感染的药物中的用途。
61.本发明还提供组氨酸缓冲液和选自甘露醇、蔗糖和海藻糖中的一种或多种稳定剂以及任选的表面活性剂(优选聚山梨醇酯80)在提高与covid-19特异性结合的人源化单克隆抗体的药物制剂的稳定性中的应用,或在制备稳定性提高的与covid-19特异性结合的人源化单克隆抗体的药物制剂中的应用。优选地,所述组氨酸缓冲液、稳定剂以及表面活性剂及其用量如本文任一实施方案所述;所述稳定性如本文任一实施方案所述。
附图说明
62.图1:人源化单克隆抗体cb6(批号20200307)与covid-19rbd蛋白的结合(binding)elisa分析。
63.图2:人源化单克隆抗体cb6(批号20200307)与covid-19rbd蛋白的阻断(blocking)elisa分析。
64.图3:人源化单克隆抗体cb6(批号20200306)阻断covid-19感染huh-7细胞。
65.图4:人源化单克隆抗体cb6(批号20200306)阻断covid-19感染vero e6细胞。
具体实施方式
66.定义和说明
67.为了更容易理解本发明,以下具体定义了某些技术和科学术语。除非在本文中另有明确定义,本文使用的所有其它技术和科学术语都具有本发明所属领域的一般技术人员通常理解的含义。应理解本发明不限于具体的方法、试剂、化合物、组合物或生物系统,当然可以对以上进行变化。还应理解本技术所用术语仅为了描述具体的实施方式,并不旨在进行限制。
68.除非该内容被另外明确说明,否则本说明书以及所附权利要求中所用的单数形式"一个"、"一种"和"该"包括复数指代。因此,例如,提及"一种多肽"包括了两种或更多种多肽等的组合。
69.术语"药物组合物"或“制剂”表示含有一种或多种本文所述抗体与其他组分的混合物,所述其他组分例如生理学可药用的载体和赋形剂。药物组合物的目的是促进对生物体的给药,利于活性成分的吸收进而发挥生物活性。
70.术语“液体制剂”是指处于液体状态下的制剂,且不意图指称重悬浮的冻干制剂。本发明的液体制剂在储存时稳定,并且其稳定性不依赖于冻干(或其他状态改变方法,例如喷雾干燥)。
71.术语“水性液体制剂”是指使用水作为溶剂的液体制剂。在一些方案中,水性液体制剂是不需冻干、喷雾干燥和/或冷冻来维持稳定性(例如化学和/或物理稳定性和/或生物活性)的制剂。
72.术语“赋形剂”是指可以向制剂添加以提供所需特性(例如稠度、提高的稳定性)和/或调节渗透压的试剂。常用赋形剂的实例包括但不限于糖类、多元醇、氨基酸、表面活性剂和聚合物。
73.本技术所用的"约"在指代可测量数值(如量、持续时间等)时意在涵盖相对于具体数值
±
20%或
±
10%的变化,包括
±
5%、
±
1%和
±
0.1%,因为这些变化适于进行所公开的方法。
74.术语"缓冲液ph约为5.0-6.5"是指这样的试剂,通过其酸/碱共轭组分的作用使得包含该试剂的溶液能抵抗ph变化。本发明的制剂中使用的缓冲液可具有约5.0至约6.5范围内的ph、或约5.5至约6.5范围内的ph、或约5.0至约6.0范围内的ph。
75.在本文中,将ph控制在该范围内的“缓冲液”实例包括乙酸盐(例如乙酸钠)、琥珀酸盐(例如琥珀酸钠)、葡萄糖酸、组氨酸、组氨酸盐酸盐、甲硫氨酸、柠檬酸盐、磷酸盐、柠檬酸盐/磷酸盐、咪唑、醋酸、醋酸盐、枸橼酸盐、其组合和其他有机酸缓冲剂。
76."组氨酸缓冲液"为包含组氨酸离子的缓冲液。组氨酸缓冲液的实例包括组氨酸和组氨酸的盐,如组氨酸盐酸盐、组氨酸乙酸盐、组氨酸磷酸盐和组氨酸硫酸盐等,如含有组氨酸与组氨酸盐酸盐的组氨酸缓冲液;本发明的组氨酸缓冲液也包括含有组氨酸和醋酸盐(如钠盐或钾盐)的组氨酸缓冲液。
[0077]“柠檬酸盐缓冲液”是包括柠檬酸根离子的缓冲液。柠檬酸盐缓冲液的实例包括柠檬酸-柠檬酸纳、柠檬酸-柠檬酸钾、柠檬酸-柠檬酸钙、柠檬酸-柠檬酸镁等。优选的柠檬酸盐缓冲液为柠檬酸-柠檬酸纳缓冲液。
[0078]“醋酸盐缓冲液”是包括醋酸根离子的缓冲液。醋酸盐缓冲液的实例包括醋酸-醋酸纳、醋酸-醋酸钾、醋酸-醋酸钙、醋酸-醋酸镁等。优选的醋酸盐缓冲液为醋酸-醋酸纳缓冲液。
[0079]“琥珀酸盐缓冲液”是包括琥珀酸根离子的缓冲液。琥珀盐缓冲液的实例包括琥珀酸-琥珀酸纳、琥珀-琥珀酸钾、琥珀酸-琥珀酸钙、琥珀酸-琥珀酸镁等。优选的琥珀酸盐缓冲液为琥珀-琥珀酸纳缓冲液。
[0080]
术语“稳定剂”表示药学上可接受的赋形剂,其在制造,储存和应用过程中保护活性药物成分和/或制剂免受化学和/或物理降解。稳定剂包括但不限于如以下定义的糖,氨基酸,盐,多元醇和他们的代谢产物,例如氯化钠、氯化钙、氯化镁、甘露醇、山梨醇、蔗糖、海藻糖、精氨酸或其盐(如盐酸精氨酸)、甘氨酸、丙氨酸(α-丙氨酸、β-丙氨酸)、甜菜碱、亮氨酸、赖氨酸、谷氨酸、天冬氨酸、脯氨酸、4-羟基脯氨酸、肌氨酸、γ-氨基丁酸(gaba)、奥品类(opines)、丙氨奥品、章鱼碱、甘氨奥品(strombine))和三甲胺的n-氧化物(tmao)、人血清白蛋白(hsa)、牛血清白蛋白(bsa)、α-酪蛋白、球蛋白、α-乳白蛋白、ldh、溶菌酶、肌红蛋白、卵清蛋白和rnaasea。部分稳定剂,如氯化钠、氯化钙、氯化镁、甘露醇、山梨醇、蔗糖等也可起到控制渗透压的作用。在本发明中具体地使用的稳定剂选自多元醇、氨基酸、盐、糖中的一种或一种以上。优选的糖为蔗糖和海藻糖,优选的多元醇为甘露醇。优选的氨基酸为精氨酸或其盐(如盐酸精氨酸)、甘氨酸、脯氨酸。优选的稳定剂为氯化钠、甘露醇、山梨醇、蔗糖、海藻糖、盐酸精氨酸、甘氨酸、脯氨酸、氯化钠-山梨醇、氯化钠-甘露醇、氯化钠-蔗糖、氯化钠-海藻糖、盐酸精氨酸-甘露醇、盐酸精氨酸-蔗糖,更优选为盐酸精氨酸、氯化钠-蔗糖、盐酸精氨酸-甘露醇、盐酸精氨酸-蔗糖,更优选为盐酸精氨酸-蔗糖。在特别优选的实施方案中,本发明使用的稳定剂选自甘露醇、蔗糖和海藻糖中的一种或多种。
[0081]
术语“表面活性剂”一般包括保护蛋白质例如抗体免受空气/溶液界面诱导的应力、溶液/表面诱导的应力的影响以减少抗体的聚集或使制剂中颗粒物的形成最小化的试剂。示例性的表面活性剂包括但不限于非离子型表面活性剂例如聚氧乙烯脱水山梨醇脂肪酸酯(如聚山梨醇酯20和聚山梨醇酯80)、聚乙烯-聚丙烯共聚物、聚乙烯-聚丙烯二醇、聚氧乙烯-硬脂酸酯、聚氧乙烯烷基醚、例如聚氧乙烯单月桂基醚、烷基苯基聚氧乙烯醚(triton-x)、聚氧乙烯-聚氧丙烯共聚物(泊洛沙姆,pluronic)、十二烷基硫酸钠(sds)。在特别优选的实施方案中,本发明使用的表面活性剂为聚山梨醇酯80。
[0082]
术语"等渗"是指该制剂具有与人血液基本相同的渗透压。等渗制剂一般具有约250至350mosm的渗透压。可使用蒸汽压或冰点下降式的渗透压计测量等渗性。
[0083]
术语“稳定的”制剂是其中的抗体在制造过程期间和/或储存时基本上保持其物理稳定性和/或化学稳定性和/或生物活性的制剂。即使所含的抗体在经过一定时间储存之后
未能保持其100%的化学结构或生物功能,医药制剂也可以是稳定的。在某些情况下,在经过一定时间储存之后,能维持约90%、约95%、约96%、约97%、约98%或约99%的抗体结构或功能,也可被认为是“稳定的”。用于测量蛋白质稳定性的各种分析技术在本技术领域中是可得的,并综述在《肽和蛋白质药物递送》(peptide and protein drug delivery)247-301,vincent lee主编,marcel dekker,inc.,new york,n.y.,pubs.(1991)),和jones,a.(1993)adv.drug delivery rev.10:29-90中(二者引入作为参考)。
[0084]
制剂在一定温度下经过一定时间的储存之后,通过测定其中剩余的天然抗体的百分比(及其它方法),可以测量其稳定性。除其它方法外,天然抗体的百分比可以通过尺寸排阻色谱法(例如尺寸排阻高效液相色谱法[sec-hplc])来测量,“天然的”指未聚集的和未降解的。在一些方案中,蛋白质的稳定性按照具有低百分比的降解(例如片段化)和/或聚集蛋白质的溶液中单体蛋白质的百分数来确定。在一些方案中,制剂可以在室温、约25-30℃或40℃下稳定储存至少2周、至少28天、至少1个月、至少2个月、至少3个月、至少4个月、至少5个月、至少6个月、至少7个月、至少8个月、至少9个月、至少10个月、至少11个月、至少12个月、至少18个月、至少24个月,或更长,最多不超过约6%、5%、4%、3%、2%、1%、0.5%,或0.1%聚集形式的抗体。
[0085]
通过测定在离子交换期间在此抗体主馏分(“主要荷电形式”)较为酸性的馏分中迁移的抗体(“酸性形式”)的百分比(及其它方法),可以测量稳定性,其中稳定性与酸性形式抗体的百分比成反比。除其它方法外,“酸化”抗体的百分比可以通过离子交换色谱法(例如阳离子交换高效液相色谱法[cex-hplc])来测量。在一些实施方式中,可接受程度的稳定性意为当制剂在一定温度下经过一定时间的储存之后,其中可检测出的酸性形式的抗体最多不超过约49%、45%、40%、35%、30%、25%、20%、15%、10%、5%、4%、3%、2%、1%、0.5%或0.1%。在测量稳定性之前储存的一定时间可以是至少2周、至少28天、至少1个月、至少2个月、至少3个月、至少4个月、至少5个月、至少6个月、至少7个月、至少8个月、至少9个月、至少10个月、至少11个月、至少12个月、至少18个月、至少24个月,或更长。当评估稳定性时,容许储存医药制剂的一定温度可以是约-80℃至约45℃范围内的任何温度,例如储存于约-80℃、约-30℃、约-20℃、约0℃、约2-8℃、约5℃、约25℃,或约40℃。
[0086]
如果抗体在颜色和/或澄清度目测检查时或通过uv光散射或通过孔径排阻层析测量时基本上不显示出例如聚集、沉淀和/或变性的迹象,则所述抗体在该药物组合物中“保持其物理稳定性”。聚集是单个分子或复合物共价或非共价缔合以形成聚集体的过程。聚集可以进行到形成可见沉淀物的程度。
[0087]
制剂的稳定性例如物理稳定性可以通过本技术领域中公知的方法来评估,包括测量样品的表观消光度(吸光度或光密度)。这样的消光测量与制剂的浊度相关。制剂的浊度部分地是溶解在溶液中的蛋白质的固有性质,并且通常通过比浊法来测量,并用比浊法浊度单位(ntu)来量度。
[0088]
随着例如溶液中一种或多种组分的浓度(例如蛋白质和/或盐浓度)而变化的浊度水平也被称为制剂的“乳浊”或“乳浊外观”。浊度水平可以参照使用已知浊度的悬液产生的标准曲线来计算。用于测定药物组合物的浊度水平的参比标准品可以基于《欧洲药典》标准(《欧洲药典》(european pharmacopoeia),第四版,“欧洲药品质量委员会指令”(directorate for the quality of medicine of the council of europe)(edqm),
strasbourg,france)。根据《欧洲药典》标准,澄清溶液被定义为浊度低于或等于按照《欧洲药典》标准具有约3的参比悬液的浊度的溶液。比浊法的浊度测量可以检测在不存在缔合或非理想效应的情况下的瑞利散射,其通常随浓度线性变化。用于评估物理稳定性的其他方法在本技术领域中是公知的。
[0089]
如果抗体在给定时间点的化学稳定性使得抗体被认为仍保持如下文中所定义的其生物活性,则所述抗体在药物组合物中“保持其化学稳定性”。可以通过例如检测或定量抗体的化学改变的形式来评估化学稳定性。化学改变可以包括尺寸改变(例如剪短),其可以使用例如孔径排阻层析、sds-page和/或基质辅助的激光解吸电离/飞行时间质谱(maldi/tof ms)来评估。其他类型的化学改变包括电荷改变(例如作为脱酰胺或氧化的结果而发生),其可以通过例如离子交换层析来评估。
[0090]
如果药物组合物中的抗体对于其预期目的来说是生物活性的,则所述抗体在药物组合物中“保持其生物活性”。例如,如果制剂于例如5℃、25℃、45℃等温度下储存一定时间(例如1至12个月)之后,该制剂所含人源化单克隆抗体与covid-19结合的亲和力为所述储存之前抗体结合亲和力的至少90%、95%或以上,则可认为本发明之制剂是稳定的。结合亲和力也可用例如elisa或等离子共振技术测定。
[0091]
在本发明的情形中,在药理学意义上,抗体的“治疗有效量”或“有效量”是指在抗体可以有效治疗的障碍的症状的预防或治疗或减轻方面有效的量。本发明中,药物的“治疗有效量”或“治疗有效剂量”是当单独使用或与另一种治疗剂组合使用时保护受试者免于疾病发作或促进疾病消退的任何量的药物,所述疾病消退通过疾病症状的严重性的降低,疾病无症状期的频率和持续时间的增加,或由疾病痛苦引起的损伤或失能的预防来证明。药物促进疾病消退的能力可以使用本领域技术人员已知的多种方法来评价,比如在临床试验期间的人受试者中,在预测人类功效的动物模型系统中,或通过在体外测定法中测定所述药剂的活性。药物治疗有效量包括“预防有效量”,即当单独或如与其它治疗药物组合给与处于患病风险的受试者或患病复发的受试者时,抑制疾病的发展或复发的任何量的药物。
[0092]
术语“受试者”或“患者”意图包括哺乳动物生物体。受试者/患者的实例包括人类和非人类哺乳动物,例如非人类灵长动物、狗、奶牛、马、猪、绵羊、山羊、猫、小鼠、兔、大鼠和转基因非人类动物。在本发明的特定实施方式中,受试者是人类。
[0093]
术语“施用”、“给与”及“处理”是指采用本领域技术人员已知的各种方法或递送系统中的任意一种将包含治疗剂的组合物引入受试者。抗pd-1抗体的给药途径包括静脉内、肌内、皮下、腹膜、脊髓或其他胃肠外给药途径,比如注射或输注。“胃肠外给药”是指除了肠内或局部给药以外的通常通过注射的给药方式,包括但不限于静脉内、肌内、动脉内、鞘内、淋巴内、损伤内、囊内、框内、心内、皮内、腹膜内、经气管、皮下、表皮下、关节内、囊下、蛛网膜下、脊柱内、硬膜内和胸骨内注射和输注以及经体内电穿孔。
[0094]
抗体
[0095]
本文所用的术语“抗体”应被理解为包括完整抗体分子及其抗原结合片段。本文所用的术语抗体的“抗原结合部分”或“抗原结合片段”(或简称为“抗体部分”或“抗体片段”)是指抗体中保持了与covid-19(2019-新型冠状病毒)或其表位特异性结合能力的一个或多个片段。
[0096]
本文所用的术语“全长抗体”或“完整抗体分子”指包含四条肽链的免疫球蛋白分
子,两条重(h)链(全长时约50-70kda)和两条轻(l)链(全长时约25kda)通过二硫键互相连接。每一条重链由重链可变区(在本文中缩写为vh)和重链恒定区(在本文中缩写为ch)组成。重链恒定区由3个结构域ch1、ch2和ch3组成。每一条轻链由轻链可变区(在本文中缩写为vl)和轻链恒定区组成。轻链恒定区由一个结构域cl组成。vh和vl区可被进一步细分为具有高可变性的互补决定区(cdr)和其间隔以更保守的称为框架区(fr)的区域。每一个vh或vl区由按下列顺序:fr1、cdr1、fr2、cdr2、fr3、cdr3、fr4从氨基末端至羧基末端排列的3个cdr和4个fr组成。重链和轻链的可变区含有与抗原相互作用的结合结构域。抗体的恒定区可介导免疫球蛋白对宿主组织或因子(包括免疫系统的各种细胞(例如,效应细胞)和经典补体系统的第一组分(clq))的结合。
[0097]
当在本文中使用时,术语“cdr”是指抗体可变序列内的互补决定区。在重链和轻链的各个可变区中存在3个cdr,其对于各个重链和轻链可变区被命名为hcdr1、hcdr2和hcdr3或lcdr1、lcdr2和lcdr3。这些cdr的准确边界按照不同的系统有不同的定义。
[0098]
本发明的所述抗体的可变区cdr的精确氨基酸序列边界可使用许多公知的方案中的任何一种方案来确定,包括由kabat等人(1991),“sequences of proteins of immunological interest,第5版.public health service,national institutes of health,bethesda,md(“kabat”编号方案)描述的kabat方案和lefranc m.-p.等人描述的imgt方案(1999nucleic acids research,27,209-212)。
[0099]
本文所使用的“抗原结合片段”包括抗体的片段或其衍生物,通常包括亲代抗体的抗原结合区或可变区(例如一个或多个cdr)的至少一个片段,其保持亲代抗体的至少一些结合特异性。抗原结合片段的实例包括但不限于fab,fab',f(ab')2和fv片段;双抗体;线性抗体;单链抗体分子,例如sc-fv;由抗体片段形成的纳米抗体(nanobody)和多特异性抗体。当抗体的结合活性在摩尔浓度基础上表示时,结合片段或其衍生物通常保持亲代抗体抗原结合活性的至少10%。优选结合片段或其衍生物保持亲代抗体的抗原结合亲和力的至少20%、50%、70%、80%、90%、95%或100%或更高。还预期抗体的抗原结合片段可包括不明显改变其生物活性的保守或非保守氨基酸取代(称为抗体的“保守变体”或“功能保守变体”)。
[0100]
当提及配体/受体、抗体/抗原或其它结合对时,“特异性”结合是指在蛋白和/或其它生物试剂的异质群体中确定是否存在所述蛋白。例如本发明的单克隆抗体与covid-19rbd蛋白的结合反应。因此,在所指定的条件下,特定的配体/抗原与特定的受体/抗体结合,并且并不以显著量与样品中存在的其它蛋白结合。
[0101]
本文所述的人源化单克隆抗体或其抗原结合片段包括申请号为202010114283.8中描述的任意一个人源化单克隆抗体,本文将其所公开的全部内容以引入的方式纳入本文。在一些方案中,在本发明的方法和组合物中使用的抗体的cdr序列包括来自于202010114283.8中描述的抗体cb6的cdr序列。
[0102]
在本文实施例中所用的非限制性、示范性抗体选自cn201811515045.7中描述的人源化抗体cb6,其能够与人covid-19rbd特异性结合。其中,抗体cb6具有氨基酸序列分别如seq id no:1、seq id no:2和seq id no:3所示的hcdr1、hcdr2和hcdr3,和分别如seq id no:4、seq id no:5和seq id no:6所示的lcdr1、lcdr2和lcdr3;优选地,抗体cb6具有氨基酸序列如seq id no:7所示的重链可变区和如seq id no:8所示的轻链可变区;优选地,抗
体cb6具有如seq id no:9所示的重链氨基酸序列和如seq id no:10所示的轻链氨基酸序列。
[0103]
医药制剂
[0104]
本发明所述的药物组合物是一种含有与covid-19特异性结合的人源化抗体的高稳定性药物组合物。特别地,本发明发现组氨酸缓冲液体系和甘露醇、蔗糖或海藻糖的组合具有高的稳定性。
[0105]
本发明提供了一种药物组合物,包含:(1)缓冲液;(2)人源化单克隆抗体或其抗原结合片段,其中,所述人源化单克隆抗体特异性结合covid-19rbd。
[0106]
本发明药物组合物中的人源化单克隆抗体抗体具有氨基酸序列分别如seq id no:1、seq id no:2和seq id no:3所示的hcdr1、hcdr2和hcdr3,和分别如seq id no:4、seq id no:5和seq id no:6所示的lcdr1、lcdr2和lcdr3;优选地,本发明药物组合物中的人源化单克隆抗体具有氨基酸序列如seq id no:7所示的重链可变区和如seq id no:8所示的轻链可变区;更优选地,本发明药物组合物中的人源化单克隆抗体具有分别如seq id no:9所示的重链氨基酸序列和如seq id no:10所示的轻链氨基酸序列。
[0107]
本发明的药物组合物中,人源化单克隆抗体或其抗原结合片段浓度约为1-300mg/ml,优选约为10-200mg/ml,更优选约为20-150mg/ml,更优选约为40-120mg/ml,更优选约为40-100mg/ml;更优选地,上述人源化单克隆抗体或其抗原结合片段浓度约为5mg/ml,10mg/ml,15mg/ml,20mg/ml,25mg/ml,30mg/ml,35mg/ml,40mg/ml,45mg/ml,50mg/ml,60mg/ml,70mg/ml,80mg/ml,90mg/ml,100mg/ml,110mg/ml,120mg/ml,130mg/ml,140mg/ml,150mg/ml,160mg/ml,170mg/ml,180mg/ml或200mg/ml,优选约为40mg/ml,60mg/ml,70mg/ml,80mg/ml,90mg/ml,100mg/ml,120mg/ml。
[0108]
本发明药物组合物中的缓冲液可选自醋酸缓冲液、柠檬酸缓冲液和组氨酸缓冲液,用以为本发明的药物组合物提供约5.0到6.5、优选约5.0到6.0,更优选约5.5-6.0,更优选为约6.0的ph。另一方面,用于本发明药物组合物中的缓冲液的ph约为5.0-6.5,优选约为5.0-6.0,更优选约5.5-6.0,更优选为约6.0。
[0109]
本发明药物组合物中特别优选的缓冲液是组氨酸缓冲液,包括组氨酸-盐酸盐缓冲液或组氨酸-醋酸盐缓冲液,优选组氨酸-盐酸盐缓冲液。更优选地,所述组氨酸-盐酸盐缓冲液由组氨酸和组氨酸盐酸盐制成,优选l-组氨酸和l-组氨酸单盐酸盐。在一些方案中,组氨酸缓冲液由1-20mm的l-组氨酸和1-20mm的l-组氨酸单盐酸盐制成。在一些方案中,组氨酸缓冲液由摩尔比为1:1到1:4的组氨酸和组氨酸盐酸盐制成。在一些方案中,组氨酸缓冲液由摩尔比为1:1组氨酸和组氨酸盐酸盐制成。在一些方案中,组氨酸缓冲液由摩尔比为1:3的组氨酸和组氨酸盐酸盐制成。在一些方案中,组氨酸缓冲液为:由4.5mm的l-组氨酸和15.5mm的l-组氨酸单盐酸盐制成的ph约为5.5的组氨酸缓冲剂。在一些方案中,组氨酸缓冲液为:由7.5mm的l-组氨酸和22.5mm的l-组氨酸单盐酸盐制成的ph为约5.5的组氨酸缓冲剂。在一些方案中,组氨酸缓冲液为:由15mm的l-组氨酸和15mm的l-组氨酸单盐酸盐制成的ph为约6.0的组氨酸缓冲液。在一些方案中,组氨酸缓冲液为:由10mm的l-组氨酸和10mm的l-组氨酸单盐酸盐制成的ph为约6.0的组氨酸缓冲液。
[0110]
因此,本发明的药物组合物可含有:ph为5.5-6.0的组氨酸-组氨酸盐酸盐缓冲液,其在药物组合物中的浓度为10-30mm;和40-120mg/ml、优选40-100mg/ml的前文任一实施方
案所述的人源化单克隆抗体或其抗原结合片段,尤其是本文所述的cb6抗体或其抗原结合片段。
[0111]
在一些方案中,本发明的药物组合物还含有稳定剂。优选地,所述稳定剂选自盐酸精氨酸、脯氨酸、甘氨酸、氯化钠、甘露醇、山梨醇、蔗糖、麦芽糖、木糖醇和海藻糖中的一种或一种以上。优选地,药物组合物中的稳定剂选自甘露醇、蔗糖和海藻糖。本发明的药物组合物中稳定剂的浓度为约10mm-400mm,优选50mm-300mm,更优选100mm-300mm。在一些方案中,稳定剂为浓度约30-200mm的氯化钠;或所述稳定剂为浓度约100-300mm、优选200-300mm的甘露醇;或所述稳定剂为浓度约100-300mm、优选200-300mm的蔗糖;或所述稳定剂为浓度约100-300mm、优选200-300mm的海藻糖。
[0112]
因此,在一些实施方案中,本发明的药物组合物含有:ph为5.5-6.0的组氨酸-组氨酸盐酸盐缓冲液,其在药物组合物中的浓度为10-30mm;40-120mg/ml、优选40-100mg/ml的前文任一实施方案所述的人源化单克隆抗体或其抗原结合片段,尤其是本文所述的cb6抗体或其抗原结合片段;以及100mm-300mm的稳定剂,优选地,所述稳定剂包括甘露醇、氯化钠、蔗糖和海藻糖中的一种,优选为100-300mm的甘露醇、100-300mm的蔗糖和100-300mm的海藻糖。在一些实施方案中,所述稳定剂为200-300mm的的蔗糖。在一些实施方案中,所述稳定剂为200-300mm的的海藻糖。在一些实施方案中,所述稳定剂为200-300mm的甘露醇。
[0113]
在一些方案中,本发明的药物组合物还包括表面活性剂。优选的表面活性剂选自聚山梨醇酯80、聚山梨醇酯20和泊洛沙姆188。最优选的表面活性剂是聚山梨醇酯80。以w/v计,本发明药物组合物中表面活性剂的浓度约为0.001%-0.1%,优选约为0.02%-0.08%。作为非限制性实施例,本发明药物组合物中表面活性剂的浓度约为0.02%,0.04%或0.08%。
[0114]
因此,在一些实施方案中,本发明的药物组合物含有:ph为5.5-6.0的组氨酸-组氨酸盐酸盐缓冲液,其在药物组合物中的浓度为10-30mm;40-120mg/ml、优选40-100mg/ml的前文任一实施方案所述的人源化单克隆抗体或其抗原结合片段,尤其是本文所述的cb6抗体或其抗原结合片段;100mm-300mm的稳定剂,优选地,所述稳定剂为100-300mm的的蔗糖,或100-300mm的甘露醇,或100-300mm的海藻糖;以及以w/v计0.02%-0.08%的聚山梨醇酯80。
[0115]
本发明的药物组合物可以是液体制剂,或者是冻干制剂。
[0116]
医药用途和方法
[0117]
本发明还提供了用于治疗或预防covid-19感染相关疾病的本发明任一实施方案所述的药物组合物,本发明任一实施方案所述的药物组合物在制备治疗或预防covid-19感染相关疾病的药物中的用途,以及给予需要的个体或患者治疗有效量的本发明任一实施方案所述的药物组合物以治疗或预防covid-19感染相关疾病的方法。
[0118]
本发明中,covid-19感染相关的疾病指covid-19感染导致发生和发展的疾病。
[0119]
下文将以具体实施例的方式阐述本发明。应理解,这些实施例仅仅是阐述性的,并非意图限制本发明的范围。实施例中所用到的方法和材料,除非另有说明,否则为本领域的常规方法和材料。
[0120]
实施例1:缓冲液体系、ph、辅料、蛋白浓度筛选实验
[0121]
液体型药物组合物中,缓冲液体系、ph、辅料、蛋白浓度密切影响抗体的稳定性,每
种具有独特理化性质的抗体都具有最适宜的缓冲液的种类、ph和辅料条件。本实施例旨在筛选一种最佳缓冲液体系、ph和辅料,使本发明公开的人源化抗体具有最佳的稳定性以适宜临床应用。
[0122]
本实施例以约20mg/ml和40mg/ml浓度的抗体cb6进行。样品使用millipore pellicon3 0.11m2膜进行超滤浓缩换液,换液后样品处于相应的处方中,样品放置在密闭的离心管中进行缓冲液筛选。缓冲液体系筛选了醋酸缓冲液、柠檬酸酸缓冲液和组氨酸缓冲液,ph从5.5到6.0(如表1所示)。辅料筛选了氯化钠、蔗糖、海藻糖或甘露醇进行了比较测试。即将上述不同的辅料分别加入含约20mg/ml或40mg/ml浓度抗体cb6的缓冲液中,具体处方信息如表1所示。将样品放置在40
±
2℃环境下,分别在第0周、第2周、第4周取出进行分析检测。
[0123]
蛋白降解的主要途径是聚集物、裂解产品和带电变体的形成。采用尺寸排阻色谱法(sec-hplc)测定天然形式(蛋白单体)与聚集形式所占的百分比,采用阳离子交换色谱法(cex-hplc)测定酸性与碱性形式抗体所占的百分比。以放置四周(4w)的sec-hplc单体含量和cex-hplc主峰含量,拟合直线并计算下降斜率(%/周)考察不同缓冲液体系、ph、辅料、蛋白浓度对抗体cb6稳定性的影响。
[0124]
通过以下参数评估稳定性:(1)目视外观和可见异物;(2)紫外分光光度法测定蛋白含量;(3)sec-hplc测量抗体单体、聚体或片段的含量;(4)cex-hplc测量抗体主要电荷、酸性电荷或碱性电荷含量;(5)nr-ce-sds法检测抗体的分子量;(6)r-ce-sds法检测抗体的分子量;(7)elisa法检测抗体结合活性。
[0125]
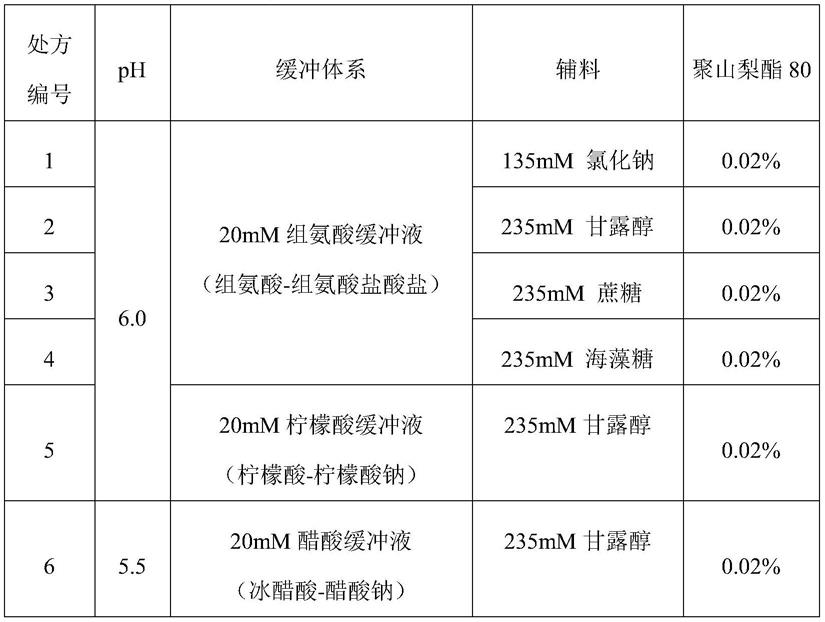
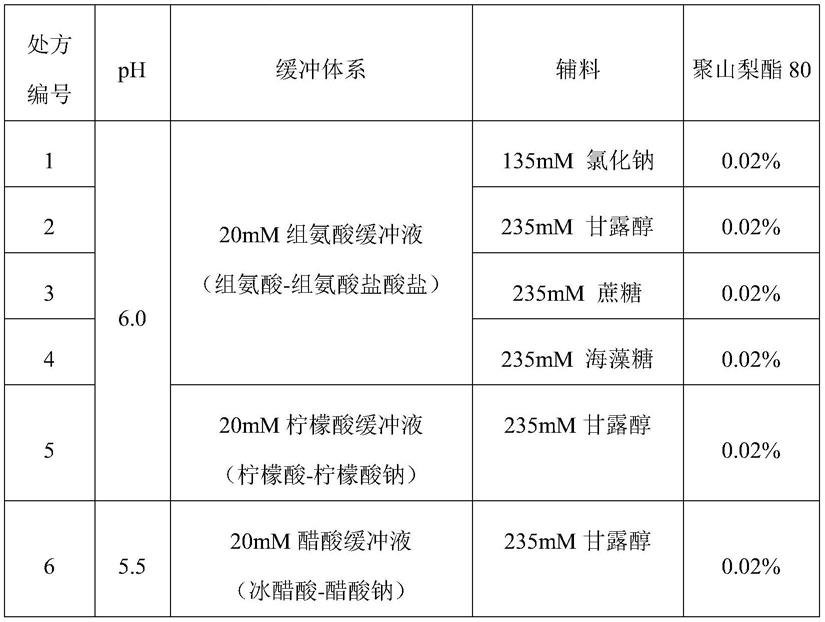
表1:缓冲液体系、ph、辅料和蛋白浓度筛选实验中的处方信息
[0126][0127]
实验结果见表2。
[0128]
处方1和处方5在蛋白浓度40mg/ml条件下有较重乳光,浓度20mg/ml无异常,其他
处方浓度20mg/ml和40mg/ml蛋白含量和外观均无异常,说明氯化钠和ph6.0柠檬酸缓冲体系不适合本产品高浓度稳定性。
[0129]
sec-hplc实验检测中,在40
±
2℃加速条件下,处方5单体含量下降速度较快,处方2、3和4的单体含量下降速率相对较低,平均下降速率0.4%/周,蛋白浓度在20mg/ml和40mg/ml情况下对纯度影响不大。
[0130]
cex-hplc下降速率结果显示,在40
±
2℃加速条件下,处方5和处方6cex主峰含量下降较快。处方1、2、3和4的cex主峰含量下降速率相对较低,蛋白浓度在20mg/ml和40mg/ml情况下对纯度影响不大。
[0131]
结合活性(elisa法)和nr-ce-sds纯度无异常,r-ce-sds纯度有轻微下降。
[0132]
表2:缓冲液体系、ph、辅料和蛋白浓度筛选实验结果
[0133][0134]
综合各项检测数据,对比处方1~处方4发现,辅料甘露醇、蔗糖和海藻糖优于氯化钠,处方2和处方5对比得出组氨酸缓冲体系优于枸橼酸缓冲体系,表现在后者有较重的乳光;ph5.5醋酸缓冲体系含辅料甘露醇(处方6)的sec-hplc纯度和cex主峰下降均较快,因此,ph6.0的组氨酸缓冲体系含辅料甘露醇、蔗糖和海藻糖(处方2/3/4)条件下对蛋白浓度高低不敏感且稳定性整体较好。
[0135]
根据上述筛选结果,选择ph6.0的组氨酸缓冲体系,辅料甘露醇、蔗糖和海藻糖进行后续研究。
[0136]
实施例2:制剂的处方稳定性考察
[0137]
2.1振摇稳定性
[0138]
选用抗体原液,配制如表3所示的处方制剂,抗体浓度为40mg/ml。手工无菌灌装到2ml西林瓶每瓶2.0ml,在80rpm或150rpm,25
±
2℃连续振摇后,通过外观和sec-hplc测量抗体单体、聚体或片段的含量进行稳定性考察,具体信息见表4。
[0139]
表3:稳定性考察处方信息
[0140][0141]
表4:振摇稳定性考察
[0142][0143]
在80rpm或150rpm,25
±
2℃连续振摇后,三个处方在外观和sec-hplc纯度方面无显著变化,表现出较好的稳定性,具体见表5。
[0144]
表5:处方筛选-振摇
[0145][0146]
2.2生理盐水稀释稳定性
[0147]
选用抗体原液,配制如表3所示的处方制剂,抗体浓度为40mg/ml。用生理盐水(0.9%nacl)稀释样品至不同浓度,于25
±
2℃放置8小时后进行检测,考察样品稳定性,进行处方条件确认,筛选结果见表6。
[0148]
表6:处方稳定性筛选结果
[0149][0150]
三个处方抗体制剂在生理盐水稀释条件下稳定性好,与输液管和输液袋的相容性良好。
[0151]
通过对样品在此处方条件下,进行振摇、生理盐水稀释的稳定性考察实验,对单体含量没有大的影响,表现了处方良好的稳定性。
[0152]
通过对不同缓冲体系,不同ph条件、不同抗体浓度和不同辅料组成进行考察,探索研究人源化抗体cb6的稳定性,并确定相对最佳水针制剂配方。抗体cb6选择组氨酸和盐酸组氨酸缓冲液来调节ph,甘露醇、蔗糖或海藻糖来调节制剂渗透压,添加聚山梨酯80来增加制剂溶解性。
[0153]
实施例3:单抗制剂与covid-19病毒s蛋白的rbd的结合特异性以及高结合活性
[0154]
将重组sars-cov-2(covid-19)s蛋白rbd(novoprotein,货号dra32)稀释至3.0μg/ml包被,在微孔板振荡器上振摇2h。洗板并用2%脱脂牛奶封闭。加入不同浓度的对照抗体(igg1亚型的同行对照抗体)和cb6抗体(从40μg/ml到0.009537ng/ml,4倍梯度稀释,按照处方2配置),孵育1小时并洗板。再与1:5000稀释的山羊抗人igg(fc特异性)过氧化物酶抗体(sigma公司,货号a0170)孵育1小时,然后与hrp底物tmb(sigma,货号t2885)孵育15分钟显色,检测抗体与covid-19病毒s蛋白的rbd的结合信号。使用对数(激动剂)对响应变量的斜率曲线拟合(graphpad prism)拟合ec
50
。
[0155]
实验结果见图1。通过结合(binding)elisa测定,cb6抗体与重组sars-cov-2s蛋白rbd具有较高的结合特异性和结合活性,ec
50
为21.7ng/ml。
[0156]
实施例4:单抗制剂可有效阻断covid-19病毒s蛋白的rbd与其受体ace2的结合
[0157]
将重组人ace2(c-6his)(novoprotein,货号c419)稀释至3.0μg/ml包板,37℃温育90min。洗板并用2%脱脂牛奶封闭。用2%脱脂牛奶将重组的sars-cov-2s蛋白rbd(c-mfc)(novoprotein,货号dra32)稀释至1.0μg/ml,再用对照抗体(igg1亚型的同行对照抗体)和
cb6抗体(从400μg/ml到0.2μg/ml,2倍梯度稀释,按照处方2配置)。将混合物加入板中孵育1小时并洗板。通过与1:5000稀释的过氧化物酶标记羊抗鼠fc片断二抗(sigma公司,货号a2554)孵育1小时,再加入tmb(sigma,货号t2885)并孵育20分钟。使用软件graphpad prism拟合js016的ic
50
。
[0158]
实验结果见图2。通过阻断(blocking)elisa测定,cb6抗体能够有效阻断covid-19病毒s蛋白的rbd与其受体ace2的结合,ic
50
为22.8μg/ml,表明cb6抗体可以抑制covid-19 rbd与包被的ace2受体融合蛋白的结合。
[0159]
实施例5:单抗制剂可有效阻断假病毒侵染靶细胞的作用
[0160]
将表达全序列covid-19刺突蛋白和萤光素酶报告基因的covid-19假病毒(终浓度为10000tcid
50
/ml)与对照抗体(抗klh抗体,lala)或梯度稀释后的cb6抗体(从10μg/ml至0.128ng/ml,5倍梯度稀释,按照处方2配置)1:1混合后共孵育1h。
[0161]
将huh-7细胞以每孔5
×
104个细胞接种在白壁透底的96孔板中,然后将100μl抗体和假病毒的混合液添加到细胞中,置于37℃培养箱孵育24小时。孵育结束后,向每孔加入70μl one-glo
tm
萤火虫荧光素酶底物,并用酶标仪(perkinelmer/envision)进行荧光检测。
[0162]
将vero e6细胞以每孔1
×
104个细胞接种在白壁透底的96孔板中,然后在37℃的培养箱中放置3小时直至细胞贴壁。待细胞贴壁后,将100μl抗体和假病毒的混合液添加到细胞中,置于37℃培养箱孵育22小时。孵育结束后,向每孔加入70μl one-glo
tm
萤火虫荧光素酶底物,并用酶标仪(perkinelmer/envision)进行荧光检测。
[0163]
抑制率=[1-(实验组荧光强度平均值-空白对照平均值)/(阴性对照组荧光强度平均值-空白对照平均值)]
×
100%。使用软件graphpad prism作图并拟合ic
50
。
[0164]
cb6抗体可以有效抑制covid-19假病毒感染huh-7及veroe6细胞,ic
50
分别为0.1831nm(0.02747μg/ml)及0.07628nm(0.01144μg/ml),详细结果见图3和图4。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。