基因peftsh5及其在提高蝴蝶兰抗致病菌侵染中的应用
技术领域
1.本发明涉及生物品种培育领域,尤其涉及基因peftsh5及其在提高蝴蝶兰抗致病菌侵染中的应用。
背景技术:
2.兰科是有花植物中最大科之一,兰科植物因其花型奇特、多变,花色丰富,深受人们喜爱。对兰花的分子生物学研究是目前研究兰花的热点之一。蝴蝶兰(phalaenopsis aphrodite rchb.f.)为兰科蝴蝶兰属,又称蝶兰,因花形似蝴蝶而得名,原产于亚热带雨林地区。蝴蝶兰素有“洋兰王后”之称,尤其在新春时节,叶腋抽出长长的花梗,开出形如蝴蝶飞舞般的花朵,花形美丽别致、色彩艳丽、花期长;而蝴蝶兰的叶片质地厚,扁平,椭圆形、长圆状披针形至倒卵状披针形,通常较宽,基部多少收狭,具关节和抱茎的鞘,花时宿存或花期在旱季时凋落。蝴蝶兰凭借其花大叶美很受大众欢迎。
3.ftsh基因最初由4个不同的研究小组在筛选不同的大肠杆菌表现型时独立发现。santos和de almeida(1975)在研究细胞分裂时,鉴定出对温度敏感的纤丝生成(filamentation temperature
‑
sensitive)突变体ftsh1,并命名为ftsh基因。蛋白酶ftsh由ftsh基因编码的一种atp和zn
2
依赖型蛋白,由分子量70~80kda的同型或异型亚基组成六聚复合体,单个亚基没有生物活性。在拟南芥中,ftsh通过寡聚化形成一个六聚环形结构,将蛋白水解活性位点埋在六聚复合体孔穴的中央,ftsh是一种保守的膜结合金属蛋白酶。
4.在枯草芽孢杆菌、乳酸乳球菌等原核生物以及酵母、拟南芥、烟草、苜蓿等多种真核生物中都发现了ftsh,说明此基因在生物基因组中广泛分布。在原核生物中,ftsh基因是单顺反子或多顺反子操纵子的一部分,ftsh蛋白定位在细胞质膜上;而在真核生物中,已知的ftsh均定位于叶绿体膜或线粒体膜上。目前,peftsh5基因在蝴蝶兰中的表达情况及功能尚不明确。
5.随着生活水平的提高,植物花卉越来越受到人们关注,蝴蝶兰作为受众广泛的观赏植物具有广大的市场前景和经济价值;然而各种植物病害严重影响其培育成本,甚至带来严重损失,因此,本领域技术人员致力于提供一种提高蝴蝶兰抗致病菌侵染的方法。
技术实现要素:
6.有鉴于现有技术的上述缺陷,本发明所要解决的技术问题是如何提高蝴蝶兰抗致病菌侵染的能力。
7.一方面,本技术提供了基因peftsh5,其特征在于,所述基因peftsh5编码的蛋白序列如seq id no.2所示。
8.另一方面,本技术还提供了基因peftsh5在提高蝴蝶兰抗致病菌侵染中的应用,其特征在于,所述应用包括下调蝴蝶兰中peftsh5基因的表达。
9.在某些实施方式中,所述下调包括基因沉默或基因敲除。
10.在某些实施方式中,所述基因沉默使得沉默后植株与野生型植株相比,peftsh5基因的表达量下降60%
‑
70%。
11.在某些实施方式中,所述peftsh5基因编码的蛋白序列如seq id no.2所示。
12.在某些实施方式中,所述peftsh5基因的编码序列如seq id no.1所示。
13.在某些实施方式中,所述致病菌包括灰葡萄孢菌和\或辣椒疫霉菌。
14.在某些实施方式中,所述致病菌为灰葡萄孢菌。
15.在某些实施方式中,所述致病菌为辣椒疫霉菌。
16.另一方面,本技术还提供了一种预防或治疗蝴蝶兰灰霉病的方法,其特征在于,所述应用包括下调蝴蝶兰中peftsh5基因的表达。
17.在某些实施方式中,所述下调包括基因沉默或基因敲除。
18.在某些实施方式中,所述基因沉默使得沉默后植株与野生型植株相比,peftsh5基因的表达量下降60%
‑
70%。
19.在某些实施方式中,所述peftsh5基因编码的蛋白序列如seq id no.2所示。
20.在某些实施方式中,所述peftsh5基因的编码序列如seq id no.1所示。
21.另一方面,本技术还提供了一种提高蝴蝶兰抗致病菌侵染的方法,其特征在于,所述方法包括下调蝴蝶兰中peftsh5基因的表达。
22.在某些实施方式中,所述下调包括基因沉默或基因敲除。
23.在某些实施方式中,所述基因沉默使得沉默后植株与野生型植株相比,peftsh5基因的表达量下降60%
‑
70%。
24.在某些实施方式中,所述peftsh5基因编码的蛋白序列如seq id no.2所示。
25.在某些实施方式中,所述peftsh5基因的编码序列如seq id no.1所示。
26.在某些实施方式中,所述致病菌包括灰葡萄孢菌和\或辣椒疫霉菌。
27.在某些实施方式中,所述致病菌为灰葡萄孢菌。
28.在某些实施方式中,所述致病菌为辣椒疫霉菌。
29.另一方面,本技术还提供了一种提高烟草抗辣椒疫霉菌侵染的方法,其特征在于,所述应用包括下调烟草中nbftsh5基因的表达。
30.在某些实施方式中,所述下调包括基因沉默或基因敲除。
31.在某些实施方式中,所述基因沉默使得沉默后植株与野生型植株相比,nbftsh5基因的表达量下降60%
‑
70%。
32.在某些实施方式中,所述nbftsh5基因的编码序列如seq id no.3所示。
33.另一方面,本技术还提供了一种预防或治疗烟草辣椒疫霉菌病的方法,其特征在于,所述应用包括下烟草中nbftsh5基因的表达。
34.在某些实施方式中,所述下调包括基因沉默或基因敲除。
35.在某些实施方式中,所述基因沉默使得沉默后植株与野生型植株相比,nbftsh5基因的表达量下降60%
‑
70%。
36.在某些实施方式中,所述nbftsh5基因的编码序列如seq id no.3所示。
37.另一方面,本技术还提供了nbftsh5基因在提高烟草抗辣椒疫霉菌侵染中的应用,所述应用包括下调烟草中nbftsh5基因的表达。
38.在某些实施方式中,所述下调包括基因沉默或基因敲除。
39.在某些实施方式中,所述基因沉默使得沉默后植株与野生型植株相比,nbftsh5基因的表达量下降60%
‑
70%。
40.在某些实施方式中,所述nbftsh5基因的编码序列如seq id no.3所示。
41.另一方面,本技术还提供了一种核酸分子nbftsh5,其特征在于,所述核酸分子nbftsh5的编码序列如seq id no.3所示。
42.另一方面,本技术还提供了引物对,所述引物对的序列如seq id no.5和6所示,所述引物对用于沉默烟草基因nbftsh5。
43.本技术通过病毒诱导的基因沉默(virus induced gene silencing,vigs)降低了蝴蝶兰peftsh5基因的表达,分析peftsh5沉默株系和野生型株对灰葡萄孢菌的抗性,证明了降低蝴蝶兰植株peftsh5的表达能够显著提高其抗灰葡萄孢菌侵染的能力;此外,本技术还通过vigs降低了蝴蝶兰peftsh5基因在烟草中的同源基因nbftsh5的的表达,分析nbftsh5沉默株系和野生型株对辣椒疫霉菌的抗性,通过对nbftsh5沉默烟草株系及相应对照植株对辣椒疫霉菌侵染抗性的分析,证明了降低烟草植株nbftsh5基因的表达以及降低蝴蝶兰植株peftsh5的表达能够显著提高其抗辣椒疫霉菌侵染的能力。本技术为培育抗病新品种,预防和治疗蝴蝶兰灰霉病,以及预防和治疗烟草或蝴蝶兰辣椒疫霉菌病提供了有效方法,降低了培育成本,提高了市场经济效益。以下将结合附图对本发明的构思、具体结构及产生的技术效果作进一步说明,以充分地了解本发明的目的、特征和效果。
附图说明
44.图1显示的是本技术中的peftsh5在小兰屿蝴蝶兰不同器官中的表达模式分析结果图。
45.图2显示的是本技术中nbftsh5沉默后烟草叶片的表型。
46.图3显示的是本技术中的nbftsh5沉默株系与对照株系中nbftsh5表达量变化分析结果图。
47.图4显示的是本技术中的nbftsh5沉默株系与对照株系中水杨酸合成相关基因以及wrky转录因子表达量变化分析结果图。
48.图5显示的是本技术中的nbftsh5沉默株系与对照株系中病斑面积变化分析结果图。
49.图6显示的是本技术中peftsh5沉默后小兰屿蝴蝶兰叶片的表型。
50.图7显示的是本技术中的peftsh5沉默株系与对照株系中peftsh5表达量变化分析结果图。
51.图8显示的是本技术中的peftsh5沉默株系与对照株系中水杨酸合成相关基因以及wrky转录因子表达量变化分析结果图。
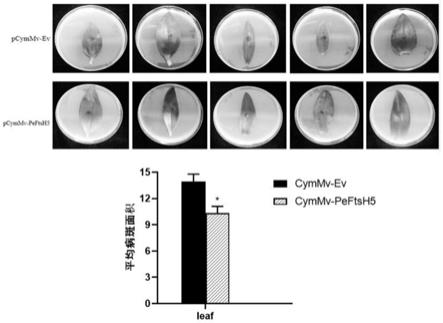
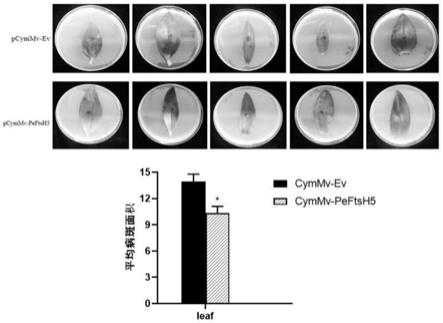
52.图9显示的是本技术中的peftsh5沉默株系与对照株系中病斑面积变化分析结果图。
具体实施方式
53.以下将结合实施例对本发明作进一步地说明,应理解这些实施例仅作为例证的目的,本发明可以通过许多不同形式的实施例来得以体现,本发明的保护范围并非仅限于文
capsici)(购自上海瑞楚生物科技有限公司),在水琼脂板上28℃培养2d后观察。
67.上述步骤(2)、(3)、(4)均以trv2
‑
gfp作平行对照。
68.结果如下:如图3所示,通过vigs顺利的降低了烟草中的nbftsh5基因表达,沉默株系表达下调60%
‑
70%。如图2所示,vigs降低了烟草中nbftsh5基因表达后,生长状况与对照基本一致,表明该基因的下调对植物的生长发育未造成明显影响。如图4所示,vigs下调烟草nbftsh5表达后,烟草的水杨酸合成相关基因nbpr1、nbeds1升高,其中nbpr1为植物水杨酸(sa)信号通路的标记(marker)基因,nbeds1为植物水杨酸(sa)信号通路的累积(accumulation)基因,除此之外,与植物抗病相关的wrky转录因子,wrky40、1、3、8也有不同程度上调。因此,当植物ftsh5下调后,会提高植物激素水杨酸(sa)的合成来抵抗胁迫环境。如图5所示,在nbftsh5基因下调后,与trv2
‑
gfp相比,vigs下调烟草nbftsh5同源基因的烟草接种辣椒疫霉菌后,病斑面积显著小于对照组,表明降低nbftsh5基因能够提高烟草对于辣椒疫霉菌侵染的抗性。
69.实施例4 vigs下调小兰屿蝴蝶兰peftsh5使小兰屿蝴蝶兰叶片抗病性提高
70.peftsh5其编码序列如seq id no.1所示。其编码蛋白序列如seq id no.2所示。
71.(1)选取小兰屿蝴蝶兰peftsh5基因cds序列,以此为模板,设计vigs引物(如seq id no.23和24所示),并将此部分序列连接到cymmv病毒载体(购自上海瑞楚生物科技有限公司)上,形成重组载体。
72.(2)重组载体转根瘤农杆菌gv3101(购自上海唯地生物技术有限公司),同时将病毒cymmv载体也转化到根瘤农杆菌gv3101中,培养获得两种gv3101菌液,然后分别注射小兰屿蝴蝶兰叶片,通过病毒诱导基因沉默(virus induced gene silence,vigs)方式沉默小兰屿蝴蝶兰peftsh5基因。
73.(3)注射5周后,进行表型观察和q
‑
pcr验证小兰屿蝴蝶兰peftsh5基因、水杨酸合成相关基因pepr1、penpr1以及抗病相关wrky转录因子wrky46、75表达变化,所用引物如seq id no.25
‑
32所示。
74.(4)对cymmv
‑
peftsh5和cymmv
‑
ev小兰屿蝴蝶兰叶片,进行接种灰葡萄孢菌(botrytis cinerea),在水琼脂板上28℃培养4d后观察。
75.上述步骤(2)、(3)、(4)均以cymmv
‑
ev作平行对照。
76.结果如下:如图7所示,通过vigs降低了小兰屿蝴蝶兰中的peftsh5基因表达,沉默株系表达下调60%
‑
70%。如图6所示,vigs降低了小兰屿蝴蝶兰中peftsh5基因表达后,叶片生长速度大于对照组,表明该基因的下调对植物的生长发育未造成负面影响。如图8所示,vigs下调小兰屿蝴蝶兰peftsh5表达后,小兰屿蝴蝶兰的水杨酸合成相关基因pepr1、penpr1升高,pr1、npr1均为植物水杨酸(sa)信号通路的标记(marker)基因,除此之外,与植物抗病相关的wrky转录因子如wrky46、75有不同程度上调。因此,当植物ftsh5下调后,会提高植物激素水杨酸(sa)的合成来抵抗胁迫环境。如图9所示,在peftsh5基因下调后,与对照组相比,vigs下调小兰屿蝴蝶兰peftsh5并接种灰葡萄孢菌后,病斑面积小于对照组,表明降低peftsh5基因能够提高小兰屿蝴蝶兰对于灰葡萄孢菌侵染的抗性。
77.以上详细描述了本发明的较佳具体实施例。应当理解,本领域的普通技术无需创造性劳动就可以根据本发明的构思作出诸多修改和变化。因此,凡本技术领域中技术人员依本发明的构思在现有技术的基础上通过逻辑分析、推理或者有限的实验可以得到的技术
方案,皆应在由权利要求书所确定的保护范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。