1.本发明涉及葫芦培养方法,特别涉及一种葫芦单倍体胚诱导的方法。
背景技术:
2.葫芦作为瓜类蔬菜嫁接的理想砧木之一,优质葫芦的育种就成为瓜类蔬菜嫁接成功的保证。单倍体育种可以缩短砧木育种的年限,提高育种效率。同时单倍体胚本身是进行遗传操作的理想受体,具有重要的遗传研究价值。
3.单倍体培养是现代育种技术的一个重要手段,在作物育种和品种改良中具有重要的意义。在现实生产中,植物自发产生单倍体的频率极低。目前主要通过离体雄核发育即花药
‑
小孢子培养、离体雌核发育即未授粉子房
‑
胚珠培养,以及原位雌核发育即用化学试剂、辐射等处理过的花粉授粉诱导等3种人工诱导途径获得单倍体植株。这几种方法对基因型的要求都比较高。例如单倍体技术几种方法已在甜瓜、西瓜、南瓜和黄瓜等瓜类作物上都获得了成功,而在葫芦上应用极少。
技术实现要素:
4.发明目的:本发明目的是提供一种可提高育种效率的葫芦单倍体胚诱导的方法。
5.技术方案:本发明提供一种葫芦单倍体胚诱导的方法,包括如下步骤:
6.(1)播种育苗:取不同葫芦品种的种子进行烫种、浸泡、催芽,待种子露白后育苗;
7.(2)移栽定植:当苗的第一片真叶完全展平、第二片真叶露心时进行移栽;
8.(3)对雄花进行辐射处理:用c
060
γ辐射源对雄花进行花粉辐射,辐射后的雄花冷藏保存;
9.(4)辐射花粉的贮藏活力测定:对花粉进行萌发率测定,花粉萌发率等于同一视野时花粉萌发数占花粉总粒数的百分比;
10.(5)辐射花粉授粉:在雄花经过辐射处理后,同天或第二天对将要开放的雌花进行授粉,需提前一天套袋,以防串粉,用2
‑
3朵辐射雄花涂抹一朵雌花的柱头;
11.(6)果实采摘和灭菌;
12.(7)不同培养基诱导离体胚:统计不同诱导培养基的种子萌发成苗率;
13.(8)再生苗的增殖、生根和驯化移栽:统计移栽植株的成活率;
14.(9)倍性鉴定:以葫芦二倍体植株为对照,对再生植株进行鉴定,结合田间的植株性状观察验证其倍性;
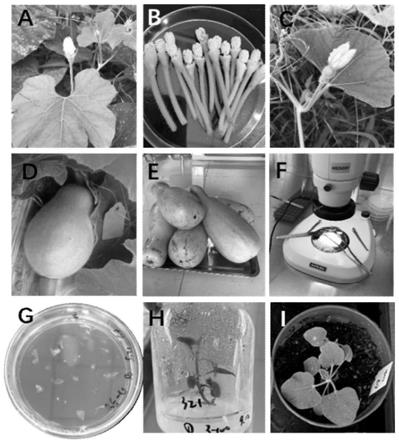
15.(10)染色体加倍,获得双单倍体后代。
16.进一步地,所述步骤(1)中催芽期定期对种子进行淘洗,并检查种子露白情况。
17.进一步地,所述步骤(2)辐射剂量为50
‑
150gy。
18.进一步地,所述步骤(3)花粉管长度超过花粉直径0.5倍的花粉即为萌发粉粒。
19.进一步地,所述步骤(5)授粉后将雌花花冠套袋,防止串粉或再次授粉。
20.进一步地,所述步骤(7)培养条件为25
±
2℃,光强2500
‑
3000lx。
21.进一步地,所述步骤(9)鉴定方法包括幼嫩卷须染色体计数、流式细胞仪鉴定或叶片保卫细胞叶绿体数目观察。
22.有益效果:本发明与现有技术相比,具有如下优势:
23.通过对不同辐射剂量的
60
coγ射线和基因型进行辐射授粉诱导单倍体的探究,建立了辐射花粉授粉诱导单倍体技术体系,染色体加倍后得到纯合自交系,能为葫芦功能基因的遗传定位提供了丰富的材料,将葫芦双单倍体材料应用于砧木育种生产,能加速育种进程,提高育种效率,为瓜类蔬菜嫁接栽培提供大量的优质抗病品种。
附图说明
24.图1为辐射花粉授粉离体培养流程图,(a)当天将要开放的雄花;(b)进行剥除萼片、花冠处理的雄花;(c)当天或第二天将要开放的雌花;(d)辐射花粉授粉后获得的葫芦果实(15
‑
21d);(e)外植体灭菌;(f)体式显微镜下解剖葫芦未成熟种子;(g)将解剖得到的葫芦胚接种到不同成分的诱导培养基中进行培养;(h)组织培养
‑
获得的葫芦单倍体/双单倍体植株;(i)再生苗的驯化移栽。
具体实施方式
25.实验材料:
26.葫芦砧木品种:横溪砧木1号、日本相生、兵丹葫芦、京欣砧1号、甬砧1号、超丰抗生王。其中前3个为高代自交系品种,后3个是杂交的商品种。以这6个葫芦品种为材料,比较不同辐射剂量、不同胚胎发育时期、不同培养基配方和外源添加物等外源因素对胚状体诱导的影响,筛选出各种合适的条件来诱导获得单倍体胚。
27.1、播种育苗
28.用55℃的热水烫种10min,再将种子转入30℃温水中浸泡6h。人工破壳后将种子移入30℃的恒温箱内进行催芽,待种子露白后播入装有瓜类专用育苗基质的50孔育苗穴盘进行育苗。催芽期每隔12h将种子取出,以30℃温水进行淘洗,并检查种子露白情况。
29.2、移栽定植
30.当试验材料的第一片真叶完全展平、第二片真叶露心时进行移栽。分批次定植于塑料大棚。大棚长宽40m
×
8m,起垄前结合整地施入腐熟的有机肥1000kg/667m2,复合肥30kg/667m2。南北向起垄6条,垄宽1m,覆盖黑色银灰双面地膜,每垄中央种植一行葫芦,株距0.6m,吊蔓栽培。植株在田间生长期的肥水、病虫害管理方法同常规。
31.3、不同辐射剂量处理雄花
32.当葫芦材料进入盛花期时,于上午9点采摘当天将要开放的雄花。移到室内对雄花进行剥除萼片、花冠处理,然后把雄花放在洁净干燥的玻璃罐瓶中,放置于4℃的冰盒内保存。处理后的雄花立即送到辐照中心用c
060
γ辐射源进行花粉辐射(辐射剂量见表1,
‘0’
为空白对照)。辐射后的雄花仍旧放在玻璃罐瓶中,放置于4℃的冰盒内保存。
33.表1葫芦雄花辐射剂量
34.序号辐射剂量(gy)10250
375410051256150
35.4、辐射花粉的贮藏活力测定
36.将辐射后的花粉放在4℃冰箱中保存,5d内分别对花粉进行萌发率测定。测定采用琼脂固体萌发法,待培养基冷却2min后,以单面刀片沾取花粉一条条地压在培养基上面。然后放入垫有湿滤纸的培养皿内,再置于25
±
2℃的培养箱中,黑暗培养促其萌发,40min后进行镜检。镜检以低倍镜头下连续观察3个不重叠视野为3次重复,花粉管长度超过花粉直径0.5倍的花粉即为萌发粉粒,花粉萌发率等于同一视野时花粉萌发数占花粉总粒数的百分比。
37.5、辐射花粉授粉
38.在雄花经过辐射处理后,同天或第二天对将要开放的雌花进行授粉(需提前一天套袋,以防串粉),用2
‑
3朵辐射雄花涂抹一朵雌花的柱头。授粉后挂上标有当天日期及雄花辐射剂量的塑料吊签,并将雌花花冠套袋,防止串粉或再次授粉。待葫芦的子房膨大至鸡蛋大小,果实端正、皮色鲜亮时表明果实已经座住,疏去发黄、萎蔫的未结实子房,授粉后第15
‑
21d采收果实的同时统计每个处理的坐果率。
39.6、果实采摘和外植体的灭菌
40.胚挽救时间:授粉后第15
‑
21d采收果实,采收果实的时间需要把握准确,太早或太晚都将影响胚拯救的成功率。这个时间可根据温度、光照等实际情况调整。
41.外植体灭菌:将葫芦果实放置在饱和的洗衣粉溶液浸泡10min,再用刷子洗刷去果实表面的污渍,最后用洁净的流水冲洗干净。待葫芦表面水份晾干后,把果实放入不透钢托盘内,转到工作的超净工作台内。用75%的酒精均匀喷雾在果实表面,点火灼烧至酒精耗净,再打开超净台的紫外灯,以紫外线照射葫芦果实30min。
42.7、不同培养基诱导离体胚
43.用灭菌后的不透钢厨刀沿葫芦果实的纵轴剖开,取出全部种子,统计每个处理果实的正常/空瘪种子数。剔除空瘪的种子,将正常种子的种皮切开,取出种胚接种到不同成分的诱导培养基(表2)中进行培养。接种时培养条件为25
±
2℃,光强2500
‑
3000lx,光照时间16h/d。待种胚长大成小植株时,统计不同诱导培养基的种子萌发成苗率。
44.表2诱导培养基成分
45.序号培养基成分1ms2ms 0.01mg/l iaa3e20a(不含iaa)4e20a(含0.01mg/l iaa)
46.8、胚胎发育时期对单倍体胚诱导的影响
47.不同形态胚的离体培养成苗率:每个处理各取一个果实,取出种子后用刀片切开种皮。在体式镜下挑出种胚,根据胚胎形状和胚胎发育阶段进行分类(表3)。将这些不同类型的胚分别接种到e20a培养基上,统计不同胚的数量以及最后的诱导成苗率。
48.表3不同形态胚的离体培养成苗率
49.种胚类型胚数成苗株数成苗率(%)球形
‑‑‑
心形
‑‑‑
鱼雷形
‑‑‑
子叶形
‑‑‑
不规则形
‑‑‑
50.9、再生苗的增殖、生根和驯化移栽
51.将种胚发育苗以茎节为界切分成段,以茎段的底端插入分化培养基5mm。20d后观察扦插茎段分化情况,即是否有丛生芽发生,并统计各分化培养基中丛生芽的发生频率。
52.将丛生芽从茎段外植体上切下,分割成单株,挑选大小基本一致的单株无根丛芽接种到不同的生根培养基上,进行生根壮苗培养。20
‑
25d后观察统计无菌苗的生根以及小苗的发育情况。
53.打开生根培养瓶的瓶盖,向瓶内注入无菌水,注水量以覆盖培养基面1
‑
2cm为宜。3d后取出生根苗,以流水小心冲去附着在根须上的培养基,将小苗定植到灭菌珍珠岩基质中,继续放在组培室内培养。10
‑
14d后待小苗抽生新叶,将之移栽于温室或大棚内,栽培基质为草炭∶珍珠岩∶田园土=1∶1∶1,移栽后的第一周注意适当遮阳保湿,10d后统计移栽植株的成活率。
54.10、倍性鉴定
55.以葫芦二倍体植株为对照,通过幼嫩卷须染色体计数、流式细胞仪鉴定、叶片保卫细胞叶绿体数目观察等3种不同的方法对再生植株进行鉴定,最后结合田间的植株性状观察验证其倍性。
56.葫芦幼嫩卷须染色体计数:睛天上午8:40
‑
9:10摘取1
‑
3cm的幼小卷须,投入敞口的容皿内。倒入冰水(以刚好浸没卷须为宜),放置在黑暗处>12h,用8
‑
羟基喹啉18℃遮光处理3
‑
4h,再用改良carony’sii固定液固定24h,用1mol/lhc在60℃水浴解离10
‑
20min。切取卷须顶部1.5
‑
3mm的分生区,用schiff试剂于阴凉处遮光染色1h,最后用1%醋酸洋红滴染、微烤、敲片、压片和镜检。
57.流式细胞仪鉴定:取待测植株的新鲜叶片0.1g,加入1ml的wpb裂解液,用刀片切割叶片,即在裂解液中破坏叶片细胞的细胞壁。再加入1ml的裂解液,用30μm的滤膜过滤至离心管中,4℃下1000r/min离心5min。倒去离心后的上清液,加入150μl的预冷pi染液,避光静置30min后上机测定,每份材料重复三次。
58.叶片保卫细胞叶绿体数目观察:取植株第5片叶片,用自来水冲洗干净。吸去或晾干叶表水份,将叶片投入无水乙醇∶冰醋酸=3∶1(v∶v)的脱色液中,直至叶片的绿色完全褪去。再放入无菌水中漂洗3
‑
5min,切取褪色叶片1cm
×
1cm,置于载玻片上。滴1
‑
2滴1%的i2‑
ki溶液染色,盖上盖玻片,在显微镜下观察、计数、拍照。每张叶片随机记录30个气孔保卫细胞的叶绿体数目,3次重复。
59.田间植株性状观察验证:结合前三种倍性分析方法得到的鉴定结果,在植株开花期观测记录其主要形态学特征。具体观测指标:植株生长势、叶片大小、株高、茎粗、节间长、花冠和子房大小、花粉育性等等。
60.11、染色体加倍
61.待再生苗在温室或大棚内移栽成活后,摘去主蔓顶部5
‑
10cm处的叶片与卷须。摘完叶须后将茎杆放入16cm的试管内,管底盛有0.5%秋水仙碱溶液,将再生苗的顶芽浸泡在药液中2h,然后取出茎杆,用自来水冲洗顶芽。顶芽继续生长、抽生叶花,即可进行自交留种,获得双单倍体后代。
62.经过多次试验发现:
63.辐射剂量和基因型对单倍体再生率的影响:在葫芦科作物中,
60
coγ射线辐射剂量控制在100
‑
300gy大多数能诱导产生单倍体,已知的有黄瓜、甜瓜、西瓜及南瓜等等。其中黄瓜是研究最多最透彻的葫芦科作物,而葫芦目前在单倍体技术这方面研究极少,无论是雌核发育和雄核发育。本试验中6个基因型有4个基因型获得再生植株,比例为66.7%,且单倍体再生率最高为0.42%,这表明辐射花粉授粉诱导单倍体技术在葫芦单倍体育种生产中是可行且有效的。辐照花粉对葫芦单倍体胚胎的诱导受基因型和辐射剂量的显着影响。坐果率也受到基因型和辐射剂量的显着影响,辐射剂量越高坐果率越低,其中最高的坐果率主要集中在低剂量的辐射中(50gy和75gy)。然后,坐果率、植株再生率与单倍体再生率之间并没有直接的相关性。单倍体主要在100
‑
150gy辐射剂量之间产生,在低剂量50gy和75gy虽然坐果率和植株再生率很高,但并没有获得单倍体植株。说明了合适的辐射剂量对葫芦单倍体诱导的关键作用。
64.胚拯救时期对单倍体再生率的影响:不同的葫芦基因型之间种子的成熟期不同,要根据具体的季节温度、品种的特性来选择采摘的时间。比如日本相生和兵丹葫芦的采摘时间就要比其他基因型早1
‑
2d,不然种壳太硬,胚胎也容易死亡。同时,葫芦也受季节的影响,5
‑
6月最适合,秋季的温度偏低种子发育不成熟。在取胚的过程中我们发现了很多形态的胚状体,主要有3大类:球形胚、心形胚、子叶形胚。其中球形胚和心形胚能够培养得到单倍体材料,而子叶形胚培养得到的是二倍体材料。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。