一种铁皮石斛组成型强启动子prodowox1及其应用
技术领域
1.本发明属于分子生物学技术领域,具体涉及一种铁皮石斛组成型强启动子prodowox1及其应用。
背景技术:
2.在真核生物中,基因表达的转录受到启动子的调控(wray et al.,2003)。启动子含有特定dna序列,它包含rna聚合酶蛋白复合物的结合位点,不论是对天然基因还是对转基因的正确表达起到关键性的调控作用。随着启动子的研究深入,它在基因工程的应用中得到了快速发展。遗传转化是植物育种中的一种重要方法,从基础研究到作物改良,使用合适启动子是保证遗传转化的成功的关键因素(potenza et al.,2004,porto et al.,2014)。因此,一种高效或/和特异的启动子的开发和利用,在植物基因工程的育种等领域具有极高的应用价值和重要的研究意义。
3.根据启动子的作用方式和功能,植物基因工程中常用的启动子可以分为3类:组成型启动子(constitutive promoter)、组织特异性启动子(tissue
‑
specific promoter)和诱导型启动子(inducible promoter)。一般来说,组成型启动子可以指导转基因或内源基因在几乎所有组织部位和全部发育阶段持续表达,这对于某个特定靶基因或其他重要的某个基因的过表达或下调等方面具有很大的应用潜力(han et al.,2015)。目前在植物基因工程中应用较为广泛的组织型启动子包括camv 35s(odell et al.,1985)、nos(marton et al.,1979)和actin(christensen et al.,1992)等,其中camv 35s启动子是植物遗传转化应用的主要启动子。组成型启动子具有诸多优点,如研究充分、易于获取和表达稳定等,赋予了其在植物基因工程中最为广泛的应用价值。然而,组成型启动子具有一些局限性(meyer and saedler,1996)如时空特异性差、基因沉默和植物能耗增加等,因此,一种组成型启动子的可用性对于用于植物转化的成功与否起决定作用。
4.铁皮石斛(dendrobium officinale)是单子叶兰科植物,具有极高的药用价值。单子叶植物的组成型启动子,对于植物转基因工程的应用来说,是一个重要且广泛的重要资源。虽然目前已从不同植物克隆到了不同类型的启动子,但铁皮石斛中高效表达的组成型启动子的克隆却很少。
技术实现要素:
5.本发明利用分子生物学技术与方法,从铁皮石斛的基因组中分离了一个组成型基因上游1121bp的启动子区域,构建含有报告基因gus的植物表达载体,提供农杆菌冻融法的转化方法转入野生型拟南芥,提供对不同发育阶段和不同器官进行gus染色分析,以进一步确定其组成型表达功能。
6.本发明的第一个方面是提供一种组成型强启动子prodowox1,其核苷酸序列与seq id no:1具有95%以上的同源性,或与seq id no:1互补序列具有95%以上的同源性,或是在seq id no:1或其互补序列采取取代、添加或缺失一个或多个碱基且具有启动子功能的;
7.优选地,所述启动子的核苷酸序列如seq id no:1所示,或所述启动子的核苷酸序列与seq id no:1所示的核苷酸序列互补的核苷酸序列。
8.本发明的第二个方面是提供一种核酸构建体,其包含第一个方面所述的启动子prodowox1和与所述启动子prodowox1可操作连接的外源基因;
9.优选地,所述外源基因可以包括但不限于筛选标记基因、报告基因、调节基因、植物品质相关基因、抗逆基因;
10.更优选地,所述抗逆基因可以包括但不限于抗病毒基因、耐寒基因、耐高温基因、抗旱基因、抗涝基因、抗虫基因、抗高盐蛋白基因。
11.本发明的第三个方面是提供一种重组表达载体,其含有第一个方面所述的启动子prodowox1或第二个方面所述的核酸构建体;
12.优选地,所述的重组表达载体为pcambia1301:prodowox1:gus;
13.更优选地,所述pcambia1301:prodowox1:gus是所述铁皮石斛启动子prodowox1克隆到含有gus基因的pcambia1301质粒上。
14.本发明的第四个方面是提供一种宿主细胞,其导入了第一个方面所述的启动子prodowox1或第二个方面所述的核酸构建体或第三个方面所述的载体;
15.优选地,所述的宿主细胞为农杆菌或大肠杆菌;
16.更优选地,所述的宿主细胞为农杆菌eha105。
17.本发明的第五个方面是提供一种基因重组细胞,其基因组整合有第一个方面所述的启动子prodowox1或第二个方面所述的核酸构建体;
18.优选地,所述的基因工程细胞为植物细胞。
19.本发明的第六个方面是提供第一个方面所述的启动子prodowox1、第二个方面所述的核酸构建体、第三个方面所述的载体或第四个方面所述的细胞在启动目的基因高效表达中的应用;
20.优选地,本发明启动子prodowox1能够特异地驱动外源基因在植物的不同生长发育阶段(种胚期、幼苗期和成熟期)和不同器官(成熟期的根、茎、叶、花序和果实)中强烈表达。
21.本发明的第七个方面是提供第一个方面所述的启动子prodowox1、第二个方面所述的核酸构建体、第三个方面所述的载体或第四个方面所述的细胞在培育改良的植物品种的应用;
22.优选地,所述改良是改良植物的营养品质及含量、产量、稳定性、抗逆性等,如改良棉花的保暖性、色泽、强度、长度等纤维品质,改良马铃薯加工性能、降低作物中的有毒、过敏源等有害成分,改良饲料作物和牧草的营养成分及其可消化性等等。
23.本发明的第八个方面是提供一组引物,用于扩增如seq id no:1所示的核苷酸序列,所述引物为:
24.prodowox1
‑
fp2:5'
‑
ttaccatcctaccaattat
‑
3',prodowox1
‑
rp2:5'
‑
ttggttgtcttccataggtg
‑
3';
25.优选地,所述引物用于克隆或鉴定本发明启动子prodowox1,其中pcr反应体系为50μl(kod fx),反应程序为:95℃预变性3min;98℃变性10s,55℃退火30s,72℃延伸2min,40个循环;72℃延伸10min。
26.本发明的第九个方面是提供一种使目的基因高效表达的方法,包括以下步骤:a.将所述的启动子prodowox1克隆到含有目的基因的pcambia1301质粒上,然后转入农杆菌eha105中筛选得到重组植物表达载体;b.将重组植物表达载体转化到目的植物细胞中。
27.与现有技术相比,本发明取得的有益效果在于:本发明首次发现、定位一个新的铁皮石斛组成型强启动子prodowox1,为深入探究铁皮石斛wox1基因调控的分子机制奠定了基础;其能够特异地驱动外源基因在植物不同生长阶段不同器官中强烈表达,克服组成型启动子的一些局限性(如时空特异性差、基因沉默和植物能耗增加等),为植物基因工程的应用提供了一个良好的资源,为应用于植物性状改良的转基因研究奠定了基础。
附图说明
28.图1为prodowox1的pcr产物电泳图。
29.图2为pcambia1301:prodowox1:gus转基因株系生长24h的gus染色。
30.图3为pcambia1301:prodowox1:gus转基因株系生长7d的gus染色。
31.图4为pcambia1301:prodowox1:gus转基因成熟株系不同器官(根、茎、叶、花序和果荚)的gus染色。
具体实施方式
32.以下实施例是对本发明的进一步说明,而不是对本发明的限制。
33.下列实例中未具体注明的实验方法,均可按照常规方法进行。如j.萨姆布鲁克等《分子克隆实验指南》、f.奥斯伯等《精编分子生物学实验指南》中所述条件,或按照所用产品生产厂商的使用说明。
34.实施例1铁皮石斛启动子prodowox1序列的获得和结构分析
35.铁皮石斛(dendrobium officinale kimura et migo)组培苗,生长的培养基为1/2ms 0.1%活性炭 2%蔗糖 0.6%琼脂粉(ph 5.4),并于组织室培养生长,组培室条件为24
±
2℃、12小时光照。
36.铁皮石斛基因组dna的提取。实验材料为种植于实验苗圃的铁皮石斛小苗,用改良的ctab方法对dna进行手提,具体提取步骤如下:
37.(1)提前准备好2
×
ctab提取液,先放于65℃的水浴锅预热,备用。
38.(2)取铁皮石斛小苗,在研钵加入液氮迅速研磨至粉末。取适当粉末转至2ml的离心管中,待液氮挥发后立即加入700μl的2
×
ctab提取液(提前预热,65℃)充分混匀。置于水浴锅(65℃,15min,每隔5min摇一次)。
39.(3)取出混合液,冷却至室温后加入等体积的酚氯仿,振荡混匀。
40.(4)离心:离心机12000rpm离心15min。
41.(5)取离心之后的上清,加入700μl氯仿再抽提一次,振荡混匀后重复步骤(4)1次。
42.(6)取离心之后的上清,转移至一个新的1.5ml离心管,再加入0.6倍体积异丙醇,振荡混匀后放置
‑
20℃冰箱10min。
43.(7)离心:离心机12000rpm离心10min。
44.(8)弃上清,加入500μl的70%乙醇清洗dna沉淀两次。
45.(9)离心:离心机12000rpm离心30sec。
46.(10)用枪头去除离心管中的酒精。在室温环境晾5min,以干燥沉淀。
47.(11)加入100μl 1
×
te(含rnase a,20μg/ml)溶解沉淀。而后置于37℃反应30min,以除去rna。
48.(12)利用nanodrop 2000分光光度计测定od260/od280和od260/od230的值,并记录dna的浓度,以判断dna的纯度和浓度。
49.(13)凝胶电泳检测:取2μl所提取的dna样品,加入loading buffer,用1%琼脂糖凝胶进行电泳检测,以检测dna的质量。
50.(14)保存:将余下的dna样品放置
‑
20℃冰箱,以保存备用。
51.利用巢式pcr技术克隆启动子prodowox1序列。首先,设计并合成相应的引物。利用铁皮石斛根据全基因组测序结果,获得两对pcr特异性引物:
52.prodowox1
‑
fp1:5'
‑
aagcctaagtttgtaaatac
‑
3',
53.prodowox1
‑
rp1:5'
‑
cggggaggttgccggaattg
‑
3';
54.prodowox1
‑
fp2:5'
‑
ttaccatcctaccaattat
‑
3',
55.prodowox1
‑
rp2:5'
‑
ttggttgtcttccataggtg
‑
3'。
56.接着,以铁皮石斛基因组dna为模板,以prodowox1
‑
fp1/prodowox1
‑
rp1这一对引物进行第一轮pcr的扩增。所用的酶为东洋纺高保真dna聚合酶试剂盒(kod fx),反应体系为20μl,反应程序为:95℃预变性5min;98℃变性10s,55℃退火30s,72℃延伸2min,36个循环;72℃延伸10min。而后,以第一轮扩增的pcr产物稀释50倍后作为模板,以prodowox1
‑
fp2/prodowox1
‑
rp2这一对引物,再次进行第二轮pcr的扩增。用于扩增的高保真酶与第一次pcr相同,反应体系50μl,反应程序为:95℃预变性3min;98℃变性10s,55℃退火30s,72℃延伸2min,40个循环;72℃延伸10min。具体操作参见说明书。pcr扩增得到一条长度约为1000bp的片段,其pcr电泳图如图1所示。
57.对所获得启动子prodowox1序列片段利用在线生物信息学软件plantcare(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)进行启动子结构和顺式元件预测(lescot et al.,2002)。经过测序对比,其3
′‑
端序列与已知的铁皮石斛dowox1基因5
′‑
端上游序列同源性较高,符合实验预期,该片段为铁皮石斛dowox1基因启动子,长度为1121bp,命名为prodowox1,其核苷酸序列如seq id no.1所示。
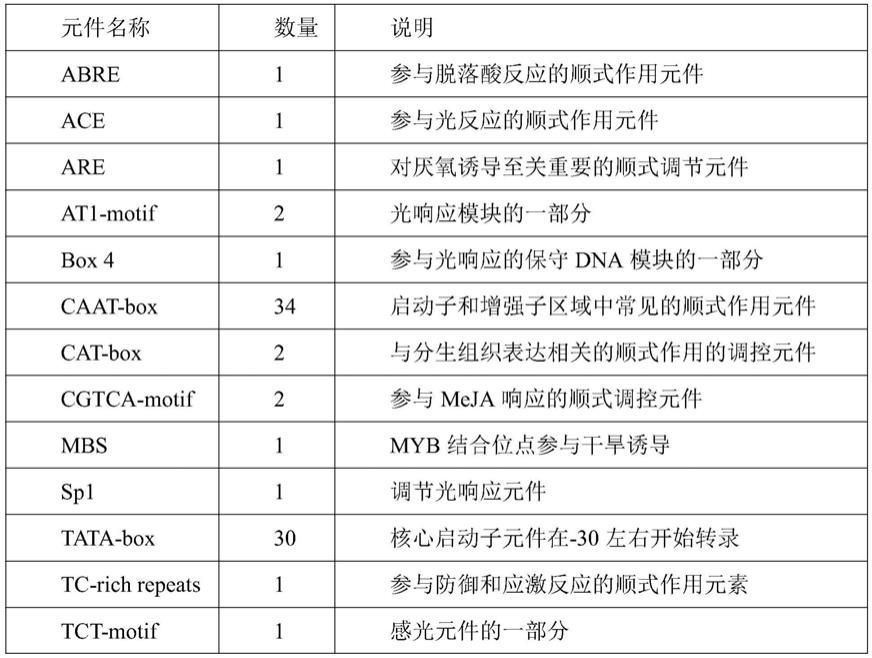
58.启动子具有多个顺式作用元件,对于基因转录起始和调控方面非常重要(li et al.,2012),为了进一步了解启动子prodowox1顺式作用元件,本发明人利用plantcare在线数据库对它们进行了预测分析(表1)。结果表明,prodowox1含有30个tata
‑
box和34个caat
‑
box,其中,tata
‑
box是
‑
30左右的核心启动子转录起始元件,caat
‑
box是启动子和增强子区域的共同顺式作用元件,这2种元件是启动子的基本顺式作用元件,它们主要进行基础转录的调控以保证精确转录,说明该序列具有植物启动子的基本结构特征,是一个完整的启动子。此外,prodowox1启动子序列含有多个与光响应的元件,如ace、box 4和tct
‑
motif。特别地,prodowox1启动子还包括生长发育响应元件如cat
‑
box(分生组织表达相关),非生物胁迫响应元件包括厌氧诱导are、干旱响应元件mbs和防御和应激反应元件tc
‑
rich repeats等,以及激素响应元件如aba、meja响应元件等顺式作用元件(表1),暗示prodowox1启动子很可能参与植物的生长发育,以及很可能受到干旱、激素等诱导,对于植物在逆境环境的正常生长具有重要的意义。
59.表1 prodowox1的顺式作用元件分析
[0060][0061][0062]
实施例2构建含启动子prodowox1序列的植物表达载体及载体向农杆菌转化
[0063]
首先,设计引物扩增带pcambia1301载体接头的启动子prodowox1,模板为提取的铁皮石斛dna,用于扩增的高保真酶为东洋纺高保真dna聚合酶试剂盒(kod fx),具体反应体系和操作步骤参见说明书。本实施例所用的目的表达载体为双元表达载体pcambia1301(该载体包含35s启动元件以及gus位点,kana抗性)。所用的引物为
[0064]
prodowox1
‑
1301
‑
fp1:5'
‑
cggtacccggggatccttaccatcctaccaattat
‑
3',
[0065]
prodowox1
‑
1301
‑
rp2:5'
‑
cctcagatctaccatggttggttgtcttccataggtg
‑
3',下划线表示构建载体所用的接头。对pcr产物用1%的琼脂糖凝胶电泳进行鉴定,并使用凝胶dna试剂盒(magen,广州,中国)进行切胶回收,获得带1301载体接头的prodowox1的回收产物,具体操作按照说明书进行。
[0066]
然后,进行超表达载体的构建。利用无缝克隆技术,将目的片段(带1301载体接头的prodowox1的回收产物)连接到目的表达载体(双酶切后的线性化载体pcambia1301)上,所用试剂盒为in
‑
fusion(takara,kyoto,japan),具体的操作按照说明书中的同源重组反应体系进行。所述同源重组反应体系如下:5
×
in
‑
fusion hd enzyme premix 2μl;linearized vector 50
‑
200ng;purified pcr fragment 400ng;ddh2o补充至总体积10μl。将上述加好的样品,放于pcr仪中(50℃反应60min),反应结束后马上放在冰上,即可进行后续的转化实验。转化实验用的大肠杆菌是天根dh5α(天根生化科技有限公司,北京,中国)。随后将转化好的样品涂布于含有kana(50mg/ml)的lb的固体培养板,于37℃培养箱倒置培
养约12h左右。待培养板长出菌落,挑取单菌落在含有kana(50mg/ml)的液体lb培养基后于摇床(37℃,220rpm)培养至菌液浑浊(约14h
‑
16h左右),进行菌液pcr后跑1%琼脂糖凝胶验证。选出跑胶条带大小正确的pcr产物所对应的菌液,送至北京擎科生物科技有限公司测序。将测序结果正确的阳性重组子提取质粒,从而获得pcambia1301:prodowox1:gus超表达载体,将其放置于
‑
20℃冰箱以保存备用。将上述阳性重组子pcambia1301:prodowox1:gus超表达载体的质粒,采用冻融法转化到农杆菌菌株eha105中,同时,将阴性对照(含有35s启动子的pcambia1301:camv 35s:gus表达载体)也转化到eha105中。挑取上述转化成功的培养板上的农杆菌单菌落,采取菌液pcr方法验证(pcr引物为前述的prodowox1
‑
fp2和prodowox1
‑
rp2),以筛选阳性克隆,跑胶条带与目的条带大小一致的确定为成功的目的表达载体。将阳性的农杆菌菌液用甘油保存为甘油菌(甘油终浓度为30%),将其放于
‑
80℃超低温冰箱备用。
[0067]
实施例3 pcambia1301:prodowox1:gus进行拟南芥遗传转化及分子鉴定
[0068]
将实施例2获得的含有植物表达载体的农杆菌通过花序侵染的方法,将含有目的序列的表达载体导入拟南芥,以实现拟南芥的遗传转化。拟南芥花序侵染法的步骤如下:
[0069]
(1)将保存于
‑
80℃的目的农杆菌菌液进行划板活化,挑取单菌落于lb液体培养基(kana抗性),放于摇床(28℃,200rpm)振荡培养过夜(约16h),至菌液od600约为0.8。
[0070]
(2)将上述培养好的农杆菌菌液进行离心(5000rpm,10min),以收集目的菌。
[0071]
(3)配制100ml的渗透培养液(1/2ms 5%蔗糖),并加入20μl表面活性剂silwet l
‑
77,以重悬农杆菌。
[0072]
(4)取长势合适的拟南芥(约4
‑
5周,开始抽薹至8cm左右,未长出果荚),将所有的拟南芥花序浸没在农杆菌重悬液1min,斜置晾干。将上述拟南芥黑暗培养2天后,取出在植物控温培养室中培养,培养条件为22℃,16小时光照,8小时黑暗的昼夜节律。一周后按前述步骤再侵染一次。
[0073]
通过转化获得拟南芥转基因植株。将上述侵染后的拟南芥进行定期浇水、浇肥和除虫,直至种子成熟,收集t0代种子。将该种子进行下一步的阳性转基因植物筛选工作。
[0074]
潮霉素筛选初步获得阳性植株,具体步骤如下:将上述获得的t0代种子经培养基(1/2ms 25μg/ml潮霉素)进行筛选,两周左右后查看拟南芥幼苗生长情况。将初步确定为阳性的拟南芥幼苗(长出两片真叶且根部较长)小心从培养基取出,然后转移至基质(泥炭土:蛭石=2:1,v/v)中培养,最终收获获得了t1代种子。重复上述步骤继续筛选2周,得到t2代种子;再次重复上述步骤继续筛选2周,得到t3代种子。将t3代种子种下,当拟南芥幼苗长至一个月左右(出现莲座叶),取下所有株系叶片(做好编号)提取基因组dna,在启动子区域和gus基因编码区设计引物进行pcr验证,说明prodowox1启动子序列已成功整合到拟南芥基因组dna。pcr鉴定引物为prodowox1
‑
fp2和prodowox1
‑
rp2。由此获得转基因拟南芥株系。
[0075]
实施例4拟南芥转基因植株的gus染色分析
[0076]
为验证prodowox1启动子的表达模式,将转基因拟南芥株系进行gus染色。取适量转基因拟南芥t3代种子于已灭菌的2ml离心管中进行消毒,具体操作步骤如下:将拟南芥种子用现配的含有0.01%tritonx
‑
100的75%的酒精消毒10min,期间不断振荡混匀。稍离心后弃上清,然后用无水乙醇洗涤1次,再离心弃上清;再用70%酒精洗涤一次,离心取上清;最后用无水乙醇洗涤1次,再离心弃上清。随后,向离心管中加入无水乙醇,将拟南芥种子转
移到灭菌的滤纸上。待种子吹干后,于超净工作台上小心用消毒后的无菌镊子点到1/2ms培养基(1.5%蔗糖 0.8%琼脂粉,ph 5.7)的平板上生长,4℃冰箱黑暗同步化2天后,移至培养室,在22℃
±
2℃,16h光照/8h黑暗条件下培养。随后,拟南芥被进一步分为了3个不同生长阶段进行取材和后续实验。其一,拟南芥培养24h后,于超净工作台上取出适量的拟南芥种苗(刚萌发,可看到种胚),进行gus染色,剩余的继续在培养板上培养;其二,取出适量培养了7d的拟南芥小苗,进行gus染色;其三,将剩余的所有拟南芥7d小苗转移到基质(泥炭土:蛭石=2:1,v/v)中培养,并在相同的环境下继续培养。待pcambia1301:prodowox1:gus转基因拟南芥植株成熟后,分别取根、茎、叶、花序和果荚这五个不同器官进行gus染色。
[0077]
以上实施例均采用biosharp bl622agus染色试剂盒(biosharp,安徽,中国)对转基因拟南芥株系(不同生长阶段和不同器官)进行gus染色,具体操作参照说明书。以上实施例的所有gus染色结果均在超景深数码体视镜(leica dvm6)对染色的材料观察表达的具体部位进行拍摄。
[0078]
我们根据前述方法将转基因拟南芥种胚、小苗和成熟苗的不同器官进行了gus染色,以了解prodowox1启动子的表达模式。gus染色结果显示,三个不同生长阶段(24h、7d和成熟株系)的pcambia1301:prodowox1:gus转基因拟南芥均可以观察到gus活性的积累(图2、图3和图4)。其中,pcambia1301:prodowox1:gus转基因拟南芥生长24h,即种胚阶段可以在整个胚观察到很深的蓝色(图2中阴影较深部分),表明具有很高的gus活性,而在种皮的gus活性较低(图2中阴影较浅部分)。pcambia1301:prodowox1:gus转基因拟南芥生长7d,即幼苗期可以在除种皮外的拟南芥幼苗其他部位观察到非常高的gus活性(图3)。pcambia1301:prodowox1:gus转基因拟南芥生长至成熟期后,我们观察到在五个不同器官(根、茎、叶、花序和果荚)均具有非常高的gus活性(图4)。
[0079]
综上,以上结果不仅说明了prodowox1启动子序列具有启动子活性,可以驱动下游gus基因在转基因拟南芥中表达,而且表明了该启动子是一个组成型启动子,且在种胚期、幼苗期和成熟期不同的生长阶段以及成熟期的不同器官都保持着非常高的gus活性,暗示它可能具有非常强大的功能。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。