致癌基因驱动的癌症的治疗
相关申请的交叉引用
1.本技术要求2019年3月12日提交的美国临时申请序列号62/817,425的优先权权益,将其全部内容通过引用并入本文。关于在联邦政府资助的研究与开发下完成的发明的权利的声明
2.不适用对光盘上提交的“序列表”、表格或计算机程序列表附录的引用
3.不适用
技术实现要素:
4.在一些方面,本文提供了治疗被鉴定为患有致癌基因驱动的癌症的受试者的方法,所述方法包括向所述受试者施用靶向腺苷的细胞外产生的药剂和/或拮抗腺苷对其受体之一的激活的药剂。
5.根据以下具体实施方式和附图,本发明的其他目的、特征和优点对于本领域技术人员将变得清楚。
附图说明
6.本专利或申请文件含有至少一张以彩色绘制的附图。在请求并支付必要的费用后,官方将会提供带有一张或多张彩色附图的本专利或专利申请公开案的副本。
7.图1跨泛癌tcga的cd73/tnap比率。cd73和tnap表达源自泛癌tcga图谱数据集。数字指示cd73和tnap的log2 cpm值的比率。左侧肿瘤的cd73高并且tnap低,而右侧肿瘤的tnap高并且cd73低。
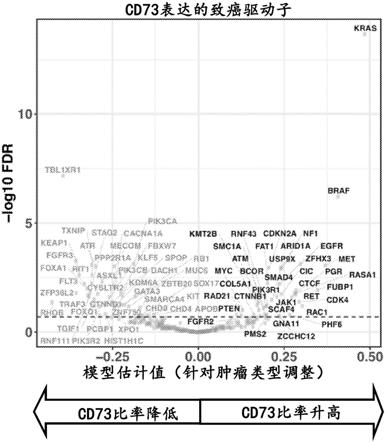
8.图2a cd73表达的致癌驱动子的鉴定。针对肿瘤类型调整的预测cd73表达的癌症驱动基因的改变的线性模型估计值。
9.图2b和图2c绘制了在致癌癌症驱动子的代表性例子kras(b)和tbl1xr1(c)中的cd73表达。左侧的图是wt表达,右侧的图是所提及的致癌癌症驱动子的突变型表达(alt)。
10.图2d和图2e腺苷途径基因的致癌调节子的鉴定。绘制了cd73的正调节子(d)和cd73的负调节子(e),其中x轴指示来自小图a的致癌基因,并且y轴示出了特定的腺苷途径基因的针对肿瘤类型调整的线性模型估计值。
11.图3a
‑
图3d显示了这样的森林图,其示出了在泛癌tcga数据集中,每个癌症驱动子的在wt患者(a,b)和发生突变的(alt)患者(c,d)中的cd73表达的针对肿瘤类型调整的无进展存活期的危险比与95%置信区间。x轴是危险比,同时y轴列出了不同的致癌蛋白。本文所显示的危险比是源自cox回归模型的系数的指数。p值也来自相同的模型,指示wt组与alt组之间的存活期差异是否是显著的。
12.图3e示出了在egfr突变型患者相比于野生型患者中的cd73表达的kaplan
‑
meier曲线。x轴指示时间(以年计),同时y轴指示患者具有无进展存活期的可能性。具有egfr alt和高cd73的患者具有最差的存活率,而具有egfr alt和低cd73的患者具有与egfr wt患者
更接近的存活率。
13.图4a和图4b在nsclc中派姆单抗反应与调节cd73的癌症驱动子的突变状态的关联性。小图a和小图b示出了来自图1的与cd73正相关和负相关的癌症驱动子改变的堆栈条形图。y轴指示在用派姆单抗的情况下,实现或未实现超过6个月的持久临床益处的患者的百分比。x轴指示所列出的每个致癌驱动子的wt和alt。
14.图4c显示了作为cd73的正调节子和负调节子的癌症驱动子的指示无进展存活期的危险比的森林图。x轴指示危险比,并且y轴列出了特定的致癌驱动子。本文所显示的危险比是源自cox回归模型的系数的指数。p值也来自相同的模型,指示wt组与alt组之间的存活期差异是否是显著的。
具体实施方式
i.概述
15.本公开文本被这样的发现所吸引,即致癌基因驱动的癌症(即,参与正常细胞生长的至少一个基因发生突变的癌症)通常改变参与腺苷的细胞外产生的一种或多种蛋白质的表达水平和/或一种或多种腺苷受体信号传导蛋白的表达水平。这些蛋白质的改变的表达水平可能导致肿瘤微环境中腺苷的量增加和/或腺苷介导的信号传导途径的过度激活。已经显示在肿瘤微环境中增加的腺苷水平和特定的腺苷介导的信号传导途径的激活的存在可在肿瘤模型中提供免疫抑制效应。因此,被鉴定为患有致癌基因驱动的癌症的受试者是用靶向参与腺苷的细胞外产生的蛋白质的药剂和/或拮抗腺苷对其受体之一的激活的药剂的疗法的首选候选者。有利地,通过施用一种或多种这些药剂,可以减少、最小化或消除参与细胞外腺苷的产生和/或腺苷介导的信号传导的蛋白质的改变的表达的影响。作为非限制性例子,egfr、braf和kras突变各自上调cd73表达,这将增加腺苷的局部水平。施用cd73抑制剂将通过减少或消除上调的cd73水平在这些癌症类型中的影响来提供积极临床益处。ii.定义
16.除非另有指示,否则以下术语旨在具有下文阐述的含义。贯穿整个说明书在其他地方定义了其他术语。
17.除非另有说明,否则术语“烷基”本身或作为另一个取代基的一部分意指具有所指定的碳原子数的直链或支链烃基(即,c1‑8意指一至八个碳)。烷基可以包括任何数量的碳,诸如c1‑2、c1‑3、c1‑4、c1‑5、c1‑6、c1‑7、c1‑8、c1‑9、c1‑
10
、c2‑3、c2‑4、c2‑5、c2‑6、c3‑4、c3‑5、c3‑6、c4‑5、c4‑6和c5‑6。烷基的例子包括甲基、乙基、正丙基、异丙基、正丁基、叔丁基、异丁基、仲丁基、正戊基、正己基、正庚基、正辛基等。
18.术语“亚烷基”是指具有所指示的碳原子数并且连接至少两个其他基团的直链或支链的饱和脂族基团,即二价烃基。与亚烷基连接的这两个部分可以与亚烷基的相同原子或不同原子连接。例如,直链亚烷基可以是
‑
(ch2)
n
‑
的二价基团,其中n是1、2、3、4、5或6。代表性亚烷基包括但不限于亚甲基、亚乙基、亚丙基、异亚丙基、亚丁基、异亚丁基、仲亚丁基、亚戊基和亚己基。亚烷基(在本技术中通常称为x1或x2基团)可以是经取代的或未经取代的。当包含x1或x2的基团是任选经取代的,应理解任选的取代基可以在所述部分的亚烷基部分上。
19.术语“环烷基”是指具有所指示的环原子数(例如,c3‑6环烷基)并且在环顶点之间
完全饱和或具有不多于一个双键的烃环。“环烷基”还意在指代双环和多环烃环,例如像双环[2.2.1]庚烷、双环[2.2.2]辛烷等。在一些实施方案中,本公开文本的环烷基化合物是单环c3‑6环烷基部分。
[0020]
术语“杂环烷基”是指具有所指示的环顶点(或成员)数并且具有从一至五个选自n、o和s的杂原子(其替换一至五个碳顶点,并且其中氮和硫原子是任选经氧化的,并且一个或多个氮原子是任选经季铵化的)的环烷基环。环杂烷基可以是单环、双环或多环系统。环杂烷基的非限制性例子包括吡咯烷、咪唑烷、吡唑烷、丁内酰胺、戊内酰胺、咪唑烷酮、乙内酰脲、二氧戊环、邻苯二甲酰亚胺、哌啶、1,4
‑
二噁烷、吗啉、硫代吗啉、硫代吗啉
‑
s
‑
氧化物、硫代吗啉
‑
s,s
‑
氧化物、哌嗪、吡喃、吡啶酮、3
‑
吡咯啉、噻喃、吡喃酮、四氢呋喃、四氢噻吩、奎宁环等。环杂烷基可以通过环碳或杂原子与分子的其余部分附接。
[0021]
如本文所用,在本文所描绘的任何化学结构中与单键、双键或三键相交的波浪线表示单键、双键或三键与分子的其余部分的附接点。另外,延伸至环(例如,苯基环)的中心的键意在指示在任何可用的环顶点处的附接。本领域技术人员应理解,显示为与环附接的多个取代基将占据提供稳定的化合物并且是以其他方式空间相容的环顶点。对于二价组分,表示意在包括任一取向(正向或反向)。例如,基团
“‑
c(o)nh
‑”
意在包括处于任一取向的连接:
‑
c(o)nh
‑
或
‑
nhc(o)
‑
,并且类似地,
“‑
o
‑
ch2ch2‑”
意在包括
‑
o
‑
ch2ch2‑
和
‑
ch2ch2‑
o
‑
二者。
[0022]
除非另有说明,否则术语“卤基”或“卤素”本身或作为另一个取代基的一部分意指氟、氯、溴或碘原子。另外,诸如“卤代烷基”的术语意在包括单卤代烷基和多卤代烷基。例如,术语“c1‑4卤代烷基”意在包括三氟甲基、2,2,2
‑
三氟乙基、4
‑
氯丁基、3
‑
溴丙基等。
[0023]
除非另有说明,否则术语“芳基”意指多不饱和的、典型地为芳族的烃基,其可以是单环或融合在一起或共价连接的多个环(最多三个环)。芳基的非限制性例子包括苯基、萘基和联苯基。
[0024]
术语“杂芳基”是指含有从一至五个选自n、o和s的杂原子的芳基(或环),其中氮和硫原子是任选经氧化的,并且一个或多个氮原子是任选经季铵化的。杂芳基可以通过杂原子与分子的其余部分附接。杂芳基的非限制性例子包括吡啶基、哒嗪基、吡嗪基、嘧啶基、三嗪基、喹啉基、喹喔啉基、喹唑啉基、噌啉基、酞嗪基、苯并三嗪基、嘌呤基、苯并咪唑基、苯并吡唑基、苯并三唑基、苯并异噁唑基、异苯并呋喃基、异吲哚基、吲哚嗪基、苯并三嗪基、噻吩并吡啶基、噻吩并嘧啶基、吡唑并嘧啶基、咪唑并吡啶、苯并噻唑基(benzothiaxolyl)、苯并呋喃基、苯并噻吩基、吲哚基、喹啉基、异喹啉基、异噻唑基、吡唑基、吲唑基、蝶啶基、咪唑基、三唑基、四唑基、噁唑基、异噁唑基、噻二唑基、吡咯基、噻唑基、呋喃基、噻吩基等。杂芳基环的取代基可以选自下文所述的可接受的取代基。
[0025]
在一些实施方案中,以上术语(例如,“烷基”、“芳基”和“杂芳基”)将是任选经取代的。下文提供了每种类型的基团的所选择的取代基。
[0026]
烷基(包括通常称为亚烷基、烯基和炔基的那些基团)的任选的取代基可以是选自以下的多种基团:卤素、
‑
or’、
‑
nr’r”、
‑
sr’、
‑
sir’r”r
”’
、
‑
oc(o)r’、
‑
c(o)r’、
‑
co2r’、
‑
conr’r”、
‑
oc(o)nr’r”、
‑
nr”c(o)r’、
‑
nr
’‑
c(o)nr”r
”’
、
‑
nr”c(o)2r’、
‑
nh
‑
c(nh2)=nh、
‑
nr’c(nh2)=nh、
‑
nh
‑
c(nh2)=nr’、
‑
s(o)r’、
‑
s(o)2r’、
‑
s(o)2nr’r”、
‑
nr’s(o)2r”、
‑
cn(氰基)、
‑
no2、芳基、芳氧基、氧代基、环烷基和杂环烷基,数量范围为从零至(2m’ 1),其中m’是在此
类基团中的碳原子总数。r’、r”和r
”’
各自独立地是指氢、未经取代的c1‑8烷基、未经取代的芳基、被1
‑
3个卤素取代的芳基、c1‑8烷氧基或c1‑8硫代烷氧基、或未经取代的芳基
‑
c1‑4烷基。当r'和r”与同一氮原子附接时,它们可以与所述氮原子组合以形成3元、4元、5元、6元或7元环。例如,
‑
nr’r”意在包括1
‑
吡咯烷基和4
‑
吗啉基。
[0027]
环烷基和杂环烷基的任选的取代基可以是选自以下的多种基团:任选地被c(o)or’取代的烷基、卤素、
‑
or’、
‑
nr’r”、
‑
sr’、
‑
sir’r”r
”’
、
‑
oc(o)r’、
‑
c(o)r’、
‑
co2r’、
‑
conr’r”、
‑
oc(o)nr’r”、
‑
nr”c(o)r’、
‑
nr
’‑
c(o)nr”r
”’
、
‑
nr”c(o)2r’、
‑
nh
‑
c(nh2)=nh、
‑
nr’c(nh2)=nh、
‑
nh
‑
c(nh2)=nr’、
‑
s(o)r’、
‑
s(o)2r’、
‑
s(o)2nr’r”、
‑
nr’s(o)2r”、
‑
cn(氰基)、
‑
no2、芳基、芳氧基和氧代基。r’、r”和r
”’
各自独立地是指氢、未经取代的c1‑8烷基、未经取代的芳基、被1
‑
3个卤素取代的芳基、c1‑8烷氧基或c1‑8硫代烷氧基、或未经取代的芳基
‑
c1‑4烷基。
[0028]
类似地,芳基和杂芳基的任选的取代基是多变的并且通常选自:
‑
卤素、
‑
or’、
‑
oc(o)r’、
‑
nr’r”、
‑
sr’、
‑
r’、
‑
cn、
‑
no2、
‑
co2r’、
‑
conr’r”、
‑
c(o)r’、
‑
oc(o)nr’r”、
‑
nr”c(o)r’、
‑
nr”c(o)2r’、
‑
nr
’‑
c(o)nr”r
”’
、
‑
nh
‑
c(nh2)=nh、
‑
nr’c(nh2)=nh、
‑
nh
‑
c(nh2)=nr’、
‑
s(o)r’、
‑
s(o)2r’、
‑
s(o)2nr’r”、
‑
nr’s(o)2r”、
‑
n3、全氟(c1‑
c4)烷氧基和全氟(c1‑
c4)烷基,数量范围为从零至芳环系统上开放化合价的总数;并且其中r’、r”和r
”’
独立地选自氢、c1‑8烷基、c1‑8卤代烷基、c3‑6环烷基、c2‑8烯基和c2‑8炔基。其他合适的取代基包括通过1
‑
6个碳原子的亚烷基系链与环原子附接的以上芳基取代基中的任一种。
[0029]
芳基环或杂芳基环的相邻原子上的取代基中的两个可以任选地被式
‑
t
‑
c(o)
‑
(ch2)q
‑
u
‑
的取代基替换,其中t和u独立地是
‑
nh
‑
、
‑
o
‑
、
‑
ch2‑
或单键,并且q是从0至2的整数。可替代地,芳基环或杂芳基环的相邻原子上的取代基中的两个可以任选地被式
‑
a
‑
(cr
f
r
g
)
r
‑
b
‑
的取代基替换,其中a和b独立地是
‑
ch2‑
、
‑
o
‑
、
‑
nh
‑
、
‑
s
‑
、
‑
s(o)
‑
、
‑
s(o)2‑
、
‑
s(o)2nr'
‑
或单键,r是从1至3的整数,并且r
f
和r
g
各自独立地是h或卤素。如此形成的新环的单键之一可以任选地被双键替换。可替代地,芳基环或杂芳基环的相邻原子上的取代基中的两个可以任选地被式
‑
(ch2)
s
‑
x
‑
(ch2)
t
‑
的取代基替换,其中s和t独立地是从0至3的整数,并且x是
‑
o
‑
、
‑
nr'
‑
、
‑
s
‑
、
‑
s(o)
‑
、
‑
s(o)2‑
或
‑
s(o)2nr'
‑
。
‑
nr'
‑
和
‑
s(o)2nr'
‑
中的取代基r'选自氢或未经取代的c1‑6烷基。
[0030]
如本文所用,术语“杂原子”意在包括氧(o)、氮(n)、硫(s)和硅(si)。
[0031]
术语“药学上可接受的盐”意在包括用相对无毒的酸或碱(取决于在本文所述的化合物上所发现的特定取代基)制备的活性化合物的盐。当本发明的化合物含有相对酸性的官能团时,可以通过使此类化合物的中性形式与足量的所需碱(纯净的或在合适的惰性溶剂中)接触来获得碱加成盐。源自药学上可接受的无机碱的盐的例子包括铝盐、铵盐、钙盐、铜盐、铁盐、亚铁盐、锂盐、镁盐、锰盐、二价锰盐、钾盐、钠盐、锌盐等。源自药学上可接受的有机碱的盐包括伯胺、仲胺和叔胺(包括经取代的胺、环状胺、天然存在的胺等,诸如精氨酸、甜菜碱、咖啡因、胆碱、n,n
’‑
二苄基乙二胺、二乙胺、2
‑
二乙基氨基乙醇、2
‑
二甲基氨基乙醇、乙醇胺、乙二胺、n
‑
乙基吗啉、n
‑
乙基哌啶、葡糖胺(glucamine)、葡萄糖胺(glucosamine)、组氨酸、海巴明(hydrabamine)、异丙胺、赖氨酸、甲葡糖胺(methylglucamine)、吗啉、哌嗪、哌啶、聚胺树脂、普鲁卡因、嘌呤、可可碱、三乙胺、三甲胺、三丙胺、氨丁三醇等)的盐。当本发明的化合物含有相对碱性的官能团时,可以通过使此类
化合物的中性形式与足量的所需酸(纯净的或在合适的惰性溶剂中)接触来获得酸加成盐。药学上可接受的酸加成盐的例子包括源自像以下的无机酸的那些:盐酸、氢溴酸、硝酸、碳酸、一氢碳酸、磷酸、一氢磷酸、二氢磷酸、硫酸、一氢硫酸、氢碘酸或亚磷酸等;以及源自像以下的相对无毒的有机酸的盐:乙酸、丙酸、异丁酸、丙二酸、苯甲酸、丁二酸、辛二酸、反丁烯二酸、扁桃酸、邻苯二甲酸、苯磺酸、对甲苯磺酸、柠檬酸、酒石酸、甲磺酸等。还包括氨基酸的盐(诸如精氨酸盐等)和有机酸(像葡糖醛酸或半乳糖醛酸等)的盐(参见例如,berge,s.m.等人,“pharmaceutical salts”,journal of pharmaceutical science,1977,66,1
‑
19)。本发明的某些特定化合物含有碱性和酸性两种官能团,所述官能团允许化合物转化为碱加成盐或酸加成盐。
[0032]
化合物的中性形式可以通过以下方式再生:使盐与碱或酸接触并且以常规方式分离母体化合物。化合物的母体形式在某些物理特性(诸如在极性溶剂中的溶解度)方面与各种盐形式不同,但是在其他方面出于本发明的目的,盐与化合物的母体形式等同。除盐形式之外,本发明还提供了呈前药形式的化合物。本文所述的化合物的前药是在生理条件下容易经历化学变化以提供本发明的化合物的那些化合物。另外,前药可以在离体环境中通过化学或生物化学方法转化为本发明的化合物。例如,当置于具有合适的酶或化学试剂的透皮贴剂储库中时,前药可以缓慢地转化为本发明的化合物。在本文其他地方更详细地描述了前药。
[0033]
除盐形式之外,本发明还提供了呈前药形式的化合物。本文所述的化合物的前药是在生理条件下容易经历化学变化以提供本发明的化合物的那些化合物。另外,前药可以在离体环境中通过化学或生物化学方法转化为本发明的化合物。例如,当置于具有合适的酶或化学试剂的透皮贴剂储库中时,前药可以缓慢地转化为本发明的化合物。
[0034]
本发明的某些化合物可以以非溶剂化形式以及溶剂化形式(包括水合形式)存在。通常,溶剂化形式与非溶剂化形式等同,并且旨在包括在本发明的范围内。本发明的某些化合物可以以多种结晶或无定形形式存在。通常,所有物理形式对于本发明所考虑的用途是等同的,并且旨在落入本发明的范围内。
[0035]
本发明的某些化合物具有不对称碳原子(光学中心)或双键;外消旋体、非对映异构体、几何异构体、区域异构体和单独的异构体(例如,单独的对映异构体)均旨在包括在本发明的范围内。当显示立体化学描绘时,意在指代存在异构体之一并且基本上不含其他异构体的化合物。“基本上不含”另一种异构体指示这两种异构体的比率为至少80/20,更优选地90/10或95/5或更高。在一些实施方案中,异构体之一将以至少99%的量存在。
[0036]
本发明的化合物还可以在构成此类化合物的原子中的一个或多个处含有非天然比例的原子同位素。同位素的非天然比例可以被定义为范围从在自然界中发现的量至由100%所讨论原子组成的量。例如,化合物可以掺入放射性同位素,例如像氚(3h)、碘
‑
125(
125
i)或碳
‑
14(
14
c);或非放射性同位素,诸如氘(2h)或碳
‑
13(
13
c)。此类同位素变化可以为在本技术内其他地方描述的那些提供另外的效用。例如,本发明的化合物的同位素变体可以具有另外的效用,包括但不限于作为诊断试剂和/或成像试剂,或作为细胞毒性治疗剂/放射毒性治疗剂。另外,本发明的化合物的同位素变体可以具有改变的药代动力学和药效学特征,这可以有助于在治疗过程中增强安全性、耐受性或功效。本发明的化合物的所有同位素变体(无论是否具有放射性)均旨在包括在本发明的范围内。
[0037]
术语“患者”或“受试者”可互换地用于指代人或非人动物(例如,哺乳动物)。
[0038]
术语“施用(administration)”、“施用(administer)”等当它们应用于例如受试者、细胞、组织、器官或生物流体时是指例如a2ar/a2br的抑制剂(或本文所述的另一种抑制剂或拮抗剂)或包含其的药物组合物与所述受试者、细胞、组织、器官或生物流体的接触。在细胞的背景下,施用包括试剂与所述细胞的接触(例如,体外或离体),以及试剂与流体的接触,其中所述流体与所述细胞接触。
[0039]
术语“治疗(treat)”、“治疗(treating)”、“治疗(treatment)”等是指在已经诊断出、观察到等疾病、障碍或病症或其症状之后启动的一连串动作(诸如施用a2ar/a2br的抑制剂或本文所述的另一种抑制剂或拮抗剂),以暂时或永久消除、减少、压制、减轻或改善困扰受试者的疾病、障碍或病症的潜在原因中的至少一种,或与困扰受试者的疾病、障碍、病症相关的症状中的至少一种。因此,治疗包括抑制(例如,阻止疾病、障碍或病症或与其相关的临床症状的发展或进一步发展)活动性疾病。
[0040]
如本文所用的术语“需要治疗”是指由医生或其他照料者所做出的这样的判断,即受试者需要治疗或将从治疗中受益。此判断是基于医生或照料者的专业知识领域中的各种因素做出的。
[0041]
术语“预防(prevent)”、“预防(preventing)”、“预防(prevention)”等是指通常在易患特定疾病、障碍或病症的受试者的背景下,以这样的方式(例如,在疾病、障碍、病症或其症状发作之前)启动的一连串动作(诸如施用a2ar/a2br抑制剂或本文所述的另一种抑制剂或拮抗剂),以临时或永久预防、压制、抑制或降低受试者患上疾病、障碍、病症等的风险(如通过例如没有临床症状所确定的)或延迟其发作。在某些情况下,所述术语还指代减缓疾病、障碍或病症的进展或抑制其进展到有害或在其他方面不期望的状态。
[0042]
如本文所用的术语“需要预防”是指由医生或其他照料者所做出的这样的判断,即受试者需要预防性护理或将从预防性护理中受益。此判断是基于医生或照料者的专业知识领域中的各种因素做出的。
[0043]
短语“治疗有效量”是指将药剂单独地或作为药物组合物的一部分并且以单一剂量或作为一系列剂量的一部分以能够当施用于受试者时对疾病、障碍或病症的任何症状、方面或特征具有任何可检测的积极影响的量施用于受试者。通过测量相关的生理效应可以确定治疗有效量,并且它可以结合给药方案和受试者的病症的诊断分析等进行调整。举例来说,在施用后的特定时间的a2ar/a2br抑制剂(或例如,本文所述的另一种抑制剂或拮抗剂)的血清水平的测量可以指示是否已经使用了治疗有效量。
[0044]
短语“以足以实现改变的量”意指在施用特定疗法之前(例如,基线水平)和之后测量的指标的水平之间存在可检测的差异。指标包括任何客观参数(例如,血清浓度)或主观参数(例如,受试者的幸福感)。
[0045]
术语“小分子”是指具有小于约10kda、小于约2kda或小于约1kda的分子量的化学化合物。小分子包括但不限于无机分子、有机分子、含有无机组分的有机分子、包含放射性原子的分子和合成分子。在治疗上,与大分子相比,小分子可以更易透过细胞、更不易降解并且更不太可能引发免疫反应。
[0046]
术语“配体”是指例如可以充当受体的激动剂或拮抗剂的肽、多肽、膜相关或膜结合分子或其复合物。配体包括天然配体和合成配体,例如细胞因子、细胞因子变体、类似物、
突变蛋白和源自抗体的结合组合物以及小分子。所述术语还包括既不是激动剂也不是拮抗剂但可以与受体结合而不显著影响其生物学特性(例如,信号传导或粘附)的药剂。此外,所述术语包括已经通过例如化学方法或重组方法改变为膜结合配体的可溶性形式的膜结合配体。配体或受体可以是完全细胞内的,也就是说,它可以在胞质溶胶、细胞核或一些其他细胞内区室中驻留。配体和受体的复合物被称为“配体
‑
受体复合物”。
[0047]
术语“抑制剂”和“拮抗剂”或者“激活剂”和“激动剂”分别是指例如用于例如配体、受体、辅因子、基因、细胞、组织或器官的激活的抑制性分子或激活性分子。抑制剂是降低、阻断、防止、延迟激活,失活、脱敏或下调例如基因、蛋白质、配体、受体或细胞的分子。激活剂是增加、激活、促进、增强激活,敏化或上调例如基因、蛋白质、配体、受体或细胞的分子。抑制剂也可以被定义为降低、阻断或失活组成型活性的分子。“激动剂”是与靶标相互作用以引起或促进靶标激活增加的分子。“拮抗剂”是对抗激动剂的一种或多种动作的分子。拮抗剂防止、降低、抑制或中和激动剂的活性,并且即使在没有鉴定出的激动剂的情况下,拮抗剂也可以防止、抑制或降低靶标(例如,靶受体)的组成型活性。
[0048]
术语“调节(modulate)”、“调节(modulation)”等是指分子(例如,激活剂或抑制剂)直接或间接增加或降低本文所述的腺苷相关蛋白的功能或活性的能力。调节剂可以单独起作用,或者它可以使用辅因子,例如蛋白质、金属离子或小分子。调节剂的例子包括小分子化合物和其他生物有机分子。小分子化合物的许多文库(例如,组合文库)是可商购获得的,并且可以用作鉴定调节剂的起点。熟练技术人员能够开发这样的一种或多种测定(例如,生物化学测定或基于细胞的测定),在所述测定中可以筛选此类化合物文库以鉴定具有所需特性的一种或多种化合物;此后,熟练药物化学家能够通过例如合成和评价其类似物和衍生物来优化此类一种或多种化合物。合成和/或分子建模研究也可以用于鉴定激活剂。
[0049]
分子的“活性”可以描述或指代分子与配体或受体的结合;催化活性;刺激基因表达或细胞信号传导、分化或成熟的能力;抗原活性;调节其他分子的活性;等等。术语“增殖活性”包括促进(即为其所需)例如正常细胞分裂以及癌症、肿瘤、发育不良、细胞转化、转移和血管生成或者与其特别相关的活性。
[0050]
如本文所用,“相当的”、“相当的活性”、“与
……
相当的活性”、“相当的效果”、“与
……
相当的效果”等是可以定量地和/或定性地查看的相对项。所述术语的含义经常取决于它们所使用的背景。举例来说,从定性的角度,可以将均激活受体的两种药剂视为具有相当的效果,但是如果一种药剂只能达到另一种药剂的活性的20%(如在本领域接受的测定(例如,剂量
‑
反应测定)或在本领域接受的动物模型中所确定的),则从定量的角度,可以将这两种药剂视为缺乏相当的效果。当将一种结果与另一种结果(例如,一种结果与参考标准)进行比较时,“相当的”经常(尽管并不总是)意指一种结果偏离参考标准小于35%、小于30%、小于25%、小于20%、小于15%、小于10%、小于7%、小于5%、小于4%、小于3%、小于2%或小于1%。在具体的实施方案中,如果一种结果偏离参考标准小于15%、小于10%或小于5%,则这种结果与参考标准是相当的。举例来说,但并非限制,活性或效果可以指代功效、稳定性、溶解度或免疫原性。
[0051]“基本上纯的”指示组分占组合物总含量的大于约50%,典型地总多肽含量的大于约60%。更典型地,“基本上纯的”是指这样的组合物,在所述组合物中总组合物的至少75%、至少85%、至少90%或更多是感兴趣的组分。在一些情况下,多肽将占组合物总含量
的大于约90%或大于约95%。
[0052]
当提及配体/受体、抗体/抗原或其他结合对时,术语“特异性结合”或“选择性结合”指示决定在蛋白质和其他生物制品的异质群体中蛋白质的存在的结合反应。因此,在所指定的条件下,指定的配体与特定的受体结合,并且不以显著量与样品中存在的其他蛋白质结合。所考虑的方法的抗体或源自抗体的抗原结合位点的结合组合物与其抗原或所述抗原的变体或突变蛋白结合,其中亲和力是任何其他抗体或源自其的结合组合物的亲和力的至少两倍、至少十倍、至少20倍或至少100倍。在一个具体的实施方案中,抗体将具有大于约109升/mol的亲和力,如通过例如scatchard分析(munsen等人1980analyt.biochem.107:220
‑
239)所确定的。
[0053]
术语“反应”(例如,细胞、组织、器官或生物体的)包括生物区室内的生物化学或生理行为(例如,浓度、密度、粘附或迁移)、基因表达率或分化状态的变化,其中所述变化与激活、刺激或治疗相关,或与诸如遗传编程的内部机制相关。在某些背景下,术语“激活”、“刺激”等是指如通过内部机制以及通过外部或环境因素调节的细胞激活;而术语“抑制”、“下调”等是指相反的效果。
[0054]
术语“致癌基因驱动的癌症”是指特征在于参与正常细胞生长的至少一个基因发生突变的各种恶性赘生物。参与正常细胞生长的基因包括但不限于kras、braf、met、fubp1、rac1、egfr、cdk4、ctcf、pgr、ret、rasa1、jak1、phf6、nf1、cic、arid1a、zfhx3、zcchc12、gna11、smad4、usp9x、cdkn2a、fat1、pik3r1、scaf4、pms2、rnf43、smc1a、bcor、fgfr2、col5a1、atm、kmt2b、ctnnb1、myc、rad21、pten、axl、hif1/2a、pak4、rhob、tbl1xr1、keap1、zfp36l2、fgfr3、foxa1、flt3、traf3、rnf111、ppp2r1a、txnip、stag2、rit1、tgif1、foxq1、atr、cysltr2、pcbp1、pik3r2、asxl1、hist1h1c、klf5、pik3cb、spop、mecom、cacna1a、ctnnd1、dach1、xpo1、znf750、fbxw7、muc6、kdm6a、gata3、zbtb20、pik3ca、rb1、sox17、smarca4、kit、chd8、chd4和apob。参与正常细胞生长的基因中的突变通常改变参与腺苷的细胞外产生的一种或多种蛋白质的表达水平和/或一种或多种腺苷受体信号传导蛋白的表达水平。这些蛋白质包括但不限于腺苷a2a受体(a2ar)、腺苷a2b受体(a2br)、腺苷a1受体(a1r)、组织非特异性碱性磷酸酶(tnap)、cd73、外核苷酸焦磷酸酶/磷酸二酯酶1(enpp1)、cd38和/或cd39。
[0055]
术语“靶向腺苷的细胞外产生的药剂”是指参与腺苷的细胞外产生的一种或多种蛋白质的调节剂。示例性调节剂包括小分子化合物、抗体和干扰rna。参与腺苷的细胞外产生的蛋白质包括但不限于组织非特异性碱性磷酸酶(tnap)、cd73、外核苷酸焦磷酸酶/磷酸二酯酶1(enpp1)、cd38和/或cd39。因此,已知靶向这些蛋白质的调节剂与本公开文本相关。
[0056]
术语“拮抗腺苷对其受体之一的激活的药剂”是指减少或完全防止腺苷与腺苷受体蛋白(通常是整合膜蛋白)结合的拮抗剂。被腺苷激活的蛋白质受体包括但不限于腺苷a1受体(a1r)、腺苷a2a受体(a2ar)和/或腺苷a2b受体(a2br)。因此,已知靶向这些受体的拮抗剂与本公开文本相关。iii.实施方案的详细描述
[0057]
本文提供了例如治疗被鉴定为患有致癌基因驱动的癌症的受试者的方法,所述方法包括向所述受试者施用靶向腺苷的细胞外产生的药剂和/或拮抗腺苷对其受体之一的激活的药剂。
致癌基因驱动的癌症
[0058]
致癌基因驱动的癌症是指特征在于参与正常细胞生长的至少一个基因发生突变的各种恶性赘生物。如本文所证明的,癌症基因组图谱(tcga)的泛癌分析证明,在致癌基因驱动的癌症中特定的发生突变的致癌基因充当腺苷途径中的蛋白质以及腺苷受体信号传导蛋白的调节子,从而改变它们的表达水平。如先前所说明的,在肿瘤微环境中增加的腺苷水平和/或特定的腺苷介导的信号传导途径的过度激活提供了免疫抑制效应。因此,本文所述的方法通过有利地鉴定改善受试者对基于受试者的致癌基因驱动的癌症的疗法的反应的合适的治疗选择来帮助医疗从业者。
[0059]
存在许多已知的致癌基因,并且本文的公开文本建立了在某些致癌基因与参与腺苷的细胞外产生的蛋白质的改变的表达水平和/或一种或多种腺苷受体信号传导蛋白的改变的表达水平之间的相关性。因此,适用于本文所述的治疗的受试者包括被鉴定为患有致癌基因驱动的癌症的那些,所述受试者在选自以下的至少一个基因中具有突变:kras、braf、met、fubp1、rac1、egfr、cdk4、ctcf、pgr、ret、rasa1、jak1、phf6、nf1、cic、arid1a、zfhx3、zcchc12、gna11、smad4、usp9x、cdkn2a、fat1、pik3r1、scaf4、pms2、rnf43、smc1a、bcor、fgfr2、col5a1、atm、kmt2b、ctnnb1、myc、rad21、pten、axl、hif1/2a、pak4、rhob、tbl1xr1、keap1、zfp36l2、fgfr3、foxa1、flt3、traf3、rnf111、ppp2r1a、txnip、stag2、rit1、tgif1、foxq1、atr、cysltr2、pcbp1、pik3r2、asxl1、hist1h1c、klf5、pik3cb、spop、mecom、cacna1a、ctnnd1、dach1、xpo1、znf750、fbxw7、muc6、kdm6a、gata3、zbtb20、pik3ca、rb1、sox17、smarca4、kit、chd8、chd4和apob。
[0060]
在一些实施方案中,被鉴定为患有致癌基因驱动的癌症的受试者在选自以下的至少一个基因中具有突变:kras、braf、met、fubp1、rac1、egfr、cdk4、ctcf、pgr、ret、rasa1、jak1、phf6、nf1、cic、arid1a、zfhx3、zcchc12、gna11、smad4、usp9x、cdkn2a、fat1、pik3r1、scaf4、pms2、rnf43、smc1a、bcor、fgfr2、col5a1、atm、kmt2b、ctnnb1、myc、rad21、pten、axl、hif1/2a和pak4。
[0061]
在一些实施方案中,被鉴定为患有致癌基因驱动的癌症的受试者在选自以下的至少一个基因中具有突变:egfr、kras、braf、met、fubp1、cdk4、ctcf、pgr、ret、rasa1、jak1、nf1、cic、arid1a、zfhx3、smad4、usp9x、cdkn2a、fat1和atm。
[0062]
在一些实施方案中,被鉴定为患有致癌基因驱动的癌症的受试者在选自以下的至少一个基因中具有突变:myc、pms2、ctnnb1和smad4。
[0063]
在一些实施方案中,被鉴定为患有致癌基因驱动的癌症的受试者在选自以下的至少一个基因中具有突变:kras、braf、rasa1、axl、hif1/2a、pak4和rac1。
[0064]
在一些实施方案中,被鉴定为患有致癌基因驱动的癌症的受试者在选自以下的至少一个基因中具有突变:egfr、kras和braf。
[0065]
可以使用已知的实验室技术和可商购获得的试剂盒来测试和鉴定在上述致癌基因中的突变。例如,snp阵列、foundation medicine的foundation one测试、rna测序或全基因组/外显子组测序。可以使用像变体调用算法(诸如mutect2、varscan、radia等)的多种模式来鉴定这些突变(ellrott k等人cell systems 2018)。
[0066]
在一些实施方案中,本公开文本提供了用于用靶向腺苷的细胞外产生的药剂和/或拮抗腺苷对其受体之一的激活的药剂和至少一种另外的治疗剂(其例子在本文的其他地
方阐述)来治疗被鉴定为患有致癌基因驱动的癌症的受试者的方法。
[0067]
在一些实施方案中,所述癌症对pd
‑
1和/或pd
‑
l1治疗无反应。靶向腺苷的细胞外产生的药剂
[0068]
已知许多蛋白质参与体内腺苷的细胞外产生。例如,导致细胞外腺苷产生的主导途径是cd39(其将atp水解为adp,然后水解为amp)和cd73(其将amp水解为腺苷)对atp的连续去磷酸化。tnap也有助于从amp产生腺苷。导致细胞外腺苷产生的可替代机制是cd38将nad 水解为adpr,并且enpp1将adpr水解为amp。enpp1也可以水解nad 以产生amp。因此,参与腺苷的细胞外产生的蛋白质包括但不限于组织非特异性碱性磷酸酶(tnap)、cd73、外核苷酸焦磷酸酶/磷酸二酯酶1(enpp1)、cd38和/或cd39。如上文所讨论的,在一个或多个致癌基因中的突变可能改变参与腺苷的产生的一种或多种蛋白质的表达水平。因此,可以调节参与腺苷的产生的蛋白质的活性的药剂是有用的,因为它们可以用于减少或消除由致癌基因驱动的癌症引起的改变的蛋白质表达和增加的腺苷水平的影响。
[0069]
如本文所考虑的,本公开文本提供了使用一种或多种靶向腺苷的细胞外产生的药剂治疗受试者的致癌基因驱动的癌症的方法。
[0070]
组织非特异性碱性磷酸酶(tnap)抑制剂。几种tnap抑制剂是本领域已知的。在一些实施方案中,可用于所述方法的tnap抑制剂是公开于wo/2013/126608、wo/2006/039480或wo/2002/092020中的药剂,将每个的内容出于所有目的通过引用特此并入。
[0071]
cd73抑制剂。在一些实施方案中,可用于所述方法的cd73抑制剂是式(i)的化合物或其药学上可接受的盐、水合物或溶剂化物,其中,每个r1独立地选自氢、任选经取代的c1‑
c6烷基、任选经取代的芳基和
‑
c(r2r2)
‑
o
‑
c(o)
‑
or3,或者两个r1基团任选地组合以形成5元至7元环;每个r2独立地选自h和任选经取代的c1‑
c6烷基;每个r3独立地选自h、c1‑
c6烷基和任选经取代的芳基;r5选自h和任选经取代的c1‑
c6烷基;x选自o、ch2和s;a选自:其中的每一个任选地被从1至5个r6取代基取代,并且其中下标n是从0至3的整数;z选自ch2、chr6、nr6和o;
每个r6独立地选自h、ch3、oh、cn、f、任选经取代的c1‑
c6烷基和oc(o)
‑
c1‑
c6烷基;并且任选地,相邻环顶点上的两个r6基团连接在一起以形成具有至少一个杂原子作为环顶点的5元至6元环;并且het选自:其中波浪线指示与所述化合物的其余部分的附接点,并且其中:r
a
选自h、nh2、nhr7、nhc(o)r7、nr7r7、r7、oh、sr7和or7;
r
b
选自h、卤素、nh2、nhr7、nr7r7、r7、oh和or7;r
c
和r
d
独立地选自h、卤素、卤代烷基、nh2、nhr7、nr7r7、r7、oh、or7、sr7、so2r7、
‑
x1‑
nh2、
‑
x1‑
nhr7、
‑
x1‑
nr7r7、
‑
x1‑
oh、
‑
x1‑
or7、
‑
x1‑
sr7和
‑
x1‑
so2r7;r
e
和r
f
独立地选自h、卤素和任选经取代的c1‑
c6烷基;每个x1是c1‑
c4亚烷基;并且每个r7独立地选自任选经取代的c1‑
c
10
烷基、任选经取代的c2‑
c
10
烯基、任选经取代的c2‑
c
10
炔基、任选经取代的c3‑
c7环烷基、任选经取代的c3‑
c7环烷基c1‑
c4烷基、任选经取代的4
‑
7元环杂烷基、任选经取代的4
‑
7元环杂烷基c1‑
c4烷基、任选经取代的芳基、任选经取代的芳基c1‑
c4烷基、任选经取代的芳基c2‑
c4烯基、任选经取代的芳基c2‑
c4炔基、任选经取代的杂芳基、任选经取代的杂芳基c1‑
c4烷基、任选经取代的杂芳基c1‑
c4烯基、任选经取代的杂芳基c2‑
c4炔基,并且任选地,与氮原子附接的两个r7基团连接在一起以形成任选地与芳基环融合的4元至7元杂环;条件是所述化合物不是那些化合物,其中x、a和het的组合得到其中r
g
是h或者两个r
g
基团组合以形成缩丙酮;并且(1)r
c
和r
e
是氢并且r
a
是
‑
oet、
‑
och2ph、
‑
sch2ph、
‑
nh2、甲基氨基、乙基氨基、二甲基氨基、二乙基氨基、n
‑
甲基
‑
n
‑
乙基氨基、苯基氨基、苄基氨基、2
‑
苯基乙基氨基、n
‑
苄基
‑
n
‑
乙基氨基、二苄基氨基、4
‑
氨基苄基氨基、4
‑
氯苄基氨基、4
‑
硝基苄基氨基或4
‑
氨磺酰基苄基氨基;或者(2)r
c
是氢,r
a
是
‑
nh2,并且r
e
是溴、氯、氨基甲基或硫代乙基;或者(3)r
c
是氢,r
a
是苄基氨基,并且r
e
是溴。
[0072]
在一些实施方案中,所述cd73抑制剂是化合物a或其药学上可接受的盐。
[0073]
在一些实施方案中,所述cd73抑制剂是化合物b
或其药学上可接受的盐。
[0074]
在一些实施方案中,所述cd73抑制剂是化合物c或其药学上可接受的盐。
[0075]
在一些实施方案中,所述cd73抑制剂是描述于美国专利公开案2017/0267710(参见,在2017年6月6日提交的美国申请序列号15/400,748)中的分子,将其内容出于所有目的通过引用特此并入。
[0076]
在一些实施方案中,所述cd73抑制剂是公开于wo 2015/164573、wo 2017/120508、wo 2018/183635、wo 2018/094148、wo 2018/119284、wo 2018/183635、wo 2018/208727、wo 2018/208980、wo 2017/098421、wo 2017/153952中的药剂,将每个的内容出于所有目的通过引用特此并入。
[0077]
在一些实施方案中,所述cd73抑制剂是奥来鲁单抗(oleclumab)(medi
‑
9447)、cpi
‑
006、nzv930/srf373、bms
‑
986179或tj4309。
[0078]
外核苷酸焦磷酸酶/磷酸二酯酶1(enpp1)抑制剂。在一些实施方案中,可用于所述方法的外核苷酸焦磷酸酶/磷酸二酯酶1(enpp1)抑制剂是mv
‑
626。
[0079]
在一些实施方案中,可用于所述方法的enpp1抑制剂是公开于wo2019/023635中的药剂,将其内容出于所有目的通过引用特此并入。
[0080]
cd38抑制剂。在一些实施方案中,可用于所述方法的cd38抑制剂是达雷木单抗(daratumumab)或艾萨妥昔单抗(isatuximab)。
[0081]
在一些实施方案中,所述cd38抑制剂是公开于wo/2019/034753、us 2018/0298106、wo 2019/034752中的药剂,将每个的内容出于所有目的通过引用特此并入。
[0082]
cd39抑制剂。cd39也被称为外核苷三磷酸二磷酸水解酶
‑
1。在一些实施方案中,可用于所述方法的cd39抑制剂是iph5201、srf617或ttx
‑
030。
[0083]
在一些实施方案中,所述cd39抑制剂是公开于wo 2012/085132、wo 2017/089334、wo 2009/095478、wo 2011/154453和wo 2018/224685中的药剂,将每个的内容出于所有目的通过引用特此并入。
[0084]
本公开文本包括上述任一种的药学上可接受的盐或衍生物。
拮抗腺苷对其受体之一的激活的药剂
[0085]
体内存在被细胞外腺苷激活的许多受体。也就是说,腺苷的结合启动了酶活性和/或传播了细胞信号。经由以下四种g偶联腺苷受体发生被腺苷激活:a1、a2a、a2b和a3。腺苷大部分通过a2a受体(主要在t细胞上表达)和a2b受体(在髓系细胞上表达)进行信号传导,这通过腺苷刺激导致t细胞激活受损。虽然了解较少,但据报道,a1受体参与癌症(诸如乳腺癌、结肠癌和胃癌)的发病机制,并且据报道a3受体参与结直肠癌和乳腺癌的发病机制。在肿瘤微环境中腺苷对这些受体中的一种或多种的过度激活激活可能导致免疫抑制效应。因此,可以阻断或以其他方式防止腺苷与这些受体结合的拮抗剂可用于治疗致癌基因驱动的癌症。相关受体包括但不限于腺苷a1受体(a1r)、腺苷a2a受体(a2ar)和/或腺苷a2b受体和腺苷a3受体(a3r)。
[0086]
如本文所考虑的,本公开文本提供了使用一种或多种拮抗腺苷对其受体之一的激活的药剂来治疗致癌基因驱动的癌症的方法。
[0087]
腺苷a1受体(a1r)拮抗剂。在一些实施方案中,可用于所述方法的a1r拮抗剂是fk352、kw
‑
3902(rolofylline)、slv320、bg9719(cvt
‑
124)或bg9928(adentri)。
[0088]
腺苷a2a受体(a2ar)和/或腺苷a2b受体(a2br)拮抗剂。在一些实施方案中,可用于所述方法的腺苷a2a受体(a2ar)和/或腺苷a2b受体(a2br)拮抗剂是式(i)的化合物或其药学上可接受的盐、水合物或溶剂化物,其中,g1是n或cr
3a
;g2是n或cr
3b
;g3是n或cr
3c
;r
3a
、r
3b
和r
3c
各自独立地是h或c1‑3烷基;r
1a
和r
1b
各自独立地选自i)h,ii)任选地被从1
‑
3个r5取代基取代的c1‑8烷基,iii)任选地被从1
‑
3个r5取代基取代的
‑
x1‑
o
‑
c1‑8烷基,iv)
‑
c(o)
‑
r6,v)任选地被1
‑
3个r7取代基取代的y,和vi)任选地被1
‑
3个r7取代基取代的
‑
x1‑
y;或者vii)r
1a
和r
1b
与它们所附接的氮一起形成任选地被从1
‑
3个r8取代基取代的5
‑
6元杂环烷基环,其中所述杂环烷基具有0
‑
2个选自o、n和s的另外的杂原子环顶点;每个y是c3‑8环烷基或具有1
‑
3个选自o、n和s的杂原子环顶点的4至6元杂环烷基;r2和r4各自独立地是h或c1‑3烷基;ar1是苯基或5至6元杂芳基,其中的每一个任选地被1
‑
3个r9取代;ar2是苯基或5至6元杂芳基,其中的每一个任选地被1
‑
3个r
10
取代;
其中ar1和ar2的所述5至6元杂芳基各自独立地具有1
‑
3个选自o、n和s的杂原子环顶点;每个x1是c1‑6亚烷基;每个r5独立地选自羟基、c3‑8环烷基、苯基、
‑
o
‑
苯基、
‑
c(o)or
a
和氧代基;每个r6是c1‑8烷基或y,其中的每一个任选地被1
‑
3个选自羟基、
‑
o
‑
苯基、苯基和
‑
o
‑
c1‑8烷基的取代基取代;每个r7独立地选自c1‑8烷基、羟基、
‑
o
‑
c1‑8烷基、氧代基和c(o)or
a
;每个r8独立地选自c1‑8烷基、羟基和氧代基;每个r9独立地选自c1‑8烷基、
‑
o
‑
c1‑8烷基、
‑
x1‑
o
‑
c1‑8烷基、
‑
o
‑
x1‑
o
‑
c1‑8烷基、
‑
x1‑
o
‑
x1‑
o
‑
c1‑8烷基、
‑
c(o)or
a
、卤素、氰基、
‑
nr
b
r
c
、y、
‑
x1‑
c3‑8环烷基和
‑
x2‑
z,其中x2选自c1‑6亚烷基、
‑
c1‑6亚烷基
‑
o
‑
、
‑
c(o)
‑
和
‑
s(o)2‑
,z是具有1
‑
3个选自o、n和s的杂原子环顶点的4至6元杂环烷基,并且其中所述r9取代基中的每一个任选地被1
‑
3个r
11
取代;每个r
10
独立地选自c1‑8烷基、卤基、氰基、
‑
o
‑
c1‑8烷基、
‑
x1‑
o
‑
c1‑8烷基、
‑
o
‑
x1‑
o
‑
c1‑8烷基、
‑
s(o)2‑
c1‑6烷基、
‑
c(o)nr
d
r
e
和具有从1
‑
3个选自o、n和s的杂原子环顶点的4
‑
6元杂芳基,其中所述r
10
取代基中的每一个任选地被1
‑
3个r
12
取代,或者在ar2的相邻环顶点上的两个r
10
任选地组合以形成任选地被1
‑
2个卤素取代的5元杂环;每个r
11
独立地选自羟基、卤基、氰基、
‑
nr
d
r
e
、
‑
c(o)or
a
、苯基、c3‑8环烷基和任选地被c(o)or
a
取代的c1‑4烷基;每个r
12
独立地选自卤基、氰基、羟基、
‑
c(o)or
a
;并且每个r
a
是h或c1‑6烷基;每个r
b
和r
c
独立地选自h、c1‑8烷基、
‑
s(o)2‑
c1‑6烷基、
‑
c(o)or
a
和
‑
x1‑
c(o)or
a
;每个r
d
和r
e
独立地选自h、c1‑8烷基、
‑
s(o)2‑
c1‑6烷基;并且条件是当g1和g2各自是n,g3是ch,r2是ch3,并且r
1a
和r
1b
各自是h时,则ar2不是2
‑
噻吩基、苯基、2
‑
甲氧基苯基、3
‑
甲氧基苯基或4
‑
甲氧基苯基、3
‑
卤代苯基或4
‑
卤代苯基、2,4
‑
二甲氧基苯基、2,4
‑
二氯苯基或者2
‑
甲基苯基或4
‑
甲基苯基。
[0089]
在一些实施方案中,所述腺苷a2a受体(a2ar)或腺苷a2b受体(a2br)拮抗剂是化合物1或其药学上可接受的盐。
[0090]
在一些实施方案中,所述腺苷a2a受体(a2ar)或腺苷a2b受体(a2br)拮抗剂是化合物2
或其药学上可接受的盐。
[0091]
在一些实施方案中,所述腺苷a2a受体(a2ar)或腺苷a2b受体(a2br)拮抗剂是化合物3或其药学上可接受的盐。
[0092]
在一些实施方案中,所述腺苷a2a受体(a2ar)和/或腺苷a2b受体(a2br)拮抗剂是描述于美国专利公开案2018/0215730(还参见2018年6月19日提交的美国申请号15/875,106,将其内容出于所有目的通过引用特此并入)中的分子。
[0093]
在一些实施方案中,所述a2a受体(a2ar)和/或腺苷a2b受体(a2br)拮抗剂是azd4635、ciforadenant(cpi
‑
444)、nir178或pbf
‑
1129。
[0094]
腺苷a3受体(a3r)拮抗剂。在一些实施方案中,可用于所述方法的a3r拮抗剂是描述于wo2007/063539a1 us2003/0078232中的分子,将每个的内容出于所有目的通过引用特此并入。癌症类型
[0095]
本领域技术人员应认识到,由相同蛋白质引起的致癌基因驱动的癌症可以起源于身体的不同部位和不同的细胞类型。在此类情况下,相同蛋白质在两种不同的细胞类型或身体的不同部位中的突变可能导致作为不同类型的癌症的致癌基因驱动的癌症。使用参与腺苷产生的蛋白质的表达水平与特定的致癌基因中的特定突变之间的关系指导疗法,本公开文本提供了不限于特定癌症类型的方法。因此,本公开文本可用于治疗许多不同的癌症类型,包括但不限于前列腺、结直肠、胰腺、宫颈、胃、子宫内膜、脑、肝、膀胱、卵巢、睾丸、头、颈、皮肤(包括黑素瘤和基底癌)、间皮内衬、白细胞(包括淋巴瘤和白血病)、食管、乳腺(包括三阴性乳腺癌)、肌肉、结缔组织、肺(包括小细胞肺癌和非小细胞肺癌)、肾上腺、甲状腺、肾或骨的癌症;胶质母细胞瘤、间皮瘤、肾细胞癌、胃癌、肉瘤(包括卡波西肉瘤)、绒毛膜癌、皮肤基底细胞癌和睾丸精原细胞瘤。
[0096]
在一些实施方案中,本公开文本提供了用于用靶向腺苷的细胞外产生的药剂和/或拮抗腺苷对其受体之一的激活的药剂和至少一种另外的治疗剂(其例子在本文的其他地方阐述)来治疗被鉴定为患有特定类型的致癌基因驱动的癌症的受试者的方法。
[0097]
在本公开文本的一些实施方案中,所述致癌基因驱动的癌症是黑素瘤、结肠癌、胰腺癌、乳腺癌、前列腺癌、肺癌、白血病、脑肿瘤、淋巴瘤、肉瘤、卵巢癌、头颈癌、宫颈癌或卡波西肉瘤。
[0098]
在本公开文本的一些实施方案中,所述致癌基因驱动的癌症是甲状腺、肾上腺、间皮内衬、胆管、胰腺、脑、肾、食管、直肠、结肠、胃、头、颈、皮肤、睾丸、卵巢、肺、子宫内膜、眼、前列腺、乳腺或肝的癌症;或者是胶质母细胞瘤、间皮瘤或肉瘤。
[0099]
在本公开文本的一些实施方案中,所述致癌基因驱动的癌症是睾丸、卵巢、肺、子宫内膜或肾上腺的癌症。
[0100]
在本公开文本的一些实施方案中,所述致癌基因驱动的癌症是眼、前列腺、乳腺、
肾、肝或肺的癌症。组合疗法
[0101]
本公开文本考虑了本文所述的治疗剂(单独地或一种或多种活性治疗剂组合)的用途。另外的活性治疗剂可以是小化学分子;大分子,诸如蛋白质、抗体、肽体、肽、dna、rna或此类大分子的片段;或者细胞疗法或基因疗法。在此类组合疗法中,各种活性剂经常具有不同的互补的作用机制。通过允许减少一种或多种药剂的剂量,从而减少或消除与一种或多种药剂相关的不良反应,此类组合疗法可能是特别有利的。此外,此类组合疗法可以对潜在的疾病、障碍或病症具有协同治疗或预防作用。
[0102]
如本文所用,“组合”意在包括可以分开施用(例如,分开配制用于分开施用(例如,如可以在试剂盒中提供的那样))的疗法以及可以在单一配制品(即,“共同配制品”)中一起施用的疗法。
[0103]
在某些实施方案中,顺序施用或应用本文所述的治疗剂,例如,其中一种药剂在一种或多种其他药剂之前施用。在其他实施方案中,同时施用本文所述的治疗剂,例如,其中同时或大致同时施用两种或更多种药剂;两种或更多种药剂可以存在于两种或更多种单独的配制品中或组合到单一配制品(即,共同配制品)中。不论两种或更多种药剂是顺序施用还是同时施用,出于本发明的目的,它们均被认为是组合施用。
[0104]
本公开文本的靶向腺苷的细胞外产生的药剂和/或拮抗腺苷对其受体之一的激活的药剂可以以在一定情况下适当的任何方式与至少一种其他(活性)药剂组合使用。在一个实施方案中,维持用至少一种活性剂和本文所述的至少一种治疗剂的治疗持续一段时间。在另一个实施方案中,减少或停止用至少一种活性剂的治疗(例如,当受试者稳定时),而以恒定的给药方案维持用本文所述的治疗剂的治疗。在一个进一步的实施方案中,减少或停止用至少一种活性剂的治疗(例如,当受试者稳定时),同时减少用本文所述的治疗剂的治疗(例如,较低的剂量、较不频繁的给药或较短的治疗方案)。在又另一个实施方案中,减少或停止用至少一种活性剂的治疗(例如,当受试者稳定时),并且增加用本文所述的治疗剂的治疗(例如,较高的剂量、较频繁的给药或较长的治疗方案)。在又另一个实施方案中,维持用至少一种活性剂的治疗,并且减少或停止用本文所述的治疗剂的治疗(例如,较低的剂量、较不频繁的给药或较短的治疗方案)。在又另一个实施方案中,减少或停止用至少一种活性剂的治疗和用本文所述的治疗剂的治疗(例如,较低的剂量、较不频繁的给药或较短的治疗方案)。
[0105]
本公开文本提供了用于用靶向腺苷的细胞外产生的药剂和/或拮抗腺苷对其受体之一的激活的药剂和至少一种另外的治疗剂或诊断剂来治疗和/或预防致癌基因驱动的癌症的方法。在一些实施方案中,所述另外的治疗剂或诊断剂是辐射、免疫调节剂或化学治疗剂、或诊断剂。可以用于本发明的合适的免疫调节剂包括cd4ol、b7和b7rp1;刺激性受体的激活性单克隆抗体(mab),诸如抗cd40、抗cd38、抗icos和4
‑
ibb配体;树突细胞抗原负载(体外或体内);抗癌疫苗,诸如树突细胞癌疫苗;细胞因子/趋化因子,诸如ill il2、il12、il18、elc/ccl19、slc/ccl21、mcp
‑
1、il
‑
4、il
‑
18、tnf、il
‑
15、mdc、ifna/b、m
‑
csf、il
‑
3、gm
‑
csf、il
‑
13和抗il
‑
10;细菌脂多糖(lps);吲哚胺2,3
‑
双加氧酶1(ido1)抑制剂和免疫刺激性寡核苷酸。
[0106]
在某些实施方案中,本公开文本包括施用本文所述的治疗剂与信号转导抑制剂
(sti)的组合。如本文所用,术语“信号转导抑制剂”是指选择性抑制信号传导途径中的一个或多个步骤的药剂。本发明的信号转导抑制剂(sti)包括:(i)bcr/abl激酶抑制剂(例如,格列卫(gleevec));(ii)表皮生长因子(egf)受体抑制剂,包括激酶抑制剂和抗体;(iii)her
‑
2/neu受体抑制剂(例如,赫赛汀(herceptin));(iv)akt家族激酶或akt途径的抑制剂(例如,雷帕霉素);(v)细胞周期激酶抑制剂(例如,夫拉平度(flavopiridol));和(vi)磷脂酰肌醇激酶抑制剂。参与免疫调节的药剂也可以与本文所述的治疗剂组合使用以抑制癌症患者体内的肿瘤生长。
[0107]
化学治疗剂的例子包括但不限于烷化剂类,诸如噻替哌和环磷酰胺;烷基磺酸盐类,诸如白消安、英丙舒凡和哌泊舒凡;氮丙啶类,诸如苯佐替哌(benzodopa)、卡波醌、美妥替哌和乌瑞替哌;乙烯亚胺类和甲基蜜胺类,包括六甲蜜胺、曲他胺、三亚乙基磷酰胺、三亚乙基硫代磷酰胺和三羟甲蜜胺;氮芥类,诸如苯丁酸氮芥、萘氮芥、氯磷酰胺(cholophosphamide)、雌莫司汀、异环磷酰胺、氮芥(mechlorethamine)、盐酸氧化氮芥、美法仑、新恩比兴、苯芥胆甾醇、泼尼莫司汀、曲磷胺、乌拉莫司汀;硝基脲类,诸如卡莫司汀、氯脲霉素、福莫司汀、洛莫司汀、尼莫司汀、雷莫司汀;抗生素类,诸如阿克拉霉素、放线菌素(actinomycin)、安曲霉素、偶氮丝氨酸、博来霉素、放线菌素(cactinomycin)、卡奇霉素、卡柔比星、洋红霉素、嗜癌霉素、色霉素、更生霉素、道诺霉素、地托比星、6
‑
重氮基
‑5‑
氧代
‑
l
‑
正亮氨酸、多柔比星、表柔比星、依索比星、伊达比星、麻西罗霉素(marcellomycin)、丝裂霉素、霉酚酸、诺拉霉素、橄榄霉素、培洛霉素、泊非霉素、嘌呤霉素、三铁阿霉素(quelamycin)、罗多比星、链黑菌素、链脲佐菌素、杀结核菌素、乌苯美司、净司他丁、佐柔比星;抗代谢物类,诸如甲氨喋呤和5
‑
氟尿嘧啶(5
‑
fu);叶酸类似物类,诸如二甲叶酸、甲氨喋呤、喋罗呤、三甲曲沙;嘌呤类似物类,诸如氟达拉滨、6
‑
巯基嘌呤、硫咪嘌呤、硫鸟嘌呤;嘧啶类似物类,诸如安西他滨、阿扎胞苷、6
‑
氮杂尿苷、卡莫氟、阿糖胞苷、二脱氧尿苷、脱氧氟尿苷、伊诺他滨、氟尿苷、5
‑
fu;雄激素类,诸如卡普睾酮、屈他雄酮丙酸酯、环硫雄醇、美雄烷、睾内酯;抗肾上腺素类,诸如氨鲁米特、米托坦、曲洛司坦;叶酸补充剂,诸如亚叶酸;醋葡醛内酯;醛磷酰胺糖苷;氨基乙酰丙酸;安吖啶;阿莫司汀(bestrabucil);比生群;伊达曲沙(edatraxate);地磷酰胺;地美可辛;亚丝醌;依氟鸟氨酸;依利醋铵;依托格鲁;硝酸镓;羟基脲;香菇多糖;氯尼达明;米托胍腙;米托蒽醌;莫哌达醇;硝基可润;喷司他丁;蛋氨氮芥;吡柔比星;鬼臼酸;2
‑
乙酰肼;丙卡巴肼;雷佐生;西索菲兰;锗螺胺;细交链孢菌酮酸;三亚胺醌;2,2',2"
‑
三氯三乙胺;乌拉坦;长春地辛;达卡巴嗪;甘露莫司汀;二溴甘露醇;二溴卫矛醇;哌泊溴烷;加胞嘧啶(gacytosine);阿拉伯糖苷(ara
‑
c);环磷酰胺;噻替哌;紫杉烷类,例如紫杉醇和多烯紫杉醇;苯丁酸氮芥;吉西他滨;6
‑
硫鸟嘌呤;巯基嘌呤;甲氨蝶呤;铂和铂配合物类,诸如顺铂、卡铂和奥沙利铂;长春碱;依托泊苷(vp
‑
16);异环磷酰胺;丝裂霉素c;米托蒽醌;长春新碱;长春瑞滨;诺维苯;诺消灵(novantrone);替尼泊苷;道诺霉素;氨基蝶呤;希罗达;伊班膦酸盐;cpt11;拓扑异构酶抑制剂类;二氟甲基鸟氨酸(dmfo);视黄酸;埃斯佩拉霉素类(esperamicins);卡培他滨;蒽环类;和上述任一种的药学上可接受的盐、酸或衍生物。
[0108]
化学治疗剂还包括用于调节或抑制对肿瘤的激素作用的抗激素剂,诸如抗雌激素,包括例如他莫昔芬、雷洛昔芬、抑制芳香酶的4(5)
‑
咪唑、4
‑
羟基他莫昔芬、曲沃昔芬、凯奥昔芬(keoxifene)、奥那司酮和托瑞米芬;和抗雄激素,诸如氟他米特、尼鲁米特、比卡鲁
胺、亮丙瑞林和戈舍瑞林;和上述任一种的药学上可接受的盐、酸或衍生物。在某些实施方案中,组合疗法包括包含一种或多种化学治疗剂的化学疗法方案。在某些实施方案中,组合疗法包括施用激素或相关激素剂。
[0109]
可以与本文所述的治疗剂组合使用的另外的治疗模式包括放射疗法、针对肿瘤抗原的单克隆抗体、单克隆抗体和毒素的复合物、t细胞佐剂、骨髓移植或抗原呈递细胞(例如,树突细胞疗法),包括用于刺激此类抗原呈递细胞的tlr激动剂。
[0110]
在某些实施方案中,本公开文本考虑了本文所述的治疗剂与过继细胞疗法组合的用途,所述过继细胞疗法是一种新的并且有前途的形式的个性化免疫疗法,在所述免疫疗法中向癌症患者施用具有抗肿瘤活性的免疫细胞。正在使用工程化以表达例如嵌合抗原受体(car)或t细胞受体(tcr)的肿瘤浸润淋巴细胞(til)和t细胞来探索过继细胞疗法。过继细胞疗法通常涉及从个体收集t细胞,基因修饰它们以靶向特定的抗原或增强它们的抗肿瘤作用,使它们扩增至足够的数量,并且将经基因修饰的t细胞输注到癌症患者体内。可以从随后将经扩增的细胞再输注到其体内的患者收集t细胞(例如,自体的),或者可以从供体患者收集t细胞(例如,同种异体的)。
[0111]
在某些实施方案中,本公开文本考虑了本文所述的化合物与基于rna干扰的疗法组合以沉默基因表达的用途。rnai开始于将较长的双链rna切割为小干扰rna(sirna)。将sirna的一条链掺入称为rna诱导的沉默复合物(risc)的核糖核蛋白复合物中,然后使用所述核糖核蛋白复合物来鉴定与经掺入的sirna链至少部分互补的mrna分子。risc可以与mrna结合或切割mrna,这二者均抑制翻译。
[0112]
本公开文本考虑了本文所述的治疗剂的抑制剂与免疫检查点抑制剂组合的用途。
[0113]
所有癌症所特有的巨大数量的遗传改变和表观遗传改变提供了一组多样化的抗原,免疫系统可以使用它们来区分肿瘤细胞与其正常对应物。在t细胞的情况下,通过t细胞受体(tcr)的抗原识别启动的反应的最终幅度(例如,细胞因子产生或增殖的水平)和质量(例如,所产生的免疫反应的类型,诸如细胞因子产生的模式)受共刺激性信号与抑制性信号(免疫检查点)之间的平衡的调节。在正常生理条件下,免疫检查点对于预防自身免疫(即,维持自身耐受性)以及对于当免疫系统对病原体感染作出反应时保护组织免受损害至关重要。免疫检查点蛋白的表达可以被肿瘤异常调节,作为重要的免疫抵抗机制。
[0114]
t细胞一直是治疗性操纵内源性抗肿瘤免疫的主要努力焦点,因为i)它们具有在所有细胞区室中选择性识别源自蛋白质的肽的能力;ii)它们具有直接识别和杀死表达抗原的细胞(通过cd8 效应t细胞;也称为细胞毒性t淋巴细胞(ctl))的能力;以及iii)它们具有通过整合适应性和先天性效应机制的cd4 辅助t细胞协调不同的免疫反应的能力。
[0115]
在临床环境中,免疫检查点的阻断
‑
其导致抗原特异性t细胞反应的放大
‑
已经被证明是人类癌症治疗中的一种有前途的方法。
[0116]
t细胞介导的免疫包括多个连续步骤,其中的每个步骤均通过平衡刺激性信号与抑制性信号进行调节以优化反应。虽然在免疫反应中几乎所有的抑制性信号最终均调节细胞内信号传导途径,但许多抑制性信号是通过膜受体启动的,所述膜受体的配体是膜结合的或可溶性的(细胞因子)。虽然相对于正常组织,调节t细胞激活的共刺激性和抑制性受体和配体在癌症中经常不过度表达,但调节组织中的t细胞效应功能的抑制性配体和受体通常在肿瘤细胞上或在与肿瘤微环境相关的非转化细胞上过度表达。可溶性和膜结合受体
‑
配体免疫检查点的功能可以使用激动剂抗体(用于共刺激性途径)或拮抗剂抗体(用于抑制性途径)进行调节。因此,与当前批准用于癌症疗法的大多数抗体相比,阻断免疫检查点的抗体不直接靶向肿瘤细胞,而是靶向淋巴细胞受体或其配体以增强内源性抗肿瘤活性。[参见pardoll,(2012年4月)nature rev.cancer 12:252
‑
64]。
[0117]
作为阻断的候选物的免疫检查点(配体和受体)(其中的一些在各种类型的肿瘤细胞中选择性上调)的例子包括pd1(程序性细胞死亡蛋白1);pdl1(pd1配体);btla(b和t淋巴细胞弱化因子);ctla4(细胞毒性t淋巴细胞相关抗原4);tim3(t细胞膜蛋白3);lag3(淋巴细胞激活基因3);tigit(具有ig和itim结构域的t细胞免疫受体);和杀伤抑制性受体,基于其结构特征可以将它们分为两类:i)杀伤细胞免疫球蛋白样受体(kir)和ii)c型凝集素受体(ii型跨膜受体家族的成员)。在文献中已经描述了其他不太明确的免疫检查点,包括受体(例如,2b4(也称为cd244)受体)和配体(例如,某些b7家族抑制性配体,诸如b7
‑
h3(也称为cd276)和b7
‑
h4(也称为b7
‑
s1、b7x和vctn1))二者。[参见pardoll,(2012年4月)nature rev.cancer 12:252
‑
64]。
[0118]
本公开文本考虑了本文所述的治疗剂与上述免疫检查点受体和配体以及尚未描述的免疫检查点受体和配体的抑制剂组合的用途。某些免疫检查点调节剂是当前可用的,包括pd1和pd
‑
l1抗体纳武单抗(bristol
‑
myers squibb)、派姆单抗(merck)、西米普利单抗(cemiplimab)(sanofi和regeneron)、阿特珠单抗(roche)、度伐鲁单抗(durvalumab)(astrazeneca)和阿维鲁单抗(avelumab)(merck),而其他正在开发中。
[0119]
在本发明的一方面,本文所述的治疗剂与免疫肿瘤剂组合,所述免疫肿瘤剂是t细胞上的(i)刺激性(包括共刺激性)受体的激动剂或(ii)抑制性(包括共抑制性)信号的拮抗剂,这二者均导致放大抗原特异性t细胞反应。某些刺激性分子和抑制性分子是免疫球蛋白超家族(igsf)的成员。与共刺激性受体或共抑制性受体结合的膜结合配体的一个重要家族是b7家族,其包括b7
‑
1、b7
‑
2、b7
‑
h1(pd
‑
l1)、b7
‑
dc(pd
‑
l2)、b7
‑
h2(icos
‑
l)、b7
‑
h3、b7
‑
h4、b7
‑
h5(vista)和b7
‑
h6。与共刺激性受体或共抑制性受体结合的膜结合配体的另一个家族是与同源tnf受体家族成员结合的分子的tnf家族,其包括cd40和cd4ol、ox
‑
40、ox
‑
40l、cd70、cd27l、cd30、cd3ol、4
‑
1bbl、cd137(4
‑
1bb)、trail/apo2
‑
l、trailr1/dr4、trailr2/dr5、trailr3、trailr4、opg、rank、rankl、tweakr/fn14、tweak、baffr、edar、xedar、taci、april、bcma、lt13r、light、dcr3、hvem、vegi/tl1a、tramp/dr3、edar、eda1、xedar、eda2、tnfr1、淋巴毒素a/tnf13、tnfr2、tnfa、lt13r、淋巴毒素a 1132、fas、fasl、relt、dr6、troy、ngfr。
[0120]
在另一方面,所述免疫肿瘤剂是抑制t细胞激活的细胞因子(例如,il
‑
6、il
‑
10、tgf
‑
b、vegf和其他免疫抑制细胞因子)或刺激t细胞激活以刺激免疫反应的细胞因子。
[0121]
在一方面,t细胞反应可以通过本文所述的治疗剂与以下中的一种或多种的组合来刺激:(i)抑制t细胞激活的蛋白质的拮抗剂(例如,免疫检查点抑制剂),所述蛋白质是诸如ctla
‑
4、pd
‑
1、pd
‑
l1、pd
‑
l2、lag
‑
3、tim
‑
3、半乳凝素9、ceacam
‑
1、btla、cd69、半乳凝素
‑
1、tigit、cd113、gpr56、vista、2b4、cd48、garp、pd1h、lair1、tim
‑
1和tim
‑
4;和/或(ii)刺激t细胞激活的蛋白质的激动剂,所述蛋白质是诸如b7
‑
1、b7
‑
2、cd28、4
‑
1bb(cd137)、4
‑
1bbl、icos、icos
‑
l、ox40、ox4ol、gitr、gitrl、cd70、cd27、cd40、dr3和cd2。可以与本文所述的治疗剂组合用于治疗癌症的其他药剂包括nk细胞上的抑制性受体的拮抗剂或nk细胞上的激
活性受体的激动剂。例如,本文的化合物可以与kir的拮抗剂(诸如利瑞鲁单抗(lirilumab))组合。
[0122]
用于组合疗法的又其他药剂包括抑制或耗尽巨噬细胞或单核细胞的药剂,包括但不限于csf
‑
1r拮抗剂,诸如csf
‑
1r拮抗剂抗体,包括rg7155(w011/70024、w011/107553、w011/131407、w013/87699、w013/119716、w013/132044)或fpa
‑
008(w011/140249;w013169264;w014/036357)。
[0123]
在另一方面,所公开的靶向本文所述的蛋白质/受体的药剂可以与一种或多种连接阳性共刺激性受体的激动剂、通过抑制性受体减弱信号传导的阻断剂、拮抗剂以及一种或多种全身性地增加抗肿瘤t细胞的频率的药剂、克服肿瘤微环境内的不同免疫抑制途径(例如,阻断抑制性受体接合(例如,pd
‑
ll/pd
‑
1相互作用)、耗尽或抑制treg(例如,使用抗cd25单克隆抗体(例如,达克珠单抗)或通过离体抗cd25珠耗尽)或逆转/防止t细胞无能或衰竭)的药剂和在肿瘤部位触发先天性免疫激活和/或炎症的药剂一起使用。
[0124]
在一方面,所述免疫肿瘤剂是ctla
‑
4拮抗剂,诸如拮抗性ctla
‑
4抗体。合适的ctla
‑
4抗体包括例如耶尔沃伊(yervoy)(伊匹单抗)或曲美目单抗(tremelimumab)。
[0125]
在另一方面,所述免疫肿瘤剂是pd
‑
1拮抗剂,诸如拮抗性pd
‑
1抗体。合适的pd
‑
1抗体包括例如欧狄沃(opdivo)(纳武单抗)、keytruda(keytruda)(派姆单抗)、medi
‑
0680(amp
‑
514;w02012/145493)、bgb
‑
108、gb
‑
226、pdr
‑
001、mdx
‑
400、shr
‑
1210、ibi
‑
308、pf
‑
06801591。所述免疫肿瘤剂还可以包括匹地利珠单抗(pidilizumab)(ct
‑
011),尽管其对pd
‑
1结合的特异性受到质疑。另一种靶向pd
‑
1受体的方法是由pd
‑
l2(b7
‑
dc)的胞外结构域与iggl的fc部分融合构成的重组蛋白,称为amp
‑
224。
[0126]
在另一方面,所述免疫肿瘤剂是pd
‑
ll拮抗剂,诸如拮抗性pd
‑
ll抗体。合适的pd
‑
ll抗体包括例如mpdl3280a(rg7446;w02010/077634)、度伐鲁单抗(medi4736)、阿特珠单抗、阿维鲁单抗、bms
‑
936559(w02007/005874)、msb0010718c(w02013/79174)、kd
‑
033、ca
‑
327、ca
‑
170、aln
‑
pdl、tsr
‑
042和sti
‑
1014。
[0127]
在另一方面,所述免疫肿瘤剂是lag
‑
3拮抗剂,诸如拮抗性lag
‑
3抗体。合适的lag3抗体包括例如bms
‑
986016(w010/19570、w014/08218)、或imp
‑
731或imp
‑
321(w008/132601、w009/44273)。
[0128]
在另一方面,所述免疫肿瘤剂是cd137(4
‑
1bb)激动剂,诸如激动性cd137抗体。合适的cd137抗体包括例如乌瑞鲁单抗(urelumab)和pf
‑
05082566(w012/32433)。
[0129]
在另一方面,所述免疫肿瘤剂是gitr激动剂,诸如激动性gitr抗体。合适的gitr抗体包括例如bms
‑
986153、bms
‑
986156、trx
‑
518(w006/105021、w009/009116)和mk
‑
4166(w011/028683)。
[0130]
在另一方面,所述免疫肿瘤剂是ox40激动剂,诸如激动性ox40抗体。合适的ox40抗体包括例如medi
‑
6383或medi
‑
6469。
[0131]
在另一方面,所述免疫肿瘤剂是ox4ol拮抗剂,诸如拮抗性ox40抗体。合适的ox4ol拮抗剂包括例如rg
‑
7888(w006/029879)。
[0132]
在另一方面,所述免疫肿瘤剂是cd40激动剂,诸如激动性cd40抗体。在又另一个实施方案中,所述免疫肿瘤剂是cd40拮抗剂,诸如拮抗性cd40抗体。合适的cd40抗体包括例如鲁卡木单抗(lucatumumab)或达西珠单抗(dacetuzumab)。
[0133]
在另一方面,所述免疫肿瘤剂是cd27激动剂,诸如激动性cd27抗体。合适的cd27抗体包括例如伐立鲁单抗(varlilumab)。
[0134]
在另一方面,所述免疫肿瘤剂是mga271(针对b7h3)(w011/109400)。给药
[0135]
本公开文本的靶向腺苷的细胞外产生的药剂和/或拮抗腺苷对其受体之一的激活的药剂可以以一定量施用于受试者,所述量取决于例如施用目标(例如,所需消退的程度);将施用配制品的受试者的年龄、体重、性别与健康和身体状况;施用途径;和疾病、障碍、病症或其症状的性质。给药方案还可以考虑与将施用的一种或多种药剂相关的任何不良反应的存在、性质和程度。有效的剂量量和剂量方案可以容易地根据例如安全性和剂量递增试验、体内研究(例如,动物模型)和熟练技术人员已知的其他方法来确定。
[0136]
通常,给药参数规定剂量量小于可能对受试者具有不可逆转的毒性的量(最大耐受剂量(mtd))且不小于对受试者产生可测量效果所需的量。考虑到施用途径和其他因素,通过例如与adme相关的药代动力学和药效学参数来确定此类量。
[0137]
有效剂量(ed)是药剂的在服用它的一部分受试者中产生治疗反应或所需效果的剂量或量。药剂的“中值有效剂量”或ed50是药剂的在施用它的群体的50%中产生治疗反应或所需效果的剂量或量。尽管ed50通常用作药剂效果的合理期望的量度,但考虑到所有相关因素,它不一定是临床医生可能认为适当的剂量。因此,在一些情况下,有效量大于所计算的ed50,在其他情况下,有效量小于所计算的ed50,并且在仍其他情况下,有效量与所计算的ed50相同。
[0138]
此外,本文所述的靶向治疗剂的药剂的有效剂量可以是这样的量,当以一个或多个剂量向受试者施用时,相对于健康受试者其产生所需的结果。例如,对于经历特定障碍的受试者,有效剂量可以是使该障碍的诊断参数、量度、标记物等改善至少约5%、至少约10%、至少约20%、至少约25%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%或大于90%的剂量,其中100%被定义为正常受试者所展现出的诊断参数、量度、标记物等。
[0139]
在某些实施方案中,本文所述的治疗剂可以以约0.01mg/kg至约50mg/kg或约1mg/kg至约25mg/kg受试者体重/天的剂量水平施用(例如,口服),每天一次或多次,以获得所需的治疗效果。
[0140]
对于口服药剂的施用,组合物可以以片剂、胶囊剂等的形式提供,所述片剂、胶囊剂等含有从1.0至1000毫克的活性成分,特别是1.0、3.0、5.0、10.0、15.0、20.0、25.0、50.0、75.0、100.0、150.0、200.0、250.0、300.0、400.0、500.0、600.0、750.0、800.0、900.0和1000.0毫克的活性成分。
[0141]
除了口服给药外,本文所述的某些药剂的合适的施用途径还包括肠胃外(例如,肌内、静脉内、皮下(例如,注射或植入)、腹膜内、脑池内、关节内、腹膜内、脑内(脑实质内)和脑室内)和眼内。通常皮下或肌内施用的贮库型注射剂也可以用于在限定的时间段内释放本文所述的药剂。
[0142]
在某些实施方案中,所需药剂(本文所述的治疗剂)的剂量被包含在“单位剂型”中。短语“单位剂型”是指物理上离散的单位,每个单位含有足以产生所需效果的预定量的本文所述的治疗剂,单独地或与一种或多种另外的药剂组合。应认识到,单位剂型的参数将
取决于特定药剂和待达到的效果。试剂盒
[0143]
本公开文本还考虑了包含本文所述的治疗剂及其药物组合物的试剂盒。所述试剂盒通常呈容纳各种组分的物理结构的形式,如下文所述,并且可以用于例如实践上述方法。
[0144]
试剂盒可以包括一种或多种本文公开的化合物(在例如无菌容器中提供),所述化合物可以呈适用于向受试者施用的药物组合物的形式。本文所述的化合物可以以随时可用的形式(例如,片剂或胶囊剂)或以需要例如在施用前重构或稀释的形式(例如,散剂)提供。当本文所述的化合物呈需要由使用者重构或稀释的形式时,所述试剂盒还可以包括与本文所述的化合物一起包装或与其分开包装的稀释剂(例如,无菌水)、缓冲剂、药学上可接受的赋形剂等。当考虑组合疗法时,所述试剂盒可以分开含有几种药剂,或者它们可以已经在试剂盒中组合。可以将试剂盒的每种组分封装在单独的容器内,并且所有各个容器可以在单个包装内。可以针对恰当地维持容纳在其中的组分所必需的条件(例如,冷藏或冷冻)设计本发明的试剂盒。
[0145]
试剂盒可以含有标签或包装插页,所述标签或包装插页包括在其中的组分的标识信息和针对它们的使用的说明书(例如,一种或多种活性成分的给药参数、临床药理学,包括作用机制、药代动力学和药效学、不良反应、禁忌症等)。标签或插页可以包括制造商信息,诸如批号和有效期。标签或包装插页可以例如整合到容纳组分的物理结构中、分开包含在物理结构内或贴到试剂盒的组分(例如,安瓿、管或小瓶)上。在某些实施方案中,标签包括描述产品在致癌基因驱动的癌症中的使用的说明书。
[0146]
标签或插页可以另外包括或并入计算机可读介质中,所述计算机可读介质是诸如磁盘(例如,硬盘、卡、内存磁盘)、光盘(诸如cd
‑
rom/ram或dvd
‑
rom/ram、dvd)、mp3、磁带或电存储介质(诸如ram和rom)或这些的混合体(诸如磁/光存储介质、闪存介质或存储型卡)。在一些实施方案中,实际说明书不存在于试剂盒中,而是提供了例如经由互联网从远程源获得说明书的手段。iv.实施例
[0147]
提出以下实施例以向本领域普通技术人员提供如何制备和使用本发明的完整公开和描述,并不旨在限制诸位发明人视为其发明的范围,也不旨在表示进行了下文的实验或它们是可以进行的所有实验。应理解,不一定进行了以一般现在时书写的示例性描述,而是可以进行描述以生成在其中描述的性质的数据等。已经努力确保关于所使用的数字(例如,量、温度等)的准确性,但是应当考虑一些实验误差和偏差。实施例1
‑
在多种癌症中腺苷途径表达的致癌基因驱动的调节
[0148]
使用泛癌癌症基因组图谱(tcga)的rna和外显子组测序数据来分析致癌基因中的突变与参与腺苷的细胞外产生的蛋白质的表达水平和/或一种或多种腺苷受体信号传导蛋白的表达水平之间的关联性。rna测序数据:
[0149]
从gdc commons(https://gdc.cancer.gov/)下载了泛癌癌症基因组图谱(tcga)的原始计数数据。使用limma包(ritchie等人,2015)中的tmm(robinson和oshlack,2010)归一化了原始计数以获得log2计数/百万(cpm)。仅包括原发性肿瘤样品进行下游分析,排除了转移性样品和正常样品。此外,我们聚焦于实体瘤,并且排除了血液癌症像弥漫性大b细
胞淋巴瘤(dlbcl)、aml以及胸腺瘤。将cd73/tnap比率计算为cd73和tnap的log2 cpm值的比率。此分析的结果显示在图1中。外显子组测序数据:
[0150]
在tcga中跨多种癌症类型鉴定出了299个共有的癌症驱动子(bailey等人,2018)。从托管在cbioportal(www.cbioportal.org)上的泛癌tcga数据下载了这299个基因的突变(snp/插入缺失)以及拷贝数改变。调节cd73表达的癌症驱动子的遗传改变的鉴定:
[0151]
对于每个癌症驱动子,给定基因中的所有改变均被二值化为突变型/改变型或野生型。只使用具有rnaseq和外显子组seq两种数据的那些tcga患者进行下游分析。使用线性回归分析(schneider等人,2010),在调整个体肿瘤类型的影响后,使用特定癌症驱动子(wt或突变型状态)的表达数据来预测cd73或其他基因在腺苷途径中的表达。对于每个癌症驱动子,计算了每个基因
‑
癌症驱动子对模型的估计值和p值,并且使用benjamini
‑
hochberg方法(benjamini和hochberg,1995)进行了多重性校正。此分析的结果显示在图2a
‑
图2e中。存活期分析:
[0152]
cd73表达在中值处被分为2组
‑
低(低于中值)和高(高于中值)。使用cox回归模型(mohamed ahmed abdelaal,2015)来评估在总存活期(os)和无进展存活期(pfs)方面cd73表达对所预测的cd73调节子的突变状态的预后影响。此分析的结果显示在图3a
‑
图3d中。使用在r中的survminer包(https://cran.r
‑
project.org/web/packages/survminer/index.html)生成了具有高相比于低cd73表达的egfr wt或alt患者的kaplan
‑
meier曲线,并且使用对数秩检验来计算不同组之间的显著性。此分析的结果显示在图3e中。非小细胞肺癌(nsclc)派姆单抗群组:
[0153]
使用派姆单抗nsclc群组(rizvi等人,2018)来将所预测的cd73表达的癌症驱动调节子与超过6个月的持久临床益处相关联。从cbioportal(www.cbioportal.org)下载了这些患者的突变和反应数据。使用cox回归模型(mohamed ahmed abdelaal,2015)来将所预测的cd73调节子的突变状态与无进展存活期相关联。此分析的结果显示在图4中。数据可视化与统计:
[0154]
使用在r(http://www.r
‑
project.org)中的ggplot2包(wickham,2016)生成了所有的图。使用在r中的ggpubr包(https://www.rdocumentatio n.org/packages/ggpubr)中的wilcoxon秩和检验或t检验计算了2组比较的箱线图的统计,示出在图2b
‑
图2c中。参考文献:bailey,m.h.,tokheim,c.,porta
‑
pardo,e.,sengupta,s.,bertrand,d.,weerasinghe,a.,colaprico,a.,wendl,m.c.,kim,j.,reardon,b.,et al.(2018).comprehensive characterization of cancer driver genes and mutations.cell173,371
–
376.e18.benjamini,y.,and hochberg,y.(1995).controlling the false discovery rate:a practical and powerful approach to multiple testing.journal of the royal statistical society:series b(methodological)57,289
–
300.mohamed ahmed abdelaal,m.(2015).modeling survival data by using cox regression model.ajtas 4,504
–
509.
ritchie,m.e.,phipson,b.,wu,d.,hu,y.,law,c.w.,shi,w.,and smyth,g.k.(2015).limma powers differential expression analyses for rna
‑
sequencing and microarray studies.nucleic acids res 43,e47
–
e47.rizvi,h.,sanchez
‑
vega,f.,la,k.,chatila,w.,jonsson,p.,halpenny,d.,plodkowski,a.,long,n.,sauter,j.l.,rekhtman,n.,et al.(2018).molecular determinants of response to anti
–
programmed cell death(pd)
‑
1and anti
–
programmed death
‑
ligand 1(pd
‑
l1)blockade in patients with non
–
small
‑
cell lung cancer profiled with targeted next
‑
generation sequencing.journal of clinical oncology 36,633
–
641.robinson,m.d.,and oshlack,a.(2010).a scaling normalization method for differential expression analysis of rna
‑
seq data.genome biol.11,r25.schneider,a.,hommel,g.,and blettner,m.(2010).linear regression analysis.deutsches aerzteblatt online 107,776
–
782.way,g.p.,armenia,j.,luna,a.,sander,c.,mina,m.,ciriello,g.,network,t.c.g.a.r.,caesar
‑
johnson,s.j.,demchok,j.a.,felau,i.,et al.(2018).machine learning detects pan
‑
cancer ras pathway activation in the cancer genome atlas.cellreports 23,172
–
180.e173.wickham,h.(2016).ggplot2(cham:springer international publishing).
[0155]
在本文中描述了本发明的具体的实施方案,包括诸位发明人已知用于实施本发明的最佳模式。在阅读了前述说明书后,所公开的实施方案的变化对于在本领域工作的个体来说可能将变得清楚,并且预期那些熟练技术人员可以适当地采用此类变化。因此,本发明旨在以不同于本文具体描述的其他方式实践,并且本发明包括如适用法律所允许的所附权利要求中阐述的主题的所有修改和等效物。此外,除非本文另有指示或在其他方面与上下文明确矛盾,否则本发明包括处于其所有可能变化形式的上述要素的任何组合。
[0156]
将在本说明书中引用的所有出版物、专利申请、登录号和其他参考文献均通过引用并入本文,如同每个单独的出版物或专利申请被具体且单独地指出通过引用并入一样。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。