1.本发明涉及有机电致发光技术领域,尤其涉及一种有机发光材料,特别涉及一种金属铱络合物及其在有机电致发光器件上的应用。
背景技术:
2.目前,作为新一代显示技术的有机电致发光器件(oled)在显示和照明技术方面都获得了越来越多的关注,应用前景十分广泛。但是,和市场应用要求相比,oled器件的发光效率、驱动电压、使用寿命等性能还需要继续加强和改进。
3.一般来说,oled器件基本结构为在金属电极中间夹杂各种不同功能的有机功能材料薄膜,犹如一个三明治的结构,在电流的驱动下,从阴阳两极分别注入空穴和电子,空穴和电子在移动一段距离后,在发光层得到复合,并以光或热的形式进行释放,从而产生了oled的发光。然而,有机功能材料是有机电致发光器件的核心组成部分,材料的热稳定性、光化学稳定性、电化学稳定性、量子产率、成膜稳定性、结晶性、色饱和度等都是影响器件性能表现的主要因素。
4.一般地,有机功能材料包括荧光材料和磷光材料。荧光材料通常为有机小分子材料,一般只能利用25%单重态发光,所以发光效率比较低。而磷光材料由于重原子效应引起地自旋轨道耦合作用,除了利用25%单重态之外,还可以利用75%三重态激子的能量,所以发光效率可以得到提升。但是相较于荧光材料,磷光材料起步较晚,且材料的热稳定性、寿命、色饱和度等都有待提升,这是一个具有挑战性的课题。现已经有人开发各种化合物作为磷光材料。例如发明专利文献cn107973823公开了一类喹啉类的铱化合物,但是该类化合物的色饱和度以及器件性能尤其是发光效率和器件寿命都有待改善;发明专利文献cn106459114公开了一类β
‑
二酮配位基配位的铱化合物,但是该类化合物的升华温度高,色饱和度不佳,特别的,器件性能尤其是发光效率和器件寿命表现不理想,有待进一步改进。以及专利文献cn111377969公开了一类二苯并呋喃联异喹啉的铱络合物但是该两类材料的器件性能,特别是色饱和度满足不了bt2020的显示色域需求,有待进一步提升,以满足快速发展的市场对oled发光材料的需求。
技术实现要素:
5.本发明是为了解决上述问题,提供一种高性能的有机电致发光器件及可实现这样的有机电致发光器件的新型材料。
6.本发明人为了达成前述目的而反复进行了深入的研究,结果发现,通过使用包含下述式(1)和式(2)为配体表示的有机金属铱络合物,可以得到高性能的有机电致发光器件。
7.所述金属铱络合物具有ir(la)(lb)(lc)的通式,其中la为式(1)所示的结构,lb为
式(2)所示的结构。本发明提供的络合物具有升华温度低,光、电稳定性好,发光效率高,寿命长,色饱和度高等优点,可用于有机发光器件中,特别是作为红色发光磷光材料,具有应用于amoled产业的可能,特别是用于显示、照明和汽车尾灯。
8.一种有机金属铱化合物,具有ir(la)(lb)(lc)的通式,其中la为式(1)所示的结构,
[0009][0010]
其中,虚线表示与金属ir连接的位置;
[0011]
其中,z为o、s、se;
[0012]
其中,r1‑
r
11
独立地选自氢、氘、卤素、氰基、取代的或未取代的c1
‑
c10烷基、取代的或未取代的c1
‑
c10杂烷基、取代的或未取代的c3
‑
c20环烷基、取代的或未取代的c3
‑
c20杂环烷基、取代或未取代的c2
‑
c10烯基、取代或未取代的c2
‑
c10炔基、取代或未取代的c6
‑
c30芳基、取代或未取代的c2
‑
c30杂芳基、取代或未取代的三c1
‑
c10烷基硅基、取代或未取代的三c6
‑
c12芳基硅基、取代或未取代的二c1
‑
c10烷基一c6
‑
c30芳基硅基、取代或未取代的一c1
‑
c10烷基二c6
‑
c30芳基硅基、或者r1‑
r4两个相邻的基团之间相互连接形成脂环族环;
[0013]
其中,r
10
不为氢、氘、卤素、氰基;
[0014]
其中,r5‑
r7至少一个为取代或未取代的c6
‑
c30芳基、取代或未取代的c2
‑
c30杂芳基;
[0015]
其中,所述杂烷基、杂环烷基、杂芳基中至少含有一个o、n或s杂原子;
[0016]
其中,所述取代为被氘、f、cl、br、c1
‑
c6烷基、c3
‑
c6环烷基、c1
‑
c6烷基取代的胺基、腈、异腈或膦基所取代,其中所述取代为单取代到最大数目取代;
[0017]
其中lb为式(2)所示的结构,
[0018][0019]
其中,虚线位置表示与金属ir连接的位置;
[0020]
其中,ra
‑
rg独立地选自氢、氘、卤素、取代的或未取代的c1
‑
c10烷基、取代的或未取代的c3
‑
c20环烷基、取代的或未取代的c1
‑
c10杂烷基、取代的或未取代的c3
‑
c20杂环烷基、或者ra、rb、rc之间两两连接以形成脂肪环,re、rf、rg之间两两连接以形成脂肪环;
[0021]
其中,所述杂烷基、杂环烷基中至少含有一个o、n或s杂原子;
[0022]
其中,所述取代为被氘、f、cl、br、c1
‑
c4烷基、c1
‑
c4烷氧基、c3
‑
c6环烷基、c1
‑
c4烷基取代的胺基、氰基、腈、异腈或膦基所取代;
[0023]
其中,lc均为单阴离子型双齿配体,lc与lb不相同且不为oo型配体;
[0024]
其中,lc与la相同或不相同,所述不相同为母核结构不相同或母核结构相同但取代基不同或母核结构相同取代基相同但取代基位置不相同;
[0025]
其中,la、lb、lc两两或三者相互连接形成多齿配体。
[0026]
作为优选的有机金属铱络合物,其中r6为取代或未取代的c6
‑
c30芳基、取代或未取代的c2
‑
c30杂芳基。
[0027]
作为优选的有机金属铱络合物,其中r6为取代或未取代的c6
‑
c18芳基、取代或未取代的c2
‑
c17杂芳基。
[0028]
作为优选的有机金属铱络合物,其中,所述r
10
优选地为取代或未取代的c1
‑
c6烷基、取代的或未取代的c3
‑
c6环烷基,所述取代为被氘、f、c1
‑
c5烷基或c3
‑
c6环烷基取代。
[0029]
作为优选的有机金属铱络合物,其中r8、r9至少之一不为氢、氘、卤素、氰基。
[0030]
作为优选的有机金属铱络合物,其中r8、r9至少之一为取代或未取代的c1
‑
c6烷基、取代的或未取代的c3
‑
c6环烷基。
[0031]
作为优选的有机金属铱络合物,其中r1‑
r4为氢。
[0032]
作为优选的有机金属铱络合物,其中z为o。
[0033]
作为优选的有机金属铱络合物,其中lc与la不相同。
[0034]
作为优选的有机金属铱络合物,其中lc为式(3)所示的结构,
[0035][0036]
其中,虚线表示与金属ir连接的位置;
[0037]
其中,r
12
‑
r
19
独立地选自氢、氘、卤素、氰基、羟基、氨基、胺基、取代的或未取代的c1
‑
c10烷基、取代的或未取代的c1
‑
c10杂烷基、取代的或未取代的c3
‑
c20环烷基、取代或未取代的c2
‑
c10烯基、取代或未取代的c2
‑
c10炔基、取代或未取代的c6
‑
c18芳基、取代或未取代的c2
‑
c17杂芳基、取代或未取代的三c1
‑
c10烷基硅基、取代或未取代的三c6
‑
c12芳基硅基、取代或未取代的二c1
‑
c10烷基一c6
‑
c30芳基硅基、取代或未取代的一c1
‑
c10烷基二c6
‑
c30芳基硅基;
[0038]
其中,r
16
‑
r
19
中至少两个不为氢;
[0039]
其中,r
12
‑
r
15
中至少一组两个相邻的基团之间可形成如下式(4)所示芳香族环;
[0040][0041]
式(4)中
[0042]
其中,虚线表示与吡啶环连接的位置;
[0043]
其中,r
20
‑
r
23
独立地选自氢、氘、卤素、氰基、取代的或未取代的c1
‑
c10烷基、取代的或未取代的c1
‑
c10杂烷基、取代的或未取代的c3
‑
c20环烷基、取代或未取代的c2
‑
c10烯基、取代或未取代的c2
‑
c10炔基、取代或未取代的c6
‑
c18芳基、取代或未取代的c2
‑
c17杂芳基、取代或未取代的三c1
‑
c10烷基硅基、取代或未取代的三c6
‑
c12芳基硅基、取代或未取代的二c1
‑
c10烷基一c6
‑
c30芳基硅基、取代或未取代的一c1
‑
c10烷基二c6
‑
c30芳基硅基、或者r
20
‑
r
23
两个相邻的基团之间相互连接形成脂环族环或芳香族环;
[0044]
其中,所述杂烷基和杂芳基中至少含有一个o、n或s杂原子;
[0045]
其中,所述取代为被氘、f、cl、br、c1
‑
c6烷基、c3
‑
c6环烷基、c1
‑
c6烷基取代的胺基、腈、异腈或膦基取代,其中所述取代为单取代到最大数目取代。
[0046]
作为优选的有机金属铱络合物,其中la为以下结构式之一,或者对应的部分或完全氘代或者氟代,
[0047]
[0048]
[0049]
[0050]
[0051]
[0052]
[0053][0054]
作为优选的有机金属铱络合物,其中lb为以下结构式之一,或者对应的部分或完全氘代或者氟代,
[0055]
[0056][0057]
作为优选的有机金属铱络合物,其中lc为以下结构式之一,或者对应的部分或完全氘代或者氟代,
[0058]
[0059][0060]
配体la,其结构式如下:
[0061][0062]
其中r1
‑
r11、z如上述所示。
[0063]
本发明的目的之一还在于,提供一种电致发光器件,其包括:阴极,阳极以及设置在阴极与阳极之间的有机层,所述有机层中包含上述的有机金属铱络合物。
[0064]
其中所述有机层中包括有发光层,所述金属铱络合物作为发光层的红色发光掺杂材料;或者其中所述有机层中包括有空穴注入层,所述的金属铱络合物作为空穴注入层中的空穴注入材料。
[0065]
本发明的材料不但具有升华温度较低,光、电化学稳定性高,色饱和度高,发光效率高,器件寿命长等优点,,可用于有机发光器件中,特别是作为红色发光磷光材料,具有应用于amoled产业的可能,特别是用于显示、照明和汽车尾灯。本发明的材料作为磷光材料,可以将三重激发态转换成光,所以能够提高有机电致发光器件的发光效率,从而降低能耗。
附图说明
[0066]
图1是本发明的化合物la002在氘代氯仿溶液中的1hnmr谱图,
[0067]
图2是本发明的化合物ir(la002)2lb005在氘代氯仿溶液中的1hnmr谱图,
[0068]
图3是本发明的化合物la005在氘代氯仿溶液中的1hnmr谱图,
[0069]
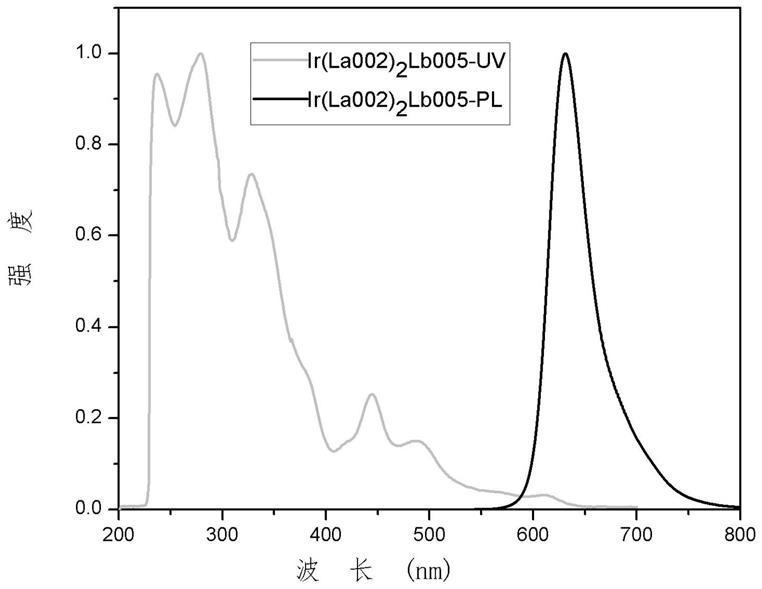
图4是本发明的化合物ir(la005)2lb005在氘代氯仿溶液中的1hnmr谱图,
[0070]
图5是本发明的化合物ir(la002)2lb005在二氯甲烷溶液中的紫外吸收光谱以及发射光谱,
[0071]
图6是本发明的化合物ir(la005)2lb005在二氯甲烷溶液中的紫外吸收光谱以及发射光谱。
具体实施方式
[0072]
本发明有机金属铱化合物,具有ir(la)(lb)(lc)的通式,其中la为式(1)所示的结
构,
[0073][0074]
其中,虚线表示与金属ir连接的位置;
[0075]
其中,z为o、s、se;
[0076]
其中,r1‑
r
11
独立地选自氢、氘、卤素、氰基、取代的或未取代的c1
‑
c10烷基、取代的或未取代的c1
‑
c10杂烷基、取代的或未取代的c3
‑
c20环烷基、取代的或未取代的c3
‑
c20杂环烷基、取代或未取代的c2
‑
c10烯基、取代或未取代的c2
‑
c10炔基、取代或未取代的c6
‑
c30芳基、取代或未取代的c2
‑
c30杂芳基、取代或未取代的三c1
‑
c10烷基硅基、取代或未取代的三c6
‑
c12芳基硅基、取代或未取代的二c1
‑
c10烷基一c6
‑
c30芳基硅基、取代或未取代的一c1
‑
c10烷基二c6
‑
c30芳基硅基、或者r1‑
r4两个相邻的基团之间相互连接形成脂环族环;
[0077]
其中,r
10
不为氢、氘、卤素、氰基;
[0078]
其中,r5‑
r7至少一个为取代或未取代的c6
‑
c30芳基、取代或未取代的c2
‑
c30杂芳基;
[0079]
其中,所述杂烷基、杂环烷基和杂芳基中至少含有一个o、n或s杂原子;
[0080]
其中,所述取代为被氘、f、cl、br、c1
‑
c6烷基、c3
‑
c6环烷基、c1
‑
c6烷基取代的胺基、腈、异腈或膦基所取代,其中所述取代为单取代到最大数目取代;
[0081]
其中lb为式(2)所示的结构,
[0082][0083]
其中,虚线位置表示与金属ir连接的位置;
[0084]
其中,ra
‑
rg独立地选自氢、氘、卤素、取代的或未取代的c1
‑
c10烷基、取代的或未取代的c3
‑
c20环烷基、取代的或未取代的c1
‑
c10杂烷基、取代的或未取代的c3
‑
c20杂环烷基、或者ra、rb、rc之间两两连接以形成脂肪环,re、rf、rg之间两两连接以形成脂肪环;
[0085]
其中,所述杂烷基和杂环烷基中至少含有一个o、n或s杂原子;
[0086]
其中,所述取代为被氘、f、cl、br、c1
‑
c4烷基、c1
‑
c4烷氧基、c3
‑
c6环烷基、c1
‑
c4烷基取代的胺基、氰基、腈、异腈或膦基所取代;
[0087]
其中,lc均为单阴离子型双齿配体,lc与lb不相同且不为oo型配体;
[0088]
其中,lc与la相同或不相同,所述不相同为母核结构不相同或母核结构相同但取代基不同或母核结构相同取代基相同但取代基位置不相同;
[0089]
其中,la、lb、lc两两或三者相互连接形成多齿配体。
[0090]
以下,对于式(1)
‑
式(4)所表示的化合物的各基团的例子进行说明。
[0091]
需要说明的是,本说明书中,“取代或未取代的碳数a~b的x基”这一表述中的“碳数a~b”表示的是x基未取代的情况下的碳数,不包括x基被取代时的取代基的碳数。
[0092]
作为c1~c10的烷基,为直链状或支链状的烷基,具体来说,为甲基、乙基、丙基、、异丙基、正丁基、异丁基、仲丁基、叔丁基、正戊基及其异构体、正己基及其异构体、正庚基及其异构体、正辛基及其异构体、正壬基及其异构体、正癸基及其异构体等,优选为甲基、乙基、丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基,更优选为丙基、异丙基、异丁基、仲丁基、叔丁基。
[0093]
作为c3~c20的环烷基,可举出环丙基、环丁基、环戊基、环己基、1-金刚烷基、2-金刚烷基、1-降冰片烷基、2-降冰片烷基等,优选为环戊基、环己基。
[0094]
作为c3~c10的杂环烷基,可举出氧杂环丙基、硫杂环丁基、n杂环戊基、氧杂环戊基、氧杂环己基、二氧杂环己基等,优选为氧杂环戊基、氧杂环己基。
[0095]
作为c2~c10的烯基,可举出乙烯基、丙烯基、烯丙基、1
‑
丁二烯基、2
‑
丁二烯基、1
‑
己三烯基、2
‑
己三烯基、3
‑
己三烯基等,优选为丙烯基、烯丙基。
[0096]
作为c1
‑
c10杂烷基,为含有除碳氢以外的原子构成的直链状或支链状的烷基、环烷基等,可举出巯甲基甲烷基、甲氧基甲烷基、乙氧基甲烷基、叔丁氧基甲烷基、n,n
‑
二甲基甲烷基、环氧丁烷基、环氧戊烷基、环氧己烷基等,优选为甲氧基甲烷基、环氧戊烷基。
[0097]
作为芳基的具体例,为苯基、萘基、蒽基、菲基、并四苯基、芘基、屈基、苯并[c]菲基、苯并[g]屈基、芴基、苯并芴基、二苯并芴基、联苯基、三联苯基、四联苯基、荧蒽基等,优选为苯基、萘基。
[0098]
作为杂芳基的具体例,可举出吡咯基、吡嗪基、吡啶基、嘧啶基、三嗪基、吲哚基、异吲哚基、咪唑基、呋喃基、苯并呋喃基、异苯并呋喃基、二苯并呋喃基、二苯并噻吩基、氮杂二苯并呋喃基、氮杂二苯并噻吩基、二氮杂二苯并呋喃基、二氮杂二苯并噻吩基、喹啉基、异喹啉基、喹喔啉基、咔唑基、菲啶基、吖啶基、菲咯啉基、吩嗪基、吩噻嗪基、吩噁嗪基、噁唑啉基、噁二唑基、呋咱基、噻吩基、苯并噻吩基、二氢吖啶基、氮杂咔唑基、二氮杂咔唑基、喹唑啉基等,优选为吡啶基、嘧啶基、三嗪基、二苯并呋喃基、二苯并噻吩基、氮杂二苯并呋喃基、氮杂二苯并噻吩基、二氮杂二苯并呋喃基、二氮杂二苯并噻吩基、咔唑基、氮杂咔唑基、二氮杂咔唑基。
[0099]
下述实施例仅仅是为了便于理解技术发明,不应视为本发明的具体限制。
[0100]
本发明中的化合物合成中涉及的原物料和溶剂等均购自于alfa、acros等本领域技术人员熟知的供应商。
[0101]
化合物la002的合成
[0102][0103]
中间体3的合成
[0104]
将原料1(30.00g,123.7mmol,1.0eq)、原料2(20.76g,148.4mmol,1.2eq)、pd
‑
132(439.2mg,0.61mmol,0.005eq)、碳酸钾(34.2g,247.2mmol,2.0eq)、甲苯(300ml)、乙醇(90ml)、去离子水(90ml)加入到1l的三口烧瓶中,抽真空氮气置换3次,在氮气保护下,60℃搅拌1小时。tlc监控,原料1反应完全。冷却到室温,反应液进行分液,收集有机相,用去离子水水洗2次(100ml/次),有机相再进行硅胶过滤,用甲苯(50ml)冲洗,收集滤液旋干得到固体,采用四氢呋喃(60ml)和乙醇(150ml)在5℃时进行重结晶1次,过滤收集固体,干燥后得到白色固体中间体3(22.3g,收率:69.95%),质谱:258.69(m h)。
[0105]
化合物la002的合成
[0106]
将中间体3(22.00g,85.37mmol,1.0eq)、原料4(23.16g,102.45mmol,1.2eq)、pd
‑
132(604.51mg,0.85mmol,0.01eq)、碳酸钾(23.6g,170.75mmol,2.0eq)、甲苯(300ml)、乙醇(100ml)、去离子水(100ml)加入到1l的三口烧瓶中,抽真空氮气置换3次,在氮气保护下,65℃搅拌2小时。tlc监控,原料3反应完全。冷却到室温,反应液进行分液,收集有机相,用去离子水水洗2次(200ml/次),有机相再进行硅胶过滤,用甲苯(100ml)冲洗,收集滤液旋干得到固体,采用四氢呋喃(200ml)和乙醇(200ml)在室温下进行重结晶2次,过滤收集固体,干燥后得到白色固体化合物la002(24.0g,收率:69.68%),质谱:404.45(m h)。1hnmr(400mhz,cdcl3)δ8.75(d,j=5.7hz,1h),8.11(s,1h),8.00(d,j=7.4hz,1h),7.96
–
7.87(m,2h),7.81(d,j=5.6hz,1h),7.69(d,j=8.8hz,1h),7.60
–
7.52(m,2h),7.46
–
7.31(m,4h),7.26(ddd,j=26.3,13.3,4.7hz,2h),2.62(s,3h).
[0107]
化合物ir(la002)2lb005的合成
[0108][0109]
化合物ir(la002)
‑
1的合成:
[0110]
将化合物la002(17.22g,42.68mmol,3.5eq)、ircl3.3h2o(4.30g,12.19mmol,1.0eq)置于一个500ml的单口圆底烧瓶中,加入乙二醇乙醚(260ml)及去离子水(86ml),真空置换3次,混合液于n2保护作用下,110℃搅拌20小时。冷却到室温后,加入甲醇(130ml)搅拌1h,过滤收集固体,得到暗红色固体为化合物ir(la002)
‑
1(10.23g,81.25%)。得到的化合物不经进一步纯化直接使用于下一步。
[0111]
化合物ir(la002)2lb005的合成:
[0112]
将化合物ir(la002)
‑
1(10.23g,9.91mmol,1.0eq)、lb005(10.52g,49.54mmol,5.0eq)、碳酸钠(10.50g,99.08mmol,10.0eq)置于一个500ml的单口圆底烧瓶中,加入乙二醇乙醚(200ml),真空置换3次,混合液于n2保护作用下,50℃搅拌24小时,tlc监控ir(la002)
‑
1反应完全。冷却到室温后,加入250ml甲醇室温打浆2h,抽滤,滤饼使用二氯甲烷(330ml)溶解滤硅胶,滤液加入去离子水(120ml)洗涤3次,分液,收集有机相浓缩,干燥得到暗红色固体,采用四氢呋喃/甲醇(7v/4v)重结晶三次得到红色固体为化合物ir(la002)2lb005(6.22g,收率:51.95%)。将6.22克ir(la002)2lb005粗品升华纯化后得到升华纯ir(la002)2lb005(3.34g,收率:53.69%)。质谱:1209.42(m h)。1hnmr(400mhz,cdcl3)δ9.08(d,j=9.0hz,2h),8.35(d,j=6.3hz,2h),8.04(s,2h),7.91(d,j=8.9hz,2h),7.83(d,j=
6.9hz,2h),7.70
–
7.65(m,2h),7.50(d,j=8.0hz,2h),7.47
–
7.39(m,6h),7.38
–
7.32(m,4h),7.32
–
7.26(m,4h),4.85(s,1h),1.68(s,6h),1.29(dd,j=15.2,6.6hz,3h),1.12(dd,j=13.0,7.4hz,2h),0.91
–
0.72(m,5h),0.51(t,j=7.4hz,6h),
‑
0.11(t,j=7.4hz,6h).
[0113]
化合物la005的合成
[0114][0115]
中间体6的合成
[0116]
参照中间体3的合成和纯化方法,只需要将对应的原物料变更即可,得到目标化合物中间体6,质谱:254.73(m h)。
[0117]
化合物la005的合成
[0118]
参照化合物la002的合成和纯化方法,只需要将对应的原物料变更即可,得到目标化合物la005,质谱:400.48(m h)。1h nmr(400mhz,cdcl3)δ8.73(d,j=5.7hz,1h),8.10(s,1h),8.01(d,j=7.6hz,1h),7.96
–
7.87(m,2h),7.81(d,j=5.8hz,1h),7.74(d,j=8.7hz,1h),7.65(d,j=8.1hz,2h),7.56(s,1h),7.47
–
7.30(m,5h),2.63(s,3h),2.44(s,3h).
[0119]
化合物ir(la005)2lb005的合成
[0120][0121]
化合物ir(la005)
‑
1的合成
[0122]
参照化合物ir(la002)
‑
1的合成和纯化方法,只需要将对应的原物料变更即可,得到化合物ir(la005)
‑
1不经纯化直接使用于下一步。
[0123]
化合物ir(la005)2lb005的合成
[0124]
参照化合物ir(la002)2lb005的合成和纯化方法,只需要将对应的原物料变更即可,得到红色固体为化合物ir(la005)2lb005(4.14g,收率:47.93%)。将4.14克ir(la005)2lb005粗品升华纯化后得到升华纯ir(la005)2lb005(2.31g,收率:55.79%),质谱:1201.49(m h)。1h nmr(400mhz,cdcl3)δ9.06(d,j=9.0hz,2h),8.32(d,j=6.3hz,2h),8.02(s,2h),7.95(d,j=10.4hz,2h),7.82(d,j=7.2hz,2h),7.75(d,j=8.0hz,4h),7.49(d,j=8.2hz,2h),7.42
–
7.26(m,12h),4.84(s,1h),2.47(s,6h),1.68(s,6h),1.38
–
1.20(m,4h),1.11(dd,j=13.0,7.4hz,2h),0.81(dd,j=14.5,8.0hz,4h),0.50(t,j=7.4hz,6h),
‑
0.14(t,j=7.4hz,6h).
[0125]
化合物la018的合成
[0126][0127]
中间体8的合成
[0128]
参照中间体3的合成和纯化方法,只需要将对应的原物料变更即可,得到目标化合物中间体8,质谱:272.72(m h)。
[0129]
化合物la018的合成
[0130]
参照化合物la002的合成和纯化方法,只需要将对应的原物料变更即可,得到目标化合物la018,质谱:418.47(m h)。
[0131]
化合物ir(la018)2lb005的合成
[0132][0133]
化合物ir(la018)
‑
1的合成
[0134]
参照化合物ir(la002)
‑
1的合成和纯化方法,只需要将对应的原物料变更即可,得到化合物ir(la018)
‑
1不经纯化直接使用于下一步。
[0135]
化合物ir(la018)2lb005的合成
[0136]
参照化合物ir(la002)2lb005的合成和纯化方法,只需要将对应的原物料变更即可,得到红色固体为化合物ir(la018)2lb005(5.04g,收率:53.74%)。将5.04克ir(la018)2lb005粗品升华纯化后得到升华纯ir(la018)2lb005(2.63g,收率:52.18%),质谱:1237.47(m h)。1h nmr(400mhz,cdcl3)δ8.96(d,2h),8.37(d,2h),7.85(s,2h),7.54(m,6h),7.44(m,2h),7.42
–
7.23(m,12h),4.83(s,1h),3.71(s,2h),2.69(s,6h),2.34(s,6h),1.27(d,j=35.0hz,8h),1.07
–
0.89(m,12h).
[0137]
化合物la025的合成
[0138][0139]
取1l单口瓶,投入化合物la018(9.32g,22.32mmol,1.0eq),60%的氢化钠(2.68g,66.97mmol,3.0eq),氘代乙醇(93ml)。真空、氮气置换三次,在氮气保护下加热至75℃,反应16h。反应降至室温。加入重水(40ml)搅拌析出固体,过滤收集固体。粗品进行硅胶柱层析分离(洗脱剂:二氯甲烷/正己烷=1/15),所得白色固体化合物la025(6.82g,收率72.64%)。质谱:421.49(m h)。
[0140]
化合物ir(la025)2lb005的合成
[0141][0142]
化合物ir(la025)
‑
1的合成
[0143]
参照化合物ir(la002)
‑
1的合成和纯化方法,只需要将对应的原物料变更即可,得到化合物ir(la025)
‑
1不经纯化直接使用于下一步。
[0144]
化合物ir(la025)2lb005的合成
[0145]
参照化合物ir(la002)2lb005的合成和纯化方法,只需要将对应的原物料变更即可,得到红色固体为化合物ir(la025)2lb005(5.04g,收率:53.74%)。将5.04克ir(la025)2lb005粗品升华纯化后得到升华纯ir(la025)2lb005(2.63g,收率:52.18%),质谱:1243.51(m h)。1h nmr(400mhz,cdcl3)δ8.99(d,2h),8.38(d,2h),7.85(s,2h),7.59(m,6h),7.45(m,2h),7.44
–
7.25(m,12h),4.84(s,1h),3.71(s,2h),2.37(s,6h),1.27(d,j=35.0hz,8h),1.07
–
0.89(m,12h).
[0146]
化合物la031的合成
[0147][0148]
中间体10的合成
[0149]
参照中间体3的合成和纯化方法,只需要将对应的原物料变更即可,得到目标化合物中间体10,质谱:241.69(m h)。
[0150]
化合物la031的合成
[0151]
参照化合物la002的合成和纯化方法,只需要将对应的原物料变更即可,得到目标化合物la031,质谱:387.44(m h)。
[0152]
化合物ir(la031)2lb005的合成
[0153][0154]
化合物ir(la031)
‑
1的合成
[0155]
参照化合物ir(la002)
‑
1的合成和纯化方法,只需要将对应的原物料变更即可,得到化合物ir(la031)
‑
1不经纯化直接使用于下一步。
[0156]
化合物ir(la031)2lb005的合成
[0157]
参照化合物ir(la002)2lb005的合成和纯化方法,只需要将对应的原物料变更即
可,得到红色固体为化合物ir(la031)2lb005(4.59g,收率:44.87%)。将4.59克ir(la031)2lb005粗品升华纯化后得到升华纯ir(la031)2lb005(2.12g,收率:46.18%),质谱:1175.4(m h)。1h nmr(400mhz,cdcl3)δ8.93(d,2h),8.37(d,2h),8.23(d,2h),8.11(d,2h),7.98(m,2h),7.56(d,j=15.0hz,4h),7.45
–
7.26(m,6h),7.14(m,4h),6.90(m,4h),4.81(s,1h),2.34(s,6h),1.27(d,j=35.0hz,6h),1.07
–
0.84(m,16h).
[0158]
化合物la032的合成
[0159][0160]
中间体12的合成
[0161]
参照中间体3的合成和纯化方法,只需要将对应的原物料变更即可,得到目标化合物中间体12,质谱:241.69(m h)。
[0162]
化合物la032的合成
[0163]
参照化合物la002的合成和纯化方法,只需要将对应的原物料变更即可,得到目标化合物la032,质谱:387.44(m h)。
[0164]
化合物ir(la032)2lb005的合成
[0165][0166]
化合物ir(la032)
‑
1的合成
[0167]
参照化合物ir(la002)
‑
1的合成和纯化方法,只需要将对应的原物料变更即可,得到化合物ir(la032)
‑
1不经纯化直接使用于下一步。
[0168]
化合物ir(la032)2lb005的合成
[0169]
参照化合物ir(la002)2lb005的合成和纯化方法,只需要将对应的原物料变更即可,得到红色固体为化合物ir(la032)2lb005(4.17g,收率:46.31%)。将4.17克ir(la032)2lb005粗品升华纯化后得到升华纯ir(la032)2lb005(1.94g,收率:46.52%),质谱:1175.4(m h)。1h nmr(400mhz,cdcl3)9.24(d,2h),8.70(d,2h),8.48(d,2h),8.33(d,2h),8.11(m,2h),7.98(m,2h),7.84(m,6h),7.61
–
7.44(m,6h),7.35(d,j=40.0hz,4h),4.82(s,1h),2.34(s,6h),1.28(d,j=35.0hz,6h),1.08
–
0.85(m,16h).
[0170]
化合物la033的合成
[0171][0172]
中间体14的合成
[0173]
参照中间体3的合成和纯化方法,只需要将对应的原物料变更即可,得到目标化合物中间体14,质谱:241.69(m h)。
[0174]
化合物la033的合成
[0175]
参照化合物la002的合成和纯化方法,只需要将对应的原物料变更即可,得到目标化合物la033,质谱:387.44(m h)。
[0176]
化合物ir(la033)2lb005的合成
[0177][0178]
化合物ir(la033)
‑
1的合成
[0179]
参照化合物ir(la002)
‑
1的合成和纯化方法,只需要将对应的原物料变更即可,得到化合物ir(la033)
‑
1不经纯化直接使用于下一步。
[0180]
化合物ir(la033)2lb005的合成
[0181]
参照化合物ir(la002)2lb005的合成和纯化方法,只需要将对应的原物料变更即可,得到红色固体为化合物ir(la033)2lb005(4.17g,收率:46.31%)。将4.17克ir(la033)2lb005粗品升华纯化后得到升华纯ir(la033)2lb005(1.94g,收率:46.52%),质谱:1175.4(m h)。1h nmr(400mhz,cdcl3)δ9.01(d,2h),8.52(d,2h),8.24(d,2h),8.12(d,2h),7.96(m,2h),7.57(d,j=15.0hz,4h),7.45
–
7.26(m,6h),7.17(m,4h),6.92(m,4h),4.82(s,1h),2.34(s,6h),1.28(d,j=35.0hz,6h),1.08
–
0.85(m,16h).
[0182]
化合物la042的合成
[0183][0184]
中间体16的合成
[0185]
参照中间体3的合成和纯化方法,只需要将对应的原物料变更即可,得到目标化合物中间体16,质谱:288.81(m h)。
[0186]
化合物la042的合成
[0187]
参照化合物la002的合成和纯化方法,只需要将对应的原物料变更即可,得到目标化合物la042,质谱:434.56(m h)。
[0188]
化合物ir(la042)2lb005的合成
[0189][0190]
化合物ir(la042)
‑
1的合成
[0191]
参照化合物ir(la002)
‑
1的合成和纯化方法,只需要将对应的原物料变更即可,得到化合物ir(la042)
‑
1不经纯化直接使用于下一步。
[0192]
化合物ir(la042)2lb005的合成
[0193]
参照化合物ir(la002)2lb005的合成和纯化方法,只需要将对应的原物料变更即可,得到红色固体为化合物ir(la042)2lb005(4.39g,收率:50.32%)。将4.39克ir(la042)2lb005粗品升华纯化后得到升华纯ir(la042)2lb005(2.35g,收率:53.53%),质谱:1269.65(m h)。1h nmr(400mhz,cdcl3)8.97(d,2h),8.38(d,2h),7.98(d,2h),7.84(d,2h),7.56(d,j=15.0hz,4h),7.39(m,4h),7.31(m,4h),6.71(d,4h),4.79(s,1h),3.10(m,2h),2.34(s,6h),1.31(m,4h),1.22(m,14h),1.07
–
0.88(m,16h).
[0194]
化合物la050的合成
[0195][0196]
中间体18的合成
[0197]
参照中间体3的合成和纯化方法,只需要将对应的原物料变更即可,得到目标化合物中间体18,质谱:269.74(m h)。
[0198]
化合物la050的合成
[0199]
参照化合物la002的合成和纯化方法,只需要将对应的原物料变更即可,得到目标化合物la050,质谱:415.50(m h)。
[0200]
化合物ir(la050)2lb005的合成
[0201][0202]
化合物ir(la050)
‑
1的合成
[0203]
参照化合物ir(la002)
‑
1的合成和纯化方法,只需要将对应的原物料变更即可,得到化合物ir(la050)
‑
1不经纯化直接使用于下一步。
[0204]
化合物ir(la050)2lb005的合成
[0205]
参照化合物ir(la002)2lb005的合成和纯化方法,只需要将对应的原物料变更即可,得到红色固体为化合物ir(la050)2lb005(3.82g,收率:43.67%)。将3.82克ir(la050)2lb005粗品升华纯化后得到升华纯ir(la050)2lb005(1.74g,收率:45.54%),质谱:1231.52(m h)。1h nmr(400mhz,cdcl3)δ8.96(d,2h),8.23(d,2h),8.11(d,2h),7.98(d,2h),7.68(s,2h),7.56(m,4h),7.39(m,4h),7.31(m,4h),6.99(s,2h),4.83(s,1h),2.68(s,6h),2.38(d,j=40.0hz,12h),1.27(m,6h),1.07
–
0.85(m,16h).
[0206]
化合物la068的合成
[0207][0208]
中间体20的合成
[0209]
参照中间体3的合成和纯化方法,只需要将对应的原物料变更即可,得到目标化合物中间体20,质谱:265.71(m h)。
[0210]
化合物la068的合成
[0211]
参照化合物la002的合成和纯化方法,只需要将对应的原物料变更即可,得到目标化合物la068,质谱:411.47(m h)。
[0212]
化合物ir(la068)2lb005的合成
[0213][0214]
化合物ir(la068)
‑
1的合成
[0215]
参照化合物ir(la002)
‑
1的合成和纯化方法,只需要将对应的原物料变更即可,得到化合物ir(la068)
‑
1不经纯化直接使用于下一步。
[0216]
化合物ir(la068)2lb005的合成
[0217]
参照化合物ir(la002)2lb005的合成和纯化方法,只需要将对应的原物料变更即可,得到红色固体为化合物ir(la068)2lb005(3.24g,收率:41.61%)。将3.24克ir(la068)2lb005粗品升华纯化后得到升华纯ir(la068)2lb005(1.86g,收率:57.40%),质谱:1223.45(m h)。1h nmr(400mhz,cdcl3)δ9.02(d,2h),8.43(d,2h),7.95(m,6h),7.84(m,4h),7.53(t,j=12.5hz,6h),7.35(m,8h),4.83(s,1h),2.34(s,6h),1.27(m,6h),1.08
–
0.85(m,16h).
[0218]
化合物la079的合成
[0219][0220]
参照化合物la002的合成和纯化方法,只需要将对应的原物料变更即可,得到目标化合物la079,质谱:446.53(m h)。
[0221]
化合物ir(la079)2lb005的合成
[0222][0223]
化合物ir(la079)
‑
1的合成
[0224]
参照化合物ir(la002)
‑
1的合成和纯化方法,只需要将对应的原物料变更即可,得到化合物ir(la079)
‑
1不经纯化直接使用于下一步。
[0225]
化合物ir(la079)2lb005的合成
[0226]
参照化合物ir(la002)2lb005的合成和纯化方法,只需要将对应的原物料变更即可,得到红色固体为化合物ir(la079)2lb005(2.77g,收率:41.61%)。将2.77克ir(la079)2lb005粗品升华纯化后得到升华纯ir(la079)2lb005(1.75g,收率:63.17%),质谱:1293.58(m h)。1hnmr(400mhz,cdcl3)δ9.08(d,j=9.0hz,2h),8.35(d,j=6.3hz,2h),8.04(s,2h),7.91(d,j=8.9hz,2h),7.83(d,j=6.9hz,2h),7.70
–
7.65(m,2h),7.50(d,j=8.0hz,2h),7.47
–
7.39(m,6h),7.38
–
7.32(m,4h),7.32
–
7.26(m,4h),4.85(s,1h),2.67(m,2h),2.21(d,4h),1.36(s,12h),1.29(dd,j=15.2,6.6hz,3h),1.12(dd,j=13.0,7.4hz,2h),0.91
–
0.72(m,5h),0.51(t,j=7.4hz,6h),
‑
0.11(t,j=7.4hz,6h).
[0227]
化合物la086的合成
[0228][0229]
参照化合物la002的合成和纯化方法,只需要将对应的原物料变更即可,得到目标化合物la079,质谱:422.44(m h)。
[0230]
化合物ir(la086)2lb005的合成
[0231][0232]
化合物ir(la086)
‑
1的合成
[0233]
参照化合物ir(la002)
‑
1的合成和纯化方法,只需要将对应的原物料变更即可,得到化合物ir(la086)
‑
1不经纯化直接使用于下一步。
[0234]
化合物ir(la086)2lb005的合成
[0235]
参照化合物ir(la002)2lb005的合成和纯化方法,只需要将对应的原物料变更即可,得到红色固体为化合物ir(la086)2lb005(2.64g,收率:40.77%)。将2.63克ir(la086)2lb005粗品升华纯化后得到升华纯ir(la086)2lb005(1.56g,收率:59.31%),质谱:1245.44(m h)。1hnmr(400mhz,cdcl3)δ9.02(d,j=9.1hz,2h),8.31(d,j=6.6hz,2h),8.02(s,2h),7.88(d,j=8.7hz,2h),7.81(d,j=6.6hz,2h),7.72
–
7.62(m,2h),7.49
–
7.36(m,6h),7.35
–
7.32(m,4h),7.31
–
7.26(m,4h),4.85(s,1h),1.68(s,6h),1.28(dd,j=15.2,6.6hz,3h),1.13(dd,j=13.0,7.4hz,2h),0.93
–
0.71(m,5h),0.52(t,j=7.4hz,6h),
‑
0.12(t,j=7.4hz,6h)。
[0236]
化合物ir(la005)2lb009的合成
[0237][0238]
参照化合物ir(la002)2lb005的合成和纯化方法,只需要将对应的原物料变更即可,得到红色固体为化合物ir(la005)2lb009(4.12g,收率:50.37%)。将4.12克ir(la005)2lb009粗品升华纯化后得到升华纯ir(la005)2lb009(2.52g,收率:61.16%),质谱:1197.46(m h)。1h nmr(400mhz,cdcl3)9.03(d,j=9.0hz,2h),8.35(d,j=6.3hz,2h),8.01(s,2h),7.96(d,j=10.4hz,2h),7.85(d,j=7.2hz,2h),7.73(d,j=8.0hz,4h),7.51(d,j=8.2hz,2h),7.43
–
7.27(m,12h),4.84(s,1h),2.35(m,13h),2.20(m,2h),1.65(m,12h),1.34(m,6h).
[0239]
化合物ir(la005)2lb018的合成
[0240][0241]
参照化合物ir(la002)2lb005的合成和纯化方法,只需要将对应的原物料变更即可,得到红色固体为化合物ir(la005)2lb018(3.68g,收率:53.14%)。将3.68克ir(la005)2lb018粗品升华纯化后得到升华纯ir(la005)2lb018(2.43g,收率:66.03%),质谱:1281.62
(m h)。1h nmr(400mhz,cdcl3)9.03(d,j=9.0hz,2h),8.35(d,j=6.3hz,2h),8.01(s,2h),7.96(d,j=10.4hz,2h),7.85(d,j=7.2hz,2h),7.73(d,j=8.0hz,4h),7.51(d,j=8.2hz,2h),7.43
–
7.27(m,12h),4.84(s,1h),3.05(m,8h),2.45(s,6h),2.34(s,6h),1.47(m,2h),1.01(d,j=15.0hz,11h),0.87(s,12h).
[0242]
化合物lc003的合成
[0243][0244]
参照化合物la002的合成和纯化方法,只需要将对应的原物料变更即可,得到目标化合物lc003,质谱:330.36(m h)。
[0245]
化合物ir(la005)(lb009)(lc003)的合成
[0246][0247]
化合物ir(la005)
‑
2的合成
[0248]
在一个3l的三口烧瓶中加入二聚体ir(la005)
‑
1(9.85g,9.75mmol,1.0eq)和二氯甲烷(740ml)中,搅拌溶解。将三氟甲磺酸银(5.01g,19.49mmol,2.0eq)溶解于甲醇(500ml),再加入到原反应瓶溶液中,真空置换3次,混合液于n2保护作用下,室温搅拌16小时。然后将反应液进行硅藻土过滤,用二氯甲烷(200ml)淋洗滤渣,将滤液旋干得到化合物ir(la005)
‑
2(7.82g,76.21%)。得到的化合物不经纯化直接使用于下一步。
[0249]
化合物ir(la005)2lc003的合成
[0250]
将化合物ir(la005)
‑
2(7.8g,7.41mmol,1.0eq)、lc003(6.1g,18.53mmol,2.5eq)加入到250ml的三口烧瓶中,加入乙醇(80ml),真空置换3次,在n2保护作用下,搅拌回流16小时。冷却到室温后进行过滤,收集固体用二氯甲烷(220ml)溶解,进行硅胶过滤,再用二氯甲烷(80ml)淋洗滤饼,滤液旋干后,采用四氢呋喃/甲醇重结晶2次(产品:四氢呋喃:甲醇=1:7:10),干燥得到化合物ir(la005)2lc003(4.51g,46.2%)。质谱:1318.52(m h)。化合物ir(la005)2(lc003)
‑
1的合成
[0251]
将化合物ir(la005)2lc003(6.33g,4.80mmol,1.0eq)、氯化锌(32.74g,240.22mmol,50eq)置于一个1l的单口烧瓶中,加入1,2二氯乙烷(380ml),真空置换3次,于
n2保护作用下,搅拌回流反应18小时。tlc点板监控原料ir(la005)2lc003基本反应完全,冷却到室温后,加入去离子水洗涤3次(120ml/次),滤液旋干得到化合物ir(la005)2lc003
‑
1(3.62g,78.84%)。得到的化合物不经纯化直接使用于下一步。
[0252]
化合物ir(la005)(lb009)(lc003)的合成
[0253]
将化合物ir(la005)2(lc003)
‑
1(3.52g,3.69mmol,1.0eq)、lb009(3.84g,18.44mmol,5.0eq)、碳酸钠(3.91g,36.88mmol,10.0eq)置于一个250ml的单口圆底烧瓶中,加入乙二醇乙醚(56ml),真空置换3次,混合液于n2保护作用下,50℃搅拌24小时,tlc监控ir(la005)2(lc003)
‑
1反应完全。冷却到室温后,加入112ml甲醇室温打浆2h,抽滤,滤饼使用二氯甲烷(100ml)溶解进行硅胶过滤,再用二氯甲烷(50ml)淋洗滤饼,收集滤液加入去离子水洗涤3次(60ml/次),分液,收集有机相浓缩,干燥得到暗红色固体,采用四氢呋喃/甲醇(产品:四氢呋喃:甲醇=1:8:12)重结晶3次得到红色固体为化合物ir(la005)(lb009)(lc003)(1.72g,收率:41.33%)。将1.72克ir(la005)(lb009)(lc003)粗品升华纯化后得到升华纯ir(la005)(lb009)(lc003)(0.93g,收率:54.06%)。质谱:1127.33(m h)。1h nmr(400mhz,cdcl3))δ8.95(d,1h),8.40(d,1h),8.17(d,1h),8.07(m,2h),7.98(m,2h),7.78(d,1h),7.60
–
7.45(m,6h),7.35(m,2h),7.16(m,3h),6.92(d,1h),4.82(s,1h),2.63(t,2h),2.42
–
2.25(m,13h),2.20(m,2h),1.89(t,2h),1.65(m,12h),1.34(m,4h).
[0254]
化合物ir(la005)(lb009)(lc004)的合成
[0255][0256][0257]
化合物ir(la005)2lc004的合成
[0258]
参照化合物ir(la005)2lc003的合成和纯化方法,只需要将对应的原物料变更即可,得到目标化合物ir(la005)2lc004,质谱:1278.57(m h)。
[0259]
化合物ir(la005)2(lc004)
‑
1的合成
[0260]
参照化合物ir(la005)2(lc003)
‑
1的合成和纯化方法,只需要将对应的原物料变更即可,得到化合物ir(la005)2(lc004)
‑
1不经纯化直接使用于下一步。
[0261]
化合物ir(la005)(lb009)(lc004)的合成
[0262]
参照化合物ir(la005)(lb009)(lc003)的合成和纯化方法,只需要将对应的原物料变更即可,得到红色固体为化合物ir(la005)(lb009)(lc004)(2.03g,收率:38.66%)。将2.03克ir(la005)(lb009)(lc004)粗品升华纯化后得到升华纯ir(la005)(lb009)(lc004)(1.18g,收率:58.70%),质谱:1087.39(m h)。1h nmr(400mhz,cdcl3)δ8.95(d,1h),8.40(d,1h),8.17(d,1h),8.07(m,2h),7.98(m,2h),7.78(d,1h),7.60
–
7.45(m,6h),7.35(m,2h),7.16(m,3h),6.92(d,1h),4.82(s,1h),2.49
–
2.26(m,15h),2.20(m,2h),1.93
–
1.50(m,13h),1.34(d,j=40.0hz,4h),0.87(s,6h).
[0263]
化合物ir(la005)(lb009)(lc025)的合成
[0264][0265][0266]
化合物ir(la005)2lc025的合成
[0267]
参照化合物ir(la005)2lc003的合成和纯化方法,只需要将对应的原物料变更即可,得到目标化合物ir(la005)2lc025,质谱:1354.63(m h)。
[0268]
化合物ir(la005)2(lc025)
‑
1的合成
[0269]
参照化合物ir(la005)2(lc003)
‑
1的合成和纯化方法,只需要将对应的原物料变更即可,得到化合物ir(la005)2(lc025)
‑
1不经纯化直接使用于下一步。
[0270]
化合物ir(la005)(lb009)(lc025)的合成
[0271]
参照化合物ir(la005)(lb009)(lc003)的合成和纯化方法,只需要将对应的原物料变更即可,得到红色固体为化合物ir(la005)(lb009)(lc025)(1.63g,收率:34.65%)。将1.63克ir(la005)(lb009)(lc025)粗品升华纯化后得到升华纯ir(la005)(lb009)(lc025)(0.77g,收率:47.23%),质谱:1163.44(m h)。1h nmr(400mhz,cdcl3)δ8.93(m,2h),8.40(d,1h),8.17(d,1h),7.98(dd,2h),7.78(m,2h),7.60
–
7.45(m,8h),7.35(m,4h),7.16(m,4h),4.84(s,1h),2.43(d,2h),2.35(m,9h),2.20(m,2h),1.91
–
1.47(m,13h),1.34(m,4h),0.87(s,6h).
[0272]
化合物ir(la005)(lb009)(lc027)的合成
[0273][0274][0275]
化合物ir(la005)2lc027的合成
[0276]
参照化合物ir(la005)2lc003的合成和纯化方法,只需要将对应的原物料变更即可,得到目标化合物ir(la005)2lc027,质谱:1366.64(m h)。
[0277]
化合物ir(la005)2(lc027)
‑
1的合成
[0278]
参照化合物ir(la005)2(lc003)
‑
1的合成和纯化方法,只需要将对应的原物料变更即可,得到化合物ir(la005)2(lc027)
‑
1不经纯化直接使用于下一步。
[0279]
化合物ir(la005)(lb009)(lc027)的合成
[0280]
参照化合物ir(la005)(lb009)(lc003)的合成和纯化方法,只需要将对应的原物料变更即可,得到红色固体为化合物ir(la005)(lb009)(lc027)(1.87g,收率:34.65%)。将1.87克ir(la005)(lb009)(lc027)粗品升华纯化后得到升华纯ir(la005)(lb009)(lc027)(0.91g,收率:48.66%),质谱:1175.45(m h)。1h nmr(400mhz,cdcl3)δ8.93(m,2h),8.40(d,1h),8.17(d,1h),7.98(dd,2h),7.78(m,2h),7.60
–
7.45(m,8h),7.35(m,4h),7.16(m,4h),4.84(s,1h),2.35(m,9h),2.21(m,1h),1.99
–
1.47(m,20h),1.36
‑
0.82(m,6h).
[0281]
选取对应的材料,用同样类似的方法可以用于合成、升华得到其他化合物。
[0282]
本发明的化合物ir(la002)2lb005/ir(la005)2lb005在二氯甲烷溶液中的紫外吸收光谱以及发射光谱,见附图所示。本发明的化合物均表现出更饱和的红色发光以及较窄的半峰宽,利于实现较高的发光效率。
[0283]
应用例:有机电致发光器件的制作
[0284]
将50mm*50mm*1.0mm的具有ito阳极电极的玻璃基板在乙醇中超声清洗10分钟,再150度烘干后经过n
2 plasma处理30分钟。将洗涤后的玻璃基板安装在真空蒸镀装置的基板支架上,首先再有阳极电极线一侧的面上按照覆盖电极的方式采用共蒸镀的模式蒸镀化合物htm1和p
‑
dopant(比例为97%:3%),形成膜厚为的薄膜,紧接着蒸镀一层htm1形成膜厚为左右的薄膜,再在htm1薄膜上蒸镀一层htm2形成膜厚为
的薄膜,然后,在htm2膜层上再采用共蒸镀的模式蒸镀主体材料1和主体材料2和掺杂化合物(比例为:48.5%:48.5%:3%,对比化合物x或本发明化合物),膜厚为主体材料和掺杂材料比例为90%:10%,在发光层上采用共蒸镀的模式蒸镀etl:liq(比例为50%:50%),再在电子传输层材料上蒸镀最后蒸镀一层金属作为电极。
[0285]
[0286][0287]
[0288][0289]
评价:将上述器件进行器件性能测试,在各实施例和比较例中,使用恒定电流电源(keithley 2400),使用固定的电流密度流过发光元件,使用分光辐射亮度计(cs 2000)测试发光波谱。同时测定电压值以及测试亮度为初始亮度的90%的时间(lt90)。结果如下:电流效率以及器件寿命均为以对比化合物5的数值为100%计算,
[0290]
[0291][0292]
由上面表格中的数据对比可知,使用本发明的化合物作为掺杂剂的有机电致发光器件,在相同色标的器件中,相较于对比化合物在驱动电压、发光效率、器件寿命都表现出更加优越的性能。
[0293]
二氯甲烷溶液中的发射波长对比:定义为:在对应的化合物用二氯甲烷配置成10
‑5mol/l的溶液,用日立(hitach)f2700荧光分光光度计测试发射波长,得出发射峰最大发射处的波长。测试结果如下:
[0294]
[0295][0296]
由上面表格中的数据对比可知,本发明金属铱络合物相较于对比化合物,具有较大的红移,可以满足产业化对深红光特别是bt2020色域的需求。
[0297]
升华温度对比:升华温度的定义为:在10
‑
7torr的真空度,蒸镀速率为1埃每秒对应的温度。测试结果如下:
[0298]
材料升华温度ir(la002)2lb005271ir(la018)2lb005273ir(la033)2lb005273ir(la068)2lb005270ir(la079)2lb005265ir(la086)2lb005266ir la005 lb009 lc003272对比化合物1280对比化合物2288对比化合物3286对比化合物4276对比化合物5268
[0299]
由上面表格中的数据对比可知,本发明金属铱络合物具有较低的升华温度,有利于产业化应用。
[0300]
本发明通过对取代基的特殊搭配,相对于现有技术,出乎意料地提供了更好的器件发光效率和改善的寿命,提供了较低的升华温度、更饱和的红色发光。上述结果表明本发明的化合物具有升华温度较低,光、电化学稳定性高,色饱和度高,发光效率高,器件寿命长等优点,可用于有机电致发光器件中。特别是作为红色发光掺杂体,具有应用于oled产业的可能,特别是用于显示、照明和汽车尾灯。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。