1.本发明属于药物分析技术领域,具体涉及一种格列齐特缓释片溶出曲线的测定方法、相似性评价方法及其应用。
背景技术:
2.口服固体制剂的溶出度测定在评价药品内在质量方面发挥着重要的作用,它不仅成为药品研究、质量评价、质量控制及生产工艺检测的主要方法和手段,同时也是建立体内外相关性的基础。
3.格列齐特,化学名为1
‑
(3
‑
氮杂双环[3.3.0]辛基)
‑3‑
对甲苯磺酰脲,分子式c
15
h
21
n3o3s,属于第二代磺酰脲类药物,是治疗2型糖尿病的一线用药。本品的长期治疗能够提高胰岛素介导的葡萄糖利用率,增强受体后胰岛素敏感途径。另外,它还具有良好的耐受性、低血糖的发生率低、低复发率以及延缓糖尿病视网膜病变进展的潜力等。
[0004]
格列齐特缓释片是一种新的格列齐特药物制剂,它采用一种独特的亲水性机制设计,由羟丙基甲基纤维素按一定的比例配制而成,有助于药物的有效成分按需释放、调节血药浓度,使其与人体血糖水平波动相吻合,它还具有较高的生物利用度,吸收不受食物作用的影响。格列齐特缓释片,在体内滞留时间较长,受胃肠道生理条件如ph、胃肠道空腹或饱食、滞留时间等因素影响较大。传统溶出方法采用的机械装置运动状态单一,和胃肠道内的层流液体状态及蠕动、转运、转动等动态过程差距较大;实验过程中通常采用同种溶出介质,介质的组成和ph不随时间而变化,和体内实际情况差异较大,不能更好的模拟缓释制剂体内释放情况。
[0005]
在传统溶出测定方法溶出曲线一致的情况下,国产格列齐特缓释片目前报道通过临床生物等效性试验较低。因此,为了能对体内生物等效性试验做出预判,提高临床生物等效性试验的成功率,建立一种区分力强的体外溶出检测方法对于格列齐特缓释片一致性评价具有重要的作用。
技术实现要素:
[0006]
本发明的目的在于提供一种格列齐特缓释片溶出曲线的测定方法、相似性评价方法及其应用,该方法通过模拟体内溶出动态过程,测定格列齐特缓释片的体外释放度,不仅可以科学有效的评价仿制制剂的质量,而且可以用于仿制制剂与参比制剂一致性评价工作。
[0007]
为实现上述技术目的,本发明采取的技术方案为:
[0008]
一种格列齐特缓释片溶出曲线的测定方法,采用流通池法对格列齐特缓释片进行溶出度测定,包括以下步骤:
[0009]
溶出介质泵入流通池,对流通池内的格列齐特缓释片进行溶出释放,溶出液输出至采样装置,在设定时间内对采样装置内的样品进行采集;
[0010]
所述流通池为闭环流通池或开环流通池;
[0011]
当流通池采用闭环流通池时,对格列齐特缓释片进行溶出释放的步骤为:
[0012]
将格列齐特缓释片样品置于流通池中的样品架上,溶出介质经过装有恒温装置的热交换器的水浴,通过恒流泵泵入流通池的下端,与格列齐特缓释片样品接触后,经流通池上端的滤过系统过滤后回到介质存储瓶;
[0013]
所述流通池锥形部装满玻璃珠,使溶出介质在流通池内以层流方式流动;采用五种不同的溶出介质,溶出介质的体积为1000ml,流速为16ml
·
min
‑1,温度为37.0
±
0.5℃,在固定的时间点测定溶出液中格列齐特的浓度,直至格列齐特缓释片溶出完成;
[0014]
当流通池采用开环流通池时,对格列齐特缓释片进行溶出释放的步骤为:
[0015]
将格列齐特缓释片样品置于流通池中的样品架上,溶出介质通过流通池,使大量新鲜的溶出介质不断地经过被测样品,让格列齐特缓释片样品随时与新鲜溶出介质接触,主药成分逐渐溶出;
[0016]
所述流通池锥形部装满玻璃珠,使溶出介质在流通池内以层流方式流动;采用序贯性切换的溶出介质;流速为4~16ml
·
min
‑1,温度为37.0
±
0.5℃,在固定的时间点测定溶出液中格列齐特的浓度,直至格列齐特缓释片溶出完成;
[0017]
利用高效液相色谱法测定溶出液中在不同时间点的格列齐特的溶出度,并绘制累积溶出量与时间的溶出曲线图。
[0018]
进一步地,采用高效液相色谱法进行溶出液中格列齐特溶出量测定时,液相色谱仪的参数为:unitary c8色谱柱,250mm
×
4.6mm,5μm;流动相:乙腈
‑
0.02mol
·
l
‑1乙酸铵溶液=45:55,用甲酸调ph至3.5;柱温:35℃;检测波长:235nm;流速:1.0ml
·
min
‑1;进样量:20μl。
[0019]
进一步地,当流通池为闭环流通池时,所述五种不同的溶出介质包括经脱气处理的ph为4.5,6.0,6.8,7.4的磷酸盐缓冲液和ph为1.2的盐酸溶液。
[0020]
进一步地,当流通池为闭环流通池时,所述固定的时间点是1、2、4、6、8、10、12、16、20、24h。
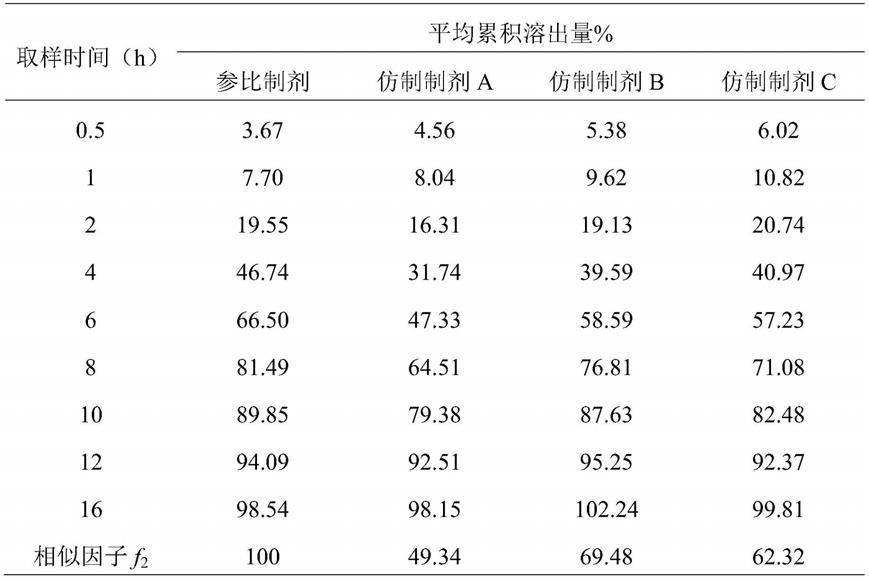
[0021]
进一步地,当流通池为开环流通池时,所述序贯性切换的溶出介质为ph1.2 hcl(2h)
‑
ph4.5 pbs(2h)
‑
ph6.0 pbs(2h)
‑
ph6.8pbs(5h)
‑
ph7.4 pbs(1h)。
[0022]
进一步地,当流通池为开环流通池时,所述固定的时间点是1、2、4、6、8、10、11、12h。
[0023]
本发明还公开了一种格列齐特缓释片溶出曲线的相似性评价方法,采用相似因子法,利用格列齐特缓释片仿制制剂与参比制剂在不同时间点测得的平均溶出度数据,计算相似因子f2,所述相似因子f2用于评价格列齐特缓释片的仿制制剂溶出曲线与参比制剂溶出曲线的相似性;
[0024]
当相似因子f2≥50时,仿制制剂与参比制剂的溶出度曲线相似,当相似因子f2<50时,仿制制剂与参比制剂的溶出曲线不相似。
[0025]
进一步地,采用上述格列齐特缓释片溶出曲线的测定方法测定格列齐特缓释片的溶出度,选择时间点2、4、8、12、16、24h时仿制制剂与参比制剂的平均溶出量数据,计算所述相似因子f2的值。
[0026]
进一步地,采用上述格列齐特缓释片溶出曲线的测定方法测定格列齐特缓释片的
溶出度,选择时间点2、4、6、11、12h时仿制制剂与参比制剂的平均溶出量数据,计算所述相似因子f2的值。
[0027]
本发明还公开了上述格列齐特缓释片溶出曲线的测定方法或格列齐特缓释片溶出曲线的相似性评价方法在格列齐特缓释片参比制剂与仿制制剂一致性评价中的应用。
[0028]
与现有技术相比,本发明具有以下有益效果:
[0029]
1)本发明采用的开环式或闭环式流通池进行格列齐特缓释片溶出曲线的测定,开环系统可提供连续的新鲜溶出介质,对于难溶性药物能够提供合适的漏槽条件;通过此溶出装置获得的体外溶出度数据更能反映一些水溶性差的药物在体内的表现;实验条件可灵活变化,如试验介质的组成、ph梯度变化、流速等,实现了对人体胃肠道生理环境的动态模拟,比篮法、桨法更接近模拟体内流体动力学;样品可固定在流通池中,适用的剂型广泛;
[0030]
2)对比实施例2和实施例3,采用本发明的流通池法测定格列齐特缓释片溶出曲线,各仿制制剂与参比制剂的溶出曲线,溶出速率有所不同,仿制制剂与参比制剂之间有较好的区分度,可以有效评价仿制制剂的质量情况,实现对仿制制剂与参比制剂进行一致性评估。
附图说明
[0031]
图1为本发明的专属性试验高效液相色谱图;
[0032]
图2为本发明实施例1中以篮法测定参比制剂和三个仿制制剂的溶出曲线示意图;
[0033]
图3为本发明实施例2中在流通池闭环系统下以ph1.2盐酸溶液为溶出介质测定参比制剂和三个仿制制剂的溶出曲线示意图;
[0034]
图4为本发明实施例2中在流通池闭环系统下以ph4.5磷酸盐缓冲液为溶出介质测定参比制剂和三个仿制制剂的溶出曲线示意图;
[0035]
图5为本发明实施例2中在流通池闭环系统下以ph6.0磷酸盐缓冲液为溶出介质测定参比制剂和三个仿制制剂的溶出曲线示意图;
[0036]
图6为本发明实施例2中在流通池闭环系统下以ph6.8磷酸盐缓冲液为溶出介质测定参比制剂和三个仿制制剂的溶出曲线示意图;
[0037]
图7为本发明实施例2中在流通池闭环系统下以ph7.4磷酸盐缓冲液为溶出介质测定参比制剂和三个仿制制剂的溶出曲线示意图;
[0038]
图8为本发明实施例3中在流通池开环系统下以4ml
·
min
‑1的流速测定参比制剂和三个仿制制剂的溶出曲线示意图;
[0039]
图9为本发明实施例3中在流通池开环系统下以8ml
·
min
‑1的流速测定参比制剂和三个仿制制剂的溶出曲线示意图;
[0040]
图10为本发明实施例3中在流通池开环系统下以16ml
·
min
‑1的流速测定参比制剂和三个仿制制剂的溶出曲线示意图。
具体实施方式
[0041]
下面结合附图和实施例对本发明的技术方案作进一步详细的说明。以下实施例仅用于说明本发明而不用于限制本发明的范围。下述实施例中所使用的实验方法,如无特殊说明,均为常规方法;所用的试剂和材料,如无特殊说明,均可从商业途径获得。
[0042]
以下实施例中,根据溶出曲线相似性判定方法,评价格列齐特缓释片的参比制剂与仿制制剂溶出曲线的相似性。
[0043][0044]
其中,r
t
为第t时间点参比制剂的平均累积释放度;t
t
为第t时间点受试制剂的平均累积释放度;n为取样时间点个数。
[0045]
相似因子f2≥50时,仿制制剂与参比制剂的溶出度曲线相似,相似因子f2<50时,仿制制剂与参比制剂的溶出曲线不相似。
[0046]
实施例1:以“篮法”测定格列齐特缓释片的溶出曲线
[0047]
1.1、专属性试验
[0048]
试验分组:
[0049]
空白溶剂:以乙腈
‑
水(体积比为45:55)为空白溶剂,摇匀,滤过,即得。
[0050]
空白辅料:按格列齐特缓释片处方比例制备不含格列齐特的空白辅料,称取相当于1片重量的空白辅料,置100ml量瓶中,加乙腈45ml,超声溶解,用水稀释至刻度,摇匀,滤过,精密量取续滤液5ml,置25ml量瓶中,用乙腈
‑
水(体积比为45:55)稀释至刻度,摇匀,即得。
[0051]
对照品溶液:取格列齐特对照品适量,精密称定,加乙腈溶解,用水稀释成浓度约为0.3mg
·
ml
‑1溶液,作为对照品储备液;精密量取上述对照品储备液5ml,置25ml量瓶中,用乙腈
‑
水(体积比为45:55)稀释至刻度,摇匀,即得。
[0052]
供试品溶液:取格列齐特缓释片20片,研细,精密称定(相当于格列齐特30mg),置100ml量瓶中,加乙腈45ml,超声溶解,用水稀释至刻度,摇匀,滤过,精密量取续滤液5ml,置25ml容量瓶中,用乙腈
‑
水(体积比为45:55)稀释至刻度,摇匀,即得。
[0053]
实验方法:对上述四组样品进行高效液相色谱法检测,记录色谱图;
[0054]
液相色谱仪的参数为:unitary c8色谱柱,250mm
×
4.6mm,5μm;流动相:乙腈
‑
0.02mol
·
l
‑1乙酸铵溶液=45:55,用甲酸调ph至3.5;柱温:35℃;检测波长:235nm;流速:1.0ml
·
min
‑1;进样量:20μl。
[0055]
结果如图1所示,其中,a、b、c、d分别为空白溶剂组、空白辅料组、对照品溶液组、供试品溶液组的样品hplc检测结果,由格列齐特对照品(图1c)及供试品(图1d)出峰位置可知,空白溶剂、空白辅料对测定无干扰,本法专属性良好。
[0056]
1.2、“篮法”测定格列齐特缓释片的溶出曲线
[0057]
参考局颁标准ybh16022006中采用的篮法测定格列齐特缓释片的溶出曲线,其中,
[0058]
溶出介质:ph7.4磷酸盐缓冲液;
[0059]
介质体积:1000ml;
[0060]
转速:100转/分;
[0061]
介质温度:37℃
±
0.5℃;
[0062]
取样时间:0.5、1、2、4、6、8、10、12、16h。
[0063]
参比制剂:格列齐特缓释片(30mg,批号:2015917,施维雅(天津)制药有限公司);
[0064]
仿制制剂:3个不同处方的国产格列齐特仿制制剂(30mg),其中,仿制制剂a(批号:190203)、仿制制剂b(批号:31907059)、仿制制剂c(批号:190601);
[0065]
需要说明的是,图2~10中,a、b、c分别指代仿制制剂a、仿制制剂b、仿制制剂c。
[0066]
采用上述1.1的专属性试验中所述色谱条件对上述四组样品进行高效液相色谱法检测,记录色谱图,计算溶出度,考察各样品的溶出曲线,溶出曲线见图2;
[0067]
采用相似因子f2进行比较,评估三个仿制制剂与参比制剂的相似性,其中选择时间点1、2、4、8h、12h仿制制剂与参比制剂的平均溶出量数据,计算相似因子f2的值;相似性结果见表1。
[0068]
由图2可见,仿制制剂与参比制剂四条溶出曲线比较相似。
[0069]
表1篮法计算结果
[0070][0071]
由表1可见,可见三个仿制制剂与参比制剂的相似因子f2均大于或略小于50,仿制制剂与参比制剂的溶出度曲线较为相似。采用该方法进行格列齐特缓释片一致性评价,区分度较差,不能有效地评价出仿制制剂与参比制剂的差异。
[0072]
实施例2:以“流通池闭环系统”测定格列齐特缓释片的溶出曲线
[0073]
流通池法(ftc)分为闭环式和开环式2种,开环或闭环流通池采用商品化仪器,均由介质储存瓶、恒流活塞泵、温控流通池、滤器、取样系统和样品收集器组成。
[0074]
选择实施例1所述的参比制剂与三厂家仿制制剂(仿制制剂a、仿制制剂b、仿制制剂c)为样品,采用闭环流通池对格列齐特缓释片进行溶出,具体步骤如下:
[0075]
将样品置于流通池中特别设计的样品架上,溶出介质经过装有恒温装置的热交换器的水浴,通过恒流泵泵入流通池的下端,与样品接触后,经流通池上端的滤过系统过滤后回到介质存储瓶;滤膜孔径为2.7μm。
[0076]
所述流通池锥形部装满粒径为1mm的玻璃珠,使溶出介质在流通池内以层流方式流动,模拟胃肠道被食物填充后的情况,使样品均匀释放,避免形成突释;
[0077]
分别以经脱气处理的ph为4.5,6.0,6.8,7.4的磷酸盐缓冲液和ph为1.2的盐酸溶液作为溶出介质,溶出介质的体积为1000ml,流速为16ml
·
min
‑1,温度为37.0
±
0.5℃,分别
在1、2、4、6、8、10、12、16、20、24h取样1.5ml;
[0078]
利用高效液相色谱法测定溶出液中在上述不同时间点的格列齐特的溶出度,并绘制累积溶出量与时间的溶出曲线图,色谱条件同实施例1,结果如图3~7所示;
[0079]
由图3~7可见,流通池闭环系统下,参比制剂与仿制制剂在五种介质中的释放行为均存在一定的差异,其中与参比制剂差异最大的是仿制制剂a且在五种介质中差异均较为明显;仿制制剂b在ph1.2的盐酸溶液与参比制剂溶出曲线差异较大;而仿制制剂c在ph1.2的盐酸溶液、ph6.0和ph6.8的磷酸盐缓冲液中与参比制剂溶出曲线差异较大;三个仿制制剂在体外溶出与参比制剂存在差异,存在临床不等效的风险。这提示三个仿制制剂在生产处方、工艺方面应继续研究;以上结果还说明“流通池闭环系统”测定格列齐特缓释片的溶出曲线,实验条件可灵活变化,如溶出介质的组成、ph梯度变化等,且可以有效区分仿制制剂与参比制剂之间的差距。
[0080]
采用相似因子法,计算相似因子f2,用于比较格列齐特缓释片的仿制制剂溶出曲线与参比制剂溶出曲线的相似性,其中,选择时间点2、4、8、12、16、24h时仿制制剂与参比制剂的平均溶出量数据,计算相似因子f2的值;结果如表2~6所示。
[0081]
表2 ph1.2盐酸溶液中格列齐特缓释片释放度测定结果
[0082][0083][0084]
表3 ph4.5磷酸盐缓冲液中格列齐特缓释片释放度测定结果
[0085][0086]
表4 ph6.0磷酸盐缓冲液中格列齐特缓释片释放度测定结果
[0087][0088][0089]
表5 ph6.8磷酸盐缓冲液中格列齐特缓释片释放度测定结果
[0090][0091]
表6 ph7.4磷酸盐缓冲液中格列齐特缓释片释放度测定结果
[0092][0093][0094]
由上表2~6可见,三个仿制制剂与参比制剂的相似因子f2只有部分大于50,即仿制制剂与参比制剂的溶出度曲线部分相似。与实施例1所述篮法相比,采用本实施例的方法进行溶出试验,三个仿制制剂a、b、c与参比制剂的相似性均降低,即该方法区分力有所增
加。
[0095]
实施例3:以“流通池开环系统”测定格列齐特缓释片的溶出曲线
[0096]
选择实施例1所述的参比制剂与三厂家仿制制剂(仿制制剂a、仿制制剂b、仿制制剂c)为样品,采用开环流通池对格列齐特缓释片进行溶出,具体步骤如下:
[0097]
将样品置于流通池中特别设计的样品架上,溶出介质通过流通池,使大量新鲜的溶出介质不断地经过被测样品,让样品随时与新鲜溶出介质接触,主药成分逐渐溶出;
[0098]
所述流通池锥形部装满粒径为1mm的玻璃珠,使溶出介质在流通池内以层流方式流动,模拟胃肠道被食物填充后的情况,使样品均匀释放,避免形成突释;
[0099]
采用序贯性切换的五种不同ph的溶出介质进行试验,即不同时间点依次切换不同的溶出介质,溶出介质的切换顺序及在不同溶出介质中的时间具体为:ph1.2 hcl(2h)
‑
ph4.5 pbs(2h)
‑
ph6.0 pbs(2h)
‑
ph6.8 pbs(5h)
‑
ph7.4 pbs(1h),分别以4、8、16ml
·
min
‑1流速,温度为37.0
±
0.5℃,分别在1、2、4、6、8、10、11、12h取样24ml,利用高效液相色谱法测定溶出液中在上述不同时间点的格列齐特的溶出度,并绘制累积溶出量与时间的溶出曲线图,色谱条件同实施例1,结果如图8~10所示;
[0100]
由图8~10可见,在流通池开环系统下,流速的改变对参比制剂的溶出速率及累积溶出量具有一定的影响,随着流速的增大,参比制剂溶出速率逐渐加快,累积溶出量增加。三种不同的流速下,三家仿制制剂的释放曲线与参比制剂释放曲线均存在显著的差异;以上结果还说明“流通池开环系统”测定格列齐特缓释片的溶出曲线,实验条件可灵活变化,如溶出介质的组成、ph梯度变化、流速等,且可以有效区分仿制制剂与参比制剂之间的差距。
[0101]
采用相似因子法,计算相似因子f2,用于比较格列齐特缓释片的仿制制剂溶出曲线与参比制剂溶出曲线的相似性,其中,选择时间点2、4、6、11、12h时仿制制剂与参比制剂的平均溶出量数据,计算相似因子f2的值;结果如表7~9所示。
[0102]
表7 4ml
·
min
‑1的流速格列齐特缓释片释放度测定结果
[0103]
[0104]
表8 8ml
·
min
‑1的流速格列齐特缓释片释放度测定结果
[0105][0106][0107]
表9 16ml
·
min
‑1的流速格列齐特缓释片释放度测定结果
[0108][0109]
由表3可见,三个仿制制剂与参比制剂的相似因子f2均小于50,即仿制制剂与参比制剂的溶出度曲线部分均不相似;进行格列齐特缓释片一致性评价,区分度较好,能有效地评价出仿制制剂与参比制剂的差异。
[0110]
综上,本发明分别通过篮法、流通池闭环系统和开环系统三种不同的溶出方法考察格列齐特缓释片仿制制剂与参比制剂体外溶出行为的一致性,得出不一样的试验结果,新的流通池溶出方法表明仿制制剂与参比制剂体外溶出行为不相似,而传统方法则显示相似。由于新的溶出方法,特别是流通池开环溶出方法与体内行为更为相似,对药物制剂间的
细微的差异更有区分度。
[0111]
流通池溶出方法的建立为格列齐特仿制制剂的一致性评价提供基础依据;也为药物的生物等效性研究提供有力的数据支持,提高临床生物等效性试验的成功率。
[0112]
基于本发明流通池溶出方法(流通池闭环系统和开环系统)的测定机理,在取样时间、溶出介质进行适应性调整的情况下,还可应用于其他药物固体制剂溶出曲线的测定及其参比制剂与仿制制剂的相似性评价。
[0113]
以上仅是本发明的优选实施方式,本发明的保护范围并不仅局限于上述实施例,凡属于本发明思路下的技术方案均属于本发明的保护范围。应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理前提下的若干改进和润饰,应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。