id no:1)重复序列区,且融合蛋白靶向此扩增重复序列区。突变型等位基因可包含超过30个串联g4c2重复序列(例如,超过100、200、300、400、500、600、700、800、900或1000个重复序列)。野生型等位基因可包含不超过30个此类重复序列(例如,不超过25、20、15、10或5个重复序列)。
12.在一些实施方案中,融合蛋白抑制来自突变型等位基因的含重复序列的rna转录物(例如,mrna)转录,且不抑制来自基因的野生型rna转录物(例如,mrna)的转录。
13.在一些实施方案中,zfp域结合至目标区中的正义序列,其中该正义序列包含一至三个六核苷酸ggggcc(seq id no:1)、gggccg(seq id no:2)、ggccgg(seq id no:3)、gccggg(seq id no:4)、ccgggg(seq id no:5)或cggggc(seq id no:6)的串联重复序列。在某些实施方案中,融合蛋白抑制人类细胞中来自突变型等位基因的正义转录。在特定实施方案中,融合蛋白抑制来自c9orf721a启动子的正义转录,且不抑制来自c9orf721b启动子的正义转录。
14.在一些实施方案中,zfp域结合至目标区中的反义序列,其中该反义序列包含一至三个六核苷酸ggcccc(seq id no:7)、gccccg(seq id no:8)、ccccgg(seq id no:9)、cccggc(seq id no:10)、ccggcc(seq id no:11)或cggccc(seq id no:12)的串联重复序列。在某些实施方案中,融合蛋白抑制人类细胞中来自突变型等位基因的反义转录。
15.在一些实施方案中,融合蛋白抑制人类细胞中来自突变型c9orf72等位基因的正义转录及反义转录两者。在一些实施方案中,相比于野生型c9orf72等位基因,融合蛋白优先抑制突变型c9orf72等位基因。
16.在其他实施方案中,融合蛋白抑制来自突变型等位基因正义和/或反义转录至少约30%、40%、75%、90%或95%。
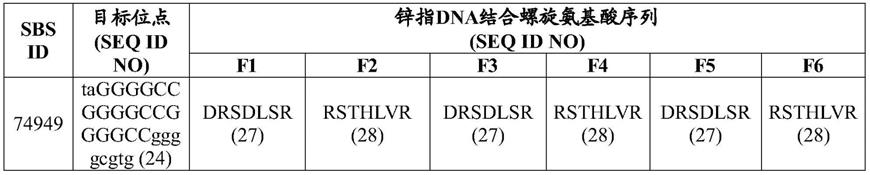
17.在一些实施方案中,融合蛋白具有一或多个zfp域,其各自任选地包含六个锌指;结合至表1中所示的目标序列;和/或包含六个锌指(排序为f1至f6),各锌指包含表1的单列中所示的dna结合(识别)螺旋序列,任选地包含对如表1中所指示的识别螺旋区外残基的一或多个突变。在其他实施方案中,融合蛋白结合至目标序列且包含对应于如表1中所示的sbs id的锌指,所述锌指包含表1的单列中所示的该sbs id的dna结合(识别)螺旋序列,其中该sbs id是78021、75114、75115、74969、79895、79898、74986、79899、79901、79902、79904、79916、75027或79921。
18.在一些实施方案中,融合蛋白具有一或多个转录抑制物域,其各自任选地包含来自人类kox1的krab域氨基酸序列,诸如下文进一步描述的。在特定实施方案中,zfp域经由肽接头连接至转录抑制物域。
19.在另一方面中,本公开提供包含本文所描述的融合蛋白中之一或多者的编码序列的核酸构建体,其中编码序列任选地可操作地连接至转录调控元件。在一些实施方案中,转录调控元件包含哺乳动物启动子,该启动子在脑细胞是组成型活性的或诱导型的,且其中启动子任选地为人类突触蛋白i启动子。在一些实施方案中,构建体为重组腺相关病毒(“aav”或“raav”)构建体。亦提供包含重组aav构建体及血清型1至10(例如,aav2、aav6或aav9)或源自其中的假型(例如,aav2/9、aav2/6或aav2/6/9)的壳体的raav。
20.在另一方面中,本公开提供包含如本文所描述的一种或多种融合蛋白和/或一种或多种核酸构建体的宿主细胞。宿主细胞可为例如人类细胞,诸如神经元或多能干细胞(例
如,胚胎干细胞或诱导性多能干细胞)。
21.亦提供药物组合物,其包含如本文所描述的一种或多种融合蛋白、一种或多种核酸构建体(例如,aav构建体)、包含核酸构建体的重组病毒(例如,raav)和/或一种或多种宿主细胞,通常与一种或多种药学上可接受的赋形剂组合。
22.在又一方面中,本公开提供抑制人类细胞(例如,神经元、神经胶细胞、室管膜细胞或神经上皮细胞)中突变型c9orf72等位基因的转录的方法,其中突变型等位基因在内含子1a中包含扩增g4c2重复序列区,该方法包含向细胞中引入如本文所描述的一种或多种融合蛋白、一种或多种核酸构建体(例如,aav)、一种或多种重组病毒、一种或多种宿主细胞和/或一种或多种药物组合物。在一些实施方案中,细胞在患有c9orf72相关病症(诸如als或c9ftd)的患者的脑或脊髓中。
23.在一个相关方面中,本公开提供治疗患有任选地选自肌萎缩侧索硬化(als)及c9家族性额颞叶痴呆(c9ftd)的c9orf72相关病症的患者的方法,该方法包含向患者引入如本文所描述的一种或多种融合蛋白、一种或多种核酸构建体(例如,aav)、一种或多种宿主细胞和/或一种或多种药物组合物。
24.在本发明治疗方法中,融合蛋白可使用表达融合蛋白的重组病毒(例如,aav载体)引入。在一些实施方案中,重组病毒经由脑室内、鞘内、颅内、眶后(ro)、静脉内、鼻内和/或脑池内途径向患者施用。在一些实施方案中,引入本发明的两种或更多种不同融合蛋白,其中两种或更多种融合蛋白的编码序列可携载在相同或不同重组病毒载体上。
25.本公开亦提供用于本文所描述的治疗方法的一种或多种融合蛋白和/或一种或多种核酸构建体、一种或多种重组病毒及一种或多种药物组合物,及融合蛋白、核酸构建体及重组病毒用于制造用于本文所描述的治疗方法的药物的用途。
26.本发明的其他特征、目标及优势在以下实施方式中显而易见。然而,应理解,实施方式虽然指示本发明的实施方案及方面,但仍仅以说明而非限制的方式给出。对于本领域技术人员而言,在本发明的范畴内的各种改变及修改将自实施方式而变得显而易见。
27.附图简述
28.图1a至图1c描绘c9orf72基因及所产生的转录物的示意图。
29.图1a显示野生型c9orf72等位基因及扩增突变型c9orf72等位基因两者的结构。扩增突变型等位基因上g4c2扩增的位置经指示(在外显子1a与1b之间的基因组区,亦即内含子1a中)。外显子显示为方框。改编自douglas,前述;亦参见rizzu等人(2016)acta neuropathologica communications 4:37。
30.图1b为突变型扩增c9orf72等位基因上靠近g4c2扩增的区的放大视图,且描绘与扩增等位基因相关的启动子及转录物。显示正义链转录中所涉及的启动子(实心箭头)及反义转录中所涉及的启动子的大致位置(空心箭头)。亦显示先前已描述的5种不同正义转录物,及大致位置及反义方向上的转录物。同上。
31.图1c显示由靶向扩增区的zfp
‑
tf抑制1a启动子及反义启动子的模型,其中zfp
‑
tf在两种启动子下游且对于启动子调控而言最佳的位置中结合。此模型中的1b启动子未受抑制,因为zfp
‑
tf的结合在1b启动子上游。
32.图2a至图2d显示使用指定zfp
‑
tf对指定细胞类型中c9orf72表达(“总c9”)的抑制。另外,图式显示对包含内含子1a的较长mrna同等型(扩增)的表达的抑制,该同等型主要
由扩增突变型等位基因(“含重复序列的同等型特异性”)产生。扩增同等型主要在c9患者系中表达。
33.图2a示出用于总c9分析及含正义及反义重复序列的同等型特异性分析的pcr分析。图顶部描绘野生型及扩增等位基因的基因组结构,而图底部显示由各等位基因制得的mrna产物。mrna绘图上的箭头组描绘总c9分析中所使用的pcr目标。
34.图2b至图2d为显示来源于健康受试者的野生型细胞系及als患者来源的纤维母细胞细胞系“c9”中不同例示性zfp
‑
tf的c9orf72表达分析结果的图。c9细胞系表征为“5/850”,其指g4c2重复序列在野生型等位基因上的数目(5)及在扩增等位基因上的数目(850)。最左侧的图:第3轮筛选(“第3轮”)中野生型细胞中的总c9orf72表达(“总c9”)。自左数第二张图:第3轮中c9细胞中的总c9。自右数第二张图:第2轮筛选(“第2轮”)中c9细胞中的总c9。最右侧的图:如藉由同等型特异性c9orf72分析所测定,自扩增c9orf72等位基因的表达。在c9细胞中进行第2轮筛选,以评估zfp
‑
tf处理后,相对于总c9转录物水平的同等型(或疾病)特异性c9orf72转录物水平。在第3轮中,在c9细胞及野生型细胞中测定总c9,以便评估zfp
‑
tf对c9细胞的野生型(wt)等位基因的效应。对于各zfp
‑
tf,自左至右显示1、3、10、30、100及300ng mrna浓度。图2b在顶部图中显示zfp
‑
tf74949、74951、74954、74955及74964的结果,且在底部图中显示74969、74971、74973、74978及74979的结果。图2b按出现的次序分别揭示seq id no:1、1及3。图2c在顶部图中显示zfp
‑
tf 74983、74984、74986、74987及74988的结果,且在底部图中显示74997、74998、75001及75003的结果。图2c按出现的次序分别揭示seq id no:4及5。图2d在顶部图中显示zfp
‑
tf 75023、75027、75031、75032、75055及75078的结果,且在底部图中显示75090、75105、75109、75114及75115的结果。图2d按出现的次序分别揭示seq id no:8
‑
11。图底部的序列表示该zfp
‑
tf的dna结合基序。各zfp
‑
tf结合至含有该基序的三个六核苷酸重复序列。转录物水平相对于由经zfp
‑
tf mrna转染的gfp mrna表达的绿色荧光蛋白(gfp)的水平标准化。图中的水平点线显示50%或70%抑制,如所指示。例如对于zfp
‑
tf 75115,在c9系中存在对总同等型转录物的大致50%抑制,及对含重复序列的同等型特异性转录物的约70%抑制,而wt系中对总同等型的抑制极小。图指示30%的转录物继续存在,其指示70%受抑制。
35.图3显示c9orf72扩增等位基因中正义及反义转录物的启动子区的图解。指示用于特异性检测正义、总及反义转录物的引物对。as:反义。ddpcr:液滴式数字pcr。图按出现的次序分别揭示seq id no:1、1及7。
36.图4a及图4b显示靶向内含子1b的引物特异性检测反义前驱mrna(pre
‑
mrna)。使用链特异性pcr以由健康对照(con)或c9细胞(c9)产生正义(s)或反义(as)cdna模板。举例而言,c9
‑
as指示在由自c9细胞分离的rna产生的反义cdna模板情况下获得的ddpcr结果。图4a显示仅cdna模板c9
‑
as产生pcr产物,表明引物对检测反义前驱mrna的特异性。图4b将图4a中的实验延伸至具有不同g4c2重复序列长度的7种不同c9orf72患者来源的细胞系及6种不同健康对照系。
37.图5a至图5c为显示使用含重复序列的同等型特异性分析得到的对c9细胞中转录物的抑制的图。图5a显示三个实验,其中zfp
‑
tf 74949、74978、75003、75027、75109、75114、75115、74960及74967以三种不同剂量(30、100或300ng)给出,且随后测量疾病正义转录物的量。图5b显示测量疾病反义转录物的三个实验。图5c显示测量总c9orf72转录物的三次运
作。
38.图6显示获自各自在其扩增等位基因上含有不同g4c2重复序列数目(分别约600、800及850个重复序列)的不同als患者的三种不同纤维母细胞系中,对总c9转录物以及扩增正义及反义转录物(疾病同等型)的抑制。在使细胞暴露于100ng zfp
‑
tf75109、75114及75115后,使用同等型选择性分析以评估抑制量。所有三种zfp
‑
tf在所有三种细胞系中维持选择性抑制。
39.图7显示在来自在等位基因上具有大于典型g4c2重复序列数目的健康受试者的两种细胞系中对总c9转录物的抑制。健康受试者在其c9orf72等位基因中的每一者上通常具有2至5个g4c2重复序列。然而,一些健康受试者含有更多重复序列。为确保提供足够的zfp
‑
tf结合位点,使用含有超过典型重复序列数目(5/8及5/20重复序列)的细胞系。在这些细胞系中,总c9转录物受极小影响。
40.图8a至图8c显示als患者来源的原代纤维母细胞(c921,亦称作c9021)、小鼠原代神经元及人类原代神经元中微阵列分析的结果,显示指定抑制物(75027、75109、75114及75115)的特异性。zfp
‑
tf 75027靶向重复gccccg(seq id no:8)基序,而zfp
‑
tf 75109、75114及75115靶向c9orf72基因的反义链中的ccggcc(seq id no:11)基序。
41.图8a显示患者来源的原代纤维母细胞(c9021)中使用thermo fisher clariom
tm
s分析的微阵列分析的结果,thermo fisher clariom
tm
s分析在其数据库中含有21,000个良好标注的基因。在向c9021细胞施用300ng下呈mrna形式的抑制物后24小时进行分析。图示出响应于指定zfp
‑
tf上调或下调的基因。
42.图8b显示小鼠原代神经元中使用thermo fisher clariom
tm
d分析的微阵列分析的结果,thermo fisher clariom
tm
d分析在其数据库中含有140,000个标注及未标注的编码及非编码转录物。aav转导后7天进行分析。所有细胞在3,000的moi下转导。图示出响应于指定zfp
‑
tf上调或下调的基因。
43.图8c显示人类原代神经元中使用thermo fisher clariom
tm
d分析的微阵列分析的结果。在3,000的moi下aav转导细胞后19天进行分析。图示出响应于指定zfp
‑
tf上调或下调的基因。
44.图9显示c9orf72 bac基因转基因小鼠中zfp的体内目标接合。a图显示用于注射的aav构建体。构建体含有突触蛋白启动子、zfp
‑
krab编码序列及venus标签。b图及c图显示研究设计,根据该设计新生小鼠用含有zfp
‑
krab表达构建体的aav脑室内(icv)注射,且注射后一个月解剖以供下游分析。d图显示经zfp
‑
krab(75027)注射的动物中海马及皮质中正义、反义及总c9rna的量。e图显示经zfp
‑
krab(75027)注射的动物中正义及反义rna聚集点的代表性影像及来自阿蒙氏角(cornu ammonis;ca)及齿状回(dentategyrus;dg)区的定量。
45.发明详述
46.本公开提供基于锌指蛋白的转录因子(zfp
‑
tf),其优先靶向具有扩增g4c2重复序列区的人类c9orf72基因等位基因且抑制这些突变型等位基因转录成rna。此种扩增区可具有超过30个g4c2重复序列。本发明zfp
‑
tf为融合蛋白,其含有(i)至少一个特异性结合至突变型等位基因的正义链或反义链上重复序列内dna基序的锌指蛋白(zfp)域,及(ii)至少一个减少等位基因在正义及反义方向中d任一者或两者上转录的转录抑制物域。预期藉由将
zfp
‑
tf引入至神经系统(例如,脑及脊髓)中减少神经元中突变型c9orf72转录物水平,抑制(例如,减少或停止)细胞内致病的细胞毒性物质的形成。本发明zfp
‑
tf可用于治疗(包括预防及缓解)c9orf72相关病症,诸如als及c9ftd。
47.本文揭示用于诊断、预防和/或治疗als及ftd的方法及组合物。特定而言,本文提供用于修饰特定基因(例如,调节其表达)以便治疗这些疾病的方法及组合物,包括经工程改造转录因子抑制物及核酸酶的用途。在一些实施方案中,调节表达包含调节正义表达和/或反义表达两者。
48.因此,本文描述抑制细胞(例如,神经元)中c9orf72基因的重复序列扩增突变型等位基因的正义和/或反义转录的方法(体内、离体和/或体外)。方法包含用突变型c9orf72基因等位基因的一种或多种抑制物处理细胞,该一种或多种抑制物包含转录抑制物域及结合至突变型c9orf72基因等位基因中的目标位点的dna结合域。(多种)抑制物可包含一种或多种锌指蛋白转录因子(包含zfp dna结合域的zfp
‑
tf)、一种或多种tal效应域转录因子(包含tal效应域dna结合域的tale
‑
tf)和/或一种或多种crispr/cas转录因子系统(包含单引导rna dna结合域)。在某些实施方案中,使用两种或更多种不同抑制物(例如,包含该两种或更多种不同抑制物的一种或多种药物组合物)。在某些实施方案中,c9orf72基因包含包括一或多个(g4c2)重复序列的突变型等位基因,任选地其中抑制物的dna结合域所结合的目标位点在该一或多个(g4c2)重复序列内。因此,本发明提供一种或多种结合至包含一或多个(g4c2)重复序列的突变型c9orf72扩增等位基因的zfp
‑
tf、tale
‑
tf或crispr/castf抑制物(例如,配制成包含该一种或多种抑制物的一种或多种药物组合物)的用途,其用于有需要的受试者(例如,患有als和/或ftd的受试者,其中疾病经治疗和/或症状得到改善)的正义和/或反义转录的抑制物(例如,相比于未经处理细胞/受试者,抑制50%、70%或更高)。在某些实施方案中,正义和/或反义转录未抑制至正常(对照)水平的超过90%。在某些实施方案中,反义及正义转录两者以相同或不同水平抑制(例如,反义及正义转录类似地受抑制);反义转录相比于正义转录受到更大抑制,或正义转录相比于反义转录受到更大抑制。在某些实施方案中,特定正义转录物受抑制,而其他未受抑制。在一些实施方案中,自1b内含子区段中的启动子转录未受抑制,而自1a内含子中的启动子转录及反义转录物受抑制。在某些实施方案中,包含扩增重复序列的转录物受选择性抑制(例如,反义转录受抑制,自1a启动子正义转录受抑制和/或自1b启动子正义转录未受抑制)。在某些实施方案中,在本文所描述的方法及用途中使用一种或多种包含如表1中所示的识别螺旋区的zfp
‑
tf抑制物,任选地与一种或多种不同抑制物(例如,另外不同zfp
‑
tf,例如一种或多种包含如表1中所示的zfp的另外zfp
‑
tf)组合。在某些实施方案中,使用一种或多种非病毒载体(例如,呈mrna形式)和/或病毒载体(例如,aav,诸如aav2/9)向细胞施用一种或多种抑制物。一种或多种调节物(例如,抑制物)的多个拷贝可使用相同或不同模式(例如,mrna和/或aav)施用。在某些实施方案中,可使用相同或不同模式来递送一种或多种不同调节物(例如,抑制物)。活受试者(例如,人类)中的体内方法及用途可涉及藉由任何适合手段,包括但不限于脑室内、鞘内、颅内、眶后(ro)、静脉内、鼻内和/或脑池内静脉内施用(例如,一种或多种包含抑制物和/或编码抑制物的多核苷酸的药物组合物)。脑施用可为单侧或双侧的(例如,施用至海马)。可施用任何量(剂量),例如1e10至1e13(例如,6e11)vg/半球。在本文所描述的方法及用途中之任一者中,受试者的als和/或ftd经治疗(和/或这些疾病的一种或多种症状经治
疗)。
49.本文提供c9orf72基因的遗传调节物,该调节物包含结合至c9orf72基因中至少12个核苷酸的目标位点的dna结合域(例如,锌指蛋白(zfp)、tal效应域蛋白(tale)或单引导rna);及转录调控物域(例如,抑制域)。亦提供编码本文所描述的遗传调节物中的一或多者的一种或多种多核苷酸(例如,病毒或非病毒基因递送媒剂,例如aav载体)。在其他方面中,本文描述包含如本文所提供的一种或多种多核苷酸和/或一种或多种基因递送媒剂的药物组合物。在一些实施方案中,遗传调节物包含调控物域,遗传调节物(及包含一种或多种遗传调节物或编码一种或多种遗传调节物的多核苷酸的药物组合物)调节(例如,抑制或活化)c9orf72基因表达。基因的正义和/或反义链可经结合和/或调节。本文亦提供经分离细胞(包括细胞群),其包含如本文所描述的一种或多种遗传调节物;一种或多种多核苷酸;一种或多种基因递送媒剂;和/或一种或多种药物组合物。亦提供用于在细胞中调节表达(例如,抑制)c9orf72基因的方法及用途(体外、体内或离体),所述方法包含向细胞施用(经由任何方法,包括但不限于脑室内、鞘内、颅内、眶后(ro)、静脉内或脑池内)如本文所描述的一种或多种遗传调节物;一种或多种多核苷酸;一种或多种基因递送媒剂;和/或一种或多种药物组合物。方法可用于治疗和/或预防受试者的肌萎缩侧索硬化(als)或额颞叶痴呆(ftd)。亦提供一种或多种遗传调节物;一种或多种多核苷酸;一种或多种基因递送媒剂;和/或一种或多种药物组合物的用途,其用于治疗和/或预防受试者的als或ftd。亦提供试剂盒,其包含如本文所描述的一种或多种遗传调节物;一种或多种多核苷酸;一种或多种基因递送媒剂;和/或一种或多种药物组合物,及任选地使用说明书。
50.因此,在一个方面中,提供一种或多种基因的经工程改造(非天然存在的)遗传调节物(例如,抑制物)。这些遗传调节物可包含调节(例如,抑制)等位基因表达的系统(例如,锌指蛋白、tal效应(tale)蛋白或crispr/dcas
‑
tf)。野生型和/或突变型等位基因的表达可在一起或分开地调节。在某些实施方案中,相比于野生型等位基因,突变型等位基因的调节水平更大(例如,相比于未经处理对照,对野生型等位基因的抑制不超过正常的50%,但突变型等位基因被抑制至少70%)。在一些实施方案中,调节表达可包含调节c9orf72基因的正义及反义转录物两者。在一些实施方案中,调节表达可主要调节正义转录物,而在其他实施方案中,调节表达可主要调节反义转录物。
51.c9orf72等位基因中的扩增突变导致与als及ftd相关的正义及反义rna产物两者的表达,因此,在一个实施方案中,提供经设计以抑制这些突变型c9orf72等位基因表达的经工程改造转录因子,以便治疗als或ftd。经工程改造锌指蛋白或tale为非天然存在的锌指或tale蛋白,其dna结合域(例如,识别螺旋或rvd)已经改变(例如,藉由选择和/或合理设计)以结合至预先选择的目标位点。本文所描述的锌指蛋白中的任一者可包括1、2、3、4、5、6个或更多个锌指,各锌指具有结合至所选(多种)序列(例如,(多种)基因)中的目标子位点的识别螺旋。在某些实施方案中,zfp
‑
tf包含具有如表1的单列中所示的识别螺旋区的zfp。类似地,本文所描述的tale蛋白中的任一者可包括任何数目的talervd。在一些实施方案中,至少一个rvd具有非特异性dna结合。在一些实施方案中,至少一个识别螺旋(或rvd)为非天然存在的。在某些实施方案中,tale
‑
tf包含结合至如表1中所示的目标位点的至少12个碱基对的tale。crispr/cas
‑
tf包括结合至目标序列的单引导rna。在某些实施方案中,经工程改造转录因子结合至(例如,经由zfp、tale或sgrna dna结合域)疾病相关基因中至少9
个至12个碱基对的目标位点,例如包含至少9个至20个碱基对(例如,9、10、11、12、13、14、15、16、17、18、19、20个或更多)的目标位点,包括这些目标位点(例如,如表1中所示的目标位点)内的连续或非连续序列。在某些实施方案中,遗传调节物包含如本文所描述的dna结合分子(zfp、tale、单引导rna),其可操作地连接至转录抑制物域(以形成遗传抑制物)。
52.因此,如本文所描述的锌指蛋白(zfp)、crispr/cas系统的cas蛋白或tale蛋白可置放成与调控物域(或功能域)操作性键联,作为融合分子的一部分。功能域可为例如转录活化域、转录抑制物域和/或核酸酶(裂解)域。藉由选择活化域或抑制域用于与dna结合分子一起使用,此类分子可用于活化或抑制基因表达。在某些实施方案中,功能域或调控物域可在组蛋白翻译后修饰中起作用。在一些情况下,域为组蛋白乙酰基转移酶(hat)、组蛋白去乙酰基酶(hdac)、组蛋白甲基化酶或使组蛋白类泛素化(sumolyate)或生物素化的酶,或允许翻译后组蛋白修饰调控基因抑制的其他酶域(kousarides,(2007)cell 128:693
‑
705)。在一些实施方案中,提供包含融合至可用于下调基因表达的转录抑制物域的靶向如本文所描述的基因(例如,c9orf72)的zfp、dcas或tale的分子。在一些实施方案中,本发明的方法及组合物适用于处理真核生物。在某些实施方案中,调控物域的活性受外源小分子或配体调控,使得在不存在外源配体的情况下将不发生与细胞的转录机构的相互作用。此类外部配体控制zfp
‑
tf、crispr/cas
‑
tf或tale
‑
tf与转录机构的相互作用的程度。(多种)调控物域可以操作方式连接至zfp、dcas或tale中的一或多者的任何(多种)部分,包括在一种或多种zfp、dcas或tale之间,在一种或多种zfp、dcas或tale外部及其任何组合。在优选实施方案中,调控物域引起对靶向基因(例如,c9orf72)的基因表达的抑制。本文所描述的融合蛋白中的任一者可配制成药物组合物。
53.在一些实施方案中,人工调控物结合至基因的转录起始位点(tss)上游(例如,5'端)的启动子区。在一些实施方案中,人工调控物结合至tss下游区。在优选实施方案中,人工调控物优先结合至c9orf72基因中的扩增重复序列区。在一些实施方案中,人工调控物与c9orf72基因结合抑制1a内含子中启动子的表达。在一些实施方案中,人工调控物与c9orf72基因结合抑制1b内含子中启动子的表达。在一些实施方案中,人工调控物的结合抑制自1a启动子及反义启动子表达,但不抑制1b启动子。亦参见图1b及图1c。
54.在一些实施方案中,本发明的方法及组合物包括两种或更多种如本文所描述的融合分子,例如两种或更多种c9orf72调节物(人工转录因子)的用途。两种或更多种融合分子可结合至不同目标位点且包含相同或不同功能域。替代地,两种或更多种如本文所描述的融合分子可结合至相同目标位点,但包括不同功能域。在一些情况下,使用三种或更多种融合分子;在其他情况下,使用四种或更多种融合分子;而在其他情况下,使用5种或更多种融合分子。在一些实施方案中,两种或更多种、三种或更多种、四种或更多种或五种或更多种融合分子(或其组分)以核酸形式向细胞递送。在优选实施方案中,融合分子引起对靶向基因的表达的抑制。在一些实施方案中,两种融合分子以各分子就其自身而言具有活性,但在组合中抑制活性累加的剂量下给出。在一些实施方案中,两种融合分子以就其自身而言两者均不具有活性,但在组合中抑制活性具有协同性的剂量下给出。
55.在又一方面中,提供编码本文所描述的dna结合域中的任一者的多核苷酸。
56.在一些实施方案中,编码dna结合蛋白的多核苷酸为mrna。在一些方面中,mrna可经化学修饰(例如,kormann等人,(2011)nature biotechnology 29(2):154
‑
7)。在其他方
面中,mrna可包含arca帽(参见美国专利第7,074,596号及第8,153,773号)。在其他实施方案中,mrna可包含未经修饰核苷酸及经修饰核苷酸的混合物(参见美国专利公开案第2012/0195936号)。
57.在又一方面中,提供包含如本文所描述的多核苷酸(例如,抑制物)中的任一者的基因递送载体。在某些实施方案中,载体为腺病毒载体(例如,ad5/f35载体);慢病毒载体(lv),包括有整合能力的或整合缺陷型慢病毒载体;或腺病毒相关病毒载体(aav)。在某些实施方案中,aav载体为aav2、aav6、aav8或aav9载体,或假型aav载体,诸如aav2/8、aav2/5、aav2/9及aav2/6。在一些实施方案中,aav载体为能够穿过血脑障壁的aav载体(例如美国专利公开案第2015/0079038号)。在其他实施方案中,aav为自身互补aav(sc
‑
aav)或单链(ss
‑
aav)分子。本文亦提供腺病毒(ad)载体、lv或腺病毒相关病毒载体(aav),其包含编码至少一种核酸酶(zfn或talen)的序列和/或用于靶向整合至目标基因中的供体序列。在某些实施方案中,ad载体为嵌合ad载体,例如ad5/f35载体。在某些实施方案中,慢病毒载体为整合酶缺陷型慢病毒载体(idlv)或有整合能力的慢病毒载体。在某些实施方案中,载体经vsv
‑
g包膜或其他包膜假型化。
58.另外,亦提供药物组合物,其包含核酸和/或融合体,诸如人工转录因子(例如,zfp、cas或tale或包含zfp、cas或tale的融合分子)。举例而言,某些组合物包括包含可操作地连接至调控序列的编码本文所描述的zfp、cas或tale中之一者的序列的核酸与药学上可接受的载剂或稀释剂的组合,其中调控序列使得核酸可在细胞中表达。在某些实施方案中,所编码的zfp、cas、crispr/cas或tale调节野生型和/或突变型等位基因。在一些实施方案中,突变型等位基因比野生型等位基因更优先经调节,例如抑制。在一些实施方案中,药物组合物包含优先调节突变型等位基因的zfp、crispr/cas或tale,及调节神经营养因子的zfp、crispr/cas或tale。基于蛋白质的组合物包括一种或多种如本文所揭示的zfp、crispr/cas或tale及药学上可接受的载剂或稀释剂。
59.在又一方面中,亦提供包含如本文所描述的蛋白质、融合分子、多核苷酸和/或组合物中之任一者的经分离细胞。经分离细胞可用于非治疗用途(诸如提供用于诊断和/或筛选方法的细胞或动物模型),和/或用于治疗用途(诸如离体细胞疗法)。
60.在又一方面中,亦提供包含如本文所描述的一种或多种遗传调节物、一种或多种多核苷酸(例如,基因递送媒剂)和/或一种或多种(例如,一群)经分离细胞的药物组合物。在某些实施方案中,药物组合物包含两种或更多种遗传调节物。举例而言,某些组合物包括核酸,该核酸包含编码如本文所描述的罕见疾病相关的基因中之一者(例如,c9orf72)的一种或多种遗传调节物的序列。在某些实施方案中,(多种)遗传调节物(例如,包含本文所描述的zfp、cas或tale)可操作地连接至调控序列,与药学上可接受的载剂或稀释剂组合,其中调控序列使得核酸可在细胞中表达。在某些实施方案中,所编码的zfp、crispr/cas或tale对突变型或野生型等位基因(例如,c9orf72)具有特异性。在一些实施方案中,药物组合物包含调节突变型和/或野生型等位基因(例如,c9orf72)的zfp
‑
tf、crispr/cas
‑
tf或tale
‑
tf,包括相比于野生型等位基因,可优先调节(例如,以更大水平抑制)突变型等位基因的tf。基于蛋白质的组合物包括一种或多种如本文所揭示的遗传调节物及药学上可接受的载剂或稀释剂。在某些实施方案中,使用包含两种或更多种遗传调节物(载于相同或不同类型的载体上,例如aav载体上)的组合物,任选地其中遗传调节物中之一者包含zfp
‑
tf抑
制物,该抑制物包含命名为74949、74978、75027或75109的zfp。
61.本发明亦提供用于抑制有需要的受试者(例如,患有如本文所描述的罕见疾病的受试者)的基因表达的方法及用途,包括藉由向受试者提供如本文所描述的一种或多种多核苷酸、一种或多种基因递送媒剂和/或药物组合物。在某些实施方案中,本文所描述的组合物用于抑制受试者的突变型c9orf72表达,包括用于治疗和/或预防als或ftd。本文所描述的组合物在持续时间段(4周、3个月、6个月至一年或更长)内抑制脑(包括但不限于额叶皮质,包括但不限于前额叶皮质;顶叶皮质;枕叶皮质;颞叶皮质,包括但不限于内嗅皮质;海马;脑干;纹状体;丘脑;中脑;小脑)及脊髓(包括但不限于腰椎、胸椎及颈椎区)中基因表达。可藉由任何施用手段,包括但不限于脑室内、鞘内、颅内、静脉内、眼眶(眶后(ro))、鼻内和/或脑池内施用,将本文所描述的组合物提供至受试者。亦提供试剂盒,其包含如本文所描述的组合物(例如,遗传调节物、多核苷酸、药物组合物和/或细胞)中之一或多者以及这些组合物的使用说明书。
62.在另一方面中,本文提供用于治疗和/或预防cns(例如,als和/或ftd)的方法,其使用本文所描述的方法及组合物进行。在一些实施方案中,方法涉及多核苷酸和/或蛋白质可使用病毒载体、非病毒载体(例如,质粒)和/或其组合递送的组合物。在一些实施方案中,方法涉及包含有包含人工转录因子(例如,zfp
‑
tf、tale
‑
tf或dcas
‑
tf)的干细胞群的组合物。施用如本文所描述的组合物(蛋白质、多核苷酸、细胞和/或包含这些蛋白质、多核苷酸和/或细胞的药物组合物)引起治疗(临床)效果,包括但不限于改善或消除与als和/或ftd相关的任何临床症状,以及使cns细胞(例如,神经元、星状细胞、髓鞘等)功能提高和/或数目增加。在某些实施方案中,相比于未接受如本文所描述的人工抑制物的对照,本文中所描述的组合物及方法使目标基因(例如,c9orf72)的正义和/或反义转录物的表达降低至少30%或40%,例如至少50%、至少70%、至少80%、至少90%、至少95%或超过95%。在一些实施方案中,实现至少50%降低。在某些实施方案中,相比于野生型等位基因,人工抑制物优先将突变型等位基因(例如,扩增等位基因)抑制例如至少20%(例如,抑制野生型等位基因不超过50%且将突变型等位基因抑制至少70%)。在一些实施方案中,抑制物优先抑制突变型等位基因上的正义转录物,而在其他实施方案中,抑制物优先抑制突变型等位基因上的反义转录物。在一些实施方案中,抑制物抑制突变型等位基因上的正义及反义转录物。
63.在另一方面中,本文描述使用病毒或非病毒载体将基因抑制物递送至受试者的脑的方法。在某些实施方案中,病毒载体为aav9载体。递送可藉由任何适合手段,包括经由使用插管到达任何脑区,例如海马或内嗅皮质。提供遗传调节物(例如,抑制物)向受试者的脑的广泛递送,包括经由顺行及逆行轴突运输至未直接施用载体的脑区(例如,递送至壳核引起递送至其他结构,诸如皮质、黑质、丘脑等)进行递送的任何aav载体。在某些实施方案中,受试者为人类,且在其他实施方案中,受试者为非人类灵长类动物。施用可呈以下形式:单次剂量,或同时给与的一系列剂量,或多次施用(施用之间按任何时序)。
64.因此,在其他方面中,本文描述预防和/或治疗受试者的疾病(例如,als和/或ftd)的方法,该方法包含使用aav向受试者施用基因的抑制物。在某些实施方案中,抑制物施用至受试者的cns(例如,海马和/或内嗅皮质)或pns(例如,脊髓/脊髓液)。在其他实施方案中,抑制物经静脉内施用。在某些实施方案中,本文描述预防和/或治疗受试者的als或ftd的方法,该方法包含使用一种或多种aav载体向受试者施用c9orf72等位基因(野生型和/或
突变型)的抑制物。在某些实施方案中,编码遗传调节物的aav经由任何递送方法,包括但不限于脑室内、鞘内、颅内、静脉内、鼻内、眶后或脑池内递送施用至cns(脑和/或csf)。在其他实施方案中,编码抑制物的aav直接施用至受试者的脑实质(例如,海马和/或内嗅皮质)中。在其他实施方案中,编码抑制物的aav经静脉内(iv)施用。在本文所描述的任一方法中,可以每次施用相同或不同剂量进行一次施用(单次施用)或进行多次施用(施用之间间隔任何时间)。当施用多次时,可使用相同或不同剂量和/或施用模式的递送媒剂(例如,iv和/或icv施用的不同aav载体)。所述方法包括在als受试者中减少肌肉功能损失、身体协调损失、肌肉硬化、肌肉痉挛、语言功能损失、吞咽困难、认知障碍的方法,减少运动功能损失的方法和/或减少一种或多种认知功能损失的方法,其均系与未接受方法的受试者相比,或与接受方法前受试者自身相比。因此,本文所描述的方法引起诸如als或ftd的罕见疾病的生物标记物和/或症状减少,生物标记物和/或症状包括一种或多种以下:肌肉功能损失、身体协调损失、肌肉硬化、肌肉痉挛、语言功能损失、吞咽困难、认知障碍,与als相关的血液和/或脑脊髓液化学物质,包括g
‑
csf、il
‑
2、il
‑
15、il
‑
17、mcp
‑
1、mip
‑
1α、tnf
‑
α及vegf量的变化(参见chen等人,front immunol.(2018)9:2122)和/或本领域已知的其他生物标记物。在某些实施方案中,所述方法可进一步包含例如在患有ftd的受试者中施用一种或多种tau(mapt)的基因抑制物。参见例如美国专利公开案第2018/0153921号。
65.在本文所描述的任一方法中,靶向等位基因的抑制物可为zfp
‑
tf,例如包含特异性结合至等位基因的zfp及转录抑制物域(例如,kox、krab等)的融合蛋白。在其他实施方案中,靶向等位基因的抑制物可为tale
‑
tf,例如包含特异性结合至基因等位基因的tale多肽及转录抑制物域(例如,kox、krab等)的融合蛋白。在一些实施方案中,靶向等位基因抑制物为crispr/cas
‑
tf,其中cas蛋白中的核酸酶域已失活,使得蛋白质不再裂解dna。所得casrna引导dna结合域融合至转录抑制物(例如,kox、krab等)以抑制靶向等位基因。在一些实施方案中,经工程改造转录因子能够抑制突变型等位基因而非野生型等位基因的表达。在其他实施方案中,dna结合分子优先识别六聚ggggcc(seq id no:1)扩增。
66.在一些实施方案中,编码如本文所描述的基因抑制物(例如,zfp
‑
tf、tale
‑
tf或crispr/cas
‑
tf)的序列插入(整合)至基因组中,而在其他实施方案中,编码抑制物的序列维持游离。在一些情况下,编码tf融合体的核酸在包含启动子的安全港位点处插入(例如,经由核酸酶介导的整合),使得内源性启动子驱动表达。在其他实施方案中,抑制物(tf)供体序列插入(经由核酸酶介导的整合)至安全港位点中,且供体序列包含驱动抑制物表达的启动子。在一些实施方案中,启动子序列广泛地表达,而在其他实施方案中,启动子为组织或细胞/类型特异性的。在优选实施方案中,启动子序列对神经元细胞具有特异性。在其他实施方案中,启动子序列对肌肉细胞具有特异性。在一些实施方案中,所选择的启动子的特征为其具有低表达。适用启动子的非限制性实例包括神经特异性启动子nse、突触蛋白、camkiia及mecp。遍在(ubiquitous)启动子的非限制性实例包括cmv、cag及ubc。其他实施方案包括如美国专利公开案第2015/0267205号中所描述的自我调控型启动子的使用。其他实施方案包括如美国专利公开案第2015/0267205号中所描述的自我调控型启动子的使用。
67.在本文所描述的任一方法中,该方法可在受试者(例如,患有als的受试者)的一或多个神经元中产生对目标等位基因(例如,突变型或野生型c9orf72)约50%或更高、55%或更高、60%或更高、65%或更高、约70%或更高、约75%或更高、约85%或更高、约90%或更
高、约92%或更高或约95%或更高抑制、98%或更高或99%或更高抑制。在某些实施方案中,该受试者(相比于未经处理受试者)中野生型等位基因的表达被抑制不超过50%,而该受试者(相比于未经处理受试者)中突变型等位基因被抑制至少70%(70%或其上任何值)。在一些实施方案中,反义启动子的表达被抑制至少70%。在某些实施方案中,见于c9orf72内含子1a、1b和/或1c的区中的反义激活子表达被抑制至少70%,而c9orf72内含子1b的区中正义启动子表达被抑制不超过50%。
68.在本文所描述的任一方法中,调控物(例如,抑制物或活化子)可以蛋白质、多核苷酸或蛋白质与多核苷酸的任何组合形式向受试者递送。在某些实施方案中,一种或多种抑制物使用aav载体递送。在其他实施方案中,调控物的至少一种组分(例如,crispr/cas系统的sgrna)以rna形式递送。在其他实施方案中,(多种)调控物使用本文所描述的表达构建体中的任一者的组合递送,例如一种抑制物(或其部分)在一种表达构建体(aav9)上,且一种抑制物(或其部分)在独立表达构建体(aav或其他病毒或非病毒构建体)上。
69.此外,在本文所描述的任一方法中,调控物(例如,抑制物)可以提供所需效果的任何浓度(剂量)向细胞递送(离体或体内)。在一些实施方案中,调控物使用腺相关病毒(aav)载体以10,000至500,000个载体基因组/细胞(或其间任何值)递送。在某些实施方案中,调控物使用慢病毒载体以250与1,000之间(或其间任何值)的moi递送。在其他实施方案中,调控物使用质粒载体以0.01至1,000纳克/100,000个细胞(或其间任何值)递送。在其他实施方案中,抑制物以mrna形式以150至1,500纳克/100,000个细胞(或其间任何值)递送。此外,对于体内使用,在本文所描述的任一方法中,(多种)遗传调节物(例如,抑制物)可以在有需要的受试者中提供所需效果的任何浓度(剂量)递送。在一些实施方案中,抑制物使用腺相关病毒(aav)载体以10,000至500,000个载体基因组/细胞(或其间任何值)递送。在某些实施方案中,抑制物使用慢病毒载体以250与1,000之间(或其间任何值)的moi递送。在其他实施方案中,抑制物使用质粒载体以0.01至1,000纳克/100,000个细胞(或其间任何值)递送。在其他实施方案中,抑制物以mrna形式以0.01至3000纳克/细胞数目(例如,50,000至200,000(例如,100,000)个细胞)(或其间任何值)递送。在其他实施方案中,抑制物使用腺相关病毒(aav)载体在1e11
‑
1e14vg/ml下以1至300μl的固定体积向脑实质递送。在其他实施方案中,抑制物使用腺相关病毒(aav)载体在1e11
‑
1e14vg/ml下以0.5至10ml的固定体积向csf递送。
70.在本文所描述的任一方法中,该方法可产生对受试者的一种或多种细胞中(多种)靶向等位基因约50%或更高、55%或更高、60%或更高、65%或更高、约70%或更高、约75%或更高、约85%或更高、约90%或更高、约92%或更高或约95%或更高的调节(例如,抑制)。在一些实施方案中,野生型及突变型等位基因以不同方式经调节,例如相比于野生型等位基因,突变型等位基因优先经修饰(例如,突变型等位基因被抑制至少70%且野生型等位基因被抑制不超过50%)。
71.在本文所描述的任一方法中,该方法可产生对受试者的一种或多种细胞中(多种)靶向等位基因的反义表达约50%或更高、55%或更高、60%或更高、65%或更高、约70%或更高、约75%或更高、约85%或更高、约90%或更高、约92%或更高或约95%或更高的调节(例如,抑制)。在一些实施方案中,突变型等位基因中的正义表达及反义表达以不同方式经调节,例如在突变型等位基因中,相比于正义转录物的表达,反义转录物的表达优先经调节
(例如,反义表达被抑制至少70%且正义表达被抑制不超过50%)。
72.在其他方面中,如本文所描述的转录因子,诸如包含以下中之一或多者的转录因子:锌指蛋白(zfp
‑
tf)、tale(tale
‑
tf)及crispr/cas
‑
tf,例如zfp
‑
tf、tale
‑
tf或crispr/cas
‑
tf,用于抑制受试者的脑(例如,神经元)中突变型和/或野生型等位基因(例如,c9orf72)的表达。抑制可为相比于受试者的未经处理(野生型)细胞,对受试者的该一种或多种细胞中靶向等位基因约50%或更高、55%或更高、60%或更高、65%或更高、70%或更高、约75%或更高、约85%或更高、约90%或更高、约92%或更高或约95%或更高的抑制。在某些实施方案中,对野生型等位基因的抑制不超过50%(相比于未经处理细胞或受试者),且对突变型(病变或同等型变异体)的抑制为至少70%(相比于未经处理细胞或受试者)。在某些实施方案中,反义转录受完全(全)抑制。在某些实施方案中,对正义转录物的抑制不超过50%(相比于未经处理细胞或受试者),且对反义转录物的抑制为至少70%(相比于未经处理细胞或受试者)。在某些实施方案中,靶向调节转录因子可用于实现本文所描述的方法中之一或多者。
73.因此,本文描述用于调节与本文所揭示的罕见病症相关的基因表达,包括在表达或不表达外源序列(诸如人工tf)的情况下进行抑制的方法及组合物。组合物及方法可供体外使用(例如,以便提供用于研究目标基因(经由其调节)的细胞;用于药物发现;和/或制备基因转基因动物及动物模型)、体内使用或离体使用,且包含施用包括靶向至罕见疾病相关基因的dna结合分子的人工转录因子或核酸酶,任选地在核酸酶伴有由核酸酶裂解后整合至基因中的供体的情况下。在一些实施方案中,在细胞中,供体基因(转基因基因)维持在染色体外。在某些实施方案中,细胞在疾病患者体内。在其他实施方案中,细胞由本文所描述的任一方法修饰,且经修饰细胞向有需要的受试者(例如,患有罕见疾病的受试者)施用。亦提供包含经基因修饰的基因(例如,外源序列)的经基因修饰的细胞(例如,干细胞、前驱细胞、t细胞、肌肉细胞等),包括由本文所描述的方法制得的细胞。这些细胞可用于向患有罕见疾病的受试者提供(多种)治疗蛋白,例如藉由向有需要的受试者施用(多种)细胞,或替代地,藉由分离由细胞产生的蛋白质且向有需要的受试者施用该蛋白质(酶替代疗法)。
74.亦提供试剂盒,其包含以下中的一或多者:如本文所描述的遗传调节物(例如,抑制物)和/或包含目标调节物(或其组分)的组分的多核苷酸和/或编码目标调节物(或其组分)的多核苷酸。试剂盒可进一步包含细胞(例如,神经元或肌肉细胞)、试剂(例如,用于例如在csf中对蛋白质进行检测和/或定量)和/或包括如本文所描述的方法的使用说明书。
75.本发明方法及组合物在下文中进一步详细描述。
76.i.锌指蛋白转录因子
77.本发明zfp
‑
tf为含有dna结合锌指蛋白(zfp)域及转录抑制物域的融合蛋白,其中两个域可由直接肽基键联或肽接头彼此缔合,或藉由二聚合(例如,经由亮氨酸拉链、stat蛋白n端域或fk506结合蛋白)彼此缔合。如本文所用,“融合蛋白”指具有共价连接域的多肽,以及经由非共价键彼此缔合的多肽的复合物。转录抑制物域可在任何适合位置,包括zfp域的c端或n端处与zfp域缔合。
78.在一些实施方案中,本发明zfp
‑
tf将人类突变型c9orf72基因的转录抑制45%或更高(例如,50%、60%、70%、80%、90%或95%或更高)。在一些实施方案中,两种或更多种本发明zfp
‑
tf在患者体内同时使用,其中zfp
‑
tf结合至扩增c9orf72区的正义和/或反义链
中的不同dna基序,以便实现对突变型c9orf72转录的最佳抑制。
79.a.zfp域的目标
80.本发明融合蛋白的zfp域优先结合至突变型人类c9orf72基因等位基因中的扩增区。人类c9orf72基因位于染色体9的短(p)臂位置21.2(9p21.2)处。其在该染色体上跨越碱基对27,546,546至27,573,866。人类c9orf72的基因组结构在图1a中显示。zfp
‑
tf的dna结合zfp域将融合蛋白引导至突变型c9orf72基因的扩增重复序列区,且将融合蛋白的转录抑制物域带到目标区。抑制域随后抑制由rna聚合酶进行的c9orf72基因转录。
81.在一些实施方案中,扩增区中的目标序列的长度为至少8个bp。举例而言,目标序列的长度可为8个bp至40个bp,诸如长度为12、15、16、17、18、19、20、21、24、27、30、33或36个bp。在某些实施方案中,本发明zfp
‑
tf的目标序列的长度为12至20(例如,12至18、15至19、15、18或19)个bp。在一些实施方案中,目标序列包含不连续的子序列。
82.g4c2重复序列引起基因的正义链及反义链中的以下六核苷酸dna基序:
83.正义c9orf72链中的基序:
84.(i)ggggcc(seq id no:1)
85.(ii)gggccg(seq id no:2)
86.(iii)ggccgg(seq id no:3)
87.(iv)gccggg(seq id no:4)
88.(v)ccgggg(seq id no:5)
89.(vi)cggggc(seq id no:6)
90.反义c9orf72链中的基序:
91.(vii)ggcccc(seq id no:7)
92.(viii)gccccg(seq id no:8)
93.(ix)ccccgg(seq id no:9)
94.(x)cccggc(seq id no:10)
95.(xi)ccggcc(seq id no:11)
96.(xii)cggccc(seq id no:12)
97.在一些实施方案中,本发明zfp
‑
tf的目标序列包含这些dna基序之一或多个(例如,2、3或4个)串联重复序列。在一些实施方案中,目标序列由基序之一的三个串联重复序列组成。在一些实施方案中,目标序列包含基序的一或多个(例如,2或3个)串联重复序列,外加来自上游和/或下游相邻序列的数个(例如,1、2、3、4或5个)核苷酸(例如,cc(g4c2)2gg)(seq id no:75)。
98.目标序列可在基因的正义链或基因的反义链上。在某些实施方案中,患者中所使用的zfp
‑
tf结合突变型等位基因的正义链及反义链两者。为确保靶向准确性且为减少zfp
‑
tf的偏离目标结合,所选c9orf72目标区的序列优选与基因组中其他基因中的序列具有低于75%同源性(例如,低于70%、低于65%、低于60%或低于50%同源性)。
99.用于进一步评估目标区段的其他准则包括与此类区段或相关区段结合的zfp的先前可获得性、设计结合给定目标区段的新zfp的简易性及偏离目标结合风险。
100.b.锌指蛋白域
[0101]“锌指蛋白”或“zfp”指具有由锌稳定的dna结合域的蛋白质。zfp以序列特异性方
式结合至dna。个别dna结合域被称为“指”。zfp具有至少一个指,各指结合二至四个dna碱基对,通常三或四个dna碱基对。各锌指通常包含大致30个氨基酸且螯合锌。与天然存在的锌指蛋白相比,经工程改造zfp可具有新颖结合特异性。工程改造方法包括但不限于合理设计及各种类型的选择。合理设计包括例如使用包含三联体(或四联体)核苷酸序列及个别锌指氨基酸序列的数据库,其中各三联体或四联体核苷酸序列与结合特定三联体或四联体序列的锌指的一种或多种氨基酸序列相关。参见例如以下中详细描述的zfp设计方法:美国专利5,789,538;5,925,523;6,007,988;6,013,453;6,140,081;6,200,759;6,453,242;6,534,261;6,979,539;8,586,526;8,841,260;8,956,828;及9,234,016;及国际专利公开案wo95/19431;wo96/06166;wo98/53057;wo98/53058;wo98/53059;wo98/53060;wo98/54311;wo00/27878;wo01/60970;wo01/88197;wo02/016536;wo02/099084;及wo03/016496。
[0102]
本发明zfp
‑
tf的zfp域可包括至少三个(例如,四、五、六、七、八、九、十、十一、十二、十三个或更多个)锌指。具有三个指的zfp域通常识别包括9至12个核苷酸的目标位点。具有四个指的zfp域通常识别包括12至15个核苷酸的目标位点。具有五个指的zfp域通常识别包括15至18个核苷酸的目标位点。具有六个指的zfp域可识别包括18至21个核苷酸的目标位点。
[0103]
如例如美国专利公开案2018/0087072中所描述,可藉由对zfp主链的突变提高zfp域的目标特异性。突变包括对zfp主链中的残基进行的突变,所述残基可与dna主链上的磷酸酯非特异性相互作用,但不在核苷酸目标特异性中涉及。在一些实施方案中,这些突变包含将阳离子氨基酸残基突变为中性或阴离子氨基酸残基。在一些实施方案中,这些突变包含将极性氨基酸残基突变为中性或非极性氨基酸残基。在其他实施方案中,突变在相对于dna结合螺旋的位置(
‑
5)、(
‑
9)和/或(
‑
14)处进行。在一些实施方案中,锌指可在位置(
‑
5)、(
‑
9)和/或(
‑
14)处包含一或多个突变。在其他实施方案中,多指zfp域中的一或多个锌指可在位置(
‑
5)、(
‑
9)和/或(
‑
14)处包含突变。在一些实施方案中,位置(
‑
5)、(
‑
9)和/或(
‑
14)处的氨基酸(例如,精氨酸(r)或赖氨酸(k))突变为丙氨酸(a)、亮氨酸(l)、ser(s)、asp(n)、glu (e)、tyr(y)和/或谷氨酰胺(q)。在一些实施方案中,位置(
‑
5)处的r残基突变为q。
[0104]
替代地,dna结合域可来源于核酸酶。举例而言,诸如i
‑
scei、i
‑
ceui、pi
‑
pspi、pi
‑
sce、i
‑
sceiv、i
‑
csmi、i
‑
pani、i
‑
sceii、i
‑
ppoi、i
‑
sceiii、i
‑
crei、i
‑
tevi、i
‑
tevii及i
‑
teviii的归巢核酸内切酶及大范围核酸酶的识别序列为已知的。亦参见美国专利5,420,032及6,833,252;belfort等人,nucleic acids res.(1997)25:3379
‑
88;dujon等人,gene(1989)82:115
‑
8;perler等人,nucleic acids res.(1994)22:1125
‑
7;jasin,trends genet.(1996)12:224
‑
8;gimble等人,j mol biol.(1996)263:163
‑
80;argast等人,j mol biol.(1998)280:345
‑
53;及新英格兰生物实验室(new england biolabs)目录。
[0105]
在一些实施方案中,本发明zfp
‑
tf包含一或多个锌指域。所述域可经由可延伸柔性接头连接在一起,使得例如一个域包含一或多个(例如,4、5或6个)锌指,且另一域包含另外一或多个(例如,4、5或6个)锌指。在一些实施方案中,接头为标准指间接头,使得指数组包含一个包含8、9、10、11或12个或更多个指的dna结合域。在其他实施方案中,接头为非典型接头,诸如柔性接头。举例而言,两个zfp域可以以下构造(n端至c端)连接至转录抑制物tf:zfp
‑
zfp
‑
tf、tf
‑
zfp
‑
zfp、zfp
‑
tf
‑
zfp或zfp
‑
tf
‑
zfp
‑
tf(两个zfp
‑
tf融合蛋白经由接头融合在一起)。
[0106]
在一些实施方案中,zfp
‑
tf为“双手(two
‑
handed)”的,亦即,其含有由中间氨基酸间隔开的两个锌指簇(两个zfp域),使得两个zfp域结合至两个非连续目标位点。双手型锌指结合蛋白的实例为sip1,其中四个锌指的簇位于蛋白质氨基端处,且三个指的簇位于羧基端处(参见remacle等人,emboj.(1999)18(18):5073
‑
84)。这些蛋白质中的锌指的各簇能够结合至独特目标序列,且两个目标序列之间的间隔可包含许多核苷酸。
[0107]
在替代性实施方案中,可使用在功能上与zfp
‑
tf类似的蛋白质代替zfp
‑
tf。举例而言,转录抑制物融合蛋白可包括来源于转录活化因子的dna结合域,如效应子(tale)dna结合域,而非zfp域。参见例如美国专利8,586,526及9,458,205;美国专利公开案2013/0196373及2013/0253040;wo2010/079430;schornack等人,j plant physiol(2006)163(3):256
‑
72);kay等人,science(2007)318:648
‑
51;moscou及bogdanove,science(2009)326:1501;及boch等人,science(2009)326:1509
‑
12。在另一实例中,转录抑制物融合蛋白可包括dna结合域,其为crispr/cas系统的单引导rna。参见例如美国专利公开案2015/0056705;jinek等人,science(2012)337:816;ramalingam等人,genome biol.(2013)14:107;hwang等人,(2013)nature biotechnology 31(3):227。
[0108]
c.转录抑制物域
[0109]
本发明zfp
‑
tf包含减弱突变型c9orf72等位基因的转录活性的一种或多种转录抑制物域。转录抑制物域的非限制性实例为kox1的krab域、kap
‑
1、mad、fkhr、egr
‑
1、erd、sid、tgfβ诱导型早期基因(tieg)、v
‑
erb
‑
a、mbd2、mbd3、dnmt家族成员(例如,dnmt1、dnmt3a、dnmt3b)、rb及mecp2。参见例如bird等人,cell(1999)99:451
‑
54;tyler等人,cell(1999)99:443
‑
46;knoepfler等人,cell(1999)99:447
‑
50;robertson等人,nature genet.(2000)25:338
‑
42。另外例示性抑制域包括但不限于rom2及athd2a。参见例如chem等人,plant cell(1996)8:305
‑
21;及wu等人,plant j.(2000)22:19
‑
27。
[0110]
在一些实施方案中,转录抑制物域包含来自人类锌指蛋白10/kox1(znf10/kox1)(例如,genbank第nm_015394.4号)的克鲁佩尔相关框(kruppel
‑
associated box;krab)域的序列。例示性krab域序列为:
[0111]
daksltawsr tlvtfkdvfv dftreewkll dtaqqivyrn vmlenyknlv slgyqltkpd vilrlekgee pwlvereihq ethpdsetaf eikssv
[0112]
(seq id no:13)。
[0113]
亦可使用此krab序列的变异体,只要其具有相同或相似转录抑制功能即可。
[0114]
d.肽接头
[0115]
本发明zfp
‑
tf的zfp域及转录抑制物域和/或zfp域内的锌指可经由肽接头连接,肽接头例如约5至200个氨基酸(例如,5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20个或更多个氨基酸)的不可裂解肽接头。一些优选接头为合成为重组融合蛋白的柔性氨基酸序列。参见例如以上描述;及美国专利6,479,626;6,903,185;7,153,949;8,772,453;及9,163,245;及wo2011/139349。本文所描述的蛋白质可包括适合接头的任何组合。接头的非限制性实例为dgggs(seq id no:14)、tgekp(seq id no:15)、lrqkdgerp(seq id no:16)、ggrr(seq id no:17)、ggrrgggs(seq id no:18)、lrqrdgerp(seq id no:19)、lrqkdgggserp(seq id no:20)、lrqkd(g3s)2erp(seq id no:21)、tgsqkp(seq id no:22)、lrqkdaargs(seq id no:26)及lrqkdaargsgg(seq id no:76)。
[0116]
在一些实施方案中,肽接头的长度为3至20个氨基酸残基,且富含g和/或s。此类接头的非限制性实例为g4s型接头(“g4s”揭示为seq id no:23),亦即,含有一或多个(例如,2、3或4个)ggggs(seq id no:23)基序或基序的变化形式(诸如在基序中具有一个、两个或三个氨基酸插入、缺失及取代者)的接头。
[0117]
在一些实施方案中,zfp
‑
tf包含核定位信号(例如,来自sv40中等t抗原的核定位信号)和/或表位标签(例如,flag及血凝素)。
[0118]
ii.zfp
‑
tf的表达
[0119]
本公开的zfp
‑
tf可经由编码其的核酸分子引入患者中。举例而言,核酸分子为rna分子,且该rna分子经由包含脂质:核酸复合物(例如,脂质体)的组合物的注射引入至患者脑中。替代地,zfp
‑
tf可经由包含zfp
‑
tf的编码序列的核酸表达载体引入患者中。表达载体可包括使得zfp
‑
tf的编码序列可在神经系统(例如,中枢神经系统)的细胞中表达的表达控制序列(诸如启动子、增强子)、转录信号序列及转录终止序列。在一些实施方案中,表达载体以稳定附加体(episome)形式在细胞中继续存在。在其他实施方案中,表达载体整合至细胞的基因组中。
[0120]
在一些实施方案中,载体上用于引导脑中zfp
‑
tf表达的启动子为组成型活性启动子或诱导型启动子。适合启动子包括但不限于劳氏肉瘤病毒(rsv)长末端重复序列(ltr)启动子(任选地伴有rsv增强子)、巨细胞病毒(cmv)启动子(任选地伴有cmv增强子)、cmv即刻早期启动子、猴病毒40(sv40)启动子、二氢叶酸还原酶(dhfr)启动子、β
‑
肌动蛋白启动子、磷酸甘油酯激酶(pgk)启动子、eflα启动子、莫罗尼鼠类白血病病毒(momlv)ltr、基于肌酸激酶(ck6)的启动子、甲状腺素转运蛋白启动子(ttr)、胸苷激酶(tk)启动子、四环素反应性启动子(tre)、乙型肝炎病毒(hbv)启动子、人类α1
‑
抗胰蛋白酶(haat)启动子、嵌合肝脏特异性启动子(lsp)、e2因子(e2f)启动子、人类端粒酶反转录酶(htert)启动子、cmv增强子/鸡β
‑
肌动蛋白/兔β
‑
血球蛋白启动子(cag启动子;niwa等人,gene(1991)108(2):193
‑
9)及ru
‑
486反应性启动子。亦可使用神经元特异性启动子,诸如突触蛋白i启动子、钙/调钙素依赖性蛋白激酶ii(camkii)启动子、甲基cpg结合蛋白2(mecp2)启动子、胆碱乙酰基转移酶(chat)启动子及钙结合蛋白(calb)启动子。亦可使用星状细胞特异性启动子,诸如神经胶纤维酸性蛋白(gfap)启动子或醛脱氢酶1家族成员l1(aldh1l1)启动子。亦可使用少突胶质细胞特异性启动子,诸如olig2启动子。另外,启动子可包括一种或多种自我调控元件,藉此zfp
‑
tf可结合且将自身表达水平抑制至预设阈值。参见美国专利9,624,498。
[0121]
可采用将核苷酸序列引入至细胞中的任何方法,包括但不限于电穿孔、磷酸钙沉淀、显微注射、阳离子或阴离子脂质体、脂质体与核定位信号组合、天然存在的脂质体(例如,外泌体)或病毒转导。
[0122]
对于表达载体的体内递送,可使用病毒转导。本领域已知的多种病毒载体可适用于本发明,例如牛痘载体、腺病毒载体、慢病毒载体、痘病毒载体、疱疹病毒载体、腺相关病毒(aav)载体、反转录病毒载体及杂交病毒载体。在一些实施方案中,本文所用的病毒载体为重组aav(raav)载体。aav载体尤其适用于中枢神经系统(cns)基因递送,因为aav感染分裂细胞及非分裂细胞两者且具有极低免疫原性,且病毒基因组以用于长期表达的稳定附加体结构的形式存在(hadaczek等人,mol ther.(2010)18:1458
‑
61;zaiss等人,genether.(2008)15:808
‑
16)。可使用任何适合的aav血清型。举例而言,aav可为aav1、aav2、aav3、
aav3b、aav4、aav5、aav6、aav7、aav8、aav8.2、aav9或aavrh10,或具有假型(例如,aav2/8、aav2/5、aav2/6、aav2/9或aav2/6/9)。参见例如美国专利7,198,951及9,585,971。
[0123]
在一些实施方案中,表达载体为aav载体且藉由重组aav病毒体引入目标人类细胞中,重组aav病毒体的基因组包含构建体,包括在两端具有aav反向末端重复(itr)序列,使得可在诸如昆虫细胞/杆状病毒产生系统或哺乳动物细胞产生系统的产生系统中产生aav病毒体。aav可经工程改造,使得其壳体蛋白在人体内的免疫原性降低且转导能力增强。在一些实施方案中,使用aav9。可使用本领域已知的方法产生本文所描述的病毒载体。可采用任何适合的容许或包装细胞类型来产生病毒颗粒。举例而言,哺乳动物(例如,293)昆虫(例如,sf9)细胞可用作包装细胞系。
[0124]
关于在有需要的患者的神经系统中表达治疗蛋白,包括zfp的方法,亦参见美国专利6,309,634;6,453,242;6,503,717;6,534,261;6,599,692;6,607,882;6,689,558;6,824,978;6,933,113;6,953,575;6,979,539;7,013,219;7,163,824;7,182,944;8,309,355;8,337,458;8,586,526;9,050,299;及9,089,667。
[0125]
iii.医药应用
[0126]
本发明zfp
‑
tf可用于治疗需要下调c9orf72表达,尤其下调突变型c9orf72等位基因表达的患者。患者患有c9orf72相关的神经变性性疾病(诸如als及c9ftd)或具有罹患所述疾病的风险。具有风险的患者包括在基因上倾向于患病的患者、遭受反复脑损伤(诸如脑震荡)的患者及已暴露于环境神经毒素的患者。本发明提供治疗受试者(诸如有需要的人类患者)的c9orf72相关神经疾病(例如,als及c9ftd)的方法,其包含向受试者的神经系统(例如,cns)中引入治疗有效量(例如,使得可对突变型c9orf72等位基因表达进行充分抑制的量)的zfp
‑
tf(例如,表达其的raav载体)。术语“治疗”涵盖缓解症状、预防症状发作、减缓疾病进展、提高生活质量及提高存活率。
[0127]
本发明提供药物组合物,其包含病毒载体,诸如重组基因组包含zfp
‑
tf的表达盒的raav。药物组合物可进一步包含药学上可接受的载剂,诸如水、生理食盐水(例如,磷酸盐缓冲生理食盐水)、右旋糖、甘油、蔗糖、乳糖、明胶、葡聚糖、白蛋白或果胶。另外,组合物可含有辅助物质,诸如润湿或乳化剂、ph缓冲剂、稳定剂或增强药物组合物有效性的其他试剂。药物组合物可含有递送媒剂,诸如脂质体、纳米胶囊、微粒、微球体、脂质颗粒及囊泡。
[0128]
本发明治疗剂所靶向的细胞为脑和/或脊髓中的细胞,包括但不限于神经元细胞(例如,运动神经元、感觉神经元、多巴胺能神经元、胆碱能神经元、谷氨酸能神经元、gaba能神经元或血清素能神经元);神经胶细胞(例如,少突胶质细胞、星状细胞、周细胞、许旺氏细胞(schwann cell)或微神经胶细胞);室管膜细胞;或神经上皮细胞。所靶向的脑区可为皮质区、额颞叶区、内嗅皮质、海马、小脑、脑桥及髓质。这些区可直接经由海马内注射、脑内注射、池内(icm)注射到达,或更一般而言经由脑实质内注射、脑室内(icv)注射、鞘内注射或静脉内注射到达。其他施用途径包括但不限于脑内、室内、鼻内或眼内施用。在一些实施方案中,在例如经由鞘内和/或脑内注射或池内注射或脑室内注射直接施用至脑脊髓液(csf)后,病毒载体在整个cns组织中传播。在其他实施方案中,在静脉内施用后,病毒载体穿过血脑障壁且在受试者的整个cns组织中实现广泛分布。在其他实施方案中,病毒载体经由脑实质内注射直接递送至目标区。在一些情况下,在脑实质内递送后,病毒载体可经历逆行或顺行运输到达其他脑区。在一些方面中,病毒载体具有独特cns组织靶向能力(例如,cns组织
向性),其以高效率实现稳定且无毒性基因转移。
[0129]
举实例而言,可经由室内施用,例如施用至患者前脑的脑室区,诸如右侧脑室、左侧脑室、第三脑室或第四脑室,向患者提供药物组合物。可经由脑内施用,例如向脑的大脑、髓质、脑桥、小脑、颅内腔、脑膜、硬脑膜、蜘蛛膜或软脑膜中或附近注射组合物,向患者提供药物组合物。在一些情况下,脑内施用可包括将药剂施用至围绕脑的蜘蛛膜下腔的脑脊髓液(csf)中。
[0130]
在一些情况下,脑内施用涉及使用立体定位手术注射。立体定位手术为此项技术中所熟知,且通常涉及计算机及三维扫描装置的使用,计算机及三维扫描装置一起用于引导向特定脑内区,例如脑室区注射。亦可使用显微注射泵(例如,来自world precision instruments)。在一些情况下,显微注射泵用于递送包含病毒载体的组合物。在一些情况下,组合物的输注速率在1微升/分钟至100微升/分钟范围内。如本领域技术人员应了解,输注速率将视多种因素而定,包括例如受试者的年龄、受试者的体重/大小、aav的血清型、所需剂量及所靶向的脑内区。因此,本领域技术人员可认为其他输注速率在某些环境中适当。
[0131]
可例如藉由静脉内施用实现向受试者递送raav。在某些情况下,可能需要将raav局部递送至脑组织、脊髓、脑脊髓液(csf)、神经元细胞、神经胶细胞、脑膜、星状细胞、少突胶质细胞、间隙空间及其类似者。在一些情况下,可藉由注射至脑室区中和/或注射至海马、皮质、小脑小叶或其他脑区,将重组aav(例如,107‑
10
15
vg/剂量)直接递送至cns。可利用针、导管或相关装置,使用本领域已知的神经外科技术,诸如藉由立体定位注射递送aav。参见例如stein等人,jvir.(1999)73:3424
‑
9;davidson等人,pnas.(2000)97:3428
‑
32;davidson等人,natgenet.(1993)3:219
‑
223;及alisky及davidson,hum.genether.(2000)11:2315
‑
29;美国专利7,837,668及8,092,429。
[0132]
除非本文另外定义,否则结合本发明使用的科学与技术术语将具有由本领域技术人员通常理解的含义。下文描述例示性方法及物质,但类似或等效于本文所描述的方法及物质的方法及物质亦可用于实施或测试本发明。在有冲突的情况下,将以本说明书(包括定义)为准。一般而言,本文所描述的结合神经学、医学、医学及医药化学及细胞生物学使用的命名法及所述学科的技术为此项技术中所熟知且常用的。酶促反应及纯化技术是根据制造商的说明书如此项技术中通常所实现或如本文所描述来进行。此外,除非上下文另外需要,否则单数术语应包括复数且复数术语应包括单数。在本说明书及实施方案通篇,词语“具有(have)”及“包含(comprise)”或诸如“具有(has/having)”、“包含(comprises/comprising)”的变化形式应理解为暗示包含陈述的整数或整数群,但不排除任何其他整数或整数群。本文所提及的所有公开案及其他参考文献均以全文引用的方式并入。尽管本文中引用多个文件,但此引用不构成这些文件中任一者形成此项技术中公知常识的部分的许可。如本文所用,如应用于所关注的一或多个值的术语“大致”或“约”指类似于所陈述参考值的值。在某些实施方案中,除非另外陈述或以其他方式根据上下文显而易见,该术语指在所陈述参考值任一方向上(大于或小于)10%、9%、8%、7%、6%、5%、4%、3%、2%、1%或更小内的一系列值。
[0133]
为了使本发明可被更好地理解,列举以下实施方案及实例。这些实施方案及实例仅为达成说明的目的,且并不应视为以任何方式限制本发明的范畴。
[0134]
iv.例示性实施方案
[0135]
本发明的非限制性例示性实施方案在下文描述。
[0136]
1.一种抑制细胞中c9orf72基因的正义和/或反义转录的方法,该方法包含用一种或多种c9orf72基因抑制物处理该细胞,该一种或多种抑制物包含转录抑制物域及结合至c9orf72基因中的目标位点的dna结合域,任选地其中该一种或多种抑制物包含一种或多种锌指蛋白转录因子(zfp
‑
tf)、一种或多种tal效应域转录因子(tale
‑
tf)和/或一种或多种crispr/cas转录因子。
[0137]
2.如实施方案1的方法,其中c9orf72基因包含包括一或多个扩增(g4c2)重复序列的突变型等位基因,任选地其中目标位点在一或多个扩增(g4c2)重复序列内。
[0138]
3.结合至包含一或多个(g4c2)重复序列的突变型c9orf72扩增等位基因的一种或多种zfp
‑
tf、tale
‑
tf和/或crispr/castf抑制物用于在有需要的受试者中抑制正义和/或反义转录的用途。
[0139]
4.如前述实施方案中任一项的方法或用途,其中相比于未经处理细胞,反义转录被抑制至少50%。
[0140]
5.如前述实施方案中任一项的方法或用途,其中相比于未经处理细胞,反义转录被抑制至少70%。
[0141]
6.如前述实施方案中任一项的方法或用途,其中包含所述扩增重复序列的转录物受选择性抑制,任选地其中反义转录受抑制,自1a启动子的正义转录受抑制和/或自1b启动子的正义转录不受抑制。
[0142]
7.如前述实施方案中任一项的方法或用途,其中所述一种或多种zfp
‑
tf抑制物包含按表1中所示的次序具有识别螺旋区的zfp。
[0143]
8.如前述实施方案中任一项的方法或用途,其中所述一种或多种zfp
‑
tf抑制物以mrna形式或使用病毒载体向所述细胞施用。
[0144]
9.如实施方案8的方法或用途,其中病毒载体是ad或aav载体。
[0145]
10.如实施方案9的方法或用途,其中aav载体是aav2/9载体。
[0146]
11.如前述实施方案中任一项的方法或用途,其中所述细胞在活受试者中且将所述一种或多种zfp
‑
tf抑制物向所述受试者施用。
[0147]
12.如实施方案11的方法或用途,其中将所述一种或多种zfp
‑
tf抑制物向所述受试者脑室内、鞘内、颅内、眶后(ro)、静脉内、鼻内和/或脑池内静脉内施用。
[0148]
13.如实施方案12的方法或用途,其中所述zfp
‑
tf抑制物向所述受试者的海马单侧或两侧施用,任选地以1e10至1e13(例如,6e11)vg/半球的剂量使用aav载体施用。
[0149]
14.如前述实施方案中任一项的方法或用途,其中所述细胞是神经元。
[0150]
15.如先前实施方案中任一项的方法或用途,其中施用两种更多种zfp
‑
tf抑制物。
[0151]
16.如实施方案15的方法或用途,其中所述两种或更多种zfp
‑
tf抑制物载于相同或不同非病毒或病毒载体上。
[0152]
17.如前述实施方案中任一项的方法或用途,其中所述受试者的als和/或ftd经治疗。
[0153]
18.如前述实施方案中任一项的方法或用途,其中受试者中als和/或ftd的一种或多种症状得到改善。
[0154]
19.一种zfp
‑
tf融合蛋白,其结合至目标序列且包含对应于如表1中所示的sbs id
的锌指,所述锌指包含表1的单列中所示的该sbs id的dna结合(识别)螺旋序列,其中该sbs id是78021。
[0155]
20.一种zfp
‑
tf融合蛋白,其结合至目标序列且包含对应于如表1中所示的sbs id的锌指,所述锌指包含表1的单列中所示的该sbs id的dna结合(识别)螺旋序列,其中该sbs id是75114。
[0156]
21.一种zfp
‑
tf融合蛋白,其结合至目标序列且包含对应于如表1中所示的sbs id的锌指,所述锌指包含表1的单列中所示的该sbs id的dna结合(识别)螺旋序列,其中该sbs id是75115。
[0157]
22.一种zfp
‑
tf融合蛋白,其结合至目标序列且包含对应于如表1中所示的sbs id的锌指,所述锌指包含表1的单列中所示的该sbs id的dna结合(识别)螺旋序列,其中该sbs id是74969。
[0158]
23.一种zfp
‑
tf融合蛋白,其结合至目标序列且包含对应于如表1中所示的sbs id的锌指,所述锌指包含表1的单列中所示的该sbs id的dna结合(识别)螺旋序列,其中该sbs id是79895。
[0159]
24.一种zfp
‑
tf融合蛋白,其结合至目标序列且包含对应于如表1中所示的sbs id的锌指,所述锌指包含表1的单列中所示的该sbs id的dna结合(识别)螺旋序列,其中该sbs id是79898。
[0160]
25.一种zfp
‑
tf融合蛋白,其结合至目标序列且包含对应于如表1中所示的sbs id的锌指,所述锌指包含表1的单列中所示的该sbs id的dna结合(识别)螺旋序列,其中该sbs id是74986。
[0161]
26.一种zfp
‑
tf融合蛋白,其结合至目标序列且包含对应于如表1中所示的sbs id的锌指,所述锌指包含表1的单列中所示的该sbs id的dna结合(识别)螺旋序列,其中该sbs id是79899。
[0162]
27.一种zfp
‑
tf融合蛋白,其结合至目标序列且包含对应于如表1中所示的sbs id的锌指,所述锌指包含表1的单列中所示的该sbs id的dna结合(识别)螺旋序列,其中该sbs id是79901。
[0163]
28.一种zfp
‑
tf融合蛋白,其结合至目标序列且包含对应于如表1中所示的sbs id的锌指,所述锌指包含表1的单列中所示的该sbs id的dna结合(识别)螺旋序列,其中该sbs id是79902。
[0164]
29.一种zfp
‑
tf融合蛋白,其结合至目标序列且包含对应于如表1中所示的sbs id的锌指,所述锌指包含表1的单列中所示的该sbs id的dna结合(识别)螺旋序列,其中该sbs id是79904。
[0165]
30.一种zfp
‑
tf融合蛋白,其结合至目标序列且包含对应于如表1中所示的sbs id的锌指,所述锌指包含表1的单列中所示的该sbs id的dna结合(识别)螺旋序列,其中该sbs id是79916。
[0166]
31.一种zfp
‑
tf融合蛋白,其结合至目标序列且包含对应于如表1中所示的sbs id的锌指,所述锌指包含表1的单列中所示的该sbs id的dna结合(识别)螺旋序列,其中该sbs id是75027。
[0167]
32.一种zfp
‑
tf融合蛋白,其结合至目标序列且包含对应于如表1中所示的sbs id
的锌指,所述锌指包含表1的单列中所示的该sbs id的dna结合(识别)螺旋序列,其中该sbs id是79921。
[0168]
33.如实施方案19至32中任一项的zfp
‑
tf融合蛋白,其中zfp
‑
tf融合蛋白包含有包含seq id no:13的转录抑制物域。
[0169]
34.如实施方案19至33中任一项的zfp
‑
tf融合蛋白,其中锌指域及转录抑制物域由包含seq id no:26的肽接头连接。
实施例
[0170]
实施例1:人工转录抑制物
[0171]
产生一组zfp
‑
tf以靶向扩增人类c9orf72等位基因。例示性zfp
‑
tf显示于以下表1中。这些zfp
‑
tf各自含有具有六个指的zfp域及如上文所描述的krab域(seq id no:13)。肽接头用于将zfp域连接至krab域。接头具有以下氨基酸序列:lrqkdaargs(seq id no:26)。
[0172]
表1显示各zfp
‑
tf中目标位点的dna序列及各锌指(f1至f6)的dna结合螺旋的氨基酸序列。seq id no显示于括号中。目标位点中由zfp域结合的目标序列以大写字母显示,而侧接序列以小写字母显示。seq id no:24为基因等位基因的正义链上的目标位点,而seq id no:25为基因等位基因的反义链上的目标位点。
[0173]
dna结合螺旋为锌指的可变部分,且通常含有六或七个氨基酸残基。如例如美国专利公开案2018/0087072中所描述,可藉由对zfp主链的突变提高zfp域的目标特异性。表中符号“^”指示指定螺旋中第1氨基酸上游的第4位处的精氨酸(r)残基改变为谷氨酰胺(q)。在各锌指螺旋序列中,七个dna结合氨基酸的位置编号为
‑
1、 1、 2、 3、 4、 5及 6。因此,r至q取代的位置编号为(
‑
5)。
[0174]
表1例示性c9orf72zfp
‑
tf
[0175]
[0176]
[0177]
[0178]
[0179][0180]
zfp
‑
tf藉由标准selex分析(参见例如miller等人,nat biotech.(2010)doi:10.1038/nbt.1755;wilen等人,plos(2011)7(4):e1002020)评估。显示所有zfp
‑
tf均结合至其目标位点。
[0181]
研究中使用五种类型的人类细胞系及一种小鼠细胞系。c9021纤维母细胞细胞系获自哥伦比亚大学als研究所)且来源于als
‑
ftd患者。该细胞系在其正常等位基因上含有5个g4c2重复序列且在其扩增等位基因上含有大致850个重复序列。野生型纤维母细胞细胞系(nds00035)、353trad及204tdp纤维母细胞细胞系获自国立神经病症及中风研究所(national institute of neurological disorders and stroke)。野生型系在各等位基因上含有两个g4c2重复序列。353trad系在一个等位基因上含有5个重复序列且在另一等位基因上含有8个重复序列。204tdp在一个等位基因上具有2个重复序列且在另一等位基因上具有20个重复序列。对于所有纤维母细胞实验,人类神经元系获自cell dynamics international(icell gabaneurons试剂盒,01434;目录号r1013;细胞批号104901)。小鼠皮质神经元获自gibco(目录号a15586)。结合至其目标区但不具有可观测抑制效应的zfp74960用作阴性对照。
[0182]
对于在患者来源的纤维母细胞中进行的所有实验,使用来自lonza的96孔shuttle nucleofector系统进行zfp
‑
tf mrna向细胞中的转染。使用amaxa p2 primary cells nucleofector试剂盒用ca
‑
137程序转染每40,000个细胞1、3、10、30、100及300ng zfp
‑
tf mrna。隔夜温育后,使用cells
‑
to
‑
ct试剂盒(thermo fisher scientific)以自经转染细胞产生cdna,接着使用qrt
‑
pcr进行基因表达分析。
[0183]
对于神经元转导,使zfp进入aav6质粒中。将神经元用aav6
‑
zfp转导。所有转导均在3,000moi下进行。小鼠神经元在转导后7天收集,而人类神经元在转导后19天收集。收集
细胞后,对其进行加工以供微阵列分析。
[0184]
筛选分析在多轮中进行。在各轮中,在多个浓度下测试zfp以鉴别具有适合目标命中(on target)(选择性抑制)模式的zfp
‑
tf。在c9(c9021)细胞中进行第2轮筛选,以评估zfp
‑
tf处理后相对于总c9orf72(“总c9”)成熟mrna的扩增正义转录物(疾病)c9orf72水平。rt
‑
pcr分析使用靶向内含子区1a的引物/探针组。
[0185]
扩增正义c9orf72转录物:
[0186]
正向:5'ccctctctccccactacttg 3'(seq id no:61)
[0187]
反向:5'ctacaggctgcggttgtttcc 3'(seq id no:62)
[0188]
探针:5'tctcacagtactcgctgagggtga 3'(seq id no:63)。
[0189]
g4c2扩增导致低效剪接及含扩增的前驱mrna的累积(图2a)。相比之下,高效剪接的野生型(wt)前驱mrna以极低水平存在。藉由在c9021细胞中使用此分析,我们显示所测试的zfp
‑
tf显示对扩增正义(疾病)c9orf72转录物的广泛范围抑制。(图2b至图2d)。
[0190]
为了评估对总c9orf72mrna的抑制,使用不同引物/探针组,其表示为“总c9”(图2a):
[0191]
总c9orf72mrna:
[0192]
正向:5'ctatgtgtgtggtgggatatgg 3'(seq id no:58)
[0193]
反向:5'ctccaggttatgtgaagcagaa 3'(seq id no:59)
[0194]
探针:5'aggcctgctaaaggattcaactggaa 3'(seq id no:60)。
[0195]
此引物/探针组可检测包含跨越外显子8及9的区的mrna。此区在所有c9orf72mrna同等型中存在。如图2b中所示,许多zfp
‑
tf显示对总c9orf72转录物的适度抑制。举例而言,zfp
‑
tf 75114及75115抑制扩增正义(疾病)转录物超过70%,同时保持总c9orf72 mrna表达超过50%(图2d,第2轮数据)。
[0196]
在第3轮中,评估总c9orf72mrna且将其在c9021细胞与野生型(wt)细胞之间比较,以便进一步评估所测试的zfp
‑
tf对总c9orf72 mrna量的影响。数据显示与wt细胞中相比,突变型细胞中总c9orf72mrna水平的减少显著得多(图2b至图2d),且所述水平在由相同zfp
‑
tf处理的野生型细胞中受到的影响小得多。整体数据说明对于一些zfp,诸如75109、75114及75115,扩增同等型受显著抑制(约70%),同时维持c9患者纤维母细胞细胞系的总c9转录物的约50%。
[0197]
在三种不同患者来源的纤维母细胞中评估zfp
‑
tf75109、75114及75115的同等型选择性抑制,所述纤维母细胞在其扩增等位基因上含有不同g4c2扩增重复序列(600、800及850个)(图6)。所有三种zfp展现不依赖于重复序列扩增长度的类似行为,说明zfp
‑
tf的选择性抑制不依赖于g4c2重复序列长度。
[0198]
评估来自健康个体的两种细胞系中对总c9转录物的抑制,所述细胞系在其等位基因上的g4c2重复序列数目大于正常值(图7)。在健康细胞系中,总c9转录物受极小影响。患者来源的细胞系(c9021)中总c9mrna转录物的zfp介导抑制并不真正代表wt同等型水平,因为使用pcr分析以检测总c9mrna转录物目标外显子8及9,其在扩增及非扩增(wt)同等型两者中均离开(图2a)。在等位基因上具有不同g4c2重复序列长度的两种不同健康细胞系中评估响应于同等型选择性zfp
‑
tf(75109、75114及75115)的总c9mrna转录物抑制(图7)。细胞系353tread在一个等位基因上具有5个重复序列且在另一等位基因上具有8个重复序列,而细
胞系204tdp在一个等位基因上具有2重复序列且在另一等位基因上具有20个重复序列。尽管总c9 mrna转录物在c9细胞系c921(在非扩增等位基因上有5个重复序列且在扩增等位基因上有850个重复序列)中以剂量依赖型方式受抑制,但其在不具有扩增等位基因的其他两种细胞系中受极小影响,表明疾病系(5/850)中对总c9同等型的抑制系对扩增同等型的抑制的结果,且非扩增同等型的表达不受选择性zfp
‑
tf影响(图7)。
[0199]
在不受理论束缚的情况下,有可能本发明zfp
‑
tf能够以合作方式起作用,以便选择性抑制具有大量重复序列的等位基因。其可由高阶(higher
‑
order)复合物介导,例如经由募集与zfp连接的krab域缔合的kap1共抑制物。在此假设下,跨越多个zfp
‑
tf的kap1/krab“支架”提高转录抑制机构的稳定性,且使得能够相比于野生型等位基因,优先抑制扩增c9orf72等位基因。
[0200]
实施例2:c9orf72抑制的特异性
[0201]
藉由以下3种细胞系中的微阵列分析评估表1中所示的zfp
‑
tf的全局特异性:c9021纤维母细胞、原代小鼠皮质神经元及人类神经元。简言之,对于c9021细胞,将100ng zfp
‑
tf编码mrna一式四份转染至150,000个c9021细胞中。24小时后,经由制造商的方案(affymetrix genechip mta1.0)提取且加工总rna。使用稳健多阵列平均(multi
‑
array average,rma)来使来自各探针组的原始信号标准化。使用transcriptome analysis console3.0(affymetrix)用“基因层级差异性表达分析(gene level differential expression analysis)”选项进行分析。将经zfp
‑
tf转染的样品与已经不相关zfp
‑
tf(不结合至c9orf72目标位点的zfp
‑
tf)处理的样品进行比较。对于相对于对照,均值信号>2倍差异,且p值<0.05(单因子变异数分析,对于各探针组进行非成对t检定)的转录物(探针组)报告变化召唤(call)。对神经元进行类似程序,其例外之处在于其在3000moi下经aav6转导,且对于小鼠神经元培养7天且对于人类神经元培养19天,随后收集。
[0202]
例示性数据显示于图8a至图8c中。数据显示zfp
‑
tf75027展现除c9orf72(显示为带圆圈)外数次偏离目标(off
‑
target),而zfp
‑
tf75109、75114及75115仅抑制c9orf72,在人类及小鼠两者中的纤维母细胞及神经元两者中极少偏离目标。这些结果证明代表性zfp
‑
tf对c9orf72具有高度特异性。
[0203]
实施例3:反义特异性抑制的检测
[0204]
因为正义及反义转录物由dna的重叠区编码,所以我们开发基于转录物的差异性加工的检测策略。对于来自扩增等位基因的正义mrna,含有扩增区的内含子(内含子1a)经错剪接且保留,而所有其他内含子经移除,包括内含子1b。相比之下,内含子1b区为反义mrna转录物的预测外显子且应保留。因此,我们设计且测试位于内含子1b内的引物且展现对反义转录物的特异性检测,如下文进一步描述。
[0205]
为检测c9orf72转录物,我们使用液滴式数字pcr(ddpcr)。简言之,为建立正义或反义cdna模板,自c9orf72患者及健康对照细胞(c9orf72细胞系:c9
‑
3、c9
‑
6、c9
‑
7、c9
‑
5、c9
‑
10、c9
‑
11、c9
‑
2、c9
‑
4;对照细胞系:kinals6、con3、kin1als17、con8、con10、con1;参见lagier
‑
tourenne等人,pnas(2013)110(47):e4530
‑
9)纯化rna,且如下使用superscript iii(thermo fischer scientific)第一链合成系统使用该rna来合成cdna:
[0206]
1)将0.5μg rna、0.5μl 10mm链特异性引物及dntp混合物混合且用水制得至10μl。为产生正义模板,使用引物5'ctctagcgactggtggaattg3'(seq id no:64)。为产生反义模
板,使用引物5'gtgcatggcaactgtttgaata3'(seq id no:65)。
[0207]
2)将此反应物在65℃下温育5分钟以便变性,且置放于冰上至少1分钟。
[0208]
3)使用这些试剂制备cdna合成混合物:10xrt缓冲液(2μl);25mm mgcl2(4μl);0.1m dtt(2μl);rna酶out(1μl);superscript iii(1μl)。
[0209]
4)将10μl此反应物添加至rna混合物中且在50℃下温育50分钟。随后藉由在85℃下温育5分钟使反应物失活。
[0210]
随后使用经标记探针根据制造商的方案使模板经历ddpcr。简言之,在abi pcr 96孔培养板中使用探针用无dutp的ddpcr超混合液(bio
‑
rad)进行pcr反应。根据制造商的说明制备pcr主混合物。以下显示位于内含子1b区上的反义引物
‑
探针组(图3)。
[0211]
正向:5'caaagcctggtggtgttcaa 3'(seq id no:66)
[0212]
反向:5'ggacatgacctggttgcttc 3'(seq id no:67)
[0213]
探针:5'cgcggccagatagacccaatgagca 3'(seq id no:68)。
[0214]
反应如下设置:
[0215]
1)将全部主混合物均匀分配在abi pcr培养板的8个孔中。
[0216]
2)将10μl1:10稀释的rt反应物或水添加至样品孔中。
[0217]
3)将15μl主混合物转移至含rt的孔中。
[0218]
4)将培养板密封,涡旋且短暂离心。
[0219]
为制备液滴,如下使用筒:
[0220]
1)在筒上将70μl探针油置于标记为油的孔中,且将20μl ddpcr反应物置于标记为样品的孔中。
[0221]
2)将橡胶垫置于筒顶部上。
[0222]
3)将40μl液滴转移至新鲜eppendorf 96孔培养板中。用铝箔密封培养板且根据制造商的方案进行pcr。
[0223]
数据显示在c9orf72纤维母细胞细胞系中,这些引物在反义扩增前驱mrna(c9
‑
as)中扩增外显子,且互补区在正义区(c9
‑
s)中不存在(图4a)。因此,本文中ddpcr反义引物特异性检测反义前驱mrna,相比于6种不同对照纤维母细胞,反义前驱mrna在7种不同c9患者来源的纤维母细胞中明显升高(图4b)。
[0224]
实施例4:扩增等位基因正义及反义前驱mrna抑制
[0225]
为测试zfp
‑
tf抑制物对扩增等位基因的活性,将细胞用zfp
‑
tf74949、74978、75003、75027、75109、75114、75115、74967(表1)或74960(阴性对照)处理,如上文所描述。由对样品顺序不知情的研究人员使用两个独立pcr分析来评定zfp
‑
tf介导的抑制。各分析使用不同引物/探针(图5a至图5c)。
[0226]
对于1号及2号运作,如上文所描述进行测量正义扩增、反义扩增及总c9的分析,其例外之处在于根据此项技术中的标准方案用随机六聚体且用以下显示的引物进行扩增:
[0227]
反义扩增c9orf72前驱mrna(图5b):如以上实施例3中所示。
[0228]
正义扩增c9orf72前驱mrna(图5a):此引物/探针组可检测包含跨越外显子1a及内含子1a的区的mrna。
[0229]
正向:5'actacttgctctcacagtactcg 3'(seq id no:69)
[0230]
反向:5'tagcgcgcgactcctgagttcc 3'(seq id no:70)
[0231]
探针:5'agggaaacaaccgcagcctgtagcaagctc 3'(seq id no:71)。
[0232]
总c9orf72mrna(图5c):此引物/探针组可检测包含外显子2内的区的mrna。
[0233]
正向:5'tgtgacagttggaatgcagtga 3'(seq id no:72)
[0234]
反向:5'gccacttaaagcaatctctgtcttg 3'(seq id no:73)
[0235]
探针:5'tcgactctttgcccaccgcca 3'(seq id no:74)。
[0236]
3号运作(图5a及图5c)使用以上实施例1中所示的引物(图2b至图2d)。对于反义疾病转录物,使用以下引物/探针以便检测内含子区1b(图5b)。
[0237]
正向:5'cagcttcggtcagagaaatgag 3'(seq id no:78)
[0238]
反向:5'aagaggcgcgggtagaa 3'(seq id no:79)
[0239]
探针:5'ctctcctcagagctcgacgcattt 3'(seq id no:80)。
[0240]
尽管使用不同引物/探针组及不同pcr分析(1号运作及2号运作藉由类似分析进行,但不同于3号运作)的实情,但数据一致且抑制水平可比。
[0241]
综合而言,所有运作一致地展现一些zfp
‑
tf能够强有力地抑制所有三种转录物(正义、反义及总)(例如,zfp
‑
tf74978、75003及75027),而一些zfp
‑
tf(例如,zfp
‑
tf75109、75114及75115)选择性抑制正义及反义疾病转录物同时保持总c9转录物(选择性抑制)。
[0242]
实施例5:bacc9orf72基因转基因小鼠神经元中对人类c9orf72的调节
[0243]
使用驱动表达的cmv启动子将靶向bac小鼠c9orf72的所有抑制物克隆至raav6载体中。在hek293t细胞中产生重组aav,使用cscl密度
‑
梯度纯化,且藉由实时qpcr根据本领域已知的方法滴定。使用纯化病毒以3e5、1e5、3e4及1e4vg/细胞感染经培养原代小鼠皮质神经元。7天后,提取总rna且使用rt
‑
qpcr监测c9orf72正义及反义转录物以及两种参考基因(例如atp5b及eif4a2)的表达。
[0244]
所有zfp
‑
tf编码aav载体将在宽感染剂量范围内在小鼠细胞中有效抑制其目标,一些zfp在多次剂量下减少目标超过95%。相比之下,对于在等效剂量下测试的cmv
‑
gfpraav6病毒,或经假拟处理的神经元,未观测到基因抑制。
[0245]
实施例6:由aav递送的zfp
‑
tf驱动的体内基因抑制
[0246]
用于目标接合研究的c9orf72 bac基因转基因小鼠含有98kb人类转基因基因,其含有具有约500个g4c2重复序列以及实质性侧接序列的全长c9orf72基因等位基因(liu等人,neuron(2016)90(3):521
‑
34)。选择两种zfp
‑
tf zfp
‑
tf75027或zfp
‑
tf75114用于此研究,其效力不同(zfp
‑
tf75027效率更强;图2d)。将两种融合蛋白的表达盒均克隆至raav载体中,该raav载体含有驱动表达的突触蛋白启动子及可自裂解肽(例如,2a肽,诸如t2a或p2a)的编码序列,后接测量生物分布的venus标签(图9,a图)。raav在hek293t细胞中产生且藉由ddpcr在itr上使用引物进行滴定。
[0247]
为评估zfp
‑
tf表达在体内对含扩增的正义及反义转录物的抑制的影响,藉由脑室内(icv)注射将zfp
‑
tfraav递送至p0c9
‑
bac或wt小鼠中。简言之,媒剂(pbs)或zfp
‑
tf 75027 raav或zfp
‑
tf 75114 raav(总剂量2e10vg/脑室)两侧施用(2μl/脑室)至新生c9
‑
bac小鼠(针对重复序列长度匹配)或wt小鼠中(图9,c图)。注射后四周处死动物且将一个半球包埋以供rna聚集点分析,且将另一半球显微解剖成皮质、海马及小脑以供进一步分析(图9,b图)。对病毒基因组及venusm rna及蛋白质的定量显示广泛生物分布,zfp
‑
tf 75027及zfp
‑
tf 75114两者的转导及表达等效。
[0248]
自皮质及海马组织提取总rna且使用iscriptcdna合成试剂盒(biorad)制备cdna。进行ddpcr以测量含正义及反义扩增的转录物的表达,及相对于小鼠tbp量标准化的总c9mrna量。用于此分析的引物为:
[0249]
总c9mrna:
[0250]
正向:5'tgtgacagttggaatgcagtga3'(seq id no:72)
[0251]
反向:5'gccacttaaagcaatctctgtcttg3'(seq id no:73)
[0252]
探针:5'tcgactctttgcccaccgcca3'(seq id no:74)。
[0253]
正义扩增前驱mrna:
[0254]
正向:5'actacttgctctcacagtactcg 3'(seq id no:69)
[0255]
反向:5'tagcgcgcgactcctgagttcc 3'(seq id no:70)
[0256]
探针:5'agggaaacaaccgcagcctgtagcaagctc 3'(seq id no:71)。
[0257]
反义扩增前驱mrna:
[0258]
正向:5'agtcgctagaggcgaaagc3'(seq id no:81)
[0259]
反向:5'cgagtgggtgagtgaggag3'(seq id no:82)
[0260]
探针:5'aagaggcgcgggtagaagcgggggc3'(seq id no:83)。
[0261]
数据显示相对于经pbs注射的对照,zfp
‑
tf75027抑制c9
‑
bac动物的海马及皮质中总c9mrna、含正义及反义扩增转录物的量(图9,d图)。(在此动物模型的情况下无法观测到选择性抑制,因为基因转基因小鼠不含有wt人类c9orf72等位基因且小鼠c9orf72基因不含有g4c2重复序列)。在zfp
‑
tf75114的情况下未观测到抑制。
[0262]
另外,使用荧光原位杂交以测量zfp
‑
tf注射后见于海马中的正义及反义rna聚集体(聚集点)的量(图9,e图)。简言之,将10μm切片与经荧光团标记的探针杂交:5'ggccccggccccggcccc
‑
cy3(seq id no:84)用于测量正义rna聚集点且5'ggggccggggccggggcc
‑
cy3(seq id no:85)用于测量反义rna聚集点。在共焦显微镜(lsm880)上以40倍放大获得堆栈影像。相对于细胞总数目标准化的正义及反义rna聚集点的数目自海马的阿蒙氏角(ca)区定量。在经zfp
‑
tf75027注射的动物中观测到较低百分比的反义rna聚集点。
[0263]
这些结果显示靶向c9orf72的zfp
‑
tf可在体内有效抑制致病c9orf72等位基因的表达,且可观测到zfp
‑
tf效力中的差异。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。