1.本发明属于微生物技术领域,特别涉及一种产胞外多糖的戊糖乳杆菌及其发酵工艺和应用。
背景技术:
2.乳酸菌是一类可利用碳水化合物发酵生成乳酸的细菌的通称,广泛存在于自然界与生物体中,被公认为是安全的微生物,具有维持肠道菌群平衡、增强免疫力、降胆固醇、降血压、抗肿瘤、抗氧化、抗突变等一系列重要 生 理 功 能,是食品工业重要的发酵菌株,是发酵乳制品、肉制品、果蔬制品领域不可或缺的明星菌株,能够改善产品的风味,提高营养价值,延长保存时间。乳酸菌还是益生菌家族的重量级成员,其应用领域涉及食品、饲料、保健品、医药,应用对象涉及人体、家禽、家畜、水产等,对于社会经济的重要性不言而喻。
3.胞外多糖是微生物分泌到细胞壁外的黏液多糖和荚膜多糖的总称,乳酸菌多糖具有抗肿瘤、抗突变、抗溃疡、抗炎症、免疫调节、降血压、降胆固醇等多种功能,已在制药领域和食品行业获得广泛应用与关注。新型 eps 的开发成为工业微生物研究的热点之一,其结构、性能也愈发受到重视。乳酸菌eps 产量与菌株自身性质相关,也受到培养基营养成分和生长条件的影响,目前乳酸菌 eps 的产量一般都比较低,通常为50
‑
425 mg
·
l
‑1,如何提高胞外多糖的产量,是目前一个需要解决的问题。
技术实现要素:
4.针对现有技术中存在的问题,本发明的目的在于提供一种产胞外多糖的戊糖乳杆菌及其发酵工艺和应用。
5.本发明的目的是通过以下技术方案实现的:一种产胞外多糖的戊糖乳杆菌,所述戊糖乳杆菌yy112于2019年09月16日保藏在中国普通微生物菌种保藏管理中心,保藏编号为cgmcc no. 18492。
6.一种由上述戊糖乳杆菌产胞外多糖的发酵工艺,包括以下步骤:(1)配置乳酸菌基础培养基,调节ph值至5.0~7.0,向培养基中接入活化的戊糖乳杆菌种子培养液3%~5%,25℃~35℃培养18~30h;(2)取步骤(1)培养好的发酵液离心去除菌体,上清液中加入质量体积比80%的三氯乙酸溶液至最终质量体积比4%,4℃静置过夜,离心取上清液,加入3倍体积80%乙醇溶液,4℃静置12h,离心取沉淀;(3)将步骤(2)得到的沉淀用水溶解,经去离子水4℃透析48h,每隔4h换一次水,最终经冻干处理,得到胞外多糖(eps)。
7.进一步的,所述乳酸菌基础培养基为mrs培养基,其中蔗糖添加量2%~4%,大豆蛋白胨添加量0.5%~1.5%,酵母浸粉添加量1%~2%。
8.进一步的,步骤(1)中戊糖乳杆菌种子培养液的接种量为4.31%,培养时间24.66h、培养温度29.61℃,发酵初始ph值6.04。
9.进一步的,步骤(1)中戊糖乳杆菌种子培养液的接种量为4%,培养时间24.5h、培养温度29.5℃,发酵初始ph值6.0。
10.本发明的另一方面:一种由上述发酵工艺得到的胞外多糖,所述胞外多糖的单糖组成为:葡萄糖、甘露糖、氨基葡萄糖、半乳糖和鼠李糖,摩尔比为62.69∶85.85∶2.46∶2.92∶1.00,平均相对分子量为5.9
×
104da。
11.所述戊糖乳杆菌yy112的应用,所述戊糖乳杆菌用于生产胞外多糖。
12.本发明相比现有技术的有益效果为:本发明采用单因素法分别确定不同营养成分和培养条件涉及因素的适宜范围,再分别采用正交试验分析法进一步确定不同营养成分最适添加量,采用box
‑
behnken响应面分析法确定重要培养参数适宜水平,通过两种优化方法结合得出适合yy112发酵产生eps的营养条件和培养生长工艺参数。优化后yy112菌株的eps的产量为380.97 mg
·
l
‑1,较优化前的260 mg
·
l
‑1增加了46.52%,eps产量得到了较大提升,对推动戊糖乳杆菌yy112的实际生产和应用具有积极意义。
13.附图说明
14.图1为葡萄糖标准曲线;图2为多糖分子量标准曲线;图3为eps
‑
2的相对分子量分布;图4为标准单糖色谱图;图5为eps
‑
2单糖色谱图。
15.生物保藏发明人从天然果蔬表面筛选获得所述的戊糖乳杆菌:本发明所述戊糖乳杆菌(lactobacillus pentosae),于2019年09月16日保藏在中国普通微生物菌种保藏管理中心(保藏单位的缩写为cgmcc),地址为:北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,邮政编码:100101,保藏编号为cgmcc no. 18492。
16.具体实施方式
17.本技术实施例所用试剂:葡萄糖、蔗糖、乳糖、麦芽糖、果糖、乙酸钠、柠檬酸二铵、柠檬酸三铵、磷酸二氢钾、吐温
‑
80、硫酸、苯酚、mgso4
·
7h2o、mnso4·
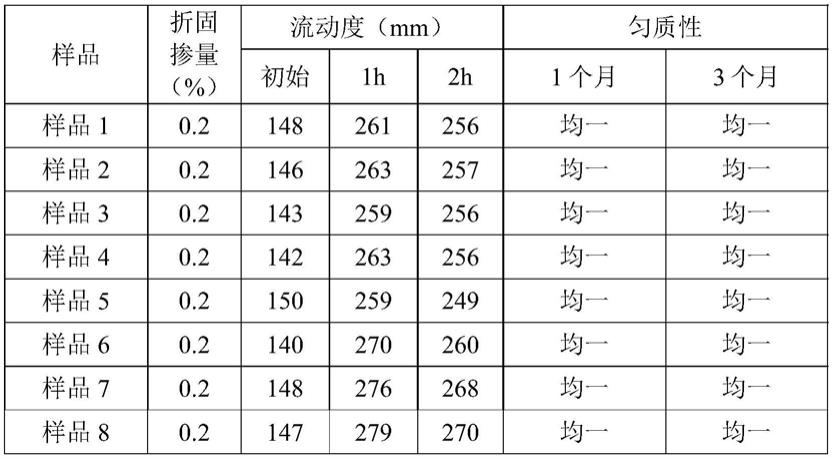
4h2o、k2hpo4、hcl、naoh等均为分析纯;蛋白胨、胰蛋白胨、大豆蛋白胨、酪蛋白胨均为生化试剂。
18.培养基包括:mrs培养基;sl培养基;sdm培养基;elliker培养基;ptyg培养基;脱脂奶粉培养基。
19.实施例1本实施例提供了一种产胞外多糖的戊糖乳杆菌,所述戊糖乳杆菌yy112于2019年09月16日保藏在中国普通微生物菌种保藏管理中心,保藏编号为cgmcc no. 18492。
20.利用所述戊糖乳杆菌产胞外多糖的发酵工艺,包括以下步骤:
(1)配置乳酸菌基础培养基,调节ph值至5.0~7.0,向培养基中接入活化的戊糖乳杆菌种子培养液,25℃~40℃培养12~48h;(2)取步骤(1)培养好的发酵液离心去除菌体,上清液中加入质量体积比80%的三氯乙酸溶液至最终质量体积比4%,4℃静置过夜,离心取上清液,加入3倍体积80%乙醇溶液,4℃静置12h,离心取沉淀;(3)将步骤(2)得到的沉淀用水溶解,经去离子水4℃透析48h,每隔4h换一次水,最终经冻干处理,得到胞外多糖(eps)。
21.采用苯酚
‑
硫酸法,以葡萄糖作为标准品,绘制标准曲线(如图1所示),得到线性回归方程:y = 0.2606x 0.001,r
2 =0.9995。相同条件下测得波长490 nm处eps水溶液的吸光度值,通过线性回归方程计算得到eps含量。
22.对比例1为探究不同培养基对eps产量的影响,本对比例分别配置了mrs、sl、sdm、elliker、ptyg、脱脂乳这6种乳酸菌基础培养基,调节ph值至6.0,接入2%活化种子培养液,37℃培养24h,分别测定eps含量,确定适宜基础培养基。
23.根据测定,lactobacillus pentosae yy112在上述6种培养基中均可产生eps,其中mrs培养基中产量最高,为259.98 mg/l,sdm培养基次之,产量为254.29 mg/l;脱脂乳中最低,为227.36 mg/l,因此选择mrs培养基为基础培养基。
24.在确定mrs培养基作为基础培养基后,进一步探究具体营养条件对eps产量的影响,包括碳源及碳源添加量、氮源及添加量、酵母浸粉添加量。
25.通过分别添加2%葡萄糖、果糖、蔗糖、乳糖、麦芽糖,配置不同碳源的mrs改良培养基,ph值调至6.0,接入2%活化种子培养液,37℃培养24h,分别测定eps含量。通过测定可知,以蔗糖为碳源时,eps产量最高,为274.26 mg/l,其次为葡萄糖(260.12 mg/l)、麦芽糖(253.09 mg/l)、乳糖(250.57 mg/l)、果糖(233.44 mg/l),选择蔗糖作为碳源。并且eps产量随蔗糖添加量增加而不断增加,当蔗糖添加量达到4%时,eps产量最高,为292.99 mg/l,但与添加量为3%时eps产量相比较(291.42 mg/l),差别不明显。综合考虑效率与经济性,选择蔗糖添加范围为2%~4%。
26.通过分别添加1%大豆蛋白胨、胰蛋白胨、酪蛋白胨、普通蛋白胨配置不同氮源mrs改良培养基,ph值调至6.0,接入2%活化种子培养液,37℃培养24h,分别测定eps含量。通过测定可知,4种蛋白胨均可促进eps合成,其中当添加大豆蛋白胨作为氮源时,eps产量最高,为285.24 mg/l,其次为酪蛋白胨(274.46 mg/l)、蛋白胨(261.78 mg/l)、胰蛋白胨(270.80 mg/l),选择大豆蛋白胨作为氮源配制培养基。当大豆蛋白胨添加量为1.0%时,eps产量最高,为285.22 mg/l,选择0.5%~1.5%为大豆蛋白胨添加量范围。
27.通过分别添加0.25%、0.50%、0.75%、1.00%的酵母浸粉,ph值调至6.0,接入2%活化种子培养液,37℃培养24h,分别测定eps含量。通过测定可知,eps产量随酵母浸粉添加量增加而提高,当酵母浸粉添加量达到1.5%时,lactobacillus pentosae yy112 eps产量最高,为276.58 mg/l,后趋于平稳,因此选择1%~2%作为酵母浸粉添加范围。
28.以碳源添加量、氮源添加量、酵母粉添加量为因素,eps产量为指标,设计l9(33)正交试验,确定高产eps的营养条件。最终确定最适组合为蔗糖添加量3%,大豆蛋白胨添加量1%,酵母浸粉添加量2%。
29.对比例2为探究培养条件对eps产量的影响,本对比例从初始ph值、接种量、培养温度和培养时间为因素,eps为指标,采用box
‑
behnken响应面法设计实验,确定最佳因素水平。
30.单因素实验:将发酵培养基初始ph值分别调为5.0、6.0、7.0、8.0,接入2%活化种子培养液,37℃培养24h,分别测定eps含量。初始ph值对lactobacillus pentosae yy112 eps产量的影响为:当ph值为6时,eps产量达到最大,为320.93 mg/l,故选择5~7为发酵初始ph值范围。
31.将培养基ph值调至6.0,分别将活化种子培养液以1%、2%、3%、4%、5%的体积比接入发酵培养基中,37℃培养24h,分别测定eps含量。不同接种量对lactobacillus pentosae yy112 eps产量的影响为:eps产量随接种量增加而增加,当接种量为4%时,eps产量最高,为363.07 mg/l。当接种量为5%时,eps产量出现略微下降趋势,故选择3%~5%作为最适接种量范围。
32.将培养基ph值调至6.0,接入2%活化种子培养液,分别在20℃、25℃、30℃、35℃、40℃下培养24h,分别测定eps含量。培养温度对lactobacillus pentosae yy112 eps产量的影响为:当培养温度达到30℃时,eps产量最高,为345.51 mg/l。当培养温度较低或较高时,eps产量均出现下降趋势。这与文献报道培养温度低于最适生长温度有利于eps的产生相一致,故选取25~35℃作为最适培养温度范围。
33.将培养基ph值调至6.0,接入2%活化种子培养液,37℃分别培养18h、24h、30h、36h、42h,分别测定eps含量。培养时间对lactobacillus pentosae yy112 eps产量的影响为:当培养时间达到24h时,eps产量达到最大,为321.57 mg/l。当培养时间延长时,eps逐渐下降,可能是由于培养基中养分减少或多糖发生了水解作用而导致的。故选择18~30 h作为最适培养时间范围。
34.最终通过软件分析得出最优培养条件为:接种量4.31%、培养时间24.66h、培养温度29.61℃、发酵初始ph值6.04,在此培养条件下lactobacillus pentosae yy112 eps产量理论值为382.886 mg/l。考虑到实际可操作性,将参数优化为:接种量4%、培养时间24.5h、培养温度29.5℃、发酵初始ph值6.0。
35.实施例2实施例1得到的胞外多糖为lactobacillus pentosae yy112粗多糖,再采用deae
‑
sepharose fast flow离子交换柱对其进行纯化。向层析柱(d2.6
×
30 cm)中装入deae
‑
sepharose fast flow凝胶,用去气后的超纯水洗去填料中的乙醇,加入0.1 mol/l nacl 溶液冲洗使填料平衡。将lactobacillus pentosae yy112粗多糖样品用超纯水溶解(50 mg/ml)后上样,上样量为100 mg。分别用超纯水、0.1 mol/l nacl溶液和0.2 mol/l nacl 溶液进行洗脱,流速为3 ml/min。使用自动部分收集器,收集时间设置为4min/支,每管6ml收集各组分多糖溶液。
36.收集到的多糖采用苯酚
‑
硫酸法,使用酶标仪进行测定多糖含量。绘制洗脱曲线,按各组分分布收集单一峰多糖溶液,离子水透析3d,每8h换水一次,浓缩透析样液,经冷冻干燥得到胞外多糖。
37.对本实施例纯化后的胞外多糖进行单糖组分和分子量的测定。
38.使用高效凝胶过滤色谱法(hpgfc),对不同dextran标准品进行检测,根据结果绘
制标准曲线,如图2所示。
39.从图中数据可得到回归方程为:log m=12.706
‑
0.4818rt(r
²ꢀ
= 0.9918)。将eps
‑
2以相同条件进样,测得结果如图3所示。从图中可看出,eps
‑
2显示为单一对称峰型。洗脱曲线保留时间为17.02 min,将保留时间带入回归方程,可计算得出平均相对分子量为5.9
×
104 da。
40.将不同单糖标准品用tfa水解后进样,得到标准单糖色谱图如图4。将eps
‑
2同样条件进样,测得其单糖色谱图如图5所示。对照标准单糖色谱图,可以推测出它们的单糖组成。
41.由图5可以看出,eps
‑
2由葡萄糖、甘露糖、氨基葡萄糖、半乳糖、鼠李糖五种单糖组成,计算得到摩尔比为:62.69:85.85:2.46:2.92:1.00。
42.最后应说明的是,以上仅用以说明本发明的技术方案而非限制,尽管参照较佳布置方案对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。