1.本发明涉及组织工程技术领域,具体是一种负载有多种基因载体微球的神经修复支架及其制备方法。
背景技术:
2.周围神经损伤使受该神经支配的区域出现感觉障碍、运动障碍和营养障碍。由于受来源有限、供体受创等问题限制,通过自体或者异体神经移植进行神经修复难以完成。因而,选用合适的材料修复支架、采用显微外科技术,进行支架桥接、缝合来修复神经、恢复神经功能成为重要手段。为减小植入材料对人体的免疫原毒性,避免二次手术创伤等,首选可体内降解的医用材料。研究证实,施万细胞在神经损伤时能产生神经生长因子ngf、转录因子c
‑
jun、脑源性神经营养因子bdnf、胶质源性神经营养因子gdnf、捷状神经营养因子cntf、神经营养因子nt
‑
3、nt
‑
4和nt
‑
5等相关神经因子。聚集在神经损伤处的血源性巨噬细胞也能分泌白介素1(il
‑
1),这种il
‑
1能刺激其附近的施万细胞分泌更多的神经生长因子(nature,1987,330(6149),658
‑
659)。这些因子的基因质粒对于治疗周围神经损伤有着重要作用,它们能通过刺激施万细胞产生更多神经生长因子,从而能加快神经细胞再生并促进神经修复。将编码生长因子的神经基因通过修复支架植入、再缓慢释放、靶向进入施万细胞和巨噬细胞,从而可以通过神经基因的转染,使损伤处的神经细胞能持续、高效表达更多的相关生长因子,从而营造出一个良好的神经再生的微环境。
3.阳离子聚合物聚乙烯亚胺(pei),由于其具有良好的“质子海绵效应”,而能与基因治疗pdna具有很高的静电结合能力,是最具潜力的基因载体材料;但pei也具有细胞毒性,并且其毒性随着其分子量增大而增加。另一种阳离子聚合物,壳聚糖(cs)具有细胞毒性小、生物相容性好、无免疫原性等特点,但是cs的基因负载能力很低。因此,将低分子量的pei和高分子量的cs相结合,可以提高它们的基因负载率,并大大降低其细胞毒性,从而有望实现其良好的基因转染效率。而作为修饰的rgd短肽由精氨酸、甘氨酸和天冬氨酸组成,其存在于多种细胞外基质中,可与11种整合素特异性结合,能有效地促进细胞对生物材料的粘附,并能帮助基因载体微球穿膜而进入细胞内,从而也能进一步提高其基因转染效率。聚乳酸是一种无毒、具有良好的生物相容性的可降解高分子材料,但其亲水性不高,体内降解缓慢。丝素蛋白则是直接从蚕丝中提取的天然高分子蛋白,具有良好的亲水性、柔韧性与抗拉伸强度,在人体内可以快速降解,并且其可以作为蛋白或药物载体材料。使用这两种材料复合并用电纺方法制备的平行丝膜,可以作为组织修复的载体支架,其同时具有生物相容性好与亲水性高的特点,从而可以引导施万细胞和神经轴突更好地沿丝轴方向定向生长。
4.现阶段,神经修复支架已经取得一定的进展,如专利cn 107007882a公开了一种用于神经修复的多孔支架,但未能满足神经细胞取向铺展的生长条件;专利cn201911143177.6公开了一种神经修复支架的制备方法,通过赋予支架良好的导电性与神经组织形成微电流通路,能通过电信号促进受损神经的修复;专利cn202020495157.7公开的神经修复支架,通过镁金属管区两端的曲线设计,而避免修复支架对神经组织的牵拉和
二次伤害。在基因工程上,郭家松、杨云华、朱思品等人分别报道了nt
‑
3、心肌营养素(ct
‑
1)、成纤维细胞生长因子(fgf)等因子的基因修饰施万细胞、神经干细胞,能促进脊髓和脑部损伤组织的再生(中山大学博士学位论文,2003年;第三军医大学博士学位论文,2004;2015年浙江省骨科学学术年会);辛林伟、杜怀栋等人报道了一种胶质源性神经营养因子(gdnf)基因修饰的施万细胞复合在胶原
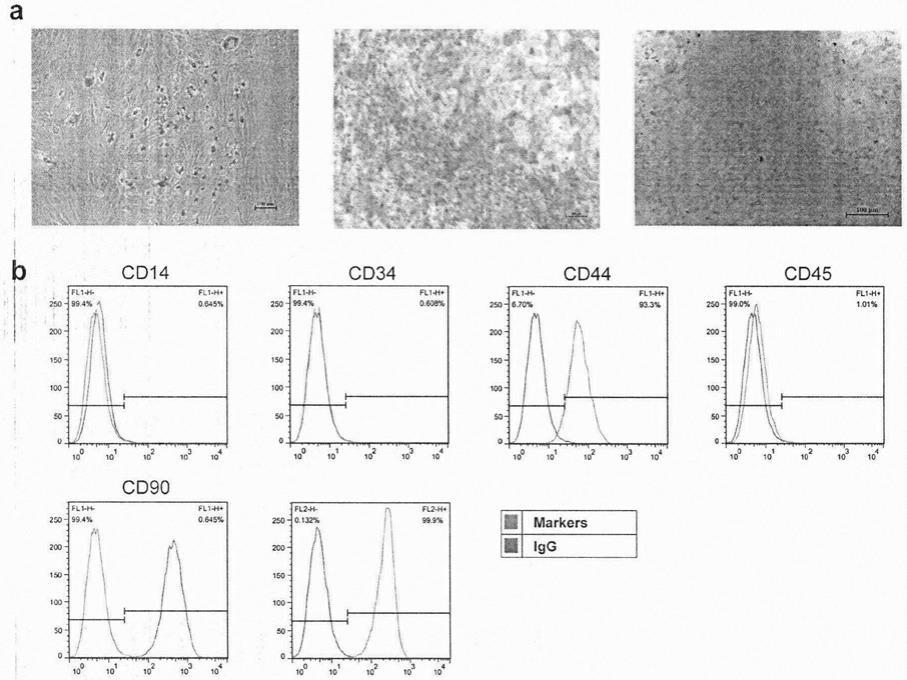
‑
壳聚糖神经支架或plga神经修复管中,桥接在动物体内能促进坐骨神经损伤的修复(中国医学科学院学报,2013,35,655
‑
661;复旦大学硕士学位论文,2006);类似地,张凤久也报道了脑源性神经营养因子bdnf基因修饰的施万细胞,粘附在壳聚糖神经支架中,具有良好的坐骨神经修复作用(内蒙古大学包头医学院硕士学位论文,2010年)。这些神经修复支架都是与已被一种神经因子转染的施万细胞或神经干细胞复合来修复坐骨神经,或者是一种神经因子基因转染的神经细胞直接注射到损伤处,来修复神经中枢神经;由于其引入了基因转染的异体细胞,仍然存在低生物相容性、免疫原性等问题,使其神经修复的能力依然不理想,且难以应用在临床修复治疗中。因此,开发一种具有良好临床中应用价值、能转染损伤处的施万细胞、负载神经修复支架上多种基因载体微球,从而促进细胞分泌神经因子和神经再生修复,是当前的一个研究重点。
技术实现要素:
5.为了弥补现有神经修复支架的技术缺陷,提高在受损神经处基因转染效率和神经因子的持续分泌,本专利提供了一种可进行神经基因治疗的神经修复支架,通过制备聚乳酸/丝素蛋白复合平行丝膜,引导神经定向生长;在此基础上,携带多种神经因子基因的载体微球,从而开发出兼具良好生物相容性和神经基因治疗效果的神经修复支架。
6.为实现上述目的,一方面,本发明提供了一种负载多种基因载体微球的神经修复支架,其由聚乙烯亚胺接枝壳聚糖分子链、rgd肽、多种神经因子的基因质粒、可降解电纺平行丝膜作为原料,经过碳二亚胺方法、静电吸引
‑
压缩成球、层层包覆技术,制备得到;所述负载多种基因载体微球的神经修复支架上的基因载体微球,为所述rgd肽修饰的聚乙烯亚胺接枝壳聚糖分子链分别与多种神经因子的基因质粒,通过静电吸附、压缩形成对应的载基因微球,其具有表面正电性、细胞靶向性和基因转染性;所述负载多种基因载体微球的神经修复支架体,为电纺平行丝膜,其具有表面负电性和可降解性;所述负载多种基因载体微球的神经修复支架,经手术植入在神经损伤处,经微球缓慢释放、穿膜进入神经细胞,并转染神经细胞而分泌相应的神经因子,从而促进神经损伤的再生修复。
7.另一方面,本发明提供如下技术方案。
8.a) cs
‑
g
‑
pei的制备:将壳聚糖(cs)溶解于乙酸溶液中,随后用naoh溶液将其沉淀出来;再将壳聚糖溶于二甲基亚砜中,并与马来酸酐溶液混合后,加热反应8~12h;用丙酮沉淀出反应物而得到马来酸化的壳聚糖;将马来酸化壳聚糖溶于naoh溶液中,加入pei(200
‑
20000 da)水溶液后,在40~80℃下反应6~36h,再于二次水中透析、真空干燥后得到pei
‑
g
‑
cs;最后,将产物溶于pbs中,用碳二亚胺方法在pei
‑
g
‑
cs的氨基上连接rgd肽。
9.b) 基因载体微球的制备:配制浓度在1~5 mg/ml的pei
‑
g
‑
cs
‑
rgd水溶液,随后逐滴加入神经因子基因质粒(pdna)分散液,直至溶液出现轻微乳光色,即得到通过静电吸附基因质粒并压缩形成的载体微球。
10.c) 电纺丝平行膜的制备:将聚乳酸和丝素蛋白以一定比例溶于六氟异丙醇中,作
为静电纺丝液;然后在11~15kv的电场下电纺丝,并用金属箔纸贴附的滚筒进行旋转收集,而得到贴附在金属箔纸上的平行丝膜;再经无水乙醇浸泡、真空干燥后,得到强化力学强度的电纺丝平行膜。
11.d)电纺平行丝膜的表面改性:将丝膜浸泡在多聚赖氨酸溶液中5~20min,干燥后再浸泡于聚谷氨酸溶液中0.5~4h,使电纺平行丝膜表面吸附两层带不同电荷、最外层为大量负电荷的聚谷氨酸分子链。
12.e)负载基因载体微球的神经修复支架的制备:将上述平行丝膜浸泡在一种基因载体微球分散液中0.5~3h,随后浸泡于聚谷氨酸溶液中0.5~4h;然后再将其浸泡于1~8mg/ml的第二种基因载体微球分散液中0.5~3h,随后再浸泡于聚谷氨酸溶液中0.5~4h;如此重复2~6次,干燥后再卷曲成管,即得到负载多种基因载体微球的神经修复支架。
13.作为本发明的进一步方案,步骤a)中,所用壳聚糖需经历溶解于乙酸、再沉淀析出的过程,壳聚糖与马来酸酐的摩尔比为2:1~6,且需在40~80℃下反应8~12h;壳聚糖上氨基与pei上亚胺基的摩尔比为2:1~4,且需在40~80℃下反应6~36h;cs
‑
g
‑
pei与rgd肽反应时的浓度分别为1~3 mg/ml和0.05~1.0 mg/ml。
14.作为本发明的进一步方案,步骤b)中,成球过程中,cs
‑
g
‑
pei的浓度为1~5 mg/ml,各种神经因子的基因质粒pdna悬浊液的浓度分别为0.01~1.0 mg/ml,pdna与材料的质量比为1:20~45。
15.作为本发明的进一步方案,步骤b)中,载体微球中的神经因子的基因质粒pdna种类包括,神经生长因子ngf、转录因子c
‑
jun、白介素1 il
‑
1、脑源性神经营养因子bdnf、胶质源性神经营养因子gdnf、捷状神经营养因子cntf、神经营养因子iii nt
‑
3的基因质粒;神经修复支架中可以负载其中一种基因载体微球,也可以同时负载其中2~6种基因质粒的载体微球。
16.作为本发明的进一步方案,步骤c)中,聚乳酸与丝素蛋白的质量比为1~6:1,两者溶于六氟异丙醇后的质量体积分数为6~15wt%,电纺的电场强度为11~15kv,电纺时间为1.5~3h,丝膜收集在贴附有金属箔的滚筒上,其转速为400~2000rpm;再将贴附在金属箔上的平行丝膜浸泡在无水乙醇5~30min,以提高丝膜轴向的力学强度。
17.作为本发明的进一步方案,步骤d)中,电纺平行丝膜先在浓度为0.01~0.5 mg/ml的聚赖氨酸溶液中浸泡5~20min,随后再于浓度为1~8 mg/ml的聚谷氨酸溶液中浸泡0.5~4h,使其最外层带有大量的聚谷氨酸负电荷。
18.作为本发明的进一步方案,步骤e)中,两种电荷分子链层层包覆且最外层为负电荷的电纺丝膜,先在1~8 mg/ml的一种基因载体微球分散液中浸泡0.5~3 h,再浸泡于浓度为1~8 mg/ml聚谷氨酸溶液中0.5~4 h;然后将其再浸泡于1~8 mg/ml的第二种基因载体微球分散液中0.5~3h;如此重复一至多次,干燥后再卷曲成管,得到负载多种基因载体微球的神经修复支架。
19.作为本发明的进一步方案,步骤e)中,两种电荷分子链层层包覆且最外层为负电荷的电纺丝膜,负载多种基因载体微球为,白介素1 il
‑
1、转录因子c
‑
jun 、ngf中的2~3种,再与神经营养因子iii nt
‑
3、脑源性神经营养因子bdnf、胶质源性神经营养因子gdnf、捷状神经营养因子cntf中的任意0~3种,从而组合为2~6种载体微球的神经修复支架。
20.作为本发明的进一步方案,步骤e)中,基因载体微球分散液中,白介素1 il
‑
1、转
录因子c
‑
jun 、ngf中的2~3种,再与神经营养因子iii nt
‑
3、脑源性神经营养因子bdnf、胶质源性神经营养因子gdnf、捷状神经营养因子cntf中的任意0~3种,组成的2~6种基因载体微球的质量比分别为1~4:1、1~4:1~2:1、1~4:1~2:1~2:1、1~4:1~2:1~2:1:1、1~4:1~2:1~2:1:1:1。
21.与现有技术相比,本发明的有益效果是:本发明制备得到的负载基因载体微球的电纺丝膜神经修复支架,具有良好的生物相容性,能良好地负载神经因子基因质粒,可用于长节段神经缺损的再生修复的基因治疗;而且本发明制备工艺简单,材料来源易得,成本低,可以作为理想的生物功能材料,在周围神经修复和脊髓神经修复领域具有良好的潜在应用价值。
附图说明
22.图1是基因载体微球制备过程示意图。
23.图2是负载多种基因载体微球的神经修复支架制备过程示意图。
24.图3是基因载体微球的透射电子显微镜照片。
25.图4是基因载体结合不同比例pdna后的核酸凝胶电泳照片。
26.图5是负载基因载体微球的电纺平行丝膜的扫描电子显微镜照片。
27.图6是生长在负载基因载体微球的电纺平行丝膜神经修复支架上的施万细胞的激光共聚焦显微镜照片。
具体实施方式
28.下面将结合本发明实施例,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
29.实施例1将壳聚糖(cs,6000da)溶于1%乙酸溶液中,再用0.1m的naoh溶液沉淀、收集、洗涤;将得到的壳聚糖溶解于二甲基亚砜中,并加入到含马来酸酐的二甲基亚砜中,调整壳聚糖上氨基与马来酸酐上羧基的摩尔比为2:1;在60℃下反应8h后,用丙酮沉产物淀出并干燥,得到马来酸化的壳聚糖;将马来酸化的壳聚糖溶于0.1m的naoh液中,加入聚乙烯亚胺(pei,600da)水溶液,调整壳聚糖与聚乙烯亚胺的物质的量之比为2:1,60℃下搅拌反应18h,随后用盐酸调节反应液ph值至7,并用二次水透析3天,冷冻干燥得到cs
‑
g
‑
pei;将cs
‑
g
‑
pei产物溶于pbs配制成2mg/ml溶液,通过碳二亚胺法偶联rgd肽;配制为浓度 2mg/ml的cs
‑
g
‑
pei
‑
rgd水溶液,再缓慢滴加一种神经因子的基因质粒pdna分散液,当pdna与材料的质量比为1:25时,溶液出现轻微乳光色即停止滴加,得到含pdna的基因载体微球;用这种方法分别制备含ngf、il
‑
1两种基因载体微球。
30.将聚乳酸和丝素蛋白以质量比2:1溶于六氟异丙醇中,配成质量体积分数为7.5wt%的纺丝液,在11kv的电场下电纺丝1.5h,将锡箔纸贴在收集滚筒上,调节滚筒速度为500rpm,收集平行丝膜在锡箔纸上;再浸泡丝膜于无水乙醇10min并常温干燥,得到强度提高的平行丝膜;将该平行丝膜浸泡在浓度为0.1 mg/ml的聚赖氨酸溶液中5min,随后再浸泡
于1 mg/ml聚谷氨酸溶液中0.5h,使丝膜表面带来大量的负电荷;再把平行丝膜浸泡在2 mg/ml的ngf基因载体微球分散液中1h,得到负载ngf基因载体微球的平行丝膜;然后把该丝膜浸泡于2 mg/ml聚谷氨酸溶液中1h后,再把其浸泡在2 mg/ml的il
‑
1基因载体微球分散液中1h,得到负载ngf、il
‑
1两种基因载体微球的平行丝膜;最后干燥、卷曲成管,即制得负载两种基因载体微球的神经修复支架。
31.实施例2将壳聚糖(cs,8000da)溶于1%乙酸溶液中,再用0.1m的naoh溶液沉淀、收集、洗涤;将得到的壳聚糖溶解于二甲基亚砜中,并加入到含马来酸酐的二甲基亚砜中,调整壳聚糖上氨基与马来酸酐上羧基的摩尔比为2:1;在60℃下反应8h后,用丙酮沉产物淀出并干燥,得到马来酸化的壳聚糖;将马来酸化的壳聚糖溶于0.1m的naoh液中,加入聚乙烯亚胺(pei,400da)水溶液,调整壳聚糖与聚乙烯亚胺的物质的量之比为2:1,60℃下搅拌反应18h,随后用盐酸调节反应液ph值至7,并用二次水透析3天,冷冻干燥得到cs
‑
g
‑
pei;将cs
‑
g
‑
pei产物溶于pbs配制成2mg/ml溶液,通过碳二亚胺法偶联rgd肽;配制为浓度 2mg/ml的cs
‑
g
‑
pei
‑
rgd水溶液,再缓慢滴加一种神经因子的基因质粒pdna分散液,当pdna与材料的质量比为1:25时,溶液出现轻微乳光色即停止滴加,得到含pdna的基因载体微球;用这种方法分别制备含ngf、il
‑
1、c
‑
jun三种基因载体微球。
32.将聚乳酸和丝素蛋白以质量比2:1溶于六氟异丙醇中,配成质量体积分数为8.0wt%的纺丝液,在10kv的电场下电纺丝1.5h,将锡箔纸贴在收集滚筒上,调节滚筒速度为700rpm,收集平行丝膜在锡箔纸上;再浸泡丝膜于无水乙醇10min并常温干燥,得到强度提高的平行丝膜;将该平行丝膜浸泡在浓度为0.1 mg/ml的聚赖氨酸溶液中5min,随后再浸泡于1 mg/ml聚谷氨酸溶液中0.5h,使丝膜表面带来大量的负电荷;再把平行丝膜浸泡在2 mg/ml的ngf基因载体微球分散液中1h,得到负载ngf基因载体微球的平行丝膜;然后把该丝膜浸泡于2 mg/ml聚谷氨酸溶液中1h后,再把其浸泡在2 mg/ml的il
‑
1基因载体微球分散液中1h;随后把该丝膜浸泡于2 mg/ml聚谷氨酸溶液中1h后,再把其浸泡在2 mg/ml的c
‑
jun基因载体微球分散液中1h,得到负载ngf、il
‑
1、c
‑
jun三种基因载体微球的平行丝膜;最后干燥、卷曲成管,即制得负载三种基因载体微球的神经修复支架。
33.实施例3将壳聚糖(cs,7000da)溶于1%乙酸溶液中,再用0.1m的naoh溶液沉淀、收集、洗涤;将得到的壳聚糖溶解于二甲基亚砜中,并加入到含马来酸酐的二甲基亚砜中,调整壳聚糖上氨基与马来酸酐上羧基的摩尔比为2:1;在60℃下反应8h后,用丙酮沉产物淀出并干燥,得到马来酸化的壳聚糖;将马来酸化的壳聚糖溶于0.1m的naoh液中,加入聚乙烯亚胺(pei,800da)水溶液,调整壳聚糖与聚乙烯亚胺的物质的量之比为2:1,60℃下搅拌反应15h,随后用盐酸调节反应液ph值至7,并用二次水透析3天,冷冻干燥得到cs
‑
g
‑
pei;将cs
‑
g
‑
pei产物溶于pbs配制成2mg/ml溶液,通过碳二亚胺法偶联rgd肽;配制为浓度 2mg/ml的cs
‑
g
‑
pei
‑
rgd水溶液,再缓慢滴加一种神经因子的基因质粒pdna分散液,当pdna与材料的质量比为1:25时,溶液出现轻微乳光色即停止滴加,得到含pdna的基因载体微球;用这种方法分别制备含ngf、il
‑
1、c
‑
jun、nt
‑
3四种基因载体微球。
34.将聚乳酸和丝素蛋白以质量比2:1溶于六氟异丙醇中,配成质量体积分数为8.0wt%的纺丝液,在10kv的电场下电纺丝1.5h,将锡箔纸贴在收集滚筒上,调节滚筒速度为
700rpm,收集平行丝膜在锡箔纸上;再浸泡丝膜于无水乙醇10min并常温干燥,得到强度提高的平行丝膜;将该平行丝膜浸泡在浓度为0.1 mg/ml的聚赖氨酸溶液中5min,随后再浸泡于1 mg/ml聚谷氨酸溶液中0.5h,使丝膜表面带来大量的负电荷;再把平行丝膜浸泡在2 mg/ml的ngf基因载体微球分散液中1h,得到负载ngf基因载体微球的平行丝膜;然后把该丝膜浸泡于2 mg/ml聚谷氨酸溶液中1h后,再把其浸泡在2 mg/ml的il
‑
1基因载体微球分散液中1h;随后把该丝膜浸泡于2 mg/ml聚谷氨酸溶液中1h后,再把其浸泡在2 mg/ml的c
‑
jun基因载体微球分散液中1h,其后把该丝膜浸泡于2 mg/ml聚谷氨酸溶液中1h后,再把其浸泡在2 mg/ml的nt
‑
3基因载体微球分散液中1h,得到负载ngf、il
‑
1、c
‑
jun、nt
‑
3四种基因载体微球的平行丝膜;最后干燥、卷曲成管,即制得负载四种基因载体微球的神经修复支架。
35.实施例4将壳聚糖(cs,7000da)溶于1%乙酸溶液中,再用0.1m的naoh溶液沉淀、收集、洗涤;将得到的壳聚糖溶解于二甲基亚砜中,并加入到含马来酸酐的二甲基亚砜中,调整壳聚糖上氨基与马来酸酐上羧基的摩尔比为2:1;在60℃下反应8h后,用丙酮沉产物淀出并干燥,得到马来酸化的壳聚糖;将马来酸化的壳聚糖溶于0.1m的naoh液中,加入聚乙烯亚胺(pei,800da)水溶液,调整壳聚糖与聚乙烯亚胺的物质的量之比为2:1,60℃下搅拌反应18h,随后用盐酸调节反应液ph值至7,并用二次水透析3天,冷冻干燥得到cs
‑
g
‑
pei;将cs
‑
g
‑
pei产物溶于pbs配制成2mg/ml溶液,通过碳二亚胺法偶联rgd肽;配制为浓度 2mg/ml的cs
‑
g
‑
pei
‑
rgd水溶液,再缓慢滴加一种神经因子的基因质粒pdna分散液,当pdna与材料的质量比为1:25时,溶液出现轻微乳光色即停止滴加,得到含pdna的基因载体微球;用这种方法分别制备含ngf、il
‑
1、c
‑
jun、nt
‑
3、bdnt五种基因载体微球。
36.将聚乳酸和丝素蛋白以质量比2:1溶于六氟异丙醇中,配成质量体积分数为8.0wt%的纺丝液,在10kv的电场下电纺丝1.5h,将锡箔纸贴在收集滚筒上,调节滚筒速度为700rpm,收集平行丝膜在锡箔纸上;再浸泡丝膜于无水乙醇10min并常温干燥,得到强度提高的平行丝膜;将该平行丝膜浸泡在浓度为0.1 mg/ml的聚赖氨酸溶液中5min,随后再浸泡于1 mg/ml聚谷氨酸溶液中0.5h,使丝膜表面带来大量的负电荷;再把平行丝膜浸泡在2 mg/ml的ngf基因载体微球分散液中1h,得到负载ngf基因载体微球的平行丝膜;然后把该丝膜浸泡于2 mg/ml聚谷氨酸溶液中1h后,再把其浸泡在2 mg/ml的il
‑
1基因载体微球分散液中1h;随后把该丝膜浸泡于2 mg/ml聚谷氨酸溶液中1h后,再把其浸泡在2 mg/ml的c
‑
jun基因载体微球分散液中1h,其后把该丝膜浸泡于2 mg/ml聚谷氨酸溶液中1h后,再把其浸泡在2 mg/ml的nt
‑
3基因载体微球分散液中1h,最后把该丝膜浸泡于2 mg/ml聚谷氨酸溶液中1h后,再把其浸泡在2 mg/ml的bdnf基因载体微球分散液中1h,得到负载ngf、il
‑
1、c
‑
jun、nt
‑
3、bdnt五种基因载体微球的平行丝膜;最后干燥、卷曲成管,即制得负载五种基因载体微球的神经修复支架。
37.实施例5将壳聚糖(cs,10000da)溶于1%乙酸溶液中,再用0.1m的naoh溶液沉淀、收集、洗涤;将得到的壳聚糖溶解于二甲基亚砜中,并加入到含马来酸酐的二甲基亚砜中,调整壳聚糖上氨基与马来酸酐上羧基的摩尔比为2:1;在60℃下反应8h后,用丙酮沉产物淀出并干燥,得到马来酸化的壳聚糖;将马来酸化的壳聚糖溶于0.1m的naoh液中,加入聚乙烯亚胺(pei,800da)水溶液,调整壳聚糖与聚乙烯亚胺的物质的量之比为2:1,60℃下搅拌反应
18h,随后用盐酸调节反应液ph值至7,并用二次水透析3天,冷冻干燥得到cs
‑
g
‑
pei;将cs
‑
g
‑
pei产物溶于pbs配制成2mg/ml溶液,通过碳二亚胺法偶联rgd肽;配制为浓度 2mg/ml的cs
‑
g
‑
pei
‑
rgd水溶液,再缓慢滴加一种神经因子的基因质粒pdna分散液,当pdna与材料的质量比为1:25时,溶液出现轻微乳光色即停止滴加,得到含pdna的基因载体微球;用这种方法分别制备含ngf、il
‑
1、c
‑
jun、nt
‑
3、bdnf、gdnf六种基因载体微球。
38.将聚乳酸和丝素蛋白以质量比2:1溶于六氟异丙醇中,配成质量体积分数为8.0wt%的纺丝液,在10kv的电场下电纺丝1.5h,将锡箔纸贴在收集滚筒上,调节滚筒速度为700rpm,收集平行丝膜在锡箔纸上;再浸泡丝膜于无水乙醇10min并常温干燥,得到强度提高的平行丝膜;将该平行丝膜浸泡在浓度为0.1 mg/ml的聚赖氨酸溶液中5min,随后再浸泡于1 mg/ml聚谷氨酸溶液中0.5h,使丝膜表面带来大量的负电荷;再把平行丝膜浸泡在2 mg/ml的ngf基因载体微球分散液中1h,得到负载ngf基因载体微球的平行丝膜;然后把该丝膜浸泡于2 mg/ml聚谷氨酸溶液中1h后,再把其浸泡在2 mg/ml的il
‑
1基因载体微球分散液中1h;随后把该丝膜浸泡于2 mg/ml聚谷氨酸溶液中1h后,再把其浸泡在2 mg/ml的c
‑
jun基因载体微球分散液中1h,其后把该丝膜浸泡于2 mg/ml聚谷氨酸溶液中1h后,再把其浸泡在2 mg/ml的nt
‑
3基因载体微球分散液中1h,再后把该丝膜浸泡于2 mg/ml聚谷氨酸溶液中1h后,再把其浸泡在2 mg/ml的bdnf基因载体微球分散液中1h,最后把该丝膜浸泡于2 mg/ml聚谷氨酸溶液中1h后,再把其浸泡在2 mg/ml的gdnf基因载体微球分散液中1h,得到负载ngf、il
‑
1、c
‑
jun、nt
‑
3、bdnf、gdnf六种基因载体微球的平行丝膜;最后干燥、卷曲成管,即制得负载六种基因载体微球的神经修复支架。
39.实施例6将壳聚糖(cs,10000da)溶于1%乙酸溶液中,再用0.1m的naoh溶液沉淀、收集、洗涤;将得到的壳聚糖溶解于二甲基亚砜中,并加入到含马来酸酐的二甲基亚砜中,调整壳聚糖上氨基与马来酸酐上羧基的摩尔比为2:1;在60℃下反应8h后,用丙酮沉产物淀出并干燥,得到马来酸化的壳聚糖;将马来酸化的壳聚糖溶于0.1m的naoh液中,加入聚乙烯亚胺(pei,800da)水溶液,调整壳聚糖与聚乙烯亚胺的物质的量之比为2:1,60℃下搅拌反应18h,随后用盐酸调节反应液ph值至7,并用二次水透析3天,冷冻干燥得到cs
‑
g
‑
pei;将cs
‑
g
‑
pei产物溶于pbs配制成2mg/ml溶液,通过碳二亚胺法偶联rgd肽;配制为浓度 2mg/ml的cs
‑
g
‑
pei
‑
rgd水溶液,再缓慢滴加一种神经因子的基因质粒pdna分散液,当pdna与材料的质量比为1:25时,溶液出现轻微乳光色即停止滴加,得到含pdna的基因载体微球;用这种方法分别制备含ngf、il
‑
1、c
‑
jun、nt
‑
3、bdnf、cntf六种基因载体微球。
40.将聚乳酸和丝素蛋白以质量比2:1溶于六氟异丙醇中,配成质量体积分数为8.0wt%的纺丝液,在10kv的电场下电纺丝1.5h,将锡箔纸贴在收集滚筒上,调节滚筒速度为700rpm,收集平行丝膜在锡箔纸上;再浸泡丝膜于无水乙醇10min并常温干燥,得到强度提高的平行丝膜;将该平行丝膜浸泡在浓度为0.1 mg/ml的聚赖氨酸溶液中5min,随后再浸泡于1 mg/ml聚谷氨酸溶液中0.5h,使丝膜表面带来大量的负电荷;再把平行丝膜浸泡在2 mg/ml的ngf基因载体微球分散液中1h,得到负载ngf基因载体微球的平行丝膜;然后把该丝膜浸泡于2 mg/ml聚谷氨酸溶液中1h后,再把其浸泡在2 mg/ml的il
‑
1基因载体微球分散液中1h;随后把该丝膜浸泡于2 mg/ml聚谷氨酸溶液中1h后,再把其浸泡在2 mg/ml的c
‑
jun基因载体微球分散液中1h,其后把该丝膜浸泡于2 mg/ml聚谷氨酸溶液中1h后,再把其浸泡在
2 mg/ml的nt
‑
3基因载体微球分散液中1h,再后把该丝膜浸泡于2 mg/ml聚谷氨酸溶液中1h后,再把其浸泡在2 mg/ml的bdnf基因载体微球分散液中1h,最后把该丝膜浸泡于2 mg/ml聚谷氨酸溶液中1h后,再把其浸泡在2 mg/ml的cntf基因载体微球分散液中1h,得到负载ngf、il
‑
1、c
‑
jun、nt
‑
3、bdnf、cntf六种基因载体微球的平行丝膜;最后干燥、卷曲成管,即制得负载六种基因载体微球的神经修复支架。
41.图1是基因载体微球制备过程示意图;用碳二亚胺法使pei与马来酸马来酸化的cs反应,而形成pei
‑
g
‑
cs,再用碳二亚胺法将rgd肽连接在pei
‑
g
‑
cs链上,分别缓慢滴加各种神经因子的基因质粒悬浊液(pdna),即得到含对应神经因子基因的载体微球。
42.图2是负载多种基因载体微球的神经修复支架制备过程示意图;将收集在金属箔纸上的电纺平行丝膜,浸泡于无水乙醇中、再干燥得到强度提高的平行丝膜;用聚谷氨酸溶液浸泡电纺丝膜,其表层带有大量的负电荷;用带正电荷的基因载体微球分散液浸泡上述电纺平行丝膜,使其负载一种基因载体微球,再先后聚谷氨酸溶液、第二种基因载体微球分散液浸泡,使其负载第二种基因载体微球;如此重复多次、再卷曲成管,得到负载多种基因载体微球的神经修复支架。
43.图3是基因载体微球的透射电子显微镜照片;可清楚看见,所制备的基因载体微粒为直径在50
‑
200nm的球形。
44.图4是基因载体结合不同比例pdna后的核酸凝胶电泳照片;当cs
‑
pei与dna的质量比于2时,凝胶中可观察到清晰的pdna带;当cs
‑
pei与dna的质量比为0.5或1时,凝胶中无条带产生,即pdna全部停留在点样孔中;这些结果表明,当cs
‑
pei的添加量在dna的2倍及以上时,cs
‑
pei能完全结合pdna,而静电压缩、形成紧密的基因载体微球。
45.图5是负载基因载体微球的电纺平行丝膜的扫描电子显微镜照片;直径约为0.5~1.0微米的电纺丝大多平行排列,白色箭头指示了丝表面吸附有许多直径约为0.1微米的基因载体微球。
46.图6是生长在负载基因载体微球的电纺平行丝膜神经修复支架上的施万细胞的激光共聚焦显微镜照片;灰色箭头指示了荧光染色的细胞核;白色箭头指示了,使用支架上负载有一种蛋白基因质粒载体微球成功转染后细胞、表达的对应蛋白。
47.本发明不限于上述示范性实施例的细节,而且在不背离本发明的精神或基本特征的情况下,能够以其他的具体形式实现本发明。实施例是示范性的,而且是非限制性的,本发明的范围由所附权利要求而不是上述说明限定,因此旨在将落在权利要求的等同要件的含义和范围内的所有变化囊括在本发明内。此外,应当理解,虽然本说明书按照实施方式加以描述,但并非每个实施方式仅包含一个独立的技术方案,说明书的这种叙述方式仅仅是为清楚起见,本领域技术人员应当将说明书作为一个整体,各实施例中的技术方案也可以经适当组合,形成本领域技术人员可以理解的其他实施方式。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。