和厚朴酚在制备抑制pd
‑
l1表达的药物中的应用
技术领域
1.本发明属于医药技术领域,具体涉及和厚朴酚在制备抑制pd
‑
l1表达的药物中的应用。
背景技术:
2.肺癌是世界范围内发病率和死亡率最高的恶性肿瘤之一。非小细胞肺癌约占原发性肺癌的80~85%,肺腺癌是非小细胞肺癌最常见的一种亚型。近年来,肺腺癌的治疗手段不断取得进展,但是肺腺癌患者的整体5年生存率并未明显提高。大多数肺腺癌患者在确诊时已处于晚期,且对放化疗等保守治疗方式不敏感,分子靶标治疗又易产生耐药而失去了手术机会。研究肺腺癌发展的分子机制,寻找新的分子靶标,仍然是肺腺癌治疗的重点。
3.近年来,肿瘤免疫治疗,尤其是免疫检查点抑制剂的出现为晚期肺腺癌患者带来新的希望。pd
‑
1(程序性死亡受体1)主要表达于激活的t细胞表面,pd
‑
l1(程序性死亡配体1)是pd
‑
1的配体,在正常情况下pd
‑
l1与t细胞表面的pd
‑
1结合,从而抑制t细胞激活,以避免因t细胞过度激活而引起自身免疫病。因此,pd
‑
1/pd
‑
l1通路对于维持机体保护性免疫和免疫耐受平衡是至关重要的。然而,肿瘤细胞在其进化过程中选择性高表达pd
‑
l1,与浸润到肿瘤中活化的t细胞表面的pd
‑
1结合,pd
‑
l1诱导抑制信号,使t细胞丧失抗肿瘤活性,从而实现肿瘤免疫逃逸。pd
‑
1和pd
‑
l1抗体药物可特异性地阻断pd
‑
1与pd
‑
l1的结合,重新激活t细胞,以恢复其的肿瘤杀伤作用。fda批准多种针对pd
‑
1和pd
‑
l1的单抗上市,在肿瘤免疫治疗中取得了巨大成功。然而,pd
‑
1和pd
‑
l1抗体并非对每一个患者都有效,临床试验结果显示,仅有10%~30%的患者能够从pd
‑
1和pd
‑
l1单抗治疗中获益,加之治疗费用高,且治疗周期长,若治疗无效,患者将丧失及时接受其他治疗的时机,更重要的是,免疫治疗带来的不良反应也不容忽视。
4.中药来源的小分子化合物具有种类繁多、结构新颖、多靶点、毒副作用小、生物活性多样化等特点,其对疾病的治疗具有广泛的作用,同时也是新药研发的重要来源。目前已有文献报道显示和厚朴酚明显上调抑癌基因sirt3的表达以及抑制egfr突变,从而抑制肺癌细胞的增殖。然而,和厚朴酚在免疫方面的研究还比较少,在调控pd
‑
l1介导的肿瘤免疫逃逸方面的研究尚未有报道。
技术实现要素:
5.本发明第一方面的目的,在于提供和厚朴酚或其药学上可接受的盐在制备pd
‑
l1抑制剂中的应用。
6.本发明第二方面的目的,在于提供和厚朴酚或其药学上可接受的盐在制备抑制肿瘤细胞增殖的药物中的应用。
7.本发明第三方面的目的,在于提供和厚朴酚或其药学上可接受的盐在制备增加肿瘤浸润淋巴细胞中cd4
t细胞和cd8
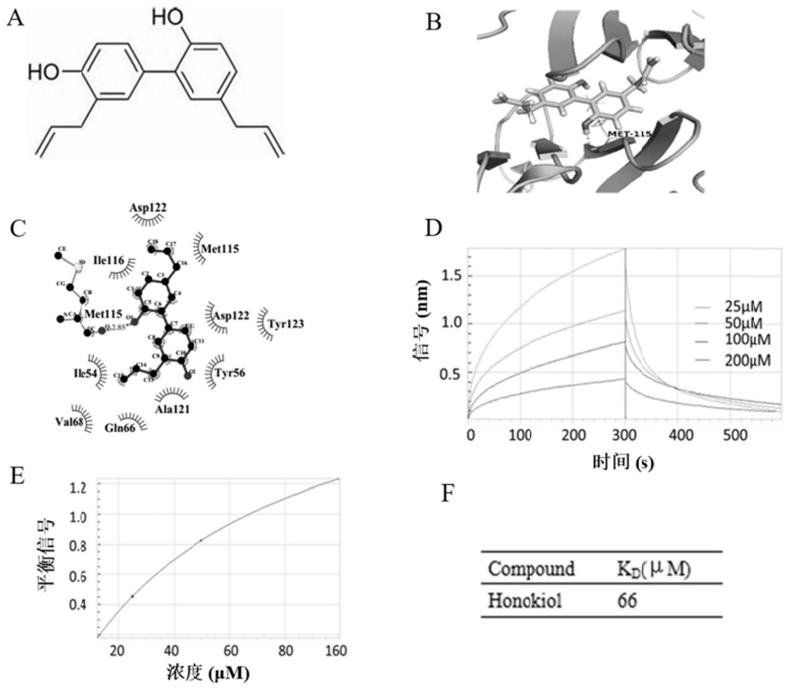
t细胞数量的药物中的应用。
8.本发明第四方面的目的,在于提供和厚朴酚或其药学上可接受的盐在制备抑制肿
瘤体积增大的药物中的应用。
9.本发明第五方面的目的,在于提供和厚朴酚或其药学上可接受的盐在制备抗肿瘤药物中的应用。
10.本发明第六方面的目的,在于提供一种抑制pd
‑
l1表达的药物。
11.为了实现上述目的,本发明所采取的技术方案是:
12.本发明的第一个方面,提供和厚朴酚或其药学上可接受的盐在制备pd
‑
l1抑制剂中的应用。
13.优选地,所述pd
‑
l1抑制剂为抑制肿瘤pd
‑
l1表达的试剂。
14.进一步优选地,所述pd
‑
l1抑制剂为抑制肿瘤pd
‑
l1蛋白表达的试剂。
15.进一步优选地,所述pd
‑
l1抑制剂为抑制肿瘤pd
‑
l1基因表达的试剂。
16.优选地,所述pd
‑
l1抑制剂为抑制干扰素诱导的肿瘤pd
‑
l1表达上调的试剂。
17.优选地,所述干扰素为ifn
‑
α、ifn
‑
β和ifn
‑
γ中的至少一种。
18.优选地,所述肿瘤选自乳腺癌、肺癌和肝癌中的至少一种。
19.进一步优选地,所述肿瘤选自肺癌。
20.更进一步优选地,所述肿瘤选自非小细胞肺癌。
21.优选地,所述和厚朴酚或其药学上可接受的盐的浓度为5~40μm。
22.进一步优选地,所述和厚朴酚或其药学上可接受的盐的浓度为10~40μm。
23.更进一步优选地,所述和厚朴酚或其药学上可接受的盐的浓度为20~30μm。
24.本发明的第二个方面,提供和厚朴酚或其药学上可接受的盐在制备抑制肿瘤细胞增殖的药物中的应用。
25.优选地,所述肿瘤选自乳腺癌、肺癌和肝癌中的至少一种。
26.进一步优选地,所述肿瘤选自肺癌。
27.更进一步优选地,所述肿瘤选自非小细胞肺癌。
28.优选地,所述和厚朴酚或其药学上可接受的盐的浓度为5~40μm。
29.进一步优选地,所述和厚朴酚或其药学上可接受的盐的浓度为10~40μm。
30.更进一步优选地,所述和厚朴酚或其药学上可接受的盐的浓度为20~30μm。
31.本发明的第三个方面,提供和厚朴酚或其药学上可接受的盐在制备增加肿瘤浸润淋巴细胞中cd4
t细胞和cd8
t细胞数量的药物中的应用。
32.优选地,所述肿瘤选自乳腺癌、肺癌和肝癌中的至少一种。
33.进一步优选地,所述肿瘤选自肺癌。
34.更进一步优选地,所述肿瘤选自非小细胞肺癌。
35.优选地,所述和厚朴酚或其药学上可接受的盐的浓度为5~40μm。
36.进一步优选地,所述和厚朴酚或其药学上可接受的盐的浓度为10~40μm。
37.更进一步优选地,所述和厚朴酚或其药学上可接受的盐的浓度为20~30μm。
38.本发明的第四个方面,提供和厚朴酚或其药学上可接受的盐在制备抑制肿瘤体积增大的药物中的应用。
39.优选地,所述肿瘤选自乳腺癌、肺癌和肝癌中的至少一种。
40.进一步优选地,所述肿瘤选自肺癌。
41.更进一步优选地,所述肿瘤选自非小细胞肺癌。
42.优选地,所述和厚朴酚或其药学上可接受的盐的浓度为5~40μm。
43.进一步优选地,所述和厚朴酚或其药学上可接受的盐的浓度为10~40μm。
44.更进一步优选地,所述和厚朴酚或其药学上可接受的盐的浓度为20~30μm。
45.本发明的第五个方面,提供和厚朴酚或其药学上可接受的盐在制备抗肿瘤药物中的应用。
46.优选地,所述肿瘤选自乳腺癌、肺癌和肝癌中的至少一种。
47.进一步优选地,所述肿瘤选自肺癌。
48.更进一步优选地,所述肿瘤选自非小细胞肺癌。
49.优选地,所述和厚朴酚或其药学上可接受的盐的浓度为5~40μm。
50.进一步优选地,所述和厚朴酚或其药学上可接受的盐的浓度为10~40μm。
51.更进一步优选地,所述和厚朴酚或其药学上可接受的盐的浓度为20~30μm。
52.本发明的第六个方面,提供一种抑制pd
‑
l1表达的药物,包括和厚朴酚或其药学上可接受的盐。
53.优选地,所述药物为抑制pd
‑
l1蛋白表达的药物。
54.优选地,所述药物为抑制pd
‑
l1基因表达的药物。
55.优选地,所述和厚朴酚或其药学上可接受的盐的浓度为5~40μm。
56.进一步优选地,所述和厚朴酚或其药学上可接受的盐的浓度为10~40μm。
57.更进一步优选地,所述和厚朴酚或其药学上可接受的盐的浓度为20~30μm。
58.优选地,所述药物的剂型形式包括液体制剂、颗粒剂、缓释剂、冲剂、片剂和胶丸中的至少一种。
59.本发明的有益效果是:本发明提供的天然小分子化合物和厚朴酚或其药学上可接受的盐可以剂量性抑制pd
‑
l1蛋白表达水平,抑制pd
‑
l1的rna转录水平;本发明提供的和厚朴酚或其药学上可接受的盐还可抑制肿瘤细胞的增殖,显著增加肿瘤浸润淋巴细胞中cd4
t细胞和cd8
t细胞数量,有效抑制裸鼠移植瘤体积的增大;本发明提供的和厚朴酚能够作为小分子药物应用于非小细胞肺癌的治疗。
附图说明
60.图1为和厚朴酚与pd
‑
l1分子对接结果图;其中,a为和厚朴酚的2d结构式;b为和厚朴酚与pd
‑
l1的对接模式展示图;c为和厚朴酚与pd
‑
l1蛋白中部分氨基酸残基的相互作用结果图;d为不同浓度的和厚朴酚与固定化pd
‑
l1蛋白的结合曲线;e为结合曲线的稳态分析结果图;f为pd
‑
l1与和厚朴酚的结合亲和力测定结果图。
61.图2为蛋白免疫印迹结果图;其中,a为对照组各细胞pd
‑
l1蛋白表达结果图;b为和厚朴酚对h358和h460细胞pd
‑
l1蛋白表达的影响结果图;c为30μm厚朴酚对h358和h460细胞pd
‑
l1 mrna表达的影响结果图;图中***表示p<0.001。
62.图3为和厚朴酚对h1975细胞pd
‑
l1表达的影响图;其中,a为不同剂量的和厚朴酚对h1975细胞pd
‑
l1表达影响的流式细胞图;b为不同剂量的和厚朴酚对h1975细胞pd
‑
l1表达影响的统计结果图;图中**表示p<0.01,***表示p<0.001。
63.图4为和厚朴酚对h358细胞pd
‑
l1表达的影响图;其中,a为不同剂量的和厚朴酚对h358细胞pd
‑
l1表达影响的流式细胞图;b为不同剂量的和厚朴酚对h358细胞pd
‑
l1表达影
响的统计结果图;图中***表示p<0.001。
64.图5为和厚朴酚对ifn
‑
γ刺激h1975细胞pd
‑
l1表达上调的影响图;其中,a为和厚朴酚对ifn
‑
γ刺激h1975细胞pd
‑
l1表达上调影响的流式细胞图;b为和厚朴酚对ifn
‑
γ刺激h1975细胞pd
‑
l1表达上调影响的统计结果图;图中***表示p<0.001。
65.图6为和厚朴酚对ifn
‑
γ刺激h358细胞pd
‑
l1表达上调的影响图;其中,a为和厚朴酚对ifn
‑
γ刺激h358细胞pd
‑
l1表达上调影响的流式细胞图;b为和厚朴酚对ifn
‑
γ刺激h358细胞pd
‑
l1表达上调影响的统计结果图;图中***表示p<0.0001。
66.图7为裸鼠异种移植模型结果图;其中,a为裸鼠异种移植实验中小鼠肿瘤体积随时间变化的结果图;b为裸鼠异种移植实验中小鼠肿瘤活体成像图;c为裸鼠异种移植实验中小鼠肿瘤体积实拍图;d为裸鼠异种移植实验中小鼠肿瘤的重量结果图;图中**表示p<0.01。
67.图8为裸鼠异种移植实验中小鼠肿瘤he染色及免疫组化结果图。
68.图9为裸鼠异种移植实验中小鼠肿瘤组织免疫荧光结果图。
69.图10为裸鼠异种移植实验中小鼠肿瘤细胞流式分选结果图;其中,a为小鼠肿瘤浸润淋巴细胞流式分选结果图;b为小鼠肿瘤浸润淋巴细胞流式分选的统计结果图;图中*表示p<0.05,**表示p<0.01。
具体实施方式
70.现结合具体实施例对本发明进行详细说明,但不限制本发明的范围。
71.本实施例中所使用的材料、试剂等,如无特别说明,为从商业途径得到的材料和试剂。其中,普通ripa裂解液(组织/细胞)购自solarbio,货号为r0020;5
×
sds上样缓冲液购买自beyotime biotechnology,货号为p0286;gapdh购买自sangon biotech,货号为d110016;anti
‑
rabbit igg,hrp
‑
linked antibody(抗兔二抗,hrp标记)购买自cell signaling technology,货号为7074s;ecl发光试剂盒购买自beyotime biotechnology,货号p0018fs;rna提取试剂盒购买自天根生化科技(北京)有限公司,货号为dp430;逆转录试剂盒购买自南京诺唯赞生物科技股份有限公司,货号为r123
‑
01;2
×
one stepgreen mix购买自南京诺唯赞生物科技有限公司,货号为q221
‑
01;llc
‑
luc购买自湖南丰晖生物科技有限公司,货号为cl0720;多聚甲醛购买自sangon biotech,货号为a500684;柠檬酸钠抗原修复液购买自solarbio,货号为c1032;hrp标记的抗兔小鼠购买自sangon biotech,货号为d601037;二氨基联苯胺显色剂购买自sangon biotech,货号为d601037;荧光二抗购买自thermo fisher scientific,货号为35552;cd4购买自abcam,货号为ab183685;cd8购买自abcam,货号为ab217344;胶原酶iv购买自invitrogen,货号为17104019;dnase i购买自invitrogen,货号为18047019;fitc anti
‑
mouse cd4购买自biolegend,货号为100203;pe anti
‑
mouse cd8购买自biolegend,货号为100707。
72.实施例1分子对接和生物膜干涉技术
73.1.分子对接
74.pd
‑
l1(pdb id:4zqk)的3d晶体结构从rcsb pdb数据库(https://www1.rcsb.org/)中获取,其次和厚朴酚的结构文件从pubchem数据库(https://pubchem.ncbi.nlm.nih.gov/)中获取,通过pymol2.3去除pd
‑
l1原有的水分子和配体,用
chemdraw19.0软件使厚朴酚能量最小化,最后使用autodock基于pd
‑
l1的tyr56、met115、ala121、tyr123、gln66、arg125、lys124来进行对接,最后使用pymol2.3展示出对接后复合物的模式和ligplot2.2展示和厚朴酚和pd
‑
l1残基的相互作用。
75.和厚朴酚的2d结构式展示在图1中a,和厚朴酚与pd
‑
l1的对接模式展示在图1中b,其中和厚朴酚的羟基与met
‑
115形成了氢键相互作用,其他主体部分则位于疏水口袋中,和厚朴酚与met
‑
115形成的氢键相互作用键长为2.85a,同时与位点的其他残基asp
‑
122、ala
‑
121、tyr
‑
56等形成了疏水作用(图1中c),表明和厚朴酚与pd
‑
l1蛋白的相互作用以氢键相互作用为主,并以疏水相互作用锁定结合取向。
76.2.生物膜干涉技术
77.采用生物膜干涉技术(biolayer interferometry,bli)检测和厚朴酚跟pd
‑
l1之间的分子相互作用,bli设备为pall fortebio公司生产的octet red96系统。具体的实验过程如下:经过平衡(300s)、结合(600s)、解离(180s)和平衡(300s)四个步骤将10μg pd
‑
l1蛋白(购买自r&d systems,货号为156
‑
b7
‑
100)固定于sa传感器上;使用ph6.5的pbs将和厚朴酚配置成为200μm储液,并将储液用pbs稀释成为200μm、100μm、50μm、25μm浓度梯度,将不同浓度的和厚朴酚结合在标记有pd
‑
l1的传感器上,同样经过平衡(300s)、结合(600s)、解离(180s)和平衡(300s)四个步骤得到响应值,实时收集数据,利用fortebio date analysis软件进行数据分析,计算kd值。
78.通过利用生物膜干涉技术对和厚朴酚与pd
‑
l1的相互作用进行检测,不同浓度(200μm、100μm、50μm、25μm)的和厚朴酚与固定化pd
‑
l1蛋白的结合曲线如图1中d所示,随着和厚朴酚浓度的的升高,结合信号逐渐降低,具有浓度梯度依赖性,表明了不同和厚朴酚浓度下的抑制作用。图1中e为和厚朴酚与固定化pd
‑
l1蛋白结合曲线的稳态分析,图1中f为pd
‑
l1与和厚朴酚的结合亲和力(kd)测定结果,表明pd
‑
l1与和厚朴酚的结合亲和力常数(kd)为60μm。
79.实施例2和厚朴酚对肺癌肿瘤细胞pd
‑
l1表达的影响
80.1.细胞培养
81.选用6种稳定的人非小细胞肺癌细胞株h1975(细胞株编号:crl
‑
5908)、h1650(细胞株编号:crl
‑
5883)、h460(细胞株编号:htb
‑
177)、h1299(细胞株编号:crl
‑
5803)、h358(细胞株编号:crl
‑
5807)和a549(细胞株编号:ccl
‑
185)以及1种人正常肺上皮细胞beas
‑
2b(细胞株编号:crl
‑
9609)(所用细胞菌株均购买自美国菌种保藏中心)分别进行培养,待细胞进入对数生长期后,用0.25%胰酶消化后,按细胞数5
×
104密度平均分入直径为6cm细胞培养皿中,每个培养皿加入3ml rpmi
‑
1640培养基(含10%已灭活的小牛血清,100u/l青
‑
链霉素),置于恒温培养箱(37℃,5%co2)中培养。待细胞完全贴壁后,将上述细胞株分别分为对照组(不加和厚朴酚)和厚朴酚(honokiol)处理组(和厚朴酚的作用剂量分别为0μm、10μm、20μm、30μm),3个平行,继续培养24h,待用。
82.2.蛋白免疫印迹
83.1)蛋白样品的制备:收集培养24h后的对照组细胞,加入普通ripa裂解液(组织/细胞)裂解各细胞株,提取各细胞株的总蛋白;
84.2)蛋白变性:取20μl总蛋白样品分别加入到离心管中,加入5μl 5
×
sds上样缓冲液,煮沸5min;
85.3)分别取20μg煮沸后的总蛋白样品以及1μlmaker(购买自sangon biotech,货号为c510010,分子量为10~180kd)进行sds
‑
page凝胶电泳(分离胶10%、浓缩胶5%);
86.4)待电泳停止,将凝胶上的蛋白样品转印至甲醇浸泡的pvdf膜上;
87.5)将转印好的pvdf膜浸入5%bsa中室温封闭1h;
88.6)一抗杂交:将封闭后的pvdf膜浸入一抗(pd
‑
l1或gapdh,gapdh为内参蛋白,pd
‑
l1购买自abclonal,货号为a1645)工作液(用5%bsa 1:1000配制)中,4℃孵育12小时,取出pvdf膜,在tbst中清洗3次,每次5min;
89.(7)二抗孵育:将pvdf膜浸入酶标二抗(anti
‑
rabbit igg,hrp
‑
linked antibody)溶液(用5%bsa 1:2000配制)中,室温孵育1小时,在tbst中清洗3次,每次5min;
90.8)利用ecl发光试剂盒检测。
91.通过检测人非小细胞肺癌细胞h1975、h1650、h460、h1299、h358、a549以及人正常肺上皮细胞besa
‑
2b中pd
‑
l1蛋白表达,结果如图2中a所示,对比人正常肺上皮细胞beas
‑
2b中pd
‑
l1蛋白表达情况,h1975、h460、h358细胞呈现pd
‑
l1蛋白强表达,而h1299细胞和a549细胞呈现pd
‑
l1蛋白弱表达。
92.选择pd
‑
l1蛋白强表达的细胞株(h358细胞和h460细胞)的和厚朴酚处理组(和厚朴酚作用剂量为30μm)的细胞重复上述实验(蛋白免疫印迹),测试和厚朴酚对肿瘤细胞pd
‑
l1表达的影响,结果如图2中b所示,处理组h358细胞和h460细胞中pd
‑
l1表达下调,表明和厚朴酚可以抑制h358细胞和h460细胞中pd
‑
l1表达,尤其是对h460细胞的pd
‑
l1表达有较强的抑制效果。
93.3.qpcr检测
94.利用qpcr测定和厚朴酚对h460细胞和h358细胞pd
‑
l1基因转录的影响,具体步骤如下:
95.1)总rna提取(按rna提取试剂盒说明书进行)
96.将对照组h460细胞、h358细胞和和厚朴酚处理组(和厚朴酚作用剂量为30μm)的h460细胞和h358细胞用pbs清洗三次,加入1ml ttizol反复吹打,使其全部裂解;加入200μl ccl4使溶液分层,4℃12000rpm离心15min。取上层液体于离心管中,加入500μl异丙醇,混匀,4℃12000rpm离心10min;弃去上清液,加入1ml 75%乙醇,振荡,4℃12000rpm离心5min,弃去上清液,放置超净台通风干燥;待彻底干燥后,加入30μl depc
‑
ddw,使之完全溶解,利用biotek take 3微量检测板测定各细胞株的rna浓度;
97.2)利用逆转录试剂盒将肿瘤细胞rna逆转录成cdna
98.a.去除基因组dna:
99.取1μg步骤1)得到的rna,加入4μl 4
×
g dna wiper mix,补rnase
‑
free ddh2o至体系总体积为16μl,混合均匀,42℃孵育2min;
100.b.rna逆转录为cdna:
101.在步骤a的反应体系中加入4μl 5
×
qrtsupermix ii,混合均匀,按以下rt
‑
pcr程序进行逆转录:50℃15min,85℃2min,反应结束后将cdna产物稀释10倍,
‑
80℃保存。
102.3)利用qpcr检测pd
‑
l1和内参gapdh的转录水平
103.按照以下反应体系和程序,用荧光定量pcr仪(roche)进行检测:
104.pd
‑
l1引物:
105.上游引物f:gctgcactaattgtctattggga(seq id no:1);
106.下游引物r:aattcgcttgtagtcggcacc(seq id no:2)。
107.gapdh引物:
108.上游引物f:ggagcgagatccctccaaaat(seq id no:3);
109.下游引物r:ggctgttgtcatacttctcatgg(seq id no:4)。
110.qpcr反应体系:2
×
one stepgreen mix 5μl,上游引物(浓度为5μm)0.5μl,下游引物(浓度为5μm)0.5μl,cdna 4μl,总体积10μl;
111.qpcr反应程序:95℃5min;94℃30s、58℃30s、72℃30s,n个循环;65℃1min,40℃30s,其中,当扩增pd
‑
l1时,n=38,当扩增gapdh时,n=30。
112.qpcr的结果如图2中c所示,与未经过和厚朴酚处理的h358细胞和h460细胞相比,通过和厚朴酚处理后的h358细胞和h460细胞pd
‑
l1的mrna的表达显著降低(p<0.001),表明和厚朴酚对h358细胞和h460细胞pd
‑
l1的mrna表达有明显抑制作用。
113.4.流式细胞检测
114.利用流式细胞术测定和厚朴酚对人非小细胞肺癌细胞株h1975和h358细胞中pd
‑
l1表达的影响,具体步骤如下:
115.1)分别取生长对数期的h358细胞和h1975细胞(未经过和厚朴酚处理),接种于12孔板培养皿中,每孔1
×
105个细胞,于培养箱(37℃,5%co2)培养12h;
116.2)实验分为两个大组:第一大组:将h1975细胞和h358细胞各自分为四个小组,和厚朴酚0μm、10μm、20μm、30μm处理组;第二大组:将h1975细胞和h358细胞各自分为三个小组,分别为对照组(不加和厚朴酚和ifn
‑
γ)、20ngifn
‑
γ处理组、20ngifn
‑
γ和30μm和厚朴酚共同处理组;
117.3)继续培养24h,用胰酶消化细胞,收集细胞,用pbs混匀,收集到1.5ml离心管中;
118.4)4℃1000rpm离心5min,用pbs将细胞重新悬浮,使细胞浓度为1
×
106个/ml;
119.5)每个样本加入2μl pd
‑
l1抗体(购买自biolegend,货号为393606),冰上避光孵育30min;
120.6)4℃1000rpm离心5min,弃去上清液,pbs清洗细胞两次,重新悬浮在500μl pbs中(细胞浓度为2
×
105个/ml),于流式细胞仪(beckman coulter,cytoflex s)上机检测。
121.通过采用0μm、10μm、20μm、30μm的4个浓度梯度的和厚朴酚对人非小细胞肺癌h1975细胞、h358细胞进行处理,结果如图3和图4所示,随着和厚朴酚剂量的增大,h1975细胞和h358细胞中pd
‑
l1的表达水平下调越明显,表明和厚朴酚可以抑制h1975细胞和h358细胞中pd
‑
l1的表达,并呈剂量依赖性;与对照组相比,在ifn
‑
γ刺激下,h1975细胞和h358细胞中pd
‑
l1表达水平显著升高,而在ifn
‑
γ和厚朴酚共同处理下,h1975细胞和h358细胞中pd
‑
l1表达水平下降(图5和图6),表明和厚朴酚显著抑制ifn
‑
γ诱导的h1975细胞和h358细胞pd
‑
l1表达上调(p<0.001)。
122.实施例3裸鼠移植瘤模型
123.1.小鼠移植瘤实验
124.小鼠移植瘤实验涉及的动物实验按照广东医科大学动物伦理委员会和委员会批准的方案进行。将小鼠肺癌细胞
‑
荧光素酶标记(llc
‑
luc)细胞重悬于无fbs培养基中(细胞浓度为1
×
106个/ml),并以100μl皮下注射至6周龄无胸腺裸鼠,建立裸鼠移植瘤模型。肿瘤
移植物生长至约60mm3后,小鼠每天腹膜内注射给予溶剂(对照组:2%dmso、40%peg400和2%吐温80的生理盐水溶液,0.2ml/只/天;给药组:和厚朴酚20mg/kg/天,和厚朴酚溶解在2%dmso、40%peg400和2%吐温80的生理盐水溶液中),每组各4只小鼠,持续注射14天。使用数显卡尺每3天测量一次小鼠肿瘤的长度和宽度,并使用以下公式计算肿瘤体积(mm3):体积(mm3)=长度(mm)
×
宽度(mm)2×
π
÷
6。
125.在裸鼠移植瘤模型中,在0~6天内,对照组小鼠和给药组小鼠肿瘤体积变化情况大致相同,超过6天后,对照组小鼠肿瘤的生长逐渐加速,肿瘤体积逐渐增大,而给药组小鼠肿瘤生长较为平缓(图7中a);连续处理14天后,用活体成像仪拍摄小鼠体内肿瘤,对照组小鼠体内肿瘤的体积明显大于给药组小鼠体内肿瘤体积(图7中b)。取出各小鼠体内的肿瘤,结果如图7中c和d所示,给药组小鼠肿瘤的体积和重量明显大于对照组小鼠肿瘤的体积和重量,表明和厚朴酚可以显著抑制裸鼠移植瘤体积的增大。
126.2.he染色及免疫组化
127.he(苏木精
‑
伊红)染色:将对照组小鼠和给药组小鼠的肿瘤组织分别用pbs洗涤3次,浸泡在4%多聚甲醛(paraformaldehyde,pfa)中固定48h,固定完成后,利用石蜡包埋后进行切片,并采用he染色方法对切片进行染色,最后在显微镜拍摄图像。
128.免疫组化:将对照组小鼠和给药组小鼠的肿瘤组织分别用pbs洗涤3次,浸泡在4%pfa中固定48h,并制备石蜡切片,并转移至载玻片上,脱蜡前将切片置于60℃恒温箱中烘烤1h,取出切片置于二甲苯及梯度乙醇中逐步进行脱蜡和水化(具体流程为:将切片依次浸入二甲苯20min
‑
二甲苯20min
‑
无水乙醇1min
‑
无水乙醇1min
‑
95%乙醇1min
‑
85%乙醇1min
‑
75%乙醇1min
‑
50%乙醇1min
‑
蒸馏水5min);水化后将切片置于已加热至沸腾的柠檬酸钠抗原修复液(1
×
)中,修复时间为10min;抗原修复后将切片冷却至室温,随后用pbs浸洗2次,每次5min,pbs浸洗后将切片置于湿盒中,并在切片组织上滴加(将切片完全覆盖即可)3%h2o2溶液,室温避光孵育15min;用pbs浸洗3次,每次5min,随后将切片置于湿盒中,在切片组织上滴加(将切片完全覆盖即可)山羊血清封闭30min,30min后去除山羊血清,分别在切片上滴加100μl一抗工作液cd4和cd8(均用pbs 1:200配制),置于湿盒中4℃孵育过夜;次日取出湿盒在室温复温40min,将切片置于pbs中浸洗3次,每次5min,在切片上加入25μl二抗(hrp标记的小鼠抗兔),37℃孵育30min;取出切片用pbs洗3次,每次5min,随后滴加(将切片完全覆盖即可)二氨基联苯胺(3,3
’‑
diaminobenzidine,dab)显色剂,作用10min,滴加苏木素复染5min,用梯度乙醇及二苯甲对染色后的切片进行脱水透明(具体流程为:将切片依次浸入50%乙醇1min
‑
75%乙醇1min
‑
85%乙醇1min
‑
95%乙醇1min
‑
无水乙醇1min
‑
无水乙醇1min
‑
二甲苯2min
‑
二甲苯2min),进而用中性树胶对染色片进行封片,在显微镜拍摄图像。
129.通过对肿瘤组织进行he染色,结果如图8所示,对照组肿瘤组织中肿瘤细胞较给药组小鼠肿瘤组织中肿瘤细胞拥挤、重叠,表明和厚朴酚对裸鼠肿瘤细胞增殖有明显的抑制作用;通过利用免疫组化来比较给药组和对照组小鼠的肿瘤组织中cd4和cd8的表达水平(图8),图中棕褐色反应产物为抗原的分布,即棕褐色部分为cd4
t细胞和cd8
t细胞,可以看出,给药组小鼠肿瘤中cd4
t细胞和cd8
t细胞数量较对照组明显增多,表明和厚朴酚可显著增加小鼠肿瘤组织中cd4
t细胞和cd8
t细胞的数量。
130.3.组织免疫荧光
131.将对照组小鼠和给药组小鼠的肿瘤组织分别用pbs洗涤3次,浸泡在4%pfa中固定48h,并制备石蜡切片,并转移至载玻片上。脱蜡前将切片置于60℃恒温箱中烘烤1h,取出切片置于二甲苯及梯度乙醇中逐步进行脱蜡和水化(具体流程为:将切片依次浸入二甲苯20min
‑
二甲苯20min
‑
无水乙醇1min
‑
无水乙醇1min
‑
95%乙醇1min
‑
85%乙醇1min
‑
75%乙醇1min
‑
50%乙醇1min
‑
蒸馏水5min);水化后将切片置于已加热至沸腾的柠檬酸钠抗原修复液中,修复时间为10min;抗原修复后将切片冷却至室温,随后用0.1%pbst浸洗3次,每次5min,随后将切片置于湿盒中,在切片组织上滴加山羊血清封闭30min,30min后去除山羊血清,并在切片上滴加100μl pd
‑
l1抗体(购买自biolegend,货号为393606)工作液(用5%bsa 1:300配制),置于湿盒中4℃孵育过夜;次日用pbs浸洗切片3次,每次5min,随后在切片上加入50μl荧光二抗稀释液(用pbs 1:1000配制),室温避光孵育1h,然后用pbs浸洗3次,每次5min;最后,在每个切片上加50μl抗淬灭封片液(pbs和甘油1:1配置而成),在封片液上盖上盖玻片,4℃避光保存,在激光共聚焦显微镜下观察,并拍照记录结果。
132.通过对对照组小鼠肿瘤组织与和给药组小鼠肿瘤组织进行免疫荧光染色,结果表明,给药组小鼠肿瘤组织中pd
‑
l1表达较对照组小鼠肿瘤组织中pd
‑
l1表达显著降低(图9),表明和厚朴酚可以显著降低小鼠肿瘤组织中pd
‑
l1的表达。
133.4.肿瘤浸润淋巴细胞流式细胞分选
134.取对照组和给药组小鼠肿瘤组织,浸泡于pbs中,剔除周围的血块、脂肪及坏死组织,用pbs清洗一遍,剪成1mm3大小,浸入含有胶原酶iv(200u/ml)和dnase i(40u/ml)的rpmi
‑
1640无血清培养基溶液中,37℃水浴消化45min。消化完毕后,上清液用70μm孔径的细胞网筛过滤,用rpmi
‑
1640培养基(含2mmol/l edta)溶液冲洗网筛,滤液1500rpm离心5min,弃上清,即获得肿瘤浸润淋巴细胞,重悬于facs缓冲液(含2%fbs、2mm edta的pbs);每支流式检测管中加入100μl细胞悬液(5
×
105~10
×
105个/管),加入2μl荧光标记抗体fitc anti
‑
mouse cd4和2μl荧光标记抗体pe anti
‑
mouse cd8进行双染,冰上孵育15min,加入pbs清洗细胞,2次重复,加入500μl facs缓冲液重悬细胞,于流式细胞仪(beckman coulter,cytoflex s)进行检测。
135.采用流式细胞技术对肿瘤浸润淋巴细胞进行流式分选,结果如图10所示,给药组小鼠的肿瘤浸润淋巴细胞中cd4
t细胞和cd8
t细胞数量明显比对照组肿瘤浸润淋巴细胞中cd4
t细胞和cd8
t细胞数量多,表明和厚朴酚可以有效增加小鼠的肿瘤浸润淋巴细胞中cd4
t细胞和cd8
t细胞数量。
136.上面结合附图对本发明实施例作了详细说明,但是本发明不限于上述实施例,在所属技术领域普通技术人员所具备的知识范围内,还可以在不脱离本发明宗旨的前提下作出各种变化。此外,在不冲突的情况下,本发明的实施例及实施例中的特征可以相互组合。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。