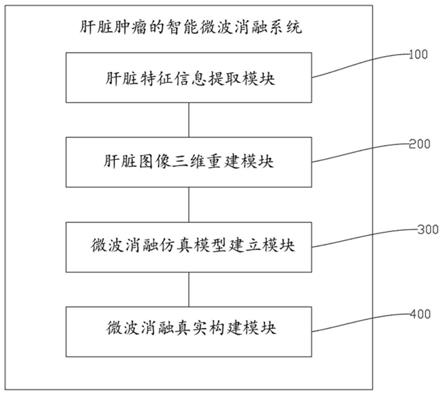
1.本发明属于可口服缓释凝胶珠制备工艺技术领域,特别涉及一种甜菜果胶基口服缓释凝胶珠及其制备方法。
背景技术:
2.果胶是一种阴离子型大分子多糖,具有胶凝、乳化、增稠、稳定等功能特性,被广泛地应用于食品、医药、化工、纺织等行业。但由于甜菜果胶分子量较低、乙酰化程度高,导致其凝胶性差,虽然具有良好的乳化特性,但其乳化稳定性不足,这制约了甜菜果胶的商品化应用。因此,对其进行阳离子化改性,完善其理化性质,有助于提高其附加值。蛋白质或多糖可与酚酸复合制备食品级纳米颗粒,这些胶体颗粒作为一种传递系统不仅可用于功能因子的包埋,还有助于功能因子的释放与吸收。传递方式可以一个可控的速率逐步释放,或由于外界因素引起快速释放。因此,这些颗粒在功能性食品和医药品行业有着广泛的应用前景。同时,一些可食用聚阴离子多糖与钙离子等二价阳离子交联可形成凝胶微球,具有良好的生物兼容性和生物粘附性,作为载体材料有诸多优势,如无毒、无刺激、能调控药物的释放,对胃酸不敏感。
3.存在问题:静电复合的纳米颗粒对酸碱敏感,很容易受到环境ph变化的影响(moschakis,thomas,and costas g.biliaderis.biopolymer
‑
based coacervates:structures,functionality and applications in food products.current opinion in colloid&interface science[j].2017,28:96
‑
109.shutava,t.g.,&lvov,y.m.nano
‑
engineered microcapsules of tannic acid and chitosan for protein encapsulation.journal of nanoscience and nanotechnology[j].2006,6(6):1655
‑
1661.),致使荷载的食品功能因子很难到达小肠时被吸收利用。单纯用ca
2
交联聚阴离子多糖得到的微球,因交联点之间的网目空隙较大(corstens,meinou n.,et al.emulsion
‑
alginate beads designed to control in vitro intestinal lipolysis:towards appetite control.journal of functional foods[j].2017,34:319
‑
328.),一些自身小于其孔径大小的食品功能因子,很容易透过释放出,致使其包埋率低,释放速度快等,水凝胶的载药量不甚理想。
技术实现要素:
[0004]
本发明的目的是针对现有技术的问题和不足,提供了一种甜菜果胶基口服缓释凝胶珠及其制备方法。
[0005]
本发明提供的甜菜果胶基口服缓释凝胶珠是一种阳离子化甜菜果胶基/酚酸纳米颗粒以及可口服缓释凝胶珠。
[0006]
本发明的目的至少通过如下技术方案之一实现。
[0007]
本发明所要解决的技术问题是:提供一种可口服的缓释凝胶珠的制备方法。通过微胶囊包覆纳米颗粒的结构设计,使纳米颗粒顺利到达小肠,并在其中将食品功能因子缓
慢释放吸收。
[0008]
本发明提供的制备方法中,先用1
‑
乙基
‑
(3
‑
二甲基氨基丙基)碳二亚胺盐酸盐/n
‑
羟基琥珀酰亚胺催化甜菜果胶与多
‑
nh2化(聚)合物接枝交联,制得阳离子化甜菜果胶;然后将阳离子化甜菜果胶和酚酸通过静电复合形成带正电荷纳米颗粒;然后与聚阴离子多糖复合稳定形成芯材含有纳米颗粒和聚阴离子多糖的胶囊,使胶囊内部的聚阴离子多糖和ca
2
通过蛋壳结构形成凝胶网络,最终得到凝胶珠(先用低浓度的聚阴离子多糖将纳米颗粒涂覆稳定,再与高浓度的聚阴离子多糖混合均匀,而后与ca
2
交联制得凝胶珠)。
[0009]
本发明提供的甜菜果胶基口服缓释凝胶珠的制备方法,具体包括如下步骤:
[0010]
(1)阳离子化甜菜果胶的制备:将甜菜果胶、多
‑
nh2化合物或多
‑
nh2聚合物及溶剂混合均匀,然后加入1
‑
乙基
‑
(3
‑
二甲基氨基丙基)碳二亚胺盐酸盐及n
‑
羟基琥珀酰亚胺,进行接枝交联反应,干燥得到阳离子化甜菜果胶;
[0011]
(2)酚酸纳米颗粒的制备:将步骤(1)所述阳离子化甜菜果胶溶于水中,得到果胶溶液,然后加入食品功能因子与酚酸,搅拌处理(阳离子化甜菜果胶和酚酸通过静电复合形成带正电荷纳米颗粒),得到带正电荷纳米颗粒溶液;
[0012]
(3)凝胶珠的制备:将步骤(2)所述带正电荷纳米颗粒溶液与低浓度聚阴离子多糖溶液混合,搅拌处理,得到混合液1,然后将所述混合液1与高浓度聚阴离子多糖溶液混合均匀,得到混合液2;将所述混合液2滴加入含ca
2
的溶液中,得到所述甜菜果胶基口服缓释凝胶珠。
[0013]
进一步地,步骤(1)所述溶剂为水;步骤(1)所述甜菜果胶与溶剂的质量体积比为1
‑
40mg/ml;
[0014]
进一步地,步骤(1)所述多
‑
nh2化合物为乙二胺、赖氨酸、精氨酸中的一种以上;
[0015]
进一步地,步骤(1)所述多
‑
nh2聚合物为ε
‑
聚赖氨酸;
[0016]
进一步地,步骤(1)所述甜菜果胶与多
‑
nh2化合物或多
‑
nh2聚合物的质量比为1:(1
‑
35)。
[0017]
进一步地,步骤(1)所述1
‑
乙基
‑
(3
‑
二甲基氨基丙基)碳二亚胺盐酸盐与n
‑
羟基琥珀酰亚胺的质量比为(0.001
‑
30):(0.002
‑
10);
[0018]
进一步地,步骤(1)所述1
‑
乙基
‑
(3
‑
二甲基氨基丙基)碳二亚胺盐酸盐与甜菜果胶的质量比为0.001
‑
30:1;
[0019]
进一步地,步骤(1)所述接枝交联反应的时间为2
‑
24h。
[0020]
进一步地,步骤(1)在阳离子化甜菜果胶的制备过程中,反应体系ph为3.0
‑
7.0,温度为10
‑
50℃。
[0021]
进一步地,步骤(1)得到阳离子化甜菜果胶后,可以使用5
‑
50kda超滤膜滤去未反应的物质。
[0022]
进一步地,步骤(2)所述阳离子化甜菜果胶与水的质量体积比为1
‑
40mg/ml;
[0023]
进一步地,步骤(2)所述食品功能因子为亚硒酸钠、甜菜红素、盐酸阿霉素、核黄素中的一种以上;
[0024]
进一步地,步骤(2)所述食品功能因子与水的质量体积比为0.01
‑
5mg/ml;
[0025]
进一步地,步骤(2)所述酚酸为单宁酸、没食子酸、绿原酸或其它植物酚酸中的一种以上;所述阳离子化甜菜果胶与酚酸的质量比为2
‑
500:100;
[0026]
进一步地,步骤(2)所述搅拌处理的时间为20
‑
120min。
[0027]
进一步地,步骤(2)在酚酸纳米颗粒的制备过程中,体系的ph为2
‑
10,搅拌处理的温度为4
‑
65℃。
[0028]
进一步地,步骤(3)所述聚阴离子多糖为海藻酸钠、低酯果胶中的一种以上;
[0029]
进一步地,步骤(3)所述低浓度聚阴离子多糖溶液的浓度为1
‑
5mg/ml,所述带正电荷纳米颗粒溶液与低浓度聚阴离子多糖溶液的体积比为1:(0.5
‑
2);步骤(3)所述搅拌处理的时间为30
‑
120min。
[0030]
步骤(3)中,由于纳米颗粒是静电复合而得,为了保证纳米颗粒不被破坏,须将温度控制在10
‑
50℃,先用较低浓度的聚阴离子多糖涂覆带正电的纳米颗粒表面并稳定30
‑
120min后,再与高浓度的聚阴离子多糖混合均匀。
[0031]
优选地,在步骤(3)所述混合液1中,带正电荷纳米颗粒溶液与低浓度聚阴离子多糖溶液的浓度比为(5
‑
20):10(wt%)。
[0032]
进一步地,步骤(3)所述高浓度聚阴离子多糖溶液的浓度为10
‑
30mg/ml,
[0033]
进一步地,在步骤(3)所述混合液2中,聚阴离子多糖的浓度为5
‑
15mg/ml;
[0034]
进一步地,步骤(3)所述混合液1滴加至高浓度聚阴离子多糖溶液中的流速为1
‑
5ml/min。
[0035]
进一步地,步骤(3)所述含ca
2
的溶液为cacl2溶液、caso4溶液和ca(hco3)2溶液中的一种以上;所述含ca
2
的溶液的浓度为10
‑
30mg/ml;在所述混合液2滴加入含ca
2
的溶液的过程中,混合液2离含ca
2
的溶液液面的垂直距离为0.5
‑
3.5cm;所述混合液2与含ca
2
的溶液的体积比为1:(10
‑
50)。
[0036]
进一步地,步骤(2)和步骤(3)所述搅拌处理的转速均为50
‑
600r/min。
[0037]
本发明提供一种由上述的制备方法制得到的甜菜果胶基口服缓释凝胶珠。
[0038]
本发明提供的甜菜果胶基口服缓释凝胶珠,纳米颗粒对食品功能因子有优良的包载性,该凝胶珠可以口服并在小肠被缓慢吸收利用。
[0039]
本发明提供的制备方法,将阳离子化甜菜果胶与酚酸复合成带正电荷纳米颗粒,并用聚阴离子多糖将带正电荷的纳米颗粒进一步包覆稳定,再用ca
2
交联得到可口服缓释凝胶珠。本发明制备的纳米颗粒对食品功能性因子有优良的包载性和缓释性,同时制备的凝胶珠可口服且容易被人体吸收。另外,引入的酚酸有很强的抗氧化和抗肿瘤等生物活性,不仅参与纳米颗粒的制备而且具有功能性。
[0040]
与现有技术相比,本发明具有如下优点和有益效果:
[0041]
本发明提供的制备方法,选用的材料生物相容性良好,无毒且可消化吸收;本发明形成的凝胶珠有理想的孔隙结构和力学性能,可使纳米颗粒顺利到达小肠缓释功能因子而不被破坏,也使口服载食品功能因子纳米颗粒的应用成为一种可能。
附图说明
[0042]
图1为负载功能因子纳米颗粒的透射电子显微镜图;
[0043]
图2为负载功能因子纳米颗粒的纳米粒径分布图;
[0044]
图3为制备纳米颗粒各物质,以及未载功能因子的纳米颗粒与载功能因子的纳米颗粒x射线衍射分析图。
具体实施方式
[0045]
以下结合实例对本发明的具体实施作进一步说明,但本发明的实施和保护不限于此。需指出的是,以下若有未特别详细说明之过程,均是本领域技术人员可参照现有技术实现或理解的。所用试剂或仪器未注明生产厂商者,视为可以通过市售购买得到的常规产品。
[0046]
本发明所述ca
2
的质量以提供ca
2
助剂(所述含ca
2
的溶液)的质量计,所述ca
2
助剂优选cacl2,caso4和ca(hco3)2中的任意一种;所述聚阴离子多糖助剂优选食品级海藻酸钠和低酯果胶中的任意一种;所述多
‑
nh2化合物或多
‑
nh2聚合物优选乙二胺,赖氨酸,精氨酸和ε
‑
聚赖氨酸中的任意一种。
[0047]
实施例1
[0048]
在25℃条件下,将1g甜菜果胶溶于100ml蒸馏水中,与等体积的ph 4.5的1wt%乙二胺溶液混合均匀,加入1
‑
乙基
‑
(3
‑
二甲基氨基丙基)碳二亚胺盐酸盐(15g)/n
‑
羟基琥珀酰亚胺(5g)催化交联,催化交联的时间为12h,得阳离子化果胶,并将所得改性果胶(阳离子化果胶)冷冻干燥;将10mg干燥后的阳离子化果胶溶于10ml蒸馏水中,搅拌速度为300r/min;接着与1mg亚硒酸钠混均,用0.1m hcl调节ph 5.0,加入150mg单宁酸,将混合溶液在室温下进行磁力搅拌2h,通过离子反应交联形成负载亚硒酸钠纳米颗粒,通过透射电子显微镜观察可以发现复合物呈颗粒状,如图1所示;通过图3可以知道,阳离子化果胶/单宁酸复合纳米颗粒与荷载亚硒酸钠的阳离子化果胶/单宁酸复合纳米颗粒晶型相同,所以亚硒酸钠被包裹在纳米颗粒中;使用纳米粒度电位仪(zetasizer nano zs)测得纳米颗粒的粒径为109.1nm,粒径分布如图2;接着将纳米颗粒溶液以流速5ml/min滴加到等体积的2mg/ml的海藻酸钠溶液后,在室温下进行磁力搅拌1h,得到混合液1,再将混合液1以流速1ml/min滴加到高浓度的海藻酸钠溶液(10mg/ml)混均至终海藻酸钠浓度为5mg/ml,得到混合液2;接着将混合液2离液面1cm处逐滴加入2wt%cacl2溶液中,所述混合液2与cacl2溶液的体积比为1:20,制得凝胶微球。用滤纸过滤得凝胶微球,并去离子水将凝胶微球和滤纸清洗3次,利用2
‑3‑
二氨基萘荧光分光光度计法测算得滤液中未包封亚硒酸钠的含量,计算得亚硒酸钠的包封率达98.8%;采用三阶段胃肠模型(mao y.,mcclements d j.influence of electrostatic heteroaggregation of lipid droplets on their stability and digestibility under simulated gastrointestinal conditions[j].food&function,2012,3(10):1025
‑
1034.)来模拟人体胃肠道,测得亚硒酸钠的生物有效性为93.2%。
[0049]
实施例2
[0050]
在25℃条件下,将1g甜菜果胶溶于100ml蒸馏水中,与等体积的ph 5.0的18wt%赖氨酸溶液混合均匀,加入1
‑
乙基
‑
(3
‑
二甲基氨基丙基)碳二亚胺盐酸盐(5g)/n
‑
羟基琥珀酰亚胺(2g)催化交联,催化交联的时间为16h,得阳离子化果胶,并将所得改性果胶(阳离子化果胶)冷冻干燥;将15mg干燥后的阳离子化果胶溶于10ml蒸馏水中,搅拌速度为500r/min;接着与3mg甜菜红素混均,用0.1m hcl溶液调节ph 4.5,加入300mg单宁酸,将混合溶液在室温下进行磁力搅拌1h,通过离子反应交联形成负载甜菜红素纳米颗粒,通过透射电子显微镜观察可以发现复合物呈颗粒状,如图1;使用纳米粒度电位仪(zetasizer nano zs)测得纳米颗粒的粒径为115.8nm,粒径分布如图2;接着将纳米颗粒溶液以流速2.5ml/min滴加到0.5倍体积的5mg/ml的海藻酸钠溶液后,在室温下进行磁力搅拌1.5h,得到混合液1,再将混合液1以流速3ml/min滴加到高浓度的海藻酸钠溶液(20mg/ml)混均至终海藻酸钠浓度为
10mg/ml,得到混合液2;接着将混合液2离液面0.5cm处逐滴加入1wt%cacl2溶液中,所述混合液2与cacl2溶液的体积比为1:50,制得凝胶微球。用滤纸过滤得凝胶微球,并去离子水将凝胶微球和滤纸清洗3次,利用紫外分光光度计法(535nm)测算得滤液中未包封甜菜红素的含量,计算得甜菜红素的包封率达97%;采用如实施例1一样的三阶段胃肠模型来模拟人体胃肠道,测得甜菜红素的生物有效性为90.3%。
[0051]
实施例3
[0052]
在25℃条件下,将4g甜菜果胶溶于100ml蒸馏水中,与等体积的ph 5.5的8wt%精氨酸溶液混合均匀,加入1
‑
乙基
‑
(3
‑
二甲基氨基丙基)碳二亚胺盐酸盐(0.3g)/n
‑
羟基琥珀酰亚胺(0.1g)催化交联,催化交联的时间为24h,得阳离子化果胶,并将所得改性果胶(阳离子化果胶)冷冻干燥;将20mg干燥后的阳离子化果胶溶于10ml蒸馏水中,搅拌速度为600r/min;接着与5mg盐酸阿霉素混均,用0.1m hcl调节ph 5.5,加入400mg没食子酸,将混合溶液在室温下进行磁力搅拌20min,通过离子反应交联形成负载盐酸阿霉素纳米颗粒,通过透射电子显微镜观察可以发现复合物呈颗粒状,如图1;使用纳米粒度电位仪(zetasizer nano zs)测得纳米颗粒的粒径为132.2nm,粒径分布如图2;再以流速5ml/min滴加到等体积的1mg/ml的低酯果胶溶液后,在室温下进行磁力搅拌1h,得到混合液1,再将混合液1以流速2.5ml/min滴加到高浓度的低酯果胶溶液(17.5mg/ml)混均至终低酯果胶浓度为10mg/ml,得到混合液2;接着将混合液2离液面1.5cm处逐滴加入2wt%cacl2溶液中,所述混合液2与cacl2溶液的体积比为1:18,制得凝胶微球;用滤纸过滤得凝胶微球,并去离子水将凝胶微球和滤纸清洗3次,利用紫外分光光度计法(490nm)测算得滤液中未包封盐酸阿霉素的含量,计算得盐酸阿霉素的包封率达93.8%;采用如实施例1一样的三阶段胃肠模型来模拟人体胃肠道,测得盐酸阿霉素的生物有效性为91.2%。
[0053]
实施例4
[0054]
在25℃条件下,将0.1g甜菜果胶溶于100ml蒸馏水中,与等体积的ph 4.0的3.5wt%ε
‑
聚赖氨酸溶液混合均匀,加入1
‑
乙基
‑
(3
‑
二甲基氨基丙基)碳二亚胺盐酸盐(0.5g)/n
‑
羟基琥珀酰亚胺(0.2g)催化交联,催化交联的时间为2h,得阳离子化果胶,并将所得改性果胶(阳离子化果胶)冷冻干燥;将15mg干燥后的阳离子化果胶溶于10ml蒸馏水中,搅拌速度为400r/min;接着与0.1mg核黄素混均,用0.1m hcl调节ph 5.0,加入300mg绿原酸,将混合溶液在室温下进行磁力搅拌1.5h,通过离子反应交联形成负载核黄素纳米颗粒,通过透射电子显微镜观察可以发现复合物呈颗粒状,如图1;使用纳米粒度电位仪(zetasizer nano zs)测得纳米颗粒的粒径为124.7nm,粒径分布如图2;再以流速1ml/min滴加到2倍体积的2.5mg/ml的低酯果胶溶液后,在室温下进行磁力搅拌1h,得到混合液1,再将混合液1以流速5ml/min滴加到高浓度的低酯果胶溶液(30mg/ml)混均至终低酯果胶浓度为15mg/ml;接着将混合液2离液面3.5cm处逐滴加入3wt%cacl2溶液中,所述混合液2与cacl2溶液的体积比为1:10,制得凝胶微球;用滤纸过滤得凝胶微球,并去离子水将凝胶微球和滤纸清洗3次,利用荧光分光光度计法(激发波长374nm,发射波长为400
‑
700nm,以533nm的发射峰值为荧光强度的计算值)测算得滤液中未包封核黄素的含量,计算得核黄素的包封率达95.1%;采用如实施例1一样的三阶段胃肠模型来模拟人体胃肠道,测得核黄素的生物有效性为92.2%。
[0055]
以上实施例仅为本发明较优的实施方式,仅用于解释本发明,而非限制本发明,本
领域技术人员在未脱离本发明精神实质下所作的改变、替换、修饰等均应属于本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。