1.本发明属于农业
‑
环境微生物的技术领域,具体涉及一种耐盐性的根际促生细菌的筛选方法、菌株及其应用。
背景技术:
2.植物根系周围有一层薄薄的土壤,它是根系新陈代谢的一个非常重要的区域,被称为根际。根际是指受植物根系生长和活动影响而物理、化学、生物特性发生变化的根系周围土壤。在根际存在大量微生物,如细菌、真菌、原生动物和藻类,其中细菌最为丰富。植物通过化感作用增加微生物的生存压力,来选择对其生长贡献最大的细菌。由于细菌是根际中最丰富的微生物,特别是考虑到它们在根部定殖的竞争力,很大程度上会影响植物的生理机能。众所周知,植物根际土壤是一个微生物种群极其丰富的环境,其中不乏存在一些有益于植物生长的微生物。植物根际促生菌(plant growth promoting rhizobacteria,pgpr)是指自由生活在土壤或附生于植物根系的一类可促进植物生长及其对矿质营养的吸收和利用,并能抑制有害生物的有益菌类。自从1978年burr等人首先在马铃薯上报导pgpr以来,国内外已发现包括荧光假单孢菌、芽孢杆菌、根瘤菌、沙雷氏属等20多个种属的根际微生物具有防病促生的潜能。最多的是假单胞菌属(pseudomonas),其次为芽胞杆菌属(bacillus)、农杆菌属(agrobacterium)、埃文氏菌属(eriwinia)、黄杆菌属(flavobacterium)、巴斯德氏菌属(pasteuria)、沙雷氏菌(serratia)、肠杆菌(enterobacter)等等。
3.土壤盐碱化及次生盐碱化是限制农田高效利用和导致农业生产力水平低下的直接影响因素。据最新统计,新疆是中国最大的盐土区,盐碱土面积达1100万hm2,约占全国盐碱土面积的1/3和新疆土地面积的6.6%。然而,基于新疆盐碱地农田土壤,目前发现的根际促生菌种类较少,同时考虑到微生物自身的生物学特性,因此,如何筛选出耐盐性的根际促生细菌对于新疆盐碱土壤的植物生长和生态重建都具有十分重要的意义。
技术实现要素:
4.本发明的目的在于针对现有技术的不足之处,提供一种耐盐性的根际促生细菌的筛选方法,该方法能筛选出对盐碱土壤的植物生长和生态重建具有促进作用的根际促生细菌。
5.为解决上述技术问题,本发明采用如下技术方案:
6.一种耐盐性的根际促生细菌的筛选方法,包括如下步骤:
7.步骤1,收集不同类型盐碱地植物根系表面附着的土壤作为分离源;
8.步骤2,将步骤1获得的分离源稀释后分别置于不同盐分浓度的lb固体培养基中涂布培养,观察生长情况,挑选出单克隆细菌;
9.步骤3,将步骤2中获得的多种初筛根际细菌菌落分别置于液体培养基进行活化,然后涂布于固体培养基中进行复筛,获得复筛根际细菌单菌落;
10.步骤4,将步骤3中获得到的菌落进行细菌鉴定,得到多种不同种类的菌株;
11.步骤5,将多种不同类型的细菌分别配置成一定盐分浓度的菌液,取作物种子并将其分别放于上述配置好的菌液中进行发芽率试验,筛选出在盐分胁迫下能提高种子发芽率的菌株;
12.步骤6,对步骤5中筛选出的菌种做进一步的耐盐性筛选,选出耐盐性的菌株;
13.步骤7,对步骤6获得的耐盐性的菌株进行促生功能筛选,最后筛选出在盐分胁迫下具有促生功能的菌株。
14.进一步地,将单克隆细菌在不同盐分lb固体培养基中进行培养,筛选出在盐分浓度不小于60g/l lb固体培养基上依旧生长的细菌。
15.进一步地,步骤4具体操作方法为:对步骤3中获得到的细菌进行pcr扩增,得到扩增的引物片段,进行细菌种类鉴定。
16.进一步地,步骤7中,促生功能检测包括对菌株在盐分胁迫下产吲哚乙酸能力的测定、解磷能力的测定以及产胞外多糖能力的测定。
17.本发明的另一目的是提供一种根据上述的耐盐性的根际促生细菌的筛选方法筛选出来的菌株,该菌株具有耐盐且产吲哚乙酸、解无机磷、分泌胞外多糖的促生功能。
18.本发明还有一目的是提供一种根据上述的耐盐性的根际促生细菌的筛选方法获得的菌株的应用,在获得该菌株后将菌株应用于盐碱地的肥料中。
19.与现有技术相比,本发明的有益效果为:本发明在盐碱地植物根系表面附着土壤中筛选出耐盐性的根际促生细菌,该菌株可在高盐分环境下存活并显著提高玉米的发芽率及生长指标,且自身具有一定的促生性能,产胞外多糖能力较强,将该菌株以制作成肥料的形式应用于盐碱土壤中对植物生长和生态重建都具有十分重要的意义,能大大提高植物的产出。
附图说明
20.图1为本发明实施例筛选的根际促生细菌的发芽率试验结果;
21.图2为本发明实施例筛选的根际促生细菌的耐盐性试验结果;
22.图3为本发明实施例筛选的根际促生细菌的促生功能试验结果;
23.图4为本发明实施例筛选的yl07和yl10的系统发育树,a)为yl07的系统发育树,b)yl10的系统发育树;
24.图5为本发明实施例筛选的根际促生细菌的对植株促生影响的试验结果,(a)为对照组、yl07和yl10对玉米的株高的影响,(b)为对照组、yl07和yl10对玉米的生物量的影响。
具体实施方式
25.下面将结合本发明实施例对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。
26.需要说明的是,在不冲突的情况下,本发明中的实施例及实施例中的特征可以相互组合。
27.下面结合具体实施例对本发明作进一步说明,但不作为本发明的限定。
28.本发明这种耐盐性的根际促生细菌的筛选方法,包括以下步骤:
29.步骤s1,土壤样品采集:收集不同类型盐碱地植物根系表面附着土壤作为分离源,在本实施例中,选择玉米根系附着的土壤进行研究,这是因为玉米为在新疆盐碱地中常年种植的玉米,取玉米根基附着土壤,加无菌水振荡处理获得微生物悬液;
30.采用新一代测序技术16s rrna和its区域分别对获得到的分离源的细菌和真菌群落进行测定,筛选出细菌群落作为后续筛选根际促生菌的主体;其中,细菌16srrna的扩增区域为:v3
‑
v4,扩增引物为:338f(5
′‑
actcctacgggaggcagcag
‑3′
)和806r(5
′‑
ggactachvgggtwtctaat
‑3′
);真菌its的扩增引物为:its1f(5
′‑
cttggtcatttagaggaagtaa
‑3′
)and its2r(5
′‑
gctgcgttcttcatcgatgc
‑3′
)。
31.步骤s2,初筛:将步骤1获得的单克隆细菌进行稀释分别置于不同盐分浓度的lb固体培养基中涂布培养,观察生长情况,得到在nacl浓度不小于60g/l lb固体培养基上依旧生长的细菌,再将取细菌置于200mm lb液体培养基进行富集培养,取富集培养液涂布于lb固体培养基进行初筛,获得多种初筛根际细菌单菌落(如图1);
32.在该步骤中,不同盐分浓度的lb固体培养基配方为:胰蛋白胨10g,酵母提取物5g,nacl可以分别选择10g、30g、50g、60g、80g,1000ml,ph=7.0;
33.200mm液体培养基配方为:胰蛋白胨10g,酵母提取物5g,nacl11.688g,蒸馏水1000ml,ph=7.0;
34.培养基配制好后,将单克隆细菌悬液进行10倍梯度稀释(10
‑1,10
‑2,10
‑3,10
‑4,10
‑5),获得稀释液,将不同梯度的稀释液分别涂布于上述lb固体培养基上,然后将培养皿移入28℃恒温培养箱中培养,培养24h后,根据培养皿上菌落的颜色、形态、大小特征,将特征不同的细菌单菌落挑出,在lb固体培养基上进行三段式划线,然后在28℃恒温培养箱中培养,对挑出的每一株细菌菌株纯化至少3次,直到获得纯菌落,依次编号,其中一部分加入甘油后冷冻保存,以备后续使用;将另外一部分纯化细菌分别在不同盐分固体培养基上进行驯化培养,观察生长情况,挑选出在小于60g/l固体培养基上仍能生长的细菌,接着将其置于200mm盐分液体培养基进行富集培养,取富集培养液涂布于固体培养基进行初筛;最后,将上述中获得的多种初筛根际细菌菌落分别置于200mm液体培养基进行活化,然后涂布于200mm固体培养基中进行复筛,获得复筛根际细菌单菌落;
35.步骤s3,复筛:将步骤2中获得的多种初筛根际细菌菌落分别置于液体培养基进行活化,然后涂布于固体培养基中进行复筛,获得复筛根际细菌单菌落;在本实施例中,将步骤2中获得的多种初筛根际细菌菌落分别置于200mm液体培养基进行活化,然后涂布于200mm固体培养基中进行复筛,获得复筛根际细菌单菌落;
36.步骤s4,终筛:将步骤3中获得到的单菌落进行细菌鉴定,得到多种不同种类的细菌;其中,终筛的具体步骤为:对步骤3中获得到的细菌进行鉴定,进行pcr扩增,反应体系:模板(1μl),上游引物(16s f)27f(1μl);下游引物(16s r)1492r(1μl),聚合酶(25μl),蒸馏水定容到50μl。扩增流程为:1预变性95℃
→
2变性(95℃,20
″
)
→
3退火(58℃,20
″
)
→
4延伸(72℃,15
″
)
→
5彻底延伸(72℃,2
′
)2—4循环30次,得到扩增的引物片段,送至生物检测机构进行细菌种类鉴定,获得多种耐盐抗性的根际促生菌,在本实施例中获得13中根际促生菌,分别记为yl01
‑
yl13。
37.步骤5:将多种不同类型的细菌分别配置成一定盐分浓度的菌液,取作物种子并将其分别放于上述配置好的菌液中进行发芽率试验,筛选出在盐分胁迫下能提高种子发芽率的菌株;
38.在本实施例中,将步骤4中的多种根际促生菌在100mm盐分处理中进行发芽率实验,得到能提高种子发芽率的多种耐盐抗性的根际促生菌;具体地,在该步骤中,发芽试验实验采用单因素设计,研究因素为细菌种类(yl01
‑
yl13,以及无细菌的对照组ck),将玉米发芽的液体盐分浓度为100mm,每组处理7个重复,共98个培养皿,每个培养皿点播50粒种子。将玉米催芽12h后,在相对应的细菌悬浮液中浸种2h,随之将浸泡2h后的玉米种子放置在嵌有灭菌滤纸的培养皿上,挑出50粒种子进行摆放在12cm无菌培养皿中,吸取15ml的100mm nacl无菌液体于培养皿中,最后将培养皿放在智能人工气候箱中,培养皿温度为25℃,湿度为60%,光照等级1级,光照时长day/night为12h/12h,分别于第3天、第5天、第7天进行发芽数的计数。
39.其中,在试验中前须先对玉米种进行灭菌处理,玉米灭菌操作为:将玉米种子使用75%的无水乙醇灭菌30s,再用10%的次氯酸钠溶液消毒15min,然后用无菌水冲洗3~4次,然后使玉米浸泡在无菌水中,浸泡时间12h。
40.而细菌悬浮液配制步骤为:将上述冷冻在
‑
80℃的细菌接种在10ml左右的lb试管中,放到28℃的摇床上进行活化培养24h,吸取1ml活化菌液接种到装有40mllb的100ml锥形瓶中进行扩大培养;
41.玉米浸种:将扩大培养后的细菌取出,离心,用磷酸缓冲液在冲洗2次,再混匀在磷酸缓冲液中,将od
600
调为0.8,将经灭菌的玉米种子分装在每个锥形瓶中,密封,浸种2h。
42.发芽率试验结果见图1,由图1结果可知,yl01,yl05,yl06,yl07,yl09,yl10,yl13较对照组较为显著,因此在该步骤中筛选出yl01,yl05,yl06,yl07,yl09,yl10,yl13作为下一步试验菌种。
43.步骤6:对步骤5中筛选出的菌种做进一步的耐盐性筛选,选出耐盐性的菌株;
44.在本实施例中,对步骤5中筛选出的菌种做进一步的耐盐性筛选,选出盐分耐受性良好的菌种;在该步骤中,将yl01、yl05、yl06、yl07、yl09、yl10、yl13以及对照组分别接种到10、20、30、40、50、60、70g/l盐分培养基上,培养3天,测定od
600
值;测试结果如图2所示,由图2可以看出,yl01对盐分的耐受性较弱,而yl06则对盐分极为敏感,因此须剔除yl01和yl06,选择yl05,yl07,yl09,yl10和yl13作为进一步筛选结果;
45.步骤7:对步骤6获得的耐盐性良好的菌种进行促生功能筛选,最后筛选出在盐分胁迫下具有促生功能的菌株。
46.在该步骤中,促生功能检测包括对菌种在盐分胁迫下产吲哚乙酸(iaa)能力的测定、解磷能力的测定以及产胞外多糖能力的测定;具体地:
47.一、产吲哚乙酸能力的测定方法如下:
48.a、iaa标准曲线测定
49.配制浓度为0、10、12.5、15、17.5、25、50μg/ml的iaa标准溶液,并按体积比1:4与fecl3比色液混合,30℃下暗藏30min,然后分别测定各浓度的od
530
,以蒸馏水与fecl3比色液1:4混合作为空白对照。最后以iaa浓度为横坐标,od
530
为纵坐标作图,得到iaa标准曲线。
50.b、菌液中iaa浓度测定:
51.将细菌在iaa培养基中生长7d的菌液,在10000r/min的离心机中离心10min,取上清液2ml,与fecl3比色液1:4混合,在30℃下暗藏30min后,观察颜色反应。三个重复均变为红色为阳性,说明能分泌iaa,颜色越深表示分泌量越多;三个重复均不变色为阴性,说明不分泌iaa。对变色的接种又菌种的处理测定od
530
(以未接种细菌的iaa培养基作为空白对照),通过iaa浓度与od
530
的标准曲线计算相应的iaa浓度。
52.二、解磷能力的测定
53.1、磷标准曲线测定
54.磷标准储备液(1000mg/l):准确称取经105℃烘干2h的kh2po4(优级纯)4.39g,加蒸馏水溶解,加5mlh2so4,冷却后标定至1000ml。
55.二硝基酚指示剂:取0.2g2,4二硝基苯酚,用水溶解并定容至100ml。
56.240g/l氢氧化钠:取24g氢氧化钠,用水溶解并定容至100ml。
57.2mol/l硫酸:吸取5.6ml硫酸加水并定容至l00ml。
58.钼锑抗显色剂:称取0.5g酒石酸锑钾,溶解于100ml水中,即成0.5%的酒石酸锑钾溶液。另称取10.0g钼酸铵,溶解于450ml水中,缓慢加入126ml硫酸,再加入0.5%酒石酸锑钾溶液100ml,最后用水稀释至1l,避光贮存,即为钼锑抗贮存液。称取1.50g抗坏血酸溶液100ml钼锑贮存液中,即为钼锑抗显色剂,该显色剂现用现配。
59.分别吸取磷标准使用液0ml、1.0ml、2.0ml、3.0ml、4.0ml、5.0ml于50ml容量瓶中,再加入与吸取待测液等体积的空白溶液,用水稀释至约30ml,加1滴~2滴二硝基酚指示剂,滴加240g/l氢氧化钠溶液中和至刚呈黄色,再加入1滴2mol/l硫酸溶液,使溶液的黄色刚刚褪去,然后加入钼锑抗显色剂5.0ml,摇匀,用水定容,即得0.0mg/l、0.2mg/l、0.4mg/l、0.6mg/l、0.8mg/l、1.0mg/l磷(p)标准系列溶液。在室温高于15℃的条件下放置30min,用分光光度计在波长700nm处测定其吸光度,拟合直线回归方程或以磷(p)质量浓度为横坐标,吸光度值为纵坐标,得到标准曲线。
60.2、菌液解磷能力测定
61.取1ml的细菌接种物(od
600
=0.8)加入装有50mlnbrip培养基的锥形瓶中,然后在28
±
2℃的摇床(220rpm)下培养7d。菌液经12000rpm离心10min后,取上清液2ml,用水稀释至约30ml,加1滴~2滴二硝基酚指示剂,滴加240g/l氢氧化钠溶液中和至刚呈黄色,再加入1滴2mol/l硫酸溶液,使溶液的黄色刚刚褪去,然后加入钼锑抗显色剂5.0ml,摇匀,用水定容,在室温高于15℃的条件下放置30min,用分光光度计在波长700nm处测定其吸光度,通过磷标准曲线计算发酵液中可溶性磷含量。
62.三、产胞外多糖能力的测定
63.葡萄糖标准曲线测定方法为:
64.配置葡萄糖标准液(250mg/l):准确称取经105℃烘干2h的葡萄糖25.0mg,加蒸馏水溶解,定容至100ml。
65.配置6%苯酚溶液:取适量苯酚(分析纯),高温蒸馏,收集180℃馏分,称取60g,用水溶解,最后定容于1000ml棕色容量瓶中,冷藏避光保存。
66.分别吸取葡萄糖标准液0ml、0.2ml、0.4ml、0.6ml、0.8ml、1.0ml、1.2ml、1.4ml、1.6ml、1.8ml、2.0ml于50ml容量瓶中,加入蒸馏水标定至2ml,各管分别加6%苯酚溶液(新制)2ml,摇匀,然后迅速加入浓硫酸10ml,立即摇匀,于40℃水浴锅中保温30min,取出,置冷
水浴中5min,于490nm波长处测定其吸光度,以葡萄糖的稀释浓度(μg/ml)为横坐标,吸光度为纵坐标,绘制标准曲线。
67.2、菌液产胞外多糖测定
68.多糖的提取:取1ml的细菌接种物(od600=0.8)加入装有50ml新鲜rcv培养基的锥形瓶中,然后在28
±
2℃的摇床(220rpm)下培养2d。菌液经12000rpm、4℃离心10min后,取上清液,加入3倍体积预冷的无水乙醇,4℃静置过夜,离心弃上清,沉淀加入少量蒸馏水溶解,真空冷冻干燥得到粗多糖。
69.取0.3g胞外多糖粗品溶解于40ml蒸馏水,按照三氯甲烷和正丁醇的体积比为4:1配制sevage液,将粗多糖溶液与sevage液以体积比2:1混合,剧烈震荡30min,去除水层和溶剂交界处的变性蛋白,重复5遍。然后在自来水和蒸馏水中各透析(mwco为8kd)1天,12000rpm、4℃离心10min后,取上清液2ml,再加6%苯酚溶液(新制)2ml,摇匀,然后迅速加入浓硫酸10ml,立即摇匀,于40℃水浴锅中保温30min,取出,置冷水浴中5min,于490nm波长处测定其吸光度,通过葡萄糖标准曲线计算发酵液中多糖的含量;
70.试验结果如图3所示,从图3中可以看出,yl07和yl10具有极显著的产iaa、产胞外多糖和解磷的促生功能,其中产胞外多糖能级极高,产值分别为yl07:650.97μg/ml,yl10:711.69μg/ml。因此,在该步骤中选择yl07和yl10作为最后的筛选结果。
71.菌株鉴定结果,yl07测序结果进行双向拼接后,将得到的16s rdna序列在ncbi网站上比对,结果为planococcus soli,同源性为100%,保藏号为,mz919348,系统发育树如图4(a);yl10测序结果进行双向拼接后,将得到的16srdna序列在ncbi网站上比对,结果为bacillus atrophaeus,同源性为99%,保藏号为,mz919345,系统发育树如图4(b)。
72.为了验证yl07和yl10对玉米种植的促生作用,还进行了盆栽试验,具体的实验方法为:
73.盆栽种植每个盆填装800g的土壤,土壤出是电导率ece=5.9ds/cm,以yl07、yl10以及空白对照组进行试验,每组10个重复,随机排列。玉米的消毒和接种处理方法同发芽实验玉米种子处理。在玉米发芽15天后,分别接种上yl07、yl10菌液以及空白对照组,其中,对照组为30ml/棵的磷酸缓冲液,试验组为30ml/棵的细菌悬液(od
600
=0.8),其试验结果如图5所示。
74.图5为菌株对玉米株高、生物量的影响,图5(a)为对照组、yl07和yl10对玉米的株高的影响,图5(b)为对照组、yl07和yl10对玉米的生物量的影响,从图5(a)中可以看出菌株yl07和yl10能够很明显的提高玉米植物的株高,增长率分别为12.48%和21.71%;从图5(b)中也可以看出,yl07和yl10菌株也可提高玉米在盐分胁迫下的生物量,增长率分别为12.56%和21.67%。因此,yl07和yl10对玉米的株高、生物量均有明显的促生效果。
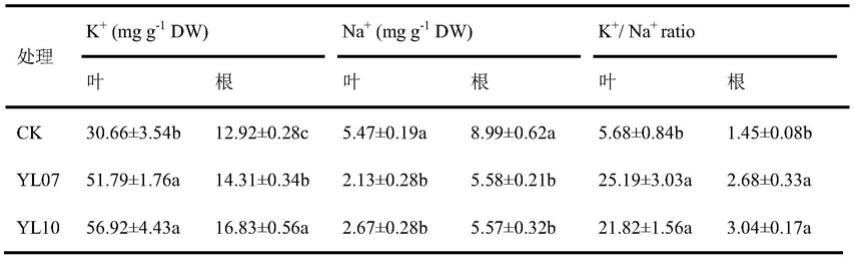
75.此外,为了进一步说明该两种菌种在盐碱地对农作物的积极作用,本实施例还验证菌种对玉米叶片、根系离子含量的影响,具体的试验结果如下表所示:
76.表1为对照组、yl07和yl10对玉米根系k
含量、na
含量的影响结果
[0077][0078]
注:p<0.05,同列字母不相同代表差异显著。
[0079]
由上表可以看出,相对于对照组,yl07和yl10可提高玉米叶片根系k
含量,降低na
对玉米的影响,差异显著。
[0080]
由上可知,本实施例提取的yl07和yl10根际促生菌可提高作物在逆境环境下的生长能力,间接或直接提高作物产量、改善抗盐碱抗病等逆境生存能力,有效缓解盐分胁迫作用。在盐碱地土壤中引入植物根际促生菌,对创造良好的根际生态环境、降低化肥与农药的使用、抑制病虫害的发生有重要的作用,在保证现代农业可持续发展的同时又达到增产的目的。本发明菌株yl07和yl10能够在盐分胁迫下生存,这就为以后将yl07和yl10促生菌应用在盐碱地中的存活率提供了一种保障性。
[0081]
综上所述,本发明yl07和yl10菌株可在高盐分环境下存活并显著提高玉米的发芽率及生长指标,且自身具有一定的促生性能,产胞外多糖能力较强。借此优势,可将这两种细菌与玉米的秸秆,玉米淀粉、麦麸、红糖、腐殖质等混合发酵研制成利于作物生长的菌肥,来促进新疆盐碱地玉米生长,这种肥料不同于传统意义上的化学肥料,可增强玉米作物的抗逆性,因此,将该菌株应用于提高新疆盐碱地玉米生长具有非常大的潜力。
[0082]
以上仅为本发明较佳的实施例,并非因此限制本发明的实施方式及保护范围,对于本领域技术人员而言,应当能够意识到凡运用本发明说明书内容所作出的等同替换和显而易见的变化所得到的方案,均应当包含在本发明的保护范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。