1.本发明涉及生物细胞技术领域,具体涉及一种用于灵长类动物神经元分离的试剂盒及方法。
背景技术:
2.近几年来,各种单细胞技术开始迅猛发展。人们通过裂解匀浆新鲜或冷冻的组织和细胞后,最后通过分离纯化等获得单细胞或者单细胞核,应用于各种单细胞技术来探索细胞的发育、细胞类型和状态、人类疾病和干细胞技术的发展。单细胞核分离技术能够获取取材困难的组织、难以分离单细胞的组织或者冰冻组织的单个细胞核,但是丢失细胞质的信息如遗传物质和蛋白质等。单细胞分离技术能够获取新鲜组织的单个细胞,但是在有些情况下,细胞是很难完整分离的,如灵长类神经系统的神经元,在分离细胞时所用的酶和机械力往往会破坏神经元的完整性,分离的细胞活性很低。因此,目前单细胞技术对神经元的研究倾向于单细胞核的分离。但是由于神经元结构的特殊性,神经元胞体、树突及突触内包含有大量遗传物质和蛋白质等,因此灵长类神经元的分离就显得特别重要。
3.中枢神经系统的细胞一直处于研究阶段,部分原因是很难分离到完整的细胞。由于脑组织的特异性,脑组织中含有丰富的神经纤维和髓鞘,且神经元的轴突和树突相互连接,蛋白酶倾向于将易解离的细胞解离出来,但是不易解离的细胞就会丢失。脑组织中的一些较为敏感的神经元可能会因为解离过度、兴奋毒性、缺氧等原因而破碎。探索灵长类动物神经元分离技术,对于研究灵长类动物罕见的神经元细胞类型、绘制神经元发育轨迹图谱、神经干细胞的分化谱系、神经元的特征与功能、深入理解人类大脑发育的规律和了解人类疾病的发生发展等至关重要。由于脑组织的特殊结构,目前还没有针对成年灵长类动物神经元分离的报道。
技术实现要素:
4.本发明的目的在于克服现有技术的不足,提供一种灵长类动物神经元分离试剂盒及方法。
5.为实现上述目的,本发明采取的技术方案为:一种人工脑脊液包含:60~65mm/l nacl,10~15mm/l nahco3,0.4~0.6mm/l nah2po4,0.9~1.1mm/l kcl,11~14mm/l d
‑
葡萄糖,0.9~1.1mm/l cacl2,0.4~0.6mm/l mgcl2,2~3mm/l l
‑
抗坏血酸钠,1.25~1.75mm/l丙酮酸钠,0.0075~0.0125mm/l牛磺酸,1.75~2.25mm/l硫脲,6.5~8.5mm/l海藻糖,0.4~0.6mm/l犬尿酸,5~15μm/l 6
‑
氰基
‑7‑
硝基喹喔啉
‑
2,3
‑
二酮,45~55μm/l dl
‑
ap5,0.4~0.6μm/l河豚毒素和3.5
‑
5.5μg/ml放线菌素d;所述人工脑脊液的ph值为7.2~7.6。
6.本技术发明人通过大量的实验筛选,在人工脑脊液中加入了抑制剂混合物犬尿酸、放线菌素d、6
‑
氰基
‑7‑
硝基喹喔啉
‑
2,3
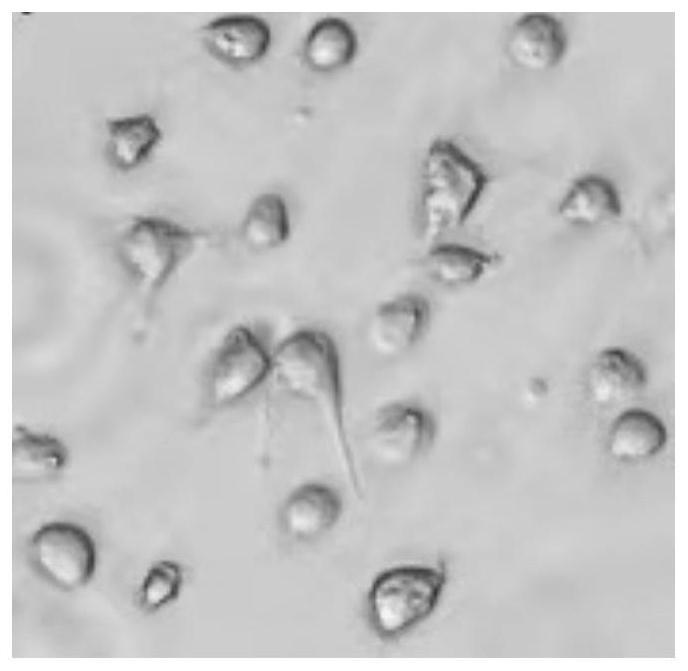
‑
二酮、dl
‑
ap5和河豚毒素,并对各组分的含量进行优选,使人工脑脊液能降低神经毒性,提高神经元的存活率,更适合灵长类动物脑细胞神经元的分离。
7.本发明还提供一种用于灵长类动物神经元分离的试剂盒,所述试剂盒包括:上述人工脑脊液和脑组织修复液。
8.本发明的试剂盒首次成功分离出灵长类动物单个神经元且能保证90%以上的神经元的存活,并能够保留神经元的胞体、树突、轴突和其他突起等。本发明的试剂盒能够实现灵长类单个神经元几乎所有信息的检测,更深入地了解不同神经元的异质性,探究神经元更全面更完整的信息。
9.作为本发明所述的用于灵长类动物神经元分离的试剂盒的优选实施方式,所述脑组织修复液包含:45~50mm/l n
‑
甲基
‑
d
‑
葡萄糖胺,14~16mm/l nahco3,0.5~0.7mm/l nah2po4,1~1.5mm/l kcl,9~11mm/l 4
‑
羟乙基哌嗪乙磺酸,11~14mm/l d
‑
葡萄糖,2.25~2.75mm/l l
‑
抗坏血酸钠,0.9~1.1mm/l硫脲,1.4~1.6mm/l丙酮酸钠,4.25~5.75mm/l mgso4和0.2~0.3mm/l cacl2;所述脑组织修复液的ph值为7.2~7.6。
10.本技术发明人通过大量的实验研究,对脑组织修复液中各组分及其含量进行筛选,使脑组织修复液更适用于灵长类动物神经元的分离。
11.作为本发明所述的用于灵长类动物神经元分离的试剂盒的优选实施方式,所述的试剂盒还包括灌流液,消化液,消化终止液和细胞清洗液。
12.作为本发明所述的用于灵长类动物神经元分离的试剂盒的优选实施方式,所述灌流液包括上述人工脑脊液和占动物体重0.002~0.003%的肝素钠。
13.本发明在人工脑脊液中加入肝素钠配置灌流液,该灌流液灌注到整个大脑,以更由内到外冷却整个大脑,尽可能清除血细胞及其他血液成分。
14.作为本发明所述的用于灵长类动物神经元分离的试剂盒的优选实施方式,所述消化液包含:上述人工脑脊液,35~45u/ml木瓜蛋白酶,15~25mg/ml胶原酶ⅱ型,消化液总体积0.4~0.6%的胰蛋白酶
‑
edta和4~6mg/ml脱氧核糖核酸酶i。
15.分离细胞时所用的酶往往会破坏神经元的完整性,使分离的细胞神经元活性很低,本技术发明人通过大量的实验筛选,在人工脑脊液中溶解稀释多种消化酶,并对消化液中各种酶的含量进行了优选,使最终制备的消化液更加温和,不会破坏单个神经元的完整性,保持神经元原有的特性,更适用于灵长类动物神经元的分离。
16.作为本发明所述的用于灵长类动物神经元分离的试剂盒的优选实施方式,所述消化终止液包含:上述人工脑脊液和占消化终止液总体积5~10%的fbs。
17.作为本发明所述的用于灵长类动物神经元分离的试剂盒的优选实施方式,所述细胞清洗液包含:pbs,细胞清洗液总体积0.01~0.04%的牛血清白蛋白和细胞清洗液总体积0.01~0.04%的d
‑
葡萄糖。
18.本发明还提供一种灵长类动物神经元的分离方法,包括以下步骤:
19.(1)脑组织材料的获取;
20.(2)将脑组织材料转移到预热的消化液进行消化;
21.(3)在步骤(2)的消化液中加入消化终止液并吹打;
22.(4)将步骤(3)的溶液进行过滤,取滤液;
23.(5)将步骤(4)的滤液进行离心,取沉淀;
24.(6)去除步骤(5)的沉淀中的髓鞘、杂质和死细胞,得细胞沉淀;
25.(7)用细胞清洗液清洗步骤(6)的细胞沉淀,得所述灵长类动物神经元细胞。
26.本技术发明人经过大量的实验研究,优化灵长类动物神经元的分离步骤,为了避免缺氧和代谢活动对细胞造成的损伤,从取材到细胞分离过程用到的大部分液体都是置于冰上且持续通氧,组织和细胞尽可能置于冰上且持续通氧,最终高效稳定的分离出高活力的灵长类动物神经元。
27.作为本发明所述的灵长类动物神经元的分离方法的优选实施方式,所述步骤(1)中,通过以下方法获取脑组织材料:采用灌流液对动物进行心脏灌注,获取脑组织浸泡于冰冷的氧饱和脑组织修复液,然后对脑组织进行修整;脑组织修块后,切成300~500μm的脑片,并将脑片置于冰冷的氧饱和的人工脑脊液;所述步骤(2)中的消化温度为34℃,消化时间为40~60min;所述步骤(3)中采用口径为800μm、400μm和200μm的玻璃吸管进行吹打;所述步骤(5)中的离心温度为4℃,离心转速为1000rpm,离心时间为5min。
28.本发明的有益效果:本发明提供的一种灵长类动物神经元分离试剂盒及方法,通过对人工脑脊液和脑组织修复液的配方的优化,首次成功的分离出灵长类动物神经元,包括神经元的胞体、树突、轴突和其他突起等,并能保证分离出的神经元活性高达90%以上;通过分离步骤的优化,能够高效稳定的分离出高活力的灵长类动物神经元。
附图说明
29.图1为灌流后的脑组织切块图。
30.图2为实施例1制备的神经元细胞悬液显微图。
31.图3为实施例2制备的神经元细胞悬液显微图。
32.图4为实施例3制备的神经元细胞悬液显微图。
具体实施方式
33.以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
34.实施例1
35.本发明实施例的一种用于灵长类动物神经元分离的试剂盒,包括人工脑脊液和脑组织修复液。其中人工脑脊液的制备方法为:将62.5mm/l nacl,12.5mm/l nahco3,0.5mm/l nah2po4,1mm/l kcl,12.5mm/l d
‑
葡萄糖,1mm/lcacl2,0.5mm/l mgcl2,2.5mm/l l
‑
抗坏血酸钠,1.5mm/l丙酮酸钠,0.01mm/l牛磺酸,2mm/l硫脲,7.5mm/l海藻糖,0.5mm/l犬尿酸,10μm/l 6
‑
氰基
‑7‑
硝基喹喔啉
‑
2,3
‑
二酮,50μm/l dl
‑
ap5,0.5μm/l河豚毒素,5μg/ml放线菌素d混合均匀持续通氧(95%o2 5%co2)30分钟,并将人工脑脊液的ph值调至7.4,得所述人工脑脊液;脑组织修复液的制备方法为:将47.5mm/l n
‑
甲基
‑
d
‑
葡萄糖胺,15mm/l nahco3,0.6mm/l nah2po4,1.25mm/l kcl,10mm/l4
‑
羟乙基哌嗪乙磺酸,12.5mm/l d
‑
葡萄糖,2.5mm/l l
‑
抗坏血酸钠,1mm/l硫脲,1.5mm/l丙酮酸钠,5mm/l mgso4,0.25mm/l cacl2混合均匀后,用93mm的盐酸将ph值调至7.4,得所述脑组织修复液。
36.本发明实施例采用上述用于灵长类动物神经元分离的试剂盒对灵长类动物神经元进行分离,具体方法如下:
37.(1)灌流液的配制:取上述人工脑脊液,加入动物的体重0.0025%的肝素钠,混合
nahco3,0.5mm/l nah2po4,1mm/l kcl,9mm/l 4
‑
羟乙基哌嗪乙磺酸,11mm/l d
‑
葡萄糖,2.25mm/l l
‑
抗坏血酸钠,0.9mm/l硫脲,1.4mm/l丙酮酸钠,4.25mm/l mgso4,0.2mm/l cacl2混合均匀后,用93mm的盐酸将ph值调至7.6,得所述脑组织修复液。
53.本发明实施例采用上述用于灵长类动物神经元分离的试剂盒对灵长类动物神经元进行分离,具体方法如下:
54.(1)灌流液的配制:取上述人工脑脊液,按动物的体重加入20mg/kg肝素钠,混合后置于冰上持续通氧(95%o2 5%co2)溶解,得冰冷的氧饱和灌流液。
55.(2)消化液的配制:在上述人工脑脊液中加入35u/ml木瓜蛋白酶,15mg/ml胶原酶ⅱ型、消化液总体积0.4%胰蛋白酶
‑
edta和4mg/ml脱氧核糖核酸酶i,混合均匀于34℃水浴锅加热10min且持续通氧(95%o2 5%co2),得消化液。
56.(3)消化终止液的配制:在上述人工脑脊液中中加入消化终止液总体积5%的fbs,混合均匀后置于冰上且持续通氧(95%o2 5%co2),得消化终止液。
57.(4)细胞清洗液的配制:在pbs中加入细胞清洗液总体积0.01%牛血清白蛋白和细胞清洗液总体积0.01%的d
‑
葡萄糖的混合液,置于冰上且持续通氧(95%o2 5%co2),得细胞清洗液。
58.(5)拉制玻璃吸管:在酒精灯上拉制口径为800μm、400μm和200μm的玻璃吸管,口径尖端尽可能抛平,以免吹打过程中损伤细胞。
59.(6)脑组织材料的获取:取配制好的灌流液对动物心脏进行灌注,取出脑组织迅速浸入已置于
‑
80℃并持续通氧25分钟的上述脑组织修复液中;对脑组织进行修整,修整后置于震动切片机上,切成300
‑
500μm的脑片,并立即用吸管转移脑片置于冰冷的氧饱和的人工脑脊液中;在立体显微镜下对脑组织区域进行修片(如图1所示),修片后的脑片转移到冰冷的氧饱和的人工脑脊液中。
60.(7)神经元细胞的分离:
61.a.将上述修片完的脑组织转移到预热的消化液中,于34℃消化40分钟且持续通氧;
62.b.吸弃步骤a中酶溶液后,于脑组织中加入1ml消化终止液,并用口径为800μm、400μm和200μm口径的玻璃吸管轻轻吹打;
63.c.取消化终止液润洗40um的过滤器,然后过滤步骤b的溶液,过滤掉细胞团或蛋白质,再加5ml消化终止液清洗过滤器,收集滤液;
64.d.将步骤c中的滤液进行离心,离心温度为4℃,离心转速为1000rpm,离心时间为5min,离心后吸弃上清,得细胞沉淀物;
65.e.分别采用髓鞘碎片去除试剂盒myelin removal beads kit(美天旎)和死细胞去除试剂盒dead cell removal kit(miltenyi)去除步骤d中的细胞沉淀物中的髓鞘、杂质和死细胞;
66.f.采用细胞清洗液对步骤e得到的细胞进行清洗,连续清洗2次,得神经元细胞。
67.(8)在显微镜下观察所得神经元细胞的形态,并采用自动细胞计数仪(bio
‑
rad,tc20)检测所制备的神经元细胞的活性和计数,结果见图3和表1。
68.实施例3
69.本发明实施例的一种用于灵长类动物神经元分离的试剂盒,包括人工脑脊液和脑
组织修复液。其中人工脑脊液的制备方法为:将65mm/l nacl,15mm/l nahco3,0.6mm/l nah2po4,1.1mm/l kcl,14mm/l d
‑
葡萄糖,1.1mm/lcacl2,0.6mm/l mgcl2,3mm/l l
‑
抗坏血酸钠,1.75mm/l丙酮酸钠,0.0125mm/l牛磺酸,2.25mm/l硫脲,8.5mm/l海藻糖,0.6mm/l犬尿酸,15μm/l 6
‑
氰基
‑7‑
硝基喹喔啉
‑
2,3
‑
二酮,55μm/l dl
‑
ap5,0.6μm/l河豚毒素,5.5μg/ml放线菌素d混合均匀持续通氧(95%o2 5%co2)30分钟,并将人工脑脊液的ph值调至7.4,得所述人工脑脊液;脑组织修复液的制备方法为:将50mm/l n
‑
甲基
‑
d
‑
葡萄糖胺,16mm/l nahco3,0.7mm/l nah2po4,1.5mm/l kcl,11mm/l 4
‑
羟乙基哌嗪乙磺酸,14mm/l d
‑
葡萄糖,2.75mm/l l
‑
抗坏血酸钠,1.1mm/l硫脲,1.6mm/l丙酮酸钠,5.75mm/l mgso4,0.3mm/l cacl2混合均匀后,用93mm的盐酸将ph值调至7.6,得所述脑组织修复液。
70.本发明实施例采用上述用于灵长类动物神经元分离的试剂盒对灵长类动物神经元进行分离,具体方法如下:
71.(1)灌流液的配制:取上述人工脑脊液,按动物的体重加入30mg/kg肝素钠,混合后置于冰上持续通氧(95%o2 5%co2)溶解,得冰冷的氧饱和灌流液。
72.(2)消化液的配制:在上述人工脑脊液中加入45u/ml木瓜蛋白酶,25mg/ml胶原酶ⅱ型、消化液总体积0.6%胰蛋白酶
‑
edta和6mg/ml脱氧核糖核酸酶i,混合均匀于34℃水浴锅加热10min且持续通氧(95%o2 5%co2),得消化液。
73.(3)消化终止液的配制:在上述人工脑脊液中中加入10%的fbs,混合均匀后置于冰上且持续通氧(95%o2 5%co2),得消化终止液。
74.(4)细胞清洗液的配制:在pbs中加入细胞清洗液总体积0.04%牛血清白蛋白和细胞清洗液总体积0.04%的d
‑
葡萄糖的混合液,置于冰上且持续通氧(95%o2 5%co2),得细胞清洗液。
75.(5)拉制玻璃吸管:在酒精灯上拉制口径为800μm、400μm和200μm的玻璃吸管,口径尖端尽可能抛平,以免吹打过程中损伤细胞。
76.(6)脑组织材料的获取:取配制好的灌流液对动物心脏进行灌注,取出脑组织迅速浸入已置于
‑
80℃并持续通氧25分钟的上述脑组织修复液中;对脑组织进行修整,修整后置于震动切片机上,切成300
‑
500μm的脑片,并立即用吸管转移脑片置于冰冷的氧饱和的人工脑脊液中;在立体显微镜下对脑组织区域进行修片(如图1所示),修片后的脑片转移到冰冷的氧饱和的人工脑脊液中。
77.(7)神经元细胞的分离:
78.a.将上述修片完的脑组织转移到预热的消化液中,于34℃消化60分钟且持续通氧;
79.b.吸弃步骤a中酶溶液后,于脑组织中加入1ml消化终止液,并用口径为800μm、400μm和200μm口径的玻璃吸管轻轻吹打;
80.c.取消化终止液润洗40um的过滤器,然后过滤步骤b的溶液,过滤掉细胞团或蛋白质,再加5ml消化终止液清洗过滤器,收集滤液;
81.d.将步骤c中的滤液进行离心,离心温度为4℃,离心转速为1000rpm,离心时间为5min,离心后吸弃上清,得细胞沉淀物;
82.e.分别采用髓鞘碎片去除试剂盒myelin removal beads kit(美天旎)和死细胞去除试剂盒dead cell removal kit(miltenyi)去除步骤d中的细胞沉淀物中的髓鞘、杂质
和死细胞;
83.f.采用细胞清洗液对步骤e得到的细胞进行清洗,连续清洗2次,得神经元细胞。
84.(8)在显微镜下观察所得神经元细胞的形态,并采用自动细胞计数仪(bio
‑
rad,tc20)检测所制备的神经元细胞的活性和计数,结果见图4和表1。
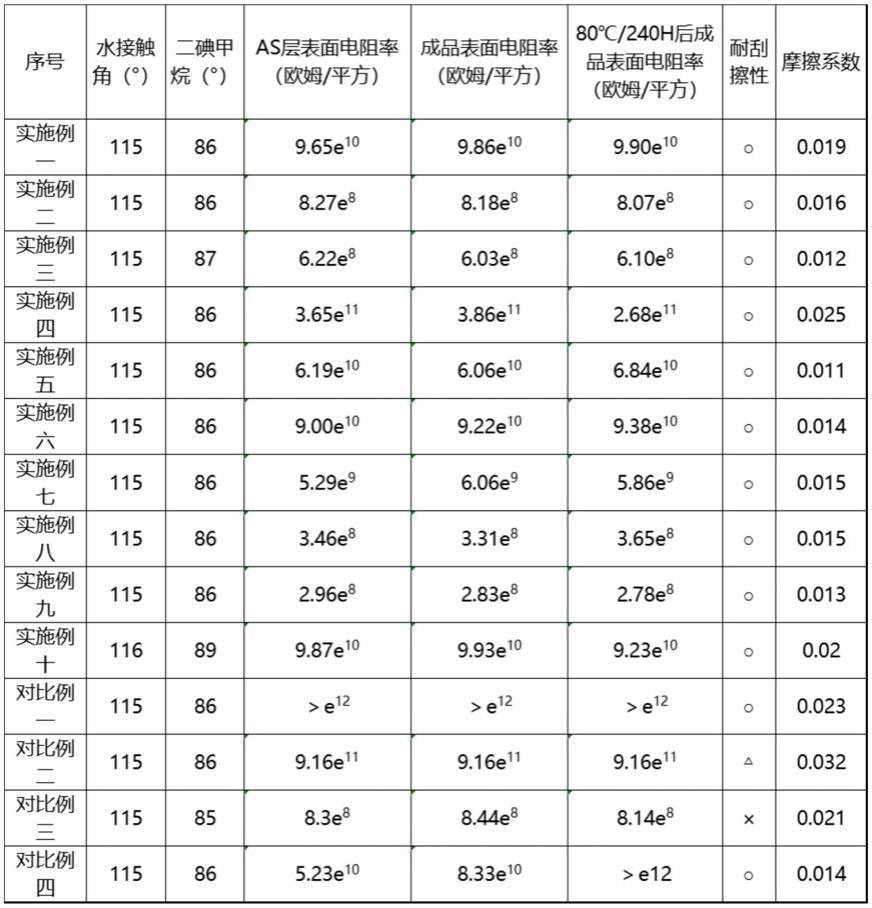
85.表1
[0086][0087][0088]
由图1可知,采用本发明的灌注液对脑组织进行灌注,脑组织灌流的效果非常好,外观呈黄色,且没有看到红色的血管分布。由图2~4可知,在显微镜下观察灵长类皮层的单细胞悬液,神经元的形态如胞体、轴突和树突清晰可见。由表1的神经元细胞的活性和计数结果可知,采用本发明的试剂盒和方法分离获得的灵长类动物神经元质量很高,细胞活性率均在90%以上。
[0089]
最后应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。