1.本发明涉及食品加工技术领域,特别是涉及一种具有良好抗氧化和抑菌性能的玫瑰天竺葵精油微胶囊的制备方法。
背景技术:
2.玫瑰天竺葵精油提取自最具玫瑰香味的玫瑰天竺葵,经常用作昂贵的玫瑰精油的替代品,并被称为“穷人的玫瑰油”,适合于大众使用和大规模生产。玫瑰天竺葵精油不仅可以添加到各种高级香皂、香水及香料产品中,还可用于防治蚊虫,作为食品中的天然抗菌剂等,并且由于其单萜醇类及倍半萜烯类含量较高,还具有消炎、利胆、防癌、抗癌等功效。玫瑰天竺葵精油无毒、无刺激性,未表现出副作用,因而广泛用于香料、化妆品、食品和制药行业。但玫瑰天竺葵精油和绝大多数植物精油一样,为脂溶性液体,几乎不溶于水,挥发性高,稳定性差,极大程度上限制了其在人体及临床上的进一步应用。因此,需要探索新的递送或包埋技术来减少其试验和应用的限制条件并保证其实际环境中的生物活性。
3.微胶囊技术是一种在固体、液体或气体材料上施加聚合物涂层以形成微型囊状物的封装保护技术,可在胶囊内部形成微环境,控制其与外部之间的相互作用,以保护内部敏感成分,降低外界因素对其影响,有利于芯材表面被进一步修饰,有效地改善功效成分在加工过程中存在的不易溶解、生物利用度低以及稳定性差等问题,在一定程度上还可以增加被包埋物质的生物活性。制备微胶囊目前常用的方法有乳液聚合、喷雾干燥、层层自组装、复凝聚等,其中,最普遍的包埋方法为喷雾干燥法,如温礼馨等采用喷雾干燥法制备了薰衣草精油微胶囊,提高了薰衣草精油的稳定性并延缓其释放。但喷雾干燥中的高温操作不利于香精等热敏性物质的包埋,其应用有一定的限制。
4.近年来较为新兴的复合凝聚法是使用两种或两种以上带有相反电荷的水溶性高分子电解质做包埋材料,通过调节ph使电荷中和引起壁材凝聚,从而包埋芯材的方法,具有操作简单、反应条件较为温和、成品产率较高、稳定性好等优势。并且对于一些不能加热的油脂,可以进一步采用冷冻干燥除去水分来避免喷雾干燥的高温,保证功能成分的生物活性。谭睿等以蛋白和多糖为壁材,通过复合凝聚制备了绿咖啡油微胶囊,研究发现微胶囊能很好地负载绿咖啡油,并使其热稳定性显著提高。但现有研究往往仅对反应ph进行优化,忽略对产品性能同样影响较大的壁材种类、添加量及比例,芯材添加量等问题,并且对于芯材能否保持功能特性,如抗氧化性和抑菌性的研究不够充分。因此,研发一种具有良好抗氧化和抑菌性能的精油微胶囊是十分必要的。
技术实现要素:
5.本发明的目的是提供一种具有良好抗氧化和抑菌性能的玫瑰天竺葵精油微胶囊的制备方法,以克服芯材热稳定性较差、功能特性有待提高等问题。本发明采用复合凝聚及真空冷冻干燥相结合的方法,通过对ph、芯壁材的优化制备玫瑰天竺葵微胶囊产品,最大程
度上提高了其活性和功效。
6.为实现上述目的,本发明提供了如下方案:
7.本发明目的之一是提供一种具有良好抗氧化和抑菌性能的玫瑰天竺葵精油微胶囊的制备方法,包括以下步骤:
8.在蛋白质分散液中加入玫瑰天竺葵精油进行第一次剪切、均质,再加入多糖分散液进行第二次剪切、均质;第一次调节ph,使蛋白质和多糖发生复凝聚反应,反应30min后冷却,第二次调节ph值,加入固化剂,反应3h得到微胶囊浊液,经干燥得到玫瑰天竺葵精油微胶囊。
9.进一步地,所述蛋白质分散液是将蛋白质溶于去离子水中得到,蛋白质分散液的质量分数为1~2%,优选为1%。
10.进一步地,所述多糖分散液是将多糖溶于去离子水中得到,多糖分散液的质量分数为0.5~2%,优选为0.5~1%。
11.进一步地,所述蛋白质分散液和多糖分散液是将蛋白质和多糖分别溶于去离子水中,室温下600rpm搅拌6h,使其充分水化。
12.进一步地,所述玫瑰天竺葵精油的质量分数为0.25~1%。
13.进一步地,所述蛋白质为动物蛋白和/或植物蛋白;
14.进一步地,所述动物蛋白为乳清蛋白、乳清分离蛋白、乳铁蛋白、酪蛋白、卵蛋白、鱼糜蛋白和明胶中的一种或多种;所述植物蛋白为大豆蛋白和花生蛋白中的一种或两种;所述蛋白质优选为乳清分离蛋白。
15.进一步地,所述多糖为壳聚糖盐酸盐、羧甲基壳聚糖、阿拉伯胶、海藻酸钠、甜菜果胶、透明质酸和黄原胶中的一种或多种,所述多糖优选为壳聚糖盐酸盐或羧甲基壳聚糖。
16.进一步地,所述第一次剪切和第二次剪切的条件均为:转速10000~15000rpm,时间3~5min;条件可进一步优选为:转速10000rpm,时间3min。
17.进一步地,所述第一次均质和第二次均质的条件均为:压力50~60mpa,循环2~3次;条件可进一步优选为:压力50mpa,循环3次。
18.进一步地,所述第一次调节ph为用氢氧化钠或盐酸调至2~7,优选为4~7,第二次调节ph为用氢氧化钠或盐酸调至5~6,优选为6。
19.进一步地,所述冷却为冰水浴降温至0~5℃。
20.进一步地,所述固化剂为谷氨酰胺转氨酶(简写为tg酶,酶活力为100u),添加量为体系总质量的0.25~0.3%,优选为0.25%。
21.进一步地,所述干燥为真空冷冻干燥。
22.本发明目的之二是提供一种所述的制备方法制备得到的玫瑰天竺葵精油微胶囊。
23.在本发明中,所有原料均为常规市售原料。
24.本发明公开了以下技术效果:
25.(1)本发明制得的玫瑰天竺葵精油微胶囊,以蛋白质和多糖作为壁材,以玫瑰天竺葵精油作为芯材,具有“内疏水,外亲水”的结构,解决了玫瑰天竺葵精油不溶于水的问题,拓宽其应用范围,提高其应用价值。
26.(2)本发明通过复凝聚反应及真空冷冻干燥技术制得微胶囊,反应条件温和,生成过程中不涉及芯壁材间的化学变化,有效地保留玫瑰天竺葵精油中的有效功能成分。
27.(3)本发明制得的微胶囊可使玫瑰天竺葵精油的抗氧化性更好地发挥,并且微胶囊产品具有良好的抑菌性能,适用于食品、药品、保健品和化妆品等行业,具有广泛应用价值。
28.(4)本发明中所用材料均为食品级大分子原料,不含有机试剂,安全无害,制备工艺简单,易于推广;同时选取的玫瑰天竺葵精油,最具玫瑰香味,同样具有一系列的生物活性,相比于玫瑰精油等较为昂贵的精油,其价格相对便宜,更能满足工业大规模生产的需求并为广大消费者所接受。
附图说明
29.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单的介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
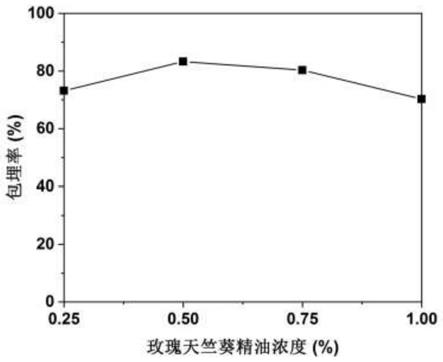
30.图1为实施例1制得微胶囊对于玫瑰天竺葵精油的包埋率;
31.图2为实施例2制得微胶囊的激光共聚焦扫描电镜图;
32.图3为实施例2制得微胶囊的傅立叶红外光谱图;
33.图4为实施例2制得微胶囊的dpph自由基清除率图;
34.图5为实施例2制得微胶囊对于大肠杆菌(a)和金黄色葡萄球菌(b)的生长影响图;
35.图6为实施例3中制得微胶囊对于玫瑰天竺葵精油的包埋率;
36.图7为实施例4制得微胶囊的激光共聚焦扫描电镜图;
37.图8为实施例4制得微胶囊的傅立叶红外光谱图;
38.图9为实施例4制得微胶囊的dpph自由基清除率图;
39.图10为实施例4制得微胶囊对于大肠杆菌(a)和金黄色葡萄球菌(b)的生长影响图。
具体实施方式
40.现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
41.应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为还具体公开了该范围的上限和下限之间的每个中间值。在任何陈述值或陈述范围内的中间值以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
42.除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。
43.在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多
种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实施方式对技术人员而言是显而易见的。本发明说明书和实施例仅是示例性的。
44.关于本文中所使用的“包含”、“包括”、“具有”、“含有”等等,均为开放性的用语,即意指包含但不限于。
45.本发明所指的室温即为室内温度,是为本领域技术人员所熟知的,在此不再赘述;尤其需要指出的是,在本发明中所指的室温为25℃。
46.实施例1
47.按照下述方法利用乳清分离蛋白(简写为wpi)和壳聚糖盐酸盐(简写为ch)为壁材,不同浓度的玫瑰天竺葵精油为芯材,利用复凝聚法制得玫瑰天竺葵精油微胶囊:
48.(1)将乳清分离蛋白和壳聚糖盐酸盐分别溶于去离子水中,室温下600rpm搅拌6h,使其充分水合,分别得到质量分数均为1%的乳清分离蛋白分散液和壳聚糖盐酸盐分散液。
49.(2)在步骤(1)所得乳清分离蛋白分散液中加入适量玫瑰天竺葵精油,得到乳清分离蛋白质量分数为1%,玫瑰天竺葵精油质量分数分别为0.25%、0.5%、0.75%、1.0%的几组混合液。
50.(3)对步骤(2)所得的几组混合液进行剪切和均质:剪切转速10000rpm,剪切时间3min;均质压力50mpa,循环次数3次;然后向其中加入步骤(1)所得的壳聚糖盐酸盐分散液。
51.(4)对步骤(3)所得的几组混合液进行剪切和均质:剪切转速10000rpm,剪切时间3min;均质压力50mpa,循环次数3次;得到0.5wt.%wpi 0.25wt.%玫瑰天竺葵精油 0.5wt.%ch、0.5wt.%wpi 0.5wt.%玫瑰天竺葵精油 0.5wt.%ch、0.5wt.%wpi 0.75wt.%玫瑰天竺葵精油 0.5wt.%ch、0.5wt.%wpi 1.0wt.%玫瑰天竺葵精油 0.5wt.%ch的混合液。
52.(5)缓慢滴加氢氧化钠调节步骤(4)所得的各种混合液ph至6.7,使其发生复凝聚反应,反应30min后使用冰水浴将体系降温至5℃。
53.(6)调节步骤(5)各体系ph至6,加入质量分数为0.25%的tg酶(酶活力为100u)进行固化反应3h,得到微胶囊浊液;经过真空冷冻干燥得到玫瑰天竺葵精油微胶囊粉末。
54.按照下述方法测定实施例1所得微胶囊对于玫瑰天竺葵精油的包埋率:
55.a.利用紫外分光光度法测试微胶囊的包埋率,应制定吸光度关于玫瑰天竺葵精油的乙醇溶液浓度的回归方程,具体方法如下:
56.移取10μl玫瑰天竺葵精油至10ml容量瓶中,用95%乙醇定容摇匀,制备成浓度为1μl/ml的精油母液。从母液中移取400μl至10ml容量瓶中,用95%乙醇定容摇匀,制备成浓度为0.04μl/ml的精油标准样品。对标准样品在200
‑
500nm间进行全波段扫描,得到玫瑰天竺葵精油的最大吸收波长。
57.从精油母液中分别吸取0、100、200、300、400、500μl至10ml容量瓶中,然后用95%乙醇定容摇匀,配制成0.00、0.01、0.02、0.03、0.04、0.05μl/ml精油标准溶液。在最大吸收波长下测定系列标准溶液的吸光度值,以玫瑰天竺葵精油浓度为横坐标,吸光度值为纵坐标,绘制精油标准曲线。
58.b.包埋率的测定:
59.取上述方法得到的各种微胶囊粉末0.01g,用95%乙醇淋洗,取滤液测其吸光度,得到未被包埋的玫瑰天竺葵精油的含量;另取0.01g微胶囊粉末加入50ml乙醇中,用600w超
声波处理10min,置350rpm下搅拌2h至从胶囊中完全提取油,过滤除去混合溶液中的不溶物,用分光光度计测定上述溶液的吸光度,得到样品中的总油量。包埋率计算公式如下:
[0060][0061]
如图1所示为实施例1所得微胶囊对于玫瑰天竺葵精油的包埋率。横轴0.25%、0.5%、0.75%、1.0%分别代表0.5wt.%wpi 0.25wt.%玫瑰天竺葵精油 0.5wt.%ch、0.5wt.%wpi 0.5wt.%玫瑰天竺葵精油 0.5wt.%ch、0.5wt.%wpi 0.75wt.%玫瑰天竺葵精油 0.5wt.%ch、0.5wt.%wpi 1.0wt.%玫瑰天竺葵精油 0.5wt.%ch的微胶囊。可以看出芯材浓度在0.25~1%范围内,微胶囊的包埋率先上升后下降,在芯材浓度为0.5%时,包埋率达到了83.28%。可见玫瑰天竺葵精油能够被包埋形成微胶囊,其中0.5wt.%wpi 0.5wt.%玫瑰天竺葵精油 0.5wt.%ch组效果最好。
[0062]
实施例2
[0063]
按照下述方法利用乳清分离蛋白(简写为wpi)和壳聚糖盐酸盐(简写为ch)为壁材,玫瑰天竺葵精油为芯材,利用复凝聚法制得玫瑰天竺葵精油微胶囊:
[0064]
(1)将乳清分离蛋白和壳聚糖盐酸盐分别溶于去离子水中,室温下600rpm搅拌6h,使其充分水合,分别得到质量分数均为1%的乳清分离蛋白分散液和壳聚糖盐酸盐分散液。
[0065]
(2)在步骤(1)所得乳清分离蛋白分散液中加入质量分数为0.5%的玫瑰天竺葵精油,得到混合液。
[0066]
(3)对步骤(2)所得的混合液进行剪切和均质:剪切转速12000rpm,剪切时间3min;均质压力55mpa,循环次数3次;然后向其中加入步骤(1)所得的壳聚糖盐酸盐分散液。
[0067]
(4)对步骤(3)所得的混合液进行剪切和均质:剪切转速12000rpm,剪切时间3min;均质压力55mpa,循环次数3次;得到0.5wt.%wpi 0.5wt.%玫瑰天竺葵精油 0.5wt.%ch的混合液。
[0068]
(5)缓慢滴加氢氧化钠调节步骤(4)所得混合液的ph至4,使其发生复凝聚反应,反应30min后使用冰水浴将体系降温至0℃。
[0069]
(6)调节步骤(5)各体系ph至5,加入质量分数为0.3%的tg酶(酶活力为100u)进行固化反应3h,得到微胶囊浊液;经过真空冷冻干燥得到玫瑰天竺葵精油微胶囊粉末。
[0070]
按照下述方法测定实施例2中制得微胶囊的微观图像:
[0071]
使用生物激光共聚焦显微镜(clsm)观察微胶囊的微观结构。油相用3μl尼罗红(nile red,0.1wt%,溶于二甲基亚砜)进行染色,蛋白质用3μl快绿(fast green,0.1wt%,溶于蒸馏水)进行染色。将15μl样品滴到玻璃载玻片上,用两种染液混合物进行染色,选择633nm和488nm的激发波长,在40
×
下获得clsm图像,其中蛋白被染为红色,油相被染为绿色。
[0072]
如图2所示为实施例2所得0.5wt.%wpi 0.5wt.%玫瑰天竺葵精油 0.5wt.%ch微胶囊的微观图像,其中蛋白质经快绿染色后在633nm出波长处激发显现红色,玫瑰天竺葵精油经尼罗红染色后在488nm波长处激发显现为绿色。可以看出红色的水相围绕绿色的油相形成微胶囊,微胶囊为球形,大小在10μm左右,形态良好。
[0073]
按照下述方法测定实施例2中制得微胶囊的傅立叶红外光谱:
[0074]
取适量微胶囊真空冷冻干燥后的粉末,加入样品质量50~100倍的kbr后进行研磨,放入模具,用压片机抽真空压制成片,对于玫瑰天竺葵精油将其滴加kbr压片上进行测量,选用空白kbr片作为背景。将样品和空白压片置于红外光谱仪上,于400~4000cm
‑1范围内进行扫描,扫描次数32次,分辨率4cm
‑1。
[0075]
如图3所示为玫瑰天竺葵精油和实施例2所得微胶囊的红外光谱。可以看出微胶囊在1063cm
‑1和1406cm
‑1处的吸收峰较强,这是玫瑰天竺葵精油中香茅醇、芳香醚和烯烃类等物质的影响,并且玫瑰天竺葵精油包埋于微胶囊后在2926cm
‑1处的c
‑
h的伸缩振动吸收峰和1717cm
‑1、1445cm
‑1、1369cm
‑1的特征峰强度有所减弱。玫瑰天竺葵精油微胶囊的红外光谱上未发现不存在于玫瑰天竺葵精油中的特殊峰值,只是各峰值不同程度地削弱或加强,可能是由于物质混合所致,这说明了微胶囊化的过程中没有新的化学键生成,没有其他化学反应发生,有利于保证芯材的完整性和生物活性。
[0076]
按照下述方法测定实施例2中制得微胶囊的抗氧化性:
[0077]
将wpi和ch等比例共同溶于去离子水,室温下600rpm搅拌6h,得到总质量分数为1%的wpi
‑
ch分散液,调节ph至6.7形成复聚物,经真空冷冻干燥形成复聚物粉末。取0.01g精油、复聚物粉末和微胶囊粉末分别加入50ml乙醇中,用600w超声波处理10min,然后在25℃下保持12h。将1ml提取液和2ml 0.1mm的dpph溶液(乙醇溶解)加入离心管,涡旋振荡,充分混合,室温避光孵育30min,在517nm波长处测吸光度值,分别做空白组、对照组、试验组,如表1:
[0078]
表1 dpph自由基清除率方法及各试剂加入量
[0079][0080][0081]
根据以下公式计算dpph自由基清除率:
[0082]
dpph自由基清除率=1-(a1-a2)/a0×
100%
[0083]
如图4所示dpph自由基清除率图,横轴wpi
‑
ch、essential oil、wpi
‑
ch
‑
oil分别代表wpi
‑
ch复聚物、玫瑰天竺葵精油、0.5wt.%wpi 0.5wt.%玫瑰天竺葵精油 0.5wt.%ch微胶囊。可以看出0.2mg/ml的壁材复聚物的自由基清除率极低(1.178%),说明单独的复聚物在该条件下几乎无抗氧化作用。玫瑰天竺葵精油的自由基清除率也仅为5.60%,这是因为精油易挥发、不稳定,在实验过程中有所损失,较低浓度下未经处理的精油难以较好地发挥抗氧化作用。与之对应的微胶囊的自由基清除率达到了54.55%,说明微胶囊能够很好地保护芯材,并能使其抗氧化能力更好地发挥。
[0084]
按照下述方法测定实施例2中制得微胶囊的抑菌性:
[0085]
从
‑
80℃冰箱取出冻存的大肠杆菌和金黄色葡萄球菌,在营养琼脂平板上划线,放于37℃下培养24h得到单菌落。挑取营养琼脂平板上的单菌落于30ml营养肉汤中,摇床培养过夜(130rpm,37℃)。收集过夜培养物于50ml离心管中,用无菌磷酸盐缓冲溶液清洗菌体两
次(8000
×
g,5min,4℃),并用营养肉汤重新悬浮菌体,调节菌悬液od 600nm至合适值,备用。然后在96孔板中加入菌悬液,对复聚物溶液和玫瑰天竺葵精油微胶囊进行稀释,浓度范围为12.5~200μl/ml,测定各孔吸光度值。然后将板放于37℃下培养24h,再次测定培养后各孔的吸光度值,计算培养前后吸光度的差值。二者之差小于0.05所对应的最小浓度即为最小抑菌浓度,根据吸光度的变化得出复聚物玫瑰天竺葵精油微胶囊的抑菌能力。
[0086]
如图5所示,(a)、(b)分别为实施例2中复聚物和微胶囊对大肠杆菌和金黄色葡萄球菌生长的影响。可以看出wpi
‑
ch复聚物对大肠杆菌有一定的抑制能力,但效果不佳,并且其对于金黄色葡萄球菌抑制作用不明显;微胶囊在浓度达到100μl/ml时,显著抑制了大肠杆菌和金黄色葡萄球菌的生长,进一步增加浓度抑制作用更加明显。这是因为精油能够破坏细菌的细胞膜,同时其中富含的酚类物质能够穿过细菌的磷脂双分子层,与蛋白质结合,阻止它们发挥正常功能,而微胶囊能够在体系中缓慢释放玫瑰天竺葵精油,从而长时间地抑制细菌的生长和繁殖,发挥抑菌作用。
[0087]
实施例3
[0088]
按照下述方法利用乳清分离蛋白(简写为wpi)和羧甲基壳聚糖(简写为cmcs)为壁材,不同浓度的玫瑰天竺葵精油为芯材,利用复凝聚法制得玫瑰天竺葵精油微胶囊:
[0089]
(1)将乳清分离蛋白和羧甲基壳聚糖分别溶于去离子水中,室温下600rpm搅拌6h,使其充分水合,分别得到质量分数均为1%的乳清分离蛋白分散液和羧甲基壳聚糖分散液。
[0090]
(2)在步骤(1)所得乳清分离蛋白分散液中加入适量玫瑰天竺葵精油,得到乳清分离蛋白质量分数为1%,玫瑰天竺葵精油质量分数分别为0.25%、0.5%、0.75%、1.0%的几组混合液。
[0091]
(3)对步骤(2)所得的几组混合液进行剪切和均质:剪切转速10000rpm,剪切时间3min;均质压力50mpa,循环次数3次;然后向其中加入步骤(1)所得的羧甲基壳聚糖分散液。
[0092]
(4)对步骤(3)所得的几组混合液进行剪切和均质:剪切转速10000rpm,剪切时间3min;均质压力50mpa,循环次数3次;得到0.5wt.%wpi 0.25wt.%玫瑰天竺葵精油 0.5wt.%cmcs、0.5wt.%wpi 0.5wt.%玫瑰天竺葵精油 0.5wt.%cmcs、0.5wt.%wpi 0.75wt.%玫瑰天竺葵精油 0.5wt.%cmcs、0.5wt.%wpi 1.0wt.%玫瑰天竺葵精油 0.5wt.%cmcs的混合液。
[0093]
(5)缓慢滴加盐酸调节步骤(4)所得的各种混合液ph至5.6,使其发生复凝聚反应,反应30min后使用冰水浴将体系降温至2℃。
[0094]
(6)调节步骤(5)各体系ph至6.0,加入质量分数为0.25%的tg酶(酶活力为100u)进行固化反应3h,得到微胶囊浊液;经过真空冷冻干燥得到玫瑰天竺葵精油微胶囊粉末。
[0095]
按照与实施例1中相同的方法测定实施例3所得微胶囊对于玫瑰天竺葵精油的包埋率:
[0096]
如图6所示为实施例3所得微胶囊对于玫瑰天竺葵精油的包埋率。横轴0.25%、0.5%、0.75%、1.0%分别代表0.5wt.%wpi 0.25wt.%玫瑰天竺葵精油 0.5wt.%cmcs、0.5wt.%wpi 0.5wt.%玫瑰天竺葵精油 0.5wt.%cmcs、0.5wt.%wpi 0.75wt.%玫瑰天竺葵精油 0.5wt.%cmcs、0.5wt.%wpi 1.0wt.%玫瑰天竺葵精油 0.5wt.%cmcs的微胶囊。与实施例1类似,芯材浓度在0.25%~1%范围内,微胶囊的包埋率先上升后下降,在芯材浓度为0.75%时,包埋率达到了80.30%。可见玫瑰天竺葵精油能够被两种壁材包埋形成微胶
囊,在该实施例中0.5wt.%wpi 0.75wt.%玫瑰天竺葵精油 0.5wt.%cmcs组效果最好。
[0097]
实施例4
[0098]
按照下述方法利用乳清分离蛋白(简写为wpi)和羧甲基壳聚糖(简写为cmcs)为壁材,玫瑰天竺葵精油为芯材,利用复凝聚法制得玫瑰天竺葵精油微胶囊:
[0099]
(1)将乳清分离蛋白和羧甲基壳聚糖分别溶于去离子水中,室温下600rpm搅拌6h,使其充分水合,分别得到质量分数均为1%的乳清分离蛋白分散液和羧甲基壳聚糖分散液。
[0100]
(2)在步骤(1)所得乳清分离蛋白分散液中加入质量分数为0.75%的玫瑰天竺葵精油,得到混合液。
[0101]
(3)对步骤(2)所得的混合液进行剪切和均质:剪切转速15000rpm,剪切时间3min;均质压力60mpa,循环次数3次;然后向其中加入步骤(1)所得的羧甲基壳聚糖分散液。
[0102]
(4)对步骤(3)所得的混合液进行剪切和均质:剪切转速15000rpm,剪切时间3min;均质压力60mpa,循环次数3次;得到0.5wt.%wpi 0.75wt.%玫瑰天竺葵精油 0.5wt.%cmcs的混合液。
[0103]
(5)缓慢滴加盐酸调节步骤(4)所得的各种混合液ph至2,使其发生复凝聚反应,反应30min后使用冰水浴将体系降温至3℃。
[0104]
(6)调节步骤(5)各体系ph至6.0,加入质量分数为0.25%的tg酶(酶活力为100u)进行固化反应3h,得到微胶囊浊液;经过真空冷冻干燥得到玫瑰天竺葵精油微胶囊粉末。
[0105]
按照与实施例2中相同的方法测定实施例4所得微胶囊的微观图像:
[0106]
如图7所示为实施例4所得微胶囊的微观图像。同样可以看出红色的水相围绕绿色的油相形成微胶囊,微胶囊为球形,大小在20μm左右。相比于实施例2中制得的微胶囊粒径较大且较圆润,这是由于其油相添加相对较多。
[0107]
按照与实施例2中相同的方法测定实施例4所得微胶囊的傅立叶红外光谱:
[0108]
如图8所示为玫瑰天竺葵精油和实施例4所得微胶囊的红外光谱。可以看出形成的微胶囊的红外光谱的吸收峰的增强和减弱情况与实施例1中相似,表明使用不同壁材制备胶囊的过程中均没有新的化学键生成,没有其他化学反应发生,有利于保证芯材的完整性和生物活性。
[0109]
按照与实施例2中相同的方法测定实施例4所得微胶囊的抗氧化性:
[0110]
如图9所示dpph自由基清除率图,横轴wpi
‑
cmcs、essential oil、wpi
‑
cmcs
‑
oil分别代表wpi
‑
cmcs复聚物、玫瑰天竺葵精油、0.5wt.%wpi 0.75wt.%玫瑰天竺葵精油 0.5wt.%cmcs微胶囊。可以看出0.2mg/ml的壁材复聚物的自由基清除率同样很低(3.067%),而微胶囊的自由基清除率达到了53.11%,说明微胶囊能够很好地保护芯材,并能使其抗氧化能力更好地发挥。
[0111]
按照与实施例2中相同的方法测定实施例4所得微胶囊的抑菌性:
[0112]
如图10所示,(a)、(b)分别为实施例4中复聚物和微胶囊对大肠杆菌和金黄色葡萄球菌生长的影响。可以看出wpi
‑
cmcs复聚物对大肠杆菌和金黄色葡萄球菌抑制作用均不明显;微胶囊在浓度达到100μl/ml时对大肠杆菌有明显的抑制作用,达到200μl/ml使其不再生长,但对于金黄色葡萄球菌的抑制能力相对较弱。总体来说,玫瑰天竺葵精油的添加使微胶囊能够很好地抑制革兰氏阴性菌大肠杆菌和革兰氏阳性菌金黄色葡萄球菌的生长,为玫瑰天竺葵精油作为稳定的天然食品抗菌剂提供了依据。
[0113]
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。