1.本发明涉及一种绿色的可见光催化的乙酰胺化合物的制备方法,属于有机合成技术领域。
背景技术:
2.酰胺键是一种广泛存在于自然界的基本官能团。据统计,约四分之一的上市药物与三分之二的候选药物含有酰胺键。酰胺键的形成是药物合成化学中应用最广泛的有机化学反应。因此,将酰胺键引入有机分子中显得尤为重要。通过文献调查发现,目前合成酰胺化合物的方法都存在一些不足之处,诸如反应条件苛刻,产率低、底物范围窄、反应高温、使用比较昂贵的金属催化剂、需要过量的酸碱添加剂等。例如:(1) 1937年,olson课题组以吡啶作为碱,在热反应条件下实现乙酰胺和胺的定量乙酰化。但是,该方法需要较高的温度,底物范围比较局限。(参见:olson, v. r.; feldman, h. b. quantitative acetylation of amines by means of acetyl chloride and pyridine. j. am. chem. soc.1937, 59, 10, 2003
‑
2005.);(2) 2019年,严国兵课题组以醋酸铜为催化剂,乙腈为溶剂,在80℃条件下实现富电子的苯胺与硫代乙酸盐合成乙酰胺。该方法底物范围非常局限,仅适用于一级富电子芳胺。(参见:yan, g.; huang, d.; yu, j.; zhang, j.; ke, q.; tian, f.; jiang, b.; ji, c. a.; zhang, l. copper
‑
catalyzed acetylation of electron
‑
rich phenols and anilines. synlett2019, 30, 06, 726
‑
730.);(3) 2019年,asachenko等人报道了苯酯胺解法来合成酰胺。该方法需要采用易制爆的氢化钠为碱;反应需要130℃的高温;底物比较局限,仅能合成二级芳酰胺;反应时间较长;反应条件比较危险。(参见:zhevskiy, s. a.; ageshina, a. a.; chesnokov, g. a.; gribanov, p. s.; topchiy, m. a.; nechaev, m. s.; asachenko, a. f. solvent
‑ꢀ
and transition metal
‑
free amide synthesis from phenyl esters and aryl amines. rsc advances. 2019, 9, 3, 1536
‑
1540.);(4)2019年,吴晓峰课题组利用乙酰丙酮钯为催化剂,六羰基钼为酰基源,过量的碳酸钾为碱,在110℃的高温下实现了由芳基硼酸和硝基苯制备二级芳香族酰胺。该体系新颖,但是操作复杂,不仅需要昂贵的催化剂和酰基源,还需要加入复杂的配体结构,很难在工业上有所应用。(参见:peng, j. b.; li, d.; geng, h. q.; wu, x. f. palladium
‑
catalyzed amide synthesis via aminocarbonylation of arylboronic acids with nitroarenes. org. lett. 2019, 21, 12, 4878
‑
4881.);(5)2007年,adapa课题组,三(乙酰丙酮酸)钌为催化剂,乙酰氯为酰基源,成功制备乙酸酯类化合物。该方法虽然产率较高,但是使用了比较昂贵的金属催化剂,并且由于乙酰氯易水解,将不利于工业上的大规模合成应用。(参见:varala, r.; nasreen, a.; adapa, s. r., ruthenium(iii) acetylacetonate [ru(acac)3] — an efficient recyclable catalyst for the acetylation of phenols, alcohols, and amines under neat conditions. can. j. chem.2007, 85, 148
‑
152.);(6)2021年,姚秋丽课题组,以亚硝基苯为原料,过量的氯化钠为添加剂,2,3
‑
丁二酮为乙酰基源,实现一级芳香族乙酰胺的制备。该方法采用了价格较昂
贵的且易制爆、毒性大的亚硝基苯为原料。并且原料需要预制备,传统的亚硝基苯由苯胺氧化制备获得。除此之外,该方法底物普适性差,仅适用于一级芳胺。(参见:ran, m.; he, j.; yan, b.; liu, w.; li, y.; fu, y.; li, c. j.; yao, q., catalyst
‑
free generation of acyl radicals induced by visible light in water to construct c
‑
n bonds. org. biomol. chem.2021, 19, 1970
‑
1975.)。
[0003]
综上所述,目前报道的这些酰胺化合物的合成方法,反应过程比较繁琐,采用过量的碱、昂贵的金属催化剂以及酰基源、反应条件比较苛刻、反应模式比较单一(绝大多数为热反应)。因此,发展一种原料来源丰富、底物范围广、绿色、温和、高效、节能、环境友好的可见光催化的乙酰胺化方法显得尤为重要。
技术实现要素:
[0004]
本发明的目的是提供一种绿色、环境友好、节能高效的可见光催化的方法来合成乙酰胺化合物,光化反应中的“光”是一种特殊的、能够参与反应的试剂,利用具有可见光吸收的金属配合物、有机染料或半导体作为光敏剂,引发后续的反应。与经典的热化学反应相比,光化学反应具有以下特点:(1)热化学反应需要较大的活化能,需要加热到一定温度反应才能发生;而光化学反应所需活化能很小,因此在室温下可以快速进行;(2)复杂的分子往往含有多个活性基团。热化学反应中要使其中某一个基团发生反应,需要将其它基团保护起来;而光化学反应可以根据基团在分子中的部位不同特定激发某一基团来引发反应的发生;(3)多数情况下热化学反应与光化学反应的产物不同,因此可利用光化学反应合成热化学反应不能合成的产物。基于光化学反应的这些性质,本发明的优越性显而易见,该反应体系中光源led灯廉价易得、原料来源丰富、反应底物普适性广(一、二、三、级脂肪胺和芳香胺均兼容于该体系)、反应条件温和、无需任何酸碱添加剂、无催化剂、廉价的2,3
‑
丁二酮作为反应原料,反应操作简便。
[0005]
为达到上述发明目的,本发明采用的技术方案是:一种绿色的可见光催化的乙酰胺化合物的制备方法,在可见光照射下,以胺、酮为原料,反应制备乙酰胺化合物。
[0006]
上述技术方案中,所述胺的化学结构式如下:所述乙酰胺化合物的化学结构式如下:上述化学结构式中,r1选自萘基、7
‑
氮杂吲哚基、烷基、苯并噻唑基、苯基以及单取代或多取代芳基,其中取代基为甲基、异丙基、叔丁基、甲氧基、叔丁基、硝基、羟基、氰基、酯基、苯基、氟、氯、溴、三氟甲基、三氟甲氧基、乙酰氧基、氨基、乙酰氨基、磺酰胺基等;r2选自氢或者烷基。
[0007]
上述技术方案中,所述可见光为le灯光,led灯为白灯、绿灯或者蓝灯;瓦数为18w~60w。优选的技术方案中,所述的led灯为白灯;白灯的瓦数为40w。
mmol, 103.3 mg)、乙醇 (95%, 0.5 ml);然后在40w白色led照射下常规搅拌6小时后,反应体系用饱和亚硫酸钠溶液淬灭,用乙酸乙酯萃取3次,合并有机层,用无水硫酸钠干燥。用旋转蒸发仪除去溶剂、硅胶吸附,通过简单的柱层析即可得产物3a,收率为85%。所制得产物的主要测试数据如下,通过分析可知,实际合成产物与理论分析一致。
[0016]1h nmr (400 mhz, dmso) δ 10.05 (s, 1h), 7.56
ꢀ–ꢀ
7.44 (m, 4h), 2.04 (s, 3h). 13
c nmr (100 mhz, dmso) δ 168.4, 138.7, 131.4, 120.8, 114.5, 24.0. hrms (esi
‑
tof): anal calcd. for. c8h
879
brno h
:213.9862, found: 213.9860; c8h
881
brno h
: 215.9842, found: 215.9840. ir (neat, cm
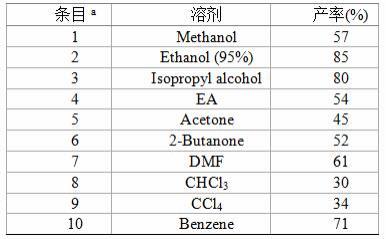
‑1): υ 3376, 2851, 1649, 1538, 1491, 1396, 1258, 1046, 991, 825, 763.将上述制备方法中的95%乙醇更换为0.5ml的其它溶剂,其余不变,收率如下:
a
反应条件: 空气氛围, 1a (0.2 mmol),2a (6.0 equiv.) ,溶剂 (0.5 ml) ,40 w 白色 leds 照射6h。
[0017]
实施例二在25 ml schlenk试管中依次加入胺1b (0.2 mmol,24.6 mg)、2,3
‑
丁二酮 (1.2 mmol, 103.3 mg)、乙醇 (95%, 0.5 ml);然后在40w白色led照射下常规搅拌6小时后,反应体系用饱和亚硫酸钠溶液淬灭,用乙酸乙酯萃取3次,合并有机层,用无水硫酸钠干燥。用旋转蒸发仪除去溶剂、硅胶吸附,通过简单的柱层析即可得产物3b,收率为69%。所制得产物的主要测试数据如下,通过分析可知,实际合成产物与理论分析一致。
[0018]1h nmr (400 mhz, dmso) δ 9.76 (s, 1h), 7.48
ꢀ–ꢀ
7.46 (m, 2h), 6.86
ꢀ–ꢀ
6.84 (m, 2h), 3.70 (s, 3h), 2.00 (s, 3h). 13
c nmr (100 mhz, dmso) δ 167.7, 155.0, 132.5, 120.5, 113.8, 55.1, 23.8. hrms (esi
‑
tof): c9h
11
no2 h
: 166.0863, found: 166.0862. ir (neat, cm
‑1): υ 3365, 1645, 1553, 1512, 1246, 1024, 990, 826, 763.实施例三
在25 ml schlenk试管中依次加入胺1c (0.2 mmol,22.2 mg)、2,3
‑
丁二酮 (1.2 mmol, 103.3 mg)、乙醇 (95%, 0.5 ml);然后在40w白色led照射下常规搅拌6小时后,反应体系用饱和亚硫酸钠溶液淬灭,用乙酸乙酯萃取3次,合并有机层,用无水硫酸钠干燥。用旋转蒸发仪除去溶剂、硅胶吸附,通过简单的柱层析即可得产物3c,收率为83%。所制得产物的主要测试数据如下,通过分析可知,实际合成产物与理论分析一致。
[0019]1h nmr (400 mhz, dmso) δ 9.97 (s, 1h), 7.60
ꢀ–ꢀ
7.56 (m, 2h), 7.14
‑
7.09 (m, 2h), 2.03 (s, 3h). 13
c nmr (100 mhz, dmso) δ 168.1, 157.8 (d, j = 237.0 hz), 135.7 (d, j = 3.0 hz), 120.7 (d, j = 7.0 hz), 115.2 (d, j = 22 hz), 23.9. 19
f nmr (377 mhz, dmso) δ
ꢀ‑
119.8 (s, 1f). hrms (esi
‑
tof): anal calcd. for. c8h8fno h
: 154.0663, found: 154.0661. ir (neat, cm
‑1): υ 3360, 1645, 1509, 1406, 1377, 1213, 1024, 989, 826.实施例四在25 ml schlenk试管中依次加入胺1d (0.2 mmol,35.4 mg)、2,3
‑
丁二酮 (1.2 mmol, 103.3 mg)、乙醇 (95%, 0.5 ml);然后在40w白色led照射下常规搅拌6小时后,反应体系用饱和亚硫酸钠溶液淬灭,用乙酸乙酯萃取3次,合并有机层,用无水硫酸钠干燥。用旋转蒸发仪除去溶剂、硅胶吸附,通过简单的柱层析即可得产物3d,收率为90%。所制得产物的主要测试数据如下,通过分析可知,实际合成产物与理论分析一致。
[0020]1h nmr (400 mhz, dmso) δ 10.14 (s, 1h), 7.69
ꢀ–ꢀ
7.67 (m, 2h), 7.28
ꢀ–ꢀ
7.25 (m, 2h), 2.05 (s, 3h). 13
c nmr (100 mhz, dmso) δ 168.5, 143.3, 138.5, 121.5, 120.2, 23.9. 19
f nmr (377 mhz, dmso) δ
ꢀ‑
57.1 (s, 1f). hrms (esi
‑
tof): anal calcd. for. c9h8f3no2 h
: 220.0580, found: 220.0578. ir (neat, cm
‑1): υ 3378, 3270, 1665, 1618, 1556, 1508, 1154, 992, 825, 762, 659.实施例五在25 ml schlenk试管中依次加入胺1e (0.2 mmol,25.4 mg)、2,3
‑
丁二酮 (1.2 mmol, 103.3 mg)、乙醇 (95%, 0.5 ml);然后在40w白色led照射下常规搅拌6小时后,反应体系用饱和亚硫酸钠溶液淬灭,用乙酸乙酯萃取3次,合并有机层,用无水硫酸钠干燥。用旋转蒸发仪除去溶剂、硅胶吸附,通过简单的柱层析即可得产物3e,收率为86%。所制得产物的
主要测试数据如下,通过分析可知,实际合成产物与理论分析一致。
[0021]1h nmr (400 mhz, dmso) δ 10.05 (s, 1h), 7.61
ꢀ–ꢀ
7.59 (m, 2h), 7.34
ꢀ–ꢀ
7.32 (m, 2h), 2.04 (s, 3h). 13
c nmr (100 mhz, dmso) δ 168.4, 138.3, 128.5, 126.5, 120.5, 24.0. hrms (esi
‑
tof): anal calcd. for. c8h
835
clno h
: 170.0367, found: 170.0366; c8h
837
clno h
: 172.0338, found: 172.0340. ir (neat, cm
‑1): υ 3393, 2920, 1658, 1547, 1487, 1392, 1258, 1092, 996, 821, 709.实施例六在25 ml schlenk试管中依次加入胺1f (0.2 mmol,27.0 mg)、2,3
‑
丁二酮 (1.2 mmol, 103.3 mg)、乙醇 (95%, 0.5 ml);然后在40w白色led照射下常规搅拌6小时后,反应体系用饱和亚硫酸钠溶液淬灭,用乙酸乙酯萃取3次,合并有机层,用无水硫酸钠干燥。用旋转蒸发仪除去溶剂、硅胶吸附,通过简单的柱层析即可得产物3f,收率为94%。所制得产物的主要测试数据如下,通过分析可知,实际合成产物与理论分析一致。
[0022]1h nmr (400 mhz, dmso) δ 9.50 (s, 1h), 7.16
ꢀ–ꢀ
7.14 (m, 2h), 6.83
ꢀ–ꢀ
6.81 (m, 2h), 2.19
ꢀ–ꢀ
2.18 (m, 1h), 1.70 (s, 3h), 0.85 (d, j = 6.9 hz, 6h). 13
c nmr (100 mhz, dmso) δ 168.0, 143.0, 137.1, 126.3, 119.1, 32.8, 23.9, 23.9. hrms (esi
‑
tof): anal calcd. for. c
11
h
15
no h
: 178.1226, found:178.1225. ir (neat, cm
‑1): υ 3285, 2958, 1661, 1542, 1460, 1320, 1264, 1023, 835, 764, 608.实施例七在25 ml schlenk试管中依次加入胺1g (0.2 mmol, 43.8 mg)、2,3
‑
丁二酮 (1.2 mmol, 103.3 mg)、乙醇 (95%, 0.5 ml);然后在40w白色led照射下常规搅拌6小时后,反应体系用饱和亚硫酸钠溶液淬灭,用乙酸乙酯萃取3次,合并有机层,用无水硫酸钠干燥。用旋转蒸发仪除去溶剂、硅胶吸附,通过简单的柱层析即可得产物3g,收率为77%。所制得产物的主要测试数据如下,通过分析可知,实际合成产物与理论分析一致。
[0023]1h nmr (400 mhz, dmso) δ 10.01 (s, 1h), 7.62
ꢀ–ꢀ
7.60 (m, 2h), 7.43
ꢀ–ꢀ
7.40 (m, 2h), 2.03 (s, 3h). 13
c nmr (100 mhz, dmso) δ 168.5, 139.1, 137.3, 121.2, 86.3, 24.0. hrms (esi
‑
tof): anal calcd. for. c8h8ino h
: 261.9723, found: 261.9721. ir (neat, cm
‑1): υ 3392, 2958, 2849, 1663, 1596, 1579, 1482, 1253, 1024, 992, 814, 731, 679.实施例八
在25 ml schlenk试管中依次加入胺1h (0.2 mmol, 48.6 mg)、2,3
‑
丁二酮 (1.2 mmol, 103.3 mg)、乙醇 (95%, 0.5 ml);然后在40w白色led照射下常规搅拌6小时后,反应体系用饱和亚硫酸钠溶液淬灭,用乙酸乙酯萃取3次,合并有机层,用无水硫酸钠干燥。用旋转蒸发仪除去溶剂、硅胶吸附,通过简单的柱层析即可得产物3h,收率为64%。所制得产物的主要测试数据如下,通过分析可知,实际合成产物与理论分析一致。化合物1h为抗癌药索拉非尼中间体,对其进行修饰将有利于这类药物分子的进一步应用。
[0024]1h nmr (400 mhz, dmso) δ 10.10 (s, 1h), 8.79
ꢀ–ꢀ
8.76 (m, 1h), 8.50
‑
8.49 (m, 1h), 7.70
ꢀ–ꢀ
7.69 (m, 2h), 7.36 (d, j = 0.6 hz 1h), 7.17
ꢀ–ꢀ
7.15 (m, 2h), 7.14
ꢀ–ꢀ
7.12 (m, 1h), 2.78 (d, j = 4.9 hz, 3h), 2.06 (s, 3h). 13
c nmr (100 mhz, dmso) δ 168.8, 166.3, 164.2, 152.9, 150.8, 148.5, 137.6, 121.8, 121.2, 114.5, 109.1, 100.0, 26.5, 24.4. hrms (esi
‑
tof): anal calcd. for. c
15
h
15
n3o3 h
: 286.1186, found: 286.1184. ir (neat, cm
‑1): υ 3354, 2921, 1672, 1538, 1454, 1369, 1254, 1065, 894, 758, 685.实施例九在25 ml schlenk试管中依次加入胺1i (0.2 mmol, 30.6 mg)、2,3
‑
丁二酮 (1.2 mmol, 103.3 mg)、乙醇 (95%, 0.5 ml);然后在40w白色led照射下常规搅拌6小时后,反应体系用饱和亚硫酸钠溶液淬灭,用乙酸乙酯萃取3次,合并有机层,用无水硫酸钠干燥。用旋转蒸发仪除去溶剂、硅胶吸附,通过简单的柱层析即可得产物3i,收率为80%。所制得产物的主要测试数据如下,通过分析可知,实际合成产物与理论分析一致。
[0025]1h nmr (400 mhz, dmso) δ 8.98 (s, 1h), 7.64 (d, j = 8.7 hz, 1h), 6.59 (d, j = 2.6 hz, 1h), 6.46 (dd, j = 8.7, 2.6 hz, 1h), 3.79 (s, 3h), 3.73 (s, 3h), 2.02 (s, 3h). 13
c nmr (100 mhz, dmso) δ 168.2, 156.7, 151.5, 123.9, 120.5, 104.0, 98.7, 55.6, 55.3, 23.5. hrms (esi
‑
tof): anal calcd. for. c
10
h
13
no3 h
: 196.0968, found: 196.0968. ir (neat, cm
‑1): υ 3421, 1731, 1670, 1528, 1455, 137, 1247, 1049, 822, 760.实施例十
在25 ml schlenk试管中依次加入胺1j (0.2 mmol, 51.8 mg)、2,3
‑
丁二酮 (1.2 mmol, 103.3 mg)、乙醇 (95%, 0.5 ml);然后在40w白色led照射下常规搅拌6小时后,反应体系用饱和亚硫酸钠溶液淬灭,用乙酸乙酯萃取3次,合并有机层,用无水硫酸钠干燥。用旋转蒸发仪除去溶剂、硅胶吸附,通过简单的柱层析即可得产物3j,收率为50%。所制得产物的主要测试数据如下,通过分析可知,实际合成产物与理论分析一致。来那度胺(又称雷利度胺)已被成功地用于治疗炎症性疾病和癌症,其中fda批准适应症为:合并地塞米松治疗多发性骨髓瘤chemicalbook(mm);作为接受过自体造血干细胞移植的mm后的维持治疗。并且它也可以用在肝细胞肝癌上。因此,对该药物分子的后期修饰将可能改变其药效。化合物3j衍生于该药物分子。
[0026]1h nmr (400 mhz, dmso) δ 11.02 (s, 1h), 9.83 (s, 1h), 7.83
‑
7.81 (m, 1h), 7.52
ꢀ–ꢀ
7.47 (m, 2h), 5.15 (dd, j = 13.3, 5.1 hz, 1h), 4.43
ꢀ–ꢀ
4.31 (q, j = 17.5 hz, 2h), 2.97
ꢀ–ꢀ
2.88 (m, 1h), 2.63
ꢀ–ꢀ
2.59 (m, 1h), 2.40
ꢀ–ꢀ
2.29 (m, 1h), 2.09 (s, 3h), 2.05
ꢀ–ꢀ
1.99 (m, 1h). 13
c nmr (100 mhz, dmso) δ 172.9, 171.1, 168.5, 167.9, 133.8, 133.7, 132.7, 128.7, 125.20, 119.1, 51.6, 46.5, 31.3, 23.5, 22.7. hrms (esi
‑
tof): anal calcd. for. c
15
h
15
n3o4 na
: 324.0955, found: 324.0953. ir (neat, cm
‑1): υ 3379, 2960, 1662, 1545, 1462, 1322, 1267, 1046, 991, 826, 763.实施例十一在25 ml schlenk试管中依次加入胺1k (0.2 mmol, 25.8 mg)、2,3
‑
丁二酮 (1.2 mmol, 103.3 mg)、乙醇 (95%, 0.5 ml);然后在40w白色led照射下常规搅拌6小时后,反应体系用饱和亚硫酸钠溶液淬灭,用乙酸乙酯萃取3次,合并有机层,用无水硫酸钠干燥。用旋转蒸发仪除去溶剂、硅胶吸附,通过简单的柱层析即可得产物3k,收率为97%。所制得产物的主要测试数据如下,通过分析可知,实际合成产物与理论分析一致。
[0027]1h nmr (400 mhz, dmso) δ 10.29 (s, 1h), 7.31
ꢀ–ꢀ
7.26 (m, 2h), 6.87
ꢀ–ꢀ
6.81 (m, 1h), 2.06 (s, 3h). 13
c nmr (100 mhz, dmso) δ 169.0, 162.44 (dd, j = 242.8, 15.3 hz), 141.77 (t, j = 14.0 hz), 101.69 (d, j = 29.2 hz), 98.03 (t, j = 26.2 hz), 24.07. 19
f nmr (377 mhz, dmso) δ
ꢀ‑
109.5 (s, 2f). hrms (esi
‑
tof): anal calcd. for. c8h7f2no h
: 172.0568, found: 172.0568. ir (neat, cm
‑1): υ 3450, 1700, 1653, 1500, 1051, 655.实施例十二
(neat, cm
‑1): υ 3405, 3293, 1670, 1527, 1489, 1393, 1258, 1049, 823, 760.实施例二十二在25 ml schlenk试管中依次加入胺1v (0.2 mmol, 30.0 mg)、 2,3
‑
丁二酮 (1.2 mmol, 103.3 mg)、乙醇 (95%, 0.5 ml);然后在40w白色led照射下常规搅拌6小时后,反应体系用饱和亚硫酸钠溶液淬灭,用乙酸乙酯萃取3次,合并有机层,用无水硫酸钠干燥。用旋转蒸发仪除去溶剂、硅胶吸附,通过简单的柱层析即可得产物3v,收率为66%。所制得产物的主要测试数据如下,通过分析可知,实际合成产物与理论分析一致。
[0038]1h nmr (400 mhz, dmso) δ 9.92 (s, 2h), 7.87 (s, 1h), 7.26
ꢀ–ꢀ
7.24 (m, 2h), 7.16 (dd, j = 8.7, 7.2 hz, 0h), 2.02 (s, 3h). 13
c nmr (100 mhz, dmso) δ 168.4, 139.6, 128.8, 113.9, 109.8, 24.1. hrms (esi
‑
tof): anal calcd. for. c
10
h
12
n2o2 h
: 193.0972, found: 193.0971. ir (neat, cm
‑1): υ 3404, 1665, 1550, 1485, 1419, 1373, 1049, 823, 761.实施例二十三在25 ml schlenk试管中依次加入胺1w (0.2 mmol, 30.0 mg)、 2,3
‑
丁二酮 (1.2 mmol, 103.3 mg)、乙醇 (95%, 0.5 ml);然后在40w白色led照射下常规搅拌6小时后,反应体系用饱和亚硫酸钠溶液淬灭,用乙酸乙酯萃取3次,合并有机层,用无水硫酸钠干燥。用旋转蒸发仪除去溶剂、硅胶吸附,通过简单的柱层析即可得产物3w,收率为67%。所制得产物的主要测试数据如下,通过分析可知,实际合成产物与理论分析一致。
[0039]1h nmr (400 mhz, dmso) δ 10.06 (s, 1h), 7.70 (d, j = 8.7 hz, 2h), 7.64
ꢀ–ꢀ
7.60 (m, 4h), 7.43 (t, j = 7.7 hz, 2h), 7.31 (t, j = 7.7 hz, 1h), 2.08 (s, 1h). 13
c nmr (100 mhz, dmso) δ 168.4, 139.8, 138.9, 134.7, 128.9, 127.0, 126.9, 126.2, 119.4, 24.1. hrms (esi
‑
tof): anal calcd. for. c
14
h
13
no h
: 212.1070, found: 212.1069. ir (neat, cm
‑1): υ 3354, 2963, 1672, 1600, 1538, 1452, 1199, 1007, 895, 758, 685.实施例二十四在25 ml schlenk试管中依次加入胺1x (0.2 mmol, 30.0 mg)、 2,3
‑
丁二酮 (1.2 mmol, 103.3 mg)、异丙醇 (0.5 ml);然后在40w白色led照射下常规搅拌6小时后,反
690.实施例二十七在25 ml schlenk试管中依次加入胺1aa (0.2 mmol, 30.4 mg)、 2,3
‑
丁二酮 (1.2 mmol, 103.3 mg)、乙醇 (95%, 0.5 ml);然后在40w白色led照射下常规搅拌6小时后,反应体系用饱和亚硫酸钠溶液淬灭,用乙酸乙酯萃取3次,合并有机层,用无水硫酸钠干燥。用旋转蒸发仪除去溶剂、硅胶吸附,通过简单的柱层析即可得产物3aa,收率为78%。所制得产物的主要测试数据如下,通过分析可知,实际合成产物与理论分析一致。
[0043]1h nmr (400 mhz, dmso) δ 10.28 (s, 1h), 8.34 (d, j = 2.2 hz, 1h), 7.66 (dd, j = 8.4, 2.2 hz, 1h), 7.36 (d, j = 8.4 hz, 1h), 2.42 (s, 3h), 2.06 (s, 3h). 13
c nmr (100 mhz, dmso) δ 168.9, 148.5, 138.2, 133.0, 126.9, 123.5, 114.1, 24.0, 19.2. hrms (esi
‑
tof): anal calcd. for. c9h
10
n2o3 h
: 195.0764, found: 195.0764. ir (neat, cm
‑1): υ 3353, 1672, 1537, 1489, 1392, 1198, 990, 894, 758, 684.实施例二十八在25 ml schlenk试管中依次加入胺1ab (0.2 mmol, 29.2 mg)、 2,3
‑
丁二酮 (1.2 mmol, 103.3 mg)、乙醇 (95%, 0.5 ml);然后在40w白色led照射下常规搅拌6小时后,反应体系用饱和亚硫酸钠溶液淬灭,用乙酸乙酯萃取3次,合并有机层,用无水硫酸钠干燥。用旋转蒸发仪除去溶剂、硅胶吸附,通过简单的柱层析即可得产物3ab,收率为45%。所制得产物的主要测试数据如下,通过分析可知,实际合成产物与理论分析一致。
[0044]1h nmr (400 mhz, cdcl3) δ 7.47 (t, j = 7.5 hz, 2h), 7.40 (t, j = 7.5 hz, 1h), 7.27
ꢀ–ꢀ
7.24 (m, 2h), 3.96 (t, j = 6.8 hz, 2h), 2.70 (t, j = 6.8 hz, 2h), 1.88 (s, 3h). 13
c nmr (100 mhz, cdcl3) δ 170.9, 142.1, 130.0, 128.5, 127.8, 117.8, 45.2, 22.5, 16.4. hrms (esi
‑
tof): anal calcd. for. c
11
h
12
n2o h
: 189.1022, found: 189.1020. ir (neat, cm
‑1): υ 2934, 2251, 1655, 1596, 1494, 1395, 1202, 1025, 908, 726, 646.实施例二十九
在25 ml schlenk试管中依次加入胺1ac (0.2 mmol, 31.4 mg)、 2,3
‑
丁二酮 (1.2 mmol, 103.3 mg)、乙醇 (95%, 0.5 ml);然后在40w白色led照射下常规搅拌6小时后,反应体系用饱和亚硫酸钠溶液淬灭,用乙酸乙酯萃取3次,合并有机层,用无水硫酸钠干燥。用旋转蒸发仪除去溶剂、硅胶吸附,通过简单的柱层析即可得产物3ac,收率为52%。所制得产物的主要测试数据如下,通过分析可知,实际合成产物与理论分析一致。
[0045]1h nmr (400 mhz, dmso) δ 8.06
ꢀ–ꢀ
8.03 (m, 1h), 8.00
ꢀ–ꢀ
7.98 (m, 1h), 7.75
ꢀ–ꢀ
7.73 (m, 1h), 7.66
‑
7.52 (m, 4h), 3.22 (s, 3h), 1.61 (s, 3h). 13
c nmr (100 mhz, dmso) δ 169.6, 140.4, 134.3, 129.5, 128.4, 127.6, 126.7, 126.2, 125.8, 121.9, 36.5, 21.6. hrms (esi
‑
tof): anal calcd. for. c
13
h
13
no h
: 200.1070, found: 200.1067. ir (neat, cm
‑1): υ 1652, 1541, 1488, 1379, 823, 761, 626.实施例三十在25 ml schlenk试管中依次加入胺1ad (0.2 mmol, 27.4 mg)、 2,3
‑
丁二酮 (1.2 mmol, 103.3 mg)、乙醇 (95%, 0.5 ml);然后在40w白色led照射下常规搅拌6小时后,反应体系用饱和亚硫酸钠溶液淬灭,用乙酸乙酯萃取3次,合并有机层,用无水硫酸钠干燥。用旋转蒸发仪除去溶剂、硅胶吸附,通过简单的柱层析即可得产物3ad,收率为63%。所制得产物的主要测试数据如下,通过分析可知,实际合成产物与理论分析一致。
[0046]1h nmr (400 mhz, dmso) δ 7.46
ꢀ–ꢀ
7.42 (m, 2h), 7.37
ꢀ–ꢀ
7.32 (m, 3h), 4.67 (s, 1h), 3.65 (t, j = 6.5 hz, 2h), 3.43 (dd, j = 11.9, 6.5 hz, 2h), 1.71 (s, 3h). 13
c nmr (100 mhz, dmso) δ 169.1, 143.4, 129.5, 128.2, 127.6, 57.9, 50.9, 22.6. hrms (esi
‑
tof): anal calcd. for. c
10
h
13
no2 h
: 180.1019, found: 180.1016. ir (neat, cm
‑1): υ 3384, 3063, 2927, 2878, 1716, 1630, 1593, 1494, 1397, 1279, 996, 852, 733.实施例三十一
在25 ml schlenk试管中依次加入胺1ae (0.2 mmol, 29.8 mg)、 2,3
‑
丁二酮 (1.2 mmol, 103.3 mg)、乙醇 (95%, 0.5 ml);然后在40w白色led照射下常规搅拌6小时后,反应体系用饱和亚硫酸钠溶液淬灭,用乙酸乙酯萃取3次,合并有机层,用无水硫酸钠干燥。用旋转蒸发仪除去溶剂、硅胶吸附,通过简单的柱层析即可得产物3ae,收率为70%。所制得产物的主要测试数据如下,通过分析可知,实际合成产物与理论分析一致。
[0047]1h nmr (400 mhz, cdcl3) δ 7.44
ꢀ–ꢀ
7.40 (m, 2h), 7.36
ꢀ–ꢀ
7.33 (m, 1h), 7.17
ꢀ–ꢀ
7.15 (m, 1h), 3.71
ꢀ–ꢀ
3.67 (m, 2h), 1.82 (s, 3h), 1.52
ꢀ–ꢀ
1.44 (m, 2h), 1.29
ꢀ–ꢀ
1.26 (m, 2h), 0.88 (t, j = 7.3 hz, 2h). 13
c nmr (100 mhz, dmso) δ 168.6, 142.8, 129.5, 128.0, 127.5, 47.6, 29.4, 22.5, 19.4, 13.6. hrms (esi
‑
tof): anal calcd. for. c
12
h
17
no h
: 192.1383, found: 192.1380. ir (neat, cm
‑1): υ 2956, 1649, 1516, 1455, 1383, 1261, 1083, 908, 826, 732.实施例三十二在25 ml schlenk试管中依次加入胺1af (0.2 mmol, 24.2 mg)、 2,3
‑
丁二酮 (1.2 mmol, 103.3 mg)、乙醇 (95%, 0.5 ml);然后在40w白色led照射下常规搅拌6小时后,反应体系用饱和亚硫酸钠溶液淬灭,用乙酸乙酯萃取3次,合并有机层,用无水硫酸钠干燥。用旋转蒸发仪除去溶剂、硅胶吸附,通过简单的柱层析即可得产物3af,收率为73%。所制得产物的主要测试数据如下,通过分析可知,实际合成产物与理论分析一致。
[0048]1h nmr (400 mhz, dmso) δ 7.47
ꢀ–ꢀ
7.44 (m, 2h), 7.38
ꢀ–ꢀ
7.35 (m, 1h), 7.29
ꢀ–ꢀ
7.27 (m, 1h), 3.63 (q, j = 7.1 hz, 2h), 1.70 (s, 3h), 0.98 (t, j = 7.1 hz, 3h). 13
c nmr (100 mhz, dmso) δ 168.4, 142.61, 129.6, 128.2, 127.6, 43.0, 22.5, 12.9. hrms (esi
‑
tof): anal calcd. for. c
10
h
13
no h
: 164.1070, found: 164.1068. ir (neat, cm
‑1): υ 3368, 2932, 1640, 1594, 1496, 1300, 1259, 1046, 990, 826, 765.实施例三十三在25 ml schlenk试管中依次加入胺1af (0.2 mmol, 36.6 mg)、 2,3
‑
丁二酮 (1.2 mmol, 103.3 mg)、乙醇 (95%, 0.5 ml);然后在40w白色led照射下常规搅拌6小时后,反应体系用饱和亚硫酸钠溶液淬灭,用乙酸乙酯萃取3次,合并有机层,用无水硫酸钠干燥。用旋转蒸发仪除去溶剂、硅胶吸附,通过简单的柱层析即可得产物3af,收率为69%。所制得产物的主要测试数据如下,通过分析可知,实际合成产物与理论分析一致。
[0049]1h nmr (400 mhz, cdcl3) δ 7.34
ꢀ–ꢀ
7.18 (m, 8h), 6.99
ꢀ–ꢀ
6.97 (m, 2h), 4.89 (s, 2h), 1.88 (s, 3h). 13
c nmr (100 mhz, cdcl3) δ 170.3, 142.8, 137.4, 129.5, 128.7, 128.3, 128.2, 127.8, 127.3, 52.7, 22.7. hrms (esi
‑
tof): anal calcd. for. c
15
h
15
no h
: 226.1226, found:226.1222. ir (neat, cm
‑1): υ 2931, 1650, 1596, 1496, 1397, 1212, 1029, 906, 726, 647.实施例三十四在25 ml schlenk试管中依次加入胺1ah (0.2 mmol, 37.0 mg)、 2,3
‑
丁二酮 (1.2 mmol, 103.3 mg)、乙醇 (95%, 0.5 ml);然后在40w白色led照射下常规搅拌6小时后,反应体系用饱和亚硫酸钠溶液淬灭,用乙酸乙酯萃取3次,合并有机层,用无水硫酸钠干燥。用旋转蒸发仪除去溶剂、硅胶吸附,通过简单的柱层析即可得产物3ah,收率为80%。所制得产物的主要测试数据如下,通过分析可知,实际合成产物与理论分析一致。
[0050]1h nmr (400 mhz, cdcl3) δ 7.55 (d, j = 8.4 hz, 2h), 7.10 (d, j = 8.4 hz, 2h), 3.25 (s, 3h), 1.88 (s, 3h). 13
c nmr (100 mhz, cdcl3) δ 170.0, 143.4, 132.7, 128.6, 121.2, 36.9, 22.2. hrms (esi
‑
tof): anal calcd. for. c9h
1079
brno h
: 228.0019, found: 228.0014; c9h
1081
brno h
: 229.9998, found: 229.9994. ir (neat, cm
‑1): υ 3395, 3060, 2932, 1649, 1587, 1484, 1371, 1179, 1084, 837, 722, 643.实施例三十五在25 ml schlenk试管中依次加入胺1ai (0.2 mmol, 25.0 mg)、 2,3
‑
丁二酮 (1.2 mmol, 103.3 mg)、乙醇 (95%, 0.5 ml);然后在40w白色led照射下常规搅拌6小时后,反应体系用饱和亚硫酸钠溶液淬灭,用乙酸乙酯萃取3次,合并有机层,用无水硫酸钠干燥。用旋转蒸发仪除去溶剂、硅胶吸附,通过简单的柱层析即可得产物3ai,收率为74%。所制得产物的主要测试数据如下,通过分析可知,实际合成产物与理论分析一致。
[0051]1h nmr (400 mhz, cdcl3) δ 7.12
ꢀ–ꢀ
7.09 (m, 2h), 7.04
ꢀ–ꢀ
7.00 (m, 2h), 3.15 (s, 3h), 1.76 (s, 3h). 13
c nmr (100 mhz, cdcl3) δ 170.2, 161.3 (d, j = 247.7 hz), 140.3 (d, j = 3.2 hz), 128.6 (d, j = 8.6 hz), 116.3 (d, j = 22.7 hz), 36.9, 22.0. 19
f nmr (377 mhz, cdcl3) δ
ꢀ‑
113.7. hrms (esi
‑
tof): anal calcd. for. c9h
10
fno h
: 168.0819, found: 168.0817. ir (neat, cm
‑1): υ 2934, 1767, 1652, 1509, 1423, 1354, 1222, 910, 726, 645.实施例三十六
在25 ml schlenk试管中依次加入胺1aj (0.2 mmol, 27.0 mg)、 2,3
‑
丁二酮 (1.2 mmol, 103.3 mg)、乙醇 (95%, 0.5 ml);然后在40w白色led照射下常规搅拌6小时后,反应体系用饱和亚硫酸钠溶液淬灭,用乙酸乙酯萃取3次,合并有机层,用无水硫酸钠干燥。用旋转蒸发仪除去溶剂、硅胶吸附,通过简单的柱层析即可得产物3aj,收率为70%。所制得产物的主要测试数据如下,通过分析可知,实际合成产物与理论分析一致。
[0052]1h nmr (400 mhz, cdcl3) δ 7.30 (t, j = 7.6 hz, 1h), 7.16 (d, j = 7.6 hz, 1h), 6.98
ꢀ–ꢀ
6.95 (m, 2h), 3.74 (q, j = 7.2 hz, 2h), 2.39 (s, 3h), 1.83 (s, 3h), 1.11 (s, 3h). 13
c nmr (100 mhz, cdcl3) δ 169.9, 142.6, 139.5, 129.2, 128.5, 128.4, 125.0, 43.6, 22.6, 21.1, 12.9. hrms (esi
‑
tof): anal calcd. for. c
11
h
15
no h
: 178.1226, found: 178.1223. ir (neat, cm
‑1): υ 3481, 2974, 2874, 1653, 1586, 1445, 1395, 1299, 1192, 838, 706, 626.实施例三十七在25 ml schlenk试管中依次加入胺1ak (0.2 mmol, 33.2 mg)、2,3
‑
丁二酮 (1.0 mmol, 86.9 mg)、乙醇 (95%, 0.5 ml);然后在40w白色led照射下常规搅拌6小时后,反应体系用饱和亚硫酸钠溶液淬灭,用乙酸乙酯萃取3次,合并有机层,用无水硫酸钠干燥。 用旋转蒸发仪除去溶剂、硅胶吸附,通过简单的柱层析即可得产物3ak,收率为55%。所制得产物的主要测试数据如下,通过分析可知,实际合成产物与理论分析一致。
[0053]1h nmr (400 mhz, cdcl3) δ 8.18
ꢀ–ꢀ
8.15 (m, 2h), 7.38
ꢀ–ꢀ
7.27 (m, 2h), 5.61 (s, 1h), 3.55 (dd, j = 13.2, 6.9 hz, 2h), 2.95 (t, j = 6.9 hz, 2h), 1.96 (s, 3h). 13
c nmr (100 mhz, dmso) δ 169.2, 148.1, 146.1, 130.0, 123.4, 34.9, 22.5. hrms (esi
‑
tof): anal calcd. for. c
10
h
12
n2o3 na
: 231.0740, found: 231.0737. ir (neat, cm
‑1): υ 3299, 2854, 1711, 1661, 1516, 1344, 1256, 855, 746, 697.实施例三十八
在25 ml schlenk试管中依次加入胺1al (0.2 mmol, 33.2 mg)、2,3
‑
丁二酮 (1.0 mmol, 86.9 mg)、乙醇 (95%, 0.5 ml);然后在40w白色led照射下常规搅拌6小时后,反应体系用饱和亚硫酸钠溶液淬灭,用乙酸乙酯萃取3次,合并有机层,用无水硫酸钠干燥。 用旋转蒸发仪除去溶剂、硅胶吸附,通过简单的柱层析即可得产物3al,收率为60%。所制得产物的主要测试数据如下,通过分析可知,实际合成产物与理论分析一致。
[0054]1h nmr (400 mhz, dmso) δ 6.92
ꢀ–ꢀ
6.90 (m, 2h), 6.84
ꢀ–ꢀ
6.82 (m, 2h), 3.68 (s, 3h), 3.55 (dd, j = 10.3, 5.5 hz, 4h), 3.01
ꢀ–ꢀ
2.98 (m, 2h), 2.94
ꢀ–ꢀ
2.92 (m, 2h), 2.03 (s, 3h). 13
c nmr (100 mhz, dmso) δ 168.45, 153.4, 145.3, 118.2, 114.4, 55.3, 50.3, 49.9, 45.8, 40.9, 21.2. hrms (esi
‑
tof): anal calcd. for. c
13
h
18
n2o2 h
: 235.1441, found: 235.1438. ir (neat, cm
‑1): υ 2988, 1626, 1512, 1445, 1331, 1233, 909, 823, 761.实施例三十九在25 ml schlenk试管中依次加入胺1am (0.2 mmol, 33.2 mg)、2,3
‑
丁二酮 (1.0 mmol, 86.9 mg)、乙醇 (95%, 0.5 ml);然后在40w白色led照射下常规搅拌6小时后,反应体系用饱和亚硫酸钠溶液淬灭,用乙酸乙酯萃取3次,合并有机层,用无水硫酸钠干燥。 用旋转蒸发仪除去溶剂、硅胶吸附,通过简单的柱层析即可得产物3am,收率为65%。所制得产物的主要测试数据如下,通过分析可知,实际合成产物与理论分析一致。
[0055]1h nmr (400 mhz, dmso) δ 8.25
ꢀ–ꢀ
8.18 (m, 2h), 7.49
ꢀ–ꢀ
7.47 (m, 2h), 4.72 (minor isomer, s, 2h), 4.61 (major isomer, s, 2h), 2.96 (major isomer, s, 3h), 2.82 (minor isomer, s, 3h), 2.09 (major isomer, s, 3h), 2.02 (minor isomer, s, 3h). 13
c nmr (100 mhz, dmso) δ 170.8, 170.5, 147.1, 146.6, 128.9, 128.2, 124.4, 124.1, 53.3, 50.0, 36.3, 33.8, 21.9, 21.7. hrms (esi
‑
tof): anal calcd. for. c
10
h
12
n2o3 h
: 209.0921, found: 209.0918. ir (neat, cm
‑1): υ 1635, 1519, 1473, 1407, 1346, 1249, 1049, 858, 736.实施例四十
在25 ml schlenk试管中依次加入胺1an (0.2 mmol, 30.0 mg)、2,3
‑
丁二酮 (1.0 mmol, 86.9 mg)、乙醇 (95%, 0.5 ml);然后在40w白色led照射下常规搅拌6小时后,反应体系用饱和亚硫酸钠溶液淬灭,用乙酸乙酯萃取3次,合并有机层,用无水硫酸钠干燥。 用旋转蒸发仪除去溶剂、硅胶吸附,通过简单的柱层析即可得产物3an,收率为55%。所制得产物的主要测试数据如下,通过分析可知,实际合成产物与理论分析一致。
[0056]1h nmr (400 mhz, dmso) δ 8.15 (s, 1h), 7.07
ꢀ–ꢀ
7.04 (m, 2h), 6.69
ꢀ–ꢀ
6.65 (m, 2h), 4.11 (d, j = 5.8 hz, 2h), 2.85 (s, 6h), 1.82 (s, 3h). 13
c nmr (100 mhz, dmso) δ 169.3, 150.1, 128.8, 127.5, 112.9, 42.2, 40.8, 23.1. hrms (esi
‑
tof): anal calcd. for. c
11
h
16
n2o h
: 193.1335, found: 193.1333. ir (neat, cm
‑1): υ 3393, 2958, 1652, 1541, 1457, 1362, 1229, 1048, 993, 824, 762, 628.实施例四十一在25 ml schlenk试管中依次加入胺1ao (0.2 mmol, 34.2 mg)、2,3
‑
丁二酮 (1.0 mmol, 86.9 mg)、乙醇 (95%, 0.5 ml);然后在40w白色led照射下常规搅拌6小时后,反应体系用饱和亚硫酸钠溶液淬灭,用乙酸乙酯萃取3次,合并有机层,用无水硫酸钠干燥。 用旋转蒸发仪除去溶剂、硅胶吸附,通过简单的柱层析即可得产物3ao,收率为50%。所制得产物的主要测试数据如下,通过分析可知,实际合成产物与理论分析一致。
[0057]1h nmr (400 mhz, dmso) δ 8.11
ꢀ–ꢀ
7.93 (m, 2h), 7.86 (d, j = 8.2 hz, 1h), 7.59
ꢀ–ꢀ
7.46 (m, 3h), 7.37
ꢀ–ꢀ
7.14 (m, 1h), 5.06 (minor isomer, s, 2h), 4.96 (major isomer, s, 3h), 2.90 (minor isomer, s, 3h), 2.90 (minor isomer, s, 3h), 2.10 (major isomer, s, 3h), 2.00 (minor isomer, s, 3h). 13
c nmr (100 mhz, cdcl3) δ 171.6, 170.5, 133.8, 133.7, 132.6, 131.6, 131.3, 130.6, 129.0, 128.5, 128.4, 128.0, 127.0, 126.5, 126.4, 126.0, 125.9, 125.5, 125.1, 123.9, 122.3, 121.9, 52.0, 48.3, 34.8, 34.3, 22.0, 21.2. hrms (esi
‑
tof): anal calcd. for. c
14
h
15
no h
: 214.1226, found: 214.1222. ir (neat, cm
‑1): υ 2961, 1636, 1510, 1485, 1398, 1260, 906, 725, 645.实施例四十二
在25 ml schlenk试管中依次加入胺1ap (0.2 mmol, 46.0 mg)、2,3
‑
丁二酮 (1.0 mmol, 86.9 mg)、乙醇 (95%, 0.5 ml);然后在40w白色led照射下常规搅拌6小时后,反应体系用饱和亚硫酸钠溶液淬灭,用乙酸乙酯萃取3次,合并有机层,用无水硫酸钠干燥。 用旋转蒸发仪除去溶剂、硅胶吸附,通过简单的柱层析即可得产物3ap,收率为70%。所制得产物的主要测试数据如下,通过分析可知,实际合成产物与理论分析一致。
[0058]1h nmr (400 mhz, cdcl3) δ 7.51 (d, j = 8.7 hz, 2h), 6.93 (d, j = 8.7 hz, 2h), 3.79
ꢀ–ꢀ
3.77 (m, 2h), 3.65
ꢀ–ꢀ
3.63 (m, 2h), 3.31
ꢀ–ꢀ
3.25 (m, 4h), 2.15 (s, 3h). 13
c nmr (100 mhz, cdcl3) δ 169.0, 152.8, 126.4 (q, j = 3.8 hz), 124.5 (q, j = 270.0 hz), 121.1 (q, j = 30.6 hz), 114.9, 48.2, 47.9, 45.7, 40.9, 21.2. 19
f nmr (377 mhz, cdcl3) δ
ꢀ‑
61.5 (s, 1f). hrms (esi
‑
tof): anal calcd. for. c
13
h
15
f3n2o h
: 273.1209, found: 273.1204. ir (neat, cm
‑1): υ 2989, 1614, 1523, 1442, 1329, 1231, 1098, 979, 819, 647。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。