1.本发明涉及生物技术领域,特别涉及一种乳腺癌新辅助化疗疗效预测的凝集素测试 载体和试剂盒以及预测模型。
背景技术:
2.乳腺癌(breast cancer,bc)是全球女性发病率最高的一种恶性肿瘤。根据2020 年国际癌症研究机构(international agency for research on cancer,iarc)发布的全球 癌症研究数据报告显示,乳腺癌首次超过肺癌成为全球最常见癌症,在绝大多数国家中 其发病率和死亡率均位居首位,因此早期诊断和治疗对提高bc患者的生存率具有非常 重要的医学指导意义。
3.乳腺癌的治疗分为手术治疗、内分泌治疗和化学治疗等。手术治疗是目前乳腺癌 早期治疗的主要方法。内分泌治疗的主要研究目的是通过阻断雌激素在受体水平的作 用,或着通过抑制雌激素的产生而达到抑制肿瘤细胞生长的作用,在临床上对于治疗激 素受体阳性转移性乳腺癌中起着重要的指导作用,到目前为止,已经开发了几种内分泌 疗法,包括选择性er调节剂、黄体生成素释放激动剂、高剂量雌激素、选择性er下 调剂和靶向治疗。化学治疗主要包括术后辅助化疗和新辅助化疗,术后辅助化疗是指手 术切除肿瘤后,为了能更彻底地清除残留的恶性肿瘤细胞,降低远处复发的风险来提高 患者生存率。
4.新辅助化疗(neoadjuvant chemotherapy,nct)被定义为进行手术治疗之前先进行 化学治疗,其后再进行手术和局部治疗,是利用化疗的放射致敏作用,缩小肿瘤大小, 降低临床分期,最大限度地发挥局部控制作用。使用新辅助化疗的好处是它提供了一个 独特的机会,可以评估具有完整病理反应的治疗反应,作为生存的替代标志,并可以更 快速地评估新治疗药物的疗效和早期停止无效治疗。另外,在对治疗有抵抗力的情况下, 及时对化疗药物的使用方案进行调整可以使患者免受于化疗药物副作用所带来的危害。 随着近年来在许多临床实践和试验中对乳腺癌化疗药物和化疗方案不断地更新和发展, 目前新辅助化疗是局部晚期乳腺癌的标准治疗方法,并且越来越多的用于早期乳腺癌患 者以提高保乳率并降低术后复发的风险。
5.近年来乳腺癌新辅助化疗在临床上使得更多患者得到了保乳治疗的选择和机会, 但仍有一些患者对化疗药物不敏感而导致疗效过长而错失最佳手术时间。目前在医学临 床上主要通过临床病理学和临床影像学来评估nct疗效,但误判率仍然很高。临床病 理学已成为疗效评价的“金标准”之一,但其只能在手术结束之后进行评估而无法适当 调整化疗方案,影像学仅能体现宏观形态的改变且易受主观因素的影响。因此,临床上 迫切需要能够有效且准确预测新辅助化疗疗效的产品和预测模型,在新辅助化疗期间对 治疗反应情况进行准确和早期的预测,对于疗效差的乳腺癌患者应对其治疗方案进行做 出及时调整或尽早地进行手术治疗以避免无效治疗,为乳腺癌患者个性化治疗提供参考 依据。
技术实现要素:
6.针对现有技术中的缺陷,本发明提出了一种乳腺癌新辅助化疗疗效预测的凝集素 测试载体和试剂盒以及预测模型,所述凝集素测试载体包括测试凝集素探针组,所述测 试凝集素探针组至少包括gna、pwm和ltl,还包括stl、rca120、gsl
‑
i、 pha
‑
e、mal
‑
ii、jacalin、eel、mal
‑
i、sba、ptl
‑
i、bs
‑
i、dsa、ptl
‑
ii、bpl、 阴性对照和阳性对照。所述试剂盒由所述的凝集素测试载体制备而得。所述预测模型 为
7.本发明提供一种基于血清蛋白的乳腺癌新辅助化疗疗效预测的凝集素测试载体, 包括测试凝集素探针组,所述测试凝集素探针组至少包括gna、pwm和ltl。
8.进一步的,所述测试凝集素探针组还包括stl、rca120、gsl
‑
i、pha
‑
e、mal
‑
ii、 jacalin、eel、mal
‑
i、sba、ptl
‑
i、bs
‑
i、dsa、ptl
‑
ii、bpl。
9.进一步的,所述测试凝集素探针组还包括阴性对照和阳性对照。
10.进一步的,所述测试载体为凝集素芯片、金属片、硝酸纤维素膜、瓷片或酶标板。
11.本发明还提供一种试剂盒,其特征在于,所述试剂盒利用所述的凝集素测试载体 制备而得。
12.本发明还提供一种基于血清蛋白的乳腺癌新辅助化疗疗效预测的预测模型,所述 预测模型为逻辑回归分析模型,所述逻辑回归分析模型为 其中,gna 为标准化的凝集素gna的荧光强度;pwm为标准化的凝集素pwm的荧光强度;ltl 为标准化的凝集素ltl的荧光强度。
13.进一步的,所述预测模型的建模方法如下:
14.(1)收集乳腺癌新辅助化疗患者的血清样本,分为化疗有效组和化疗无效组; 然后,所述化疗有效组和所述化疗无效组按照6:4比例随机分为训练集和验证集;
15.(2)对步骤(1)的血清样本进行凝集素芯片实验,所述凝集素芯片由2个bsa 的阴性对照,37种凝集素和1个阳性对照组成,使用数理学分析方法对芯片进行分析 并选出差异表达的糖蛋白糖链;
16.(3)通过凝集素印迹实验对步骤(3)获得的差异表达结果进行可靠性验证;
17.(4)基于步骤(2)获得的凝集素芯片数据,利用spss 21.0软件中的二元逐步 logisitic逻辑回归分析方法,将步骤(2)获得的所有差异表达的凝集素作为候选凝集 素,利用训练集中的样本数据构建鉴别乳腺癌新辅助化疗疗效的数学模型,然后利用 origin 8.0软件对所构建疗效预测模型的灵敏度和特异性进行计算;然后将所述验证集 中的血清样本数据代入数学公式,得到所述乳腺癌新辅助化疗疗效预测的预测模型; 利用roc曲线分析对所述预测模型进行评估和验证。
18.进一步的,所述37种凝集素为:jacalin、eca、hhl、wfa、gsl
‑
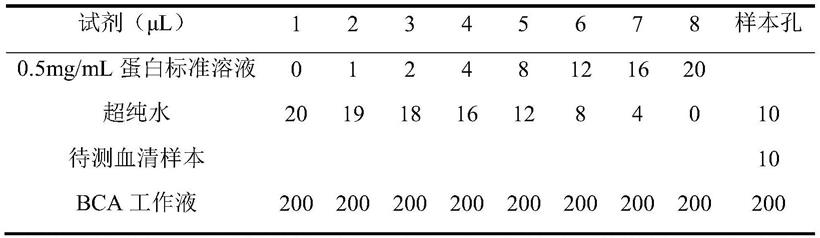
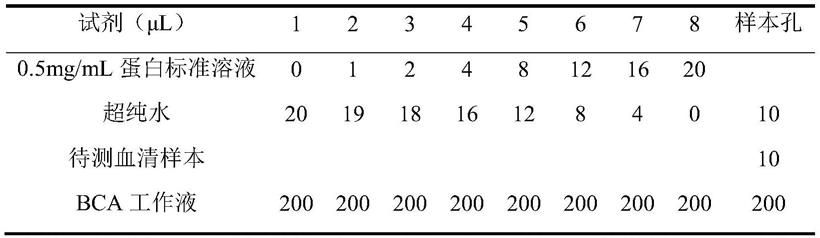
ii、mal
‑
ii、 pha
‑
e、ptl
‑
i、sja、pna、eel、aal、ltl、mpl、lel、gsl
‑
i、dba、lca、 rca120、stl、bs
‑
i、cona、ptl
‑
ii、dsa、sba、vva、npa、psa、aca、wga、 uea
‑
i、pwm、mal
‑
i、gna、bpl、pha
‑
e l、sna。
19.本发明还提供一种基于血清蛋白的乳腺癌新辅助化疗疗效预测的系统,包括:
20.(1)权利要求1~3任一项所述的测试凝集素探针组;
21.(2)利用测试凝集素探针组与血清样本结合检测血清糖蛋白糖型的装置;
22.(3)分析判断测试凝集素探针组所识别的糖链是否发生相应的上调、下调的数 据分析模块。
23.本发明还提供所述的凝集素测试载体、所述的试剂盒、所述的预测模型在乳腺癌 新辅助化疗疗效预测中的应用。
24.综上,与现有技术相比,本发明达到了以下技术效果:
25.(1)本发明的乳腺癌新辅助化疗患者血清中ncta组与nctb组的蛋白质糖链存 在显著的差异,差异表达的凝集素所特异性识别的糖链将有助于临床决策提供一定的实 验依据,可能作为一种乳腺癌新辅助化疗疗效评估的生物标志物为临床疗效诊断提供参 考性意见。
26.(2)本发明基于血清糖蛋白糖型构建了一个可以用于预测乳腺癌新辅助化疗疗效 的模型model nct,能够判定患者对当前新辅助化疗药物的敏感性并确定患者是否需要 继续保持既定治疗方案,同时对预测疗效差的患者争取治疗窗口期、节约医疗成本、并 调整个性化治疗方案等方面具有重要价值。本发明中所构建的model nct显示出了较 好的疗效预测能力和临床应用潜能。
27.(3)本发明利用凝集素芯片技术对收集的20例未知临床疗效的新辅助化疗患者第 一次或第二次化疗后的血清样本进行逐例检测,将凝集素芯片检测分析结果代入modelnct中进行计算,将所得结果与临床最终疗效结果进行比较,显示model nct具有较 好的区分效果,可以正确区分9例ncta的8例,11例nctb中的9例,准确率高达 85%,验证了该模型的有效性和可靠性。
附图说明
28.为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附 图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作 是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可 以根据这些附图获得其他相关的附图。
29.图1为本发明实施例2的凝集素芯片点样矩阵设计图。
30.图2为本发明实施例3的bca法蛋白定量曲线图。
31.图3为本发明实施例3的ncta和nctb血清样本对应的凝集素芯片扫描图。
32.图4为本发明实施例3的144例血清样本的凝集素芯片数据进行聚类分析后的糖型 总览图。
33.图5为本发明实施例3的nctb相比于ncta显著上调的凝集素。图上方为该凝集 素所识别的糖链结构。
34.图6为本发明实施例3的nctb相比于ncta显著下调的凝集素。图上方为该凝集 素所识别的糖链结构。
35.图7为本发明实施例3的血清蛋白银染图与凝集素印迹条带图。
36.图8为本发明实施例3的凝集素印迹条带灰度分析图(*p≤0.05,**p≤0.01,***p ≤0.001)。
37.图9为本发明实施例4的model nct在训练集和验证集中的roc曲线。
38.图10为本发明实施例6的bca法蛋白定量曲线图。
具体实施方式
39.为了使本技术领域的人员更好地理解本发明方案,下面将结合本发明实施例中的 附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例 仅仅是本发明一部分的实施例,而不是全部的实施例。基于本发明中的实施例,本领 域普通技术人员在没有做出创造性劳动的前提下所获得的所有其他实施例,都应当属 于本发明保护的范围。
40.糖基化是调节多种生理和病理功能的关键细胞机制,糖蛋白、糖脂和蛋白聚糖糖 链的改变是癌细胞的共同特征。蛋白质糖基化与肿瘤的分子机制和临床应用密切相 关,包括细胞信号传递、细胞通讯、肿瘤血管生成、转移、肿瘤诊断、预后和特定治 疗靶点的标记。目前,癌症中异常的蛋白质糖基化能提供更多的机会来识别新的生物 标记物。因此,在各种生物分子上存在的糖链结构具有重要的病理意义。
41.与乳腺癌中的聚糖结构相关的变化使其成为早期发现或预后的有吸引力的生物标 志物。近年来,以组织和血清为基础的生物标记物的发现引起了广泛的关注,尤其是血 清生物标志物,因为它们有可能应用于“液体活检”。液体活检是一种简单、微创的方 法,可以实时捕捉肿瘤异质性,并在没有肿瘤组织的情况下发挥重要作用,糖蛋白是理 想的生物标志物,因为它们通过活跃的分泌或渗漏从组织或血细胞进入血液循环,因此 可通过血清进行分析。用于乳腺癌检测的主要血清糖蛋白的免疫指标有三种:muc
‑
1 上的癌抗原15
‑
3(ca 15
‑
3)和ca 27
‑
29,以及与细胞粘附有关的锚定糖蛋白癌胚抗原 (cea)。然而,这些生物标记物在临床上的灵活性和特异性仍有待提高,因此,仍需 进一步的研究为乳腺癌的诊断、预后和治疗寻找更好的肿瘤标志物。
42.本发明利用凝集素芯片技术,对144例nct患者的血清样本蛋白糖链结构进行个 例分析。其中,144例nct患者依据新辅助化疗后病理反应miller
‑
payne分级系统分为 92例化疗有效组(ncta)和52例化疗无效组(nctb)。通过芯片分析检出差异表达的 糖链,并以印迹实验对凝集素芯片结果加以验证。随后,选用67例nct患者第一次或 第二次化疗后的血清样本的凝集素芯片分析结果作为训练集(42例ncta,25例nctb) 利用二元logisitic逐步逻辑回归分析方法构建nct疗效预测模型(model nct),选用 44例nct患者第三次化疗及之后的血清样本的芯片分析结果作为验证集(26例ncta, 18例nctb),通过受试者工作特征曲线(receiver operating characteristic cure,roc) 对model nct的预测效能进行验证,最后,收集20例未知临床疗效的第一次或第二次 患者血清样本进行盲测,进一步评估model nct的临床应用潜能。
43.实施例1血清样本的收集及处理
44.1.血清样本的收集
45.本发明所采用的血清样本均通过了伦理委员会的审查,所有收集的血清样本的提供 者均已事先签署了知情同意书,所有的血清样本均在交大一附院乳腺外科进行收集,收 集健康志愿者和乳腺癌患者的血清样本,样本提供者需无糖尿病以及除乳腺以外其他部 位无肿瘤及炎症等慢性疾病,采样前血清样本提供者48h内不可服用药物,前3h内需 禁食。将血液在室温或者4℃静置半小时后,3000r/min离心10分钟即可对血液进行分 离,随后将
血清装入无菌管中
‑
80℃分装冻存。
46.2.血清样本蛋白浓度的测定
47.(1)依据bradford试剂使用说明,将25mg/ml的蛋白标准溶液稀释到一定浓度的 蛋白水平待用。
48.(2)依据使用说明书,按照固定比例,配制bca蛋白工作液。
49.(3)按照表1将各试剂加入到96孔板中。
50.表1 bca蛋白浓度测定表
[0051][0052]
(4)将加好样的96孔板平放在桌上,上下左右进行摇晃使样品与工作液充分混匀, 随后放在37℃摇床上进行30分钟的孵育。
[0053]
(5)打开bio
‑
tek elx800酶标仪,在电脑上打开软件并设置波长为562nm,选 择需要检测的孔进行检测,随后读取并记录各孔的光密度(od)值。
[0054]
(6)用标准品孔的od值绘制标准曲线,然后计算出每一个血清样本的浓度。
[0055]
3.血清样本蛋白浓度的荧光标记
[0056]
(1)根据说明书上的方法对荧光染料干粉cy3进行活化,取出一管向其中加入 120μl dmso,充分涡旋离心后再室温避光放置1小时即可。
[0057]
(2)取1.5ml灭菌后的离心管,加入ph=9.3的碳酸钠缓冲液100μl和15μl待标 记的血清样本,充分混匀离心后再加入4μl已经活化好的cy3荧光,摇床上室温避光 反应3小时即可。
[0058]
(3)待3h避光反应完成后,向每管内加入4m羟胺20μl后立即将其放入冰中终 止荧光与血清蛋白的反应。
[0059]
(4)使用sephadex g
‑
25柱对cy3标记的血清样本进行分离,柱体使用前先用灭 菌水将柱体清洗3遍,经0.45μm滤膜过滤的1
×
pbs对柱体进行平衡换液3遍后,然后 在柱体中加入已被荧光标记好的血清样本,待其完全浸入柱内,加入1
×
pbs观察柱内 分层现象,上层为游离的荧光,中层为未标记上荧光的蛋白,下层即为荧光标记的蛋白, 用1.5ml无菌离心管接取下层液体,用nano photometer微量核酸蛋白分析仪检测接取 液中的蛋白质浓度后
‑
20℃避光保存。
[0060]
实施例2凝集素芯片的制备、结果处理和分析
[0061]
1.环氧化修饰玻片的准备
[0062]
(1)取40张1
×
3英寸高透光型玻片放到玻片架上,放到一个装有300ml超纯水 的清洗盒中,超声波清洗4次,每次5分钟。然后向装有300ml超纯水的清洗盒中加 入玻片专用去污剂5ml,待水浴锅加热至75℃后将玻片放入其中水浴1小时,随后进 行10分钟的超声清洗,超声完后放到超纯水中继续进行清洗,置于摇床上进行15分钟 的反复清洗。
[0063]
(2)将清洗完的玻片置于装有食人鱼刻蚀液的器皿中,待水浴锅的温度加热至95℃ 后将其置于水浴锅中水浴2个小时来彻底清洗玻片上的杂质,水浴完成后进行10分钟 的超声清洗,随后将其放到超纯水中继续在摇床上清洗15分钟。
[0064]
(3)将清洗完的玻片放入装有300ml的10%氢氧化钠溶液中,置于摇床,37℃避 光过夜反应,反应完成后将其进行10分钟的超声清洗,随后将其放到超纯水中继续在 摇床上进行15分钟的清洗。
[0065]
(4)最后将将清洗完的玻片置于由乙酸等试剂配制的溶液中,37℃避光在摇床上 清洗6个小时,随后进行10分钟的超声清洗,再用适量的乙醇清洗3次,每次5分钟, 清洗完后用离心机甩干玻片后置于37℃真空干燥箱中干燥3个小时,最后置于4℃冰箱 中保存待用。
[0066]
2.凝集素芯片的点制
[0067]
设计凝集素芯片矩阵,芯片是由2个1mg/ml的bsa的阴性对照,37种凝集素和 1个阳性对照组成,将37种凝集配制成2mg/ml的凝集素溶液与点样缓冲液等比例混合。 随后将点样液按照设计好的顺序依次分别加入到384孔板中,使用晶芯smartarrayer 48 生物芯片点样系统,装置玻片和384孔板,设置点样相关参数,每个孔重复点三次样, 每张片基重复分别4个相同的点样矩阵。具体设计的凝集素点样矩阵如图1所示。在点 样仪上对具体的参数进行设置之后进行点样。将点制完成后的凝集素芯片置于具有高湿 度和适宜温度的环境下孵育12个小时,随后将凝集素芯片移入真空干燥箱40℃中进行 大约3个小时的干燥,最后将干燥完的凝集素芯片移到4℃冰箱中避光保存,备用。
[0068]
3.凝集素芯片的封闭
[0069]
从4℃干燥箱中取出所需数量的凝集素芯片,在芯片正面的右下角进行刻字标记, 然后放置到37℃真空干燥箱中干燥1小时进行回温。回温后将芯片放入装有乙醇的瓶中 10s,随后对凝集素芯片进行20min的清洗,清洗过程中用1
×
pbst清洗10分钟,每5 分钟清洗1次、1
×
pbs同上。清洗完成后使用离心机进行离心甩干,取出封闭专用的盖 玻片放在芯片杂交盒上,向封闭专用盖玻片中加入600μl的封闭缓冲液,然后将凝集素 芯片正面朝下扣在盖玻片上,旋紧杂交盒,将其放置到生物芯片杂交仪中37℃封闭1 小时。
[0070]
4.凝集素芯片的孵育
[0071]
封闭完成后,取出凝集素芯片,同上述方法进行清洗之后离心甩干待用。配制孵育 液:向1.5ml离心管中加入85μl芯片孵育缓冲液、8μl 4mol/lml羟胺溶液、2μl 10% 的tween
‑
20溶液、6μg血清蛋白,最后加超纯水补足体积至120μl。
[0072]
取出孵育专用盖玻片放在芯片杂交盒上,向孵育专用盖玻片中加入120μl的孵育 液,然后将凝集素芯片正面朝下扣在孵育盖玻片上,旋紧杂交盒,将其放置到芯片恒温 孵育箱hl
‑
2000中37℃进行3个小时的孵育。孵育完成后,取出凝集素芯片,同上述 方法进行清洗离心甩干备用。
[0073]
5.凝集素芯片数据的获取
[0074]
打开芯片扫描仪,在电脑上设置固定的激发光波长以及程序数据,将甩干的凝集素 芯片正面朝下置于芯片扫描处,先对凝集素芯片进行预扫描,随后精确扫描,扫描结束 后获取芯片数据并保存图像。
[0075]
6.凝集素芯片数据的处理
[0076]
通过genepix 3.0软件可以获取到凝集素芯片通过扫描仪扫描之后芯片的相关数 据,对每个凝集素所对应的3个重复点求取中值,随后对中值归一化处理,得到每个凝 集素的荧光信号归一化值(normalized fluorescent intensities,nfis)。然后使用graphpadprism 8.0使用student's t test检验方法对两组数据进行组间比较分析,选出差异显著的 凝集素并对实验数据进行做图,根据p值结果判定是否具有统计学意义,其中p<0.05 用“*”标记;p<0.01用“**”标记;p<0.001用“***”标记;p<0.0001用“****
”ꢀ
标记。
[0077]
7.聚类分析
[0078]
利用expander 8.0对血清样本37种凝集素的nfis进行聚类分析,以直观观察37 种凝集素在不同血清样本中的表达情况。
[0079]
实施例3乳腺癌新辅助化疗患者血清蛋白质差异糖链结构的研究
[0080]
本实施例以乳腺癌患者在临床上接受新辅助化疗后的患者血清为研究对象,目前, 国内常用miller
‑
payne分级系统对新辅助化疗疗效进行有效的病理评估,mp分级基于 乳腺癌患者新辅助化疗后的随访数据,根据镜下对患者化疗前后样本的肿瘤减少情况进 行比较可将其分为5级,1级(g1)为浸润癌细胞基本无改变;2级(g2)为浸润癌细 胞减少大约30%;3级(g3)为浸润癌细胞减少在30%到90%之间;4级(g4)浸润癌 细胞减少超过90%;5级(g5)为原肿瘤部位已无癌细胞,即为pcr,mp评级不仅可 以对患者术后疗效进行有效评估同时也为患者后期治疗方案提供可靠的依据。本发明参 考mp分级方法将g4、g5归为化疗有效组(ncta),g1、g2、g3归为化疗无效组(nctb)。 利用凝集素芯片技术分析其血清蛋白质糖链结构,筛选出显著性表达差异的糖链结构, 并通过凝集素印迹实验对部分差异表达的糖链结构进行进一步的验证,针对异常糖链的 表达差异可为乳腺癌患者的新辅助化疗疗效评估提供理论参考。
[0081]
本实验共收集乳腺癌新辅助化疗患者血清样本144例,根据144例患者术后的mp 评级报告,参考mp分级方法将g4、g5归为化疗有效组(ncta),g1、g2、g3归为 化疗无效组(nctb)其具体信息如表2所示。
[0082]
表2乳腺癌新辅助化疗患者血清样本提供者信息
[0083][0084]
使用bca法对处理过的血清样本进行蛋白质定量,以对应的od值/562nm为y坐 标,各孔的蛋白质浓度为x坐标,所得的曲线如图2所示。通过线性回归获得计算公式 y=0.9513x 0.0052,r2=0.999。
[0085]
将各孔的od值代入公式中,计算出血清蛋白混合样本的蛋白浓度,由于144例血 清样本数量太大因此其具体每一例的血清样本的蛋白浓度以及cy3荧光标记后的浓度 在此未列出,表3中为仅用于银染和印迹实验的血清混合样本的蛋白浓度。
[0086]
表3sds
‑
page和凝集素印迹实验混合样本蛋白浓度
[0087][0088]
本发明对所收集的144例血清样本(92例ncta、52例nctb)进行了凝集素芯片 实验,凝集素芯片实验中所有的血清蛋白样本的上样量均为6μg,使用数理学分析方法 对芯片进行分析并选出差异表达的糖蛋白糖链。图3为ncta和nctb血清样本对应的 凝集素芯片代表图,显著上调用白框标注,显著下调用灰框标注。图4为144例血清样 本的凝集素芯片数据进行聚类分析后的糖型总览图。横轴为144例血清样本,纵轴为37 种凝集素,每个方块分别代表了凝集素与每一例血清样本的结合强度,红色方块表示结 合强度相对较高,绿色方块表示结合强度相对较低,黑色方块表示中等结合强度。图中 颜色以灰度表示。
[0089]
经统计学分析后,凝集素芯片分析结果如图5和图6所示,图5和图6为ncta和 nctb之间差异表达凝集素散点图,统计发现共有17种凝集素识别的糖链结构在ncta 和nctb组之间中有具有差异变化(详细见表4)。相比于ncta组,其中特异性识别 的core(glcnac)of n
‑
glycan、β
‑
gal、αgalnac等糖链结构的stl、rca120、gsl
‑
i这 3种凝集素的nfis在nctb组中显现上调趋势(见图5),而特异性识别的high
‑
mannose、 (galnac)n、fucα1
‑
2galβ1
‑
4glcnac等糖链结构的14种凝集素pha
‑
e、mal
‑
ii、jacalin、 eel、pwm、mal
‑
i、gna、sba、ptl
‑
i、bs
‑
i、dsa、ptl
‑
ii、bpl、ltl的nfis 在nctb组中显示出下调趋势(见图6)。分析发现的具有显著性差异的17种凝集素所 特异性识别的详细糖链结构及差异性详见表4。
[0090]
表4 ncta和nctb组中具有显著性差异的凝集素
[0091][0092][0093]
*p≤0.05,**p≤0.01,***p≤0.001,****p≤0.0001
[0094]
本实施例进一步通过凝集素印迹实验对上述结果进行可靠性验证,选出凝集素gna 和eel进行凝集素印迹实验。用cy5荧光标记凝集素。为了消除组内个体差异导致引 起的误差,使用血清的混合样本对其进行本部分实验,sds
‑
page蛋白银染结果显示 ncta和
nctb两组血清蛋白的条带在分子量15
‑
150kd中,其蛋白分子量基本一致(见 图7),gna和eel在印迹实验中显示出了ncta和nctb两组的差异,cy5荧光标 记的凝集素gna在分子量50
‑
70kd(b1)和分子量70
‑
100kd(b2)的条带都显示出 ncta组的gna与血清蛋白的结合强度高于nctb组,cy5荧光标记的凝集素eel在 分子量50
‑
70kd(b1、b2)同样显示出了ncta组的结合强度高于nctb组(见图7), 然后使用imagej对凝集素印迹扫描图进行灰度值分析并制做柱状图(见图8),gna和 eel的印迹结果与其芯片结果的变化趋势基本一致,从而也证明了芯片检测的准确性和 可靠性。
[0095]
综上,乳腺癌新辅助化疗患者血清中ncta组与nctb组的蛋白质糖链存在显著的 差异,差异表达的凝集素所特异性识别的糖链将有助于临床决策提供一定的实验依据, 可能作为一种乳腺癌新辅助化疗疗效评估的生物标志物为临床疗效诊断提供参考性意 见。
[0096]
实施例4乳腺癌新辅助化疗疗效预测模型的构建
[0097]
在临床上,每化疗两个周期后对患者进行一次病理评估,在评估后的治疗选择方面 主要根据主治医生的临床经验而目前没有达到临床共识。因此,为了增加实验的可靠性 和准确性,本发明构建模型的训练集数据均选用乳腺癌新辅助化疗患者第一次或第二次 化疗后的血清样本的芯片数据,为了进一步证明模型的准确性,选用患者第三次化疗及 之后的血清样本的芯片数据作为验证集对所构建的模型进行验证。将收集的111例乳腺 癌新辅助化疗患者(nct)样本按照上述方法及mp分级系统将样本分为68例化疗有 效组(ncta)和43例化疗无效组(nctb),然后按照6:4比例随机分为训练集和验证 集,其中训练集包括42例ncta,25例nctb,用于构建nct疗效预测模型;验证集 包括26例ncta,18例nctb,用于对所构建的疗效预测模型进行评估和验证。分组信 息见表5。
[0098]
表5训练集和验证集血清样本分组信息表
[0099][0100]
基于上述乳腺癌新辅助化疗血清样本的凝集素芯片数据,利用spss 21.0软件中的 二元逐步logisitic逻辑回归分析方法,将实施例3中筛选出来的17种差异表达的凝集 素作为候选凝集素,利用训练集中的样本数据构建鉴别乳腺癌新辅助化疗疗效的数学模 型,然后利用origin 8.0软件对所构建疗效预测模型的灵敏度和特异性进行计算;然后 将验证组中的血清样本数据代入数学公式,利用roc曲线分析对其进行评估和验证, 并对其样本的正确判断情况进行统计。
[0101]
根据前期的凝集素芯片数据分析结果,仅依据所筛选的单种凝集素上下调趋势或多 种凝集素组合的上下调趋势来区分乳腺癌新辅助化疗的疗效有效或者疗效无效的方式 在很多情况下缺乏客观性而且不能做出有效的判断。本发明希望实现对乳腺癌新辅助化 疗疗效进行准确的评估,因此基于凝集素芯片数据结果利用二元逐步logisitic逻辑回归 分析方法对数据进行科学的分类和合理的量化,构建用于鉴别乳腺癌新辅助化疗疗效的 模型(model nct)。其中,model nct的模型公式见公式(1),能够从ncta中区分 nctb。
[0102][0103]
其中,gna为标准化的凝集素gna的荧光强度;pwm为标准化的凝集素pwm 的荧光强度;ltl为标准化的凝集素ltl的荧光强度。
[0104]
由上述公式可看出gna、pwm和ltl这三种凝集素被包含在model nct中,对 实施例3中凝集素芯片筛选的17种候选凝集素以及model nct进行roc曲线分析。 具体分析结果如图9(a)以及表6所示,候选凝集素(gna、pwm、ltl)以及modelnct在roc曲线分析显示具有较好的疗效预测效能(从ncta中区分nctb),其中凝 集素gna的auc值为0.878,灵敏度为0.857,特异性为0.760;pwm的auc值为0.771, 灵敏度为0.714,特异性为0.600;ltl的auc值为0.762,灵敏度为0.738,特异性为 0.600;而model nct的auc值为0.920,灵敏度为0.857,特异性为0.880(见表6), 可以看出模型的预测效果比单一凝集素的疗效预测效能好,并且根据图中roc曲线图 也可以直观看出模型的优势。
[0105]
表6 model nct与单一候选凝集素的roc曲线分析结果表
[0106][0107]
实施例5本发明的疗效预测模型的验证
[0108]
为了对训练集中构建的乳腺癌新辅助化疗疗效预测模型的临床预测能力进行评估, 本实施例使用验证集中的血清样本数据(26例ncta,18例nctb)对已构建的乳腺癌 新辅助化疗疗效预测模型的准确性进行验证,将训练集中的数据代入model nct,将模 型输出结果进行分析。图9(b)的roc曲线和表6的分析数据展示了验证集中疗效评 估模型的验证结果,结果表明,model nct的auc值为0.861,灵敏度为0.731,特异 性为0.778,同该灵敏度、特异性组合对应的最佳工作点(cut
‑
off value,cut
‑
off值)为 0.753。经过个例样本芯片数据带入预测模型后的得数与cut
‑
off值比较,大于等于0.753 被预测为化疗有效,小于0.753则被预测为化疗无效。结果显示model nct能够正确预 测26例ncta中的19例,18例nctb中的14例。
[0109]
实施例6本发明的疗效预测模型的盲测
[0110]
为了对所构建的乳腺癌新辅助化疗疗效预测模型的预测能力更进一步在临床应用 上进行评估,于西安交通大学第一附属医院乳腺外科处收集了乳腺癌新辅助化疗患者第 一次或第二次化疗后的血清样本共20例,所有血清样本的提供者及协助血清采集的医 生均知情,为了使实验更加严谨和评估工作更加的完整,本实施例采用了盲测的方法对 所构建的模型进行评估,只有待实验完成后,才能与每位患者的最终临床mp评级结果 进行比
对,以此对所构建的模型在临床应用上的潜能进行评估。
[0111]
1.血清蛋白的定量
[0112]
使用bca法对处理过的血清样本进行蛋白质定量,以各孔的蛋白质浓度为x坐标, 对应的od值/562nm为y坐标,所得的曲线如图10所示。通过线性回归获得计算公式 y=0.5684x 0.0236,r2=0.999。
[0113]
表7列出20例乳腺癌新辅助化疗后血清样本的原始浓度以及cy3荧光标记后的浓 度,使用bca法测定血清样本的原始浓度,用nano photometer测定cy3荧光标记后的 浓度。
[0114]
表7血清蛋白cy3标记前后浓度汇总表
[0115][0116]
2.疗效评估模型的盲测结果
[0117]
利用凝集素芯片技术对20例血清样本进行检测并计算出每例样本的nfis值,然后 将20例nfis值代入model nct的模型公式后即可得到相应的模型预测结果。然后将 此结果与实际临床mp结果进行比对,汇总结果见表8。
[0118]
表8 20例血清样本盲测结果
[0119][0120]
结果显示,model nct共诊断出ncta 10例,nctb 10例,误判3例,灵敏度为 0.818,特异性为0.889,准确率为0.85,可以正确预测9例ncta的8例,11例nctb 中的9例。综上所
述,本发明中所构建的model nct显示出了较好的疗效预测能力和 临床应用潜能,通过盲测对模型进行了初步的评估与验证。
[0121]
实施例7本发明的基于血清蛋白的乳腺癌新辅助化疗疗效预测的凝集素测试载体
[0122]
本发明提供一种基于血清蛋白的乳腺癌新辅助化疗疗效预测的凝集素测试载体, 包括测试凝集素探针组,所述测试凝集素探针组至少包括gna、pwm和ltl。
[0123]
因为前述实施例中gna、pwm和ltl在nctb组中均显示出下调趋势,在实际 应用时,将待检测样本的凝集素芯片结果同对照组的凝集素芯片结果进行对比,如果 gna、pwm和ltl的表达均下调,说明待测样本的乳腺癌患者的新辅助化疗可能无 效。
[0124]
本发明还提供一种基于血清蛋白的乳腺癌新辅助化疗疗效预测的凝集素测试载 体,包括测试凝集素探针组,所述测试凝集素探针组包括gna、pwm、ltl、stl、 rca120、gsl
‑
i、pha
‑
e、mal
‑
ii、jacalin、eel、mal
‑
i、sba、ptl
‑
i、bs
‑
i、dsa、 ptl
‑
ii、bpl。在实际应用时,将待检测样本的凝集素芯片结果同对照组的凝集素芯 片结果进行对比,如果stl、rca120、gsl
‑
i的表达均上调,其余均下调,说明待测 样本的乳腺癌患者的新辅助化疗可能无效。
[0125]
此外,所述测试凝集素探针组还包括阴性对照和阳性对照。阴性对照为1~2个, 可以是bsa,阳性对照为marker。
[0126]
所述测试载体除了可以是本发明实施例的凝集素芯片之外,还可以是金属片、硝 酸纤维素膜、瓷片或酶标板。上述区别只是载体形式的不同,只要能够负载需要的凝 集素均可以实现本发明的技术方案。
[0127]
实施例8本发明的基于血清蛋白的乳腺癌新辅助化疗疗效预测的系统
[0128]
所述系统包括3个部分:
[0129]
(1)测试凝集素探针组;所述凝集素探针组至少包括gna、pwm和ltl,还 包括stl、rca120、gsl
‑
i、pha
‑
e、mal
‑
ii、jacalin、eel、mal
‑
i、sba、ptl
‑
i、 bs
‑
i、dsa、ptl
‑
ii、bpl,还可以包括阴性对照和阳性对照。阴性对照为1~2个, 可以是bsa,阳性对照为marker。
[0130]
(2)利用测试凝集素探针组与血清样本结合检测血清糖蛋白糖型的装置;
[0131]
(3)分析判断测试凝集素探针组所识别的糖链是否发生相应的上调、下调的数 据分析模块。
[0132]
本发明利用凝集素芯片技术对ncta和nctb血清糖蛋白糖型的差异表达进行分析, 发现共有17中凝集素在ncta和nctb两组中存在显著性差异,并且凝集素印迹实验 结果与芯片结果相同,凝集素stl、rca120、gsl
‑
i所特异性识别的core(glcnac)ofn
‑
glycan、β
‑
gal、αgalnac等糖链结构在ncta组中显著性下调,而凝集素pha
‑
e、 mal
‑
ii、jacalin、eel、pwm、mal
‑
i、gna、sba、ptl
‑
i、bs
‑
i、ptl
‑
ii、dsa、 bpl、ltl所特异性识别的high
‑
mannose、fucα1
‑
2galβ1
‑
4glcnac、(galnac)n等糖链 结构在ncta组中显著性上调,这些凝集素所特异性识别的糖链在乳腺癌中均有不同程 度的升高或降低,因此这些糖链的变化可以作为乳腺癌新辅助化疗疗效评估的潜在生物 标志物。
[0133]
基于111例乳腺癌新辅助化疗后患者血清样本的凝集素芯片数据,选用乳腺癌新辅 助化疗患者第一次或第二次化疗后的血清样本芯片结果数据作为模型测试集,患者第三 次化疗及之后的血清样本芯片结果数据作为模型验证集,利用二元logisitic逐步逻辑回 归分析方法构建乳腺癌新辅助化疗疗效预测模型(model nct),其model nct包含了gna、pwm和ltl三种凝集素,gna的auc为0.878,灵敏度为0.857,特异性为 0.760;pwm的auc
为0.771,灵敏度为0.714,特异性为0.600;ltl的auc为0.762, 灵敏度为0.738,特异性为0.600;而model nct的auc值为0.920,灵敏度为0.857, 特异性为0.880,可以看出单一凝集素的预测能力均低于model nct的预测能力,在验 证组中,model nct能够正确预测26例ncta中的19例,18例nctb中的14例,其 auc值为0.861,灵敏度为0.731,特异性为0.778,数据显示出了model nct相比于单 个凝集素具有较高的灵敏度和特异性的优势。
[0134]
利用凝集素芯片技术对收集的20例未知临床疗效的新辅助化疗患者第一次或第二 次化疗后的血清样本进行逐例检测,将凝集素芯片检测分析结果代入model nct中进 行计算,将所得结果与临床最终疗效结果进行比较,显示model nct具有较好的区分 效果,可以正确区分9例ncta的8例,11例nctb中的9例,准确率为85%,进一步 验证了模型的有效性和可靠性。
[0135]
本发明的模型model nct,能够判定患者对当前新辅助化疗药物的敏感性并确定患 者是否需要继续保持既定治疗方案,同时对预测疗效差的患者争取治疗窗口期、节约医 疗成本、并调整个性化治疗方案等方面具有重要价值。本发明中所构建的model nct 显示出了较好的疗效预测能力和临床应用潜能。
[0136]
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和 原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。