serpine1抑制剂在肝细胞癌微波消融术后抗复发转移中的用途
技术领域
1.本发明涉及serpine1抑制剂在肝细胞癌微波消融术后抗复发转移中的用途,属于生物医药技术领域。
背景技术:
2.肝细胞癌(hcc,以下简称“肝癌”)在我国恶性肿瘤中位居第三,五年总体生存率仅为12.1%。肝癌的治疗手段多种多样,如外科切除、肝移植、介入治疗、微波/射频消融、靶向药物、全身化疗等。在《原发性肝癌诊疗规范(2019版)》中,微波消融是治疗肝癌的一种重要手段。然而,微波消融后残癌复发转移是患者死亡的关键原因,进一步发现新的治疗手段对提高肝癌总体预后意义重大。
3.血管生成被认为是肿瘤转移最重要的病理过程之一。在肝细胞癌(hcc)中,由于肿瘤血供一般比较丰富,医生很容易区分恶性病变和良性病变。因此,抗血管生成治疗成为肝癌治疗肿瘤的有效手段。多年来,血管内皮生长因子a(vegf
‑
a)是恶性血管生成中一种关键的促血管生成细胞因子。许多研究报告了vegf在hcc中的“不良作用”。尽管索拉非尼是一种靶向vegfr的tki抑制剂,且已被fda批准用于治疗晚期或不可切除的hcc十多年,但应用索拉非尼的患者总生存期仅延长3个月左右。
4.纤溶酶原激活剂抑制剂i型(也称为serpine1、pai
‑
1)是丝氨酸蛋白酶抑制剂超家族的成员,最早被报道可降低基质金属蛋白酶(mmp)的活化,从而破坏细胞微环境的平衡。最近的研究证明了serpine1与癌症之间的关系。詹姆斯等人揭示mir
‑
30c通过阻断乳腺癌和肺癌中的serpine1来抑制致癌作用;来自teng等人的研究说明nkx2
‑1‑
as1/mir
‑
145
‑
5p轴正向上调胃癌中serpine1的翻译。在hcc方面,serpine1发挥的作用尚不清楚。
5.rna甲基化是真核细胞转录后水平的重要修饰,已被证明发挥不同的作用。有一半以上的rna甲基化是n6
‑
甲基腺苷(m6a修饰)。迄今为止,m6a修饰已被证明广泛参与了肿瘤转移的过程。陈等人证明mettl3/m6a/gls2轴促进食管鳞状细胞癌的进展;侯等人揭示ythdc1/m6a通过上调mir
‑
30d抑制胰腺导管腺癌;陈等人说明m6a状态决定了乳腺癌肺转移的发生。然而,关于m6a修饰是否以及如何在hcc亚致死热处理后的血管生成中起作用,知之甚少。
6.最近,类器官技术已成为研究癌症生物学、临床转化和精准医疗的重要模型。与传统的二维细胞系相比,患者来源的类器官(pdo)可以更准确地概括肿瘤组织学和遗传学特征。患者来源移植模型(pdx)更昂贵、更耗时,并且可能在小鼠特异性肿瘤进化下。pdo是一种体外三维(3
‑
d)肿瘤模型,具有自我更新和自我组织的能力,并保留了来源肿瘤的关键特征。在之前的研究中曾采用hcc pdo模型来评估亚致死热处理后的表型变化,发现hcc pdo表现出高转移特征,这可能与cd
‑
47介导的emt作用有关。因此,亚致死热处理可引起hcc的侵袭,这表明微波消融有可能导致肿瘤转移。另一方面,血管生成普遍与肿瘤转移密切相关。
技术实现要素:
7.本发明所要解决的技术问题是:肝细胞癌微波消融术进行治疗后存在残癌复发转移等问题。
8.为了解决上述技术问题,本发明提供了serpine1抑制剂在制备微波消融术后抗肝癌复发转移的药物中的应用。
9.优选地,所述药物包括医学上可接受的载体和有效量的活性成分,所述活性成分为serpine1抑制剂。
10.优选地,所述的serpine1抑制剂包括pai
‑
039。
11.本发明的pai
‑
039,化学名为1
‑
苄基
‑5‑
(4
‑
(三氟甲氧基)苯基)
‑
1h
‑
吲哚
‑3‑
基)氧乙酸;α
‑
氧代
‑1‑
(苯基甲基)
‑5‑
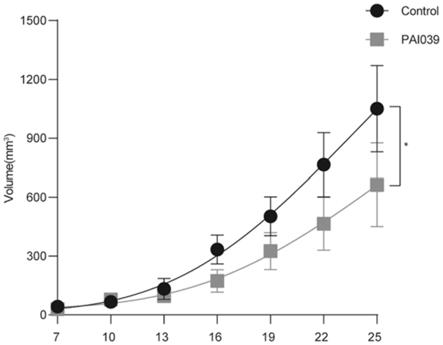
[4
‑
(三氟甲氧基)苯基]
‑
1h
‑
吲哚
‑3‑
乙酸,又名tiplasinin、tiplaxtinin、way
‑
168039,是一种有效的,具有口服活性的选择性的纤溶酶原激活物抑制剂
‑
1(pai
‑
1)抑制剂,具有式(i)的结构,分子量为439.38,其化学式为c
24
h
16
f3no4。
[0012][0013]
与现有技术相比,本发明的有益效果在于:
[0014]
本发明提供的serpine1抑制剂为微波消融术后抗肝癌复发转移提供一种新的药物治疗方案,为临床上实现进一步提高肝癌患者预后提供了一种新的途径。
附图说明
[0015]
图1a:展示亚致死热损伤细胞模型rna
‑
seq结果中的“前25个增加的基因”和“前25个减少的基因”的热图;
[0016]
图1b:基于三个go术语“血管生成”、“正向调控血管生成”和“细胞外分泌蛋白”绘制的维恩图以及维恩图的具体“交叉基因”列表;
[0017]
图1c:表示serpine1在mrna和蛋白质水平上的变化。
[0018]
图1d:表示tcga数据库中serpine1高表达和低表达患者的总体存活率;
[0019]
图1e:表示hcc不同阶段serpine1的表达水平;
[0020]
图1f:表示hpa数据库中serpine1的典型蛋白质水平
[0021]
图1g:表示serpine1在接受切除的患者的hcc和癌旁组织中的表达;
[0022]
图1h:表示vx2兔消融模型建立示意图;
[0023]
图1i:表示消融手术前成功建立vx2肝癌原位;代表性肿瘤为7
×
7mm2;a:肿瘤;b:正常肝组织;
[0024]
图1j:表示对兔子模型进行微波消融的示意图;
[0025]
图1k:表示超声图像显示微波消融后1天、3天、7天、14天的一般情况;
①
:正常肝组
织;
②
:残留肿瘤;
③
:消融组织;
[0026]
图1l:表示h.e.染色(
×
10)前后消融部分周围的残留肿瘤和正常肝脏;a:肿瘤;b:消融组织;c:周围炎性部位;d:正常肝组织;)
[0027]
图1m:表示不同时间点残留兔肝癌serpine1的相对mrna水平和相对蛋白水平;
[0028]
图2a:表示hcclm3和huh7细胞系在37℃培养条件下,敲低serpine1后mrna表达水平和蛋白表达水平降低,46℃培养条件可部分恢复serpine1的mrna表达水平和蛋白表达水平;
[0029]
图2b:表示hcclm3和huh7细胞系在37℃培养条件下,serpine1抑制剂pai
‑
039使serpine1的mrna转录水平和蛋白表达水平下降,46℃培养条件可部分恢复serpine1的mrna水平和蛋白表达水平;
[0030]
图2c:表示elisa显示在hcclm3细胞系在37℃培养条件下,敲低serpine1后细胞外上清液中serpine1的水平下降,46℃培养条件可部分恢复serpine1的水平,而elisa显示在huh7细胞系在37℃培养条件下,敲低serpine1后细胞外上清液中serpine1的水平下降,46℃培养条件无法显著恢复serpine1的水平;
[0031]
图2d:展示huvec的管形成试验,收集来自hcclm3或huh7的在不同处理条件下获得的上清培养huvec 48小时,与直接使用37℃培养条件的上清液相比,使用敲低serpine1后细胞外上清液中培养后管形成数量显著降低,使用46℃培养条件获得的上清液可部分恢复管形成数量;
[0032]
图2e:表示在huvec的管形成试验中,收集来自hcclm3或huh7的在不同处理条件下获得的上清培养huvec 48小时,与直接使用37℃培养条件的上清液相比,使用加入pai
‑
039后的培养上清液后管形成数量显著降低,而使用46摄氏度培养条件的上清液可显著增加管形成数量;
[0033]
图2f:展示string分析显示与serpine1潜在相关蛋白较多,且vegf,smad2,smad3和smad7与serpine1显著相关;
[0034]
图2g:显示在hcclm3和huh7肝癌细胞中,serpine1敲低后vegf的蛋白水平表达显著降低,而在46℃培养条件下,vegf的表达水平可以增加;
[0035]
图2h:显示在hcclm3和huh7肝癌细胞中,serpine1敲低后,上清液中vegf的相对表达量显著降低,在加入vegf后细胞外vegf表达水平升高;
[0036]
图2i:展示hcclm3和huh7细胞在46℃条件下进行培养,serpine1被敲除后vegf表达降低,加入vegf后,serpine表达无明显变化;
[0037]
图2j:展示huvec的管形成试验,收集来自hcclm3或huh7的上清液并用于培养huvec 48小时;使用46℃ serpine1敲低的上清液处理后,管形成数量降低,当加入vegf处理后的细胞上清液时,管形成数量增加;
[0038]
图3a:展示当在hcclm3或huh7中敲低mettl3时,加入pai
‑
1后,serpine1的mrna表达水平升高,mettl3的mrna表达水平无明显变化;
[0039]
图3b:表示当在hcclm3或huh7中加/不加serpine1敲低mettl3时,相对mettl3和serpine1蛋白水平;
[0040]
图3c:展示在hcclm3或huh7中,serpine1被敲低后,serpine1mrna表达水平无明显变化;
[0041]
图3d:展示当serpine1在hcclm3或huh7中被敲低时,相对mettl3和serpine1蛋白水平;
[0042]
图3e:展示来自rmbase的serpine1预测的m6a修饰位点示意图;
[0043]
图3f:表示野生型或m6a共有序列突变体serpine1 cdna与萤火虫荧光素酶报告基因融合,serpine1的m6a共有序列的突变解除了hcclm3和huh7中serpine1与mettl3的转录后抑制;
[0044]
图3g:表示huvec的小管形成实验,收集来自hcclm3或huh7的上清液并用于培养huvec 48小时,条件是46℃,敲除mettl3,加入pai
‑
1后增殖扩增能力提高;
[0045]
图3h:展示46℃下有/无加serpine1敲低mettl3条件下的rna稳定性测定;
[0046]
图3i:展示在hcclm3或huh7细胞系中,当igf2bp1被敲低后,igf2bp1和serpine1的转录和翻译水平显著下降;
[0047]
图3j:展示在hcclm3或huh7中,当serpine1被敲低后,igf2bp1和serpine1在转录组和翻译水平显著下降;
[0048]
图3k:展示野生型或m6a共有序列突变体serpine1 cdna与萤火虫荧光素酶报告基因融合,serpine1的m6a共有序列的突变解除了hcclm3和huh7中serpine1与igf2bp1的转录后抑制;
[0049]
图4a:表示肝癌类器官是由肝癌细胞构成的三维细胞团,加热后表现出emt特征;
[0050]
图4b:表示he染色显示肝癌类器官具有肝癌组织学特征;
[0051]
图4c:免疫荧光染色表明pdo
‑
1表现出hcc的典型特征:afp的阳性表达和epcam的阴性表达,且serpine1的表达水平在经过46℃热处理的pdo中显著更高,并且这种影响可以通过添加pai
‑
039来减弱;
[0052]
图4d:免疫荧光染色表明pdo
‑
2表现出hcc的典型特征:afp的阳性表达和epcam的阴性表达,且serpine1的表达水平在经过46℃热处理的pdo中显著更高,并且这种影响可以通过添加pai
‑
039来减弱;
[0053]
图4e:免疫荧光染色表明pdo
‑
3表现出hcc的典型特征:afp的阳性表达和epcam的阴性表达,且serpine1的表达水平在经过46℃热处理的pdo中显著更高,并且这种影响可以通过添加pai
‑
039来减弱;
[0054]
图4f:表示37℃、46℃、46℃ pai
‑
039条件下serpine1表达水平的变化,热处理后serpine1表达水平显著升高,而加入pai
‑
039后serpine1表达水平显著降低;
[0055]
图5a:表示将10只雌性balb/c裸鼠接受了亚致死热处理的hcclm3注射,其中5只接受生理盐水,另外5只每隔一天接受pai
‑
039,第25天是实验结束,处死小鼠;
[0056]
图5b:表示注射pai
‑
039显著抑制肿瘤生长;
[0057]
图5c:代表对照组和pai
‑
039组he染色结果;
[0058]
图5d:展示免疫组化结果,与对照组相比,pai
‑
039组的serpine1表达水平显著降低;
[0059]
图5e:展示免疫组化结果,与对照组相比,pai
‑
039组的vegf表达水平显著降低;
[0060]
以上各图中,“ns”:表示not significant(没有显著差异);*:表示p<0.05;**:表示p<0.01;***:表示p<0.001;****:表示p<0.0001。
具体实施方式
[0061]
为使本发明更明显易懂,兹以优选实施例,并配合附图作详细说明如下。
[0062]
以下实施例中,所用到的具体实验方法如下所示:
[0063]
1、细胞培养和处理
[0064]
采用hcc细胞系hcclm3和huh7细胞株来完成体外实验;并用一株兔鳞状细胞系vx2进行兔原位移植。这三种细胞来自复旦大学(中国上海)中山医院肝癌研究所。vx2细胞已被广泛用作经典的肝肿瘤模型。细胞在dulbecco改良的eagle培养基(dmem,gibco,gibco,grand island,ny,usa)中培养,该培养基含有10%胎牛血清(fbs)和抗生素(青霉素(100u/ml)/链霉素(0.1mg/ml))。培养条件为37℃、5%co2、加湿环境,每周换液3次。
[0065]
2、转染和稳定细胞系
[0066]
使用lipofectamine 2000试剂(life technology,thermo fisher scientific,de,usa)进行质粒转染,pcdna3.1
‑
serpine1、pcdna3.1
‑
vegf和serpine1病毒(ubi
‑
mcs
‑
3flag
‑
cbh
‑
gcgfp
‑
ires
‑
puromycin)和2条sirnas(simettl3:5'
‑
gcuaccuggacgucaguautt
‑
3'(seq id no:1),siigf2bp1:5'
‑
tctgcaactcgttcaccgt
‑
3'(seq id no:2))均购自genechem(中国上海)。空载体用作阴性对照。转染程序严格遵循制造商对lipofectamine 2000试剂(invitrogen)的说明。对于一组,将总共5
×
105个细胞接种到6孔板的孔中。转染后,rt
‑
qpcr分析或蛋白质印迹分析用于验证转染效率。
[0067]
3、rna提取和实时pcr
[0068]
根据制造商的说明,通过rna纯化试剂盒(ezbioscience,usa)提取总rna。然后,使用4
×
reverse transcription master mix(ezbioscience)进行rt
‑
pcr,使用无dnaase和rnaase的尖端(yueyibiotech,上海,中国)。sybr green pcr试剂盒(yeasen,中国)用于qpcr。根据2
‑
δδct方法,将每个基因的表达水平标准化为actin的表达水平,作为内部对照。
[0069]
人类基因和兔基因的引物(由中国sunya合成)如下:
[0070]
人
‑
肌动蛋白:
[0071]
actin
‑
f:accttctacaatgagctgcg(seq id no:3);
[0072]
actin
‑
r:cctggatagcaacgtacatgg(seq id no:4)。
[0073]
人类
‑
serpine1:
[0074]
serpine1
‑
f:accgcaacgtggttttctca(seq id no:5);
[0075]
serpine1
‑
r:ttgaatcccatagctgcttgaat(seq id no:6)。
[0076]
人类
‑
mettl3:
[0077]
mettl3
‑
f:ttgtctccaaccttccgtagt(seq id no:7);
[0078]
mettl3
‑
r:ccagatcagagaggtggtgtag(seq id no:8)。
[0079]
人类
‑
igf2bp1:
[0080]
igf2bp1
‑
f:gcggccagttcttggtcaa(seq id no:9);
[0081]
igf2bp1
‑
r:ttgggcaccgaatgttcaatc(seq id no:10)。
[0082]
兔肌动蛋白:
[0083]
肌动蛋白
‑
f:tggctctaacagtccgcctag(seq id no:11);
[0084]
肌动蛋白
‑
r:agtgcgacgtggacatccg(seq id no:12)。
[0085]
兔
‑
serpine1:
[0086]
serpine1
‑
f:gcctctaaggaccgcaatgt(seq id no:13);
[0087]
serpine1
‑
r:gccgtgctctgctcatctat(seq id no:14)。
[0088]
4、rna
‑
seq分析
[0089]
对于rna
‑
seq分析,在构建文库后,使用github包soapnuke(v1.5.2)(https://github.com)操作测序数据以删除以下元素:使用测序适配器读取;低质量读数。随后,干净的读数被转换为fastq格式。hisat2(v2.0.4)(http://www.ccb.jhu.edu/software/hisat)用于绘制干净读数。然后,通过ericscript(v0.5.5)(http://rnaseq
‑
mats.sourceforge.net/)或rmats(v3.2.5)(https://bowtiebio.sourceforge.io/)融合剪接基因。之后,使用rsem(v1.2.12)计算基因的表达水平(https://github.com/deweylab/rsem)。最后,使用r(https://www.r
‑
project.org/)进行q值≤0.05的分析。go(http://www.geneontology.org/)和kegg(https://www.kegg.jp/)对注释不同表达基因的富集分析有助于我们了解表型的变化。
[0090]
5、蛋白质印迹
[0091]
在指定时间收获细胞。在每个极中,20μg的总蛋白质用于电泳。将膜用5%脱脂牛奶室温封闭1小时,然后与一抗在4℃下孵育过夜。随后,将相应的二抗应用于膜并在室温下孵育2小时。使用化学发光ecl试剂盒(tanon,上海,中国)可视化蛋白质条带。使用的抗体如下:单克隆抗β
‑
肌动蛋白抗体#a5441(sigma);抗serpine1(ab2)抗体#av47470(sigma);β
‑
肌动蛋白(13e5)兔单克隆抗体#4970(cst);pai
‑
1(d9c4)兔单克隆抗体#11907(cst);抗vegfa抗体[vg
‑
1]#ab1316(abcam);mettl3(e3f2a)rabbit mab#86132(cst);igf2bp1#ab82968(abcam)。
[0092]
6、gepia和hpa和string
[0093]
通过gepia2(http://gepia2.cancer
‑
pku.cn)和tcga数据库(http://www.oncolnc.组织/)。应用的统计方法是采用对数秩检验的kaplan
‑
meier方法。hpa数据库中hcc和正常肝组织的表达评分描述了估计的serpine1水平。string数据库(https://string
‑
db.org/cgi/input.pl)已被广泛用于预测蛋白质
‑
蛋白质相互作用(ppi),通过该数据库寻找可能与serpine1相互作用的蛋白质。
[0094]
7、消融模型
[0095]
采用新西兰白兔建立肝癌原位模型。兔子首先皮下种植vx2细胞。异种移植物长到约1cm3后,将其切成碎片(约2~3mm3)并准备移植。兔在异种移植物原位移植前12小时禁食。移植开始时,兔用2%戊妥钠麻醉并清洗皮肤。移植后用明胶海绵止血,连续3天使用青霉素40万单位。vx2兔模型建立2周后进行超声检查(意大利esaote的mylab twice),移植图为9.50
±
1.56mm(8mm
‑
13mm)。激光烧蚀系统为echo laser x4(发射激光波长为1064nm,光纤直径为300um)。消融时功率选择4w,输出能量100j左右。破坏了肿瘤的1/3
‑
2/3,建立了残留肿瘤(部分消融)模型,创造了亚致死热处理的条件。然后分别在消融后3天、7天和14天使用彩色多普勒超声和剪切波粘弹性检查病变。
[0096]
8、荧光素酶报告基因检测
[0097]
根据制造商的说明(11402es60,yeasen)进行荧光素酶报告基因检测。将hcclm3和huh7细胞接种在6孔板中,并用宽型serpine1响应荧光素酶报告构建体(serpine1
‑
wt)、突
变型serpine1响应荧光素酶报告构建体(serpine1
‑
mut)、宽型mettl3质粒转染,或相应地,igf2bp1。在转染后24h时,将细胞裂解物与10μg/ml的萤火虫和tk分别孵育10分钟,并使用双荧光素酶报告基因检测系统(promega,麦迪逊,威斯康星州,美国)和微孔板发光计(普罗麦加)。萤火虫荧光素酶活性被相应的海肾荧光素酶活性校正。结果代表三个独立实验。
[0098]
9、酶联免疫吸附试验
[0099]
细胞转染后,收集细胞培养上清液。使用人serpine1试剂盒(ab269373,abcam)和vegf
‑
a人elisa试剂盒(bms277
‑
2,thermofish,invitrogen)按照制造商的说明分析serpine1和vegf浓度。
[0100]
10、rna衰变分析
[0101]
根据qing等的研究进行了rna衰减测定。简而言之,hcclm3和huh7细胞以50%的汇合度接种在6厘米的平板中。24小时后,将每个6厘米的平板重新接种到三个6厘米的平板中。48小时后,在胰蛋白酶消化和收集前的6小时、3小时和0小时加入放线菌素d至3mg/ml。通过柱上dnase
‑
i消化步骤纯化总rna。rna量由rt
‑
qpcr确定。mrna衰减率是通过qing等人描述的方程计算的,具体计算过程如下:
[0102]
dc:mrna浓度;
[0103]
dt:特定时间;
[0104]
‑
k
decay
:mrna衰减的速率常数;
[0105]
c:mrna浓度;
[0106]
t:时间;
[0107]
首先可以得到公式:
[0108]
dc/dt=
‑
k
decay
·
c;
[0109]
然后降解常数可以被估计为:
[0110]
in(c/c0)=
‑
k
decay
·
t;
[0111]
c0是降解初始浓度,因此降解一半的浓度计算则为:
[0112]
in(1/2)=
‑
k
decay
·
t
1/2
;
[0113]
所以rna降解一半所需时间为:
[0114]
t
1/2
=in2/k
decay
。
[0115]
11、裸鼠皮下异种移植
[0116]
为了模拟亚致死热处理皮下植入模型,将hcclm3在46℃下加热10分钟,并接种到6厘米的培养皿中以模拟亚致死状态,然后如前所述,每天更换培养皿两次培养基。2天后,将5
×
105稳定亚致死热处理的hcclm3细胞皮下注射到balb/c裸鼠体内。植入后7天,对照组每隔一天给予pbs 0.1ml,而pai
‑
039组则每隔一天口服1mg/kg tiplaxtinin(pai
‑
039)。25天后,处死小鼠。
[0117]
12、类器官
[0118]
建立了hcc pdo类器官,使用3个pdo进行实验。对于加热组,在300g离心10分钟后收集pdo,然后在46℃下孵育10分钟。pai
‑
1抑制剂pai
‑
039(终浓度:10μmol/l)加入pdo培养中位数4
‑
5天。然后加热的pdo继续传代,并在福尔马林固定前每2
‑
3天拍摄一次类器官照片。pdo预先用1%琼脂糖(biowest琼脂糖,111860)包埋,用4%磷酸盐缓冲的福尔马林固定,包埋在石蜡中,切成4μm以进行苏木精
‑
伊红和免疫荧光分析,使用标准程序。
[0119]
在进行免疫荧光染色过程中,使用了以下一抗:抗epcam(1:100;21050
‑1‑
ap;proteintech)、抗afp(1:200;14550
‑1‑
ap;proteintech)、抗pai1(1:100;ab66705);abcam)。第二种是alexa fluor 488偶联的山羊抗兔抗体(1:200;gb25303;servicebio,中国)或cy3偶联的山羊抗兔抗体(1:200;gb21303;servicebio,中国)。细胞核用4,6
‑
二脒基
‑2‑
苯基吲哚(servicebio,china)复染。图像是用共聚焦显微镜(奥林巴斯)获得的。
[0120]
13、人类肝癌样本
[0121]
2021年期间,5名hcc患者在介入放射科接受活检,并被诊断为hcc。所有患者均提供书面知情同意书。
[0122]
14、管形成试验
[0123]
在matrigel上通过huvec细胞形成管,将来自不同转染条件的hcclm3或huh7的上清液放入huvec细胞中。9小时后,对管形成进行摄影。
[0124]
15、免疫组化
[0125]
样品用不同浓度的乙醇脱水,最后包埋在石蜡中。将石蜡切片制成碎片并在60℃下干燥过夜。连续石蜡切片在脱蜡后在浓度降低的乙醇中再水化。根据制造商的说明(boster,武汉,中国)使用sabc试剂盒。使用的一抗和二抗分别为人serpine1,pai
‑
1抗体(ab66705,abcam)。最后,通过相差显微镜(佳能,日本)对切片进行成像。
[0126]
实施例1
[0127]
pai
‑
1在亚致死消融后增加:
[0128]
对亚致死热处理模型进行了rna
‑
seq测序,并获得了前25个上调的mrna和前25个下调的mrna的热图,如图1a所示。由于肿瘤血管对肿瘤的存活至关重要,因此基于go术语“正向调节血管生成”、“血管生成”、“细胞外外泌体”之间绘制了维恩图。结果显示了8个“交叉基因”,即“serpine1、rapgef3、ecm1、prkd2、prkca、erap1、cast、gab1”,其中,“serpine1”具有最明显的变化,亚致死热处理组比对照组增加至少16倍,如图1b所示。这表明serpine1可能是hcc亚致死热处理后血管生成的关键蛋白。
[0129]
此外,验证了serpine1的mrna和蛋白质水平的变化。亚致死热处理后serpine1的mrna和蛋白质表达水平增加,如图1c所示。随后通过分析tcga数据库检查serpine1在hcc中的功能,分析tcga数据库中serpine1高表达和低表达患者的总体存活率,lihc数据集显示serpine1高表达组的存活时间较短,如图1d所示。另一方面,通过检测hcc不同阶段serpine1的水平发现,随着肿瘤分期的发展,患者具有更高的serpine1表达,如图1e所示。通过hpa数据库分析serpine1的典型蛋白质水平,hpa数据集表明,hcc患者的serpine1表达高于对应患者,如图1f所示,这与我们的病例一致,serpine1在接受切除的患者的hcc中表达高于癌旁组织中表达,如图1g所示。为了通过亚致死热处理模拟hcc,使用vx2建立了消融兔hcc模型,如图1h所示,图1i表示成功建立vx2肝癌原位模型,代表性肿瘤为7
×
7cm2。使用超声波精确定位异种移植物并控制消融区域,并使残留的hcc生长,如图1j所示,微波消融的功率为4w,输出能量100j左右。通过超声图像观察微波消融后1天、3天、7天、14天的一般情况,并对消融后第7天进行超声造影,结果如图1k所示。h.e.染色前后显微镜下观察消融部分周围的残留肿瘤和正常肝脏,可观察到残留的hcc组织存活下来,如图1l所示。通过检测serpine1的相对mrna表达水平和蛋白表达水平升高,结果显示,与未消融组相比,消融后第3天和第7天serpine1的mrna表达水平和蛋白表达水平升高,之后,serpine1的相对表达
水平在消融7天之后逐渐减少,如图1m所示。
[0130]
实施例2
[0131]
serpine1在亚致死热处理后部分通过vegf促进血管生成:
[0132]
为了进一步研究serpine1的具体机制,在实验中建立了serpine1敲低的细胞,并使用了serpine1抑制剂pai
‑
039进行处理,结果显示,hcclm3和huh7细胞系在37℃培养条件下,敲低serpine1后mrna表达水平和蛋白表达水平降低,46℃培养条件可部分恢复serpine1的mrna表达水平和蛋白表达水平,如图2a所示。此外,hcclm3和huh7细胞系在37℃培养条件下,serpine1抑制剂pai
‑
039使serpine1的mrna转录水平和蛋白表达水平下降,46℃培养条件可部分恢复serpine1的mrna和蛋白表达水平,如图2b所示。当serpine1基因敲低或pai
‑
039抑制时,上清液中serpine1的分泌显著减少。之后进行酶联免疫吸附试验,elisa显示在hcclm3细胞系在37℃培养条件下,敲低serpine1后细胞外上清液中serpine1的水平下降,46℃培养条件可部分恢复serpine1的水平,而elisa显示huh7细胞系在37℃培养条件下,敲低serpine1后细胞外上清液中serpine1的水平下降,46℃培养条件却无法显著恢复serpine1的水平,如图2c所示。因此,在hcclm3细胞中,亚致死热处理挽救了serpine1敲低或应用pai
‑
039的部分影响,然而,在huh7细胞中加入pai
‑
039抑制剂却没有观察到这种现象。
[0133]
收集来自hcclm3或huh7的在不同处理条件下获得的上清培养huvec 48小时。与直接使用37℃培养条件的上清液相比,使用敲低serpine1后细胞外上清液中培养后管形成数量显著降低,使用46℃培养条件获得的上清液可部分恢复管形成数量,如图2d所示;收集来自hcclm3或huh7的在不同处理条件下获得的上清培养huvec 48小时。与直接使用37℃培养条件的上清液相比,使用加入pai
‑
039后的培养上清液后管形成数量显著降低,而使用46摄氏度培养条件的上清液可显著增加管形成数量,如图2e所示。管形成试验表明,在病毒或pai
‑
039抑制serpine1的条件下,用上清液培养后,huvec降低了管形成能力。然后,通过string(https://string
‑
db.org)分析了蛋白质
‑
蛋白质相互作用,结果显示与serpine1潜在相关蛋白较多,smad家族和vegf的一些成员与serpine1接近;此外,在tcga lihc数据集中,smad2、smad3、smad7和vegfa与serpine1显著相关其中,vegf与serpine1的相关性系数r值高达0.37,强烈表明serpine1与vegf之间存在关联,如图2f所示。在hcclm3和huh7肝癌细胞中,serpine1敲低后vegf的蛋白水平表达显著降低,而在46℃培养条件下,vegf的表达水平可以增加,如图2g所示。在hcclm3和huh7肝癌细胞中,serpine1敲低后,上清液中vegf的相对表达量显著降低,在加入vegf后细胞外vegf表达水平升高,如图2h所示。正如预期的那样,vegf随着hcclm3和huh7中serpine1的抑制而降低,同时,分泌的vegf也减少了。hcclm3和huh7细胞在46℃条件下进行培养,serpine1被敲除后vegf表达降低,加入vegf后,serpine表达无明显变化,如图2i所示。接下来,进行huvec的管形成试验,收集来自hcclm3或huh7的上清液并用于培养huvec 48小时。使用46℃ serpine1敲低的上清液处理后,管形成数量降低,当加入vegf处理后的细胞上清液时,管形成数量增加,如图2j所示。因此,结果表明额外的vegf可以促进通过抑制serpine1促进管形成。
[0134]
实施例3
[0135]
mettl3/igf2bp1/m6a轴正向调节serpine1:
[0136]
在之前的研究表明mettl3在亚致死热处理后促进hcc的侵袭。而血管生成与hcc的
侵袭呈正相关。因此,接下来通过实验验证mettl3是否可以在血管生成中调节serpine1。当在hcclm3或huh7中敲低mettl3时,加入pai
‑
1后,serpine1的mrna表达水平升高,mettl3的mrna表达水平无明显变化,如图3a所示。当在hcclm3或huh7中加/不加serpine1敲低mettl3时,相对mettl3和serpine1蛋白水平变化如图3b所示。以上结果表明,抑制mettl3会降低serpine1在mrna水平和蛋白质水平的表达,额外的serpine1可以部分挽救serpine1水平,但对mettl3没有影响。在hcclm3或huh7中,serpine1被敲低后,mettl3 mrna表达水平无明显变化,抑制serpine1并没有抑制mettl3的表达,如图3c所示。上面的数据表明,mettl3可能位于serpine1的上游。由于mettl3是一种甲基转移酶,为了验证serpine1是否以m6a方式受mettl3调控,接着在rmbase 2.0(http://rna.sysu.edu.cn/rmbase)上分析了serpine1的m6a修饰位点。结果,有超过40个预测m6a位点,如图3e所示。
[0137]
根据预测,通过选择两个基序得分最高的m6a修饰位点(紫色的)及其相邻的m6a位点来构建serpine1
‑
mutant(serpine1
‑
mut)质粒。采用野生型或m6a共有序列突变体serpine1 cdna与萤火虫荧光素酶报告基因融合,荧光素酶测定表明serpine1用mettl3强烈增加了萤火虫/海肾的活性,但serpine1
‑
mut不能,如图3f所示,serpine1的m6a共有序列的突变解除了hcclm3和huh7中serpine1与mettl3的转录后抑制结果。随后,进行huvec的小管形成实验,收集来自hcclm3或huh7的上清液并用于培养huvec 48小时。条件是46℃,敲除mettl3,加入pai
‑
1后增殖扩增能力提高,如图3g所示。因此,mettl3的沉默可以抑制小管形成能力,但serpine1的过表达可以挽救这种影响测定。46℃下有/无加serpine1敲低mettl3条件下的rna稳定性,结果如图3h所示。在hcclm3或huh7细胞系中,当igf2bp1被敲低后,igf2bp1和serpine1在转录和翻译水平显著下降,如图3i所示。在hcclm3或huh7中,当serpine1被敲低后,igf2bp1和serpine1在转录组和翻译水平显著下降,如图3j所示。采用野生型或m6a共有序列突变体serpine1 cdna与萤火虫荧光素酶报告基因融合,荧光素酶测定结果如图3k所示。结果表明,serpine1的m6a共有序列的突变解除了hcclm3和huh7中serpine1与igf2bp1的转录后抑制。
[0138]
实施例4
[0139]
serpine1在亚致死热处理下在类器官中上调:
[0140]
进一步使用hcc pdo模型来验证serpine1的功能。在46℃10分钟的热处理后,hcc pdo表现出上皮表型,如更大的侵袭伪足形成和不规则的成纤维细胞样形状。添加serpine1抑制剂pai
‑
039(10μm),表型可在一定程度上逆转,如图4a所示。he染色表明pdo表现出假腺体组织学结构,如图4b所示。免疫荧光染色表明三个pdo表现出hcc的典型特征,例如afp的阳性表达和epcam的阴性,如图4c
‑
4e所示。通过检测serpine1的表达水平发现,serpine1的表达水平在经过热处理的pdo中显着更高,并且这种影响可以通过添加pai
‑
039来减弱,如图4c
‑
4f所示。以上结果表明,在三维pdo模型中,热处理也刺激了serpine1的表达,这种作用可以被serpine1抑制剂pai
‑
039逆转。
[0141]
实施例5
[0142]
pai
‑
039在亚致死热处理后有效抑制体内serpine1的表达:
[0143]
将10只雌性balb/c裸鼠接受了亚致死热处理的hcclm3注射,如图5a所示。其中5只接受生理盐水,另外5只每隔一天接受pai
‑
039。第25天实验结束,处死小鼠,通过建立亚致死热损伤hcclm3皮下异种移植模型考察serpine1抑制剂pai
‑
039在亚致死热治疗后的体内
作用,与对照组相比,pai
‑
039组显示出更小的异种移植体积,如图5b所示,注射pai
‑
039显著抑制肿瘤生长。两组均表现出恶性增长,如图5c所示。免疫组化结果显示,与对照组相比,pai
‑
039组的serpine1表达水平显著降低,如图5d所示,正如预期的那样,与对照组相比,pai
‑
039组显示出更少的serpine1表达。值得注意的是,免疫组化结果显示,与对照组相比,pai
‑
039组的vegf表达水平显著降低,如图5e所示。这些数据表明,pai
‑
039可以抑制亚致死热处理后的体内异种移植。
[0144]
上述实施例仅为本发明的优选实施例,并非对本发明任何形式上和实质上的限制,应当指出,对于本技术领域的普通技术人员,在不脱离本发明的前提下,还将可以做出若干改进和补充,这些改进和补充也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。