基于分子亚型治疗前列腺癌的方法
1.相关申请的交叉引用
2.本技术要求于2019年1月30日提交的美国临时申请62/799,036、于2019年1月30日提交的美国临时申请62/799,037、于2019年2月5日提交的美国临时申请62/801,609、于2019年2月5日提交的美国临时申请62/801,610、于2019年3月27日提交的美国临时申请62/824,968、于2019年3月27日提交的美国临时申请62/825,001以及于2019年11月20日提交的美国临时申请62/938,318。上述申请的全部内容以引用方式并入本文。
背景技术:
3.前列腺癌是全世界第二大最常诊出的癌症,也是导致男性癌症死亡的第六大原因。
4.发达国家的前列腺癌发病率高于世界其他地区,在这些国家,前列腺癌的许多风险因素更为常见,包括更长的预期寿命和富含红肉的饮食。另外,在有更多机会接受筛查项目的发达国家,检测率更高。在接受治疗的患者中,疾病结果最重要的临床预后指标是分期、治疗前psa水平和格里森评分。一般来讲,分级和分期越高,预后越差。虽然前列腺癌在早期阶段可以治愈,然而在前列腺癌的后期阶段,随着治疗的进行,一些患者会出现生化复发的情况。雄激素剥夺疗法(adt)是前列腺癌的主要治疗方法。虽然adt最初是有效的,但几乎所有的患者最终都会发生疾病进展,进展为去势抵抗性前列腺癌(crpc)。需要改善的治疗前列腺癌的方法。
技术实现要素:
5.在一些实施方案中,本发明涉及作为患有前列腺癌(例如,非转移性去势抵抗性前列腺癌(nmcrpc))的人类男性中雄激素受体抑制剂(例如,阿帕鲁胺(apa)和雄激素剥夺疗法(adt)(apa adt))的预后指标的分子标记。
6.在一个方面,本发明提供了使用雄激素受体抑制剂(例如,apa)和雄激素剥夺疗法(adt)(例如,apa adt)提供人类男性前列腺癌(例如,nmcrpc)的改善的治疗益处的方法,该方法包括以下步骤、由以下步骤组成和/或基本上由以下步骤组成:
7.如果确定从该人类男性中获得的生物样本具有以下特征,则向该人类男性施用治疗有效量的该雄激素受体抑制剂(例如,apa)和治疗有效量的该adt:
8.a)前列腺癌的管腔样或基底样分子亚型;
9.b)大于约0.6的基因组分类器评分;
10.c)第一类共调控标记中的至少一种标记的表达增加;
11.d)第二类共调控标记中的至少一种标记的表达增加;
12.e)第三类共调控标记中的至少一种标记的表达降低;
13.f)第四类共调控标记中的至少一种标记的表达增加;或它们的组合。
14.在另一方面,本发明提供了治疗人类男性前列腺癌(例如,nmcrpc)的方法,所述方法包括以下步骤、由以下步骤组成和/或基本上由以下步骤组成:
15.如果确定从该人类男性中获得的生物样本具有以下特征,则向该人类男性施用治疗有效量的雄激素受体抑制剂(例如,apa)和治疗有效量的雄激素剥夺疗法(adt):
16.a)前列腺癌的管腔样或基底样分子亚型;
17.b)大于约0.6的基因组分类器评分;
18.c)第一类共调控标记中的至少一种标记的表达增加;
19.d)第二类共调控标记中的至少一种标记的表达增加;
20.e)第三类共调控标记中的至少一种标记的表达降低;
21.f)第四类共调控标记中的至少一种标记的表达增加;或它们的组合。
22.在另一方面,本发明提供了预测患有前列腺癌(例如,nmcrpc)的人类男性通过施用治疗有效量的雄激素受体抑制剂(例如,apa)和治疗有效量的雄激素剥夺疗法(adt)(例如,apa adt),获得相对于单独施用治疗有效量的该adt而言改善的益处的方法,所述方法包括以下步骤、由以下步骤组成和/或基本上由以下步骤组成:
23.a)确定从该人类男性中获得的生物样本是否具有以下特征:
24.i)前列腺癌的管腔样或基底样分子亚型;
25.ii)大于约0.6的基因组分类器评分;
26.iii)第一类、第二类和/或第四类共调控标记中的至少一种标记的表达水平增加;
27.iv)第三类共调控标记中的至少一种标记的表达水平降低;或它们的组合,以及
28.b)基于以下特征,预测该人类男性通过施用该治疗有效量的该雄激素受体抑制剂(例如,apa)和该治疗有效量的该adt,获得相对于单独施用该治疗有效量的该adt而言改善的益处:
29.i)前列腺癌的管腔样或基底样分子亚型;
30.ii)大于约0.6的基因组分类器评分;
31.iii)第一类、第二类和/或第四类共调控标记中的至少一种标记的表达水平增加;
32.iv)第三类共调控标记中的至少一种标记的表达水平降低;或它们的组合。
33.在另一方面,本发明提供了使用联合施用治疗有效量的雄激素受体抑制剂(例如,apa)和治疗有效量的雄激素剥夺疗法(adt)(例如,apa adt),相对于单独施用治疗有效量的该adt而言,改善对治疗人类男性非转移性去势抵抗性前列腺癌(nmcrpc)的反应的方法,该方法包括以下步骤、由以下步骤组成和/或基本上由以下步骤组成:
34.a)确定从该人类男性中获得的生物样本是否具有以下特征:
35.i)前列腺癌的管腔样或基底样分子亚型;
36.ii)大于约0.6的基因组分类器评分;
37.iii)第一类、第二类和/或第四类共调控标记中的至少一种标记的表达水平增加;
38.iv)第三类共调控标记中的至少一种标记的表达水平降低;或它们的组合,以及
39.b)基于以下特征,相对于单独施用该治疗有效量的该adt而言,改善对联合施用该治疗有效量的该雄激素受体抑制剂(例如,apa)和该治疗有效量的该adt的反应:
40.i)前列腺癌的管腔样或基底样分子亚型;
41.ii)大于约0.6的基因组分类器评分;
42.iii)第一类、第二类和/或第四类共调控标记中的至少一种标记的表达水平增加;
43.iv)第三类共调控标记中的至少一种标记的表达水平降低;或它们的组合。
44.在另一方面,本发明提供了鉴定被诊断为患有前列腺癌(例如,nmcrpc)的人类男性的方法,该人类男性被预测为通过治疗有效量的雄激素受体抑制剂(例如,apa)和治疗有效量的雄激素剥夺疗法(adt)(例如,apa adt),获得相对于单独施用治疗有效量的该adt而言改善的治疗益处,该方法包括以下步骤、由以下步骤组成和/或基本上由以下步骤组成:
45.a)确定从该人类男性中获得的生物样本是否具有以下特征:
46.i)前列腺癌的管腔样或基底样分子亚型;
47.ii)大于约0.6的基因组分类器评分;
48.iii)第一类、第二类和/或第四类共调控标记中的至少一种标记的表达水平增加;
49.iv)第三类共调控标记中的至少一种标记的表达水平降低;或它们的组合,以及
50.b)基于以下特征,预测该人类男性通过施用该治疗有效量的该雄激素受体抑制剂(例如,apa)和该治疗有效量的该adt,获得相对于单独施用该治疗有效量的该adt而言改善的益处:
51.i)前列腺癌的管腔样或基底样分子亚型;
52.ii)大于约0.6的基因组分类器评分;
53.iii)第一类、第二类和/或第四类共调控标记中的至少一种标记的表达水平增加;
54.iv)第三类共调控标记中的至少一种标记的表达水平降低;或它们的组合。
55.在又一方面,本发明提供了预测人类男性前列腺癌(例如,nmcrpc)对联合施用治疗有效量的雄激素受体抑制剂(例如,apa)和治疗有效量的雄激素剥夺疗法(adt)(例如,apa adt),相对于单独施用治疗有效量的该adt而言的治疗反应的改善的方法,该方法包括以下步骤、由以下步骤组成和/或基本上由以下步骤组成:
56.a)确定来自该人类男性的生物样本是否具有以下特征:
57.i)前列腺癌的管腔样或基底样分子亚型;
58.ii)大于约0.6的基因组分类器评分;
59.iii)第一类、第二类和/或第四类共调控标记中的至少一种标记的表达水平增加;
60.iv)第三类共调控标记中的至少一种标记的表达水平降低,或它们的组合,以及
61.b)基于以下特征,预测对该治疗有效量的该雄激素受体抑制剂(例如,apa)和该治疗有效量的该adt,相对于单独施用该治疗有效量的该adt而言反应的改善:
62.i)前列腺癌的管腔样或基底样分子亚型;
63.ii)大于约0.6的基因组分类器评分;
64.iii)第一类、第二类和/或第四类共调控标记中的至少一种标记的表达水平增加;
65.iv)第三类共调控标记中的至少一种标记的表达水平降低,或它们的组合。
66.在一些实施方案中,联合施用apa adt的无转移生存期(mfs)相对于单独施用单独的adt而言,提高了至少约6个月。
67.在一些实施方案中,联合施用apa adt的第二次无进展生存期(pfs2)相对于单独施用单独的adt(即,单独施用adt)而言,提高了至少约6个月。
68.在一些实施方案中,该方法还包括从人类男性中获得生物样本。
69.在一些实施方案中,确定该生物样本具有前列腺癌的管腔样分子亚型。
70.在一些实施方案中,基于大于约0.6的基因组分类器评分来确定该人类男性具有高转移风险。在一些实施方案中,基于大于0.6的基因组分类器评分来确定该人类男性具有
高转移风险。
71.在一些实施方案中,确定该生物样本的该第一类共调控标记中的至少一种标记的表达增加。
72.在一些实施方案中,确定该生物样本的该第二类共调控标记中的至少一种标记的表达增加。
73.在一些实施方案中,确定该生物样本的第三类共调控标记中的至少一种标记的表达降低。
74.在一些实施方案中,确定该生物样本的第四类共调控标记中的至少一种标记的表达降低。
75.在一些实施方案中,该前列腺癌是nmcrpc。
76.在本发明的一些实施方案中,无转移生存期相对于施用单独的adt而言得到提高。在本发明的一些实施方案中,第二次无进展生存期相对于施用单独的adt而言得到提高。
77.在一些实施方案中,该人类男性已进行前列腺切除术。
附图说明
78.本专利或专利申请文件包含至少一张绘制成彩色的附图。在提出请求并且支付必要的费用后,美国专利和商标局将会提供本专利或专利申请公开的带彩图副本。
79.根据以下对示例性实施方案的更具体的描述,上述内容将显而易见,如附图所示,其中相同的参考字符在不同视图中指代相同的部件。附图未必按比例绘制,而是将重点放在示出实施方案。
80.图1a至图1b比较了前列腺癌的管腔样亚型和基底样亚型。图1a(修改自smith等人,pnas 112(47):e6544
‑
52(2013),图4a)显示,与局部疾病相比,前列腺癌的基底样亚型在转移中富集。图1b(改编自zhang等人,nat commun.7:10718(2016),图1g)比较了前列腺中的管腔样亚型和基底样亚型之间的功能差异。
81.图2(改编自zhao等人,jama oncol.,3(12):1663
‑
72(2017))示出了zhao et al.,jama oncol.,3(12):1663
‑
72(2017)(下文称为“zhao等人”或“pam50”)和zhang等人,nature communications 7:10798(2016)(在下文中称为“zhang等人”)报道的前列腺肿瘤的分子亚型的频率。这两篇参考文献均全文并入本文中。
82.图3显示,在spartan试验中,前列腺癌的基底样亚型在患者中富集。图3的上图基于zhao等人,jama oncol.,3(12):1663
‑
72(2017);并且图3的下图基于zhang等人,nat commun.7:10718(2016)和smith等人,pnas 112(47):e6544
‑
52(2013)。
83.图4显示,在spartan试验患者中,与管腔样肿瘤相比,基底样肿瘤的预后更差。
84.图5示出了spartan研究设计以及样本收集和分析。
85.图6示出了在spartan生物标志物群体中差异表达的基因的热图。
86.图7a和图7b示出了在具有管腔样亚型(图7a)和基底样亚型(图7b)的患者中的治疗组与无转移生存期(mfs)的关系。在spartan试验患者中,与单独的adt(pbo adt)相比,管腔样肿瘤和基底样肿瘤均显示出对阿帕鲁胺(apa)和雄激素剥夺疗法(adt)(apa adt)的改善的益处。
87.图8a和图8b示出了在spartan的单独的adt(pbo adt)(图8a)和apa adt(图8b)治
疗组中的基底样亚型和管腔样亚型与mfs的关系。在spartan试验患者中,与单独的adt(pbo adt)相比,管腔样肿瘤显示出对apa adt的最大mfs益处。
88.图9a至图9b示出了管腔样肿瘤和基底样肿瘤的结果。图9a和图9b示出了在具有管腔样亚型(图9a)和基底样亚型(图9b)的患者中的治疗组与第二次无进展生存期(pfs2)的关系。在spartan试验患者中,与单独的adt相比,管腔样肿瘤和基底样肿瘤均显示出对阿帕鲁胺(apa)和雄激素剥夺疗法(adt)(apa adt)的改善的益处。图9c和图9d示出了在spartan的adt(图9c)和apa adt(图9d)治疗组中的管腔样亚型和基底样亚型与pfs2的关系。
89.图10示出了与基底样分子亚型相关联的生物途径。
90.图11显示,gc与转移相关联。上图基于karnes等人,j urol.190(6):2047
‑
53(2013),图3。
91.图12a和图12b示出了在spartan的单独的adt(pbo adt)(图12a)和apa adt(图12b)治疗组中的gc评分与mfs的关系。图12a显示,当在spartan队列中用adt治疗时,gc高风险患者与不良预后相关联。图12b显示,当在sparan队列中用apa adt治疗时,gc高风险和低至平均风险患者具有类似的无转移生存期(mfs)。
92.图13a和图13b示出了在具有高(图13a)和低至平均(图13b)gc评分的患者中的治疗组与mfs的关系。在spartan队列中,在用apa adt治疗时相比于用adt治疗时,gc高风险患者显示出最大的mfs益处。
93.图14a至图14k示出了实施例2的方法。图14a示出了整个方法步骤。图14b示出了分层聚类热图。每一行代表一个标记,每一列代表一个患者样本。图14c和14d分别是原始数据和分级数据的箱线图。图14e示出了160个标记的分位数归一化数据。值的范围为1至233。图14f示出了基于经验累积分布下面积的相对变化对聚类数量(k=4)进行的选择。图14g至图14j示出了矩阵之间的成对皮尔逊相关性。对角线指示x轴标签和y轴标签(例如,在图14i中,标记2与标记3的相关性为75%)。右上:相关系数。左下:两个标记之间的相关性的散点图。图14k示出了233个spartan样本的标记表达图谱。将肿瘤样本分成三个亚型(1:高基底/ne样,51.7%;2:高风险和类固醇同源性,33.9%;和3:高免疫,15.2%)。将160个标记分成四个类(第一类:24.38%;第二类:31.87%,第三类:25%,和第四类:18.75%)。
94.图15a至图15e示出了genomic_gleason_grade_2(代表性的第一类标记)的结果。图15a和图15b示出了在spartan的adt(图15a)和apa adt(图15b)治疗组中的genomic_gleason_grade_2的表达与无转移生存期(mfs)的关系。图15c和图15d示出了在具有genomic_gleason_grade_2的高表达(图15c)和低表达(图15d)的患者中的治疗组与mfs的关系。图15e示出了genomic_gleason_grade_2的表达与治疗组的相对风险的关联。
95.图16a至图16e示出了hallmark_cholesterol_homeostasis(代表性的第二类标记)的结果。图16a和图16b示出了在spartan的adt(图16a)和apa adt(图16b)治疗组中的hallmark_cholesterol_homeostasis的表达与mfs的关系。图16c和16d示出了在具有hallmark_cholesterol_homeostasis的高表达(图16c)和低表达(图16d)的患者中治疗组与mfs的关系。图16e示出了hallmark_cholesterol_homeostasis的表达与治疗组的相对风险的关联。
96.图17a至图17e示出了beltran2016_1(代表性的第三类标记)的结果。图17a和图17b示出了在spartan的adt(图17a)和apa adt(图17b)治疗组中的beltran2016_1的表达与mfs的关系。图17c和图17d示出了在具有beltran2016_1的高表达(图17c)和低表达(图17d)的患者中的治疗组与mfs的关系。图17e示出了beltran2016_1的表达与治疗组的相对风险的关联。
97.图18a至图18e示出了hallmark_il2_jak_stat5_signaling(代表性的第四类标记)的结果。图18a和图18b示出了在spartan的adt(图18a)和apa adt(图18b)治疗组中的hallmark_il2_jak_stat5_signaling的表达与mfs的关系。图18c和18d示出了在具有hallmark_il2_jak_stat5_signaling的高表达(图18c)和低表达(图18d)的患者中的治疗组与mfs的关系。图18e示出了hallmark_il2_jak_stat5_signaling的表达与治疗组的相对风险的关联。
具体实施方式
98.对示例性实施方案的描述如下:
99.贯穿本说明书和随后的权利要求书,除非上下文另有要求,否则词语“包括”以及诸如“包含”和“含有”的变型形式将被理解为暗示包括,例如所陈述的整数或步骤或者整数或步骤的组,但不排除任何其他的整数或步骤或者整数或步骤的组。当在本文中使用时,术语“包含”可以被术语“含有”或“包括”取代。
100.如本文所用,“由
……
组成”排除权利要求要素中未指定的任何要素、步骤或成分。当在本文使用时,“基本上由
……
组成”不排除没有实质上影响权利要求的基本和新颖特征的材料或步骤。每当在本文中用于本发明的一个方面或实施方案的情况时,术语“包含”、“含有”、“包括”和“具有”中的任一者均可以,在一些实施方案中,用术语“由
……
组成”或“基本上由
……
组成”替代以改变本公开的范围。
101.如本文所用,多个列举的要素之间的连接术语“和/或”被理解为包含单个选项和组合选项两者。例如,在两个要素由“和/或”连接的情况下,第一种选项是指在没有第二个要素的情况下适用第一个要素。第二种选项是指在没有第一个要素的情况下适用第二个要素。第三种选项是指适合一起使用第一要素和第二要素。这些选项中的任一种选项均被理解为落在含义内,并且因此满足如本文所用的术语“和/或”的要求。多于一种选项的并行适用性也被理解为落在含义内,并且因此满足术语“和/或”的要求。
102.应当了解,本文所用的术语只是为了描述具体实施方案的目的,并非旨在进行限制。如本文所用,除非上下文另有明确说明,否则冠词“一个”、“一种”和“该/所述”应被理解为包括复数指代。
103.当提供一个列表时,除非另行指出,否则应当理解,该列表中的每个单独元素和该列表的每种组合都是单独的实施方案。例如,作为“a、b或c”呈现的实施方案的列表将被理解为包括实施方案“a”、“b”、“c”、“a或b”、“a或c”、“b或c”或者“a、b或c”。
104.术语“人类男性”和“患者”在本文中可以互换使用。“人类男性”包括前列腺癌正在接受治疗的男性人类。
105.如本文所用,术语“癌症”是指倾向于以不受控制的方式增殖的细胞异常生长,并且在一些情况下是指转移(扩散)。
106.如本文所用,术语“前列腺癌”是指经组织学或细胞学确认的前列腺腺癌。
107.术语“局部晚期前列腺癌”是指所有活性癌细胞看起来仅限于前列腺和相关联器官或相邻器官(例如精囊、膀胱颈和直肠壁)的前列腺癌。
108.术语“高风险局部化前列腺癌”是指具有发展转移或在具有治疗企图的初始治疗后的复发疾病的可能性的局部晚期前列腺癌。
109.术语“去势敏感性前列腺癌”是作为局限性疾病或生物化学复发对雄激素剥夺疗法(adt)具有反应性的癌症。
110.术语“非转移性去势敏感性前列腺癌”、“nmcrpc”或“nm
‑
crpc”在本文中互换使用,是指未在男性中扩散(转移)并且对雄激素剥夺疗法(adt)具有反应性的前列腺癌。在一些实施方案中,利用骨扫描和计算机断层扫描(ct)或磁共振成像(mri)扫描对非转移性去势敏感性前列腺癌进行评估。
111.nmcrpc患者的前列腺特异性抗原和去势睾酮水平可能升高,同时在计算机断层扫描和骨扫描上无转移性疾病的放射学发现。
112.如本文所用,术语“crpc”是指去势抵抗性前列腺癌。crpc是尽管为前列腺癌细胞的生长提供能量的雄激素受到抑制,然而仍继续生长的前列腺癌。
113.术语“未经化学疗法的转移性去势抵抗性前列腺癌”是指先前未用化学治疗剂治疗的转移性去势抵抗性前列腺癌。
114.术语“管腔样”和“管腔”在本文中互换使用。
115.术语“基底样”和“基底”在本文中互换使用。
116.术语“高风险nmcrpc”是指患有nmcrpc的男性发生转移的概率高。
117.如本文所用,术语“第一类共调控标记”、“第一类标记”、“与预后相关的标记”、“预后相关的标记”、“风险标记”和“高风险标记”是可互换的,并且包括表4中提供的标记。人们发现这些标记预测转移风险较高。
118.如本文所用,术语“第二类共调控标记”、“第二类标记”、“与类固醇稳态相关的标记”、“类固醇稳态相关的标记”和“类固醇稳态标记”是可互换的,并且包括表5中提供的标记。人们发现这些标记与类固醇稳态相关。
119.如本文所用,术语“第三类共调控标记”、“第三类标记”、“神经内分泌标记”、“ne标记”、“神经内分泌
‑
基底标记”、“具有ne样特征的腺苷酸”和“激素疗法无反应的基底和神经内分泌样标记”是可互换的,并且包括表6中提供的标记。人们发现这些标记与对雄激素受体(ar)指导疗法具有抗性的前列腺癌相关联(beltran等人,divergent clonal evolution of castration
‑
resistant neuroendocrine prostate cancer,nat med.2016;22(3)298
‑
305)。
120.如本文所用,术语“第四类共调控标记”、“第四类标记”、“hallmark基因集”、“基质/免疫标记”、“免疫/基质标记”和“免疫和基质il2/il
‑6‑
jak
‑
stat5样标记”是可互换的,并且包括表7中提供的标记。
121.术语“无转移生存期”或“mfs”是指在研究中已在无癌症扩散的情况下生存规定的一段时间或未死亡的人类男性的百分比。mfs通常被报告为在研究中从开始登记、随机化或治疗起的时间。mfs是针对个体或研究群体报告。在用雄激素受体抑制剂治疗crpc的情况下,无转移生存期的增加是与用安慰剂治疗相比,在无癌症扩散或死亡(以先发生者为准)
的情况下观察到的额外时间。具体地讲,无转移生存期是从随机化到影像学上首次检测到远处转移或死亡的时间。
122.术语“转移时间”是从随机化到示出bicr确认的放射摄影术可检测的骨或软组织远处转移的首次证据的扫描时间的时间。
123.短语“第二次无进展生存期”、“第一次后续疗法的无进展生存期”或“pfs2”在本文中互换使用,被定义为从随机化到第一次后续抗癌治疗期间研究者评估的疾病进展(psa、放射摄影、症状或任何组合)或第二次后续抗癌治疗开始前的死亡(任何原因)(以先发生者为准)的时间。后续疗法之后未记录进展的人类男性的进展数据在已知无进展的最后日期或死亡日期进行删失。在一些实施方案中,施用安全且有效量的雄激素受体抑制剂提供改善的抗肿瘤活性,如通过第一次后续疗法的无进展生存期所测量。
124.术语“第一后续疗法的无进展生存期(pfs2)”被定义为从随机化到第一次后续疗法期间研究者评估的疾病进展到研究人员评估的疾病进展(psa、放射摄影、症状或任何组合)或第二次后续抗癌治疗开始前的死亡(任何原因)(以先发生者为准)的时间。
125.后续疗法之后未记录进展的人类男性的进展数据在已知无进展的最后日期或死亡日期进行删失。在一些实施方案中,施用安全且有效量的雄激素受体抑制剂提供改善的抗肿瘤活性,如通过第一次后续疗法的无进展生存期所测量。
126.根据前列腺癌工作组(pcwg2)标准,在mfs的初步分析时评估前列腺特异性抗原反应和psa进展时间。(h.i.scher,m.j.morris,e.basch,g.heller,2011,j clin oncol.)psa进展时间被计算为从随机化到满足根据pcwg2的psa进展标准时的时间。
127.术语“无进展生存期”基于recist v1.1并且在lh schwartz,2016,euro j of cancer 2016中有所定义,该文献以引用方式并入本文。
128.对于具有至少一个可测量病灶的人类男性,疾病进展被定义为靶病灶的直径总和增加至少20%,以研究的最小总和作为参考(如果基线总和为研究的最小值,则包括基线总和)。除了20%的相对增加之外,总和还必须显示至少5mm的绝对增加。此外,一个或多个新病灶的出现也被视为进展。对于在ct或mri扫描中仅观察到不可测量的疾病的人类男性,明确的进展(代表总体疾病状态变化)或一个或多个新病灶的出现被视为进展。对于通过骨扫描检测到的新骨病灶,需要第二种成像模式(例如ct或mri)来确认进展。在一些实施方案中,施用安全且有效量的雄激素受体抑制剂提供改善的抗肿瘤活性,如通过无进展生存期所测量。
129.术语“症状进展时间”被定义为以下任一种情况从随机化到记录在crf中的时间(以较早发生者为准):(1)骨骼相关事件(sre)的发展:病理骨折,脊髓压迫,或需要骨进行外科手术干预或放射治疗;(2)需要启动新的全身性抗癌疗法的疾病相关症状的疼痛进展或恶化;或(3)因需要外科手术干预或放射疗法的局部肿瘤进展导致的临床显著症状的发展。在一些实施方案中,施用安全且有效量的雄激素受体抑制剂提供改善的抗肿瘤活性,如通过症状进展时间所测量。
130.术语“总体生存期”被定义为从随机化到因任何原因导致的死亡日期的时间。在分析时生存的人类男性的生存数据在其生存的最后已知日期进行删失。此外,对于没有基线后信息生存的人类男性,数据在随机化日期进行删失;对于失去随访或撤销同意的人类男性,数据在其生存的最后已知日期进行删失。在一些实施方案中,施用安全且有效量的抗雄
激素提供改善的抗肿瘤活性,如通过总体生存期所测量。
131.术语“细胞毒性化学疗法开始时间”被定义为从随机化到记录施用于人类男性的新细胞毒性化学疗法(例如,生存期随访crf)的时间。未开始细胞毒性化学疗法的人类男性的细胞毒性化学疗法开始时间在最后一次联系日期进行删失。在一些实施方案中,施用安全且有效量的雄激素受体抑制剂提供改善的抗肿瘤活性,如通过细胞毒性化学疗法时间所测量。
132.如本文所用,术语“生存期益处”是指从施用药物试验的随机化时间到死亡,患者生存期的增加。在一些实施方案中,生存益处为约1、约2、约3、约4、约5、约6、约7、约8、约9、约10、约15、约20、约25、约30、约35、约40、约45、约50、约55、约60、约80、约100个月或大于100个月。
133.如本文所用,术语“与疾病进展相关症状的延迟”是指从施用药物试验的随机化时间开始,症状诸如疼痛、尿路梗阻和生活品质考虑因素的发展时间的增加。
134.术语“随机化”当涉及临床试验时是指当患者被确认适合进行临床试验并且被分配给治疗组的时间。
135.雄激素受体抑制剂
136.如本文所用,术语“雄激素受体抑制剂”是指能够预防或抑制雄激素对体内正常反应性组织的生物学效应的活性药物成分。
137.如本文所用,术语“ar拮抗剂”或“ar抑制剂”在本文中可互换使用,是指抑制或降低ar多肽的至少一种活性的药剂。示例性ar活性包括但不限于共激活因子结合、dna结合、配体结合或核转位。
138.如本文所用,“完全拮抗剂”是指在有效浓度下基本上完全抑制ar多肽的活性的拮抗剂。“基本上完全”是指对ar多肽活性的至少约80%、至少约90%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或更高抑制。
139.如本文所用,“部分拮抗剂”是指能够部分抑制ar多肽的活性,但甚至在最高浓度下也不是完全拮抗剂的拮抗剂。
140.示例性雄激素受体抑制剂包括但不限于氟他胺、尼鲁米特、比卡鲁胺、4
‑
[7
‑
(6
‑
氰基
‑5‑
三氟甲基吡啶
‑3‑
基)
‑8‑
氧代
‑6‑
硫代
‑
5,7
‑
二氮杂螺[3.4]辛
‑5‑
基]
‑2‑
氟代
‑
n
‑
甲基苯甲酰胺(也称为阿帕鲁胺或arn
‑
509)、4
‑
(3
‑
(4
‑
氰基
‑3‑
(三氟甲基)苯基)
‑
5,5
‑
二甲基
‑4‑
氧代
‑2‑
硫代咪唑啉
‑1‑
基)
‑2‑
氟代
‑
n
‑
甲基苯甲酰胺(也称为mdv3100或恩杂鲁胺)和达罗鲁胺。
[0141][0142]4‑
[7
‑
(6
‑
氰基
‑5‑
三氟甲基吡啶
‑3‑
基)
‑8‑
氧代
‑6‑
硫代
‑
5,7
‑
二氮杂螺[3.4]辛
‑5‑
基]
‑2‑
氟
‑
n
‑
甲基苯甲酰胺(阿帕鲁胺)。
[0143][0144]4‑
(3
‑
(4
‑
氰基
‑3‑
(三氟甲基)苯基)
‑
5,5
‑
二甲基
‑4‑
氧代
‑2‑
硫代咪唑啉
‑1‑
基)
‑2‑
氟
‑
n
‑
甲基苯甲酰胺(恩杂鲁胺)。
[0145]
在一些实施方案中,雄激素受体抑制剂在ar多肽的配体结合位点处或附近与ar多肽结合。
[0146]
在一些实施方案中,本文所述的方法中设想的雄激素受体抑制剂抑制ar核转位(诸如达罗鲁胺)、dna与雄激素反应元件结合以及共激活因子募集。在一些实施方案中,本文所述的方法中设想的雄激素受体抑制剂在ar过表达的前列腺癌细胞中不表现出激动剂活性。
[0147]
阿帕鲁胺是直接与ar的配体结合域结合的第二代雄激素受体抑制剂,它削弱核转位、ar与dna的结合以及ar靶基因调控,从而抑制肿瘤生长并促进细胞凋亡。阿帕鲁胺以高于比卡鲁胺的亲和力结合ar,并在非去势激素敏感性和比卡鲁胺抵抗性人前列腺癌异种移植模型中诱导部分或完全的肿瘤消退(clegg等人,《临床癌症研究》march 15,2012 72;1494年)。阿帕鲁胺缺乏在ar过表达的情况下比卡鲁胺所表现的部分激动剂活性。阿帕鲁胺是的活性成分。关于阿帕鲁米特的附加信息可参见例如(阿帕鲁胺)片剂的处方信息产品说明书,http://www_janssenlabels.com/package
‑
insert/product
‑
monograph/prescribing
‑
information/erleada
‑
pi_pdf,其以引用方式并入本文。
[0148]
达罗鲁胺、bay1841788或odm
‑
201是包括orm
‑
16497和orm
‑
16555两种非对映体的ar拮抗剂。
[0149]
它对赋予其他第二代抗雄激素抗性的已知ar突变体具有活性。
[0150]
达罗鲁胺以高亲和力结合ar,并且削弱后续的ar雄激素诱导的核转位和ar基因靶标的转录。
[0151]
matsubara,n.,mukai,h.,hosono,a.等人,cancer chemother pharmacol 80:1063(2017)。
[0152]
根据前列腺癌是否已转移到身体的其他部位,将去势抵抗性前列腺癌(crpc)归类为非转移性或转移性的。
[0153]
术语“雄激素剥夺疗法(adt)”是指将前列腺癌患者中的雄激素水平降低至睾酮的去势水平(<50ng/dl)。这种治疗可包括睾丸切除术或使用促性腺激素释放激素激动剂或拮抗剂。adt包括手术去势(睾丸切除术)和/或向人施用黄体化激素释放激素(“lhrh”)激动剂。lhrh激动剂的示例包括醋酸戈舍瑞林、醋酸组胺瑞林、醋酸亮丙瑞林和棕榈酸曲普瑞林。
[0154]
如本文所用,术语“共同施用”等涵盖向单个患者施用所选择的治疗剂,并且旨在包括将这些药剂通过相同或不同的施用途径和/或在相同或不同的时间施用的治疗方案。
[0155]
如本文所用,术语“药物组合”是指产生自多于一种活性成分的混合或组合并且包
括活性成分的固定和非固定组合两者的产物。
[0156]
术语“fdht
‑
pet”是指18f
‑
16p
‑
氟
‑
5a
‑
二氢睾酮正电子发射断层显像,是使用基于二氢睾酮的示踪剂的技术,并且允许对患者中配体与雄激素受体的结合进行视觉评估。
[0157]
可使用该技术评估雄激素受体导向疗法的药效学。
[0158]
术语“连续每天给药日程表”是指对于特定治疗剂没有任何药物假期的情况下施用该特定治疗剂。在一些实施方案中,特定治疗剂的连续每天给药日程表包括在每一天大致相同的时间每天施用特定治疗剂。
[0159]
术语“治疗”(treat和treatment)是指对患有病理性病症的人类的癌症的治疗,并且是指通过杀死癌细胞缓解该病症的效果,以及导致病症进展被抑制的效果,并且包括进展速率的减缓、进展速率的终止、病症的改善和病症的治愈。作为预防性措施的治疗(即预防)也包括在内。
[0160]
术语“药物产品”或“经批准的药物产品”是含有活性药物成分的产品,该活性药物成分已被政府机构(例如,食品和药物产品管理局或其他国家及地区的类似机构)批准上市用于至少一种适应症。
[0161]
本发明的一个方面涉及用含有雄激素受体抑制剂(例如,阿帕鲁胺(apa))的经批准的药物产品和含有雄激素剥夺疗法(adt)的经批准的药物产品(例如apa adt),以单独或相同的剂型,提供对人类男性前列腺癌(例如,nmcrpc)的改善的治疗益处的方法,该方法包括以下步骤、由以下步骤组成和/或基本上由以下步骤组成:
[0162]
如果确定从该人类男性中获得的生物样本具有以下特征,则向该人类男性施用治疗有效量的该雄激素受体抑制剂和治疗有效量的该adt:
[0163]
a)前列腺癌的管腔样或基底样分子亚型;
[0164]
b)大于约0.6的基因组分类器评分;
[0165]
c)第一类共调控标记中的至少一种标记的表达增加;
[0166]
d)第二类共调控标记中的至少一种标记的表达增加;
[0167]
e)第三类共调控标记中的至少一种标记的表达降低;
[0168]
f)第四类共调控标记中的至少一种标记的表达增加;或它们的组合。
[0169]
本发明的另一方面涉及治疗人类男性前列腺癌(例如,nmcrpc)的方法,该方法包括以下步骤、由以下步骤组成和/或基本上由以下步骤组成:
[0170]
如果确定从该人类男性中获得的生物样本具有以下特征,则向该人类男性施用治疗有效量的雄激素受体抑制剂(例如,apa)和治疗有效量的含有雄激素剥夺疗法(adt)(例如,apa adt)的经批准的药物产品:
[0171]
a)前列腺癌的管腔样或基底样分子亚型;
[0172]
b)大于约0.6的基因组分类器评分;
[0173]
c)第一类共调控标记中的至少一种标记的表达增加;
[0174]
d)第二类共调控标记中的至少一种标记的表达增加;
[0175]
e)第三类共调控标记中的至少一种标记的表达降低;
[0176]
f)第四类共调控标记中的至少一种标记的表达增加;或它们的组合。
[0177]
在另一方面,本发明提供了预测患有非转移性去势抵抗性前列腺癌(nmcrpc)的人类男性通过施用治疗有效量的雄激素受体抑制剂(例如,apa)和治疗有效量的含有雄激素
剥夺疗法(adt)(例如,apa adt)的经批准的药物产品,获得相对于单独施用治疗有效量的该adt而言改善的益处的方法,所述方法包括以下步骤、由以下步骤组成和/或基本上由以下步骤组成:
[0178]
a)确定从该人类男性中获得的生物样本是否具有以下特征:
[0179]
i)前列腺癌的管腔样或基底样分子亚型;
[0180]
ii)大于约0.6的基因组分类器评分;
[0181]
iii)第一类、第二类和/或第四类共调控标记中的至少一种标记的表达水平增加;
[0182]
iv)第三类共调控标记中的至少一种标记的表达水平降低;或它们的组合,以及
[0183]
b)基于以下特征,预测该人类男性通过施用该治疗有效量的该雄激素受体抑制剂(例如,apa)和该治疗有效量的该adt,获得相对于单独施用该治疗有效量的该adt而言改善的益处:
[0184]
i)前列腺癌的管腔样或基底样分子亚型;
[0185]
ii)大于约0.6的基因组分类器评分;
[0186]
iii)第一类、第二类和/或第四类共调控标记中的至少一种标记的表达水平增加;
[0187]
iv)第三类共调控标记中的至少一种标记的表达水平降低;或它们的组合。
[0188]
本发明的另一方面涉及使用联合施用治疗有效量的雄激素受体抑制剂(例如,apa)和治疗有效量的含有雄激素剥夺疗法(adt)(例如,apa adt)的经批准的药物产品,相对于单独施用治疗有效量的该adt而言,改善对治疗人类男性非转移性去势抵抗性前列腺癌(nmcrpc)的反应的方法,该方法包括以下步骤、由以下步骤组成和/或基本上由以下步骤组成:
[0189]
a)确定从该人类男性中获得的生物样本是否具有以下特征:
[0190]
i)前列腺癌的管腔样或基底样分子亚型;
[0191]
ii)大于约0.6的基因组分类器评分;
[0192]
iii)第一类、第二类和/或第四类共调控标记中的至少一种标记的表达水平增加;
[0193]
iv)第三类共调控标记中的至少一种标记的表达水平降低;或它们的组合,以及
[0194]
b)基于以下特征,相对于单独施用该治疗有效量的该adt而言,改善对联合施用该治疗有效量的该雄激素受体抑制剂(例如,apa)和该治疗有效量的该adt的反应:
[0195]
i)前列腺癌的管腔样或基底样分子亚型;
[0196]
ii)大于约0.6的基因组分类器评分;
[0197]
iii)第一类、第二类和/或第四类共调控标记中的至少一种标记的表达水平增加;
[0198]
iv)第三类共调控标记中的至少一种标记的表达水平降低;或它们的组合。
[0199]
本发明的另一方面涉及鉴定被诊断为患有nmcrpc的人类男性(或人类男性的子集)的方法,其中该nmcrpc被预测为通过治疗有效量的雄激素受体抑制剂(例如,apa)和治疗有效量的雄激素剥夺疗法(adt)(例如,apa adt),获得相对于单独施用治疗有效量的该adt而言改善的治疗益处,该方法包括以下步骤、由以下步骤组成和/或基本上由以下步骤组成:
[0200]
a)确定从该人类男性中获得的生物样本是否具有以下特征:
[0201]
i)前列腺癌的管腔样或基底样分子亚型;
[0202]
ii)大于约0.6的基因组分类器评分;
[0203]
iii)第一类、第二类和/或第四类共调控标记中的至少一种标记的表达水平增加;
[0204]
iv)第三类共调控标记中的至少一种标记的表达水平降低;或它们的组合,以及
[0205]
b)基于以下特征,预测该人类男性通过施用该治疗有效量的该雄激素受体抑制剂(例如,apa)和该治疗有效量的该adt,获得相对于单独施用该治疗有效量的该adt而言改善的益处:
[0206]
i)前列腺癌的管腔样或基底样分子亚型;
[0207]
ii)大于约0.6的基因组分类器评分;
[0208]
iii)第一类、第二类和/或第四类共调控标记中的至少一种标记的表达水平增加;
[0209]
iv)第三类共调控标记中的至少一种标记的表达水平降低,或它们的组合。
[0210]
本发明的另一方面涉及预测人类男性nmcrpc对联合施用治疗有效量的雄激素受体抑制剂(例如,apa)和治疗有效量的雄激素剥夺疗法(adt)(例如,apa adt),相对于单独施用治疗有效量的该adt而言的治疗反应的改善的方法,该方法包括以下步骤、由以下步骤组成和/或基本上由以下步骤组成:
[0211]
a)确定从该人类男性中获得的生物样本是否具有以下特征:
[0212]
i)前列腺癌的管腔样或基底样分子亚型;
[0213]
ii)大于约0.6的基因组分类器评分;
[0214]
iii)第一类、第二类和/或第四类共调控标记中的至少一种标记的表达水平增加;
[0215]
iv)第三类共调控标记中的至少一种标记的表达水平降低;或它们的组合,以及
[0216]
b)基于以下特征,预测对联合施用该治疗有效量的该雄激素受体抑制剂(例如,apa)和该治疗有效量的该adt,相对于单独施用该治疗有效量的该adt而言反应的改善:
[0217]
i)前列腺癌的管腔样或基底样分子亚型;
[0218]
ii)大于约0.6的基因组分类器评分;
[0219]
iii)第一类、第二类和/或第四类共调控标记中的至少一种标记的表达水平增加;
[0220]
iv)第三类共调控标记中的至少一种标记的表达水平降低;或它们的组合。
[0221]
本发明的另一方面涉及评估患有癌症(例如,nmcrpc)并接受apa adt的人类男性的临床结果的方法,该方法包括以下步骤、由以下步骤组成和/或基本上由以下步骤组成:
[0222]
a)获得从该人类男性中获得的生物样本的基因表达数据;
[0223]
b)如果该生物样本具有以下特征,则评估该人类男性通过apa adt获得与单独的adt相比改善的益处:
[0224]
i)前列腺癌的基底样或管腔样分子亚型;
[0225]
ii)大于约0.6的基因组分类器评分;
[0226]
iii)第一类、第二类和/或第四类共调控标记中的至少一种标记的表达增加;
[0227]
iv)第三类共调控标记中的至少一种标记的表达降低;或它们的任何组合。
[0228]
本发明的另一方面涉及预测用adt apa治疗人类男性癌症(例如,nmcrpc)的临床结果的方法,该方法包括以下步骤、由以下步骤组成和/或基本上由以下步骤组成:
[0229]
a)获得在该人类男性中获得的生物样本中的表达数据;
[0230]
b)将该表达数据分配给共调控标记,这些共调控标记选自:预后相关的标记、类固醇稳态相关的标记、激素疗法无反应的基底和神经内分泌样标记和免疫和基质il2/il
‑6‑
jak
‑
stat5样标记,以及它们的组合;
[0231]
c)确定该生物样本的adt apa评分;以及
[0232]
d)基于至少一个类别的表达水平预测该治疗的该临床结果。
[0233]
在一些实施方案中,该前列腺癌是非转移性去势抵抗性前列腺癌(nmcrpc)。在一些实施方案中,该人类男性患有未经化学疗法的转移性去势难治性前列腺癌。
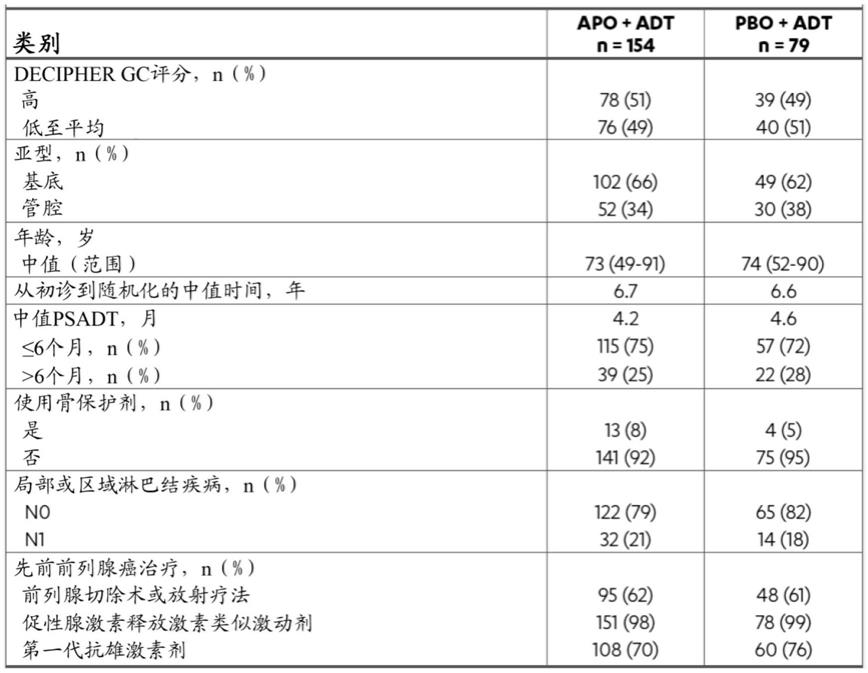
[0234]
在一些实施方案中,该nmcrpc为高风险nmcrpc。在一些实施方案中,该高风险nmcrpc具有少于约20个月,例如少于约19个月、少于约18个月、少于约17个月、少于约16个月、少于约15个月、少于约14个月、少于约13个月、少于约12个月、少于约11个月、少于约9个月、少于约8个月、少于约7个月、少于约6个月、少于约5个月、少于约4个月、少于约3个月、少于约2个月或少于约1个月的前列腺特异性抗原倍增时间(psadt)。在一些实施方案中,该高风险nmcrpc具有小于约10个月的psadt。
[0235]
在一些实施方案中,该高风险nmcrpc具有介于约1和约20个月之间,例如约1
‑
19个月、约2
‑
19个月、约2
‑
18个月、约3
‑
18个月、约3
‑
17个月、约4
‑
17个月、约4
‑
16个月、约5
‑
16个月、约5
‑
15个月、约6
‑
15个月、约6
‑
14个月、约7
‑
14个月、约7
‑
13个月、约8
‑
13个月、约8
‑
12个月、约9
‑
12个月或约9
‑
11个月的psadt。
[0236]
在一些实施方案中,该高风险nmcrpc具有局部区域复发(例如,原发性肿瘤床、膀胱颈、吻合区、盆腔淋巴结)。在一些实施方案中,该高风险nmcrpc具有高格里森评分。在一些实施方案中,该高风险nmcrpc具有大体积肿瘤。
[0237]
在一些实施方案中,该方法还包括从人类男性中获得生物样本。
[0238]
在一些实施方案中,该人类男性已进行前列腺切除术。
[0239]
在一些实施例方案中,该生物样本是原发性前列腺肿瘤样本。
[0240]
在一些实施方案中,该生物样本是前列腺活检样本。
[0241]
活检是从人类男性的活体(例如,从人类男性的前列腺)移除组织(例如,可疑组织)或细胞样本的过程。可以不同方式收集前列腺活检样本。前列腺活检可涉及使针穿过直肠壁(经直肠活检)。这是进行前列腺活检的最常见方式。收集前列腺活检样本的另一种方法可包括将针插入使其穿过肛门和阴囊之间的皮肤区域(经阴部活检)。在肛门和阴囊之间的皮肤区域(会阴)开一个小切口。将活检针穿过切口插入前列腺中以提取组织样本。mri或ct扫描通常用于指导该过程。医师可针对可疑区域进行活检,或者可从前列腺中的若干位置采集样本。一般来讲,采集10至12个组织样本。因此,在本发明的实施方案中,该前列腺活检样本可包括正常前列腺组织、正常前列腺组织和癌组织,或仅癌组织。
[0242]
在一些实施方案中,该生物样本是手术肿瘤样本。该手术肿瘤样本可包括在前列腺切除术期间收集的前列腺样本。该手术肿瘤样本可包括远离前列腺的肿瘤或转移性病灶。该手术肿瘤样本可包括整个前列腺或前列腺的一部分。在一些实施方案中,该手术肿瘤样本包括肿瘤。
[0243]
在一些实施方案中,确定从人类男性中获得的生物样本具有前列腺癌的分子亚型,该前列腺癌的分子亚型选自管腔样分子亚型或基底样分子亚型。在一些实施方案中,该生物样本具有前列腺癌的管腔样分子亚型。在一些实施方案中,该生物样本具有前列腺癌的基底样分子亚型。
[0244]
在一些实施方案中,使用技术诸如northern印迹分析、southern印迹分析、western印迹分析、微阵列等,基于mrna表达、与每个亚型相关联的一个或多个遗传标志物
或它们的组合来确定该生物样本是否包含基底样或管腔样亚型的细胞。
[0245]
在一些实施方案中,基于细胞的组织学特征,例如使用苏木精和伊红染色(h&e)、免疫组织化学或它们的组合的显微分析来确定该生物样本是否包含基底样或管腔样亚型的细胞。可使用标准光学显微镜和/或软件分析。在一些实施方案中,使用手术肿瘤样本或前列腺活检样本的粗略分析。
[0246]
在一些实施方案中,确定基因组分类器(gc)评分。gc评分代表0
‑
1的连续评分。评分>0.6的患者进展为转移的风险似乎较高(klein ea等人,european urology 67(4):778
‑
86(2015))。
[0247]
在一些实施方案中,基于大于约0.6的gc评分来确定该人类男性(患有nmcrpc)具有高转移风险。在一些实施方案中,基于大于0.6的gc评分来确定该人类男性(患有nmcrpc)具有高转移风险。在一些实施方案中,具有高于约0.6的gc评分和用单独的adt治疗的不良预后的生物样本预测该人类男性受益于adt apa。在一些实施方案中,具有小于约0.6的gc评分的生物样本预测该人类男性受益于adt和adt apa。
[0248]
在一个实施方案中,基因组分类器是22标志物基因组分类器(例如,),该22标志物基因组分类器包含对应于与以下基因/基因座(最近的基因/基因座(标志物类型;细胞带))相关联的rna:lasp1(编码,17q12)、iqgap3(3'utr,1q23.1)、nfib(内含子,9p23)、s1pr4(3'utr,19p13.3)、thbs2(3'utr,6q27)、ano7(3'utr,2q37.3)、pcdh7(内含子,4p15.1)、mybpc1(编码,12q23.2)、eppk1(3'utr,8q24.3)、tsbp(内含子,6p21.32)、pbx1(编码,1q23.3)、nusap1(3'utr,15q15.1)、zwilch(3'utr,15q22.31)、ube2c(3'utr,20q13.12)、camkc2n1(编码反义,1p36.12)、rabgap1(外显子/内含子连接反义,9q33.2)、pcat
‑
32(非编码转录物,5p15.2)、gyatl1p4/pcat
‑
80(非编码转录物,11q12.1)和tnfrsf19(内含子,13q12.12)(erho n等人,plos one 8(6):e66855(2013),其以引用方式全文并入本文)。
[0249]
在一些实施方案中,基因组分类器包含选自以下项的至少一种标志物:lasp1、iqgap3、nfib、s1pr4、thbs2、ano7、pcdh7、mybpc1、eppk1、tsbp、pbx1、nusap1、zwilch、ube2c、camkc2n1、rabgap1、pcat
‑
32、gyatl1p4/pcat
‑
80、tnfrsf19以及它们的组合。
[0250]
在一些实施方案中,使用一种标志物来确定gc评分。在其他实施方案中,使用2种
‑
22种标志物来确定gc评分,例如使用3种
‑
22种、3种
‑
20种、4种
‑
20种、4种
‑
18种、5种
‑
18种、5种
‑
16种、6种
‑
16种、6种
‑
14种、7种
‑
14种、7种
‑
12种、8种
‑
12种或8种
‑
10种标志物来确定gc评分。在一些实施方案中,使用22种标志物来确定gc评分。
[0251]
在一些实施方案中,确定生物样本的第一类、第二类、第三类和/或第四类共调控标记中的至少一种标记的表达水平。在一些实施方案中,确定该生物样本具有以下特征:
[0252]
a)第一类共调控标记中的至少一种标记的表达增加;
[0253]
b)第二类共调控标记中的至少一种标记的表达增加;
[0254]
c)第三类共调控标记中的至少一种标记的表达降低;
[0255]
d)第四类共调控标记中的至少一种标记的表达增加;或它们的任何组合。
[0256]
在一些实施方案中,基因标记是decipher基因标记。在一些实施方案中,该第一类共调控标记中的该至少一种标记是表4中的标记。在一些实施方案中,该第二类共调控标记中的该至少一种标记是表5中的标记。在一些实施方案中,该第三类共调控标记中的该至少
一种标记是表6中的标记。在一些实施方案中,该第四类共调控标记中的该至少一种标记是表7中的标记。
[0257]
在一些实施方案中,使用判别分析(da)和逻辑回归对生物样本的表达谱进行评分,并基于该评分确定人类男性(患者)的临床结果。da是用于将病例分类成通常二分的分类因变量的值的统计工具。
[0258]
在一些实施方案中,使用关于转移阳性或阴性的患者的删失信息生成函数,其等同于更高或更低的风险。在一些实施方案中,记录相对于观察到的每个人类男性的标记评分的判别评分以将它们分类为阳性或阴性。
[0259]
在一些实施方案中,使用所计算的判别评分建立将人类男性分配给组的截止评分。例如,如果人类男性的判别评分高于或等于截止评分,则将该人类男性分配给组1(阳性),否则将该人类男性分配给组2(阴性)。
[0260]
da是逻辑回归的早期替代形式,逻辑回归现在常用来代替da,因为其通常涉及较少的违反假设的情况(自变量不必呈正态分布、线性相关或具有相等的组内方差),处理分类以及连续变量稳健,并且具有许多人发现更易于解释的系数(mclachlan和geoffrey j.,discriminant analysis and statistical pattern recognition.ny:wiley
‑
interscience.2004(wiley series in probability and statistics))。
[0261]
通过逻辑回归,标记评分可以确定患者的结果。与da类似,在逻辑回归中,结果用二分变量(转移阳性或阴性)测量,并且由于截止值可以根据待用于分类的预测概率调整,结果也可用作分类器。
[0262]
在一些实施方案中,如果表达水平高于或等于中值,则将生物样本分配给(例如,第一类、第二类、第三类或第四类标记的)高表达组。在一些实施方案中,如果表达水平低于中值,则将生物样本分配给(例如,第一类、第二类、第三类或第四类标记的)低表达组。
[0263]
在一些实施方案中,确定该生物样本的该第一类共调控标记中的至少一种标记的表达增加。
[0264]
在一些实施方案中,该第一类共调控标记中的该至少一种标记选自:agell2012_1、bibikova2007_1、bismar2006_1、bismar2017_1、cheville2008_1、cuzick2011_1、cuzick2011_lm_1、decipher_1、decipherv2_2、genomic_capras_1、genomic_gleason_grade_1、genomic_gleason_grade_2、glinsky2005_1、hallmark_mtorc1_signaling、hallmark_myc_targets_v1、hallmark_myc_targets_v2、klein2014_1、lapointe2004_1、larkin2012_1、long2014_1、nakagawa2008_1、non_organ_confined_1、normaltumor_1、pam50_luminalb、penney2011_1、penney2011_lm_1、ramaswamy2003_1、saal2007_1、saal2007_pten、sdms_1、singh2002_1、staging_epe_1、staging_lni_1、staging_svi_1、stephenson2005_1、talantov2010_1、varambally2005_1、wu2013_1、yu2007_1以及它们的组合。
[0265]
在一些实施方案中,如果患者在该第一类共调控标记中的至少一种标记上的表达评分高于或等于在nmcrpc患者群体中的所述标记上的中值表达评分,则该患者的该第一类共调控标记中的该至少一种标记的表达增加。
[0266]
在一些实施方案中,该第一类共调控标记中的该至少一种标记包括genomic_gleason_grade_2。在一些实施方案中,如果该表达评分(归一化标记评分)高于或等于
0.49,则该第一类共调控标记中的该至少一种标记的表达增加。
[0267]
在一些实施方案中,使用第一类共调控标记中的至少2种、3种、4种、5种、6种、7种、8种、9种、10种或更多种标记来确定生物样本的第一类共调控标记的表达是否增加。
[0268]
在一些实施方案中,确定该生物样本的该第二类共调控标记中的至少一种标记的表达增加。
[0269]
在一些实施方案中,该第二类共调控标记中的该至少一种标记选自:ar_related_pathway_arv7、ar_related_pathway_glucocorticoid_receptor、aros_1、docetaxel_sens_1、ergmodel_1、glinsky2004_1、hallmark_adipogenesis、hallmark_androgen_response、hallmark_angiogenesis_brauer2013、hallmark_angiogenesis_keggvegf、hallmark_angiogenesis_liberzon2015、hallmark_angiogenesis_masiero2013、hallmark_angiogenesis_nolan2013、hallmark_angiogenesis_uhlik2016、hallmark_apical_surface、hallmark_bile_acid_metabolism、hallmark_cholesterol_homeostasis、hallmark_dna_repair、hallmark_e2f_targets、hallmark_fatty_acid_metabolism、hallmark_g2m_checkpoint、hallmark_glycolysis、hallmark_hedgehog_signaling、hallmark_heme_metabolism、hallmark_mitotic_spindle、hallmark_notch_signaling、hallmark_oxidative_phosphorylation、hallmark_peroxisome、hallmark_pi3k_akt_mtor_signaling、hallmark_protein_secretion、hallmark_spermatogenesis、hallmark_unfolded_protein_response、hallmark_uv_response_dn、hallmark_xenobiotic_metabolism、immunophenoscore_1_cp、immunophenoscore_1_ctla.4、immunophenoscore_1_ido1、immunophenoscore_1_lag3、immunophenoscore_1_pd.1、immunophenoscore_1_pd.l2、immunophenoscore_1_tem.cd4、immunophenoscore_1_tigit、kegg_mismatch_repair、kegg_non_homologous_end_joining、kegg_nucleotide_excision_repair、long2011_1、nelson_2016_ar_1、pam50_luminala、pca_vs_mibc_1、race_1、ragnum2015_1以及它们的组合。
[0270]
在一些实施方案中,如果患者在该第二类共调控标记中的至少一种标记上的表达评分高于或等于在nmcrpc患者群体中的所述标记上的中值表达评分,则该患者的该第二类共调控标记中的该至少一种标记的表达增加。
[0271]
在一些实施方案中,该第二类共调控标记中的该至少一种标记包括hallmark_cholesterol_homeostasis。在一些实施方案中,如果该表达评分(归一化标记评分)高于或等于0.25,则该第二类共调控标记中的该至少一种标记的表达增加。
[0272]
hallmark_cholesterol_homeostasis包括:abca2、acat2、acss2、actg1、adh4、alcam、aldoc、antxr2、anxa13、anxa5、atf3、atf5、atxn2、avpr1a、cbs、cd9、chka、clu、cpeb2、ctnnb1、cxcl16、cyp51a1、dhcr7、ebp、ech1、errfi1、ethe1、fabp5、fads2、fam129a、fasn、fbxo6、fdft1、fdps、gldc、gnai1、gpx8、gstm2、gusb、hmgcr、hmgcs1、hsd17b7、idi1、jag1、ldlr、lgals3、lgmn、lpl、lss、mal2、mvd、mvk、nfil3、nsdhl、pcyt2、pdk3、plaur、plscr1、pmvk、pnrc1、pparg、s100a11、sc5dl、scd、sema3b、sqle、srebf2、stard4、stx5、tm7sf2、tmem97、tnfrsf12a、tp53inp1和trib3。
[0273]
在一些实施方案中,使用第二类共调控标记中的至少2种、3种、4种、5种、6种、7种、8种、9种、10种或更多种标记来确定生物样本的第二类共调控标记的表达是否增加。
[0274]
在一些实施方案中,确定该生物样本的第三类共调控标记中的至少一种标记的表达降低。
[0275]
在一些实施方案中,该第三类共调控标记中的该至少一种标记选自:ars_1、beltran2016_1、dasatinib_sens_1、estimate2013_2_purity、hallmark_apical_junction、hallmark_apoptosis、hallmark_coagulation、hallmark_epithelial_mesenchymal_transition、hallmark_estrogen_response_early、hallmark_estrogen_response_late、hallmark_hypoxia、hallmark_kras_signaling_dn、hallmark_myogenesis、hallmark_p53_pathway、hallmark_pancreas_beta_cells、hallmark_reactive_oxigen_species_pathway、hallmark_tgf_beta_signaling、hallmark_tnfa_signaling_via_nfkb、hallmark_uv_response_up、hallmark_wnt_beta_catenin_signaling、immunophenoscore_1_icos、immunophenoscore_1_mdsc、immunophenoscore_1_pd.l1、immunophenoscore_1_sc、immunophenoscore_1_tim3、immunophenoscore_1_treg、kegg_base_excision_repair、kegg_homologous_recombination、lotan2016_1、neg_ctrl_qc、nelson2016_1、pam50_basal、portos_1、portos_2、rbloss_1、smallcell_1、smallcell_2、smallcell_3、torresroca2009_1、zhang2016_basal_1以及它们的组合。
[0276]
在一些实施方案中,如果患者在该第三类共调控标记中的至少一种标记上的表达评分低于在nmcrpc患者群体中的所述标记上的中值表达评分,则该患者的该第三类共调控标记中的该至少一种标记的表达降低。
[0277]
在一些实施方案中,该第三类共调控标记中的该至少一种标记包括beltran2016_1。在一些实施方案中,如果该表达评分(归一化标记评分)低于
‑
0.44,则该第三类共调控标记中的该至少一种标记的表达降低。
[0278]
beltran2016_1包括:mphosph9、adam7、folh1、cd200、fkbp5、glra2、ndrg1、camkk2、man1a1、med28、ell2、acsl3、pmepa1、gnmt、abcc4、herc3、pip4k2b、klk3、eaf2、cenpn、mapre2、nkx3
‑
1、klk2、ar、tnk1、maf、c1orf116、tmprss2、tbc1d9b和zbtb10。
[0279]
在一些实施方案中,使用第三类共调控标记中的至少2种、3种、4种、5种、6种、7种、8种、9种、10种或更多种标记来确定生物样本的第三类共调控标记的表达是否降低。
[0280]
在一些实施方案中,确定该生物样本的第四类共调控标记中的至少一种标记的表达降低。
[0281]
在一些实施方案中,该第四类共调控标记中的该至少一种标记选自:estimate2013_2_estimate、estimate2013_2_immune、estimate2013_2_stromal、hallmark_allograft_rejection、hallmark_angiogenesis、hallmark_complement、hallmark_il2_jak_stat5_signaling、hallmark_il6_jak_stat3_signaling、hallmark_inflammatory_response、hallmark_interferon_alpha_response、hallmark_interferon_gamma_response、hallmark_kras_signaling_up、immunophenoscore_1_act.cd4、immunophenoscore_1_act.cd8、immunophenoscore_1_b2m、immunophenoscore_1_cd27、immunophenoscore_1_ec、immunophenoscore_1_hla.a、immunophenoscore_1_hla.b、immunophenoscore_1_hla.c、immunophenoscore_1_hla.dpa1、immunophenoscore_1_hla.dpb1、immunophenoscore_1_hla.e、immunophenoscore_1_hla.f、immunophenoscore_1_ips、immunophenoscore_1_ips.raw、immunophenoscore_1_mhc、immunophenoscore_1_
tap1、immunophenoscore_1_tap2、immunophenoscore_1_tem.cd8以及它们的组合。
[0282]
在一些实施方案中,如果患者在该第四类共调控标记中的至少一种标记上的表达评分高于或等于在nmcrpc患者群体中的所述标记上的中值表达评分,则该患者的该第四类共调控标记中的该至少一种标记的表达增加。
[0283]
在一些实施方案中,该第四类共调控标记中的该至少一种标记包括hallmark_il2_jak_stat5_signaling。在一些实施方案中,如果该表达评分(归一化标记评分)高于或等于
‑
0.42,则该第四类共调控标记中的该至少一种标记的表达增加。
[0284]
hallmark_il2_jak_stat5_signaling包括:abcb1、adam19、ager、ahcy、ahnak、ahr、akap2、alcam、amacr、anxa4、aplp1、arl4a、batf、batf3、bcl2、bcl2l1、bhlhe40、bmp2、bmpr2、ca2、capg、capn3、casp3、ccnd2、ccnd3、ccne1、ccr4、cd44、cd48、cd79b、cd81、cd83、cd86、cdc42se2、cdc6、cdcp1、cdkn1c、cish、ckap4、coch、col6a1、csf1、csf2、cst7、ctla4、ctsz、cxcl10、cyfip1、dcps、dennd5a、dhrs3、drc1、ecm1、eef1akmt1、emp1、eno3、enpp1、eomes、etfbkmt、etv4、f2rl2、fah、fam126b、fgl2、flt3lg、furin、gabarapl1、gadd45b、galm、gata1、gbp4、glipr2、gpr65、gpr83、gpx4、gsto1、gucy1b1、hipk2、hk2、hopx、huwe1、icos、ifitm3、ifngr1、igf1r、igf2r、ikzf2、ikzf4、il10、il10ra、il13、il18r1、il1r2、il1rl1、il2ra、il2rb、il3ra、il4r、irf4、irf6、irf8、itga6、itgae、itgav、itih5、klf6、lclat1、lif、lrig1、lrrc8c、ltb、maff、map3k8、map6、mapkapk2、muc1、mxd1、myc、myo1c、myo1e、ncoa3、ncs1、ndrg1、nfil3、nfkbiz、nop2、nrp1、nt5e、odc1、p2rx4、p4ha1、pdcd2l、penk、phlda1、phtf2、pim1、plagl1、plec、plin2、plpp1、plscr1、pnp、pou2f1、praf2、prkch、prnp、ptch1、ptger2、pth1r、ptrh2、pus1、rabgap1l、rgs16、rhob、rhoh、rnh1、rora、rragd、s100a1、scn9a、sell、selp、serpinb6、serpinc1、sh3bgrl2、she、slc1a5、slc29a2、slc2a3、slc39a8、smpdl3a、snx14、snx9、socs1、socs2、spp1、spred2、spry4、st3gal4、swap70、syngr2、syt11、tgm2、tiam1、tlr7、tnfrsf18、tnfrsf1b、tnfrsf21、tnfrsf4、tnfrsf8、tnfrsf9、tnfsf10、tnfsf11、traf1、ttc39b、twsg1、uck2、umps、wls和xbp1。
[0285]
在一些实施方案中,使用第四类共调控标记中的至少2种、3种、4种、5种、6种、7种、8种、9种、10种或更多种标记来确定生物样本的第四类共调控标记的表达是否降低。
[0286]
在一些实施方案中,鉴定共调控表达标记包括应用共有聚类并部分地基于相关共有聚类确定共调控表达标记。
[0287]
在一些实施方案中,鉴定共调控表达标记包括对标记进行评分以创建标记评分,按标记评分的大小对标记进行排序以创建分级标记,转置这些分级标记,以及对样本进行分位数归一化。
[0288]
在一些实施方案中,评估表达标记包括使用kaplan
‑
meier分析、cox比例建模或kaplan
‑
meier分析和cox比例建模两者。
[0289]
在一些实施方案中,该方法还包括基于共调控表达标记中的每一类将患者分成高表达组和低表达组,以及针对高表达组和低表达组的表达水平和施用相互作用与结果之间的关联来评估表达标记。
[0290]
在一些实施方案中,人类男性接受apa adt的联合施用。spartan证明,向雄激素剥夺疗法(adt)中加入apa提高了nmcrpc患者的无转移生存期(mfs)和第二次无进展生存期(pfs2)。
[0291]
在一些实施方案中,改善的益处包括无转移生存期(mfs)的增加、转移时间(ttm)的增加、第二次无进展生存期(pfs2)的增加,症状进展时间的增加、细胞毒性化学疗法开始时间的增加、与疾病进展相关症状的延迟、总体生存期的改善、生存期益处或它们的组合。
[0292]
在一些实施方案中,改善的益处包括mfs的增加。在一些实施方案中,联合施用apa adt的mfs相对于单独施用单独的adt而言得到提高。
[0293]
在一些实施方案中,mfs的增加为约1个月、约2个月、约3个月、约4个月、约5个月、约6个月、约7个月、约8个月、约9个月、约10个月、约11个月、约12个月、约13个月、约14个月、约15个月、约16个月、约17个月、约18个月、约19个月、约20个月、约21个月、约22个月、约23个月或约24个月。
[0294]
在一些实施方案中,mfs的增加为至少约1个月,例如至少约2个月、至少约3个月、至少约4个月、至少约5个月、至少约7个月、至少约8个月、至少约9个月、至少约10个月、至少约11个月、至少约12个月,至少约13个月、至少约14个月、至少约15个月、至少约16个月、至少约17个月、至少约18个月、至少约19个月、至少约20个月、至少约21个月、至少约22个月、至少约23个月或至少约24个月。在一些实施方案中,mfs的增加为至少约6个月。
[0295]
在一些实施方案中,mfs的增加为介于约1个月和约48个月之间,例如约1
‑
45个月、约2
‑
45个月、约2
‑
42个月、约3
‑
42个月、约3
‑
39个月、约4
‑
39个月、约4
‑
36个月、约5
‑
36个月、约5
‑
33个月、约6
‑
33个月、约6
‑
30个月、约7
‑
30个月、约7
‑
27个月、约8
‑
27个月、约8
‑
24个月、约9
‑
24个月、约9
‑
21个月、约10
‑
21个月、约10
‑
18个月、约11
‑
18个月、约11
‑
15个月或约12
‑
15个月。
[0296]
在一些实施方案中,mfs的增加是相对于患有nmcrpc并已用安慰剂治疗的男性人类群体的平均生存期而言的。
[0297]
在一些实施方案中,mfs是指从随机化到首次出现bicr确认的骨或软组织远处转移或因任何原因导致的死亡(以先发生者为准)的时间。
[0298]
在一些实施方案中,改善的益处包括pfs2的增加。在一些实施方案中,联合施用apa adt的pfs2相对于单独施用单独的adt而言得到提高。
[0299]
在一些实施方案中,pfs2的增加为约1个月、约2个月、约3个月、约4个月、约5个月、约6个月、约7个月、约8个月、约9个月、约10个月、约11个月、约12个月、约13个月、约14个月、约15个月、约16个月、约17个月、约18个月、约19个月、约20个月、约21个月、约22个月、约23个月或约24个月。
[0300]
在一些实施方案中,pfs2的增加为至少约1个月,例如至少约2个月、至少约3个月、至少约4个月、至少约5个月、至少约7个月、至少约8个月、至少约9个月、至少约10个月、至少约11个月、至少约12个月,至少约13个月、至少约14个月、至少约15个月、至少约16个月、至少约17个月、至少约18个月、至少约19个月、至少约20个月、至少约21个月、至少约22个月、至少约23个月或至少约24个月。在一些实施方案中,pfs2的增加为至少约6个月。
[0301]
在一些实施方案中,pfs2的增加为介于约1个月和约48个月之间,例如约1
‑
45个月、约2
‑
45个月、约2
‑
42个月、约3
‑
42个月、约3
‑
39个月、约4
‑
39个月、约4
‑
36个月、约5
‑
36个月、约5
‑
33个月、约6
‑
33个月、约6
‑
30个月、约7
‑
30个月、约7
‑
27个月、约8
‑
27个月、约8
‑
24个月、约9
‑
24个月、约9
‑
21个月、约10
‑
21个月、约10
‑
18个月、约11
‑
18个月、约11
‑
15个月或约12
‑
15个月。
[0302]
在一些实施方案中,改善的益处包括转移时间(ttm)的增加。
[0303]
在一些实施方案中,ttm的增加为约1个月、约2个月、约3个月、约4个月、约5个月、约6个月、约7个月、约8个月、约9个月、约10个月、约11个月、约12个月、约13个月、约14个月、约15个月、约16个月、约17个月、约18个月、约19个月、约20个月、约21个月、约22个月、约23个月或约24个月。
[0304]
在一些实施方案中,ttm的增加为至少约1个月,例如至少约2个月、至少约3个月、至少约4个月、至少约5个月、至少约6个月、至少约7个月、至少约8个月、至少约9个月、至少约10个月、至少约11个月、至少约12个月,至少约13个月、至少约14个月、至少约15个月、至少约16个月、至少约17个月、至少约18个月、至少约19个月、至少约20个月、至少约21个月、至少约22个月、至少约23个月或至少约24个月。
[0305]
在一些实施方案中,ttm的增加为介于约1个月和约48个月之间,例如约1
‑
45个月、约2
‑
45个月、约2
‑
42个月、约3
‑
42个月、约3
‑
39个月、约4
‑
39个月、约4
‑
36个月、约5
‑
36个月、约5
‑
33个月、约6
‑
33个月、约6
‑
30个月、约7
‑
30个月、约7
‑
27个月、约8
‑
27个月、约8
‑
24个月、约9
‑
24个月、约9
‑
21个月、约10
‑
21个月、约10
‑
18个月、约11
‑
18个月、约11
‑
15个月或约12
‑
15个月。
[0306]
在一些实施方案中,改善的益处包括与疾病进展相关症状的延迟。
[0307]
在一些实施方案中,雄激素受体抑制剂(即抗雄激素)是小分子。在一些实施方案中,雄激素受体抑制剂是雄激素受体(ar)拮抗剂。在一些实施方案中,雄激素受体抑制剂是ar完全拮抗剂。在一些实施方案中,雄激素受体抑制剂是apa adt。在一些实施方案中,雄激素受体抑制剂(例如apa adt)的施用是通过口服施用。
[0308]
雄激素剥夺疗法或adt是指将前列腺癌患者中的雄激素水平降低至睾酮的去势水平(<50ng/dl)。在一些实施方案中,此类治疗可包括睾丸切除术或使用促性腺激素释放激素激动剂或拮抗剂。在一些实施方案中,adt包括手术去势(睾丸切除术)和/或向人施用黄体化激素释放激素(“lhrh”)激动剂。lhrh激动剂的示例包括醋酸戈舍瑞林、醋酸组胺瑞林、醋酸亮丙瑞林和棕榈酸曲普瑞林。
[0309]
医师可根据说明、建议和实践来开具lhrh激动剂处方。在一些实施方案中,该lhrh激动剂处方包括在约28天至约3个月的时间段内施用约0.01mg至约20mg的醋酸戈舍瑞林、在约28天至约3个月的时间段内施用约3.6mg至约10.8mg的醋酸戈舍瑞林;在约3天至约12个月的时间段内施用约0.01mg至约200mg的醋酸亮丙瑞林,优选地在约3天至约12个月的时间段内施用约3.6mg的醋酸亮丙瑞林;或在约1个月的时间段内施用约0.01mg至约20mg的羟萘酸曲普瑞林,优选地在1个月的时间端内施用约3.75mg的羟萘酸曲普瑞林。在一些实施方案中,该lhrh激动剂处方包括在12个月的时间段内施用约50mg的醋酸组胺瑞林或每天施用约50μg的醋酸组胺瑞林。
[0310]
雄激素耗竭是具有以下通常可预见到的结果的标准治疗:psa水平下降,肿瘤不增殖的稳定期,然后是psa水平升高并再生长为去势难治性疾病。在过去,adt一直是转移性前列腺癌患者的护理标准。
[0311]
本文所述治疗剂的施用可以任何方式进行,例如,通过肠胃外或非肠胃外施用,包括通过气溶胶吸入、注射、输注、摄取、植入或移植。例如,本文所述的组合物可通过经动脉、皮内、皮下、瘤内、髓内、鼻内、肌内、静脉内(i.v.)注射或腹膜内施用于患者。在一个方面,
本公开的组合物通过i.v.注射施用。在一个方面,本公开的组合物通过皮内或皮下注射施用于人类男性。组合物可例如直接注射到肿瘤、淋巴结、组织或器官中。
[0312]
在本发明的一些实施方案中,施用通过口服施用进行。在一个实施方案中,组合物(例如,apa和/或雄激素剥夺疗法组分)以固体口服剂型存在。在一些实施方案中,组合物被配制为片剂。在一些实施方案中,雄激素剥夺疗法是恩杂鲁胺。含有阿帕鲁胺或恩杂鲁胺的固体口服剂型可作为如wo2014113260和cn104857157中所公开的软凝胶胶囊剂提供,这些专利中的每一者以引用方式并入本文,或者作为如wo2016090098、wo2016090101、wo2016090105和wo2014043208中所公开的片剂提供,这些专利中的每一者以引用方式并入本文。适于制备本发明的固体口服剂型的技术描述于以下文献中:remington's pharmaceutical sciences,第18版,ar.gennaro编辑,1990年,第89章;以及remington
‑
the science,and practice of pharmacy,第21版,2005年,第45章。
[0313]
为了制备药物组合物,根据常规的药物配混技术,可将活性药物成分与药用载体紧密混合,根据施用(如口服或肠胃外施用)所需的制剂形式,该载体可采取多种形式。合适的药学上可接受的载体是本领域所熟知的。有关这些药学上可接受的载体中的一些载体的描述可参见american pharmaceutical association和pharmaceutical society of great britain出版的the handbook of pharmaceutical excipients。
[0314]
在固体口服制剂诸如用于重构或吸入的干粉、颗粒剂、胶囊剂、囊片、软胶囊剂、丸剂和片剂(各自包括立即释放、定时释放和持续释放制剂)中,合适的载体和添加剂包括但不限于稀释剂、制粒剂、润滑剂、粘结剂、助流剂、崩解剂等。由于其在给药方面的方便性,片剂和胶囊剂代表了有利的口服单位剂型,在这种情况下显然采用固体药用载体。如果需要,片剂可通过标准技术包糖衣、包明胶衣、包膜衣或包肠溶衣。
[0315]
在一些实施方案中,所述方法所用的组合物呈单位剂型,诸如片剂、丸剂、胶囊剂、用于重构或吸入的干粉剂、颗粒剂、锭剂、无菌溶液剂或混悬剂、定量气雾剂或液体喷剂、滴剂或栓剂,供经口施用、经鼻施用、舌下施用、眼内施用、透皮施用、直肠施用、干粉吸入器施用或其他吸入或吹入途径施用。通过常规制剂技术制造这些制剂。为制备固体药物组合物诸如片剂,将主要活性成分与药用载体如常规的制片成分诸如稀释剂、粘结剂、粘合剂、崩解剂、润滑剂、抗粘剂和助流剂混合。合适的稀释剂包括但不限于淀粉(即玉米、小麦或马铃薯淀粉,可为水解的)、乳糖(颗粒状的、喷雾干燥的或无水的)、蔗糖、蔗糖基稀释剂(甜食的糖;蔗糖加上约7重量%至10重量%的转化糖;蔗糖加上约3重量%的改性糊精;蔗糖加上转化糖、约4重量%的转化糖、约0.1重量%至0.2重量%的玉米淀粉以及硬脂酸镁)、右旋糖、肌醇、甘露糖醇、山梨糖醇、微晶纤维素(即购自fmc公司的avicel微晶纤维素)、磷酸二钙、二水合硫酸钙、三水合乳酸钙等。合适的粘结剂和粘合剂包括但不限于阿拉伯树胶、瓜耳胶、黄蓍胶、蔗糖、明胶、葡萄糖、淀粉和纤维素(即甲基纤维素、羧甲基纤维素钠、乙基纤维素、羟丙基甲基纤维素、羟丙基纤维素等)、水溶性或水分散性粘结剂(如藻酸及其盐、硅酸镁铝、羟乙基纤维素[即购自hoechst celanese的tylose]、聚乙二醇、多糖酸、膨润土、聚乙烯吡咯烷酮、聚甲基丙烯酸酯和预胶凝淀粉)等。合适的崩解剂包括但不限于淀粉(玉米、马铃薯等)、羧甲淀粉钠、预胶凝淀粉、粘土(硅酸镁铝)、纤维素(如交联羧甲基纤维素钠和微晶纤维素)、藻酸盐、预胶凝淀粉(即玉米淀粉等)、树胶(即琼脂、瓜耳胶、刺槐豆胶、刺梧桐树胶(karaya)、果胶和黄蓍胶)、交联的聚乙烯基吡咯烷酮等。合适的润滑剂和抗粘剂包括
但不限于硬脂酸盐(硬脂酸镁、硬脂酸钙和硬脂酸钠)、硬脂酸、滑石、蜡、stearowet、硼酸、氯化钠、dl
‑
亮氨酸、carbowax 4000、carbowax 6000、油酸钠、苯甲酸钠、乙酸钠、十二烷基硫酸钠、十二烷基硫酸镁等。合适的助流剂包括但不限于滑石、玉米淀粉、二氧化硅(即,得自cabot的cab
‑
o
‑
sil二氧化硅、得自w.r.grace/davison的syloid二氧化硅和得自degussa的aerosil二氧化硅)等。可向可咀嚼的固体剂型中加入甜味剂和香味剂以改善该口服剂型的适口性。此外,可向固体剂型添加或涂布着色剂和涂布剂以便易于识别药物或出于美学目的。这些载体与药物活性物质配制在一起,以提供具有治疗释药特征的药物活性物质的精确、适宜剂量。
[0316]
适用于本文所用的药物组合物的粘结剂包括但不限于淀粉、纤维素及其衍生物(例如,乙基纤维素、乙酸纤维素、羧甲基纤维素钙、羧甲基纤维素钠、甲基纤维素、羟丙基甲基纤维素)、聚乙烯吡咯烷酮以及它们的混合物。
[0317]
适用于本文所用的药物组合物的填料的示例包括但不限于微晶纤维素、粉末状纤维素、甘露糖醇、乳糖、磷酸钙、淀粉、预先胶凝化的淀粉以及它们的混合物。
[0318]
药物组合物中的粘结剂或填料通常以药物组合物或剂型的约50重量%至约99重量%存在。
[0319]
崩解剂可用于组合物中以提供在暴露于水性环境时崩解的片剂。包含过多崩解剂的片剂可能在存放期间崩解,而包含过少崩解剂的那些可能不以所需速率或在所需条件下崩解。因此,应使用不会不利地改变活性成分的释放的既不太多也不太少的足量崩解剂来形成固体口服剂型。所用的崩解剂的量根据制剂的类型而变化,并且对于本领域的普通技术人员是容易识别的。典型的药物组合物包含约0.5重量%至约15重量%的崩解剂,具体地讲是约1重量%至约5重量%的崩解剂。可用于本文所用的药物组合物的崩解剂包括但不限于交联羧甲基纤维素钠、交联聚乙烯吡咯烷酮、羧甲淀粉钠、马铃薯或木薯淀粉、预先胶凝化的淀粉、其他淀粉、其他纤维素、树胶以及它们的混合物。
[0320]
可用于本文所用的药物组合物的润滑剂包括但不限于硬脂酸钙、硬脂酸镁、矿物油、轻质矿物油、甘油、山梨糖醇、聚乙二醇、其他二醇、硬脂酸、月桂基硫酸钠、硬脂富马酸钠、滑石粉、氢化植物油(例如花生油、棉籽油、向日葵油、芝麻油、橄榄油、玉米油和大豆油)、硬脂酸锌、油酸乙酯、月桂酸乙酯、琼脂以及它们的混合物。润滑剂通常以小于其所掺入的药物组合物或剂型的约1重量%的量使用。
[0321]
压片制剂可任选地包膜衣以提供颜色、光保护和/或掩味。还可对片剂进行包衣,以调节胃肠道中释放的发生和/或速率,从而优化或最大化患者对api的生物暴露。
[0322]
硬胶囊制剂可通过将例如阿帕鲁胺的共混物或制粒填充到由例如明胶或羟丙甲纤维素组成的壳中来制备。可制备软凝胶胶囊制剂。
[0323]
旨在口服的药物组合物可根据本文所述的方法以及本领域已知的用于制备药物组合物的其它方法,由上述固体分散体制剂和共混材料制备。此类组合物还可包含一种或多种选自甜味剂、调味剂、着色剂和防腐剂的试剂,以提供药学上美观且可口的制剂。
[0324]
片剂可包含与适于制备片剂的无毒性药用赋形剂混合的活性成分。这些赋形剂可为例如惰性稀释剂、制粒和崩解剂、粘合剂、助流剂、润滑剂和抗氧化剂,例如没食子酸丙酯、丁基羟基茴香醚和丁基羟基甲苯。片剂可无包衣,或者它们可通过已知技术包膜衣,以改变外观或可涂布功能性包衣以延迟在胃肠道中的崩解和吸收,由此在较长时间段内提供
持续作用。
[0325]
用于口服的组合物也可提供为胶囊(例如硬明胶),其中活性成分与惰性固体稀释剂例如碳酸钙、磷酸钙或高岭土混合;或提供为软明胶胶囊,其中活性成分与液体或半固体例如花生油、液体石蜡、分馏甘油酯、表面活性剂或橄榄油混合。水性混悬剂包含与适于制造水性混悬剂的赋形剂混合的活性物质。适于通过添加水来制备水性混悬剂的可分散的粉剂和颗粒剂提供了与分散剂或润湿剂、悬浮剂以及一种或多种防腐剂混合的活性成分。在本发明的某些实施方案中,本发明的药物组合物包含以下浓度的稀释剂体系、崩解剂、盐、润滑剂、助流剂和膜包衣:分别从约3%重量/重量至约58%重量/重量、从约4%重量/重量至约20%重量/重量、从约4%重量/重量至约20%重量/重量、从约0.5%重量/重量至约4%重量/重量、从约0%重量/重量至约2%重量/重量,以及从约1%重量/重量至约5%重量/重量,或者分别为从约18%重量/重量至约40%重量/重量、从约7%重量/重量至约15%重量/重量、从约7%重量/重量至约18%重量/重量、从约l.0%重量/重量至约3.0%、从约0.1%重量/重量至约l.0%重量/重量以及从约2.0%重量/重量至约4.0%重量/重量。在某些实施方案中,将固体分散体制剂与稀释剂、一种或多种崩解剂、润滑剂和助流剂共混。示例性共混组合物或口服剂型包括甘露糖醇、微晶纤维素、交联羧甲基纤维素钠、氯化钠、胶态二氧化硅、硬脂酰富马酸钠和硬脂酸镁。
[0326]
崩解剂可以约4%重量/重量至约20%重量/重量或约7%重量/重量至约15%重量/重量的浓度存在。还可存在盐,其可为氯化钠、氯化钾或它们的组合。盐和崩解剂的组合以最终药物组合物的约5%重量/重量至约35%重量/重量的浓度存在。
[0327]
在某些实施方案中,片芯的非活性成分为:胶态无水二氧化硅、交联羧甲基纤维素钠、羟丙基甲基纤维素
‑
乙酸琥珀酸酯、硬脂酸镁、微晶纤维素和硅化微晶纤维素。在其他实施方案中,片剂成品具有由以下赋形剂组成的膜包衣:氧化铁黑、氧化铁黄、聚乙二醇、聚乙烯醇、滑石粉和二氧化钛。
[0328]
给药方法和治疗方案
[0329]
在一个方面,本文描述了治疗人类男性非转移性去势抵抗性前列腺癌(nmcrpc)的方法,该方法包括以下步骤、由以下步骤组成或基本上由以下步骤组成:向患有非转移性去势抵抗性前列腺癌的男性人类施用有效量的雄激素受体抑制剂(例如,阿帕鲁胺或恩杂鲁胺),其中该雄激素受体抑制剂口服施用。在一些实施方案中,雄激素受体抑制剂每天施用。在一些实施方案中,雄激素受体抑制剂每天施用两次。在一些实施方案中,雄激素受体抑制剂每天施用三次。在一些实施方案中,雄激素受体抑制剂每天施用四次。在一些实施方案中,阿帕鲁胺隔天施用。在一些实施方案中,抗雄激素每周施用。在一些实施方案中,雄激素受体抑制剂每周施用两次。在一些实施方案中,雄激素受体抑制剂隔周施用。在一些实施方案中,雄激素受体抑制剂按连续每天给药日程表口服施用。
[0330]
在一个实施方案中,所需剂量以单剂量或同时(或在短时间段内)或以适当的间隔,例如两个、三个、四个或更多个亚剂量/天施用的分剂量提供。在一些实施方案中,雄激素受体抑制剂以同时(或在短时间段内)施用的分剂量提供,每天一次。在一些实施方案中,雄激素受体抑制剂以相等份量施用的分剂量提供,每天两次。在一些实施方案中,雄激素受体抑制剂以相等份量施用的分剂量提供,每天三次。在一些实施方案中,雄激素受体抑制剂以相等份量施用的分剂量提供,每天四次。
[0331]
在某些实施方案中,雄激素受体抑制剂是恩杂鲁胺或阿帕鲁胺。在一些实施方案中,抗雄激素是恩杂鲁胺。在一些实施方案中,雄激素受体抑制剂是阿帕鲁胺。在一些实施方案中,雄激素受体抑制剂是达罗鲁胺。
[0332]
一般来讲,用于治疗本文所述的男性人类前列腺癌的阿帕鲁胺的剂量通常在10mg/天至1000mg/天的范围内。在一些实施方案中,以约30mg/天至约1200mg/天的剂量向男性人类口服施用阿帕鲁胺。在一些实施方案中,以约30mg/天至约600mg/天的剂量向男性人类口服施用阿帕鲁胺。在一些实施方案中,以约30mg/天、约60mg/天、约90mg/天、约120mg/天、约160mg/天、约180mg/天、约240mg/天、约300mg/天、约390mg/天、约480mg/天、约600mg/天、约780mg/天、约960mg/天、或约1200mg/天的剂量向男性人类口服施用阿帕鲁胺。
[0333]
在一些实施方案中,以约240mg/天的剂量向男性人类口服施用阿帕鲁胺。在一些实施方案中,向男性人类施用大于240mg/天的阿帕鲁胺。在一些实施方案中,以每天四次约60mg的剂量向男性人类口服施用阿帕鲁胺。在一些实施方案中,阿帕鲁胺按连续每天给药日程表口服施用于男性人类。
[0334]
在一些实施方案中,恩杂鲁胺以约160mg的剂量口服施用。在一些实施方案中,施用大于160mg/天的恩杂鲁胺。
[0335]
在一些实施方案中,达罗鲁胺以约1200mg的剂量口服施用。在一些实施方案中,以每天两次约600mg的剂量(等同于1200mg的总日剂量)口服施用达罗鲁胺。在一些实施方案中,施用大于1200mg/天的达罗鲁胺。
[0336]
在未观察到人疾病或病症状态改善的某些实施方案中,增加雄激素受体抑制剂的每天剂量。在一些实施方案中,将每天一次的给药日程表改变为每天两次的给药日程表。在一些实施方案中,采用每天三次的给药日程表来增加施用的雄激素受体抑制剂的量。
[0337]
在一些实施方案中,给予人的雄激素受体抑制剂的量根据多种因素而变化,诸如但不限于疾病或病症的病状和严重程度和人的特性(例如,体重),以及所施用的特定附加治疗剂(如果适用)。
[0338]
在某些实施方案中,当与以下中的一者或多者共同施用时,雄激素受体抑制剂(抗雄激素)例如阿帕鲁胺、恩杂鲁胺或达罗鲁胺的剂量减少:
[0339]
(a)cyp2c8抑制剂,优选地吉非罗齐或氯吡格雷;或者
[0340]
(b)cyp3a4抑制剂,优选地酮康唑或利托那韦。
[0341]
在一些实施方案中,阿帕鲁胺不与以下物质共同施用:
[0342]
(a)主要被cyp3a4代谢的药物,例如地瑞那韦、非洛地平、咪达唑仑或辛伐他汀;
[0343]
(b)主要被cyp2c19代谢的药物,例如安定或奥美拉唑;
[0344]
(c)主要被cyp2c9代谢的药物,例如华法林或苯妥英;或者
[0345]
(d)为ugt底物的药物,例如左甲状腺素或丙戊酸。
[0346]
在另外的实施方案中,阿帕鲁胺不与以下物质共同施用:
[0347]
(a)为p
‑
gp底物的药物,例如非索非那丁、秋水仙碱、达比加群酯或地高辛;或者
[0348]
(b)bcrp/oatp1b1底物,优选地拉帕替尼、甲氨蝶呤、罗苏伐他汀或瑞格列奈。
[0349]
在另外的实施方案中,患有所述非转移性去势抵抗性前列腺癌的男性人类已接受用于治疗癌症的至少一种先前疗法,任选地其中用于治疗癌症的先前疗法是比卡鲁胺或氟他胺。
[0350]
此外,在另外的实施方案中,患有所述非转移性去势抵抗性前列腺癌的男性人类是未经治疗的。
[0351]
在其他实施方案中,单个单位剂量的组合物包含约240mg的阿帕鲁胺。在一些实施方案中,将多剂量的包含约60mg的阿帕鲁胺、由其组成或基本上由其组成的单个单位剂量组合物(例如,4个多单位剂型或单独单位剂型)施用于人类男性。阿帕鲁胺的每天总剂量可为约240mg/天。
[0352]
施用的量和频率将由人类男性的病症以及人类男性疾病的类型和严重程度等因素确定,尽管合适的剂量可由临床试验确定。
[0353]
在一个实施方案中,可在一天、两天、三天、四天、五天、六天、一周、两周、三周、一个月、五周、六周、七周、两个月、三个月、四个月、五个月、六个月或更长时间之后重复施用。也可以重复治疗过程,按照慢性施用一样。重复施用可为相同剂量或不同剂量。
[0354]
在一个实施方案中,所需剂量以单剂量或同时(或在短时间段内)或以适当的间隔,例如两个、三个、四个或更多个亚剂量/天施用的分剂量提供。在一些实施方案中,组合物以同时(或在短时间段内)施用的分剂量提供,每天一次。在一些实施方案中,组合物以相等份量施用的分剂量提供,每天两次。在一些实施方案中,组合物以相等份量施用的分剂量提供,每天三次。在一些实施方案中,组合物雄激素受体抑制剂以相等份量施用的分剂量提供,每天四次。
[0355]
在本发明的方法中,治疗剂可通过维持疗法施用,诸如每周一次持续6个月或更长时间。
[0356]
在一些实施方案中,还例如同时向人类男性施用促性腺激素释放激素(gnrh)类似物。在一些实施方案中,人类男性已(或将)进行双侧睾丸切除术。
[0357]
在一些实施方案中,本发明所用的雄激素剥夺疗法(adt)组合物可以与本文针对阿帕鲁胺所述相同的剂量和/或施用时间和日程表施用。用于adt的组合物包括但不限于黄体化激素释放激素(lhrh)激动剂(例如亮丙瑞林和戈舍瑞林)、lhrh拮抗剂(例如地加瑞克)、雌激素、抗雄激素(例如氟他胺、恩杂鲁胺、比卡鲁胺和尼鲁米特)。
[0358]
阿帕鲁胺(apa)和雄激素剥夺疗法(adt)可同时(例如,在相同的组合物中,或在单独的组合物中)或在不同的时间(例如顺序地)施用。在一个实施方案中,apa可在施用adt之前施用。在一个实施方案中,adt可在施用apa之前施用。
[0359]
在一些实施方案中,还向人类男性施用一种或多种附加治疗剂,例如本文所述的组合物或化合物。附加治疗剂可与阿帕鲁胺或雄激素剥夺疗法(adt)同时施用(例如,在相同的组合物中,或在单独的组合物中),或可在施用apa或adt之前或之后施用,或可在施用apa或adt之前和之后都施用。
[0360]
在另外的实施方案中,本文所述的治疗剂可在治疗方案中与外科手术、放射、化学疗法、免疫抑制剂(诸如甲氨蝶呤、环孢菌素、硫唑嘌呤、麦考酚酯和fk506)、抗体或其他免疫消融剂(诸如抗cd3抗体或其他抗体疗法、细胞毒素、氟达拉滨、环孢菌素、fk506、雷帕霉素、霉酚酸、类固醇、fr901228)、细胞因子和辐射联合使用。
[0361]
在一个实施方案中,治疗剂可与本文所述方法中的其他化学治疗剂联合使用。示例性化学治疗剂包括但不限于蒽环霉素(例如,多柔比星(例如,脂质体多柔比星))、长春花生物碱(例如,长春碱、长春新碱、长春地辛、长春瑞滨)、烷基化剂(例如,环磷酰胺、达卡巴
嗪、美法仑、异环磷酰胺、替莫唑胺)、免疫细胞抗体(例如,阿伦妥单抗(alemtuzamab)、吉妥珠单抗、利妥昔单抗、托西莫单抗)、抗代谢物(包括例如叶酸拮抗剂、嘧啶类似物、嘌呤类似物和腺苷脱氨酶抑制剂(例如氟达拉滨))、mtor抑制剂、tnfr糖皮质激素诱导的tnfr相关蛋白(gitr)激动剂、蛋白酶体抑制剂(例如阿克拉霉素a、胶霉毒素或硼替佐米)、免疫调节剂(诸如沙利度胺或沙利度胺衍生物(例如来那度胺))。
[0362]
被认为用于联合疗法的化学治疗剂的不完全列表包括阿那曲唑比卡鲁胺硫酸博来霉素白消安亚叶酸钙、美法仑6
‑
巯基嘌呤甲氨蝶呤米托蒽醌麦罗塔、紫杉醇phoenix(yttrium90/mx
‑
dtpa)、喷司他丁、以聚苯丙生20为载体的卡莫司汀植入膜剂更生霉素(放线菌素d,cosmegan)、盐酸柔红霉素枸橼酸柔红霉素脂质体注射剂地塞米松、多西他赛盐酸多柔比星依托泊苷白消安注射剂卡培他滨n4
‑
戊氧羰基
‑5‑
脱氧
‑5‑
氟胞苷、卡铂卡莫司汀苯丁酸氮芥顺铂克拉屈滨环磷酰胺(或)、阿糖胞苷、胞嘧啶阿拉伯糖苷阿糖胞苷脂质体注射剂达卡巴嗪磷酸氟达拉滨5
‑
氟尿嘧啶氟他胺替扎他滨、吉西他滨(二氟脱氧胞苷)、羟基脲伊达比星异环磷酰胺伊立替康l
‑
天冬酰胺酶枸橼酸他莫昔芬替尼泊苷6
‑
硫鸟嘌呤、噻替哌、替拉扎明注射用盐酸拓扑替康长春碱长春新碱和长春瑞滨
[0363]
示例性烷基化剂包括但不限于氮芥子气、乙烯亚胺衍生物、烷基磺酸盐、亚硝基脲和三氮烯:尿嘧啶氮芥(aminouracil和三氮烯:尿嘧啶氮芥(aminouraciluracil nitrogen)、氮芥环磷酰胺(环磷酰胺(revimmune
tm
)、异环磷酰胺美法仑苯丁酸氮芥哌泊溴烷哌泊溴烷三亚乙基蜜胺
三亚乙基硫代磷胺、替莫唑胺噻替哌白消安卡莫司汀洛莫司汀链脲霉素和达卡巴嗪另外的示例性烷基化剂包括但不限于奥沙利铂美法仑(也称为l
‑
pam、l
‑
溶肉瘤素和苯丙氨酸氮芥,);六甲蜜胺(也称为六甲基蜜胺(hmm),);卡莫司汀苯达莫司汀白消安(和);卡铂替莫唑胺(和);更生霉素(也称为放线菌素d,);洛莫司汀(也称为ccnu、);顺铂(也称为cddp、和
‑
aq);苯丁酸氮芥环磷酰胺(和);达卡巴嗪(也称为dtic、dic和咪唑甲酰胺,);六甲蜜胺(也称为六甲基蜜胺(hmm),);异环磷酰胺泼尼氮芥(prednumustine);丙卡巴肼双氯乙基甲胺(也称为氮芥、莫司汀和双氯乙基甲胺盐酸盐,);链脲霉素噻替哌(也称为硫代磷酰胺、tespa和tspa、);环磷酰胺);环磷酰胺以及盐酸苯达莫司汀
[0364]
可用于本文的免疫调节剂的示例包括但不限于,例如奥法木单抗(购自);培非司亭来那度胺(cc
‑
5013,);沙利度胺actimid(cc4047);和irx
‑
2(人细胞因子(包括白介素1、白介素2和干扰素γ)的混合物,cas 951209
‑
71
‑
5,购自irx therapeutics)。
[0365]“治疗有效量”或“有效量”在本文中互换使用,是指在所需剂量和时间段有效实现期望的治疗结果的量。治疗有效量可根据以下因素变化:诸如个体的疾病状态、年龄、性别和重量,以及治疗剂或治疗剂组合在个体中引发期望的反应的能力。有效治疗剂或治疗剂组合的示例性指标包括,例如:患者健康状况的改善、肿瘤负荷的减少、肿瘤生长的遏止或减慢和/或癌细胞没有向身体其他部位转移的情况。
[0366]
可用于本发明实施方案的情况的递送系统可包括定时释放递送系统、延迟释放递送系统和缓释递送系统,使得药物的递送在待治疗部位敏化之前进行,并且进行足够的时间以使待治疗部位敏化。组合物可与其他治疗剂或疗法联合使用。此类系统可避免组合物的重复施用,从而增加对人类男性和医师的便利性,并且可特别适用于本发明的某些组合物实施方案。
[0367]
许多类型的释放递送体系是可用的,并且是本领域普通技术人员已知的。这些释放递送系统包括聚合物基础系统,诸如聚(丙交酯
‑
乙交酯)、共聚草酸酯、聚酯酰胺、聚原酸酯、聚己内酯、聚羟基丁酸和聚酸酐。前述含有药物的聚合物的微胶囊描述于例如美国专利
5,075,109中。递送体系还包括为脂质的非聚合物系统,这些脂质包括甾醇(诸如胆固醇、胆固醇酯和脂肪酸或中性脂肪(诸如甘油一酯、甘油二酯和甘油三酯));硅橡胶系统;基于肽的系统;水凝胶释放体系;蜡涂层;使用常规粘合剂和赋形剂的压片;部分熔融的植入物;等。具体示例包括但不限于:(a)侵蚀系统,其中活性组合物以一定形式包含在基质(诸如美国专利4,452,775、4,667,014、4,748,034和5,239,660中所述的基质)内,和(b)扩散系统,其中活性组分以可控的速率从聚合物(诸如美国专利3,854,480和3,832,253中所述的聚合物)中渗透出来。此外,可使用基于泵的硬件递送系统,其中一些系统适于植入。
[0368]
示例性实施方案
[0369]
实施方案1是一种使用阿帕鲁胺(apa)和雄激素剥夺疗法(adt)(apa adt)提供人类男性非转移性去势抵抗性前列腺癌(nmcrpc)的改善的治疗益处的方法,所述方法包括以下步骤、由以下步骤组成和/或基本上由以下步骤组成:
[0370]
如果确定从所述人类男性中获得的生物样本具有以下特征,则向所述人类男性施用治疗有效量的apa adt:
[0371]
a)前列腺癌的管腔样分子亚型;
[0372]
b)大于约0.6的基因组分类器评分;
[0373]
c)第一类共调控标记中的至少一种标记的表达增加;
[0374]
d)第二类共调控标记中的至少一种标记的表达增加;
[0375]
e)第三类共调控标记中的至少一种标记的表达降低;
[0376]
f)第四类共调控标记中的至少一种标记的表达增加;或它们的组合。
[0377]
实施方案2是一种治疗人类男性非转移性去势抵抗性前列腺癌(nmcrpc)的方法,所述方法包括以下步骤、由以下步骤组成和/或基本上由以下步骤组成:
[0378]
如果确定从所述人类男性中获得的生物样本具有以下特征,则向所述人类男性施用治疗有效量的阿帕鲁胺(apa)和治疗有效量的雄激素剥夺疗法(adt)(apa adt):
[0379]
a)前列腺癌的管腔样分子亚型;
[0380]
b)大于约0.6的基因组分类器评分;
[0381]
c)第一类共调控标记中的至少一种标记的表达增加;
[0382]
d)第二类共调控标记中的至少一种标记的表达增加;
[0383]
e)第三类共调控标记中的至少一种标记的表达降低;
[0384]
f)第四类共调控标记中的至少一种标记的表达增加;或它们的组合。
[0385]
实施方案3是一种预测患有非转移性去势抵抗性前列腺癌(nmcrpc)的人类男性通过施用治疗有效量的阿帕鲁胺(apa)和治疗有效量的雄激素剥夺疗法(adt)(apa adt),获得改善的益处的方法,所述方法包括以下步骤、由以下步骤组成和/或基本上由以下步骤组成:
[0386]
a)确定从所述人类男性中获得的生物样本是否具有以下特征:
[0387]
i)前列腺癌的管腔样或基底样分子亚型;
[0388]
ii)大于约0.6的基因组分类器评分;
[0389]
iii)第一类、第二类和/或第四类共调控标记中的至少一种标记的表达水平增加;
[0390]
iv)第三类共调控标记中的至少一种标记的表达水平降低;或它们的组合,以及
[0391]
b)基于以下特征,预测所述人类男性通过施用所述治疗有效量的apa adt,获得相
对于单独施用所述治疗有效量的所述adt而言改善的益处:
[0392]
i)前列腺癌的管腔样分子亚型;
[0393]
ii)大于约0.6的基因组分类器评分;
[0394]
iii)第一类、第二类和/或第四类共调控标记中的至少一种标记的表达水平增加;
[0395]
iv)第三类共调控标记中的至少一种标记的表达水平降低;或它们的组合。
[0396]
实施方案4是一种使用联合施用治疗有效量的阿帕鲁胺(apa)和治疗有效量的雄激素剥夺疗法(adt)(apa adt),相对于单独施用治疗有效量的所述adt而言,改善对治疗人类男性非转移性去势抵抗性前列腺癌(nmcrpc)的反应的方法,所述方法包括以下步骤、由以下步骤组成和/或基本上由以下步骤组成:
[0397]
a)确定从所述人类男性中获得的生物样本是否具有以下特征:
[0398]
i)前列腺癌的管腔样或基底样分子亚型;
[0399]
ii)大于约0.6的基因组分类器评分;
[0400]
iii)第一类、第二类和/或第四类共调控标记中的至少一种标记的表达水平增加;
[0401]
iv)第三类共调控标记中的至少一种标记的表达水平降低;或它们的组合,以及
[0402]
b)基于以下特征,相对于单独施用所述治疗有效量的所述adt而言,改善对联合施用所述治疗有效量的apa adt的反应:
[0403]
i)前列腺癌的管腔样分子亚型;
[0404]
ii)大于约0.6的基因组分类器评分;
[0405]
iii)第一类、第二类和/或第四类共调控标记中的至少一种标记的表达水平增加;
[0406]
iv)第三类共调控标记中的至少一种标记的表达水平降低;或它们的组合。
[0407]
实施方案5是一种鉴定被预测为通过施用治疗有效量的apa和治疗有效量的雄激素剥夺疗法(adt)(apa adt),获得相对于单独施用治疗有效量的adt而言改善的nmcrpc治疗益处的人类男性的方法,所述方法包括以下步骤、由以下步骤组成和/或基本上由以下步骤组成:
[0408]
a)确定从所述人类男性中获得的生物样本是否具有以下特征:
[0409]
i)前列腺癌的管腔样或基底样分子亚型;
[0410]
ii)大于约0.6的基因组分类器评分;
[0411]
iii)第一类、第二类和/或第四类共调控标记中的至少一种标记的表达水平增加;
[0412]
iv)第三类共调控标记中的至少一种标记的表达水平降低,或它们的组合,以及
[0413]
b)基于以下特征,预测所述人类男性通过施用所述治疗有效量的apa adt,获得相对于单独施用所述治疗有效量的所述adt而言改善的益处:
[0414]
i)前列腺癌的管腔样分子亚型;
[0415]
ii)大于约0.6的基因组分类器评分;
[0416]
iii)第一类、第二类和/或第四类共调控标记中的至少一种标记的表达水平增加;
[0417]
iv)第三类共调控标记中的至少一种标记的表达水平降低;或它们的组合。
[0418]
实施方案6是一种预测人类男性nmcrpc对联合施用治疗有效量的阿帕鲁胺(apa)和治疗有效量的雄激素剥夺疗法(adt)(apa adt),相对于单独施用治疗有效量的所述adt而言的反应的改善的方法,所述方法包括以下步骤、由以下步骤组成和/或基本上由以下步骤组成:
[0419]
a)确定从所述人类男性中获得的生物样本是否具有以下特征:
[0420]
i)前列腺癌的管腔样或基底样分子亚型;
[0421]
ii)大于约0.6的基因组分类器评分;
[0422]
iii)第一类、第二类和/或第四类共调控标记中的至少一种标记的表达水平增加;
[0423]
iv)第三类共调控标记中的至少一种标记的表达水平降低;或它们的组合,以及
[0424]
b)基于以下特征,预测对联合施用所述治疗有效量的apa adt,相对于单独施用所述治疗有效量的所述adt而言的反应的改善:
[0425]
i)前列腺癌的管腔样分子亚型;
[0426]
ii)大于约0.6的基因组分类器评分;
[0427]
iii)第一类、第二类和/或第四类共调控标记中的至少一种标记的表达水平增加;
[0428]
iv)第三类共调控标记中的至少一种标记的表达水平降低;或它们的组合。
[0429]
实施方案7是根据实施方案1至6中任一项所述的方法,其中所述人类男性已进行前列腺切除术。
[0430]
实施方案8是根据实施方案1至7中任一项所述的方法,其中所述生物样本是前列腺活检样本或手术肿瘤样本。
[0431]
实施方案9是根据实施方案1至7中任一项所述的方法,其中所述生物样本是原发性前列腺肿瘤样本。
[0432]
实施方案10是根据实施方案1至9中任一项所述的方法,其中联合施用apa adt的无转移生存期(mfs)相对于单独施用单独的adt而言,提高了至少约6个月。
[0433]
实施方案11是根据实施方案1至10中任一项所述的方法,其中联合施用apa adt的第二次无进展生存期(pfs2)相对于单独施用单独的adt而言,提高了至少约6个月。
[0434]
实施方案12是根据实施方案1至11中任一项所述的方法,其中所述施用通过口服施用进行。
[0435]
实施方案13是根据实施方案1至12中任一项所述的方法,其中确定所述生物样本具有前列腺癌的管腔样分子亚型。
[0436]
实施方案14是根据实施方案1至13中任一项所述的方法,其中确定所述生物样本具有大于0.6的基因组分类器评分。
[0437]
实施方案15是根据实施方案14所述的方法,其中所述基因组分类器是22标志物基因组分类器,所述22标志物基因组分类器包含选自以下项的标志物:lasp1、iqgap3、nfib、s1pr4、thbs2、ano7、pcdh7、mybpc1、eppk1、tsbp、pbx1、nusap1、zwilch、ube2c、camkc2n1、rabgap1、pcat
‑
32、gyatl1p4/pcat
‑
80、tnfrsf19以及它们的组合。
[0438]
实施方案16是根据实施方案14或15所述的方法,其中基于所述基因组分类器评分来确定所述人类男性具有高转移风险。
[0439]
实施方案17是根据实施方案1至16中任一项所述的方法,其中确定所述生物样本的所述第一类共调控标记中的至少一种标记的表达增加。
[0440]
实施方案18是根据实施方案17所述的方法,其中所述第一类共调控标记中的所述至少一种标记选自:agell2012_1、bibikova2007_1、bismar2006_1、bismar2017_1、cheville2008_1、cuzick2011_1、cuzick2011_lm_1、decipher_1、decipherv2_2、genomic_capras_1、genomic_gleason_grade_1、genomic_gleason_grade_2、glinsky2005_1、
hallmark_mtorc1_signaling、hallmark_myc_targets_v1、hallmark_myc_targets_v2、klein2014_1、lapointe2004_1、larkin2012_1、long2014_1、nakagawa2008_1、non_organ_confined_1、normaltumor_1、pam50_luminalb、penney2011_1、penney2011_lm_1、ramaswamy2003_1、saal2007_1、saal2007_pten、sdms_1、singh2002_1、staging_epe_1、staging_lni_1、staging_svi_1、stephenson2005_1、talantov2010_1、varambally2005_1、wu2013_1、yu2007_1以及它们的组合。
[0441]
实施方案19是根据实施方案18所述的方法,其中所述第一类共调控标记中的所述至少一种标记包括genomic_gleason_grade_2。
[0442]
实施方案20是根据实施方案1至19中任一项所述的方法,其中确定所述生物样本的所述第二类共调控标记中的至少一种标记的表达增加。
[0443]
实施方案21是根据实施方案20所述的方法,其中所述第二类共调控标记中的所述至少一种标记选自:ar_related_pathway_arv7、ar_related_pathway_glucocorticoid_receptor、aros_1、docetaxel_sens_1、ergmodel_1、glinsky2004_1、hallmark_adipogenesis、hallmark_androgen_response、hallmark_angiogenesis_brauer2013、hallmark_angiogenesis_keggvegf、hallmark_angiogenesis_liberzon2015、hallmark_angiogenesis_masiero2013、hallmark_angiogenesis_nolan2013、hallmark_angiogenesis_uhlik2016、hallmark_apical_surface、hallmark_bile_acid_metabolism、hallmark_cholesterol_homeostasis、hallmark_dna_repair、hallmark_e2f_targets、hallmark_fatty_acid_metabolism、hallmark_g2m_checkpoint、hallmark_glycolysis、hallmark_hedgehog_signaling、hallmark_heme_metabolism、hallmark_mitotic_spindle、hallmark_notch_signaling、hallmark_oxidative_phosphorylation、hallmark_peroxisome、hallmark_pi3k_akt_mtor_signaling、hallmark_protein_secretion、hallmark_spermatogenesis、hallmark_unfolded_protein_response、hallmark_uv_response_dn、hallmark_xenobiotic_metabolism、immunophenoscore_1_cp、immunophenoscore_1_ctla.4、immunophenoscore_1_ido1、immunophenoscore_1_lag3、immunophenoscore_1_pd.1、immunophenoscore_1_pd.l2、immunophenoscore_1_tem.cd4、immunophenoscore_1_tigit、kegg_mismatch_repair、kegg_non_homologous_end_joining、kegg_nucleotide_excision_repair、long2011_1、nelson_2016_ar_1、pam50_luminala、pca_vs_mibc_1、race_1、ragnum2015_1以及它们的组合。
[0444]
实施方案22是根据实施方案21所述的方法,其中所述第二类共调控标记中的所述至少一种标记包括hallmark_cholesterol_homeostasis。
[0445]
实施方案23是根据实施方案1至22中任一项所述的方法,其中确定所述生物样本的所述第三类共调控标记中的至少一种标记的表达降低。
[0446]
实施方案24是根据实施方案23所述的方法,其中所述第三类共调控标记中的所述至少一种标记选自:ars_1、beltran2016_1、dasatinib_sens_1、estimate2013_2_purity、hallmark_apical_junction、hallmark_apoptosis、hallmark_coagulation、hallmark_epithelial_mesenchymal_transition、hallmark_estrogen_response_early、hallmark_estrogen_response_late、hallmark_hypoxia、hallmark_kras_signaling_dn、hallmark_myogenesis、hallmark_p53_pathway、hallmark_pancreas_beta_cells、hallmark_
reactive_oxigen_species_pathway、hallmark_tgf_beta_signaling、hallmark_tnfa_signaling_via_nfkb、hallmark_uv_response_up、hallmark_wnt_beta_catenin_signaling、immunophenoscore_1_icos、immunophenoscore_1_mdsc、immunophenoscore_1_pd.l1、immunophenoscore_1_sc、immunophenoscore_1_tim3、immunophenoscore_1_treg、kegg_base_excision_repair、kegg_homologous_recombination、lotan2016_1、neg_ctrl_qc、nelson2016_1、pam50_basal、portos_1、portos_2、rbloss_1、smallcell_1、smallcell_2、smallcell_3、torresroca2009_1、zhang2016_basal_1以及它们的组合。
[0447]
实施方案25是根据实施方案24所述的方法,其中所述第三类共调控标记中的所述至少一种标记包括beltran2016_1。
[0448]
实施方案26是根据实施方案1至25中任一项所述的方法,其中确定所述生物样本的所述第四类共调控标记中的至少一种标记的表达增加。
[0449]
实施方案27是根据实施方案26所述的方法,其中所述第四类共调控标记中的所述至少一种标记选自:estimate2013_2_estimate、estimate2013_2_immune、estimate2013_2_stromal、hallmark_allograft_rejection、hallmark_angiogenesis、hallmark_complement、hallmark_il2_jak_stat5_signaling、hallmark_il6_jak_stat3_signaling、hallmark_inflammatory_response、hallmark_interferon_alpha_response、hallmark_interferon_gamma_response、hallmark_kras_signaling_up、immunophenoscore_1_act.cd4、immunophenoscore_1_act.cd8、immunophenoscore_1_b2m、immunophenoscore_1_cd27、immunophenoscore_1_ec、immunophenoscore_1_hla.a、immunophenoscore_1_hla.b、immunophenoscore_1_hla.c、immunophenoscore_1_hla.dpa1、immunophenoscore_1_hla.dpb1、immunophenoscore_1_hla.e、immunophenoscore_1_hla.f、immunophenoscore_1_ips、immunophenoscore_1_ips.raw、immunophenoscore_1_mhc、immunophenoscore_1_tap1、immunophenoscore_1_tap2、immunophenoscore_1_tem.cd8以及它们的组合。
[0450]
实施方案28是根据实施方案27所述的方法,其中所述第四类共调控标记中的所述至少一种标记包括hallmark_il2_jak_stat5_signaling。
[0451]
本发明的以下实施例旨在进一步说明本发明的性质。应当理解,以下实施例不限制本发明,并且本发明的范围由所附权利要求书确定。
[0452]
实施例
[0453]
nmcrpc是已对雄激素剥夺疗法(adt)产生耐药性的非转移性前列腺癌(scher hi等人,j clin oncol.34:1402
‑
18(2016))。前列腺特异性抗原倍增时间(psadt)<8
‑
10个月的nmcrpc患者发生转移性疾病和前列腺癌特异性死亡的风险显著,并且三分之一的nmcrpc患者在2年内发生骨转移性疾病(smith mr等人,j clin oncol.31:3800
‑
06(2013))。已表明,将雄激素受体抑制剂(ari)阿帕鲁胺(apa)、恩杂鲁胺和达罗鲁胺加入持续性adt改善了nmcrpc的结果(smith mr等人,n engl j med.378:1408
‑
18(2018);hussain m等人,n engl j med.378:2465
‑
74(2018);fizazi k等人,n engl j med.380:1235
‑
46(2019))。与其他ari一样,apa抑制雄激素受体(ar)核转位,抑制dna结合,并阻碍ar介导的转录(clegg nj等人,cancer res.72:1494
‑
1503(2012))。
[0454]
spartan临床试验用于评估阿帕鲁胺(apa)在患有高风险非转移性去势抵抗性前列腺癌(nmcrpc)的成年男性中的有效性和安全性。参见smith等人,n engl j med 378:
1408
‑
18(2018)。
[0455]
基底亚型和管腔亚型代表前列腺癌中的两种生物学上不同的群体。管腔和基底细胞均包括可引起前列腺癌的自我维持的谱系(choi n等人,cancer cell 21(2):253
‑
65(2012))。与局部疾病相比,基底样亚型在转移中富集(图1a)。成年鼠前列腺基底和管腔细胞是自我维持的谱系,均可用作前列腺癌起始的靶标(choi n等人,cancer cell 21(2):253
‑
65(2012))。基底亚型和管腔亚型代表源自不同谱系依赖性分化的两种不同表型(wang和shen,cell rep.8:1339
‑
46(2014),参见例如图1)。分化良好的管腔样细胞表达雄激素受体并且是激素依赖性的,而未分化的或分化不良的基底样细胞更像干细胞并且对激素不太敏感(wang和shen,cell rep.8:1339
‑
46(2014))。图1b示出了前列腺中的管腔亚型和基底亚型之间的功能差异。
[0456]
如图2和图3所示,在使用相同的基因标记但与用于前列腺癌的平台不同的平台的pam50乳腺癌预后基因标记测定(guiu等人,ann oncol 23(12):2997
‑
3006(2012))和zhang(zhao sg等人,jama oncol.3:1663
‑
72(2017))中报道的基底样分子亚型的频率在spartan试验nmcrpc队列中具有大于90%的重叠,并且基底样肿瘤在该队列中富集。虽然基因标记与的测定相同,但本文的数据使用的huex阵列生成。管腔b肿瘤在用adt(无adt作为对照)治疗时预后较好;并且基底和管腔a肿瘤在用adt(无adt作为对照)治疗时预后较差(zhao sg等人,jama oncol.3:1663
‑
72(2017))。如图4所示,在spartan队列中,与基底样肿瘤(25.6个月)相比,管腔样肿瘤的转移时间更长(未达到)。已表明,基底样和管腔a亚型对adt具有抗性,并且pam50和zhang两者的基底亚型与对adt的临床反应不良相关联,并且管腔b亚型(pam50)对adt具有选择性敏感性(zhao sg等人,jama oncol.3:1663
‑
72(2017),图4a和图4b;和zhang等人,nature communications 7:10798(2016),图4o(格里森评分分析))。
[0457]
实施例1:在spartan试验中鉴定nmcrpc患者对阿帕鲁胺反应的分子决定子
[0458]
引言
[0459]
与前列腺特异性抗原(psa)倍增时间(pdadt)较长的患者相比,psa快速升高(即pdadt≤10个月)的非转移性去势抵抗性前列腺癌(nmcrpc)患者发生远处转移的风险高并且临床结果较差(smith mr等人,j clin oncol.23:2918
‑
25(2005);smith mr等人,cancer 117:2077
‑
85(2011);smith mr等人,lancet 379:39
‑
46(2012))。延迟转移可改善结果并降低伴随疾病进展的发病率和死亡率(small ej等人,genitourinary cancers symposium,abstract 161(february 8
‑
10,2018,san francisco,ca);lin jh等人,j clin oncol.35(15suppl).abstract e16525(2017))。
[0460]
阿帕鲁胺(apa)是强效的下一代雄激素受体(ar)抑制剂,其防止ar的核转位和ar介导的信号传导途径的激活(clegg nj等人,cancer res.72:1494
‑
1503(2012))。在spartan研究中,相比于安慰剂(pbo) adt(small ej等人,genitourinary cancers symposium,abstract 161(february 8
‑
10,2018,san francisco,ca);smith mr等人,n engl j med.378:1408
‑
18(2018)),向雄激素剥夺疗法(adt)中加入apa改善了患有高风险nmcrpc的男性的无转移生存期(mfs)(smith mr等人,n engl j med.378:1408
‑
18(2018))。
[0461]
—apa adt的中值mfs(主要终点)为40.5个月,而pbo adt的中值mfs为16.2个月
(hr,0.28;95%ci,0.23
‑
0.35;p<0.0001)。
[0462]
在spartan中,apa adt的改善在所有次要和探索性终点中是一致的(small ej等人,genitourinary cancers symposium:abstract 161(february 8
‑
10,2018,san francisco,ca);smith mr等人,n engl j med.378:1408
‑
18(2018)),包括以下项的延迟:
[0463]
—无进展生存期(pfs)(hr,0.29;95%ci,0.24
‑
0.36;p<0.0001);
[0464]
—症状进展时间(hr,0.45;95%ci,0.32
‑
0.63;p<0.0001);
[0465]
—第二次无进展生存期(pfs2)(hr,0.49;95%ci,0.36
‑
0.66;p<0.0001)。
[0466]
与基线相比,spartan患者的mfs改善并不伴随生活质量的下降。(saad f等人,lancet oncol.19:1404
‑
16(2018))。
[0467]
apa是第一个基于mfs的主要终点批准用于nmcrpc的药物(lawrence wt等人,j urol.6:1264
‑
72(2018))。
[0468]
若干分子标记经验证可用于预测前列腺癌的转移和疾病侵蚀性(karnes rj等人,j urol.190:2047
‑
53(2013);zhang等人,nat commun.7:10718(2016);zhao sg等人,jama oncol.3:1663
‑
72(2017)),包括:
[0469]
—基于22标志物mrna的基因组分类器(gc),已表明其预测(karnes rj等人,j urol.190:2047
‑
53(2013)):
[0470]
·
高转移风险(>0.6的高gc评分)。
[0471]
·
低至中等转移风险(≤0.6低至平均gc评分)。
[0472]
—管腔或基底亚型,已表明其预测对adt的反应(zhao sg等人,jama oncol.3:1663
‑
72(2017)):
[0473]
·
管腔b亚型与对adt的敏感性相关联。
[0474]
·
管腔a和基底亚型对adt的反应性可能较低。
[0475]
基于肿瘤生物学的疗法的个性化可用于指导apa联合治疗策略。
[0476]
目标
[0477]
来自nmcrpc的患者的该全转录组分析的目标是评估对apa adt的反应或抗性的潜在预测因子并定义高风险患者群体。
[0478]
方法
[0479]
spartan(nct01946204)是多中心、双盲、随机化(2:1)、安慰剂对照临床试验,其中1207名nmcrpc患者被随机分配(2:1),以每天一次240mg的剂量口服接受(n=806)或每天一次接受安慰剂(n=401)。spartan试验中的所有患者均接受伴随的促性腺激素释放激素(gnrh)类似物或进行双侧睾丸切除术。患者按前列腺特异性抗原(psa)倍增时间(psadt)、骨保护剂的使用和局部疾病进行分层。要求患者的psadt≤10个月,并且通过盲化独立中心评审(bicr)确认非转移性疾病。psa结果是盲的,并且不用于治疗中止。随机分配到任一组的患者因为通过bicr确认的放射影像学疾病进展、仅限于局部的进展、新治疗开始、不可接受的毒性或戒断而中止治疗。以下患者人口统计和基线疾病特征在治疗组之间取得平衡。中值年龄为74岁(范围48
‑
97岁),并且26%的患者为80岁或以上。种族分布为66%白人、12%亚洲人和6%黑人。两个治疗组中百分之七十七(77%)的患者先前接受过前列腺的外科手术或放射疗法。大多数患者具有7或更高的格里森评分(78%)。在sspan队列中,apa治疗与显著更长的mfs相关联(参见例如smith mr等人,n engl j med.378:1408
‑
18
(2018),图1a)。
[0480]
spartan患者的子集提供了存档的福尔马林固定石蜡包埋肿瘤块或切片,用于探索性生物标志物分析。对340个样本进行了分析,其中107个样本未能满足qc验收标准,233个样本被纳入本分析中(生物标志物群体)(图5)。
[0481]
进行了前列腺测试,其为一种可商购获得的基因组测定(加利福尼亚州圣地亚哥市decipher biosciences,inc.)。按decipher gc评分以及基底样/管腔样亚型对分析样本进行分层。
[0482]
为了确定基底样或管腔样亚型,评估100个基因的子集的表达。
[0483]
—基于先前定义和验证的基因标记和截止值将肿瘤分层为基底样或管腔样(zhang等人,nat commun.7:10718(2016))。
[0484]
—使用t检验鉴定差异表达的基因,其中调整/未调整的p值为0.05。
[0485]
—将基因表达总结为以中值为中心(单个基因表达减去中值)并除以标准偏差。
[0486]
使用cox比例风险模型评估gc评分或基底样/管腔样亚型与mfs和pfs2之间的关联。由于在用apa adt治疗的管腔样亚型的患者子集中缺乏pfs2事件,因此每当该子集参与分析时,使用log
‑
rank检验来评估pfs2与亚型和治疗组的关联。
[0487]
—mfs被定义为从随机化到首次出现发射学上可检测的骨或软组织远处转移或因任何原因导致的死亡(以先发生者为准)的时间。
[0488]
—pfs2被定义为从随机化到第一次后续抗癌治疗中研究者评估的疾病进展或第二次后续抗癌治疗开始前任何原因的死亡(以先发生者为准)的时间。
[0489]
结果
[0490]
患者群体
[0491]
纳入spartan生物标志物群体中的患者具有侵蚀性疾病特征(表1)。
[0492]
表1.生物标志物群体中患者的特征(n=233)
[0493][0494]
在spartan试验中具有管腔(lu)样肿瘤与基底(ba)样肿瘤的nmcrpc患者对apa的反应
[0495]
相对于管腔(lu)样肿瘤和基底(ba)样肿瘤而言,分析了spartan临床试验中与单独的adt相比对apa和adt的益处。共评估了233名患者。大约65%的患者(n=151)具有与不良预后相关联的ba亚型,表明nmcrpc具有高风险性质。(参见例如zhao sg等人,jama oncol.3:1663
‑
72(2017),图4a和图4b;和zhang等人,nature communications 7:10798(2016),图4o(格里森评分分析))。与nmcrpc中的ba亚型相关联的关键生物途径是神经内分泌分化、上皮间质转化、血管生成和炎症。
[0496]
在这两组中,生物标志物群体中具有基底样亚型(65%,n=151)的患者多于管腔样亚型(35%,n=82)(组合管腔a或b)。总体而言,30%的患者具有管腔b亚型,5%的患者具有管腔a亚型。
[0497]
在spartan中,基底样亚型和管腔样亚型的分布不同于先前的一项研究中所述的分布,该研究对来自按pam50(华盛顿州西雅图市nanostring technologies,inc.)分类的基底亚型、管腔亚型a和管腔亚型b的比例大致相等,侵蚀性较低的局限性疾病患者的3782个样本进行分析(zhao sg等人,jama oncol.3:1663
‑
72(2017))。
[0498]
spartan中基底样和管腔(a或b)亚型中差异表达的基因在图6中示出。
[0499]
具有lu亚型(已知对adt敏感)和ba亚型(通常对adt有抗性)的患者受益于apa adt与单独的adt:lu的无转移生存期(mfs)的风险比(hr(95ci))=0.22(0.08,0.56),p=0.0017,并且ba的mfs的hr(95ci)=0.34(0.20,0.58),p=0.0001(图7a和图7b)。具有基底
样亚型和管腔样亚型的患者在向adt中加入apa后mfs延长(图7a和图7b)。
[0500]
在用单独的adt(pbo adt,n=79)治疗的患者中,mfs在亚型(基底样与管腔样)方面无差异:lu与ba亚型mfs的hr(95ci)为0.66(0.08,1.2),p=0.227(图8a)。在用apa adt(n=154)治疗的患者中,与具有基底样亚型的患者相比,具有管腔样亚型的患者具有显著更大的mfs益处:lu与ba亚型mfs的hr为0.40,p=0.030(图8b)。
[0501]
在第二次无进展生存期(pfs2)中也观察到类似的益处。在用apa adt治疗相比于用pbo adt治疗的情况下,具有管腔样亚型的患者还具有显著提高的pfs2(hr(95ci),0.35(0.16,0.79);p=0.0113)(图9a)。在用apa adt治疗相比于用pbo adt治疗的情况下,具有基底样亚型的患者具有显著提高的pfs2(hr(95ci),0.45(0.26,0.78);p=0.0043)(图9b)。在adt组中,具有管腔样亚型的患者与具有基底样亚型的患者相比具有提高的pfs2(hr(95ci),0.72(0.36,1.42);p=0.3415)(图9c)。在apa adt组中,具有管腔样亚型的患者与具有基底样亚型的患者相比具有提高的pfs2(hr(95ci),0.62(0.32,1.21);p=0.1601)(图9d)。
[0502]
来自基因组资源信息数据库(grid)的途径与基底样分子亚型的关联也使用多变量分析进行评估,并且结果在图10中示出。
[0503]
综上所述,基底样亚型和管腔样亚型代表前列腺癌中的两种生物学上不同的群体。基底样亚型在spartan试验中富集(65%),并且在用adt治疗时预后更差,而管腔样亚型受益于adt治疗。在spartan试验中,这两种亚型均受益于apa adt。基底样亚型代表adt不足并因此需要apa的“需求未得到满足的群体”。进一步分层允许将策略与apa组合以改善结果。与单独的adt相比,管腔样肿瘤显示出对apa adt的持续益处(即mfs和pfs2),并且与单独的adt相比,基底样肿瘤显示出对apa adt的持续益处(mfs、pfs2)。与基底样亚型相比,管腔样亚型显示出对apa adt的最大益处(mfs)。
[0504]
在spartan试验中具有高风险和低至平均风险gc的nmcrpc患者对apa的反应
[0505]
spartan研究最近证明,向adt中加入apa提高了nmcrpc患者的无转移生存期(mfs)和第二次无进展生存期(pfs2)。对来自spartan患者的可用原发性肿瘤样本进行全转录组谱分析,以评估对apa adt的反应或抗性的预测因子。使用可商购获得的基因组测定(前列腺测试,加利福尼亚州圣地亚哥市decipher biosciences,inc.)来评估来自spartan患者的存档的原发性肿瘤中的基因表达。gc(基于22标志物mrna的分类器)经验证可用于预测转移性前列腺癌(karnes rj等人,j urol.190:2047
‑
53(2013))(图11),并且ba/lu亚型划分在前列腺癌中得到了验证(zhao sg等人,jama oncol.3:1663
‑
72(2017);zhang等人,nature communications 7:10798(2016))。分别基于基因组分类器(gc)高评分(gc>0.6)和低至平均评分(gc≤0.6),将患者分层为发生转移风险高和发生转移风险低,并且分层为ba和lu亚型。还评估了与ba亚型相关联的代表关键生物途径的基因标记。使用cox比例风险模型评估gc评分与亚型和结果之间的关联。
[0506]
共评估了233名患者。在这些治疗组中,生物标志物群体中高风险和低至平均风险患者的比例相似:50.2%(n=117)具有高风险,并且49.8%(n=116)具有低至平均风险。gc
评分亚组在治疗组之间平衡良好(表1)。
[0507]
在pbo adt组的患者中,与低至平均gc评分相比,高gc评分与显著更短的mfs时间相关联(图12a)。向adt中加入apa导致所有患者的mfs延长,并克服了高gc评分风险的增加(图12b)。
[0508]
在用apa adt治疗的情况下,高和低至平均decipher gc评分患者均具有改善的结果(图13a和图13b)。具有高gc评分的患者的mfs的益处幅度高于具有低至平均gc评分的患者。在用apt治疗相比于用adt治疗的情况下,预后差的高gc评分患者具有提高的mfs(hr(95ci)=0.21(0.11,0.40),p<0.0001)(图13a),表明apa克服了这些患者中的阴性预后。
[0509]
pbo adt组中的中值pfs2在高gc评分亚组中为25.1个月,而在低至平均gc评分亚组中为29.7个月(hr,0.47;p=0.198)。在高gc亚组和低至平均gc亚组中未达到apa adt组中的中值pfs2(hr,0.29;p=0.128)。在用apa adt治疗相比于用pbo adt治疗的情况下,具有高gc评分的患者具有显著更长的pfs2:相比于25.1个月,未达到中值pfs2(hr,0.26;p=0.008)。在用apa adt治疗相比于用adt治疗的情况下,预后差的高gc评分患者具有提高的pfs2(hr=0.26,p=0.0084),表明apa克服了这些患者中的阴性预后。
[0510]
从kaplan
‑
meier曲线中的清晰分离可以看出,相比于pbo adt(中值pfs2,29.7个月),用apa adt治疗提高了具有低至平均decipher gc评分(中值pfs2,nr)的患者的pfs2,但差异未达到统计学意义(hr,0.18;p=0.054)。在用apa adt治疗相比于用adt治疗的情况下,预后差的高gc评分患者具有提高的mfs(hr=0.21,p<0.0001)和pfs2(hr=0.26,p=0.0084),表明apa克服了这些患者中的阴性预后。
[0511]
结论
[0512]
在高风险spartan nmcrpc患者中,大约三分之二具有与adt抗性相关联的基底样亚型,三分之一具有管腔b亚型,少数具有管腔a亚型。spartan生物标志物群体中的大多数患者具有基底样亚型(65%),该亚型与侵蚀性疾病相关联并且通常对雄激素剥夺无反应。
[0513]
无论分子亚型如何,所有患者均受益于向adt中加入apa。在具有管腔样亚型的患者中用apa adt治疗的益处幅度大于在具有基底样亚型的患者中用apa adt治疗的益处幅度。按基底样/管腔样标记进行的亚型划分可以是临床研究中患者选择的有效方法。
[0514]
具有基底样和管腔样亚型的患者受益于向持续性adt中加入apa;然而,在具有管腔样亚型的患者中用apa治疗的益处显著大于在具有基底样亚型的患者中用apa治疗的益处。向adt中加入apa克服了基底样亚型对adt的不敏感性。
[0515]
spartan生物标志物群体中的一半患有nmcrpc的男性具有高gc评分,表明具有侵蚀性疾病并且发生转移风险高。无论gc评分如何,所有患者均受益于向adt中加入apa。在具有高gc评分和最大风险的患者中用apa adt治疗的益处幅度最大。高gc评分可用于鉴定患者的早期强化治疗和apa联合治疗策略。
[0516]
具有gc评分和基底样亚型的患者对于治疗的需求尚未得到满足;本文所公开的结果表明,尽管这些患者的进展风险高,但他们仍可受益于向adt中加入apa。
[0517]
分子标志诸如gc和ba/lu亚型鉴定尽管发生转移风险高但仍受益
于apa adt的nmcrpc患者。gc可用于鉴定用apa或其他药剂进行早期强化治疗的患者,并且ba/lu亚型划分是结合新型疗法与apa的试验中患者选择的有效方法。gc高评分患者代表adt不足从而迫切需要立即使用apa进行治疗的侵蚀性需求未得到满足的群体。
[0518]
表2和表3汇总了实施例1的结果。
[0519]
表2.在spartan研究中adt和apa adt治疗患者的个体治疗组的治疗效果
[0520]
高gc评分相比于低至平均gc评分以及ba亚型相比于lu亚型
[0521][0522]
表3.在spartan研究中adt和apa adt治疗患者的生物标志物亚型的治疗效果
[0523]
高gc评分相比于低至平均gc评分以及ba亚型相比于lu亚型
[0524][0525]
实施例2:阿帕鲁胺(apa)在不同基因表达亚类中对雄激素剥夺疗法(adt)的影响
[0526]
目标
[0527]
本研究的一个目标是表征前列腺癌并指导新型治疗策略,包括:(1)将160个预先定义的转录组标记聚类成生物共调控的类别;(2)评估每个类别中这些标记的预后和预测值;以及(3)基于标记表达评估apa adt的差异治疗效果。本研究的另一个目标是基于所有生物类别中标记的表达来定义新型联合治疗策略。
[0528]
方法
[0529]
对spartan试验数据进行了研究。将患者以2:1的比率随机分配,以接受阿帕鲁胺
(240mg/天)或安慰剂。所有患者继续接受雄激素剥夺疗法。主要终点是无转移生存期,其被定义为从随机化到影像学上首次检测到远处转移或死亡的时间(smith mr等人,n engl j med.378:1408
‑
18(2018))。
[0530]
spartan患者的子集(n=233)提供了存档的福尔马林固定石蜡包埋肿瘤样本(块或切片),用于探索性生物标志物分析(图14a至图14k)。基因表达谱由decipher biosciences(加利福尼亚州圣地亚哥市decipher biosciences,inc.)使用人外显子1.0阵列平台生成。进行数据归一化以识别标记之间的相关性。具体地讲,将标记从最低评分到最高评分排序。通过求并列元素的平均值来分配并列值(tie),例如,(1,2,3,3,4,5)=(1,2,3.5,3.5,5,6)。转置分级标记并进行分位数归一化(图14c至图14e)。
[0531]
总结了基因表达谱以评估指示临床预后和前列腺癌相关生物学的160个预先定义的基因表达标记(来源于文献)。共有聚类用于鉴定四组生物共调控的基因表达标记。具体地讲,通过使用r文库consensusclusterplus(wilkerson和hayes,bioinformatics 2010;26(12):1572
‑
73),采用以下参数:hclust方法,80%二次采样,1000次迭代,平均连接,皮尔逊距离来分配类别。考虑到经验累积分布下面积的相对变化来选择聚类的数量(k=4)(图14f)。使用相同的方法在样本中寻找聚类。将标记聚类和样本聚类组合以寻找与不同标记相关联的患者子集。高表达和低表达的截止值由标记的中值归一化表达定义。
[0532]
评估基因表达标记的表达和治疗结果之间的关联和相互作用基于每种表达标记,将患者分层为高表达组和低表达组。kaplan
‑
meier分析用于评估高表达组与低表达组的转移时间。cox比例风险模型用于研究转移的相对风险与表达之间的关联。
[0533]
结果
[0534]
无监督聚类鉴定了四类共调控标记。每个类别主要由具有共同临床意义和/或生物学功能的标记组成。第一类(c1)代表预后相关的标记(表4);第二类(c2)代表类固醇稳态相关的标记(表5);第三类(c3)代表激素疗法无反应的基底和神经内分泌样标记(表6);并且第四类(c4)代表免疫和基质标记(表7)。对来自每个类别的代表性标记(rs)与每个治疗组内的反应的关联进行了评估。
[0535]
第一类:预后相关的标记(24.38%)
[0536]
第一类预后相关的标记(风险)列于表4中。代表性的标记包括decipher、管腔b、格里森分级评分、capra、psa复发、pca中的侵蚀性、转移、pten丢失、mtorc信号传导和pam50
‑
管腔b。
[0537]
在治疗组之间,高表达子和低表达子的比例相似:50%(n=117)具有高表达(中值及高于中值),并且50%(n=116)具有低表达(低于中值)。截止值为0.49。
[0538]
向adt中加入apa导致所有患者的mfs延长,并且克服了genomic_gleason_grade_2(代表性的第一类标记)的高表达风险的增加。genomic_gleason_grade_2的表达增加预测转移风险较高(hr=2.98,p=0.002),用adt治疗的预后较差(hr:[95%ci],2.18,1.11
‑
4.28,p=0.0241),并且用apa adt治疗的改善益处较大(hr:[95%ci],0.81,0.43
‑
1.56,p=0.5337)(图15a和图15b)。
[0539]
与用adt治疗相比,genomic_gleason_grade_2的高表达子和低表达子用apa adt治疗均具有改善的结果。具有genomic_gleason_grade_2的高表达与低表达的患者的mfs分别为(hr:[95%ci],0.19,0.10
‑
0.37,p<0.0001)和(hr:[95%ci],0.53,0.26
‑
1.07,p=
0.0772)(图15c和图15d),表明apa克服了高风险患者的阴性预后。
[0540]
图15e示出了genomic_gleason_grade_2的表达与治疗组的相对风险的关联。pbo组中的相对风险随着标记表达的增加而增长。apa组中的相对风险保持恒定,即使当标记的表达增加时也是如此。
[0541]
治疗效果为(hr:[95%ci],0.71,0.27
‑
1.86,p=0.4921),genomic_gleason_grade_2的效果为(hr:[95%ci],2.98,1.50
‑
5.96,p=0.0019),并且治疗效果和genomic_gleason_grade_2的效果之间的相互作用为(hr:[95%ci],0.36,0.13
‑
0.95,p=0.0390)。
[0542]
第二类:类固醇稳态相关的标记(31.87%)
[0543]
第二类类固醇稳态相关的标记(类固醇稳态)列于表5中。代表性的标记包括胆固醇稳态、管腔a、gr活性、多西他赛敏感性、arv7活性、ar活性、erg
、脂肪生成、血管生成和dna修复。
[0544]
在治疗组之间,高表达子和低表达子的比例相似:50%(n=117)具有高表达(中值及高于中值),并且50%(n=116)具有低表达(低于中值)。截止值为0.25。
[0545]
向adt中加入apa导致所有患者的mfs延长,并且克服了hallmark_cholesterol_homeostasis(代表性的第二类标记)的高表达风险的增加。hallmark_cholesterol_homeostasis的表达增加预测转移风险较高(hr:[95%ci],0.57,0.35
‑
0.92,p=0.02),用adt治疗的预后较差(hr:[95%ci],1.31,0.68
‑
2.51,p=0.4191),并且用apa adt治疗的改善益处较大(hr:[95%ci],0.86,0.45
‑
1.64,p=0.6382)(图16a和图16b)。
[0546]
与用adt治疗相比,hallmark_cholesterol_homeostasis的高表达子和低表达子用apa adt治疗均具有改善的结果。具有第二类标记的高表达与低表达的患者的mfs分别为(hr:[95%ci],0.21,0.11
‑
0.43,p<0.0001)和(hr:[95%ci],0.42,0.22
‑
0.79,p=0.0077)(图16c和图16d),表明apa克服了高风险患者的阴性预后。
[0547]
图16e示出了hallmark_cholesterol_homeostasis的表达与治疗组的相对风险的关联。pbo组中的相对风险随着标记表达的增加而增长。apa组中的相对风险随着标记表达的增加而降低。
[0548]
治疗效果为(hr:[95%ci],0.48,0.26
‑
0.88,p=0.0178),hallmark_cholesterol_homeostasis的效果为(hr:[95%ci],1.42,1.02
‑
1.98,p=0.0402),并且治疗效果和hallmark_cholesterol_homeostasis的效果之间的相互作用为(hr:[95%ci],0.57,0.35
‑
0.93,p=0.0232)。
[0549]
第三类:激素疗法无反应的基底和神经内分泌样标记(25%)
[0550]
第三类激素疗法无反应的基底和神经内分泌样标记(神经内分泌基底)列于表6中。代表性的标记包括rb丢失状态、p53丢失、pam50
‑
基底、beltran
‑
nepc、放射疗法反应、小细胞癌、wnt
‑
b连环蛋白、缺氧和巨噬细胞。
[0551]
在治疗组之间,高表达子和低表达子的比例相似:50%(n=117)具有高表达(中值及高于中值),并且50%(n=116)具有低表达(低于中值)。截止值为
‑
0.44。
[0552]
大约27%的spartan生物标志物肿瘤是分子ne亚型(beltran等人,divergent clonal evolution of castration
‑
resistant neuroendocrine prostate cancer,nat med.2016;22(3)298
‑
305)。
[0553]
向adt中加入apa导致所有患者的mfs延长。beltran2016_1(代表性的第三类标记)
的表达增加分别预测用adt治疗的预后(hr:[95%ci],1.58,0.82
‑
3.04,p=0.1755)和用apa adt治疗的预后(hr:[95%ci],0.97,0.51
‑
1.86,p=0.9379)(图17a和图17b)。
[0554]
具有beltran2016_1的高表达(腺癌)的患者受益于apa adt(hr:[95%ci],0.41,0.21
‑
0.81,p=0.0106)。当用apa adt治疗时,beltran2016_1的低表达子(具有ne样特征的腺癌)也显示出较低的风险(hr:[95%ci],0.25,0.13
‑
0.47,p<0.0001)(图17c和图17d)。
[0555]
图17e示出了beltran2016_1的表达与治疗组的相对风险的关联。pbo组中的相对风险随着标记表达的增加而降低。apa组中的相对风险保持恒定,而无论标记表达如何。
[0556]
治疗效果为(hr=0.9540(0.05,15.65),p=0.92),beltran2016_1的效果为(hr=0.9854(0.63,1.61),p=1.00),并且治疗效果与beltran2016_1的效果之间的相互作用为(hr=0.4488(0.69,2.32),p=1.26)。
[0557]
第四类:免疫和底物il2/il
‑6‑
jak
‑
stat5标记(19%)
[0558]
第四类免疫和底物il2/il
‑6‑
jak
‑
stat5标记(基质/免疫的)列于表7中。代表性的标记包括il2
‑
jak
‑
stat5信号传导、il6
‑
jak
‑
stat3信号传导、炎症反应、干扰素γ(ifg)反应、干扰素α(ifa)反应和同种异体移植物排斥。
[0559]
第四类标记是基质/免疫的,这意味着该类别中的大多数标记与免疫系统相关。hallmark基因集不能与该术语互换,因为hallmark相关的标记与癌症生物学的不同方面相关联,而不仅仅是免疫相关的。
[0560]
hallmark基因集汇总并代表特定明确的生物状态或过程,并且显示出连贯的表达。这些基因集通过基于鉴定显示出协同表达的基因集重叠和保留的计算方法生成(liberzon a等人,the molecular signatures database(msigdb)hallmark gene set collection,cell syst 23;1(6):417
‑
25(2015))。
[0561]
衍生hallmark的初始重叠基因集被称为hallmark的“创始者”集。50个hallmark的集合将来自v4.0 msigdb集合c1至c6的超过4,000个初始重叠基因集的信息合并。hallmark降低噪音和冗余并为gsea提供更好的生物空间划分:参见http://software.broadinstitute.org/gsea/msigdb/collection_details.jsp。
[0562]
在治疗组之间,高表达子和低表达子的比例相似:50%(n=117)具有高表达(中值及高于中值),并且50%(n=116)具有低表达(低于中值)。截止值为
‑
0.42。
[0563]
第四类标记表达与预后无关联。然而,hallmark_il2_jak_stat5_signaling(代表性的第四类标记)的更高表达与apa adt患者(hr:[95%ci],0.43,0.21
‑
0.86,p=0.0180)相比于adt患者(hr:[95%ci],1.10,0.57
‑
2.11,p=0.7825)的更好结果相关联(图18a和图18b)。
[0564]
具有hallmark_il2_jak_stat5_signaling的低表达的患者受益于apa adt(hr:[95%ci],0.39,0.20
‑
0.74,p=0.0040)。当用apa adt治疗时,hallmark_il2_jak_stat5_signaling的高表达子也显示出较低的风险(hr:[95%ci],0.21,0.10
‑
0.43,p<0.0001)(图18c和图18d)。
[0565]
图18e示出了hallmark_il2_stat5_signaling的表达与治疗组的相对风险的关联。pbo组中的相对风险随着标记表达的增加而增长。apa组中的相对风险随标记表达的增加而快速降低。
[0566]
治疗效果为(hr:[95%ci],0.05,0.09
‑
0.32,p=0.0015),hallmark_il2_jak_
stat5_signaling的效果为(hr:[95%ci],0.55,0.35
‑
0.86,p=0.0082),并且治疗效果和hallmark_il2_jak_stat5_signaling的效果之间的相互作用为(hr:[95%ci],0.53,0.28
‑
0.98,p=0.0444)。因此,第四类标记与取决于apa adt治疗的结果相关联。
[0567]
结论
[0568]
当将apa adt与adt进行比较时,第一类标记(与安慰剂人类男性转移的风险增加相关联)和治疗之间的相互作用与结果显著相关联。类似地,显著的标记
‑
治疗相互作用也存在于第二类标记中。第三类标记与pbo组的较高的转移风险相关联,而无论水平表达如何。具有低表达(腺癌)的患者受益于apa adt,而当用apa adt治疗时,高表达子(具有ne样特征的腺癌)也显示出较低的风险。最后,在第四类基质标记中也观察到治疗和标记之间的相互作用效果(与用apa adt治疗的较高表达子人类男性的转移风险增加相关联)。
[0569]
这些结果基于生物学上不同的类别进一步对入组到spartan的临床高风险患者进行分层。与观察到的临床益处一致,本发现表明大多数患者受益于apa adt治疗。此外,结果鉴定了可能最受益于apa adt治疗的子集,诸如高风险、高类固醇生成和高基质亚型。
[0570]
本文引用的所有专利、已公布的专利申请和参考文献以及其他引用的教导内容全文以引用方式并入。
[0571]
虽然已经具体示出和描述了示例的实施方案,但是本领域的技术人员应当理解,在不脱离所附权利要求书所涵盖的实施方案的范围的前提下,可以在其中进行形式和细节上的各种改变。
[0572]
表4.第一类共调控标记
[0573]
[0574][0575]
表5.第二类共调控标记
[0576]
[0577][0578]
表6.第三类共调控标记
[0579]
[0580][0581]
表7.第四类共调控标记
[0582]
标记说明estimate2013_2_estimate肿瘤、免疫和基质含量estimate2013_2_immune肿瘤、免疫和基质含量estimate2013_2_stromal肿瘤、免疫和基质含量hallmark_allograft_rejection hallmark_angiogenesis hallmark_complement hallmark_il2_stat5_signaling hallmark_il6_jak_stat3_signaling hallmark_inflammatory_response hallmark_interferon_alpha_response hallmark_interferon_gamma_response hallmark_kras_signaling_up immunophenoscore_1_act.cd4肿瘤免疫原性immunophenoscore_1_act.cd8肿瘤免疫原性
immunophenoscore_1_b2m肿瘤免疫原性immunophenoscore_1_cd27肿瘤免疫原性immunophenoscore_1_ec肿瘤免疫原性immunophenoscore_1_hla.a肿瘤免疫原性immunophenoscore_1_hla.b肿瘤免疫原性immunophenoscore_1_hla.c肿瘤免疫原性immunophenoscore_1_hla.dpa1肿瘤免疫原性immunophenoscore_1_hla.dpb1肿瘤免疫原性immunophenoscore_1_hla.e肿瘤免疫原性immunophenoscore_1_hla.f肿瘤免疫原性immunophenoscore_1_ips肿瘤免疫原性immunophenoscore_1_ips.raw肿瘤免疫原性immunophenoscore_1_mhc肿瘤免疫原性immunophenoscore_1_tap1肿瘤免疫原性immunophenoscore_1_tap2肿瘤免疫原性immunophenoscore_1_tem.cd8肿瘤免疫原性
[0583]
表8.参考
[0584]
[0585]
[0586]
[0587]
[0588]
[0589]
[0590]
[0591]
[0592]
[0593]
[0594][0595]
v是指版本。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。