1.本发明涉及酶法应用技术领域,更具体地,涉及酶法制备壳寡糖及其在食品保鲜中的应用。
背景技术:
2.壳寡糖(chitosan oligosaccharide,cos)是一种由β
‑
1,4糖苷键连接n
‑
乙酰氨基葡萄糖和n
‑
氨基葡萄糖组成的多糖类物质,聚合度在2
‑
10之间,分子量≤3200u,是自然界中唯一带正电荷的寡糖。壳寡糖因具有抗氧化、抗菌等生物活性功能,因此,目前其在果蔬以及肉类生制品的保鲜应用取得一定的成效。
3.壳寡糖的制备方法主要分为物理、化学、酶解法三大类。酶解法具有无污染、产物得率高、产品均一性好、制备时间短等优点,克服了物理法效率低以及化学法污染环境的缺点,成为壳寡糖制备方法中的研究热点。目前可用于制备壳寡糖的酶主要有几丁质酶、壳聚糖酶、纤维素酶、脂肪酶和木瓜蛋白酶,其中几丁质酶和壳聚糖酶为专一性酶,较难获取且价格昂贵,而木瓜蛋白酶具有易于获取、稳定性好、价格低廉等优点,且降解效果较纤维素酶和脂肪酶好,因此具有巨大的研究潜力,且黄永春等通过计算机随机模拟试验证明木瓜蛋白酶能选择性作用于glcnac
‑
glcn糖苷键而对壳聚糖进行有效降解。目前壳寡糖的制备研究大多以产物的还原糖含量为检测指标,然而壳寡糖的抗菌抗氧化等生物活性功能却与其脱乙酰度和分子量息息相关,因此壳寡糖还原糖含量的高低并不代表其生物活性的强弱。
4.现有技术缺乏采用木瓜蛋白酶法制备高抗氧化活性壳寡糖的工艺。
技术实现要素:
5.本发明为了克服现有技术中存在的上述缺陷,首先提供了酶法制备壳寡糖。
6.本发明的第二个目的是提供上述方法得到的壳寡糖。
7.本发明的第三个目是提供上述壳寡糖的应用。
8.本发明的目的通过以下技术方案实现:
9.一种利用木瓜蛋白酶制备壳寡糖的方法,以壳聚糖为原料,酶解条件为:酶底比为20%,酶解温度为47.74℃,酶解反应ph值为4.81,酶解反应时间为1h。
10.本研究以壳聚糖酶解产物的抗氧化活性为检测指标,以期探明木瓜蛋白酶法酶解条件的变化对壳聚糖酶解产物抗氧化活性的影响以及木瓜蛋白酶法制备抗氧化活性壳寡糖的工艺参数。
11.上述方法得到的壳寡糖的平均分子量为1603u,产率为45.07%
±
3.52%。
12.壳寡糖具有抗氧化、抗菌等生物活性功能而倍受关注并成为研究热点。近年来关于壳寡糖的抗氧化活性或产率的相关研究较多,现有技术以壳聚糖酶为反应酶,壳寡糖的产率为检测指标,通过正交试验得到产率最高的工艺条件,在该工艺条件下壳寡糖的产率为1.884%。本研究以价格低廉的木瓜蛋白酶为反应酶,更直观阐述壳寡糖的抗氧化能力,
以壳聚糖酶解物的抗氧化性为指标,打破传统仅用产量以评判其酶解工艺的方法,通过响应面优化得出最优酶解条件,在该条件下制得壳寡糖的平均分子量为1603u,获得的壳寡糖产率为45.07%
±
3.52%,远高于现有技术的研究结果,且生产成本较低。
13.然而相对于大多数使用木瓜蛋白酶对壳聚糖降解的研究而言,本工艺的酶底比高达20%远远超过前人研究的酶底比(10%),可能的原因是较低的酶底比使壳聚糖酶解不彻底,导致酶解产物平均分子量较高(约为7000
‑
9000u),达不到寡糖的程度。而本研究采用较高的酶底比使壳聚糖降解彻底,所得酶解产物的分子量为1603u以达到较高抗氧化活性壳寡糖的分子量。为了后续工业化生产,可采取固定化酶技术以节约成本,这有待进一步研究。
14.有报道使用纤维素酶水解壳聚糖,以制备抗氧化活性的壳寡糖乙酸盐,在ph5.6,50
±
10℃条件下水解时间达10h,本工艺仅酶解1h,大大缩减了生产时间,提高生产效率。也有报道使用木瓜蛋白酶水解脱乙酰度90%的壳聚糖,在ph 4.0、40℃条件下水解,所得壳寡糖的dpph自由基清除率的ic50在2.36
‑
2.71mg/ml,总还原力相当于14.0
‑
17.0μg/ml抗坏血酸,本研究工艺所得壳寡糖的抗氧化活性远高于上述研究结果。
15.因此,本发明还提供所述壳寡糖在发挥抗氧化活性功能中的应用。
16.作为一种优选的实施方式,本发明上述壳寡糖可以用于作为食品保鲜剂。
17.更具体的,上述应用可以是:将壳寡糖按照2%的比例添加到虾肉火腿肠中,用于抑制虾肉火腿肠中菌落生长速率。
18.与现有技术相比,本发明具有以下有益效果:
19.本研究采用木瓜蛋白酶法对壳聚糖进行降解,得到高抗氧化活性的壳寡糖,该壳寡糖的dpph自由基清除率ic
50
为1.86
±
0.10mg/ml,总还原力相当于39.44
±
2.94μg/ml抗坏血酸的还原能力。该壳寡糖的生产工艺为酶底比20%,酶解温度为47.74℃,酶解ph为4.81,酶解时间为1h。与同类产品相比,该生产工艺制备的壳寡糖产率更高(45.07%
±
3.52%),降解更彻底(平均分子量为1603u),时间更短(1h),抗氧化活性更强。因此,本研究可为抗氧化活性壳寡糖的研制提供理论参考。
附图说明
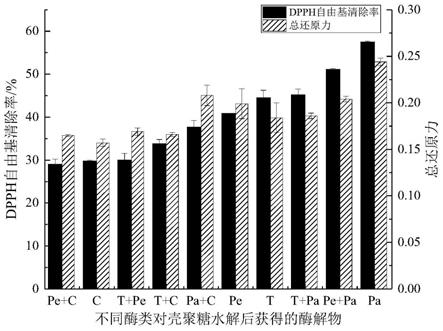
20.图1为木瓜蛋白酶与常见酶制备壳寡糖的抗氧化性比较;其中,pe为胃蛋白酶;c为壳聚糖酶;pa为木瓜蛋白酶;t为胰蛋白酶;
21.图2显示木瓜蛋白酶酶解参数对壳寡糖抗氧化活性的影响,其中图2a为酶底比对壳聚糖酶解物抗氧化活性的影响;图2b为反应温度对壳聚糖酶解物抗氧化活性的影响;图2c为反应时间对壳聚糖酶解物抗氧化活性的影响;图2d为反应ph对壳聚糖酶解物抗氧化活性的影响;
22.图3为木瓜蛋白酶酶解条件优化的响应面三维图;其中,图3a为温度和ph值的交互作用对壳聚糖酶解物dpph自由基清除率的影响;图3b为温度和时间的交互作用对壳聚糖酶解物dpph自由基清除率的影响;图3c为ph值和时间的交互作用对壳聚糖酶解物dpph自由基清除率的影响;图3d为温度和ph值的交互作用对壳聚糖酶解物总还原力的影响;图3e为温度和时间的交互作用对壳聚糖酶解物总还原力的影响;图3f为ph值和时间的交互作用对壳聚糖酶解物总还原力的影响;
23.图4为添加不同剂量壳寡糖对虾肉火腿肠(25℃恒温贮藏过程中)菌落总数的影响;
24.图5为添加不同剂量壳寡糖对虾肉火腿肠(4℃恒温贮藏过程中)菌落总数的影响。
具体实施方式
25.下面对本发明的具体实施方式作进一步说明。在此需要说明的是,对于这些实施方式的说明用于帮助理解本发明,但并不构成对本发明的限定。此外,下面所描述的本发明各个实施方式中所涉及的技术特征只要彼此之间未构成冲突就可以相互组合。
26.下述实验例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
27.实施例1木瓜蛋白酶法与常见酶法制备壳寡糖的抗氧化特性研究
28.一、木瓜蛋白酶与其他常见酶类对壳聚糖的酶解能力比较
29.将2g壳聚糖溶于0.05mol/l ph5.6的醋酸
‑
醋酸钠缓冲溶液中,用0.2mol/l盐酸将ph值调至4.5,定容至100ml,分别加入(木瓜蛋白酶、胃蛋白酶、胰蛋白酶、壳聚糖酶,以及两酶分别组合成的复合酶,各复合酶比例为1:1),酶底比为12%,在40℃条件下水浴1h。酶解结束后,沸水浴10min灭酶活,冷却至室温,将溶液ph调至7,8 000r/min离心10min,收集上清液(以下简称壳聚糖酶解液),待测其抗氧化活性。
30.二、壳聚糖酶解液dpph自由基清除率的测定
31.分别将0.1ml蒸馏水和0.1ml壳聚糖酶解液与0.1ml 0.2mmol/l的dpph无水乙醇溶液混匀,记为a
c
组和a
i
组,将0.1ml壳聚糖酶解液和0.1ml无水乙醇溶液混匀,记为a
j
组,而后于室温避光静置30min,最后于517nm测定其吸光度值。以蒸馏水为空白对照,按下述公式计算出壳聚糖酶解液的dpph自由基清除率,清除率为50%时壳寡糖的浓度为ic
50
。
32.dpph自由基清除率=[1
‑
(a
i
‑
a
j
)/a
c
]
×
100%;式中:a
i
为壳聚糖酶解液和dpph无水乙醇的吸光度值;a
j
为壳聚糖酶解液和无水乙醇的吸光度值;a
c
为蒸馏水和dpph无水乙醇的吸光度值。
[0033]
三、壳聚糖酶解液总还原力的测定
[0034]
将0.3ml 0.2mol/l ph6.6的磷酸缓冲溶液、0.3ml壳聚糖酶解液和0.3ml 1%的铁氰化钾溶液加入试管中并混匀,置于50℃水浴锅中水浴20min后快速冷却,加入0.3ml 10%的三氯乙酸终止反应,在4℃温度条件下以4000r/min的转速离心10min,取上清液0.5ml,加入0.5ml蒸馏水和0.1ml 0.1%的三氯化铁,混匀后静置10min,于700nm波长下测定吸光度值,以抗坏血酸为阳性对照。
[0035]
四、壳寡糖产率的测定
[0036]
将壳聚糖酶解液放入真空冷冻干燥机干燥成粉末,然后称量其质量,产率为壳聚糖酶解液冷冻干燥后粉末的质量与底物质量之比。
[0037]
五、壳寡糖平均分子量的测定
[0038]
100μg/mld
‑
盐酸氨基葡萄糖标准溶液:准确称取0.1000g干燥至恒重d
‑
盐酸氨基葡萄糖,加水定容至1000ml;乙酰丙酮溶液:取3.50ml乙酰丙酮溶液,用1mol/l的碳酸钠溶液定容至50ml;对
‑
二甲氨基苯甲醛溶液:称取0.80g对
‑
二甲氨基苯甲醛,溶于15ml无水乙醇和15ml盐酸。
[0039]
准确吸取0、1.0、2.0、3.0、4.0、5.0mld
‑
盐酸氨基葡萄糖标准溶液于25ml比色管中,用蒸馏水补充至5ml,混匀,分别加入乙酰丙酮溶液1ml,混匀后沸水浴25min,快速冷却至室温,加入1ml对
‑
二甲氨基苯甲醛溶液,用无水乙醇定容至10ml,混匀后于60℃条件下水浴1h,冷却至室温,于525nm处测定其吸光度值,以d
‑
盐酸氨基葡萄糖的浓度为横坐标,吸光度值为纵坐标,绘制标准曲线。
[0040]
样品的测定方法与上述标准溶液的方法一致,精确称取0.1000g干燥至恒重的壳寡糖,定容至100ml,将d
‑
盐酸氨基葡萄糖标准改成待测样品,其它步骤不变。
[0041][0042]
式中:m为平均分子量,u;m为样品质量,g;v为样液体积,ml;216.5为d
‑
盐酸氨基葡萄糖的相对分子质量,g/mol;c为对照标准曲线得出的d
‑
盐酸氨基葡萄糖浓度,μg/ml。
[0043]
结果如图1所示,在同等底物、同等酶量条件下,木瓜蛋白酶水解所得酶解产物的dpph自由基清除率和总还原力远高于其它酶制得的酶解产物(p<0.01),木瓜蛋白酶法制得酶解产物的抗氧化活性约为壳聚糖酶法的1.7倍。
[0044]
实施例2木瓜蛋白酶法酶解条件的单因素试验设计
[0045]
初始酶解条件为ph 4.5、酶解温度40℃、酶解时间1h、按底物质量20%加入木瓜蛋白酶,在此基础上通过单因素试验对酶底比、ph值、酶解温度、酶解时间进行参数优化。单因素水平:酶底比(10%、15%、20%、25%、30%)、ph值(2.4、3.2、4.0、4.8、5.6)、酶解温度(20、30、40、50、60℃)、酶解时间(30、60、120、180、240、300min)。
[0046]
结果如图2所示,在酶底比为10%
‑
20%时,随着酶底比的增加壳聚糖酶解物的抗氧化性急速上升,当酶底比达到20%时,抗氧化活性的增加减缓,这是由于底物逐渐被饱和,基于成本考虑,最终选取酶的添加量为酶底比20%[图2(a)]。随着温度的升高,壳聚糖酶解物的抗氧化活性呈现逐渐上升的趋势,在50℃时达到最大值,随着温度上升,分子间运动加剧,酶与底物接触的可能性增加,酶解速率加快,当温度超过酶的最适温度后,继续升高温度,可能会导致酶部分失活,从而影响其催化活性[图2(b)]。随反应时间的延长,壳聚糖酶解物对dpph自由基的清除能力呈现先上升后下降的趋势,而总还原力呈现波动状态,最大值分别在2h和3h,因此酶解时间选择1
‑
3h做进一步优化[图2(c)]。随ph值的增加,壳聚糖酶解物的抗氧化性呈现先下降后上升的趋势,在ph为4.8时达到最大值,抗氧化值在ph值为2.4时呈现较高值是由于过酸环境会促进壳聚糖的降解[图2(d)]。根据单因素试验,确定最佳酶解条件为酶底比20%、反应温度50.00℃、反应ph 4.80,反应时间待进一步研究。
[0047]
实施例3木瓜蛋白酶法酶解条件的响应面设计
[0048]
参照单因素试验结果,根据box
‑
behnken原理设计,以酶解温度、时间、ph值为自变量,壳聚糖酶解液的dpph自由基清除率和总还原力为响应值,设计三因素三水平的响应面分析试验,分析因素及水平如表1。
[0049]
表1木瓜蛋白酶法酶解条件的响应面分析因素及水平
[0050]
[0051][0052]
在单因素试验的基础上,根据box
‑
behnken原理设计,以温度、ph值、时间为自变量,壳聚糖酶解物的dpph自由基清除率和总还原力为响应值,试验设计及结果见表2。
[0053]
利用design expert 8.0软件对所得数据进行回归分析,对各因素回归拟合之后,得到dpph自由基清除率回归方程:
[0054]
y1= 63.82
‑
0.63a
‑
0.78b
‑
0.54c 6.23ab
‑
1.28ac
‑
0.87bc
‑
3.37a2‑
3.87b2 1.08c2;总还原力回归方程:y2= 0.31
‑
2.375
×
10
‑3a 5.750
×
10
‑3b
‑
0.010c 2.750
×
10
‑3ab 6.500
×
10
‑3ac
‑
2.500
×
10
‑4bc
‑
4.600
×
10
‑3a2‑
0.016b2‑
3.600
×
10
‑3c2。
[0055]
表2木瓜蛋白酶酶解条件的响应面优化试验设计与结果
[0056][0057]
以壳聚糖酶解物的dpph自由基清除率为响应值时,回归模型极显著(p<0.0001),且回归模型的失拟项不显著(p=0.7345),r2=0.9907,r
2adj
=0.9788,表明该模型可以很好地反映壳聚糖酶解物的dpph自由基清除率与反应时间、温度和ph值各因素之间的关系,可以对酶解工艺进行很好的预测。
[0058]
方差分析结果表明一次项和二次项对结果影响均显著(p<0.05),且根据f值可知,各因素对dpph自由基清除率影响强弱顺序为:b>a>c(表3)。以壳聚糖酶解物的总还原力为响应值时,回归模型极显著(p=0.0027),且回归模型的失拟项不显著(p=0.1419),r2=0.9305,r
2adj
=0.8411,表明该回归方程能对壳聚糖酶解工艺结果进行较好的预测。一次项c和二次项b2对结果影响显著(p<0.05),一次项b对结果影响极显著(p<0.01),其余各项均不显著(表3)。
[0059]
表3壳聚糖酶解物的ddph自由基清除率和总还原力回归模型方差分析
[0060][0061]
注:**:差异极显著(p<0.01);*:差异显著(p<0.05)
[0062]
木瓜蛋白酶法通过响应面优化得到最优的酶解条件为酶解温度47.74℃、酶解ph 4.81、酶解时间1h,预测壳聚糖酶解物的dpph自由基清除率为65.10%,总还原力为0.323(图3)。为了验证模型预测的准确性,在温度48.00℃、ph值4.80、酶解时间1h条件下,平行进行3次试验,测得壳聚糖酶解物的dpph自由基清除率为65.43%
±
0.71%,ic
50
为1.86
±
0.10mg/ml,总还原力为0.328
±
0.010,相当于39.44
±
2.94μg/ml抗坏血酸的还原能力,与预测值基本接近,表明实验值与理论预测值具有较好的拟合性,也进一步验证了该模型的可行性。该壳寡糖的平均分子量为1603u,产率为45.07%
±
3.52%。
[0063]
因本研究的产品壳寡糖具有较高抗氧化活性,因此其可作为抗氧化剂以延缓食品的氧化腐败进程。目前壳寡糖的来源主要有甲壳类动物和昆虫的外壳、软体动物以及某些真菌和藻类,其中同一来源的产品安全性较高,本研究所使用的壳聚糖为虾源壳聚糖,降解产物为虾源壳寡糖,属于海洋源。针对富含多不饱和脂肪酸的水产品而言,脂类的过氧化始终是水产干制品品质劣变的主要原因。如红鱼干中的脂肪含量高达11.3
‑
14.7%,极易因氧化而出现氧化褐变、哈败的问题。因此,可利用本研究壳寡糖产品的抗氧化特性,有效解决水产干制品中的氧化劣变问题,且同为海洋源产品,其安全性更高。
[0064]
实施例4木瓜蛋白酶法酶解得到的壳寡糖用于虾肉火腿肠的保鲜
[0065]
虾肉火腿肠中用于防腐保鲜的壳寡糖按照0%、0.5%、1%、2%的比例在斩拌结束后添加至肉糜中,混合均匀后进行后续加工处理得到最终具有一定抑菌效果的成品。由于虾肉火腿肠中蛋白质、脂肪的含量较高,细菌滋生迅速,所以选择在较低温度的环境下进行贮藏(贮藏温度选择4℃和25℃)。贮藏过程中定期对虾肉火腿肠的菌落总数,确定各指标在不同贮藏温度下随着贮藏时间变化的回归方程。
[0066]
结果如下:如图4和图5,在没有添加壳寡糖的虾肉火腿肠菌落总数几乎呈指数增长,尤其在25℃的条件下贮藏第五天菌落总数已经超过108cfu/g。在两个贮藏温度下都可以明显看出随着壳寡糖添加量的增加,菌落总数的变化率也在降低,虾肉火腿肠菌落总数增长速率越来越慢,尤其对比未添加壳寡糖的虾肉肠,0.5%、1%、2%添加量的虾肉肠菌落总数增长较为平缓,尤其在4℃条件下添加了2%壳寡糖的虾肉肠的菌落总数增长极其缓
慢。在25℃贮藏温度下,0%、0.5%壳寡糖添加量的虾肉火腿肠在第二天就超过了国家标准规定的菌落总数限量,1%壳寡糖添加量的虾肉肠菌落总数在第三天超标,而2%的壳寡糖添加量则在第六天才超标。在4℃贮藏温度下,0%、0.5%、1%壳寡糖添加量的虾肉肠分别在第三天、第五天、第六天超标,而添加量为2%的壳寡糖的菌落总数在第六天也仍未超标。由此可见,壳寡糖在虾肉肠的保鲜效果较为明显,且在两种贮藏温度下,2%添加量的壳寡糖的保鲜效果都是最佳的。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。