针对achr单亚基抗体的检测试剂盒及其应用
技术领域
1.本发明属于基因工程和抗体检测技术领域,涉及针对achr单亚基抗体的检测试剂盒及其应用。
背景技术:
2.重症肌无力(mg)是一种由针对神经肌肉接头蛋白的抗体(ab)引起的自身免疫性疾病,病症是波动性肌肉无力和易疲劳。mg全球患病率为(150~250)/百万,预估年发病率为(4~10)/百万。我国mg发病率约为0.68/10万,女性发病率略高;住院死亡率为14.69
‰
,主要死亡原因包括呼吸衰竭、肺部感染等。
3.在约85%mg患者中可检测到针对肌肉乙酰胆碱受体(achr)的抗体。已知肌肉achr由五个同源亚基组成,在胎儿或失神经肌肉中为(α1)2、β1、δ、γ,在成人肌肉中为(α1)2、β1、δ、ε(如图12所示)。每个亚基都有一个高度结构化的细胞外结构域(ecd),四个跨膜结构域和部分结构化的细胞内结构域。自身抗体靶向achr亚基的ecd,其异质性较强,可在同一患者中发现针对achr五个单亚基的自身抗体。据报道,约50%的achr自身抗体与α单亚基结合,尤其是与主要免疫抗原性区域(mir)结合。该区域由α单亚基ecd上的重叠表位形成,其核心表位位于第67
‑
76位氨基酸之间。此外,已有研究证明,针对α单亚基的自身抗体比针对其他单亚基的自身抗体更具致病性。
4.achr
‑
ab的存在对mg具有近100%的特异性,然而,其对于临床治疗的指导价值还不明朗。lindstrom等在1976年和sanders等在2014年发表的文章表明,achr
‑
ab的浓度与疾病的严重程度无关。但masuda等在2012年发表的文章表明,仅考虑mir定向抗体的浓度时,这种相关性就会出现。另一方面,oosterhuis等在1983年发表的文章表明,在个别患者中,抗体浓度与疾病的严重程度和治疗反应性有关。sophianos等在1989年发表的文章中表明,这种情况可能是由于针对achr五个单亚基的自身抗体对achr贡献程度不同导致的。kostelidou等人在2007年发表的文章,通过免疫吸附已检测到针对achr五个单亚基的自身抗体,但其与疾病的严重程度和治疗反应性的关系仍不清楚。
5.多年来,achr
‑
ab的检测方法已经取得很大进展。最开始放射免疫沉淀测定(ripa)被广泛采用,之后开发了几种非放射性检测方法,包括酶联免疫吸附测定(elisa)、荧光免疫沉淀测定(fipa)和基于细胞的测定(cba)。ripa灵敏度高,特异性强,可以定量检测到低浓度achr
‑
ab,但一些achr
‑
ab是构象依赖性的,不与该测定中使用的可溶性achr的ecd结合;此外,ripa试剂的有效期短,约为一个月,不适合像中国这样一个地域辽阔的国家,而且还存在放射性污染的缺点。elisa灵敏度高,有效期长,但其使用强酸终止液会污染环境;此外,elisa需要依赖价格昂贵的试剂盒从而导致检测成本较高。fipa灵敏度高、特异性强,但裂解液中的去垢剂可能会破坏achr的天然构象,影响achr和抗体相互作用的效果;此外,fipa中的蛋白a珠可能对achr有非特异性吸附或者对样品中的其他蛋白有交叉反应。
6.在过去的几年中,因为可以鉴定出以前未能检测出的针对膜蛋白空间构象表位的致病性抗体,cba的应用逐渐普及。与ripa相比,cba能够更好表达achr构象依赖性表位,转
染细胞通过固定和封闭后保存时间较长,可长期使用。与elisa相比,cba的检测下限较低,所使用试剂均为常规试剂,不需要依赖价格昂贵的试剂盒,检测成本较低。与fipa相比,cba不使用裂解液和蛋白a珠,很大程度上保留了achr的天然构象,较少产生非特异性吸附和交叉反应。cba具有灵敏度高、特异性强的特点,其特异性达99%,此处的特异性是指疾病诊断的特异性。因此,构建一种灵敏度高、特异性强的检测mg患者血清中针对achr单亚基自身抗体的方法至关重要。
技术实现要素:
7.为了克服现有技术的不足,本发明的目的之一在于提供针对achr单亚基抗体的检测试剂盒,该检测试剂盒可对mg患者血清中achr单亚基的自身抗体进行检测,从而探究五种单亚基抗体与mg患者疾病严重程度的关系。
8.本发明的目的之二在于提供针对achr单亚基抗体的检测试剂盒的应用。
9.本发明的目的之一采用如下技术方案实现:
10.针对achr单亚基抗体的检测试剂盒,所述试剂盒中包括细胞检测组件,所述细胞检测组件的制备包括以下步骤:
11.s1:获取achr单亚基的目的基因;
12.s2:将步骤s1得到的achr单亚基的目的基因分别与荧光标记载体连接,构建得到真核表达质粒;
13.s3:将步骤s2得到的真核表达质粒分别转染细胞,得到含荧光标记的achr单亚基抗原的转染细胞,即细胞检测组件。
14.进一步地,所述achr单亚基分别为α1、β1、δ、ε、γ,载体为pcmv6
‑
ac
‑
gfp。
15.进一步地,所述s1包括以下步骤:
16.(1)从肝脏细胞系中提取的总rna为模板反转录得到cdna;
17.(2)通过ncbi检索关键词chrna1、chrnb1、chrnd、chrne、chrng,分别得到人achr单亚基α1、β1、δ、ε、γ目的基因对应的mrna转录本,根据选定的mrna转录本的cds设计相应的上游引物和下游引物,pcr扩增步骤(1)得到的cdna得到相应的人achr亚基α1、β1、δ、ε、γ目的基因;
18.(3)将步骤(2)得到的pcr产物进行纯化,得到纯化后的人achr单亚基α1、β1、δ、ε、γ目的基因;并将纯化后的α1、β1、δ、ε、γ目的基因进行双酶切。
19.进一步地,所述步骤(2)α1的上游引物为attgcgatcgccatggagccctggcct,下游引物为cgacgcgttccttgctgatttaattcaatgagtcgacc;
20.β1的上游引物为attgcgatcgccatgaccccaggggct,下游引物为cgacgcgtaggaaaggggtctggagg;
21.δ的上游引物为attgcgatcgccatggaggggccagtg,下游引物为cgacgcgtgatgaagcgcttgtcctgc;
22.ε的上游引物为attgcgatcgccatggcaagggctccg,下游引物为cgacgcgtaggctggatacacggcgcgta;
23.γ的上游引物为attgcgatcgccatgcatgggggccagg,下游引物为cgacgcgtgtctggtgagggcaggta。
24.进一步地,所述s2包括以下步骤:
25.(1)将pcmv6
‑
ac
‑
gfp载体进行双酶切、胶回收得到纯化的pcmv6
‑
ac
‑
gfp载体片段,将步骤s1得到的人achr单亚基α1、β1、δ、ε、γ目的基因片段分别和纯化的pcmv6
‑
ac
‑
gfp载体片段连接,得到五种连接产物;
26.(2)将步骤(1)得到的五种连接产物转化感受态细胞得到五种转化产物,然后将五种转化产物涂布于培养板中,每种均挑选单菌落增菌培养;提取质粒,分别得到五种真核表达质粒pcmv6
‑
ac
‑
gfp
‑
α1、pcmv6
‑
ac
‑
gfp
‑
β1、pcmv6
‑
ac
‑
gfp
‑
δ、pcmv6
‑
ac
‑
gfp
‑
ε、pcmv6
‑
ac
‑
gfp
‑
γ。
27.进一步地,所述s3包括以下步骤:接种hek293细胞至培养系统中,当细胞融合度为50%时将步骤s2得到的五种真核表达质粒用转染试剂分别转染细胞,分别得到含荧光标记的achr单亚基α1、β1、δ、ε、γ抗原的转染细胞,即细胞检测组件。
28.进一步地,所述试剂盒还包括固定液、通透液、封闭液、洗涤液、阳性对照、阴性对照。优选地,固定液为4%的甲醛;通透液为0.5%triton x
‑
100;封闭液为1%牛血清白蛋白;洗涤液为pbs;阳性对照为商品化大鼠单克隆抗体;阴性对照为健康人血清。
29.本发明的目的之二采用如下技术方案实现:
30.针对achr单亚基抗体的检测试剂盒的应用,所述试剂盒中的荧光标记的achr单亚基抗原与待测血清进行免疫反应,用于检测待测血清中是否存在针对achr单亚基的自身抗体。
31.进一步地,所述检测过程包括:
32.(1)将步骤s3得到的细胞检测组件进一步固定、通透、封闭;
33.(2)将步骤(1)得到的细胞与待测血清共同孵育,进行免疫反应。
34.进一步地,所述步骤(2)的过程包括:
35.(2.1)将血清标本进行比例稀释;
36.(2.2)将步骤(1)通透、封闭后的细胞与(2.1)稀释后的血清混合并共同孵育;
37.(2.3)步骤(2.2)孵育完成后对细胞进行洗涤,然后加入对应的二抗孵育,孵育完成后再次洗涤,使用荧光显微镜进行观察。
38.相比现有技术,本发明的有益效果在于:
39.本发明提供了针对achr单亚基抗体的检测试剂盒,该试剂盒包括细胞检测组件
━
含荧光标记的achr单亚基抗原的转染细胞。上述试剂盒通过cba方法制备得到,能够在很大程度上保留achr的天然构象,较少产生非特异性吸附和交叉反应,且具有灵敏度高、特异性强的特点。本发明还提供了针对achr单亚基抗体的检测试剂盒的应用,将上述试剂盒用于检测待测血清中是否存在针对achr单亚基的自身抗体,从而分析其与mg患者疾病严重程度的关系,为临床治疗提供新指标、新方案。也可以将achr
‑
ab按照亚基进行分类并归纳其临床症状,针对这些症状进行对症治疗将是未来achr
‑
mg治疗的首选方向。此外,定期监测achr亚基自身抗体的浓度对mg患者的预后情况具有指导意义。
附图说明
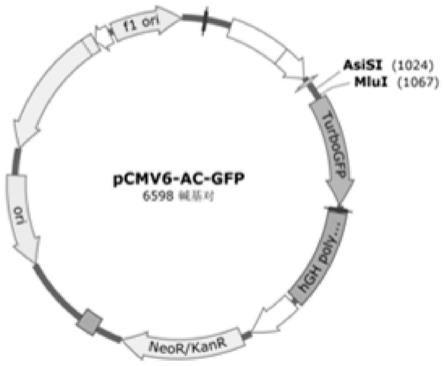
40.图1为本发明pcmv6
‑
ac
‑
gfp载体结构图;
41.图2为本发明pcmv6
‑
ac
‑
gfp
‑
α1真核表达质粒结构图;
42.图3为本发明pcmv6
‑
ac
‑
gfp
‑
β1真核表达质粒结构图;
43.图4为本发明pcmv6
‑
ac
‑
gfp
‑
δ真核表达质粒结构图;
44.图5为本发明pcmv6
‑
ac
‑
gfp
‑
ε真核表达质粒结构图;
45.图6为本发明pcmv6
‑
ac
‑
gfp
‑
γ真核表达质粒结构图;
46.图7为本发明pcmv6
‑
ac
‑
gfp
‑
α1、pcmv6
‑
ac
‑
gfp
‑
β1、pcmv6
‑
ac
‑
gfp
‑
δ、pcmv6
‑
ac
‑
gfp
‑
ε、pcmv6
‑
ac
‑
gfp
‑
γ五种真核表达质粒单、双酶切鉴定图;
47.图8为本发明间接免疫荧光法验证人achr单亚基α1、β1、δ、ε、γ蛋白水平表达图;
48.图9为本发明免疫印迹法验证人achr单亚基α1、β1、δ、ε、γ蛋白水平表达图;
49.图10为本发明cba法检测健康人血清中针对人achr单亚基α1、β1、δ、ε、γ的自身抗体应用图;
50.图11为本发明cba法检测mg患者血清中针对人achr单亚基α1、β1、δ、ε、γ的自身抗体应用图;
51.图12为肌肉achr在胎儿、成人肌肉中的同源亚基组成示意图。
具体实施方式
52.下面,结合附图以及具体实施方式,对本发明做进一步描述,需要说明的是,在不相冲突的前提下,以下描述的各实施例之间或各技术特征之间可以任意组合形成新的实施例。
53.实施例
54.针对achr单亚基抗体的检测试剂盒,试剂盒中包括细胞检测组件、固定液、通透液、封闭液、洗涤液、阳性对照、阴性对照。其中细胞检测组件为含荧光标记的achr单亚基抗原的转染细胞;固定液为4%的甲醛;通透液为0.5%triton x
‑
100;封闭液为1%牛血清白蛋白;洗涤液为pbs;阳性对照为商品化大鼠单克隆抗体;阴性对照为健康人血清。
55.其中细胞检测组件的制备过程包括以下步骤:
56.s1:获取achr单亚基α1、β1、δ、ε、γ目的基因
57.(1)从人肝脏细胞系中提取的总rna为模板反转录得到cdna。
58.(1.1)rna提取操作步骤:
59.①
贴壁细胞:弃去培养基,用pbs清洗一次。每10cm2培养面积的细胞加入1ml rna isolater,使之充分覆盖到细胞表面,然后用移液器将细胞吹打下来。将裂解液转移至1.5ml离心管中,用移液器反复吹打直至充分裂解,冰上静置5分钟。
60.②
向上述裂解液中加入1/5体积的氯仿。剧烈震荡15秒成乳浊液,4℃静置5分钟。
61.③
4℃环境下以12000rpm离心15分钟。
62.④
小心取出离心管。此时溶液分为三层:无色的水相(上层)、白色中间层以及红色的有机层(下层)。小心吸取上层水相至一个新的离心管中。
63.⑤
加入等体积预冷的异丙醇,上下颠倒混匀,4℃静置10分钟。
64.⑥
12000rpm、4℃离心10分钟,通常可以看到白色沉淀。
65.⑦
小心弃去上清,加入1ml 75%乙醇(用rnase
‑
free ddh2o配制)。轻弹管底,让沉淀悬浮起来,并上下颠倒数次,室温静置5分钟。
66.⑧
12000rpm、4℃离心5分钟,弃去上清。
67.⑨
在洁净的环境中室温敞口干燥沉淀2~5分钟,注意不可过分干燥,否则会导致rna难以溶解。
68.⑩
加入适量的rnase
‑
free ddh2o溶解沉淀,必要时可用移液器轻轻吹打几下,待完全溶解后,取少量检测,其余在
‑
80℃保存。
69.(1.2)反转录得到cdna
70.①
在microtube管中根据表1配制下列反应液。
71.表1
72.试剂使用量5
×
gdna eraser buffer2μlgdna eraser1μltotal rna1μgrnase free ddh2oup to 10μl
73.②
42℃保温2分钟后,4℃保存。
74.③
在上述microtube管中按照表2配制下列反转录反应液,缓慢混匀。
75.表2
76.试剂使用量上述反应液10μlprimescript rt enzyme mix i1μlrt primer mix1μl5
×
primescript buffer 2(for real time)4μlrnase free ddh2o4μltotal20μl
77.④
按下列条件进行反转录反应,最终得到cdna:
78.步骤一、37℃,15min;
79.步骤二、85℃,5sec;
80.步骤三、4℃hold。
81.(2)通过ncbi检索关键词chrna1、chrnb1、chrnd、chrne、chrng,分别得到人achr单亚基α1、β1、δ、ε、γ目的基因对应的mrna转录本nm_000079.4、nm_000747.3、nm_000751.3、nm_000080.4、nm_005199.5,根据选定的mrna转录本的cds设计五对带有asisi和mlui酶切位点的特异性引物(表3)。将反应组分ddh2o、上游引物、下游引物、cdna、2
×
phanta max master mix依次加入并充分混匀。根据引物tm值设置退火温度,设置对应的反应程序进行pcr,得到相应的人achr亚基α1、β1、δ、ε、γ目的基因。
82.表3
[0083][0084]
pcr反应体系如表4所示:
[0085]
表4
[0086]
成分体积2
×
phanta max master mix(dye plus)25μl上游引物(10μmol)2μl下游引物(10μmol)2μlcdna1μlddh2oup to 50ul
[0087]
achrα1的pcr反应程序如表5.1、achrβ1、δ、ε、γ的pcr反应程序如表5.2所示。
[0088]
表5.1
[0089]
[0090]
表5.2
[0091][0092]
(3)将步骤(2)得到的pcr产物进行纯化,得到纯化后的人achr单亚基α1、β1、δ、ε、γ目的基因;并将纯化后的α1、β1、δ、ε、γ目的基因进行双酶切。
[0093]
(3.1)将pcr产物进行1%琼脂糖凝胶电泳,琼脂糖凝胶电泳过程的参数设置为电压90v,时间60分钟。电泳结束后,将1500bp左右的凝胶切下,使用胶回收试剂盒回收目的基因胶条,得到纯化的人achr单亚基α1、β1、δ、ε、γ目的基因。
[0094]
(3.2)人achr单亚基α1、β1、δ、ε、γ目的基因双酶切
[0095]
将纯化后的带有酶切位点的人achr单亚基α1、β1、δ、ε、γ目的基因用限制性核酸内切酶asisi和mlui进行双酶切,37℃水浴锅中酶切4小时。目的基因双酶切体系如表6所示。
[0096]
表6
[0097]
成分体积dna20μl10
×
快切酶buffer3μlasisi1.3μlmlui1.3μlddh2oup to 30μl
[0098]
s2:将步骤s1得到的achr单亚基α1、β1、δ、ε、γ目的基因分别与载体pcmv6
‑
ac
‑
gfp连接,构建得到五种真核表达质粒pcmv6
‑
ac
‑
gfp
‑
α1、pcmv6
‑
ac
‑
gfp
‑
β1、pcmv6
‑
ac
‑
gfp
‑
δ、pcmv6
‑
ac
‑
gfp
‑
ε、pcmv6
‑
ac
‑
gfp
‑
γ。
[0099]
(1)将pcmv6
‑
ac
‑
gfp载体进行双酶切、胶回收得到纯化的pcmv6
‑
ac
‑
gfp载体片段,将步骤s1得到的人achr单亚基α1、β1、δ、ε、γ目的基因片段分别和纯化的pcmv6
‑
ac
‑
gfp载体片段连接,得到五种连接产物。
[0100]
(1.1)pcmv6
‑
ac
‑
gfp载体双酶切
[0101]
本发明选用表达绿色荧光蛋白的pcmv6
‑
ac
‑
gfp载体(购自origene)作为真核表达载体,由snapgene得出其结构图(图1)。将带有相同酶切位点的pcmv6
‑
ac
‑
gfp用限制性核酸内切酶asisi和mlui进行双酶切,37℃水浴锅中酶切4小时。载体双酶切体系如表7所示。
[0102]
表7
[0103]
成分体积dna15.5μl10
×
快切酶buffer3μl
asisi3.3μlmlui3.3μlddh2oup to 30μl
[0104]
(1.2)pcmv6
‑
ac
‑
gfp载体片段胶回收
[0105]
将pcmv6
‑
ac
‑
gfp载体片段进行1%琼脂糖凝胶电泳,琼脂糖凝胶电泳过程的参数设置为电压90v,时间60分钟。电泳结束后,将7000bp左右的凝胶切下,使用胶回收试剂盒回收载体胶条,得到纯化pcmv6
‑
ac
‑
gfp载体片段。
[0106]
(1.3)连接
[0107]
将人achr单亚基α1、β1、δ、ε、γ目的基因片段和pcmv6
‑
ac
‑
gfp载体片段使用t4 dna连接酶在16℃下连接20小时。α1、β1、δ、ε、γ目的基因片段与pcmv6
‑
ac
‑
gfp载体片段的摩尔比为2:1。连接反应体系如表8所示。
[0108]
表8
[0109]
成分体积载体片段2μl目的基因片段0.9μl10
×
t4 dna连接酶buffer1μlt4 dna连接酶1μlddh2oup to 10μl
[0110]
(2)将步骤(1)得到的五种连接产物转化感受态细胞得到五种转化产物,然后将五种转化产物涂布于培养板中,每种均挑选单菌落增菌培养;提取质粒,分别得到五种真核表达质粒pcmv6
‑
ac
‑
gfp
‑
α1、pcmv6
‑
ac
‑
gfp
‑
β1、pcmv6
‑
ac
‑
gfp
‑
δ、pcmv6
‑
ac
‑
gfp
‑
ε、pcmv6
‑
ac
‑
gfp
‑
γ。
[0111]
(2.1)转化
[0112]
将上述得到的五种连接产物转化dh5α感受态细胞得到五种转化产物,然后将五种转化产物涂布于含有100mg/ml氨苄青霉素的lb固体培养板中,37℃生长16小时后挑选单菌落增菌培养。使用质粒提取试剂盒提取五种真核表达质粒,分别命名为pcmv6
‑
ac
‑
gfp
‑
α1、pcmv6
‑
ac
‑
gfp
‑
β1、pcmv6
‑
ac
‑
gfp
‑
δ、pcmv6
‑
ac
‑
gfp
‑
ε、pcmv6
‑
ac
‑
gfp
‑
γ。上述五种真核表达质粒结构图如图2至6所示。
[0113]
(2.2)单、双酶切鉴定
[0114]
对步骤(2.1)得到的pcmv6
‑
ac
‑
gfp
‑
α1、pcmv6
‑
ac
‑
gfp
‑
β1、pcmv6
‑
ac
‑
gfp
‑
δ、pcmv6
‑
ac
‑
gfp
‑
ε、pcmv6
‑
ac
‑
gfp
‑
γ五种真核表达质粒进行单酶切和双酶切,并对单酶切、双酶切产物进行1%琼脂糖凝胶电泳鉴定,琼脂糖凝胶电泳过程的参数设置为电压90v,时间60分钟。单酶切、双酶切反应体系如表9、表10所示。
[0115]
表9
[0116]
成分体积dna3μl10
×
快切酶buffer2μlmlui1μlddh2oup to 20μl
[0117]
表10
[0118]
成分体积dna3μl10
×
快切酶buffer2μlasisi1μlmlui1μlddh2oup to 20μl
[0119]
图7为pcmv6
‑
ac
‑
gfp
‑
α1、pcmv6
‑
ac
‑
gfp
‑
β1、pcmv6
‑
ac
‑
gfp
‑
δ、pcmv6
‑
ac
‑
gfp
‑
ε、pcmv6
‑
ac
‑
gfp
‑
γ五种真核表达质粒的单、双酶切鉴定图,结果表明上述五种质粒成功构建。
[0120]
(2.3)测序鉴定
[0121]
对pcmv6
‑
ac
‑
gfp
‑
α1、pcmv6
‑
ac
‑
gfp
‑
β1、pcmv6
‑
ac
‑
gfp
‑
δ、pcmv6
‑
ac
‑
gfp
‑
ε、pcmv6
‑
ac
‑
gfp
‑
γ五种真核表达质粒送至生工生物工程(上海)股份有限公司进行测序,上述质粒的序列分别为seq.no.1、seq.no.2、seq.no.3、seq.no.4、seq.no.5,对测序后的拼接结果进行blast分析,结果与ncbi完全一致,同源性100%。
[0122]
s3:将步骤s2得到的五种真核表达质粒分别转染细胞,得到含荧光标记的achr单亚基α1、β1、δ、ε、γ抗原的转染细胞,即细胞检测组件。
[0123]
(1)接种hek293细胞至培养系统中,当细胞融合度为50%时将步骤s2得到的五种真核表达质粒用转染试剂分别转染细胞,分别得到含荧光标记的achr单亚基α1、β1、δ、ε、γ抗原的转染细胞,即细胞检测组件。
[0124]
(1.1)细胞培养
[0125]
用胰蛋白酶将贴壁生长的hek293细胞从培养瓶中消化下来,并以1000rpm离心5分钟,弃上清,再将细胞重悬,计数并以1
×
104个细胞/孔的密度铺在48孔细胞培养板上,培养基为dmem附加10%胎牛血清、100单位/ml青霉素、100单位/ml链霉素,放入37℃、5%co2培养箱中培养至少24小时。
[0126]
(1.2)细胞转染
[0127]
当细胞融合度为50%时,使用invigentech将pcmv6
‑
ac
‑
gfp
‑
α1、pcmv6
‑
ac
‑
gfp
‑
β1、pcmv6
‑
ac
‑
gfp
‑
δ、pcmv6
‑
ac
‑
gfp
‑
ε、pcmv6
‑
ac
‑
gfp
‑
γ五种真核表达质粒分别瞬时转染细胞。对于achrα1单亚基自身抗体估计,每个孔使用0.6μg的pcmv6
‑
ac
‑
gfp
‑
α1质粒进行转染。对于achrβ1、δ、ε、γ单亚基自身抗体估计,每个孔的添加量与α1单亚基相同。最终分别得到含荧光标记的achr单亚基α1、β1、δ、ε、γ抗原的转染细胞,即细胞检测组件。
[0128]
由于大部分achrα1、β1、δ、ε、γ单亚基在内质网会被泛素化降解,只有一小部分单亚基进入高尔基体糖基化后转运到细胞膜上,所以本发明通过使用蛋白酶体抑制剂mg
‑
132进一步提高achrα1、β1、δ、ε、γ单亚基在细胞膜上的表达。泛素化的achrα1、β1、δ、ε、γ单亚基在暴露于mg
‑
132时不能被蛋白酶体降解,可以通过去泛素化作用“回收”,从而使单亚基水平增加。高尔基体achrα1、β1、δ、ε、γ单亚基池的增加可能原因是单亚基在内质网水平的降解速度较慢,这将促进单亚基成熟并在细胞膜上表达。
[0129]
瞬时转染和稳定转染各有优缺点(表11),本发明根据实验目的选择表达效率较高的瞬时转染。瞬时转染是指外源基因进入宿主细胞后存在于游离的载体上,而不整合到宿
主细胞的染色体上,因此一个宿主细胞中可存在多个拷贝数,从而产生高水平的表达。一般在外源基因导入细胞两天后收获细胞。
[0130]
表11
[0131][0132]
实验例1
[0133]
对瞬时转染的细胞进行鉴定和评估
[0134]
(1)间接免疫荧光验证蛋白水平表达
[0135]
(1.1)将步骤s3得到的细胞检测组件进一步固定、通透、封闭
[0136]
转染48小时后,48孔细胞培养板中贴壁生长的hek293细胞用pbs稀释的4%甲醛4℃下固定20分钟。用pbs洗涤一次后,将细胞用pbst(pbs稀释的0.5%triton x
‑
100)通透,然后用含1%牛血清白蛋白的pbst在4℃下封闭过夜。
[0137]
(1.2)achr单亚基α1、β1、δ、ε、γ抗原与商品化大鼠单克隆抗体反应(阳性对照)
[0138]
将通透、封闭后的48孔细胞培养板中的hek293细胞与以1:100的比例用pbst稀释的商品化大鼠单克隆抗体在室温下孵育2小时。pbs洗涤三遍后,将细胞与以1:1000的比例用pbst稀释的alexa fluor 594偶联的山羊抗大鼠igg在室温下孵育2小时。孵育完成后用pbs洗涤三遍,向每孔中加入适量dapi染色液,室温染色10分钟,吸除dapi染色液,用pbs洗涤三遍。最后使用荧光显微镜完成视觉检查和成像,所有照片均在相似的显微镜设置下获得。
[0139]
检测结果如图8,dapi染核定位显示细胞核呈蓝色。hek293细胞表达的achr单亚基α1、β1、δ、ε、γ蛋白定位于细胞膜,细胞膜呈绿色。当将通透、封闭后的hek293细胞与针对achr单亚基α1、β1、δ、ε、γ的大鼠单克隆抗体和二抗孵育后,细胞膜呈红色。最终形成抗原抗体二抗复合物固定在细胞表面,在荧光显微镜下观察得到绿色和红色的双色荧光。
[0140]
(2)免疫印迹验证蛋白水平表达
[0141]
(2.1)总蛋白提取
[0142]
转染48小时后,去除贴壁细胞的培养基,用预冷的pbs轻轻洗一遍;在6孔板的每个孔中加入100μl ripa裂解液与1μl pmsf,冰上裂解20分钟,收集细胞裂解液于1.5ml干净离心管中,以12000rpm的转速4℃下离心30分钟。
[0143]
(2.2)蛋白变性
[0144]
离心后,上清即为蛋白提取液,吸取少量蛋白提取液做蛋白浓度测定。向剩余蛋白提取液的离心管中加入1/4上清体积的5
×
蛋白上样缓冲液,待干式恒温器温度升至98℃,将其加热变性10分钟。
[0145]
(2.3)制胶
[0146]
配制10%分离胶,将制好的胶溶液加入预先安装好的制胶器中,加水封胶,水平放置30分钟后倒掉水。配制5%浓缩胶,将制好的胶溶液加入制胶器中,插入样品梳,赶走气泡,水平放置30分钟后拔走样品梳,加入1
×
电泳液。
[0147]
(2.4)电泳
[0148]
上样时,为保证每个泳道蛋白样体积一致,体积相差较大的用1
×
的蛋白上样缓冲液补齐。浓缩胶使用90v电压、电泳30分钟,使蛋白样压齐,待样品进入分离胶时,调为120v电压、电泳60分钟。
[0149]
(2.5)转膜
[0150]
切下26kd左右的gfp蛋白凝胶、36kd左右的gapdh蛋白凝胶以及70~100kd的achr单亚基α1、β1、δ、ε、γ目的蛋白凝胶,剪下比蛋白凝胶稍大的pvdf膜,用湿转法在冰水浴中转膜,200ma的电流转膜55分钟。
[0151]
(2.6)封闭
[0152]
用1
×
tbst配制的5%脱脂奶粉作为封闭液,将蛋白膜条室温封闭2小时。
[0153]
(2.7)抗体孵育
[0154]
将商品化大鼠单克隆抗体以1:1000稀释于1
×
tbst中,achr单亚基α1、β1、δ、ε、γ目的蛋白膜条与之4℃过夜孵育;用1
×
tbst将目的蛋白膜条摇晃洗3次,每次10分钟;将hrp标记的山羊抗大鼠igg以1:5000稀释于1
×
tbst中,目的蛋白膜条与之在室温摇晃孵育2小时;最后用1
×
tbst将目的蛋白膜条摇晃洗3次,每次10分钟。gfp蛋白膜条、gapdh蛋白膜条的抗体孵育过程同achr单亚基α1、β1、δ、ε、γ目的蛋白膜条。
[0155]
(2.8)曝光
[0156]
打开amersham imager 600成像仪,将ecl发光液a液与b液1:1混匀,吸取混匀的发光液滴加在pvdf膜上,进行曝光。
[0157]
如图9所示,achr单亚基α1、β1、δ、ε、γ蛋白在hek293细胞成功表达。
[0158]
实验例2
[0159]
针对achr单亚基抗体的检测试剂盒的应用
[0160]
mg最重要的诊断依据是病人的临床表现,其次是辅助检查。mg诊断标准符合a和b
‑
d中的任意一条:
[0161]
a.患者存在肌肉易疲劳无力,且活动后加重休息后减轻或缓解;
[0162]
b.新斯的明试验阳性;
[0163]
c.肌电图阳性;
[0164]
d.血清抗体检测阳性。
[0165]
据此标准共纳入1000例mg患者。
[0166]
本发明检测血清中自身抗体过程为:
[0167]
(1)将步骤s3得到的细胞检测组件进一步固定、通透、封闭。
[0168]
转染48小时后,48孔细胞培养板中贴壁生长的hek293细胞用pbs稀释的4%甲醛于4℃固定20分钟。用pbs洗涤一次后,将细胞用pbst通透,然后用含1%牛血清白蛋白的pbst在4℃下封闭过夜。
[0169]
(2)将步骤(1)得到的细胞与待测血清共同孵育,进行免疫反应。
[0170]
(2.1)取临床mg患者的血清作为标本,并用pbst以1:20的比例对血清进行稀释;
[0171]
(2.2)将步骤(1)通透封闭后的48孔细胞培养板中的hek293细胞与上步稀释后的血清混合,在室温下孵育2小时;
[0172]
(2.3)孵育完成后,用pbs洗涤三遍后,将细胞与以1:1000用pbst稀释的dylight 594偶联的羊抗人igg fc二抗在室温下孵育2小时。孵育完成后再次用pbs洗涤三次,使用荧光显微镜完成视觉检查和成像。
[0173]
图10、图11分别为本发明cba法检测健康人血清(阴性对照)、不同mg患者血清(阳性血清)中针对人achr单亚基的自身抗体应用图。五种真核表达质粒转染到对应的hek293细胞中表达绿色荧光蛋白,加入患者血清后发生免疫反应,merge后呈现黄色荧光效果,表明该血清样本中含有针对achr单亚基的自身抗体。健康人血清检测则无上述免疫反应发生,merge后依旧为绿色荧光效果。由此可知本发明得到的针对achr单亚基抗体的检测试剂盒可以用于检测待测血清中是否存在针对achr单亚基的自身抗体,并可根据检测结果分析其与mg患者疾病严重程度有无关系。
[0174]
综上,本发明提供了针对achr单亚基抗体的检测试剂盒,该试剂盒能够在很大程度上保留achr的天然构象,较少产生非特异性吸附和交叉反应,且具有灵敏度高、特异性强的特点。本发明将针对achr单亚基抗体的检测试剂盒用于检测待测血清中是否存在针对achr五个不同单亚基α1、β1、δ、ε、γ的自身抗体,从而分析其与mg疾病严重程度的关系,为临床治疗提供新指标、新方案。也可以将achr
‑
ab按照亚基进行分类并归纳其临床症状,针对这些症状进行对症治疗将是未来achr
‑
mg治疗的首选方向。此外,定期监测achr亚基自身抗体的浓度对mg患者的预后情况具有指导意义。
[0175]
上述实施方式仅为本发明的优选实施方式,不能以此来限定本发明保护的范围,本领域的技术人员在本发明的基础上所做的任何非实质性的变化及替换均属于本发明所要求保护的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。