1.本发明涉及生物技术领域,具体涉及一种被靶向修饰且装载有药物的外泌体及其制备方法和应用。
背景技术:
2.缺血性脑卒中、出血性脑卒中、阿尔兹海默症、帕金森病等神经系统疾病发病率在现代社会中越来越高,且治疗比较困难。以急性缺血性脑卒中为例,经fda批准的药物仅有rt-pa,但是其治疗时间窗仅有4.5小时,导致只有少部分患者能从中获益,所以亟待研发治疗药物。
3.神经营养因子家族包括神经生长因子(ngf)、脑源性神经营养因子(bdnf)、神经营养因子4(nt4)、神经营养因子5(nt5)等。ngf是神经营养因子家族首个被发现的分子,在神经系统生理发育过程中起关键调控作用。在神经系统损伤后,神经营养因子家族可以起到减轻组织损伤、促进组织修复的作用。例如,给予ngf可以减少神经细胞死亡、调节炎症并促进细胞向抗炎型极化、促进血管新生、促进神经再生以及改善神经功能,具有广谱神经保护作用。既往研究发现脑缺血损伤后,内源性ngf的表达水平显著下降。因此,如果能将神经营养因子有效递送至脑组织受体细胞,将可能对神经系统疾病产生治疗作用。
4.但目前将神经营养因子递送至神经组织受体细胞存在以下问题:(1)常规静脉注射或皮下注射的方法给予的神经营养因子无法高效地穿过血脑屏障,虽然病毒载体、神经营养因子基因修饰的细胞、纳米胶囊和水凝胶等已经被用作神经营养因子的装载手段。但目前没有高效靶向神经组织装载神经营养因子的递送方式。(2)神经营养因子的半衰期较短,例如经静脉外源性给予的ngf在体内的半衰期只有2.3小时,皮下注射给予的ngf半衰期只有4.5h。(3)非特异性的递送会引起外周组织的非预期不良效应,如采用肌肉注射ngf会引起局部疼痛。上述多种因素阻碍了ngf治疗神经系统疾病的应用。
5.即使采用静脉注射或皮下注射直接递送神经营养因子的信使rna(mrna),由于mrna极度不稳定、容易快速降解,导致无法通过直接递送神经营养因子的mrna到达神经组织并翻译成神经营养因子。
6.公开于该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不应当被视为承认或以任何形式暗示该信息构成已为本领域一般技术人员所公知的现有技术。
技术实现要素:
7.发明目的
8.本发明的目的在于提供一种被靶向修饰且装载有药物的外泌体及其制备方法和应用,该外泌体中装载有神经营养因子、神经营养因子mrna等,可以靶向性地向神经组织受体细胞递送神经营养因子,从而通过抗炎、抗凋亡、促进神经细胞存活、促进神经再生的方式减轻神经组织损伤、促进修复。
9.解决方案
10.为实现本发明目的,本发明实施例提供了一种狂犬病病毒糖蛋白(rvg)修饰的外泌体,所述外泌体装载有选自以下的一种或几种:神经营养因子;具有神经营养因子活性的神经营养因子片段;具有神经营养因子活性的短肽;及编码其的mrna。
11.在一种可能的实现方式中,神经营养因子包括:神经生长因子、脑源性神经营养因子、神经营养因子4、神经营养因子5、神经营养因子6、神经营养因子7中的一种或几种。
12.在一种可能的实现方式中,装载有神经营养因子和/或神经营养因子mrna的狂犬病病毒糖蛋白(rvg)修饰的外泌体为新鲜提取的或冻存的。
13.在一种可能的实现方式中,当装载有神经营养因子和/或神经营养因子mrna的狂犬病病毒糖蛋白(rvg)修饰的外泌体为冻存的时,冻存的温度条件为-80℃,冻存的时间为3个月或以内。
14.在一种可能的实现方式中,所述外泌体靶向神经组织细胞;可选地,靶向脑组织神经细胞。
15.在一种可能的实现方式中,所述外泌体能被神经元细胞、星形胶质细胞、小胶质细胞、少突胶质细胞及其他神经组织细胞摄取。
16.本发明实施例还提供了上述外泌体的制备方法,包括以下步骤:采用狂犬病病毒糖蛋白(rvg)与外泌体蛋白溶酶体相关膜糖蛋白2b(lamp2b)融合表达的重组载体与克隆有神经营养因子的重组载体共同转染表达系统的细胞,表达后收集细胞上清进行超速离心提取外泌体。
17.本发明实施例还提供了包含有狂犬病病毒糖蛋白(rvg)与外泌体蛋白溶酶体相关膜糖蛋白2b(lamp2b)融合表达的重组载体与克隆有神经营养因子的重组载体的表达系统的细胞。
18.在一种可能的实现方式中,神经营养因子包括:神经生长因子、脑源性神经营养因子、神经营养因子4、神经营养因子5、神经营养因子6、神经营养因子7中的一种或几种。
19.在一种可能的实现方式中,重组载体包括重组质粒,可选地,包含有狂犬病病毒糖蛋白(rvg)与外泌体蛋白溶酶体相关膜糖蛋白2b(lamp2b)融合表达的重组载体为pcdna3.1(-)-rvg-lamp2b重组载体;克隆有神经营养因子的重组载体为pci-neo-ngf重组质粒。
20.在一种可能的实现方式中,所述表达系统的细胞包括:人胚肾293细胞、哺乳动物骨髓间充质干细胞、哺乳动物神经干细胞、哺乳动物脐带间充质干细胞、哺乳动物胎盘间充质干细胞、哺乳动物血液干细胞中的一种或多种。
21.在一种可能的实现方式中,所述制备方法还包括以下步骤:将提取获得的外泌体进行冻存;可选地,冻存的温度条件为-80℃,冻存的时间为3个月或以内。
22.本发明实施例还提供了一种药物组合物,包括上述外泌体,还包括一种或多种药学上可接受的辅料。
23.在一种可能的实现方式中,所述药物组合物为用于治疗神经系统疾病的药物组合物。
24.在一种可能的实现方式中,所述药物组合物还包括其他用于治疗神经系统疾病的药物活性成分。
25.本发明实施例还提供了一种上述外泌体在制备治疗神经系统疾病的药物中的应用。
26.本发明实施例还提供了一种用于治疗神经系统疾病的方法,包括以下步骤:向患有神经系统疾病的受试者施用有效剂量的上述外泌体。
27.在一种可能的实现方式中,所述神经系统疾病包括:缺血性脑卒中、出血性脑卒中、脑小血管病、血管性认知障碍等脑血管病,运动神经元病、阿尔兹海默病、多系统萎缩等神经系统变性疾病,多发性硬化、视神经脊髓炎、脑白质营养不良等中枢神经系统脱髓鞘疾病,帕金森病、亨廷顿病等运动障碍性疾病,脊髓炎、脊髓损伤等脊髓疾病,面神经炎、多发性神经病等周围神经疾病,神经血管性水肿、雷诺病等自主神经系统疾病,重症肌无力、肌营养不良等神经肌肉接头和肌肉疾病,遗传性共济失调等神经系统遗传性疾病,脑性瘫痪等神经系统发育异常性疾病,糖尿病神经系统并发症、甲状腺疾病神经系统并发症等内科系统疾病的神经系统并发症,脑外伤、脊髓外伤等神经创伤性疾病。
28.在一种可能的实现方式中,所述治疗神经系统疾病的方式包括以下的一种或几种:抗炎、抗凋亡、促进神经细胞存活、促进神经再生等。
29.在一种可能的实现方式中,抗炎的方式包括:通过促进1型促炎型小胶质细胞向2型抗炎型小胶质细胞极化。
30.在一种可能的实现方式中,所述受试者包括:人、猴、猪、兔、狗、大鼠或小鼠。
31.在一种可能的实现方式中,所述施用的方式包括:静脉注射、动脉注射、组织定位注射、皮下注射、肌肉注射。
32.有益效果
33.(1)本发明实施例的外泌体中装载有神经营养因子和/或神经营养因子mrna,该外泌体仅通过单次静脉注射就可以靶向性地穿过血脑屏障向神经组织受体细胞递送神经营养因子,从而通过抗炎、抗凋亡、促进神经细胞存活、促进神经再生等方式来减轻神经组织损伤、促进修复。
34.(2)本发明实施例的外泌体在单次静脉注射2小时就能靶向神经组织受体细胞并被其摄取,其本身携带的一定量的神经营养因子就能直接释放到受体细胞中,从而实现对受体细胞的迅速治疗,并且其装载的神经营养因子mrna后续也会在受体细胞中翻译,直至mrna降解,而mrna能相对较长时间的稳定存在于该外泌体中,从而延长了神经营养因子在体内的半衰期。
35.(3)本发明实施例的外泌体可以促进其在脑缺血损伤区的集中,并且相对减少其他外周组织器官对外泌体的摄取,从而在治疗时减少对外周组织的毒性和其他非预期效应。
36.(4)本发明实施例的外泌体可以在-80℃的条件下稳定地贮存长达3个月,并且在此期间内,外泌体中装载的神经营养因子及其mrna也可以稳定贮存;进一步的,经过长期贮存的外泌体的治疗效果相对于新鲜收获的外泌体并没有显著下降。
37.(5)本发明实施例的外泌体的单次注射相对于直接将ngf蛋白质反复多次间断或持续的注射而言,也会减少副作用的产生。
附图说明
38.一个或多个实施例通过与之对应的附图中的图片进行示例性说明,这些示例性说明并不构成对实施例的限定。在这里专用的词“示例性”意为“用作例子、实施例或说明性”。
这里作为“示例性”所说明的任何实施例不必解释为优于或好于其它实施例。
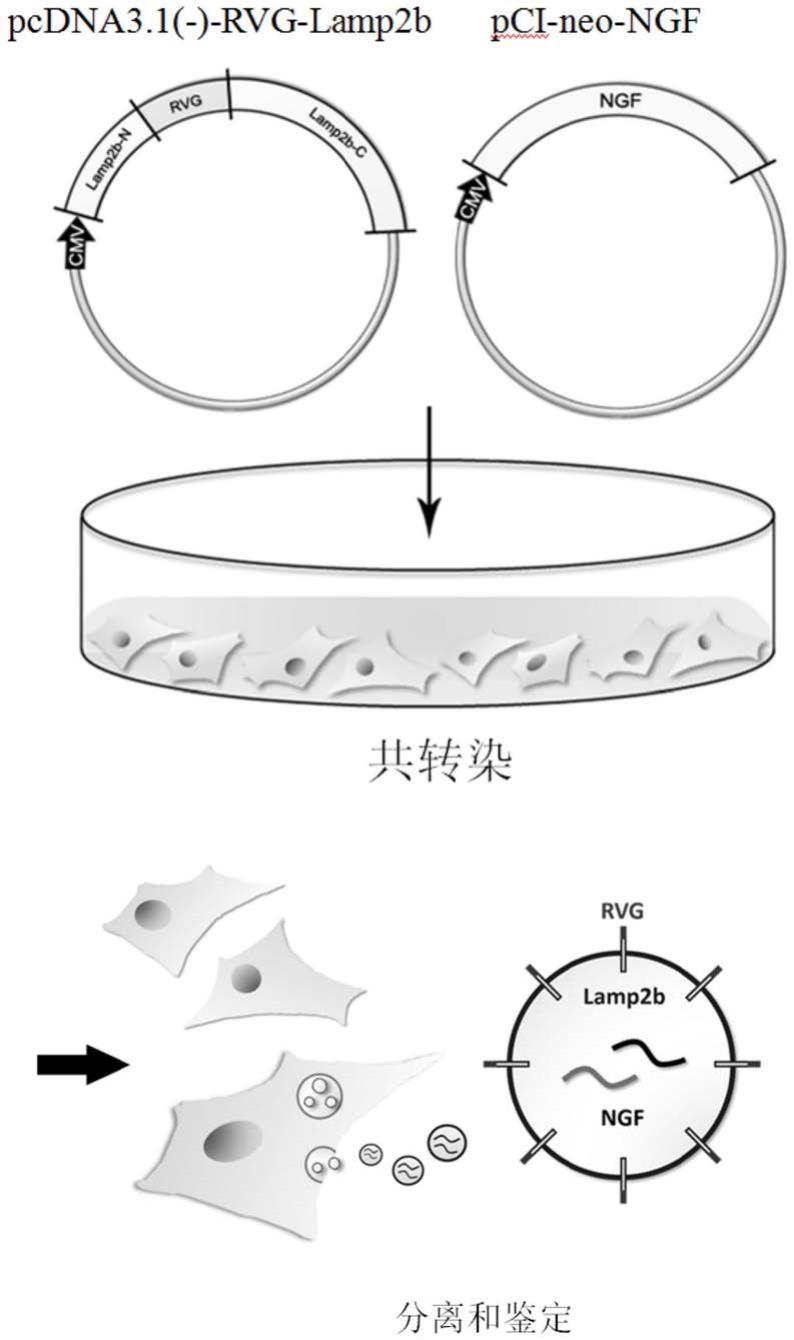
39.图1是本发明实施例1中质粒重组、共转染、外泌体分离鉴定的技术路线图。
40.图2a是本发明实施例2中未进行转染的hek293、共转染有pcdna3.1 pci-neo的hek293、共转染有rvg-lamp2b ngf hek293中ngf mrna的相对表达量。图2b是本发明实施例2中从未进行转染的hek293、共转染有pcdna3.1 pci-neo的hek293、共转染有rvg-lamp2b ngf hek293培养上清中获得的外泌体中ngf mrna的相对表达量。图2c是本发明实施例2中从未进行转染的hek293、共转染有pcdna3.1 pci-neo的hek293、共转染有rvg-lamp2b ngf hek293培养上清中获得的外泌体中的ngf蛋白的相对表达量。****表示p<0.0001。数据以3次不同实验的平均值
±
sem表示。
41.图3a是本发明实施例3中用不同剂量的ngf@exo
rvg
处理的hek293细胞中ngf mrna的表达量,hek293细胞在4h时收获。*表示p<0.05,**表示p<0.01,***表示p<0.001。图3b是本发明实施例3中用100μg ngf@exo
rvg
处理的hek293细胞中的不同时间的ngf蛋白表达量。**表示p<0.01,****表示p<0.0001。数据以3次不同实验的平均值
±
sem表示。
42.图4a是本发明实施例4中以下不同外泌体中ngf mrna的表达量:未转染hek293培养上清中新鲜收获的外泌体,新鲜收获的ngf@exo
rvg
,保存1个月或3个月的ngf@exo
rvg
。图4b是本发明实施例4中用新鲜收获的100μg ngf@exo
rvg
,保存1个月或3个月的ngf@exo
rvg
分别处理的hek293细胞中ngf mrna的表达量,hek293细胞在4h时收获,3组数据之间没有显著性差异。图4c是本发明实施例4中用新鲜收获的100μg ngf@exo
rvg
,保存1个月或3个月的ngf@exo
rvg
分别处理的hek293细胞中ngf蛋白质的表达量,hek293细胞在4h时收获,3组数据之间没有显著性。数据以3次不同实验的平均值
±
sem表示。
43.图5a是本发明实施例5中试验的技术路线图。图5b是本发明实施例5中dii标记的ctrl exo、exo
rvg
和ngf@exo
rvg
的体内跟踪。尾静脉注射外泌体后于2h收获脑、肝、脾、心、肺、肾,然后进行冰冻切片。ctrl exo组在缺血损伤区的dii荧光信号较少,而exo
rvg
组和ngf@exo
rvg
组的dii荧光信号强度较ctrl exo组显著增加。scale bar=50μm。图5c和图5d是本发明实施例5中ctrl exo组和ngf@exo
rvg
组处理小鼠后,ngf mrna和蛋白质在缺血损伤区对侧(contra)和同侧(ipsi)皮层的表达水平,ngf@exo
rvg
组脑缺血损伤组织中ngf mrna和蛋白显著升高。图5e和图5f是本发明实施例5中ngf@exo
ctrl
组和ngf@exo
rvg
组处理小鼠后,ngf mrna和蛋白质在缺血损伤区对侧(contra)和同侧(ipsi)皮层的表达水平,ngf@exo
rvg
组脑缺血损伤组织中ngf mrna和蛋白显著升高。数据以5次不同实验的平均值
±
sem表示。****,p<0.0001。
44.图6a和图6b是本发明实施例6中缺血区域cd16/iba1和cd206/iba1百分率的细胞计数值。数据以5只不同小鼠数据的平均值
±
sem表示。***,p<0.001;****,p<0.0001。
45.图7是本发明实施例6中缺血区tunel阳性/dapi阳性细胞百分比的细胞计数值。数据以5只不同小鼠数据的平均值
±
sem表示。****,p<0.0001。
46.图8是本发明实施例6中细胞定量每mm2缺血损伤区dcx阳性细胞计数值。数据以5只不同小鼠数据的平均值
±
sem表示。****,p<0.0001。
具体实施方式
47.为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中
的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
48.另外,为了更好的说明本发明,在下文的具体实施方式中给出了众多的具体细节。本领域技术人员应当理解,没有某些具体细节,本发明同样可以实施。在一些实施例中,对于本领域技术人员熟知的原料、元件、方法、手段等未作详细描述,以便于凸显本发明的主旨。
49.除非另有其它明确表示,否则在整个说明书和权利要求书中,术语“包括”或其变换如“包含”或“包括有”等等将被理解为包括所陈述的元件或组成部分,而并未排除其它元件或其它组成部分。
50.如无特殊记载,本发明实施例中的实验方法都是本领域常规方法,本发明实施例中的材料本领域技术人员都可以获得。
51.实施例1.ngf@exo
rvg
的构建与鉴定
52.在本技术中我们采用狂犬病病毒糖蛋白(rvg)与外泌体蛋白溶酶体相关膜糖蛋白2b(lamp2b)融合表达的质粒对外泌体进行靶向修饰,制备rvg修饰的外泌体,并向该rvg修饰的外泌体装载神经营养因子及其mrna。本实施例中以向该rvg修饰的外泌体装载人源重组ngf蛋白及其mrna为例,说明制备过程。
53.ngf@exo
rvg
的构建:我们采用rvg与lamp2b融合表达的质粒pcdna3.1(-)-rvg-lamp2b(记载于《exosome mediated delivery of mir-124 promotes neurogenesis after ischemia.》,pmid:28624203)与克隆有神经营养因子的重组载体pci-neo-ngf质粒(cn 102898514 a)(本技术中后续用rvg-lamp2b ngf共同表示这两个质粒)共同转染表达系统的人胚肾293细胞,收集细胞上清进行超速离心提取外泌体,即ngf@exo
rvg
(见图1)。
54.对照外泌体的构建:我们采用空载体pcdna3.1(-)和pci-neo(本技术中后续用pcdna3.1 pci-neo共同表示这两个质粒)共同转染人胚肾293细胞,收集细胞上清进行超速离心提取外泌体,即对照外泌体ctrl exo。
55.经western-blot检测,ctrl exo与ngf@exo
rvg
均可以显著表达外泌体的特征蛋白cd63,alix和tsg101,但是并不表达高尔基体特征蛋白gm130。与ctrl exo相比,ngf@exo
rvg
可以表达更高水平的lamp2b。
56.经透射电镜(tem)及nanosight颗粒跟踪分析显示,ctrl exo与ngf@exo
rvg
的形态、粒径分布、产量没有显著差异。ctrl exo与ngf@exo
rvg
的浓度没有显著差别,样品经1000倍稀释后,ctrl exo的浓度为(2.78
±
0.05)
×
108particles/ml(n=4),ngf@exo
rvg
的浓度为(2.70
±
0.04)
×
108particles/ml(n=4)。
57.实施例2.ngf@exo
rvg
内含ngf的检测
58.采用qrt-pcr检测未进行转染的hek293细胞、共转染有rvg-lamp2b ngf的hek293细胞、共转染有pcdna3.1 pci-neo hek293细胞中ngf mrna的表达水平,结果显示共转染有rvg-lamp2b ngf的hek293细胞内ngf mrna的含量水平显著升高(见图2a)。
59.采用qrt-pcr检测从未进行转染的hek293细胞、共转染有rvg-lamp2b ngf的hek293细胞、共转染有pcdna3.1 pci-neo hek293细胞培养上清中收获的外泌体中ngf mrna的表达水平,结果显示共转染有rvg-lamp2b ngf的hek293细胞培养上清收获的ngf@
exo
rvg
内ngf mrna的含量水平显著升高(见图2b)。
60.采用elisa检测从未进行转染的hek293细胞、共转染有rvg-lamp2b ngf的hek293细胞、共转染有pcdna3.1 pci-neo hek293细胞培养上清中收获的外泌体中ngf蛋白的表达水平,结果显示共转染有rvg-lamp2b ngf的hek293细胞培养上清收获的ngf@exo
rvg
内ngf蛋白的含量水平显著升高(见图2c)。
61.以上内容说明ngf@exo
rvg
可以有效装载ngf mrna和蛋白质。
62.实施例3.ngf@exo
rvg
可以向受体细胞递送ngf
63.前述结果证明ngf@exo
rvg
可以装载ngf mrna及蛋白质,我们还探索了外泌体ngf@exo
rvg
在被受体细胞摄取时,是否能够向受体细胞传递ngf。为此,我们向hek293细胞培养基中不加或加入20μg,50μg,100μg,200μg或300μg ngf@exo
rvg
进行孵育4h(如图3a所示)。采用qrt-pcr检测发现,不加ngf@exo
rvg
时,hek293细胞没有明显的神经生长因子的表达;加入100μg ngf@exo
rvg
可以显著增加受体细胞hek293内的ngf mrna水平。在与20μg和50μg ngf@exo
rvg
进行孵育后,神经生长因子虽然有上涨的趋势,但并没有显著增加神经生长因子mrna的表达;100-300μg ngf@exo
rvg
可以显著增加受体细胞hek293内的ngf mrna及蛋白质水平,当加入200μg和300μg ngf@exo
rvg
时受体细胞hek293内的ngf mrna及蛋白质水平增加相对较少,可能和受体细胞的摄取能力有关。
64.另外,为了进一步确认所递送的ngf mrna是否可以在受体细胞中被翻译成蛋白,我们将hek293细胞与100μg ngf@exo
rvg
共孵育2h,4h,8h,12h,24h。在收集hek293细胞并清洗三遍,然后进行elisa检测。结果表明:受体细胞中的ngf浓度在2h到4h内有上升,ngf表达量在8h时达到峰值,之后因为递送的ngf mrna和翻译的ngf蛋白质有所降解,在12h到24h期间有缓慢下降,但是在24h和2h时ngf蛋白的量还是有显著差异的,表明ngf mrna在其降解前会有持续的翻译(如图3b)。这些结果都表明ngf@exo
rvg
能有效将ngf递送到受体细胞。另外,升高的ngf蛋白质水平可以被蛋白翻译抑制剂chx部分抑制,也进一步验证了受体细胞hek293内的蛋白不止是ngf@exo
rvg
直接传递过来的蛋白,还包括由递送来的ngf mrna翻译后获得的。
65.实施例4.ngf@exo
rvg
可以稳定贮存较长时间
66.为了日后进行临床应用,我们对ngf@exo
rvg
经过长时间贮存后是否稳定进行了检测。我们将提取好的ngf@exo
rvg
冻存至-80℃,保存1个月或3个月。与未转染的hek293细胞中获得的外泌体相比,转染有新鲜收获的、保存1个月、保存3个月的ngf@exo
rvg
的hek293细胞中,ngf mrna的量都有显著增加(如图4a)。
67.另外,我们将新鲜收获的、保存1个月、保存3个月的ngf@exo
rvg
分别与hek293共孵育,并检测了受体细胞中ngf mrna和ngf蛋白的表达量(如图4b和图4c)。与新鲜收获的ngf@exo
rvg
相比,冻存了3个月的ngf@exo
rvg
在向受体细胞hek293递送ngf mrna及蛋白质的能力方面没有显著变化,这表明包裹在ngf@exo
rvg
中mrna及蛋白质的稳定性。长期的保存并没有影响ngf mrna及蛋白质的递送,为日后ngf@exo
rvg
作为成品制剂提供了数据参考。
68.实施例5.ngf@exo
rvg
可以递送ngf到达脑缺血损伤区
69.为了进一步确认ngf@exo
rvg
向脑缺血损伤区域递送ngf的效率,我们建立了脑缺血模型,在脑缺血后24h经尾静脉向小鼠注射200μg外泌体。注射2小时后将小鼠处死并进行荧光外泌体在体示踪,注射4h后进行qrt-pcr分析,注射8h后进行ngf elisa分析(如图5a所
示)。
70.动物与脑缺血模型的建立如下:
71.采用c56bl/6雄性小鼠,8-9周龄,体重22-23g。
72.脑缺血模型:将小鼠采用异氟烷麻醉,尾静脉注射琥珀红钠盐25mg/kg体重,头部皮肤消毒并用眼科剪剪开头皮,在距bregma点后侧0.5 to 2.5mm、中线旁开0.5 to 2.5mm制备颅窗,采用冷光源光纤照射8分钟,术后缝皮、消毒。
73.5.1荧光外泌体在体示踪检测
74.ngf@exo
rvg
及ctrl exo的获取同前描述。我们采用pcdna3.1(-)-rvg-lamp2b与pci-neo质粒共同转染人胚肾293细胞,收集细胞上清进行超速离心提取外泌体,即exo
rvg
,所得exo
rvg
与ngf@exo
rvg
的区别在于没有装载ngf。
75.为了评估外泌体在体内的分布,我们采用dii染料(1,1
’-
dioctadecyl-3,3,3’,3
’-
tetramethylindocarbocyanine perchlorate)标记上述ngf@exo
rvg
、ctrl exo以及exo
rvg
3种外泌体。
76.将脑缺血模型小鼠分组,包括:ngf@exo
rvg
组、ctrl exo组以及exo
rvg
组,向不同组的小鼠分别尾静脉注射相应种类的外泌体(注射量均为含有200μg外泌体的200μl生理盐水,即ngf@exo
rvg
组小鼠注射ngf@exo
rvg
外泌体、ctrl exo组小鼠注射ctrl exo外泌体以及exo
rvg
组小鼠注射exo
rvg
外泌体)后,取脑组织制作冰冻切片,经荧光显微镜观测:ctrl exo组小鼠在脑组织缺血损伤区仅有很少量荧光信号,在肝脏、脾脏、肺部有显著的荧光信号,在心脏、肾脏有很少量荧光信号;ngf@exo
rvg
组小鼠与exo
rvg
组小鼠的外泌体的分布没有显著差异,但是这两组小鼠相较于ctrl exo组小鼠,在脑组织缺血损伤区的荧光信号显著增加,在肝脏、脾脏、肺部的荧光信号有所减少,在心脏、肾脏有很少量荧光信号(如图5b所示)。上述结果提示,rvg-lamp2b修饰外泌体可以显著增加其向脑组织缺血损伤区的靶向性。
77.我们还将冰冻切片与不同细胞类型的标志物进行染色,发现dii标记ngf@exo
rvg
的荧光信号可以与神经元标志物neun、星形胶质细胞标志物gfap、小胶质细胞标志物iba1共标,提示这些细胞都可以摄取外泌体。
78.5.2检测ngf@exo
rvg
能否向脑缺血损伤区递送ngf
79.我们采用pcdna3.1(-)与pci-neo-ngf质粒共同转染人胚肾293细胞,收集细胞上清进行超速离心提取外泌体,即ngf@exo
ctrl
(所得外泌体没有rvg靶向性修饰,但是装载了ngf)。
80.将脑缺血模型小鼠分组,包括:ngf@exo
rvg
组、ctrl exo组以及ngf@exo
ctrl
组,向不同组的小鼠分别尾静脉注射相应种类的外泌体。注射4h后将小鼠处死进行qrt-pcr分析,8h后进行ngf elisa分析。qrt-pcr及elisa检测的结果显示(如图5c,图5d,图5e和图5f所示),相较于ctrl exo及ngf@exo
ctrl
,ngf@exo
rvg
可以显著增加脑缺血损伤区内的ngf mrna及蛋白质水平,而ngf@exo
ctrl
不能显著增加脑缺血损伤区内的ngf mrna及蛋白质水平。
81.实施例6.ngf@exo
rvg
可以通过抗炎、抗凋亡、促进神经再生减轻脑缺血损伤
82.如上所述,我们建立脑缺血模型,将脑缺血模型小鼠分组,包括:ngf@exo
rvg
组、exo
rvg
、ctrl exo组以及生理盐水组,在脑缺血后24h经尾静脉注射向不同组的小鼠分别尾静脉注射相应种类的外泌体或生理盐水(3个外泌体组的注射量均为含有200μg外泌体的
mrna和蛋白,可以显著促进m1型小胶质细胞向m2型小胶质细胞极化,增强细胞对凋亡的抵抗并促进其存活,促进脑缺血损伤区的神经再生,这些结果直接证实了ngf@exo
rvg
治疗脑缺血的疗效。
98.最后应说明的是:以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的精神和范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。