测定人血浆中辛伐他汀、
β
‑
羟酸辛伐他汀的方法
技术领域
1.本发明涉及一种人血浆中药物浓度的检测方法,具体涉及一种采用高效液相色谱串联质谱技术测定人血浆中辛伐他汀、β
‑
羟酸辛伐他汀的方法。
背景技术:
2.以辛伐他汀为代表的他汀类药物(statins)属于3
‑
羟基
‑
甲基戊二酰辅酶(hmg
‑
coa)还原酶抑制剂,辛伐他汀本身无活性,口服吸收后的主要水解产物辛伐他汀酸为活性代谢物,在体内具有显著的多靶器官效应性:
①
通过抑制胆固醇代谢路径的关键限速酶hmg
‑
coa来遏制甲醛戊酸的产生,降低ldl
‑
c,治疗高脂血症;
②
治疗心血管系统疾病,动脉粥样硬化或心肌缺血等;
③
有拮抗炎症、抗增殖、抗血栓形成及免疫抑制等诸多对机体有益的作用。
3.辛伐他汀被认为是除了饮食疗法之外治疗高脂血症的首选药物之一。辛伐他汀对降低原发性高脂血症、杂合子家族性高胆固醇血症、家族性和非家族性异常β脂蛋白血症或混合型高胆固醇血症糖尿病和肾病综合征的高脂血症的疗效很好。另外对于冠心病合并高胆固醇血症的患者,辛伐他汀可以降低死亡危险性,降低冠心病死亡和非致死性心肌梗塞的危险性,降低中风和短暂性脑缺血的危险性。另外可以提高对脑血管疾病患者的疗效改善其预后,可对糖尿病合并高脂血症患者有明显的治疗和改善其预后,也可改善颈总动脉粥样硬化。
4.辛伐他汀(sv)在体内经肝脏代谢后,95%代谢为辛伐他汀酸(sva)发挥作用,血药浓度较低,采用一般的hplc法难以达到理想的测定结果,选择uplc-ms/ms方法同时测定血浆中的sv及其活性代谢产物sva的浓度以及血药浓度与时间的函数关系,合并计算药代动力学及生物利用度,更有实际意义。文中建立的方法能同时测定血浆中的sv和sva,可用于辛伐他汀制剂的药动学及生物等效性研究。
技术实现要素:
5.发明目的:本发明的目的是提供一种采用高效液相色谱串联质谱技术能分别定量检测血浆中辛伐他汀、β
‑
羟酸辛伐他汀的方法。该检测方法前处理简单、质谱采集时间短、成本低廉、方便实验室进行大规模临床样本检测。
6.技术方案:
7.本发明取用200μl血浆样品进行简单的液液萃取处理后同时测定辛伐他汀、β
‑
羟酸辛伐他汀浓度;该发明操作简便,前处理简单,质谱采集时间短(4min),各项验证指标均满足法规要求,能准确定量辛伐他汀、β
‑
羟酸辛伐他汀,最大限度上简化和方便实验室操作,满足临床的需求。
8.本发明所述的一种采用高效液相色谱串联质谱技术能分别定量检测血浆中辛伐他汀、β
‑
羟酸辛伐他汀的方法,包括以下步骤:
9.(1)血浆样品预处理
10.在黄光冰浴条件下,将待测样品200μl移取至2ml离心管中,再加10μl氘代混合内标工作溶液,加入1200μl的mtbe,将样品涡旋5分钟后,在10000rpm、4℃条件下离心5分钟,用移液枪移取上清液1000μl至新的96孔板中,在25℃条件下氮气流吹干;加入200μl的含0.1%甲酸水:乙腈(1:1)复溶,涡旋3分钟,在4000rpm、4℃条件下离心5分钟,得到待测样品;
11.(2)标准曲线和质控血浆样品的配制
12.使用乙腈:水(1:1)溶液配制标曲和质控工作溶液,所述工作溶液包括辛伐他汀、β
‑
羟酸辛伐他汀工作溶液,取上述工作溶液10μl与490μl空白血浆基质混合配制成不同浓度的标准曲线样品和质控样品,用辛伐他汀、β
‑
羟酸辛伐他汀和内标的峰面积比和标准样品的浓度来建立标准曲线,得到相应的线性回归方程。
13.(3)采用液相色谱
‑
质谱联用检测
14.①
液相色谱条件:色谱柱:xselect c18 2.1*50mm 3.5μm;
15.流动相:水相:0.1%甲酸水,有机相:0.2%甲酸乙腈,洗针液:甲醇:水(1:1);
16.柱温:室温;自动进样器温度:4℃;
17.采用水相和有机相为混合流动相进行梯度洗脱,每个样品采集时间为4min,进样体积为10μl,流速为0.6ml/min,流动相梯度洗脱参数如下:0min,50%有机相;2.1min,85%有机相;2.9min,85%有机相;2.91min,50%有机相;4min,停止。
18.②
质谱条件:在电喷雾电离检测模式下,采用多反应监测的质谱扫描模式,其中辛伐他汀采用正离子模式,β
‑
羟酸辛伐他汀采用负离子模式,离子化电压(is)分别为3000v和
‑
4500v,离子源温度(tem):500℃,气帘气(cur):35psi,入口电压(ep)分别为10v和
‑
10v,碰撞气(cad):9psi,雾化气(gas1):50psi,涡轮气(gas2):45psi,离子对分别为:m/z 441.3
→
325.2(sv),m/z 447.3
→
325.2(sv
‑
d6),m/z435.31
→
319.18(sva),m/z 441.3
→
319.1(sva
‑
d6)。
19.(4)待测血浆中各物质的浓度测定
20.将待测血浆按步骤(1)样品制备的方法制备,取待测样品按步骤(3)采用液相色谱
‑
质谱联用检测的方法检测,将测得的辛伐他汀、β
‑
羟酸辛伐他汀和各自内标的峰面积比值代入所建的标准曲线中,计算得到待测血浆中辛伐他汀、β
‑
羟酸辛伐他汀的浓度。
21.有益效果:
22.辛伐他汀酸结构中含有酸性羧基,在阳离子和阴离子检测方式下都有质谱响应。辛伐他汀酸在阴离子模式下响应较大,但是所出峰有杂质干扰,而辛伐他汀只能用阳离子模式检测。同一样品通过正负离子切换的模式来测定,需将正负离子模式下分别检测的待测物充分分离,以留出足够的时间进行正负离子切换,从而保证两种模式互不干扰的质谱原理决定了阳离子模式和阴离子模式不能同时测定。
23.因为辛伐他汀对热及碱性条件敏感,在提取时应使用适量的缓冲液以控制溶液的ph,同时应注意环境温度的影响。辛伐他汀与辛伐他汀酸在溶液中可相互转化,血浆样本一般需低温避光或采用酸化血浆的方式进行处理。本研究开始采用低温避光方式,但处理过程中发现血浆样品稳定性略差,遂选择酸化血浆的方式对血浆样品进行处理,结果能够保证血浆样品处理过程及低温保存的稳定性。
24.辛伐他汀血浆样品的预处理方法有沉淀蛋白法和液
‑
液萃取法。沉淀蛋白法虽然
操作简便、分析成本低,但处理后血浆基质成分的干扰较大,且容易污染色谱柱和离子源,因此,实验中采用液-液萃取的方法对辛伐他汀血浆样品进行预处理。液液萃取常用溶剂有:甲基叔丁基醚(mtbe)、乙酸乙酯(etoac)以及乙醚(dee)等等。我们评价了mtbe和etoac对基质效应和回收率的影响,结果显示,mtbe作为提取溶剂,无论在提取回收率还是基质效应方面都比etoac有优势,所以最终选择了mtbe作为最终的萃取溶剂。
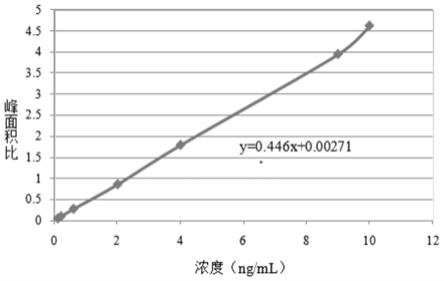
25.经验证的辛伐他汀的线性定量范围为0.100ng/ml
‑
10.0ng/ml,β
‑
羟酸辛伐他汀的线性定量范围为0.100ng/ml
–
10.0ng/ml(因空白生物基质由空白人血浆:200mm乙酸铵(ph4.5)=1:1(v/v)配制得到,换算后辛伐他汀的标准曲线范围为0.100ng/ml至10.0ng/ml,β
‑
羟酸辛伐他汀的标准曲线范围为0.100ng/ml至10.0ng/ml。若无特殊说明,后续提到的标准曲线范围均指换算后的标准曲线范围)。
26.本研究建立了一种高效液相色谱串联质谱技术(lc
‑
ms/ms),分别测定人体血浆中辛伐他汀、β
‑
羟酸辛伐他汀的方法。采用同位素内标法定量可以极大的消除基质干扰,而且结果不受前处理过程、仪器响应波动等条件的影响,能够达到准确定量。本发明采用液液萃取,前处理过程简单,灵敏度高,单个样品分析时间短,大大降低了耗材成本,缩短了操作时间,采用稳定的同位素内标定量结果准确,所有验证项均满足法规要求,在本发明条件下辛伐他汀、β
‑
羟酸辛伐他汀均可准确定量,可用于临床药代动力学研究,为相应的药物浓度监测提供了一种稳定、可靠、简便的检测方法。
附图说明
27.图1为辛伐他汀代表性标准曲线图。
28.图2为β
‑
羟酸辛伐他汀代表性标准曲线图。
具体实施方式
29.为了加深对本发明的理解,下面将结合实施例和附图对本发明作进一步详述,该实施例仅用于解释本发明,并不构成对本发明保护范围的限定。
30.仪器:ab5500三重四级杆质谱仪(美国ab sciex公司),配岛津uplc
‑
30a超高效液相系统(日本岛津公司);xpr2百万分之一天平(瑞士mettler公司);万分之一天平(双杰电子);milli
‑
q纯水仪(默克化工);centrifuge 5810r离心机(eppendorf,hettich);可调移液器(eppendorf 2
‑
20μl,10
‑
100μl,20
‑
200μl,100
‑
1000μl);96孔板、样品瓶等。
31.空白基质、试剂和对照品:本发明所用空白基质均来自于潍坊高新技术产业开发区人民医院;乙酸(hplc,dikmiapure/macklin),乙腈(hplc,merck),水为自制超纯水,甲醇(hplc,merck),甲酸(hplc,aladdin),乙酸铵(ar,上海凌峰),甲基叔丁基醚(mtbe)(hplc,tedia);辛伐他汀(中检院,100601
‑
201906,含量99.5%),β
‑
羟酸辛伐他汀(两支,tlc,3019
‑
100a3,含量93.2%/92.8%),辛伐他汀
‑
d6(tlc,3305
‑
092a2,含量99.0%),β
‑
羟酸辛伐他汀
‑
d6(tlc,3411
‑
001a2,含量97.1%)。
32.实施例1实验过程
33.1.血浆样品预处理;
34.移取200μl样品(空白样品和内标空白样品加200μl空白生物基质)至2ml离心管中,加入10μl混合内标工作溶液(空白样品加入10μl乙腈:水(1:1)代替);分别加入1200μl
的mtbe,将样品涡旋5分钟后,在10000rpm、4℃条件下离心5分钟,用移液枪移取上清液1000μl至新的96孔板中,在25℃条件下氮气流吹干;加入200μl的含0.1%甲酸水:乙腈(1:1)复溶,涡旋3分钟,在4000rpm、4℃条件下离心5分钟,交由lc
‑
ms/ms进样分析。
35.2.标准曲线和质控血浆样品的配制
36.(1)辛伐他汀、β
‑
羟酸辛伐他汀储备液和工作溶液的配制:
37.①
辛伐他汀储备液ss
‑
a(sv)
38.精密称取辛伐他汀对照品,用适量的乙腈溶解,配制成浓度为1.00mg/ml的储备液ss
‑
a(sv)(使用校正因子)。
39.②
β
‑
羟酸辛伐他汀储备液ss
‑
a(sva)
40.精密称取simvastatin ep impurity a sodium salt对照品,用适量的乙腈:水(1:1)溶解,配制成浓度为1.00mg/ml的储备液ss
‑
a(sva)(使用校正因子)。
41.③
辛伐他汀及其代谢产物β
‑
羟酸辛伐他汀储备液b(ss
‑
b)
42.取0.02ml的ss
‑
a(sv),0.02ml的ss
‑
a(sva)加到1.96ml的乙腈:水(1:1)溶液中,混合均匀配制成10/10μg/ml(sv/sva)的储备液ss
‑
b。
43.④
辛伐他汀及其代谢产物β
‑
羟酸辛伐他汀储备液c(ss
‑
c)
44.取0.2ml的ss
‑
b加到1.8ml的乙腈:水(1:1)溶液中,混合均匀配制成1/1μg/ml(sv/sva)的储备液ss
‑
c。
45.⑤
辛伐他汀及其代谢产物β
‑
羟酸辛伐他汀储备液d(ss
‑
d)
46.取0.2ml的ss
‑
c加到1.8ml的乙腈:水(1:1)溶液中,混合均匀配制成0.1/0.1μg/ml(sv/sva)的储备液ss
‑
d。
47.表1:按照下表使用乙腈:水(1:1)配制标曲和质控工作溶液,标曲和质控工作液来自于不同的储备液
[0048][0049]
(3)内标储备液及工作液配制:
[0050]
用适量的乙腈溶解辛伐他汀
‑
d6对照品,配制成浓度为1.00mg/ml的内标储备液is
‑
a(sv
‑
d6)(使用校正因子)。
[0051]
用适量的乙腈:水(1:1)溶解simvastatin ep impurity a
‑
d6sodium salt对照品,配制成浓度为1.00mg/ml的内标储备液is
‑
a(sva
‑
d6)(使用校正因子)。
[0052]
取0.0300ml的is
‑
a(sv
‑
d6),0.0300ml的is
‑
a(sva
‑
d6)加到2.94ml的乙腈:水(1:1)中,混合均匀配制成10.0/10.0μg/ml(sv
‑
d6/sva
‑
d6)的内标储备溶液is
‑
b。
[0053]
取0.01ml的is
‑
b加到4.99ml的乙腈:水(1:1)中,混合均匀配制成20/20ng/ml(sv
‑
d6/sva
‑
d6)的内标工作溶液is
‑
c。
[0054]
(4)标准曲线和质控血浆样品的配制:
[0055]
各取上述工作溶液10μl与490μl空白血浆基质混合配制成不同浓度的标准曲线样品和质控样品,标曲浓度分别为:辛伐他汀/β
‑
羟酸辛伐他汀(0.1/0.1ng/ml、0.2/0.2ng/ml、0.6/0.6ng/ml、2/2ng/ml、4/4ng/ml、9/9ng/ml、10/10ng/ml);质控浓度分别为辛伐他汀/β
‑
羟酸辛伐他汀(0.1/0.1ng/ml、0.3/0.3ng/ml、1/1ng/ml、8/8ng/ml)。
[0056]
3.hplc
‑
ms/ms检测:
[0057]
(1)液相色谱条件:
[0058]
流动相(水相:0.1%甲酸水,有机相:0.2%甲酸乙腈,洗针液:甲醇:水(1:1));
[0059]
色谱柱:xselect c18 2.1*50mm 3.5μm;
[0060]
柱温:室温;自动进样器温度:4℃;
[0061]
采用水相和有机相为混合流动相进行梯度洗脱,详见表3,每个样品采集时间为4min,进样体积为10μl,流速为0.6ml/min。
[0062]
表3:流动相梯度洗脱参数
[0063]
时间(min)02.12.92.914%有机相50858550stop
[0064]
(2)质谱条件:
[0065]
在电喷雾电离检测模式下,采用多反应监测的质谱扫描模式,其中β
‑
羟酸辛伐他汀采用负离子模式,辛伐他汀采用正离子模式,各个待测物及内标相应的质谱参数见表4。
[0066]
表4:质谱参数
[0067]
参数:优化数值(
‑
)优化数值( )离子化电压(is):
‑
4500v3000v气帘气(curtain gas):3535温度(temperature):500℃500℃人口电压(ep):
‑
1010碰撞气(cad):99停留时间(dwell time):200msec200msec雾化气(gas 1):5050涡轮气(gas 2):4545
[0068][0069]
4.待测血浆中各物质的浓度测定:
[0070]
将待测血浆按步骤(1)样品制备的方法制备,取待测样品按步骤(3)采用液相色谱
‑
质谱联用检测的方法检测,用辛伐他汀、β
‑
羟酸辛伐他汀和内标的峰面积比和标准样品的浓度来建立标准曲线,得到相应的线性回归方程,将测得的辛伐他汀、β
‑
羟酸辛伐他汀和各自内标的峰面积比值代入所建的标准曲线中,计算得到待测血浆中辛伐他汀、β
‑
羟酸辛伐他汀的浓度。
[0071]
实施例2方法学考察
[0072]
(1)准确度和精密度试验:各取上述对应工作液10μl与490μl空白基质混合,配制成lloq、lqc、mqc、hqc 4个不同浓度的质控样品,每个浓度6个重复,随行新鲜配制的标准曲线进行测定,结果显示,辛伐他汀re%在0.81~2.68之间,%cv在4.03~7.84之间;β
‑
羟酸辛伐他汀re%在1.23~5.60之间,%cv在3.61~7.17之间。
[0073]
(2)基质效应、提取回收率试验:以至少6个不同来源的空白人血浆制备的空白样品,前处理后加入一定量的待测物和内标,使其最终浓度分别与lqc、hqc的进样浓度一致,同时配制含有一定量待测物和内标的纯溶液,其最终浓度分别与lqc、hqc的进样浓度一致,每个浓度平行测定至少6份。对于每个来源基质,应该通过计算基质存在下的峰面积(由空白人血浆前处理后加入待测物和内标测得),与不含基质的样品(待测物和内标的纯溶液)相应峰面积平均值的比值,计算每一待测物和内标的基质因子。进一步通过待测物的基质因子除以内标的基质因子,计算经内标归一化的基质因子。结果显示,辛伐他汀经内标归一化基质效应因子分别为0.975和0.975,%cv分别为3.73和2.91;β
‑
羟酸辛伐他汀经内标归一化基质效应因子分别为1.01和1.03,%cv分别为3.67和1.90。
[0074]
(3)回收率试验:6个重复的lqc、mqc、hqc与18个混合空白血浆样品一同处理。处理后,将含有待测物和内标的溶液加入空白样品中,以使其最终浓度与高、中、低质控样品的进样浓度一致。通过比较单个质控样品中待测物或内标响应值与前处理后加入待测物、内标的空白样品的响应值的平均值来评价回收率。结果显示,辛伐他汀待测物提取回收率分别为55.72%、49.90%、56.07%,%cv分别为5.58、10.53、9.76,内标提取回收率为59.52%,%cv为10.11;β
‑
羟酸辛伐他汀待测物提取回收率分别为72.85%、65.37%、64.96%,%cv分别为6.89、7.29、8.06,内标提取回收率为71.67%,%cv为6.67。
[0075]
(4)稳定性试验:稳定性试验考察了稳定性样品在不同条件下(前处理过程中,制备后,冻融循环,长期稳定性,全血中)放置一段时间后,用新鲜配置的标准曲线定量稳定性样品与理论浓度的偏差,结果表明,辛伐他汀、β
‑
羟酸辛伐他汀基质样品在不同条件下放置一段时间后均保持稳定。
[0076]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。