1.本发明涉及基因工程领域,尤其涉及一种基于斜带石斑鱼mstn自体基因疫苗的构建方法。
背景技术:
2.肌肉生长抑制素基因(myostatins,mstn)是一种抑制肌肉细胞增殖生长的负调控基因,属于tgf
‑
β家族成员,故又称为gdf
‑
8。研究表明,该基因表达的抑制或突变失活,能阻断mstn对肌细胞增殖生长的抑制作用,引起广泛的肌肉增殖并显著降低体表脂肪的沉积,产生以肌纤维数量显著增加、体重显著增大为特征的肌肥大现象,即所谓的“双肌性状”。
3.制备mstn基因工程疫苗并用该疫苗进行免疫,然后利用自身的免疫系统长期生产抗mstn的抗体,该抗体完全具有专门结合和抑制mstn的能力,从而能够解除mstn对肌细胞生长的抑制作用。目前,关于利用mstn进行主动免疫的方法主要集中在畜牧业,如牛、羊、猪等,在水产领域中,尤其是斜带石斑鱼的养殖中很少有关于mstn的报道。
技术实现要素:
4.本发明克服了现有技术的不足,提供一种基于斜带石斑鱼mstn自体基因疫苗的构建方法。
5.为达到上述目的,本发明采用的一种技术方案为:一种基于斜带石斑鱼mstn自体基因疫苗的构建方法,其特征在于,包括以下步骤:
6.s1外源基因设计:外源基因为“kozak序列
‑
乙型脑炎病毒信号肽
‑
乙型肝炎病毒表面核心抗原
‑
ss
‑
ss
‑
th表位
‑
linker连接序列
‑
斜带石斑鱼mstn成熟肽基因序列”,将其合成并克隆至t载;
7.s2酶切:采用takara nhe i和xho i酶在37℃分别对s1中的重组质粒和pcdna3.1 载体进行双酶切,然后使用dna片段纯化试剂盒进行片段回收;
8.s3连接反应:通过t4 dna连接酶连接将s2中的载体片段和外源基因片段,反应体系在16℃下连接8h;
9.s4转化:将jm109感受态细胞从
‑
80℃超低温冰箱中取出,置于冰上溶解后,将s3中的接连产物加入,然后加入不含抗性的lb液体培养基,然后生化箱中培养,再进行pcr验证,获得阳性菌种;
10.s5质粒的大量培养及纯化:将s5中获得的阳性菌种在含有相应抗性的lb液体培养基中培养,然后在溶菌酶的作用下获得质粒溶液,质粒溶液加入纯化仪,得到纯化的质粒溶液;
11.s6质粒浓缩:s5中获得的质粒浓度为500ng/μl,对质粒进行浓缩后,将浓度分别调整为500ng/μl、1000ng/μl、2000ng/μl后于
‑
80℃保存,获得mstn自体核酸疫苗。
12.在本发明的一个较佳实施例中,进一步包括,外源基因的重组质粒和载体双酶切体系包括:1.0μl nhe i,1.0μl xho i,≤2.0μg基因/质粒,2.0μl 10
×
buffer,不超过20.0
μl ddh20,20.0μl total volume。在本发明的一个较佳实施例中,进一步包括,s2中使用dna片段纯化试剂盒进行片段回收的方法包括以下步骤:
13.s201向pcr反应液中加入3倍体积的buffer dc,然后均匀混合;
14.s202将试剂盒中的spin column安置于collection tube上;
15.s203将s201的溶液转移至spin column中,12000rpm、室温的状态下离心1min,弃滤液;
16.s204将700μl的buffer wb加入spin column中,12000rpm、室温的状态下离心30s,弃滤液;
17.s205重复操作步骤s204;
18.s206将spin column安置于collection tube上,12000rpm、室温的状态下离心1min;
19.s207取新的1.5ml的离心管并将spin column安置于上,在spin column膜的中央处加入30μl左右的elution buffer,室温静置1min;
20.s208 12000rpm、室温的状态下离心1min洗脱dna。
21.在本发明的一个较佳实施例中,进一步包括,s3中接连反应的反应体系如下:6.0μl外源基因片段,6.0μl载体片段,1.0μl t4 dna连接酶,1.0μl 10
×
t4 dna ligation buffer,10.0μl total volume。
22.在本发明的一个较佳实施例中,进一步包括,s4转化过程中包括以下步骤:
23.s401将jm109感受态细胞从
‑
80℃超低温冰箱中取出,置于冰上溶解后将上述10μl连接产物全部加入,用移液枪吹打几次;
24.s402冰上孵育45min左右,然后转移至42℃水浴锅热激90s后立即停止取出,冰上静置10min;
25.s403加入不含抗性的lb液体培养基400μl,在37℃,200rpm的摇床振荡培养60min;
26.s404 4000rpm,离心5min后取出,弃掉上层液体,留下100μl左右液体,用移液枪吹打均匀;
27.s405将上述100μl液体均匀滴到含有抗性的平板上,用涂布棒将液体涂抹分散,涂布棒在使用前必须高温灭菌,并待温度低至室温方可使用,此过程全部在超净台中操作;
28.s406将平板置于37℃生化培养箱,正面放置1h,然后倒置过夜;
29.s407挑选平板上的单个白色菌落,加入装有含抗性的1ml lb液体培养基的1.5ml离心管中,用移液枪吹打数次,在200rpm,37℃条件下震荡培养。
30.s408 3
‑
4h后,取上述培养菌液进行pcr验证;
31.s409将上述反应产物进行核酸凝胶电泳,挑选电泳结果为阳性的菌液。
32.在本发明的一个较佳实施例中,进一步包括,s408中的反应体系包括:5.0μl pcr mix,3.5μl primer f/r,1.0μl菌液,0.5μl ddh2o,11.0μl total volume,反应程序:94℃3min;35cycles:94℃30s;55℃1min;72℃10min,4℃无限。
33.在本发明的一个较佳实施例中,进一步包括,s5质粒的大量培养及纯化的步骤包括:
34.s501将阳性菌接种到6l含有相应抗性的lb液体培养基中,于37℃,200rpm摇床过夜培养;
35.s502将过夜培养的菌液分装到6个50ml离心管中,4000g离心10min,弃上清;
36.s503向每管的沉淀物中加入solutionⅰ40ml,剧烈震荡直到沉淀完全溶解,分装到200ml玻璃瓶中;
37.s504向每个玻璃瓶加入4ml的溶菌酶溶液,轻轻混匀;
38.s505取solutionⅱ80ml加入到广口瓶中,拿起玻璃瓶轻轻的快速颠倒数次以混合内容物,摇晃后放置在冰水中冰浴30min;
39.s506待溶液清亮,加入solutionⅲ,轻轻摇晃,此时产生大量絮状沉淀;
40.s507置于冰水中冰浴10min,在8层纱布上进行过滤,取全部清夜;
41.s508洗涤中空纤维过滤系统akta flux:打开akta flux,先用50ml 0.5mol/l naoh洗涤仪器,接着再加入50ml 10%酒精洗涤,最后加入50ml纯水洗涤;
42.s509使用筛孔cfp
‑4‑
e
‑
2u,将得到的质粒溶液加入纯化仪,设置参数为mixer 40,feed 50纯化,将纯化得到的溶液全部保存;
43.s510再次洗涤机器如上s508步骤;
44.s511将筛孔换成ufp
‑
300
‑
c
‑
2u,同样设置参数为mixer 40,feed50,继续纯化s510得到的溶液,将溶液纯化到原来量的一半,将所得质粒溶液保存。
45.在本发明的一个较佳实施例中,进一步包括,s6中质粒浓缩的步骤包括:
46.s601加入一定体积的质粒溶液,再加入质粒溶液体积1/10的乙酸钠于质粒溶液中充分混匀,乙酸钠的浓度为3mol/l,ph=5.2,使其最终浓度为0.3mol/l;
47.s602加入2倍质粒溶液体积的冰上预冷无水乙醇,再次混匀,于
‑
20℃的环境中静止20min;
48.s603室温下12000g离心10min,小心移除上清液,吸去壁管上所有的液滴;
49.s604加入1/2离心管容量的70%乙醇,12000g离心2min,小心移除上清液,吸去壁管上所有的液滴;
50.s605于室温下将开盖的离心管置于实验桌上以使残留的液体挥发至干;
51.s606加适量的去离子水溶解质粒沉淀;
52.s607测得浓缩后质粒浓度,将浓度分别调整为500ng/μl、1000ng/μl、2000ng/μl后于
‑
80℃保存。
53.在本发明的一个较佳实施例中,进一步包括,mstn自体基因疫苗用于斜带石斑鱼进行免疫。
54.本发明解决了背景技术中存在的缺陷,本发明具备以下有益效果:
55.(1)本技术的疫苗构建技术路线简单有效,可操作性强,并且疫苗的免疫效果较好。
56.(2)经过本技术制备的mstn自体基因疫苗对斜带石斑鱼进行免疫后,注射剂量为200μg的实验组与对照组的增长速度和增重率存在显著性差异,注射剂量为100μg的实验组与对照组的增重速度存在显著性差异;在第三次注射至取样期间,注射剂量为100μg的实验组与对照组的增长速度和增重速度均存在显著性差异。
57.(3)本技术中将斜带石斑鱼的肌肉制成石蜡切片并进行he染色,显微镜下拍照(a、b、c、d)。通过adobe photoshop cs6软件进行图片处理,计算对照组与三个实验组单个肌纤维平均相对横截面积,发现与对照组相比,总体而言实验组平均肌纤维相对横截面积均大
于对照组,且随着实验组免疫剂量的增加,平均肌纤维相对横截面积增大,通过统计分析发现,对比对照组,注射剂量为100μg和200μg的实验组存在显著性。
58.(4)本技术中对养殖结束后的实验鱼进行肌肉取样,提取组织rna并反转录制成cdna模板。通过rt
‑
qpcr检测smad3、myod、myog、p21和mrf4等mstn信号通路下游及相关基因的表达量。免疫mstn自体核酸疫苗后,与对照组相比,三个剂量实验组的smad3和mrf4的mrna表达量均呈下降趋势,经过统计学分析,其中当剂量为50μg和100μg时smad3并不存在显著性差异,当剂量为200μg时差异显著,当剂量为50μgmrf4并不存在显著性差异,当剂量为100μg和200μg时差异显著;myod、myog和p21的mrna表达量均呈上升趋势,但均在剂量为200μg时才存在显著性差异。
附图说明
59.下面结合附图和实施例对本发明进一步说明;
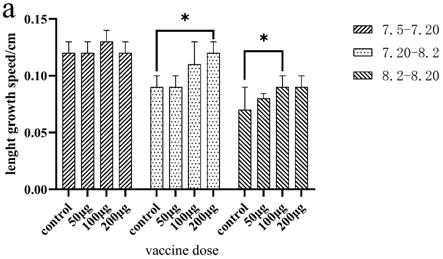
60.图1斜带石斑鱼体长增长速度图;
61.图2斜带石斑鱼体长增长率图;
62.图3斜带石斑鱼体重增重速度图;
63.图4斜带石斑鱼体重增重率图;
64.图5对照组肌纤维石蜡切片he染色;
65.图6免疫50μg组肌纤维石蜡切片he染色;
66.图7免疫100μg组肌纤维石蜡切片he染色;
67.图8免疫200μg组肌纤维石蜡切片he染色图;
68.图9单个肌纤维的平均相对面积图;
69.图10 smad3的表达量图;
70.图11 p21的表达量图;
71.图12 myog的表达量图;
72.图13 myod的表达量图;
73.图14 mrf4的表达量图。
具体实施方式
74.现在结合实施例对本发明作进一步详细的说明。
75.实施例1:本实施例中公开了一种基于斜带石斑鱼mstn自体基因疫苗的构建方法,具体步骤如下:
76.一、方案设计:
77.(1)外源基因设计:kozak序列
‑
乙型脑炎病毒信号肽
‑
乙型肝炎病毒表面核心抗原
‑
ss
‑
ss
‑
th表位
‑
linker连接序列
‑
鱼mstn成熟肽基因序列。
78.(2)设计说明:
79.①
添加kozak序列是pcdna3.1 载体说明书中要求的,可以提高外源蛋白的表达;
80.②
添加乙型脑炎病毒信号肽是为了正确引导外源蛋白,提高蛋白生物学效率;
81.③
添加th(辅助性t细胞)表位于乙肝表面核心抗原基因内部,是为了提高蛋白的免疫原性;之所以放在内部是参考了其它文献;
82.④
添加乙肝表面核心抗原基因是为了使mstn成熟肽外源性,因为鱼体免疫系统只能识别非自身的蛋白并产生抗体,若不添加乙型脑炎病毒核心抗原只有mstn成熟肽基因的话,是不可能激发免疫系统产生抗体的;
83.⑤
添加ss(生长抑素)基因是因为ss和mstn都是抑制肌肉生长的基因;
84.⑥
添加
‑
linker连接序列是因为乙肝表面核心抗原蛋白如果和mstn成熟肽蛋白紧紧的连接在一起,可能会影响mstn成熟肽蛋白的生物学功能,就如同两个人并排走路,需要相隔一定的距离才能走好,如果把两个人的手脚绑在一起,就很难行走。所以添加一个人畜无害的连接序列及连接了两个蛋白在一起,又给两个蛋白一定的空间去发挥各自的生物学功能。
85.⑦
整个外源基因串联在一起后,需要对密码子优化,以达到在鱼体内表达最优的目的,以提高表达量。
86.(3)将外源基因“外源信号肽 乙肝病毒表面核心抗原 mstn成熟肽”交上海生工合成后,克隆至pcdna3.1 载体,最终得到重组质粒以及阳性菌。
87.二、酶切与片段回收
88.(1)双酶切:采用takara nhe i和xho i酶按如下体系在37℃分别对外源基因重组质粒和载体进行双酶切:
89.表1外源基因重组质粒和载体双酶切体系
[0090][0091]
(2)片段回收使用dna片段纯化试剂盒(takara),按照说明书操作如下:
[0092]
①
向pcr反应液(或其它酶促反应液)中加入3倍体积的buffer dc(如果需加入的buffer dc量不足100μl时应加入100μl),然后均匀混合;
[0093]
②
将试剂盒中的spin column安置于collection tube上;
[0094]
③
将上述操作
①
的溶液转移至spin column中,12000rpm、室温的状态下离心1min,弃滤液;
[0095]
④
将700μl的buffer wb加入spin column中,12000rpm、室温的状态下离心30s,弃滤液;
[0096]
⑤
重复操作步骤
④
;
[0097]
⑥
将spin column安置于collection tube上,12000rpm、室温的状态下离心1min;
[0098]
⑦
取新的1.5ml的离心管并将spin column安置于上,在spin column膜的中央处加入30μl左右的elution buffer,室温静置1min(注:将elution buffer加热至60℃使用);
[0099]
⑧
12000rpm、室温的状态下离心1min洗脱dna。
[0100]
三、连接反应
[0101]
通过t4 dna连接酶连接将上述载体片段和外源基因片段,连接体系按照t4 dna连接酶说明书进行,如下表配制反应体系并在16℃连接8h:
[0102]
表2 mstn和载体连接反应体系
[0103][0104][0105]
四、转化
[0106]
(1)jm109感受态细胞从
‑
80℃超低温冰箱中取出,置于冰上溶解后将上述10μl连接产物全部加入,用移液枪吹打几次;
[0107]
(2)冰上孵育45min左右,然后转移至42℃水浴锅热激90s后立即停止取出,冰上静置10min;
[0108]
(3)加入不含抗性的lb液体培养基400μl,在37℃,200rpm的摇床振荡培养60min(进行此步时将超净台紫外打开,将含有抗性的平板在生化箱预热);
[0109]
(4)4000rpm,离心5min后取出,弃掉上层液体,留下100μl左右液体,用移液枪吹打均匀;
[0110]
(5)将上述100μl液体均匀滴到含有抗性的平板上,用涂布棒将液体涂抹分散,涂布棒在使用前必须高温灭菌,并待温度低至室温方可使用,此过程全部在超净台中操作;
[0111]
(6)将平板置于37℃生化培养箱,正面放置1h,然后倒置过夜;
[0112]
(7)挑选平板上的单个白色菌落,加入装有含抗性的1ml lb液体培养基的1.5ml离心管中,用移液枪吹打数次,在200rpm,37℃条件下震荡培养。
[0113]
(8)3
‑
4h后,取上述培养菌液进行pcr验证,反应体系如下:
[0114]
表3菌液验证反应体系
[0115][0116]
(9)反应程序:94℃3min;35cycles:94℃30s;55℃1min;72℃10min,4℃无限。
[0117]
(10)将上述反应产物进行核酸凝胶电泳,挑选电泳结果为阳性的菌液送至测序。
[0118]
五、质粒的大量培养及纯化
[0119]
(1)将阳性菌接种到6l含有相应抗性的lb液体培养基中,于37℃,200rpm摇床过夜培养;
[0120]
(2)将过夜培养的菌液分装到6个50ml离心管中,4000g离心10min,弃上清;
[0121]
(3)向每管的沉淀物中加入solutionⅰ40ml,剧烈震荡直到沉淀完全溶解,分装到200ml玻璃瓶中;
[0122]
(4)向每个玻璃瓶加入4ml的溶菌酶溶液,轻轻混匀;
[0123]
(5)取solutionⅱ80ml加入到广口瓶中,拿起玻璃瓶轻轻的快速颠倒数次以混合内容物,摇晃后放置在冰水中冰浴30min;
[0124]
(6)待溶液清亮,加入solutionⅲ,轻轻摇晃,此时产生大量絮状沉淀;
[0125]
(7)置于冰水中冰浴10min,在8层纱布上进行过滤,取全部清夜。
[0126]
(8)洗涤中空纤维过滤系统akta flux:打开akta flux,先用50ml naoh(0.5mol/l)洗涤仪器,接着再加入50ml 10%酒精洗涤,最后加入50ml纯水洗涤。
[0127]
(9)使用筛孔cfp
‑4‑
e
‑
2u,将得到的质粒溶液加入纯化仪,设置参数为(mixer 40,feed 50)。纯化,将纯化得到的溶液全部保存。
[0128]
(10)再次洗涤机器如上(8)步骤。
[0129]
(11)将筛孔换成ufp
‑
300
‑
c
‑
2u,同样设置参数为(mixer 40,feed 50)。继续纯化刚刚得到的溶液,将溶液纯化到原来量的一半,将所得质粒溶液保存。
[0130]
六、质粒浓缩
[0131]
测得提取的质粒浓度均在500ng/μl左右,为了达到所需质粒浓度,对质粒进行浓缩。浓缩方法如下:
[0132]
(1)加入一定体积的质粒溶液,再加入质粒溶液体积1/10的乙酸钠(3mol/l,ph=5.2)于质粒溶液中充分混匀,使其最终浓度为0.3mol/l;
[0133]
(2)加入2倍质粒溶液体积的冰上预冷无水乙醇,再次混匀,于
‑
20℃的环境中静止20min;
[0134]
(3)室温下12000g离心10min,小心移除上清液,吸去壁管上所有的液滴;
[0135]
(4)加入1/2离心管容量的70%乙醇,12000g离心2min,小心移除上清液,吸去壁管上所有的液滴;
[0136]
(5)于室温下将开盖的离心管置于实验桌上以使残留的液体挥发至干;
[0137]
(6)加适量的去离子水溶解质粒沉淀;
[0138]
(7)测得浓缩后质粒浓度,将浓度分别调整为500ng/μl、1000ng/μl、2000ng/μl后于
‑
80℃保存。
[0139]
获得500ng/μl、1000ng/μl、2000ng/μl mstn自体基因疫苗。
[0140]
实施例二:免疫
[0141]
取体长13cm左右的斜带石斑鱼180尾,如下表进行分组及免疫,其中每组分3个平行,每个平行15尾鱼苗,注射体积为100μl:
[0142]
表4
[0143]
分组浓度(ng/μl)实验组
①
500实验组
②
1000实验组
③
2000对照组生理盐水
[0144]
每组免疫3次,每次免疫时间间隔2周,第三次免疫后养殖3
‑
4周后取样。
[0145]
一、mstn自体核酸疫苗对斜带石斑鱼体重体长的影响研究
[0146]
(1)期间每次免疫时称重、测量全长;
[0147]
(2)最后一次免疫3
‑
4周后称重、测量全长,绘制生长曲线。
[0148]
其结果如图1
‑
4中所示,对于检测mstn核酸疫苗的效用来说,体重与体长的变化是最显著直观的。第一次免疫到第二次免疫期间,与对照组相比,三个实验组斜带石斑鱼体重和体长并无明显变化;在第二次免疫到第三次免疫、第三次面议到取样期间,与对照组相比,三个实验组斜带石斑鱼体重体长的增长/重速度和增长/重率总体上呈现随注射剂量增加而上升的趋势,经过统计学分析,在第二次注射到第三次注射期间,注射剂量为200μg的实验组与对照组的增长速度和增重率存在显著性差异,注射剂量为100μg的实验组与对照组的增重速度存在显著性差异;在第三次注射至取样期间,注射剂量为100μg的实验组与对照组的增长速度和增重速度均存在显著性差异。
[0149]
二、mstn自体核酸疫苗对斜带石斑鱼肌肉组织的影响研究
[0150]
1.鱼体组织样品采集
[0151]
第三次免疫后养殖3
‑
4周后对每组实验鱼用丁香酚麻醉,进行肌肉组织取样,组织块大小大约5mm
×
5mm
×
2mm左右。
[0152]
2.样品固定与包埋
[0153]
(1)将切好的组织块立刻放入4%多聚甲醛中固定24h;
[0154]
(2)组织块依次经过75%、75%、85%、95%、95%、100%、100%各级乙醇溶液脱水,各0.5h;
[0155]
(3)无水乙醇、二甲苯等量混合液2h,二甲苯、二甲苯各0.5h;
[0156]
(4)将石蜡加热至56℃融化,对组织块进行包埋。
[0157]
3.切片、展片与烤片
[0158]
(1)将包埋好的石蜡块修整,夹在切片机的夹物台上;
[0159]
(2)将刀片固定在刀夹上,刀口朝外;
[0160]
(3)推动螺旋,将刀片靠近石蜡块,但不能超过刀口,调整刀片与石蜡块之间的位置和角度,大约15
°
左右;
[0161]
(4)调整厚度调节器至切出的条带大约4
‑
10μm;
[0162]
(5)摇动转轮,将石蜡块切成蜡带,用毛笔将蜡带挑起,持续摇动转轮切片;
[0163]
(6)蜡带长度至7
‑
8cm时将蜡带挑断,放到56℃的水浴锅中展平;
[0164]
(7)将展平的蜡带贴在载玻片上,放在45℃恒温箱中烘干。
[0165]
4.he染色
[0166]
(1)使用二甲苯脱蜡,第一次5min,第二次10min,
[0167]
(2)无水乙醇、二甲苯按1:1的比例,5min;无水乙醇3min;95%酒精3min;80%酒精3min;70%酒精3min;50%酒精3min;
[0168]
(3)使用苏木精染料进行染色3min;
[0169]
(4)流水稍洗去染料10min;
[0170]
(5)再用0.5%盐酸乙醇进行分化5s,然后水洗去多余染料10min;
[0171]
(6)脱水:95%酒精2min;50%酒精2min;70%酒精2min;80%酒精2min;95%酒精2min;
[0172]
(7)伊红液染色20s,染色完成后放入95%酒精冲洗两次;
[0173]
(8)脱水:95%酒精2min;无水乙醇2min;
[0174]
(9)透明,封片:无水乙醇和二甲苯按1:1的比例进行透明2min;二甲苯2min;第二次二甲苯2min;
[0175]
(10)用树脂进行封片,自然风干。
[0176]
5.切片观察与计算
[0177]
将切片置于显微镜下进行观察与拍照,通过软件计算肌纤维横截面面积。
[0178]
如图5
‑
8所示,将斜带石斑鱼的肌肉制成石蜡切片并进行he染色,显微镜下拍照(a、b、c、d)。通过adobe photoshop cs6软件进行图片处理,计算对照组与三个实验组单个肌纤维平均相对横截面积,如图9所示,发现与对照组相比,总体而言实验组平均肌纤维相对横截面积均大于对照组,且随着实验组免疫剂量的增加,平均肌纤维相对横截面积增大,通过统计分析发现,对比对照组,注射剂量为100μg和200μg的实验组存在显著性(e)。
[0179]
三、mstn自体核酸疫苗对斜带石斑鱼mstn信号通路下游及相关基因的影响研究
[0180]
1.鱼体组织样品采集
[0181]
每组免疫3次,每次间隔2周,第三次免疫后养殖3
‑
4周后取样,采集肌肉组织样品。
[0182]
2.总rna提取
[0183]
(1)所有剪刀、镊子用75%乙醇消毒后用锡箔纸包好,高压灭菌锅灭菌,所用rna枪头用全新盒装枪头,高速离心机开4℃预冷。
[0184]
(2)将样品从
‑
80℃冰箱取出,置于冰上解冻,取rnase
‑
free 1.5ml离心管并加入600μl reagent试剂(invitrogen),然后将样品放入其中,用研磨棒粉碎样品组织块,后加入400μl reagent试剂(invitrogen)补足至1ml,混匀后室温静置5min。
[0185]
(3)加入200μl氯仿,震荡机上震荡混匀,室温静置15min。
[0186]
(4)12000rpm、4℃的状态下离心15min,吸取上清至新的rnase
‑
free 1.5ml离心管中,注意不要吸到白色沉淀。
[0187]
(5)加入500μl异丙醇,上下颠倒混匀,室温静置10min。
[0188]
(6)12000rpm、4℃的状态下离心10min,弃上清,加入1ml用depc灭菌水配制的75%乙醇后混匀,冰上静置3
‑
5min。
[0189]
(7)12000rpm、4℃的状态下5min,弃上清溶液,将多余液体吸出,注意不吸到rna沉淀,在超净台开盖,室温下干燥3
‑
5min。
[0190]
(8)根据rnase
‑
free 1.5ml离心管中rna沉淀的量,用50μl左右的depc灭菌水溶解沉淀的rna。
[0191]
(9)测量溶解后的rna浓度,若od 260/280值大于1.8且小于2.0,证明提取的rna质量合格,可以进行后续实验。
[0192]
(10)凝胶电泳进一步检测提取的rna质量,170v的电压下20min,结束后将核酸胶放入成像系统,若电泳图像为3条带,且28s条带最亮,18s条带稍暗,5s条带最暗,证明提取的rna质量合格,可以进行后续实验;
[0193]
(11)rna保存在
‑
80℃低温冰箱。
[0194]
3.cdna的合成
[0195]
cdna的合成使用逆转录revertra qpcr rt kit(toyobo)试剂盒,按照说明书操作如下:
[0196]
(1)取1μg rna于pcr管中,65℃水浴变性5min,冰浴5min;
[0197]
(2)按下表配制反转录体系:
[0198]
表5r na反转录体系
[0199][0200]
(3)反应程序:37℃,25min;98℃,5min;4℃,无限;
[0201]
(4)合成的cdna于
‑
80℃保存备用。
[0202]
4.实时荧光定量pcr
[0203]
(1)rt
‑
qpcr使用green realtime pcr master mix(toyobo)试剂盒,按照说明书操作如下表:
[0204]
表6荧光定量pcr体系
[0205][0206][0207]
(2)反应程序:applied biosystems quantstudio 5 real
‑
time pcr system(thermofish,usa),按照上表所示反应体系,向384孔板中避光加入各试剂后混匀,离心15
‑
20s,接下来在thermo fisher quanstudio 5实时荧光定量pcr仪器开始pcr反应,反应程序设置为第一步:95℃,10min;第二步:95℃,15s;第三步:55℃,15s;第四步:72℃,20s(第二步至第四步循环40次)。
[0208]
5.数据处理与统计分析
[0209]
实验数据通过graphpad prism 7.0软件采用one
‑
way anova单因素方差分析方法进行显著性分析。且当p<0.05时表示差异显著,用*表示;当p<0.01时表示差异极显著,用**表示;当p<0.001时表示差异极其显著,用***表示。
[0210]
亚细胞定位图像通过adobe photoshop cs6软件进行处理。肌纤维细胞横截面图像通过adobe photoshop cs6软件计算单个肌纤维相对横截面面积,计算公式:
[0211][0212]
然后通过graphpad prism 7.0软件进行统计学分析。流式细胞仪采用flowjo软件进行图像分析。
[0213]
对养殖结束后的实验鱼进行肌肉取样,提取组织rna并反转录制成cdna模板。通过rt
‑
qpcr检测smad3、myod、myog、p21和mrf4等mstn信号通路下游及相关基因的表达量。结果如图10
‑
14所示,免疫mstn自体核酸疫苗后,与对照组相比,三个剂量实验组的smad3和mrf4的mrna表达量均呈下降趋势,经过统计学分析,其中当剂量为50μg和100μg时smad3并不存在显著性差异,当剂量为200μg时差异显著,当剂量为50μg mrf4并不存在显著性差异,当剂量为100μg和200μg时差异显著;myod、myog和p21的mrna表达量均呈上升趋势,但均在剂量为200μg时才存在显著性差异。
[0214]
以上依据本发明的理想实施例为启示,通过上述的说明内容,相关人员完全可以
在不偏离本项发明技术思想的范围内,进行多样的变更以及修改。本项发明的技术性范围并不局限于说明书上的内容,必须要根据权利要求范围来确定技术性范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。