一种foxm1靶向降解小分子foxm1
‑
protac及其衍生物与应用
技术领域
1.本发明属于生物技术和生物医药技术领域,涉及一种foxm1靶向降解小分子foxm1
‑
protac及其衍生物与应用。
背景技术:
2.肝细胞癌(hcc)是世界上常见的恶性肿瘤之一。世界卫生组织国际癌症研究中心(international agency for research on cancer,iarc)报告指出,肝癌发病率位于肺癌、乳腺癌等之后居恶性肿瘤第5位,死亡率位于肺癌、结直肠之后,居恶性肿瘤第3位,是五大致死率最高的癌症中唯一一种年发病率上升的癌症。肝癌发病地域分布在世界范围内有显著差异性,发展中国家的肝病发病率较高。危险因素包括乙型肝炎病毒、丙型肝炎病毒、脂肪肝、酒精相关肝硬化、吸烟、肥胖、糖尿病、铁超载和各种饮食暴露。
3.肝癌预后差。只有5%到15%的患者有资格接受手术切除,这只适用于早期患者,并且由于肝脏再生能力降低,通常没有肝硬化;与左肝切除术相比,右肝切除术后并发症的风险更高。晚期肝癌的治疗方案包括:(a)经动脉化疗栓塞术(tace),与中晚期肝癌保守治疗相比,tace可使2年生存率提高23%;(b)口服索拉非尼(一种激酶抑制剂)是晚期患者最常接受的选择。然而,只有不到三分之一的患者从该治疗中获益,并且在开始该方案后的六个月内,耐药性很明显。随着长期使用,化疗药物,如索拉非尼,会有如毒性或药物无效等问题的产生。因此,目前的消融治疗和化疗都不能有效改善这种毁灭性疾病的预后。进一步研究寻找更好的治疗肝癌的方法是必要的。
4.伴随着医学及分子生物学的不断发展及研究的日益深入,逐渐的认识到肝癌的发生、发展是多基因共同作用、多个信号通路参与而引起的“炎症
‑
增生
‑
癌变”的演变过程。国内外研究发现,肝癌是一种分子发病机制较为复杂的实体瘤,其发生发展涉及多条信号通路的失调,与多种基因变异有关。据cosmic database资料,西方人群肝癌基因变异谱中8个基因突变频率超过5%,主要集中在基因组不稳定性、永生化和wnt等信号通路。据genomicare资料,中国人群中有20多个基因变异频率超过5%,主要集中在基因组不稳定性、血管生成、细胞周期失控、生长因子、pi3k
‑
akt
‑
mtor等信号通路。
5.除放疗和化疗外,随着靶向治疗、基因治疗、新辅助化疗、免疫治疗等治疗手段的发现与应用,为肝癌的治疗提供了更多更好的选择,也成为肝癌治疗重要的组成部分。分子靶向药物治疗在特定患者中疗效显著,患者生存获益。但靶向药物的应用存在局限性,主要因为目前靶向药物的有效的靶点还较少,同时在选择适宜的靶向治疗药物前,需要对患者进行相应的分子靶点检测。目前,与肝癌治疗相关的靶点主要有vegfr1
‑
3、fgfr1
‑
4、pdgfr
ɑ
、rtk、kit、ret,均已用于临床。因此,肝癌靶向治疗选用药物的关键是对与发病机制相关的信号通路驱动及肝癌特异性转录因子进行鉴别。
6.foxm1作为调控细胞周期和细胞进程重要的转录因子,已证实在39种人类恶性肿瘤中,foxm1调控网络是18000例癌症患者不良预后的主要预测因子,这也揭示了foxm1在癌症中的重要作用。然而,foxm1究竟是如何在人体细胞中发挥其致癌活性的,目前尚不完全
清楚。一种机制与foxm1靶点的转录激活有关,这种激活导致多种促肿瘤效应,包括增强细胞增殖。另外,foxm1可能通过与其他蛋白质相互作用作为癌基因,从而支持不同的致癌途径。foxm1调控着肿瘤发生和发展的关键过程。作为一种典型的增殖相关转录因子,foxm1在转录水平上直接或间接激活靶基因的表达,并表现出时空模式,其失调几乎涉及到肿瘤细胞的所有特征。并且大量的数据和实验证实,在多种不同肝细胞癌中foxm1的表达量均上调,并且通过对病人数据分析显示,foxm1的表达量与肝癌病人的预后密切相关。foxm1被认为是肿瘤的致命伤,并成为判断肿瘤发生发展的新的肿瘤标志物及抗肿瘤药物开发的重要靶标。目前国内以foxm1为靶标的相关药物治疗仍在临床前研究阶段,并无任何一种直接靶向foxm1的抗肿瘤药物上市或应用于临床。
7.利用蛋白质水解靶向嵌合体(protacs)靶向降解蛋白质已成为药物开发中的一种新的治疗方法。protacs通过劫持e3泛素连接酶的活性进行靶蛋白泛素化并随后被26s蛋白酶体降解来介导所需靶蛋白质的降解。蛋白质与泛素(一种小的蛋白质修饰剂)的结合对于26s蛋白酶体调节蛋白质降解是必不可少的。尽管在20世纪70年代末描述了蛋白质降解的atp依赖途径,但30年后首次报道了利用该系统进行靶向蛋白质降解的应用。蛋白质水解靶向嵌合体(protac)是一种异双功能分子,由以下三部分组成:(1)结合靶蛋白的配体;(2)用于招募e3泛素连接酶(e3招募元件;e3re)以促进靶蛋白泛素化的配体;(3)连接这些配体的连接体。迄今为止,已有超过100篇文章描述了protacs用于靶向蛋白质降解及其在化学生物学和药物开发中的应用。
8.作为新的和有前景的技术,protacs在以下方面显示出巨大的机会。首先,protacs对耐药靶点具有特殊的敏感性。传统意义上化疗是癌症治疗的主要方法。对化疗药物的获得性耐药性阻碍了临床应用,并导致疾病复发。随着新靶点和新药物发现技术的研究进展,另一个强有力的策略是通过小分子直接而特异地抑制致癌蛋白或受体的功能。值得注意的是,激酶抑制剂的发现并没有解决癌症治疗的耐药问题,而protacs通过消除整个靶点来影响蛋白质功能,从而删除靶点的全部功能,包括酶活性和非酶功能,因此protacs可以解决当前治疗所面临的潜在耐药性。此外,protacs对靶表达增加和靶蛋白突变不太敏感,因为它们具有催化作用,所以只需要低剂量的protacs就可以发挥很好的效果。
9.基于protacs不仅能够对靶蛋白进行深度的降解,具有持续性和对下游信号快速、强大的抑制,而且在体外能够长久的抑制肿瘤的发生发展,使得利用蛋白质水解靶向嵌合体降解蛋白质成为当前肿瘤治疗的热点方式。因此,针对肝癌细胞内靶点foxm1靶向降解嵌合体protac的开发是很有必要的。
技术实现要素:
10.为了解决上述背景技术中所提出的问题,本发明的目的在于提供一种foxm1靶向降解小分子foxm1
‑
protac及其衍生物与应用。本技术foxm1靶向降解小分子foxm1
‑
protac(衍生物)包括本技术提供的foxm1拮抗多肽(衍生物)和药物,通过该拮抗多肽(衍生物)与靶点foxm1具有特异性高亲和力,当foxm1靶向降解小分子foxm1
‑
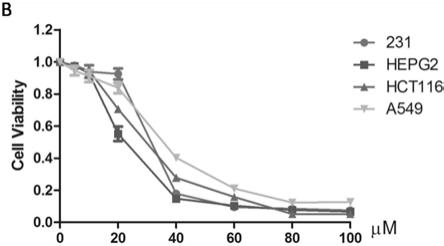
protac(衍生物)与foxm1结合后能够阻止foxm1与其它蛋白或基因的结合并诱导foxm1蛋白降解进而影响下游相关基因及信号通路,该foxm1靶向降解小分子foxm1
‑
protac(衍生物)在靶向抑制肝癌细胞增殖、促进肝癌细胞凋亡等方面起着重要的作用,其在肝癌靶向治疗方面具有巨大的应用价
值。
11.为了达到上述目的,本发明所采用的技术方案为:一方面,本发明提供了一种foxm1拮抗多肽,所述foxm1拮抗多肽的氨基酸序列如seq id no:1所示。
12.另一方面,本发明提供了一种foxm1拮抗多肽的衍生物,所述foxm1拮抗多肽的衍生物为上述所述的foxm1拮抗多肽氨基酸侧链基团上,和/或,上述所述的foxm1拮抗多肽片段的氨基端或羧基端进行常规修饰得到的产物;
13.或者为上述所述的foxm1拮抗多肽上连接用于多肽或蛋白检测或纯化的标签所得到的产物。
14.进一步地,所述常规修饰包括氨基化、酰胺化、羟基化、羧基化、羰基化、烷基化、乙酰化、磷酸化、酯化、糖基化、环化、生物素化、荧光基团修饰、聚乙二醇peg修饰或固定化修饰;
15.优选地,所述标签包括his6、gst、egfp、mbp、nus、ha、igg、flag、c
‑
myc或profinityexact。
16.进一步地,所述foxm1拮抗多肽的衍生物为上述所述的foxm1拮抗多肽末端进行酰胺化修饰得到的产物。
17.进一步地,所述foxm1拮抗多肽及其衍生物的获得,采用现有技术中的公知方法进行,既可以用多肽自动合成仪进行化学合成;通过将短肽序列推导出核苷酸序列,然后克隆到载体中进行生物合成;也可以从现有存在的生物体内进行大量提取和纯化。
18.进一步地,所述foxm1拮抗多肽及其衍生物可以来源于哺乳类动物或者鸟类,例如灵长类动物(人类);啮齿类动物,包括小鼠,大鼠,仓鼠,兔,马,牛,犬类,猫等。
19.另一方面,本发明提供了一种foxm1靶向降解小分子foxm1
‑
protac,其包括上述所述的foxm1拮抗多肽和药物。
20.再一方面,本发明提供了一种foxm1靶向降解小分子foxm1
‑
protac的衍生物,其包括上述所述的foxm1拮抗多肽的衍生物和药物。
21.进一步地,还包括连接基团linker,所述连接基团linker将上述所述的foxm1拮抗多肽和药物进行连接,或,将上述所述的foxm1拮抗多肽的衍生物和药物进行连接。
22.进一步地,所述药物包括pomalidomide。
23.进一步地,所述foxm1靶向降解小分子foxm1
‑
protac及其衍生物的获得,采用现有技术中的公知方法进行,既可以用多肽自动合成仪进行化学合成;通过将短肽序列推导出核苷酸序列,然后克隆到载体中进行生物合成,然后在和药物链接;也可以从现有存在的生物体内进行大量提取和纯化,然后再和药物连接。
24.再一方面,本发明提供了一种多聚核苷酸,其特征在于,其编码上述所述的foxm1拮抗多肽或上述所述的foxm1拮抗多肽的衍生物。
25.再一方面,本发明提供了一种上述所述的foxm1靶向降解小分子foxm1
‑
protac或上述所述的foxm1靶向降解小分子foxm1
‑
protac的衍生物在制备预防和/或治疗高表达foxm1的肿瘤的药物中的应用。
26.再一方面,本发明提供了一种上述所述的foxm1靶向降解小分子foxm1
‑
protac或上述所述的foxm1靶向降解小分子foxm1
‑
protac的衍生物在制备抑制高表达foxm1的肿瘤细胞增殖和/或促进高表达foxm1的肿瘤细胞凋亡的药物中的应用。
27.进一步地,所述高表达foxm1的肿瘤包括肝癌、肺癌、乳腺癌、结直肠癌,优选为肝癌。
28.再一方面,本发明提供了一种药物组合物或检测试剂,包含上述所述的foxm1靶向降解小分子foxm1
‑
protac、上述所述的foxm1靶向降解小分子foxm1
‑
protac的衍生物中的至少一种。
29.进一步地,所述药物组合物含有一种或者是多种药学上可以接受的载体。
30.进一步地,所述药学上可以接受的载体包括稀释剂、赋形剂、填充剂、粘合剂、湿润剂、崩解剂、吸收促进剂、吸附载体、表面活性剂或润滑剂等。
31.进一步地,所述药物组合物可以制成片剂、粒剂、胶囊、口服液或注射剂等多种形式,各种剂型的药物可以按照药学领域的常规方法制备。
32.进一步地,所述药物组合物可以制成片剂、粒剂、胶囊、口服液或注射剂等多种形式,各种剂型的药物可以按照药学领域的常规方法制备。
33.本发明的有益效果是:
34.(1)本发明提供了一种foxm1靶向降解小分子药物foxm1
‑
protac及其衍生物,所述的foxm1
‑
protac及其衍生物能够专一性与foxm1结合,并特异性与foxm1结合,诱导foxm1降解,抑制foxm1下游信号通路。
35.(2)本发明提供的foxm1靶向降解小分子药物foxm1
‑
protac及其衍生物可以通过阻断foxm1的信号通路抑制癌细胞增殖,促进癌细胞发生凋亡,可以作为foxm1结合位点的生物类降解型小分子药物,可用于制备预防和/或治疗肿瘤。能够在医学与生物学领域得到广泛的应用,并产生巨大的社会与经济效益。
附图说明
36.图1为本发明实施例中合成pomalidomide
‑
peg2的质谱图;
37.图2为本发明foxm1靶向降解小分子foxm1
‑
protac抑制肝癌细胞hepg2增殖作用结果图;
38.图3为本发明foxm1靶向降解小分子foxm1
‑
protac抑制foxm1高表达癌细胞增殖作用结果图;
39.图4为本发明foxm1靶向降解小分子foxm1
‑
protac诱导hepg2细胞中foxm1降解的结果图;其中a:不同浓度下,foxm1
‑
protac处理hepg2 16h foxm1表达量变化;b:不同时间下,foxm1
‑
protac处理hepg2 20μm foxm1表达量变化。
40.图5为本发明foxm1靶向降解小分子foxm1
‑
protac抑制hepg2细胞增殖、迁移结果图;其中,a:克隆形成;b:细胞划痕。
具体实施方式
41.为了更清楚地理解本发明,现参照下列实施例及附图进一步描述本发明。实施例仅用于解释而不以任何方式限制本发明。
42.实施例中,各原始试剂材料均可商购获得,未注明具体条件的实验方法为所属领域熟知的常规方法和常规条件,或按照仪器制造商所建议的条件。
43.本技术以下实施例中foxm1靶向降解小分子foxm1
‑
protac为pomalidomide
‑
peg2
‑
seq id no:1(即pomalidomide
‑
peg2
‑
glssmhsapplr
‑
grkkrrqrrrppqq)。
44.实施例1 foxm1
‑
protac的合成
45.首先合成获得foxm1
‑
protac的中间物pomalidomide
‑
peg2,并通过中间物与已知多肽序列连接,最后合成高纯度的小分子foxm1
‑
protac,由上海瀚香生物公司完成。
46.其中,中间物pomalidomide
‑
peg2的质谱图如图1所示,从图1可以看出中间产物的纯度和质量达到后续合成要求。
47.实施例2 cck
‑
8检测foxm1
‑
protac对hepg2细胞的抑制作用
48.接种hepg2细胞于10cm培养皿中,用10%fbs的dmem培养基培养至密度95%,待细胞达到所需密度后,吸掉培养基,用pbs清洗2次,加入1ml胰酶,37度孵育消化1min,之后加入1ml 10%fbs的dmem培养基,捶打分散细胞,吸取10μl细胞悬液加入到1ml dmem培养基中制成细胞悬液,用细胞计数板计数所制备的细胞悬液中的细胞数量,然后按每孔5
×
103个接种于96孔板中培养24小时。次日,弃掉细胞培养基,向培养板加入新鲜培养基和不同浓度的foxm1
‑
protac,将培养板在培养箱孵育48小时,向每孔加入10μl cck
‑
8溶液(注意不要再孔中生成气泡,它们会影响od值的读数)将培养板在培养箱内孵育1
‑
4小时,用酶标仪测定在450nm处的吸光度,然后按照下述公式计算细胞活力,并绘制抑制曲线。细胞活力(%)=[a(加药)
‑
a(空白)]/[a(0加药)
‑
a(空白)]
×
100,a(加药):具有细胞、cck
‑
8溶液和药物溶液的孔的od值,a(0加药):具有细胞、cck
‑
8溶液而没有药物溶液的孔的od值,a(空白):没有细胞的孔的od值。结果见图2,由图2可以看出,随着药物浓度的增加,细胞活力不断下降,最后趋于平稳,并且细胞的ic50值约为20μm。
[0049]
实施例3 cck
‑
8检测foxm1
‑
protac对hepg2及其它foxm1高表达细胞的抑制作用
[0050]
首先分别选取肝癌hepg2、肺癌a549、乳腺癌mb
‑
231、结直肠癌hct116四种不用癌型的细胞,分别接种四种细胞于10cm培养皿中,用10%fbs的dmem培养基培养至密度95%,待细胞达到所需密度后,吸掉培养基,用pbs清洗2次,加入1ml胰酶,37度孵育消化1min,之后加入1ml 10%fbs的dmem培养基,捶打分散细胞,吸取10μl细胞悬液加入到1ml dmem培养基中制成细胞悬液,用细胞计数板计数所制备的细胞悬液中的细胞数量,然后按每孔5
×
103个接种于96孔板中培养24小时。次日,弃掉细胞培养基,向培养板加入新鲜培养基和不同浓度的foxm1
‑
protac,将培养板在培养箱孵育48小时,向每孔加入10μl cck
‑
8溶液(注意不要再孔中生成气泡,它们会影响od值的读数)将培养板在培养箱内孵育1
‑
4小时,用酶标仪测定在450nm处的吸光度。后按照下述公式计算细胞活力,并绘制抑制曲线。细胞活力(%)=[a(加药)
‑
a(空白)]/[a(0加药)
‑
a(空白)]
×
100,a(加药):具有细胞、cck
‑
8溶液和药物溶液的孔的od值,a(0加药):具有细胞、cck
‑
8溶液而没有药物溶液的孔的od值,a(空白):没有细胞的孔的od值。结果见图3,由图3可以看出,随着药物浓度不断升高,四种癌细胞的活力都会降低,并且不同细胞对药物的敏感性不同,其中肝癌细胞对该药物最敏感,有着最低的ic50值。
[0051]
实施例4 foxm1
‑
protac可以诱导hepg2细胞中foxm1的降解
[0052]
①
将肝癌细胞hepg2以5
×
105个/孔接种于6孔细胞培养板中,每孔培养基体积为2ml,培养24h;
[0053]
②
加入不同浓度梯度(0μm,2μm,5μm,10μm,20μm,30μm,50μm)的foxm1
‑
protac培养16小时,收集细胞,加入裂解液收集蛋白;
[0054]
③
加入相同浓度梯度(20μm)的foxm1
‑
protac培养不同时间(0h,2h,4h,8h,12h,24h),收集细胞,加入裂解液收集蛋白;
[0055]
④
按照雅酶制胶试剂盒准备10%浓度的sds
‑
page胶;
[0056]
⑤
在收集的蛋白样品中加入适量的sds
‑
page蛋白上样缓冲液5x sample bf.混合,sample bf要添加b
‑
巯基乙醇(500μl bf 70μl b
‑
巯基乙醇)。蛋白样品与sample bf混匀,离心10s,12000rpm。100℃5
‑
10分钟,使蛋白变性。12000rpm短暂离心,冷却。冷却到室温后,把蛋白样品直接上样到sds
‑
page胶加样孔内。按设计顺序对准上样槽缓缓加入样品和预染蛋白marker。通常电泳时溴酚蓝到达胶的底端处附近即可停止电泳,或者可以根据预染蛋白质分子量标准的电泳情况,预计目的蛋白已经被适当分离后即可停止电泳。
[0057]
⑥
准备盒子并装甲醇,transfer bf,从电泳装置上卸下凝胶玻璃板。取出胶,用刀片切除浓缩胶和下端溴酚蓝。用尺子量准胶的长和宽度。裁减两张同尺寸的滤纸和一张pvdf膜。膜先用甲醇处理震荡1分钟,然后用ro水洗5次,1分钟/1次。再用transfer bf泡10分钟以上。滤纸和胶也泡在transfer bf里。转膜器内棉块可以用这空闲时间洗干净,再烘干,然后用transfer bf沾湿,转膜器黑板对自己,按“海绵—滤纸—凝胶—pvdf膜—滤纸—海绵”的顺序装置好。依次放好,注意胶和膜的接触面,不能有气泡。膜与滤纸间,滤纸和胶之间不能有气泡。用涂抹棒或15ml的玻璃离心管来回在上面轻轻滚动即可赶出气泡。滤纸放双层效果更佳。260ma电压100min。
[0058]
⑦
用镊子取出膜,蛋白面朝上,在5%的脱脂奶粉(tbst配制。eg,40ml tbst溶液里 2g脱脂奶粉)封闭液中进行封闭1
‑
1.5h。参考一抗的说明书,选择杂交体系为5ml or 10ml。如所加一抗的量较多,选5ml杂交体系甚至3or 4ml。参考一抗的说明书,按照适当比例用稀释液(1%的封闭液,eg,杂交体系为5ml:1ml封闭液 4ml tbst or杂交体系10ml:2ml封闭液 8ml tbst)稀释一抗。室温或4℃在侧摆摇床上缓慢摇动孵育1h,回收一抗。用tbst洗3次,5min/次,在摇床上缓慢摇动洗涤。参考二抗的说明书,按照适当比例稀释二抗。在摇床上缓慢摇动孵育一小时。用tbst洗5次,5min/次,在摇床上缓慢摇动洗涤。使用ecl western荧光检测试剂来检测蛋白。结果见图4,由图4可以看出,随着时间的延长foxm1
‑
protac对foxm1的降解越多,并且在相同时间内,foxm1
‑
protac浓度越高对foxm1的降解越多。
[0059]
实施例5 foxm1
‑
protac可以抑制hepg2细胞的增殖、迁移,促进凋亡
[0060]
①
将肝癌细胞hepg2以100个/孔接种于6孔细胞培养板中,每孔培养基体积为2ml,培养24h;之后加入20μm foxm1
‑
protac和适量新鲜培养基,并以未加药组作为对照,每两天更换培养基和药物,连续培养至,细胞团含有50个以上细胞,用甲醇固定实验组和对照组细胞后,0.1%的结晶紫染色,统计每组中的克隆形成数,结果如图5a,由图可以看出,与对照组相比,加入foxm1
‑
protac后,细胞形成的克隆数明显减少,foxm1
‑
protac能有效抑制细胞的克隆形成。
[0061]
②
将6孔板长满肝癌细胞hepg2以1:2接种于新的6孔细胞培养板中,每孔培养基体积为2ml,培养24h待细胞长满后用墙头划痕,并用pbs洗去漂浮的细胞;显微镜拍照记录划痕距离,加入20μm foxm1
‑
protac和适量无血清新鲜培养基,并以未加药组作为对照,48h后洗去漂浮细胞,显微镜拍照记录划痕距离,结果如图5b,由图可以看出,与对照组相比,加入foxm1
‑
protac后,划痕的宽度更宽,细胞的迁移减慢,foxm1
‑
protac能有效抑制细胞的迁移。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。