slc7a11基因在肝细胞癌介入栓塞术后中的应用
技术领域
1.本发明涉及slc7a11基因在肝细胞癌介入栓塞术后中的应用,属于分子生物技术领域。
背景技术:
2.肝细胞癌(hcc)是最常见的原发性肝癌,其典型特征是快速增殖和转移较早。巴塞罗那临床肝癌(bclc)标准和中国原发性肝癌诊治指南(2017版)都推荐了不同阶段hcc的治疗方法。然而,临床上仍需要更多治疗方法,因为该疾病通常在中晚期被诊断出来,并且hcc患者的五年生存率仍不理想。
3.介入治疗已广泛应用于不可切除的hcc患者。然而,介入栓塞引起的缺氧状态可能促进hcc细胞的增殖和转移,其内在机制尚不清楚。因此,探索缺氧与hcc发展的分子机制对于推进未来的治疗至关重要。值得注意的是,异常的表观遗传变化会导致基因表达的严重破坏,从而促进hcc的发生和发展。
4.n6
‑
甲基腺苷(m6a)rna修饰已成为表观遗传调控机制的一个新维度,可在翻译前控制mrna表达。在至少三分之一的哺乳动物mrna中发现了 m6a。据估计,一个mrna中平均有3
‑
5个m6a修饰。值得注意的是,许多 m6a位点在小鼠和人类之间在进化上是保守的。多组分m6a甲基转移酶复合物(mtc)在mrna修饰中执行m6a的沉积,其由异二聚体、甲基转移酶样3 (mettl3)/甲基转移酶样14(mettl14)复合物、主要酶复合物和其他参与因素包括kiaa1429、wtap和rbm15。就该复合体而言,mettl3是与甲基供体s
‑
腺苷甲硫氨酸(sam)结合并催化甲基基团转移的催化亚基,而mettl14 通过稳定mettl3构象和识别底物rna来负责m6a沉积。m6a修饰位点经常在3'非翻译区(3'utr)和编码序列(cds)中富集,在终止密码子区域周围富集特别高,其中包含经典的共有序列drach(d=g、a或u;r=g或a; h=a、c或u).这种可逆的催化过程由m6a橡皮擦脂肪量和肥胖相关蛋白 (fto)和alkb同源物5(alkbh5)进行。m6a修饰的rna可以通过m6a 阅读器蛋白进行识别,包括yt521
‑
b同源(yth)域家族蛋白 (ythdf1
–
ythdf3、ythdc1和ythdc2)。其中,ythdf2是第一个经过鉴定和充分研究的m6a阅读器蛋白,它通过其c端ytd结构域靶向 m6a,n端结构域负责将mrna推向加工体以进一步降解。
5.最近的研究表明m6a参与了多种生理过程。作为mtc的另一个不可或缺的组成部分,mettl14已被证明在各种类型的癌症中上调。weng等人报道,敲除mettl14可以显着抑制白血病干/起始细胞(lscs/lics)的自我更新。进一步的机制研究表明,其靶标mrnamyb和myc上m6a丰度的降低导致 mrna稳定性和翻译的降低。据报道,mettl14还可以驱动ebv介导的肿瘤发生。然而,chen等人发现mettl14通过靶向mir
‑
37528抑制结直肠癌 (crc)进展;ma等人认为mettl14通过靶向pri
‑
mir
‑
12629抑制hcc转移。然而,mettl14在肝癌介入栓塞术后的肿瘤复发转移中的具体功能仍然难以捉摸。
6.铁死亡是以一种以脂质过氧化产物(mda)和/或致死活性氧(ros)增多、铁依赖性为主要特征的非凋亡性细胞死亡方式,在癌症治疗中显示出巨大的前景。由slc7a11和
分析的tcga数据库的生物信息学分析/)关键字为“mettl14”,“肝细胞癌与正常分析”;
21.图2b:表示在oncomine(https://www.oncomine.org/resource/main.html)使用关键词“slc7a11”、“肝细胞癌”分析了来自“wurmbach liver”、“roessler liver”和“roessler liver 2”数据库的生物信息学分析对比正态分析”;
22.图2c:表示mettl14在七种hcc细胞系(huh7、hepg2、7721、hcclm3、 mhcc97h、plc/prf/5、bel
‑
7402)中的蛋白表达模式,与通过蛋白质印迹检测的正常肝细胞系l02进行比较(下图),相对mettl14蛋白质水平被量化(上图);
23.图2d:表示与正常肝细胞系l02进行比较,分别通过qpcr和蛋白质印迹检测的七种hcc细胞系(huh7、hepg2、smmc
‑
7721、hcclm3、mhcc97h、 plc/prf/5、bel
‑
7402)中slc7a11的mrna和蛋白水平;
24.图2e:表示mettl14对缺氧条件下huh7和hcclm3细胞slc7a11表达的影响,分别通过rt
‑
qpcr和蛋白质印迹检测slc7a11 mrna和蛋白质水平;
25.图3a:表示slc7a11 mrna的示意图和5'utr预测的“m6a”位点(图中圈出的碱基a),“drach”中间的碱基a被t替换,以制备用于荧光素酶报告基因检测的突变质粒;
26.图3b:表示mettl14和mettl14
‑
r298p突变体对hcclm3细胞中slc7a11表达的影响,分别通过qpcr和western印迹检测slc7a11的mrna 和蛋白质水平;
27.图3c:表示dot blot显示稳定表达宽型mettl14和 mettl14
‑
r298p突变体的总m6a水平;
28.图3d:表示slc7a11荧光素酶报告基因示意图;
29.图3e:表示确定了基于pgl3基本质粒的wt或mut荧光素酶报告基因在mettl14转染的hcclm3细胞中的相对活性(标准化为载体对照组);
30.图3f:表示应用merip分析和qrt
‑
pcr来评估hcclm3表达的宽型 mettl14或mettl14
‑
r298p突变体中slc7a11的m6a修饰,通过 m6a
‑
ip/input和igg
‑
ip/input计算各组m6a的富集度;
31.图3g:表示宽型mettl14和mettl14
‑
r298p突变体对hcc肿瘤生长的影响,裸鼠皮下注射稳定表达mettl14、mettl14
‑
r298p或对照载体的 hcclm3细胞,每周计算两次肿瘤生长;
32.图3h:表示在异种移植模型中过表达hcclm3细胞(或阴性对照)的稳定宽型mettl14或mettl14
‑
r298p突变体的肿瘤生长曲线;
33.图3i:表示通过蛋白质印迹检测异种移植物中cox2、slc7a11和 mettl14的表达模式;
34.图3j:表示种移植物中mettl14分别和cox2、slc7a11之间的相关性;
35.图3k:表示三种异种移植物的h&e染色切片;
36.图3l:表示免疫组织化学检测的异种移植物中cox2、slc7a11和 mettl14的表达模式;
37.图4a:表示在用放线菌素d(标准化为0小时)处理后,在huh7和 hcclm3细胞中测定了mrna衰减率;
38.图4b:表示rt
‑
qpcr和蛋白质印迹显示沉默ythdf2对huh7和 hcclm3中slc7a11 mrna和蛋白质水平的影响;
39.图4c:表示转染了siythdf2的huh7和hcclm3细胞中wt或 mut荧光素酶报告基因的相对活性(标准化为载体对照组)的测定结果;
40.图5a:表示根据制造商的说明通过流式细胞术进行ros检测的定量分析结果;其中,huh7和hcclm3细胞用或不用10mm浓度的nac处理36小时;
41.图5b:表示通过蛋白质印迹和qpcr分别检测huh7和hcclm3细胞中emt 相关e
‑
cadherin、n
‑
cadherin和vimentin的蛋白和mrna水平,其中,细胞用或不用10mm浓度的nac处理36小时;
42.图5c:表示通过电子显微镜检测hcclm3细胞中用/不用nac或 shslc7a11处理的线粒体的形态学改变,其中,白色箭头指的是典型的线粒体;
43.图5d:表示slc7a11敲低对肿瘤生长的影响以及在5周的时间过程中检测的肿瘤体积生长曲线;
44.图5e:表示肿瘤切片的h&e染色图,显示为肿瘤结构;
45.图5f:表示免疫组织化学分析显示shslc7a11组具有更高的cox2表达;
46.图6a:表示蛋白质印迹显示了huh7和hcclm3细胞中mettl14和 slc7a11的表达模式,其中,稳定表达宽型mettl14或r298p突变体的细胞用slc7a11过表达(转染);
47.图6b:表示伤口愈合显示mettl14对照、mettl14过表达和 mettl14
‑
r298p以及slc7a11分别对缺氧条件下huh7和hcclm3细胞的迁移率的影响;
48.图6c:表示cck
‑
8测定说明了mettl14对照、mettl14过表达和 mettl14
‑
r298p,加上slc7a11在缺氧条件下huh7和hcclm3细胞的增殖趋势;
49.以上各图中,“ns”:表示不具有显著性差异(not significant);*:表示p< 0.05;**:表示p<0.01;***:表示p<0.001;****:表示p<0.0001。
具体实施方式
50.为使本发明更明显易懂,兹以优选实施例,并配合附图作详细说明如下。
51.以下实施例中,所用到的具体实验方法如下所示:
52.(1)细胞培养及处理
53.七株人肝癌细胞系(huh7、hepg2、7721、hcclm3、mhcc97h、plc/prf/5 和bel
‑
7402)和一株正常人肝细胞株l02来自中山医院张士哲博士和甘伟博士,复旦大学(中国上海)。所有细胞系均在dulbecco改良的eagle培养基(dmem,gibco,grand island,ny,usa)中培养。dmem的额外混合物是10%胎牛血清(fbs)、抗生素(青霉素(100u/ml)/链霉素(0.1mg/ml))。培养细胞需要5%co2、37℃的湿润环境。培养基每周更新两次。n
‑
乙酰
‑
l
‑
半胱氨酸(nac)购自apexbio(美国休斯顿)。
54.(2)转染和稳定细胞株
55.lipofectamine 2000试剂(life technology,thermo fisher scientific,de, usa)用于进行瞬时转染。pcdna3.1
‑
mettl14、pcdna3.1
‑
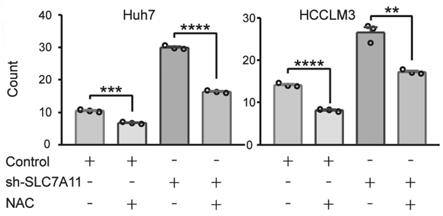
ythdf2、 plko.1
‑
slc7a11和pcdna3.1
‑
slc7a11
‑
his( )购自genechem(中国上海)。空载体用作阴性对照。根据制造商的说明使用lipofectamine 2000试剂 (invitrogen)进行转染测定。本实验共使用5
×
105个细胞。转染48小时后,通过rt
‑
qpcr分析或蛋白质印迹验证转染效率。
56.(3)实时荧光定量pcr
57.根据制造商的说明,通过rna纯化试剂盒(ezbioscience,usa)提取总 rna。然后,使用4
×
reverse transcription master mix(ezbioscience)进行rt
‑
pcr,使用无dnaase和rnaase的尖端(yueyibiotech,上海,中国)。 sybr green pcr试剂盒(yeasen,中国)用于qpcr。根据2
‑
δδct
方法,将每个基因的表达水平标准化为gapdh的表达水平,作为内部对照。 mettl14、ythdf2、slc7a11、e
‑
钙粘蛋白、n
‑
钙粘蛋白、波形蛋白和gapdh 的引物(sunya,中国)如下:
58.mettl14(f:5
′‑
catcaggctaaaggatgagtt
‑3′
(seq id no:1);r:5
′‑ꢀ
ctaacttcataatatcatcc
‑3′
(seq id no:2));
59.ythdf2(f:5
′‑
agccccacttcctaccagatg
‑3′
(seq id no:3);r:5
′‑ꢀ
tgagaactgttatttccccatgc
‑3′
(seq id no:4));
60.slc7a11(f:5
′‑
gtctggagaaacagccaagg
‑3′
(seq id no:5);r: 5
′‑
cggagttcctcgaatagctg
‑3′
(seq id no:6));
61.e
‑
cadherin(f:5
′‑
cgagagctacacgttcacgg
‑3′
(seq id no:7);r:5
′‑ꢀ
gggtgtcgagggaaaaatagg
‑3′
(seq id no:8));
62.n
‑
cadherin(f:5
′‑
ctgacaatgaccccacagc
‑3′
(seq id no:9);r: 5
′‑
tcctgctcaccaccact actt
‑3′
(seq id no:10));
63.vimentin(f:5
′‑
tctacgaggaggagatgcgg
‑3′
;(seq id no:11)r: 5
′‑
ggtcaagacgtgccag agac
‑3′
(seq id no:12));
64.gapdh(f:5
′‑
gcaccgtcaaggctgagaac
‑3′
(seq id no:13);r: 5
′‑
tggtgaagac gccagtgga
‑3′
(seq id no:14))。
65.(4)细胞增殖实验
66.根据制造商的方案,通过cell counting kit
‑
8测定(yeason,shanghai,china) 检测细胞增殖。根据制造商的方案,在每个孔中种植10000个细胞24小时或 12小时。检查点结束时,用10μl cck8溶液检测每孔的od值。在450nm和 600nm处用分光光度法测量溶液。
67.(5)蛋白免疫印迹
68.ripa收集细胞,每组取总蛋白20μg进行电泳。将膜与5%脱脂牛奶在 22℃下孵育2小时,然后与一抗孵育。主要抗体如下:actin(13e5,cst), mettl14(d8k8w,cst),ythdf2(ab220163,abcam),slc7a11(ab175186, abcam),e
‑
cadherin(24e10,cst),n
‑
cadherin(d4r1h)cst)、波形蛋白(d21h3, cst)和肌动蛋白(13e5,cst)在4℃下过夜。随后,在22℃温度下使用抗兔二抗2小时。使用化学发光ecl试剂盒(tanon,上海,中国)观察蛋白质条带。
69.(6)划痕实验
70.为了评估细胞的迁移能力,进行了伤口愈合试验。如果需要,将nac和/ 或pcdna3.1
‑
slc7a11
‑
his( )(2μg)添加到孔中。细胞在37℃和5%co2条件下培养。用20
‑
200μl移液器吸头进行划痕,随后用pbs洗涤板并更换为新鲜培养基。使用相差显微镜(佳能,日本)在划伤后0和48小时拍摄伤口愈合图像。
71.(7)活性氧ros检测
72.为了评估细胞的迁移能力,进行了伤口愈合试验。如果需要,将nac和/ 或pcdna3.1
‑
slc7a11
‑
his( )(2μg)添加到孔中。细胞在37℃和5%co2条件下培养。用20
‑
200μl移液器吸头进行划痕,随后用pbs洗涤板并更换为新鲜培养基。使用相差显微镜(佳能,日
本)在划伤后0和48小时拍摄伤口愈合图像。
73.(8)荧光报告基因实验
74.根据制造商的说明(11402es60,yeasen)收集rna。huh7或hcclm3 细胞接种在6孔板中,并用宽型slc7a11响应荧光素酶报告构建体 (slc7a11
‑
wt)、突变体slc7a11响应荧光素酶报告构建体(slc7a11
‑
mut)、宽型或mettl14质粒转染,siythdf2,相应地。在转染后24h,将细胞裂解物与10μg/ml的萤火虫和tk分别孵育10分钟。通过双荧光素酶报告基因检测系统(promega,madison,wi,usa)和微孔板光度计(promega)测量荧光素酶活性。萤火虫荧光素酶活性被相应的海肾荧光素酶活性校正。
75.(9)甲基化rna免疫沉淀(merip)
76.merip遵循制造商的说明(pierce
tm magnetic rna
‑
protein pull
‑
down kit, cat.no.20164)。简而言之,分离出200μg的总rna用于polya rna (promega)并进行定量。polya rna被分成大约100nt长的片段。在进行 m6a
‑
ip之前,使用生物分析仪确保rna片段化。之后,首先进行第一链cdna 合成。qpcr如所述进行。
77.(10)rna稳定性实验
78.如前所述进行rna衰变测定。简而言之,将huh7和hcclm3细胞以 60%的汇合度接种在6厘米的平板中。24小时后,将每个6厘米的平板重新播种到三个6厘米的平板中。48小时后,在收集前的8小时、4小时、2小时和0小时加入放线菌素d至3mg/ml。通过柱上dnase
‑
i消化步骤纯化总 rna。rna量由rt
‑
qpcr确定。
79.(11)mda实验
80.为了测试脂质过氧化,我们使用脂质过氧化(mda)检测试剂盒(货号 mak085,sigma
‑
aldrich,美国)。该程序遵循制造商的说明。
81.(12)电镜拍照
82.为了获得线粒体在细胞中的位置,对不同干预的hcc细胞进行电子显微镜摄影。为了成像,如下制备细胞。样品在4℃下用1%锇酸固定1小时。之后,使用ddh2o清洗样品。然后,样品用醋酸铀染色过夜。使用不同浓度的酒精使样品脱水。样品经embed 812embedding kit包埋,最后聚合成像。
83.(13)动物模型
84.使用不同的慢病毒感染野生型hcclm3细胞株,具体使用的慢病毒种类有: slc7a11
‑
control(无义序列)、slc7a11
‑
knockdown(shrna的序列为: ttctccgaacgtgtca cgtttc)(seq id no:15);mettl14
‑
vector(无义序列)、mettl14
‑
overexpression、mettl14
‑
r298p共五种慢病毒。根据说明书,准备好5
×
105个hcclm3细胞,使用额定moi(滴度单位)的对应病毒感染细胞,并于37℃,5%co2,90%以上湿度的条件下培养。18小时后,使用嘌呤霉素进行稳转株的筛选(载体均带有表达gfp及嘌呤抗性的片段)。3天后在荧光显微镜下使用约488nm处的单个激发峰,发射峰波长为509nm的荧光观察稳转株的建立。确认几乎所有细胞均带有绿色荧光后,再次予以细胞扩增。
85.成功建立稳转株后,进行皮下瘤种植。本研究主要分为两个动物实验,分别有二组和三组不同类别的皮下瘤移植瘤模型。(1):mettl14
‑
vector、 mettl14
‑
overexpression、mettl14
‑
r298p三种移植瘤观察mettl14的m6a 功能对肿瘤生长的作用;(2)slc7a11
‑
control、slc7a11
‑
knockdown两种移植瘤观察slc7a11对肿瘤生长的作用。
86.具体种植过程为:消化每种细胞,以3.5
×
107个细胞溶解于100μl的pbs 中,并注射于裸鼠背侧靠右后皮下;7天后观察成瘤情况并进行下一步实验;约 5周后处死裸鼠,最终根据定期(每3天)测量结果对移植瘤进行计算并绘制肿瘤生长图。
87.(14)h&e染色和免疫组织化学
88.异种移植样品在4%多聚甲醛(sigma
‑
aldrich,dk
‑
2860,丹麦)中固定过夜,并在切割6μm切片之前嵌入石蜡中。抗原修复在100℃的柠檬酸盐缓冲液中进行25分钟。将0.1%tween20和2.5%bsa(sigma
‑
aldrich)混合到样品中。一抗如下:mettl14(ab220030,abcam,u.k.)、slc7a11(ab37185,abcam, u.k.)和cox2(ab179800,abcam,u.k.)。应用适当的辣根过氧化物酶偶联二抗进行开发(ab205718,abcam,英国)。
89.实施例1
90.缺氧在体外以hif
‑
1α依赖性方式抑制mettl14诱导的铁死亡:
91.为了确定缺氧条件下mettl14和rna m6a修饰的作用,首先检测了 mettl14在含1%o2(缺氧条件,hypoxia)的huh7和hcclm3细胞系中的表达。结果表明,与对照组(常氧,normoxia)相比,缺氧有效地降低了 mettl14并增加了两种hcc细胞系中的hif
‑
1α表达,如图1a所示。然后,采用shrna敲低hif
‑
1α,结果表明对hif
‑
1α的抑制强烈阻止了缺氧诱导的mettl14下调,如图1b所示,这表明缺氧引发的mettl14抑制是hif
‑
1α依赖性的。铁死亡是一种受调节的细胞死亡形式,已被证明具有肿瘤抑制功能,可用于癌症治疗。ros和mda是铁死亡的公认指标。为了探讨缺氧对铁死亡的影响,通过流式细胞术测定ros(活性氧)。结果显示抑制hif
‑
1α增强了 huh7和hcclm3细胞系中ros的积累(p<0.0001),如图1c所示。此外, mda(脂质过氧化)测定显示,与对照组相比,hif
‑
1α敲低组的mda含量更高(p<0.01),如图1d所示。此外,众所周知,铁死亡可以诱导典型的形态变化,其特征是线粒体浓缩和破坏。一致地,与对照组相比,在实验中观察到敲低 hif
‑
1α显著诱导更小、更密集的线粒体膜受损,如图1e所示。以上实验结果表明缺氧以hif
‑
1α依赖性方式下调mettl14,并通过敲低hif
‑
1α可诱导 hcc细胞中的铁死亡。
92.实施例2
93.mettl14在hcc中负调节slc7a11的表达:
94.为了探索mettl14调节铁死亡的潜在机制,使用多个数据库分析了 mettl14和slc7a11的表达模式,该系统是介导铁死亡的系统xc
‑
的核心成员。首先,在癌症基因组图谱(tcga)和oncomine数据库中分析了mettl14 在hcc患者与健康患者中的表达模式。与正常肝脏相比,mettl14在hcc 患者中的表达水平分别下调1.052倍(p=7.32
×
10
‑9)、1.059倍(p=4.86
×
10
‑4);另一方面,mettl14表达较低的hcc患者的总生存期短于mettl14表达较高的患者,如图2a所示。此外,在oncomine数据库“wurmbach liver”、“roessler liver”和“roessler liver 2”中进一步分析了slc7a11在hcc患者和健康受试者中的表达。与健康受试者相比,hcc患者的slc7a11的表达上调至 3.343倍(p=6.18
×
10
‑6)、1.943倍(p=1.58
×
10
‑4)、1.494倍(p=1.47
×
10
‑
18
),如图2b所示。
95.在7种hcc细胞系中进一步分析了mettl14表达。与正常肝细胞系 l02相比,除hepg2外,huh7、7721、hcclm3、mhcc97h、plc/prf/5和 bel
‑
7402细胞系中mettl14蛋白降低,如图2c所示。
96.另外,除了hepg2和mhcc97h外,大多数检测到的hcc细胞系中slc7a11的mrna和蛋
白质水平均显著上调,如图2d所示,表明mettl4 可能与slc7a11表达呈负相关。重要的是,缺氧条件下过表达的mettl14可以在mrna和蛋白质水平上显著下调slc7a11的表达,如图2e所示。以上结果表明,mettl14负调节slc7a11表达。
97.实施例3
98.mettl14在hcc中slc7a11 mrna的5'utr处触发m6a甲基化:
99.为了验证slc7a11和mettl14之间的具体关系,首先检查了rna basev2.0(http://www.sysu.edu.cn),发现slc7a11 mrna的5'utr内有几个潜在的 m6a位点,如图3a所示,这表明slc7a11可能以依赖于m6a的方式由 mettl14调节。已经证明r298p突变大大降低了mettl14甲基化活性。因此建立了稳定的mettl14
‑
r298p表达huh7和hcclm3细胞系,如图3b 所示。为了确定slc7a11的m6a修饰是否由mettl14介导,首先通过 m6a斑点印迹法检测了阴性对照组和稳定的mettl14过表达组以及 mettl14
‑
r298p组中的总m6a水平。正如预期的那样,m6a水平随着 mettl14的过表达而显著增加,但在两个hcc细胞系中因r298p突变而降低,如图3c所示。
100.为了探索slc7a11上m6a修饰的本质,使用野生型(wt)和突变型 (mut)质粒进行荧光素酶报告基因检测,如图3d所示。对于突变报告基因,胞嘧啶碱基(c)被设计为在几个预测的m6a位点替换腺苷碱基(a)以阻断 m6a甲基化的影响,而野生型报告基因包含完整的m6a位点。正如预期所见, mettl14过表达适度降低了宽型组的荧光素酶活性,但对突变对应物几乎没有影响,如图3e所示,表明slc7a11调节受mettl14引导的m6a修饰的控制。
101.此外,通过merip
‑
qpcr测定检测到slc7a11中m6a的富集。与igg 对照组相比,在m6a特异性抗体处理组中检测到slc7a11转录物的显著富集。此外,mettl14
‑
r298p突变表达后由m6a修饰的slc7a11水平显著降低,如图3f所示。因此,mettl14可能会影响m6a的整体水平,特别是 slc7a11。
102.为了证实mettl14在体内的作用,通过将具有宽型mettl14或 mettl14
‑
r298p突变体稳定过表达的hcc细胞(hcclm3)皮下注射到裸鼠中来构建肿瘤异种移植模型。结果发现宽型mettl14过表达抑制了肿瘤发生,与对照组相比,肿瘤体积显著降低。同时,mettl14
‑
r298p突变体的强制表达在异种移植小鼠中失去了肿瘤抑制作用,如图3g,3h所示。一致地,与对照和mettl14
‑
r298p突变组相比,mettl14过表达组表现出较低水平的 slc7a11和较高水平的cox2,这是异种移植物中铁死亡的金指标,如图3i 所示。并且还显示了异种移植物中mettl14和slc7a11之间呈负相关, mettl14和cox2之间呈正相关,如图3j所示。此外,肿瘤切片的h&e染色表示为肿瘤结构,如图3k所示。通过免疫组织化学进一步研究了异种移植肿瘤切片中mettl14、slc7a11和cox2的表达。与其他两组相比,mettl14 过表达组表现出较低的slc7a11表达和较高的cox2表达,如图3l所示。
103.因此,以上结果表明mettl14通过在hcc中以m6a依赖性方式靶向 slc7a11来发挥肿瘤抑制功能。
104.实施例4
105.mettl14诱导的slc7a11 mrna衰减依赖于m6a
‑
ythdf2:
106.找出slc7a11的阅读器至关重要,因为m6a修饰的mrna转录物依赖于阅读器蛋白在功能上参与生物过程。在实施例2中的结果表明mettl14过表达显著下调了huh7和hcclm3细胞系中的slc7a11 mrna(图2e)。接下来测试了m6a修饰是否影响slc7a11的mrna稳定性。
qpcr表明,在放线菌素d存在下,mettl14的过表达显著增强了slc7a11 mrna的降解,如图4a所示。
107.ythdf2(yth域家族2)是一种公认的m6a阅读器蛋白,已被证明可以调节mrna的稳定性。通过敲低ythdf2的表达在mrna和蛋白质水平上显著增加了slc7a11的表达,如图4b所示,这表明ythdf2在slc7a11 调节中的潜在作用。此外,如前所述,荧光素酶报告基因检测是用含有野生型 (wt)或突变体(mut)slc7a11的质粒进行的。正如预期的那样,ythdf2的敲低显著增加了宽型组的荧光素酶活性,但对突变组几乎没有影响,如图4c所示。
108.因此,以上实验结果表明m6a
‑
ythdf2进行mettl14诱导的 slc7a11 mrna降解。
109.实施例5
110.slc7a11的敲低刺激铁死亡并在hcc中表现出抗肿瘤作用:
111.为了验证slc7a11抑制是否可以模拟mettl14的肿瘤抑制功能,首先构建了慢病毒敲低slc7a11的hcclm3细胞(shrna的序列为: ttctccgaacgtgtca cgtttc(seq id no:15)),并检测了slc7a11敲低对铁死亡诱导的影响,如图5a所示,shslc7a11强烈刺激了ros的产生,而ros清除剂n
‑
乙酰
‑
l
‑
半胱氨酸(nac)在huh7和huh7中显著阻断了 hcclm3细胞中shslc7a11诱导的ros积累以及emt逆转,如图5b所示。此外,nac治疗有效地消除了电子显微镜检测到的shslc7a11诱导的线粒体收缩。与shslc7a11组相比,shslc7a11 nac组的线粒体表现出相对更完整的膜和更大的尺寸,如图5c所示。此外,在裸鼠体内观察到同样的趋势。与对照组相比,slc7a11的下调显著抑制了肿瘤生长,如图5d所示。肿瘤切片的h&e染色表示为肿瘤结构,如图5e所示。此外,免疫组织化学分析显示shslc7a11组具有更高的cox2表达,如图5f所示。因此,通过抑制hcc细胞中的slc7a11验证了抗肿瘤作用。
112.实施例6
113.外源性表达的slc7a11消除了mettl14在hcc缺氧条件下诱导的肿瘤抑制作用:
114.通过进一步的实验检查了slc7a11的抑制是否有助于mettl14的抗肿瘤作用。如图6a所示,在缺氧环境下,宽型mettl14而不是mettl14
‑
r298p 突变体强烈抑制slc7a11表达,而slc7a11的过表达有效地消除了 mettl14在两种hcc细胞系中诱导的slc7a11下调。正如预期的那样,由此产生的slc7a11过表达明显消除了mettl14诱导的细胞迁移抑制,如图6b所示。此外,slc7a11过表达还显著阻止了mettl14在huh7和hcclm3细胞中诱导的生长抑制,如图6c所示。以上实验结果表明slc7a11 有效地参与了mettl14调节的生长和迁移。
115.上述实施例仅为本发明的优选实施例,并非对本发明任何形式上和实质上的限制,应当指出,对于本技术领域的普通技术人员,在不脱离本发明的前提下,还将可以做出若干改进和补充,这些改进和补充也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。