1.本发明属于药物技术领域,具体涉及一种免疫激活型抗体及其应用。
背景技术:
2.toll样受体(toll like receptor,tlr)属于经典的动物天然免疫系统。哺乳动物及人类的tlr受体有11个成员,如tlr2、tlr3、tlr4、tlr7、tlr9等;各tlr分别能够被特异性配体激活后产生抵御细菌、病毒等各种微生物侵袭,以及抗肿瘤。其中的tlr7能够被人工合成的小分子免疫激活剂激活。虽然tlr7的激活强度与免疫细胞(如树突状细胞、巨噬细胞、t细胞,b细胞和nk细胞等)对杀伤肿瘤细胞的能力正相关,但是非特异性杀伤也易于导致免疫风暴对正常组织的损伤副作用。
3.因此,如何减轻或避免免疫激活剂在激活免疫系统时对正常组织的副作用,是目前研究的重点之一。
技术实现要素:
4.本发明的目的是提供一种免疫激活型抗体及其应用,旨在解决现有免疫激活剂在激活免疫系统时容易导致对正常组织的损伤副作用等技术问题。
5.为了实现上述发明目的,本发明第一方面,提供了一种免疫激活型抗体,其包括抗体和免疫激活剂,所述抗体与所述免疫激活剂通过偶联链偶联,所述偶联链包括如式(a)所示的结构、如式(b)、式(c)、式(d)所示的结构中的至少一种:
[0006][0007][0008]
本发明通过将免疫激活剂和抗体通过偶联链进行偶联,可形成一系列靶向特定组织和病灶、靶点的免疫激活型抗体,可达到局部靶向激活免疫的作用,解决了tlr激活对正
常组织的负面影响。经实验验证,该免疫激活型抗体可引导其中的免疫激活剂在需要的位点或环境(如肿瘤微环境)发挥作用,具有激活目的免疫细胞(如t细胞、b细胞、nk细胞等)、逆转惰性的免疫细胞(如巨噬细胞转为m1型抗肿瘤巨噬细胞,提高m1/m2比例等)、将免疫细胞转化为具有抗肿瘤活性的免疫细胞(如提高ifn
‑
γ cd8的细胞数量等)等多种作用,具有更好的特异性免疫调节和治疗效果。
[0009]
本发明第二方面,提供了一种免疫激活型抗体在制备抗肿瘤药物、抗病毒药物、免疫调节药物和/或消除靶点蛋白的制剂中的应用。
[0010]
由于本发明提供免疫激活型抗体具有局部靶向激活免疫的作用,将其用于制备抗肿瘤药物、抗病毒药物、免疫调节药物、和/或消除靶点蛋白制剂中,不仅可以避免非特异性杀伤对正常组织的损伤副作用,而且具有激活目的免疫细胞(如t细胞、b细胞、nk细胞等)、逆转惰性的免疫细胞(如巨噬细胞转为m1型抗肿瘤巨噬细胞,提高m1/m2比例等)、将免疫细胞转化为具有抗肿瘤活性的免疫细胞(如提高ifn
‑
γ cd8的细胞数量等)等多种作用,应用前景良好。
附图说明
[0011]
图1为本发明实施例1对化合物的hek
‑
blue htlr7检测的方法和结果;
[0012]
图2和图3为本发明实施例2对化合物释放的tlr7激动剂释放效果的检测结果;
[0013]
图4为本发明实施例3对化合物15
‑
4给药第25天肿瘤重量的检测结果;
[0014]
图5为本发明实施例3对化合物34给药25天的肿瘤体积变化检测结果;
[0015]
图6为本发明实施例4中化合物28、化合物30和化合物15
‑
4对肿瘤微环境巨噬细胞调节作用的检测结果(m1/m2标记物mhc
‑
classii/cd206相对值);
[0016]
图7为本发明实施例4中化合物28、化合物30和化合物15
‑
4对肿瘤组织ifn
‑
γ cd8细胞改变相对值的检测结果;
[0017]
图8为本发明实施例5中化合物35对sk
‑
br
‑
3细胞的抑制效应检测结果;
[0018]
图9为本发明实施例5中化合物36对a549细胞的抑制效应检测结果;
[0019]
图10为本发明实施例6中的各化合物对hek
‑
blue htlr7细胞的激活效果;
[0020]
图11为本发明实施例6中的各化合物对hek
‑
blue htlr7细胞的失活效果;
[0021]
图12为本发明实施例以ho
‑
vc
‑
t为代表的酶(cathepsin
‑
b)作用tlr7激动剂降解示意图;
[0022]
图13免疫激活性抗体通式;
[0023]
图14trastuzumab曲妥珠单抗的蛋白序列;
[0024]
图15atezolizumab单抗的蛋白序列;
[0025]
图16cathepsin酶催化裂解释放免疫激动剂示意图;
[0026]
图17各化合物在cathepsin
‑
b酶作用下的tlr7激活效果图;
[0027]
图18各化合物在无cathepsin
‑
b作用时对tlr7激活效果图;
[0028]
图19抗体29
‑
1对人h1299细胞的抑制效果图;
[0029]
图20抗体17
‑
1对人mda
‑
mb
‑
453细胞的抑制效果图。
具体实施方式
[0030]
为使本发明实施例的目的、技术方案和技术效果更加清楚,对本发明实施例中的技术方案进行清楚、完整地描述,以下所描述的实施例是本发明一部分实施例,而不是全部的实施例。结合本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其它实施例,都属于本发明保护的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行;所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
[0031]
在本发明的描述中,术语“和/或”,描述关联对象的关联关系,表示可以存在三种关系,例如,a和/或b,可以表示:单独存在a,同时存在a和b,单独存在b的情况。其中a,b可以是单数或者复数。字符“/”一般表示前后关联对象是一种“或”的关系。
[0032]
在本发明的描述中,“至少一个”是指一个或者多个,“多个”是指两个或两个以上。“以下至少一项(个)”或其类似表达,是指的这些项中的任意组合,包括单项(个)或复数项(个)的任意组合。例如,“a,b,或c中的至少一项(个)”,或,“a,b,和c中的至少一项(个)”,均可以表示:a、b、c、a
‑
b(即a和b)、a
‑
c、b
‑
c、或a
‑
b
‑
c,其中a、b、c分别可以是单个,也可以是多个。
[0033]
需要理解的是,本发明实施例中所提到的相关成分的重量不仅仅可以指代各组分的具体含量,也可以表示各组分间重量的比例关系,因此,只要是按照本发明实施例相关组分的含量按比例放大或缩小均在本发明公开的范围之内。具体地,本发明实施例中所述的重量可以是μg、mg、g、kg等化工领域公知的质量单位。
[0034]
另外,除非上下文另外明确地使用,否则词的单数形式的表达应被理解为包含该词的复数形式。术语“包括”或“具有”旨在指定特征、数量、步骤、操作、元件、部分或者其组合的存在,但不用于排除存在或可能添加一个或多个其它特征、数量、步骤、操作、元件、部分或者其组合。
[0035]
本发明实施例提供了一种免疫激活型抗体,其包括抗体和免疫激活剂,抗体与免疫激活剂通过偶联链偶联,偶联链包括如式(a)所示的结构、如式(b)所示的结构、如式(c)所示的结构、如式(d)所示的结构中的至少一种:
[0036][0037]
本发明实施例通过将免疫激活剂和抗体通过偶联链进行偶联,可形成一系列靶向特定组织和病灶、靶点的免疫激活型抗体,可达到局部靶向激活免疫的作用,解决了tlr激活对正常组织的负面影响。经实验验证,该免疫激活型抗体可引导其中的免疫激活剂在需要的位点或环境(如肿瘤微环境)发挥作用,具有激活目的免疫细胞(如t细胞、b细胞、nk细胞等)、逆转惰性的免疫细胞(如巨噬细胞转为m1型抗肿瘤巨噬细胞,提高m1/m2比例等)、将免疫细胞转化为具有抗肿瘤活性的免疫细胞(如提高ifn
‑
γ cd8的细胞数量等)等多种作用,具有更好的特异性免疫调节和治疗效果。
[0038]
本发明实施例提供的免疫激活型抗体区别于其它免疫激活型抗体之处在于,本发明实施例提供的免疫激活型抗体在普通免疫细胞环境中不会激发表达tlr7或tlr8的免疫细胞,也不会产生免疫细胞因子;只有在抗体靶标的细胞环境(如肿瘤细胞环境),或抗体导向的含有蛋白酶(如cathepsin
‑
b)的环境中才能激活免疫系统和免疫细胞。
[0039]
本发明实施例提供的免疫激活型抗体的结构通式如图13所示。
[0040]
该结构通式中,“偶联链”由“第一连接链”、“第二连接链”和“可降解链”共同组成,其中,“第一连接链”、“第二连接链”均为本领域常规用于连接的结构,此处不一一赘述;“可降解链”这一部分的结构即为式(a)所示的结构,该结构也可以替换为式(b)、式(c)和/或式(d)所示的结构,相应的免疫激活型抗体的结构通式会发生变化,此处不再列举其变化后的通式。例如,式(a)所示的结构中的一些具体结构(valine
‑
citrulline linker:val
‑
cit),通过替换可降解链部分,可得到式(b)所示的结构的一些具体结构(valine
‑
alanine linker:val
‑
ala),具体如下:
[0041][0042]
本发明实施例提供的免疫激活型抗体主要包括三部分:抗体、偶联链和免疫激活剂。以下对该三部分进行具体说明:
[0043]
偶联链:
[0044]
本发明实施例中的偶联链可以选自含cathepsin
‑
b区域可降解的链、烷基、烷氧基、含氮烷基、杂环、特异功能链中的至少一种。
[0045]
在一些实施例中,偶联链包括化合物5、化合物5
‑
1、化合物5
‑
2、化合物gy209、化合物6、化合物6
‑
1、化合物6
‑
2、化合物6
‑
3、化合物7、化合物7
‑
1、化合物7
‑
2、化合物7
‑
3、化合物7
‑
4、化合物7
‑
5、化合物8、化合物8
‑
1、化合物8
‑
2、化合物8
‑
3、化合物8
‑
4、化合物8
‑
5、化合物8
‑
6、化合物8
‑
7、化合物27、化合物gy206、化合物gy207、化合物5a
‑
gy102、化合物vcb
‑
4、化合物bvc
‑
t
‑
4、化合物tri
‑
linker
‑
1、化合物tri
‑
linker
‑
2中的至少一种,结构式分别如下:
[0046][0047]4‑
((s)
‑2‑
((s)
‑2‑
(6
‑
(2,5
‑
dioxo
‑
2,5
‑
dihydro
‑
1h
‑
pyrrol
‑1‑
yl)hexanamido)
‑3‑
methylbutanamido)
‑5‑
ureidopentanamido)benzyl 6
‑
amino
‑2‑
butoxy
‑9‑
(cyanomethyl)
‑8‑
oxo
‑
8,9
‑
dihydro
‑
7h
‑
purine
‑7‑
carboxylate
[0048][0049]6‑
amino
‑2‑
butoxy
‑9‑
(cyanomethyl)
‑
n
‑
(4
‑
((s)
‑2‑
((s)
‑2‑
(6
‑
(2,5
‑
dioxo
‑
2,5
‑
dihydro
‑
1h
‑
pyrrol
‑1‑
yl)hexanamido)
‑3‑
methylbutanamido)
‑5‑
ureidopentanamido)benzyl)
‑8‑
oxo
‑
8,9
‑
dihydro
‑
7h
‑
purine
‑7‑
carboxamide
[0050][0051]
n
‑
((s)
‑1‑
(((s)
‑1‑
(6
‑
amino
‑2‑
butoxy
‑8‑
oxo
‑9‑
(prop
‑2‑
yn
‑1‑
yl)
‑
8,9
‑
dihydro
‑
7h
‑
purin
‑7‑
yl)
‑1‑
oxo
‑5‑
ureidopentan
‑2‑
yl)amino)
‑3‑
methyl
‑1‑
oxobutan
‑2‑
yl)
‑6‑
(2,5
‑
dioxo
‑
2,5
‑
dihydro
‑
1h
‑
pyrrol
‑1‑
yl)hexanamide
[0052][0053]4‑
(((s)
‑1‑
(((s)
‑1‑
((4
‑
(((6
‑
amino
‑2‑
butoxy
‑8‑
oxo
‑9‑
(prop
‑2‑
yn
‑1‑
yl)
‑
8,9
‑
dihydro
‑
7h
‑
purine
‑7‑
carbonyl)oxy)methyl)phenyl)amino)
‑1‑
oxo
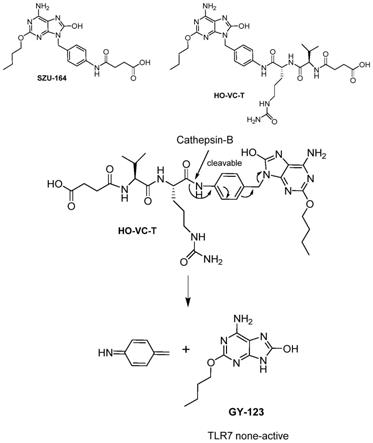
‑5‑
ureidopentan
‑2‑
yl)amino)
‑3‑
methyl
‑1‑
oxobutan
‑2‑
yl)amino)
‑4‑
oxobutanoic acid
[0054][0055]4‑
(((s)
‑1‑
(((s)
‑1‑
((4
‑
((6
‑
amino
‑2‑
butoxy
‑8‑
oxo
‑9‑
(prop
‑2‑
yn
‑1‑
yl)
‑
8,9
‑
dihydro
‑
7h
‑
purine
‑7‑
carboxamido)methyl)phenyl)amino)
‑1‑
oxo
‑5‑
ureidopentan
‑2‑
yl)amino)
‑3‑
methyl
‑1‑
oxobutan
‑2‑
yl)amino)
‑4‑
oxobutanoic acid
[0056][0057]4‑
(((s)
‑1‑
(((s)
‑1‑
(6
‑
amino
‑2‑
butoxy
‑8‑
oxo
‑9‑
(prop
‑2‑
yn
‑1‑
yl)
‑
8,9
‑
dihydro
‑
7h
‑
purin
‑7‑
yl)
‑1‑
oxopropan
‑2‑
yl)amino)
‑3‑
methyl
‑1‑
oxobutan
‑2‑
yl)amino)
‑4‑
oxobutanoic acid
[0058][0059]4‑
(((s)
‑1‑
(((s)
‑1‑
(6
‑
amino
‑2‑
butoxy
‑8‑
oxo
‑9‑
(prop
‑2‑
yn
‑1‑
yl)
‑
8,9
‑
dihydro
‑
7h
‑
purin
‑7‑
yl)
‑1‑
oxo
‑5‑
ureidopentan
‑2‑
yl)amino)
‑3‑
methyl
‑1‑
oxobutan
‑2‑
yl)amino)
‑4‑
oxobutanoic acid
[0060][0061]4‑
((2s,5s)
‑5‑
isopropyl
‑
17
‑
isothiocyanato
‑
4,7
‑
dioxo
‑2‑
(3
‑
ureidopropyl)
‑
9,12,15
‑
trioxa
‑
3,6
‑
diazaheptadecanamido)benzyl
[0062]6‑
amino
‑2‑
butoxy
‑8‑
oxo
‑9‑
(prop
‑2‑
yn
‑1‑
yl)
‑
8,9
‑
dihydro
‑
7h
‑
purine
‑7‑
carboxylate
[0063][0064]6‑
amino
‑2‑
butoxy
‑
n
‑
(4
‑
((2s,5s)
‑5‑
isopropyl
‑
17
‑
isothiocyanato
‑
4,7
‑
dioxo
‑2‑
(3
‑
ureidopropyl)
‑
9,12,15
‑
trioxa
‑
3,6
‑
diazaheptadecanamido)benzyl)
‑8‑
oxo
‑9‑
(prop
‑2‑
yn
‑1‑
yl)
‑
8,9
‑
dihydro
‑
7h
‑
purine
‑7‑
carboxamide
[0065][0066]4‑
((2s,5s)
‑5‑
isopropyl
‑
17
‑
isothiocyanato
‑
4,7
‑
dioxo
‑2‑
(3
‑
ureidopropyl)
‑
9,12,15
‑
trioxa
‑
3,6
‑
diazaheptadecanamido)benzyl
[0067]6‑
amino
‑2‑
butoxy
‑9‑
(cyanomethyl)
‑8‑
oxo
‑
8,9
‑
dihydro
‑
7h
‑
purine
‑7‑
carboxylate
[0068]
[0069]
(s)
‑
n
‑
((s)
‑1‑
(6
‑
amino
‑2‑
butoxy
‑8‑
oxo
‑9‑
(prop
‑2‑
yn
‑1‑
yl)
‑
8,9
‑
dihydro
‑
7h
‑
purin
‑7‑
yl)
‑1‑
oxo
‑5‑
ureidopentan
‑2‑
yl)
‑2‑
(2
‑
(2
‑
(2
‑
(2
‑
isothiocyanatoethoxy)ethoxy)ethoxy)acetamido)
‑3‑
methylbutanamide
[0070][0071]
(s)
‑
n
‑
(4
‑
(6
‑
amino
‑2‑
butoxy
‑8‑
oxo
‑9‑
(prop
‑2‑
yn
‑1‑
yl)
‑
8,9
‑
dihydro
‑
7h
‑
purine
‑7‑
carbonyl)phenyl)
‑2‑
((s)
‑2‑
isopropyl
‑
14
‑
isothiocyanato
‑4‑
oxo
‑
6,9,12
‑
trioxa
‑3‑
azatetradecanamido)
‑5‑
ureidopentanamide
[0072][0073]
(s)
‑
n
‑
(4
‑
((6
‑
amino
‑2‑
butoxy
‑8‑
oxo
‑9‑
(prop
‑2‑
yn
‑1‑
yl)
‑
8,9
‑
dihydro
‑
7h
‑
purin
‑7‑
yl)methyl)phenyl)
‑2‑
((s)
‑
14
‑
azido
‑2‑
isopropyl
‑4‑
oxo
‑
6,9,12
‑
trioxa
‑3‑
azatetradecanamido)
‑5‑
ureidopentanamide
[0074][0075]4‑
((2s,5s)
‑
17
‑
azido
‑5‑
isopropyl
‑
4,7
‑
dioxo
‑2‑
(3
‑
ureidopropyl)
‑
9,12,15
‑
trioxa
‑
3,6
‑
diazaheptadecanamido)benzyl
[0076]6‑
amino
‑2‑
butoxy
‑9‑
(cyanomethyl)
‑8‑
oxo
‑
8,9
‑
dihydro
‑
7h
‑
purine
‑7‑
carboxylate
[0077][0078]6‑
amino
‑
n
‑
(4
‑
((2s,5s)
‑
17
‑
azido
‑5‑
isopropyl
‑
4,7
‑
dioxo
‑2‑
(3
‑
ureidopropyl)
‑
9,12,15
‑
trioxa
‑
3,6
‑
diazaheptadecanamido)benzyl)
‑2‑
butoxy
‑9‑
(cyanomethyl)
‑8‑
oxo
‑
8,9
‑
dihydro
‑
7h
‑
purine
‑7‑
carboxamide
[0079][0080]6‑
amino
‑
n
‑
(4
‑
((2s,5s)
‑
17
‑
azido
‑5‑
isopropyl
‑
4,7
‑
dioxo
‑2‑
(3
‑
ureidopropyl)
‑
9,12,15
‑
trioxa
‑
3,6
‑
diazaheptadecanamido)benzyl)
‑2‑
butoxy
‑8‑
oxo
‑9‑
(prop
‑2‑
yn
‑1‑
yl)
‑
8,9
‑
dihydro
‑
7h
‑
purine
‑7‑
carboxamide
[0081][0082]6‑
amino
‑
n
‑
(4
‑
((2s,5s)
‑
17
‑
azido
‑5‑
isopropyl
‑
4,7
‑
dioxo
‑2‑
(3
‑
ureidopropyl)
‑
9,12,15
‑
trioxa
‑
3,6
‑
diazaheptadecanamido)benzyl)
‑2‑
butoxy
‑9‑
((1
‑
cyclooctyl
‑
1h
‑
1,2,3
‑
triazol
‑4‑
yl)methyl)
‑8‑
oxo
‑
8,9
‑
dihydro
‑
7h
‑
purine
‑7‑
carboxamide
[0083][0084]
(s)
‑
n
‑
((s)
‑1‑
(6
‑
amino
‑2‑
butoxy
‑8‑
oxo
‑9‑
(prop
‑2‑
yn
‑1‑
yl)
‑
8,9
‑
dihydro
‑
7h
‑
purin
‑7‑
yl)
‑1‑
oxopropan
‑2‑
yl)
‑2‑
(2
‑
(2
‑
(2
‑
(2
‑
azidoethoxy)ethoxy)ethoxy)acetamido)
‑3‑
methylbutanamide
[0085][0086]
n
‑
((s)
‑1‑
(((s)
‑1‑
(6
‑
amino
‑2‑
butoxy
‑8‑
oxo
‑9‑
(prop
‑2‑
yn
‑1‑
yl)
‑
8,9
‑
dihydro
‑
7h
‑
purin
‑7‑
yl)
‑1‑
oxopropan
‑2‑
yl)amino)
‑3‑
methyl
‑1‑
oxobutan
‑2‑
yl)
‑6‑
(2,5
‑
dioxo
‑
2,5
‑
dihydro
‑
1h
‑
pyrrol
‑1‑
yl)hexanamide
[0087][0088]
(s)
‑
n
‑
((s)
‑1‑
(6
‑
amino
‑2‑
butoxy
‑8‑
oxo
‑9‑
(prop
‑2‑
yn
‑1‑
yl)
‑
8,9
‑
dihydro
‑
7h
‑
purin
‑7‑
yl)
‑1‑
oxopropan
‑2‑
yl)
‑2‑
(2
‑
(2
‑
(2
‑
(2
‑
isothiocyanatoethoxy)ethoxy)ethoxy)acetamido)
‑3‑
methylbutanamide
[0089][0090]
(s)
‑
n
‑
((s)
‑1‑
(6
‑
amino
‑2‑
butoxy
‑8‑
oxo
‑9‑
(prop
‑2‑
yn
‑1‑
yl)
‑
8,9
‑
dihydro
‑
7h
‑
purin
‑7‑
yl)
‑1‑
oxo
‑5‑
ureidopentan
‑2‑
yl)
‑2‑
(2
‑
(2
‑
(2
‑
(2
‑
azidoethoxy)ethoxy)ethoxy)acetamido)
‑3‑
methylbutanamide
[0091][0092]4‑
(((s)
‑1‑
(((s)
‑1‑
((4
‑
(15
‑
(4
‑
((6
‑
amino
‑2‑
butoxy
‑8‑
hydroxy
‑
9h
‑
purin
‑9‑
yl)methyl)
‑
1h
‑
1,2,3
‑
triazol
‑1‑
yl)
‑3‑
oxo
‑
2,7,10,13
‑
tetraoxa
‑4‑
azapentadecyl)phenyl)amino)
‑1‑
oxo
‑5‑
ureidopentan
‑2‑
yl)amino)
‑3‑
methyl
‑1‑
oxobutan
‑2‑
yl)amino)
‑4‑
oxobutanoic acid
[0093][0094]4‑
(17
‑
azido
‑5‑
isopropyl
‑
4,7
‑
dioxo
‑2‑
(3
‑
ureidopropyl)
‑
9,12,15
‑
trioxa
‑
3,6
‑
diazaheptadecanamido)benzyl
[0095]6‑
amino
‑2‑
butoxy
‑9‑
((1
‑
cyclooctyl
‑
1h
‑
1,2,3
‑
triazol
‑4‑
yl)methyl)
‑8‑
oxo
‑
8,9
‑
dihydro
‑
7h
‑
purine
‑7‑
carboxylate
[0096]
[0097]4‑
(17
‑
azido
‑5‑
isopropyl
‑
4,7
‑
dioxo
‑2‑
(3
‑
ureidopropyl)
‑
9,12,15
‑
trioxa
‑
3,6
‑
diazaheptadecanamido)benzyl
[0098]6‑
amino
‑2‑
butoxy
‑9‑
((1
‑
(1
‑
((2
‑
((2
‑
(dimethylamino)ethyl)(methyl)amino)
‑4‑
methoxy
‑5‑
((4
‑
(1
‑
methyl
‑
1h
‑
indol
‑3‑
yl)pyrimidin
‑2‑
yl)amino)phenyl)amino)
‑1‑
thioxo
‑
5,8,11
‑
trioxa
‑2‑
azatridecan
‑
13
‑
yl)
‑
1h
‑
1,2,3
‑
triazol
‑4‑
yl)methyl)
‑8‑
oxo
‑
8,9
‑
dihydro
‑
7h
‑
purine
‑7‑
carboxylate
[0099][0100]4‑
((2s,5s)
‑
17
‑
azido
‑5‑
isopropyl
‑
4,7
‑
dioxo
‑2‑
(3
‑
ureidopropyl)
‑
9,12,15
‑
trioxa
‑
3,6
‑
diazaheptadecanamido)benzyl
[0101]
(2
‑
(2
‑
(2
‑
(2
‑
(4
‑
((6
‑
amino
‑2‑
butoxy
‑8‑
hydroxy
‑
9h
‑
purin
‑9‑
yl)methyl)
‑
1h
‑
1,2,3
‑
triazol
‑1‑
yl)ethoxy)ethoxy)ethoxy)ethyl)carbamate
[0102][0103]
(s)
‑
n
‑
(4
‑
((6
‑
amino
‑2‑
butoxy
‑8‑
oxo
‑9‑
(prop
‑2‑
yn
‑1‑
yl)
‑
8,9
‑
dihydro
‑
7h
‑
purin
‑7‑
yl)methyl)phenyl)
‑2‑
((s)
‑2‑
isopropyl
‑
14
‑
isothiocyanato
‑4‑
oxo
‑
6,9,12
‑
trioxa
‑3‑
azatetradecanamido)
‑5‑
ureidopentanamide
[0104][0105]
n2
‑
(4
‑
(((s)
‑1‑
(((s)
‑1‑
((4
‑
((6
‑
amino
‑2‑
butoxy
‑8‑
hydroxy
‑
9h
‑
purin
‑9‑
yl)
methyl)phenyl)amino)
‑1‑
oxo
‑5‑
ureidopentan
‑2‑
yl)amino)
‑3‑
methyl
‑1‑
oxobutan
‑2‑
yl)amino)
‑4‑
oxobutanoyl)
‑
n6
‑
diazolysine
[0106][0107]
n1
‑
(2
‑
(2
‑
(2
‑
(2
‑
(4
‑
(((2
‑
((2
‑
acrylamido
‑5‑
methoxy
‑4‑
((4
‑
(1
‑
methyl
‑
1h
‑
indol
‑3‑
yl)pyrimidin
‑2‑
yl)amino)phenyl)(methyl)amino)ethyl)(methyl)amino)methyl)
‑
1h
‑
1,2,3
‑
triazol
‑1‑
yl)ethoxy)ethoxy)ethoxy)ethyl)
‑2‑
(14
‑
(4
‑
((6
‑
amino
‑8‑
hydroxy
‑2‑
(2
‑
methoxyethoxy)
‑
9h
‑
purin
‑9‑
yl)methyl)phenyl)
‑7‑
(4
‑
azidobutyl)
‑
6,9,12
‑
trioxo
‑2‑
thia
‑
5,8,13
‑
triazatetradecyl)
‑
n4
‑
(2
‑
(2,6
‑
dioxopiperidin
‑3‑
yl)
‑1‑
oxoisoindolin
‑4‑
yl)succinamide
[0108][0109]
n1
‑
(2
‑
(2
‑
(2
‑
(2
‑
(4
‑
(((2
‑
((2
‑
acrylamido
‑5‑
methoxy
‑4‑
((4
‑
(1
‑
methyl
‑
1h
‑
indol
‑3‑
yl)pyrimidin
‑2‑
yl)amino)phenyl)(methyl)amino)ethyl)(methyl)amino)methyl)
‑
1h
‑
1,2,3
‑
triazol
‑1‑
yl)ethoxy)ethoxy)ethoxy)ethyl)
‑2‑
((14s,17s)
‑
22
‑
amino
‑
17
‑
((4
‑
((6
‑
amino
‑2‑
butoxy
‑8‑
hydroxy
‑
9h
‑
purin
‑9‑
yl)methyl)phenyl)carbamoyl)
‑7‑
(4
‑
azidobutyl)
‑
14
‑
isopropyl
‑
6,9,12,15,22
‑
pentaoxo
‑2‑
thia
‑
5,8,13,16,21
‑
pentaazadocosyl)
‑
n4
‑
(2
‑
(2,6
‑
dioxopiperidin
‑3‑
yl)
‑1‑
oxoisoindolin
‑4‑
yl)succinamide。
[0110]
本发明实施例还提供了一系列用于合成上述偶联链具体化合物的中间体化合物,
它们分别为化合物18
‑
2、化合物5a、化合物102
‑
3、化合物vc
‑
an4、化合物val5、化合物val6、化合物vc100、化合物vcb
‑
2、化合物poma
‑
ico3n3、化合物s
‑
poma
‑
ico3n3、化合物bi
‑
linker、化合物bvc
‑
t
‑
2、化合物ho
‑
vc
‑
t、化合物n3
‑
vc
‑
t、化合物ma
‑
vc
‑
t、svc
‑
t中的至少一种,结构式分别如下:
[0111][0112]4‑
((s)
‑2‑
((s)
‑2‑
amino
‑3‑
methylbutanamido)
‑5‑
ureidopentanamido)benzyl
[0113]6‑
amino
‑2‑
butoxy
‑8‑
oxo
‑9‑
(prop
‑2‑
yn
‑1‑
yl)
‑
8,9
‑
dihydro
‑
7h
‑
purine
‑7‑
carboxylate
[0114][0115]4‑
(17
‑
azido
‑5‑
isopropyl
‑
4,7
‑
dioxo
‑2‑
(3
‑
ureidopropyl)
‑
9,12,15
‑
trioxa
‑
3,6
‑
diazaheptadecanamido)benzyl(4
‑
nitrophenyl)carbonate
[0116][0117]6‑
amino
‑9‑
((1
‑
(2
‑
(2
‑
(2
‑
(2
‑
aminoethoxy)ethoxy)ethoxy)ethyl)
‑
1h
‑
1,2,3
‑
triazol
‑4‑
yl)methyl)
‑2‑
butoxy
‑
n
‑
methyl
‑8‑
oxo
‑
n
‑
propyl
‑
8,9
‑
dihydro
‑
7h
‑
purine
‑7‑
carboxamide
[0118][0119]
(9h
‑
fluoren
‑9‑
yl)methyl((s)
‑1‑
(((s)
‑1‑
((4
‑
((6
‑
amino
‑2‑
butoxy
‑8‑
oxo
‑9‑
(prop
‑2‑
yn
‑1‑
yl)
‑
8,9
‑
dihydro
‑
7h
‑
purine
‑7‑
carboxamido)methyl)phenyl)amino)
‑1‑
oxo
‑5‑
ureidopentan
‑2‑
yl)amino)
‑3‑
methyl
‑1‑
oxobutan
‑2‑
yl)carbamate
[0120][0121]
(s)
‑
n
‑
(4
‑
(aminomethyl)phenyl)
‑2‑
((s)
‑
14
‑
azido
‑2‑
isopropyl
‑4‑
oxo
‑
6,9,12
‑
trioxa
‑3‑
azatetradecanamido)
‑5‑
ureidopentanamide
[0122][0123]4‑
nitrophenyl(4
‑
((2s,5s)
‑
17
‑
azido
‑5‑
isopropyl
‑
4,7
‑
dioxo
‑2‑
(3
‑
ureidopropyl)
‑
9,12,15
‑
trioxa
‑
3,6
‑
diazaheptadecanamido)benzyl)carbamate
[0124][0125]
(s)
‑2‑
amino
‑
n
‑
((s)
‑1‑
(6
‑
amino
‑2‑
butoxy
‑8‑
oxo
‑9‑
(prop
‑2‑
yn
‑1‑
yl)
‑
8,9
‑
dihydro
‑
7h
‑
purin
‑7‑
yl)
‑1‑
oxo
‑5‑
ureidopentan
‑2‑
yl)
‑3‑
methylbutanamide
[0126][0127]
(s)
‑2‑
amino
‑
n
‑
((s)
‑1‑
(6
‑
amino
‑2‑
butoxy
‑8‑
oxo
‑9‑
(prop
‑2‑
yn
‑1‑
yl)
‑
8,9
‑
dihydro
‑
7h
‑
purin
‑7‑
yl)
‑1‑
oxo
‑5‑
ureidopentan
‑2‑
yl)
‑3‑
methylbutanamide
[0128][0129]
n1
‑
(2
‑
(2
‑
(2
‑
(2
‑
azidoethoxy)ethoxy)ethoxy)ethyl)
‑
n4
‑
(2
‑
(2,6
‑
dioxopiperidin
‑3‑
yl)
‑1‑
oxoisoindolin
‑4‑
yl)
‑2‑
methylenesuccinamide
[0130][0131]2‑
(((2
‑
aminoethyl)thio)methyl)
‑
n1
‑
(2
‑
(2
‑
(2
‑
(2
‑
azidoethoxy)ethoxy)ethoxy)ethyl)
‑
n4
‑
(2
‑
(2,6
‑
dioxopiperidin
‑3‑
yl)
‑1‑
oxoisoindolin
‑4‑
yl)succinamide
[0132][0133]
n1
‑
(2
‑
(2
‑
(2
‑
(2
‑
(4
‑
(((2
‑
((2
‑
acrylamido
‑5‑
methoxy
‑4‑
((4
‑
(1
‑
methyl
‑
1h
‑
indol
‑3‑
yl)pyrimidin
‑2‑
yl)amino)phenyl)(methyl)amino)ethyl)(methyl)amino)methyl)
‑
1h
‑
1,2,3
‑
triazol
‑1‑
yl)ethoxy)ethoxy)ethoxy)ethyl)
‑2‑
(((2
‑
aminoethyl)
thio)methyl)
‑
n4
‑
(2
‑
(2,6
‑
dioxopiperidin
‑3‑
yl)
‑1‑
oxoisoindolin
‑4‑
yl)succinamide
[0134][0135]
(s)
‑
n
‑
(4
‑
((6
‑
amino
‑2‑
butoxy
‑8‑
hydroxy
‑
9h
‑
purin
‑9‑
yl)methyl)phenyl)
‑2‑
((s)
‑2‑
amino
‑3‑
methylbutanamido)
‑5‑
ureidopentanamide
[0136][0137]4‑
(((s)
‑1‑
(((s)
‑1‑
((4
‑
((6
‑
amino
‑2‑
butoxy
‑8‑
hydroxy
‑
9h
‑
purin
‑9‑
yl)methyl)phenyl)amino)
‑1‑
oxo
‑5‑
ureidopentan
‑2‑
yl)amino)
‑3‑
methyl
‑1‑
oxobutan
‑2‑
yl)amino)
‑4‑
oxobutanoic acid
[0138][0139]
(s)
‑
n
‑
(4
‑
((6
‑
amino
‑2‑
butoxy
‑8‑
hydroxy
‑
9h
‑
purin
‑9‑
yl)methyl)phenyl)
‑2‑
((s)
‑
14
‑
azido
‑2‑
isopropyl
‑4‑
oxo
‑
6,9,12
‑
trioxa
‑3‑
azatetradecanamido)
‑5‑
ureidopentanamide
[0140][0141]
n
‑
((s)
‑1‑
(((s)
‑1‑
((4
‑
((6
‑
amino
‑2‑
butoxy
‑8‑
hydroxy
‑
9h
‑
purin
‑9‑
yl)methyl)phenyl)amino)
‑1‑
oxo
‑5‑
ureidopentan
‑2‑
yl)amino)
‑3‑
methyl
‑1‑
oxobutan
‑2‑
yl)
‑6‑
(2,5
‑
dioxo
‑
2,5
‑
dihydro
‑
1h
‑
pyrrol
‑1‑
yl)hexanamide
[0142][0143]
(s)
‑
n
‑
(4
‑
((6
‑
amino
‑2‑
butoxy
‑8‑
hydroxy
‑
9h
‑
purin
‑9‑
yl)methyl)phenyl)
‑2‑
((s)
‑2‑
isopropyl
‑
14
‑
isothiocyanato
‑4‑
oxo
‑
6,9,12
‑
trioxa
‑3‑
azatetradecanamido)
‑5‑
ureidopentanamide。
[0144]
免疫激活剂:
[0145]
本发明实施例提供的免疫激活剂可以为本领域常规的免疫激活剂,包括但不限于tlr7激动剂、tlr8激动剂、sting激动剂、小分子免疫激活剂中的至少一种。在一些实施例中,小分子免疫激活剂包括化合物1、化合物2、化合物3、化合物4中的至少一种,结构式分别如下:
[0146][0147]
抗体:
[0148]
本发明实施例提供的抗体可以是任意靶向致病原的抗体,该致病原即抗原。在一些实施例中,抗原选自her2、her3、pd
‑
l1、pd
‑
1、tigit、trop2、egfr、muc1、liv
‑
1、muc16、ceacam1及其各亚型、urlc10、ny
‑
eso
‑
1、gaa、ofa、cyclin b1、wt
‑
1、cef、vegfr1、vegfr2、ttk、muc1、hpv 16e7、cea、ima910、koc1、sl
‑
701、mart
‑
1、gp100、tyrosinase、gsk2302050a、survivin、mage
‑
3.1、mage
‑
10.a2、gp209
‑
2m、melan
‑
a、na17.a2、koc1、co16、depdc1、mphosph1、mage12、ont
‑
10、gd2l、gd3l、gsk2302032a、urlc10、cdca1、rspsma、psa、muc
‑
2、tert、hpv16、hpv18、stf
‑
ii、g17dt、ict
‑
107、dex2、htert、pap、lrrc15、msln、ly6k、cd56、ptk7、folr1、dll3、cd3、btk、gpc3、epcam、cecam5、cmet、gpa33、alk、ros1、braf、mek、ret、cdk4/6、brca、parp、brca、flt3、cd19、cd20、bcl2、cd38、smoothened、gd2、ezh2、mth1、kras、c
‑
myc、hca ix、hca xii、brd4、hdac、nyc、topk、bcma、pi3k、pdgfr、tim3、ox40、cd47、sirp
‑
ɑ
、cd40、cd122、cd160、tgf
‑
β、hif
‑1ɑ
/2
ɑ
、psgl
‑
1、frizzled
‑
7、slc4a7、ccr2、ccr4、ccr5、cxcr4、cxcr5、ccl12、cxcl1、cxcl8、cxcl10、cd30、cd33、cd22、cd79b、nectin
‑
4、cd45、cd117、psma、nkg2d、claudin18.2、mg7、ror1、ror2、fgfr、fgfr2、fgfr4、wnt2a、wnt3a、wnt5a、wnt9b、wnt7b、hgf、lilrb1、caf、ang2、arg1、csf1r、tie2、rxrβ、asgpr1、bcl2、hpk1、enpp1、sb9、klrg1、b7
‑
h3、ifi27、reg4、cd161、st2、ripk1、claudin
‑
6中的至少一种。这些致病原的抗体通过靶向这些致病原,可以将免疫激活型抗体中的免疫激活剂引导到相应的靶向位点,达到局部靶向激活免疫的作用。
[0149]
免疫激活型抗体:
[0150]
根据偶联链的变化,可得到一系列不同结构的免疫激活型抗体的通式,包括如式
(i)所示偶联物式(i
‑
1)所示偶联物式(i
‑
2)所示偶联物式(i
‑
3)所示偶联物式(i
‑
4)所示偶联物式(ii)所示偶联物
式(ii
‑
1)所示偶联物式(ii
‑
2)所示偶联物式(ii
‑
3)所示偶联物式(ii
‑
4)所示偶联物式(iii)所示偶联物
式(iii
‑
1)所示偶联物式(iii
‑
2)所示偶联物式(iii
‑
3)所示偶联物式(iii
‑
4)所示偶联物式(iv)所示偶联物式(iv
‑
1)所示偶联物
式(iv
‑
2)所示偶联物式(iv
‑
3)所示偶联物式(iv
‑
4)所示偶联物中的至少一种,且n大于0。
[0151]
以下列举一些较为典型的免疫激活型抗体,包括化合物15、化合物15
‑
1、化合物15
‑
2、化合物17、化合物21、化合物22、化合物22
‑
2、化合物24、化合物24
‑
2、化合物15
‑
3、化合物15
‑
4、化合物15
‑
5、化合物24
‑
3、化合物28、化合物29、化合物30、化合物30
‑
1、化合物31、化合物32、化合物33、化合物34、化合物35、化合物36、化合物37中的至少一种,结构式分别如下:
[0152]
[0153]
[0154]
[0155]
[0156]
[0157]
[0158][0159]
本发明实施例提供的上述偶联链、小分子免疫激动剂及相应免疫激活型抗体的合成方法具体如下:
[0160]
化合物1的合成方法,包括如下步骤:
[0161]
将2.37克的化合物pro
‑
1与1.2克的化合物溴丙腈,溶解在50ml的乙腈中,加入1.5克的k2co3,于室温搅拌12小时。过滤,加入2ml的三甲基碘硅烷,于室温搅拌10小时。加入5ml饱和nahco3溶液,减压蒸馏除去溶剂,硅胶柱层析分离(甲醇:二氯甲烷=1:10体积比),收集产品溶液,减压浓缩除去溶解,得固体产品即为化合物1。
[0162][0163]
化合物2和化合物3的合成方法与化合物1的合成方法基本相同,不同之处在于合成化合物2时,将化合物pro
‑
1替换为化合物9;合成化合物2时,将化合物pro
‑
1替换为化合物10。其中,化合物9的结构式为化合物10的结构式为
[0164]
以her2抗体为例的式iii的代表性化合物15的合成:
edc,120μl的dipea,室温反应过夜,lc
‑
ms监测反应。反应结束后,经hplc纯化,得白色固体化合物14(119mg),产率为47.7%。esi
‑
ms:m/z=956.5[m h] 。
[0170]
将化合物14(100mg)加入tfa/dcm(1:3)(2ml),室温搅拌8小时。减压真空除去溶剂至干燥固体;溶解在5ml的dmso中,加入硫二咪唑(181mg),300μl的三乙胺。室温反应12小时。反应液冷冻干燥得粗品,hplc纯化得化合物7(44mg,47%)。esi
‑
ms:m/z=898.4[m h] 。
[0171][0172]
取her2抗体(去糖基化分子量:145531)100mg,化合物7(12mg),三乙胺(5μl),溶解在dmso和纯水(1:10体积)的溶剂中,于10℃震荡反应10小时,用10k的滤膜过滤。洗脱得到偶联抗体化合物15;质谱测得dar(药物/抗体,比值)值为5.98。
[0173]
参考化合物15的合成,用化合物1替换化合物4可得化合物7
‑
2:
[0174][0175]
参考化合物15的偶联合成,将化合物7用化合物7
‑
1取代可得类似物化合物15
‑
1:
[0176][0177]
进一步用化合物7
‑
3偶联her2抗体可得化合物15类似物化合物15
‑
2:
[0178][0179]
化合物7
‑
3的合成路线如下:
[0180][0181]
将bncooh用丁二酸酐置换,和化合物vc100反应,可直接得到化合物6
‑
3:
[0182][0183]
化合物5
‑
1的合成步骤如下:
[0184][0185]
将1微摩尔的化合物val1和等当量的化合物16溶解在3ml的dmso中,室温搅拌8小时后,冷冻干燥除去dmso,加入1ml的tfa/dcm(1:3体积),室温震荡反应2小时,真空减压抽干溶解,残余物hplc纯化,得化合物mm
‑
vc。
[0186]
将300mg的化合物mm
‑
vc与等当量的hobt,edc,dipea混合溶解在2ml的dmso中,室温震荡器反应2h。加入142mg的化合物bnma,继续反应过夜。反应混合物冷冻干燥,加入1ml的tfa/dcm(1:3体积)室温震荡反应2小时,真空减压抽干溶解,残余物hplc纯化,得化合物mm
‑
vca
‑
nh2,238mg,收率65%,质谱:esi
‑
ms:m/z=572.5[m h]
。
[0187]
另将1微摩尔化合物1与等当量的化合物4a溶解在2ml的dmso中,加入等当量的tea,室温搅拌反应12小时,40℃反应1小时。冷冻干燥得化合物4a
‑
1粗品;粗品溶解在干燥的dmso中加入等当量的mm
‑
vca
‑
nh2,室温搅拌12h,hplc纯化得化合物5
‑
1,收率43%,esi
‑
ms:m/z=860.4[m h]
。
[0188]
化合物6
‑
1的合成:
[0189][0190]
将500mg的化合物fvc
‑
1和等摩尔的混合缩合剂(hobt,edc,dipea)溶解在20倍重量的dmso中,于室温搅拌2小时,加入等当量的化合物bnma,继续室温反应过夜。将反应混合液直接冷冻干燥,残余物溶解在甲醇,用hplc纯化,得化合物fvc
‑
2纯品453mg,75%,esi
‑
ms:m/z=601.4[m h] 。
[0191]
将200mg化合物4与等摩尔的化合物4a,混合于2ml的dmso,加入2等当量的tea,室温震荡8小时,加入等当量的化合物fvc
‑
2,于室温继续反应过夜,再加入4倍当量的
piperidine,室温震荡反应6小时。混合物冷冻干燥。加入甲醇溶解,hplc纯化得化合物vc
‑
an4,收率28%,esi
‑
ms:m/z=666.30[m h]
。
[0192]
取100mg的化合物vc
‑
an4,溶解在2ml的dmso中,加入等当量的tea,继续加入等当量的succinic anhydride,于40℃震荡反应过夜。混合物冷冻干燥,加入2ml的水/甲醇(1:1),用醋酸调节ph5,直接用hplc纯化,得化合物6
‑
1,94mg(收率82%),esi
‑
ms:m/z=766.62[m h]
。
[0193]
式i的代表性化合物17的合成:
[0194][0195]
将化合物12
‑
2(100mg)直接加入到10ml的tfa/dcm(1:3)中,室温搅拌8小时,减压蒸除溶剂,真空抽干;溶解在5ml的dmso中,加入30μl的三乙胺、化合物16(45mg)。混合物室温搅拌反应10小时。hplc纯化得化合物5(93mg)。esi
‑
ms:m/z=861.4[m h] 。
[0196]
取hs
‑
还原型her2抗体100mg,化合物5(12mg),三乙胺(5μl),溶解在5ml的纯水中,于10℃震荡反应10小时,用10k的滤膜过滤。洗脱得到偶联抗体化合物17;质谱测得dar(药物/抗体,比值)值为4。
[0197]
hs
‑
还原型her2抗体的制备:将her2抗体用透析法透析除去各种添加物,溶解在dpbs中(15mg/ml),用浓度为5mm的edta溶液调节ph 7.0。加入5当量的tcep溶液(用5mm浓度的tcep水溶液)于室温还原2小时。10kd滤膜除去小分子,纯水洗脱抗体,真空冷冻干燥得还
原型抗体。
[0198]
抗体17
‑
1的合成:
[0199][0200]
将15倍当量的5
‑2‑
2(10mg)和0.1ml的tea溶解在0.2ml的dmso中,加入到100mg的hs
‑
还原型曲妥珠单抗的dpbs(5ml)溶液中。混合液于20oc震荡反应10小时。用20k的滤膜超滤除去小分子,敞口容器室温搅拌6小时,得到her2抗体偶联5
‑2‑
2的新抗体17
‑
1;质谱测得偶联比(adr值)为2。
[0201]
hs
‑
还原型曲妥珠单抗的制备:按照hs
‑
还原型her2的制备方法即得。
[0202]
其中,trastuzumab曲妥珠单抗的蛋白序列(who drug information vol.24,no.2,2010),请参见图14所示,trastuzumab曲妥珠单抗的蛋白序列如seq id no:1和seq id no:2。
[0203]
化合物8的合成:
[0204][0205]
将化合物12
‑
2(100mg)直接加入到10ml的tfa/dcm(1:3)中,室温搅拌8小时,减压蒸除溶剂,真空抽干后,溶解在5ml的dmso中,加入30μl的三乙胺。将化合物19(30mg),hobt(27mg),edc(39mg),dipea(68μl),室温反应过夜。lc
‑
ms监测反应。反应结束后,经hplc纯化,得白色固体化合物8(63.6mg,产率为55.7%)。esi
‑
ms:m/z=883.3[m h] 。
[0206]
式iv的代表性化合物22的合成:
[0207][0208]
将dbco
‑
acid的活化酯20(20eq)与her2抗体(1eq)在含10%的dmso纯水中混合,于10℃震荡反应12小时。质谱检测至her2抗体反应完全。反应混合物用10kd的分子滤膜除去小分子,用dpbs溶液洗脱偶联物化合物21(测得偶联度6)。将化合物21的dpbs溶液中加入10%体积的dmso,加入1.5当量的化合物8,于25℃震荡反应12小时,用20kd的分子滤膜除去小分子。dpbs溶解抗体得偶联抗体化合物22的dpbs溶液。质谱测得化合物22的平均偶联度为6。
[0209]
化合物22
‑
2的合成:
[0210][0211]
将等当量的化合物vcb
‑
1与化合物gy100混合溶解在dmf中,加入2当量的k2co3,与室温反应过夜。加水10倍水,搅拌均匀后,得沉淀物。将沉淀物用1:10的甲醇/dcm硅胶层析分离,得纯品化合物vcb
‑
2,esi
‑
ms:m/z=723.7[m h] 。化合物vcb
‑
2经过脱去boc保护,再与叠氮基羧酸进行常规缩合酰胺化反应,产物用hplc纯化得化合物7
‑
5,esi
‑
ms:m/z=838.4[m h]
。与偶联物化合物21进行click偶联反应,分子滤膜纯化得化合物22
‑
2,质谱测得dar=6。
[0212]
按照合成7
‑
5类似方法,可合成得到化合物vcb
‑
4:
[0213][0214]
将vcb
‑
2(300mg)与10ml的tfa/dcm(1/3体积)混合,室温搅拌12小时,减压蒸馏除去溶剂,残余中加入乙酸乙酯20ml、0.2ml的tea,混合均匀后,用水10ml洗乙酸乙酯1次。有机层用无水na2so4干燥。滤除干燥剂,减压蒸出乙酸乙酯,得vcb
‑
3(210mg,收率81%),esi
‑
ms:m/z=623.3[m h] 。
[0215]
取200mg的vcb
‑
3,溶解在5ml的dmso中,加入100mg的bn
‑
peg
‑
oh,等当量的edc,dipea。室温搅拌过夜;反应液直接冷冻干燥,加入10ml的tfa/dcm(1/3体积)混合搅拌12小时。减压蒸馏除去溶剂,残余中加入乙酸乙酯20ml、0.2ml的tea,混合均匀后,用水10ml洗乙酸乙酯1次。减压蒸除乙酸乙酯,残余物hplc纯化得nh2
‑
vcb
‑
3(124mg,收率47%),si
‑
ms:m/z=812.4[m h] 。
[0216]
取100mg的nh2
‑
vcb
‑
3,溶解在3ml的dmso中,加入33mg的dims,1001μl的tea,室温反应至完成(ms质谱监测)。冷冻干燥,残余物用hplc分离纯化,得vcb
‑
4(51mg,收率49%),esi
‑
ms:m/z=854.4[m h] 。
[0217]
化合物5
‑2‑
1的合成:
[0218][0219]
将benzo
‑
acid(150mg)溶解在5ml的thf中,加入nhs(106mg),edc.hcl(211.5mg)室温搅拌反应3小时。将nh2
‑
peg3
‑
n3(200mg)和dipea(192μl)混合溶解在5ml的thf溶剂中缓慢滴加入上述反应液中,形成的混合反应在室温继续搅拌10小。减压蒸馏除去溶剂,残余物hplc分离纯化得benzo
‑
peg3
‑
n3(210mg,收率63%);esi
‑
ms:m/z=364.1[m h] 。
[0220]
取benzo
‑
peg3
‑
n3(100mg)和nh2
‑
vcb
‑
3(224mg)混合溶解在7ml的dmso中,加入2ml纯水,10mg硫酸铜和10mg的l
‑
抗坏血酸钠,形成的混合物室温搅拌12小时。反应物过滤,滤液冷冻干燥,冻干物加入少许dmf溶解,hplc分离纯化得nh2
‑
vcb
‑
209(175mg,收率54%);esi
‑
ms:m/z=1175.5[m h] 。
[0221]
将m
‑
nhs(25mg)溶解在1ml的dmso中;取nh2
‑
vcb
‑
209(110mg)和dipea(16μl)溶解在2ml的dmso中,缓慢滴加在m
‑
nhs溶液中。形成的反应混合物室温搅拌反应10小时。反应物冷冻干燥,冻干物加入少许dmf溶解,hplc分离纯化得5
‑2‑
1(82mg,收率66%);esi
‑
ms:m/z=664.2[(m/2) h] 。
[0222]
化合物gy209的合成:
[0223][0224]
将化合物benzo
‑
peg3
‑
n3(100mg)和gy100(72mg)溶解在dmso
‑
去离子水(3:1体积比,4ml)中,加入无水硫酸铜(10mg)、l
‑
抗坏血酸钠(12mg);形成的混合溶液于室温搅拌过夜。过滤得清液,滤液冷冻干燥,冻干物加入少许甲醇溶解,用hplc分离纯化得gy209(58mg,收率34%);esi
‑
ms:m/z=625.2[m h] 。
[0225]
化合物5
‑2‑
2的合成:
[0226][0227]
将szu
‑
128(100mg)溶解在5ml的dmf中,加入boc
‑
benz
‑
br(55mg)、30mg的k2co3;形成的混合物室温搅拌反应12小时。反应液过滤,滤液冷冻干燥,冻干物hplc分离纯化的nbz
‑
128(90mg,收率75%);esi
‑
ms:m/z=632.3[m h] 。
[0228]
将v
‑
ala(32mg)、nhs(13mg)、edc.hcl(22mg)混合溶解在1ml的thf中,混合液室温震荡反应6小时。取nbz
‑
128(70mg)溶解在1ml的dmso中,缓慢滴加在上述混合液中,加完后继续室温震荡反应1小时,加入dipea(20μl);继续室温震荡反应6小时。然后加入0.5ml的tfa,室温继续反应3小时。反应液直接用hplc分离纯化的n
‑
va
‑
128(72mg,收率81%);esi
‑
ms:m/z=802.3[m h] 。
[0229]
将m
‑
peg3
‑
nhs(35mg)溶解在1ml的无水dmso中;取n
‑
va
‑
128(60mg)和dipea(13μl)溶解在2ml的无水dmso,缓慢滴加入m
‑
peg3
‑
nhs溶液中,加完后室温震荡反应10小时。反应液冷冻干燥,冻干物溶解在少量甲醇中,用hplc分离纯化得5
‑2‑
2(61mg,收率71%);esi
‑
ms:m/z=1156.6[m h] 。
[0230]
化合物6的合成:
[0231][0232]
将化合物12(200mg)直接加入到10ml的tfa/dcm(1:3)中,室温搅拌8小时,减压蒸除溶剂,真空抽干;干燥固体溶解在水中,加入40μl的三乙胺,hplc纯化得化合物18
‑
2类白色固体120mg(收率69%),esi
‑
ms:m/z=667.3[m h] 。
[0233]
将化合物18
‑
2溶解在dmso中,加入等当量的tea,加入等当量的丁二酸酐,室温混合搅拌6小时。混合液冷冻干燥得固体,加入适量水溶解,醋酸调节ph值5,析出产品,过滤,干燥得化合物6。esi
‑
ms:m/z=767.3[m h] 。
[0234]
以化合物8为代表的偶联链中,免疫激活剂可以替换为其它tlr7激动剂,如多功能的gy159(大环脂可以提高细胞膜穿透性)、gy127(免疫激活的抗癌效果)等,可以制备多功能抗体化合物24、化合物24
‑
2等:
[0235][0236]
将200mg化合物19,358mg化合物2a,176mg hobt,254mg edc,450μl的dipea溶于5ml dmso中,室温反应过夜,lc
‑
ms监测反应。反应结束后,经hplc纯化,得白色固体(化合物3a)210mg,产率为41.2%。esi
‑
ms:m/z=594.3[m h] 。
[0237][0238]
将200mg化合物3a,113mg化合物4a,180μl的dipea溶于2ml dmso中,室温反应过夜,lc
‑
ms监测反应。反应结束后,经hplc纯化,得白色固体(化合物5a)65mg,产率为25.4%。esi
‑
ms:m/z=759.3[m h] 。
[0239][0240]
将30mg化合物5a,18mg化合物gy159,21μl的dipea溶于1ml dmso中,室温反应过夜,lc
‑
ms监测反应。反应结束后,经hplc纯化,得白色固体(化合物gy206)8mg,产率为19.5%。esi
‑
ms:m/z=1035.5[m h] 。
[0241][0242]
将30mg化合物5a,42mg化合物gy127,21μl的dipea溶于1ml dmso中,室温反应过夜,lc
‑
ms监测反应。反应结束后,经hplc纯化,得黄色固体(化合物gy207)11mg,产率为17.7%。esi
‑
ms:m/z=1586.7[m h] 。
[0243]
参考her2偶联体化合物22,由化合物gy207与化合物21可以制备免疫激活型抗体化合物24如下式:
[0244][0245]
化合物gy127本身具有tlr7激活作用和抑制肿瘤细胞作用。多功能抗体化合物24在抗体的特异性靶向引导下,在肿瘤微环境和肿瘤细胞释放化合物gy127,达到局部免疫激活和强化的抗肿瘤效果。
[0246]
同样的方法,将化合物22中的抗体替换为c
‑
met抗体(abcam,ab51067),化合物1替换为化合物gy102,可得类似物化合物24
‑
2:
[0247][0248]
参考化合物15的合成方法,将激动剂部分替换为化合物gy102,可以得到化合物15
‑
4:
[0249][0250]
将抗体替换为asgpr1抗体,免疫激动剂替换为化合物gy102
‑
3,可以得到化合物15
‑
3:
[0251][0252]
在化合物15
‑
3中,asgpr1是去唾液酸糖蛋白受体,特异性的表达在肝组织;小分子免疫激动剂前体化合物102
‑
3在肝脏代谢出化合物102,因此化合物15
‑
3是特异性的肝脏靶向免疫激活型抗体,其中的小分子免疫激动剂化合物102
‑
3合成方法如下:
[0253][0254]
将480mg的化合物gy102溶解在dmso中加入140μl的三乙胺,于5
‑
10℃下,缓慢滴加等当量的氯甲酸叔丁酯;自然室温反应4小时,反应混合物直接冷冻干燥得固体,固体加入5℃的水搅拌溶解去掉盐,过滤得化合物102
‑
1,真空干燥。干燥物溶解在dmso中,加入140μl的三乙胺,于5
‑
10℃下,缓慢滴加等当量的化合物ac
‑
1,自然室温搅拌过夜。反应液直接冷冻干燥得固体,固体加入5℃的水搅拌溶解去掉盐,过滤得化合物102
‑
2,加入1ml的tfa和3ml的dcm,室温搅拌4小时,减压真空蒸馏除去溶剂,残余物加入水,hplc纯化,得化合物102
‑
3(121mg,收率21%),esi
‑
ms:m/z=579.3[m h] 。
[0255]
将化合物15
‑
4中的抗体置换为cd206抗体(abcam,ab64693),可得化合物15
‑
5:
[0256][0257]
同样的方法,将化合物22中的抗体替换为pd
‑
1抗体,化合物8替换为化合物gy206,可得类似物化合物24
‑
3:
[0258][0259]
式ii的偶联抗体代表性化合物28的合成:
[0260][0261]
将化合物26和化合物gy102等当量溶解在dmso中,混合溶液室温搅拌,质谱检测原料反应基本完全。反应液冷冻干燥,干燥固体加入适量tfa/dcm(1:3)中溶解,室温搅拌4小时。减压蒸馏除去tfa,hplc分离纯化,得化合物27,esi
‑
ms:m/z=985.4[m h] 。
[0262]
将100mg的化合物27和等当量的nhs(n
‑
羟基丁二酰亚胺)溶解在1ml无水dmso中,加入等当量的edc,混合物于15℃密闭搅拌反应6小时;将738mg的her2抗体溶解在10ml的纯水中,缓慢加入到反应液中,加完后,继续室温密闭反应10小时,加入乙醇胺(6μl);反应液用20kd的分子滤膜,dpbs洗脱小分子,dpbs溶解抗体得偶联抗体化合物28的dpbs溶液。质谱测得化合物28的平均偶联度为4。
[0263]
参考化合物17的合成,可以得到偶联抗体化合物29,如下式:
[0264][0265]
将抗体的15倍当量的5
‑2‑
1(12mg)和0.1ml的tea溶解在0.2ml的dmso中,加入到100mg的hs
‑
还原型pd
‑
l1单抗(atezolizumab)的dpbs(5ml)溶液中。混合液于20oc震荡反应10小时。用20k的滤膜超滤除去小分子,敞口容器室温搅拌6小时,得到pd
‑
l1抗体偶联5
‑2‑
1的新抗体29
‑
1;质谱测得偶联比(adr值)为2。
[0266]
hs
‑
还原型pd
‑
l1抗体的制备:按照hs
‑
还原型her2抗体的制备方法即得。
[0267]
其中,atezolizumab(阿替利珠单抗)的蛋白序列(who drug information vol.28,no.4,2014),请参考图15所示,阿替利珠单抗的蛋白序列如seq id no:3和seq id no:4。
[0268]
偶联抗体化合物30合成方法:
[0269][0270]
与合成化合物8
‑
4同样方法,将化合物19替换,可得到化合物8
‑
5、化合物8
‑
6:
[0271]
[0272][0273]
同样方法可得化合物5
‑
2和化合物7
‑
3:
[0274][0275]
与化合物30合成相同的路线方法,可以合成抗体化合物30
‑
1:
[0276][0277]
化合物8
‑
2的合成方法:
[0278][0279]
等当量的化合物val1和化合物1a,在hobt,edc,dipea的dmso中生成化合物val2,用tfa作用后,生成化合物val3,继续和化合物6a在在hobt,edc,dipea的作用下,生成化合物val4,去保护生成化合物val5。化合物val5直接和化合物4a反应生成化合物val6。化合物val6和化合物4,在加热条件下生成化合物8
‑
2。
[0280]
用化合物8
‑
2同样的方法可以合成化合物8
‑
3、化合物8
‑
1:
[0281][0282]
与化合物8
‑
2类似的方法可以实现化合物7
‑
1的合成:
[0283][0284]
将化合物vc
‑
an4(200mg)与化合物13(92mg)混合溶解在2ml的dmso中,加入等当量的缩合试剂(hobt,edc,dipea),混合物室温反应12小时。直接冷冻干燥,hplc纯化得化合物14
‑
1,209mg(73%),esi
‑
ms:m/z=955.4[m h] 。
[0285]
将100mg的化合物14
‑
1加入2ml的tfa/dcm(1:3体积),质谱监测脱去保护基反应完成后,将反应液真空蒸馏除去溶剂,残余物中加入3ml的dmf溶解,加入100μl的tea和20mg的硫二咪唑,室温反应至完成(ms质谱监测)。反应混合物用hplc分离纯化,得化合物7
‑
1(52mg,收率56%),esi
‑
ms:m/z=897.7[m h]
。
[0286]
her2抗体偶联物化合物31的合成:
[0287][0288]
将化合物bva
‑
3与1:3的tfa/dcm混合于室温搅拌反应8小时,减压蒸馏除去溶剂。残余物真空干燥,加入适量dmf溶解,加入2当量的tea混合均匀后,冰水浴10℃下慢慢加入等当量的丁二酸肝(succinic anhydride),继续自然室温搅拌12小时。反应完成后,加入10倍水,调节到ph3,
‑
20℃冷冻析出固体,过滤,水洗得到化合物6
‑
2粗品。hplc纯化得纯品化合物6
‑
2,esi
‑
ms:m/z=532.3[m h] 。
[0289]
将20当量的化合物6
‑
2加入适量的dmso中,于10℃加入等当量的hobt、edc和dipea,混合物搅拌反应2小时。此混合液缓慢加入到含1当量的her2抗体的水溶解中,于室温自然反应12小时。反应液用10k滤膜透析除去小分子,所得大分子抗体用纯水多次洗涤,洗涤液冷冻干燥得偶联抗体化合物31。测得平均偶联度(dar=4)。
[0290]
同样方法,将化合物6
‑
2替换为化合物8
‑
5或者化合物8
‑
6,可得偶联抗体化合物32和化合物33:
[0291][0292]
抗体化合物34的合成路线:
[0293][0294]
将化合物bvc
‑
1和对硝基苯酚等当量溶解在dmso中,加入等当量的edc和dipea,室温搅拌12小时。反应产物加入乙醚冷冻,析出固体过滤得到bvc
‑
2;bvc
‑
2溶解在干燥的dmf中,加入等当量的k2co3,和等当量的化合物gy100,室温搅拌12小时,产物用hplc分离纯化得化合物bvc
‑
3。将化合物bvc
‑
3和化合物pip
‑
3进行click反应,然后tfa脱去保护基,hplc纯化得化合物bvc
‑
4;化合物bvc
‑
4和化合物19在缩合剂作用下,生成化合物bvc
‑
5,与偶联物化合物21click反应,得偶联抗体化合物34:
[0295][0296]
新抗体化合物34的免疫激活剂部分是化合物gy161,其具有强大的抗肿瘤活性,靶向肿瘤的抗体定向释放,将大大加强其抗肿瘤效果。
[0297]
本发明实施例中的免疫激活剂可以替换为多功能的免疫激活小分子,例如同时含有lenalidomide/osimertinb/szu
‑
160的三功能小分子部分(化合物tri
‑
linker
‑
1):
[0298][0299]
化合物tri
‑
linker
‑
1合成:
[0300]
将依康酸酐与化合物no3n3等摩尔混合于干燥的dmso中,加入等摩尔的tea,于40℃搅拌过夜,用hcl中和至ph4,反应混合物直接冷冻干燥,得化合物ico3n3。化合物ico3n3和lenalidomide等当量在dmso中,用缩合剂(hobt/edc)进行缩合反应,然后hplc分离纯化,得化合物poma
‑
ico3n3:esi
‑
ms:m/z=572.20[m h]
。将化合物poma
‑
ico3n3溶解在dmso中,加入等摩尔的巯基乙胺,密闭室温搅拌过夜,反应物直接冷冻干燥得s
‑
poma
‑
ico3n3:esi
‑
ms:m/z=649.20[m h]
。将100mg的化合物s
‑
poma
‑
ico3n3与79mg的化合物kyne
‑
9291混合溶解在1:4的水/dmso混合溶液(0.5ml)中,加入l
‑
抗坏血酸钠和无水硫酸铜各8mg,混合物于室温反应5小时,lc
‑
ms监测反应结束后,直接用hplc纯化出产品得化合物bi
‑
linker,91mg(51%),esi
‑
ms:m/z=1172.50[m h]
。取70mg的化合物bi
‑
linker,溶解在干燥的1ml的dmso中,加入36mg的化合物szu
‑
160,及1.1当量的hobt/edc/dipea,于室温震荡反应过夜。反应混合物直接冷冻干燥,加入少量异丙醇溶解,用hplc纯化,得纯品化合物tri
‑
linker
‑
1,69mg(收率66%),esi
‑
ms:m/z=1752.7[m h]
。
[0301]
抗体化合物35的合成:
[0302][0303]
将偶联物化合物21的dpbs溶液中加入10%体积的dmso,加入1.5当量的化合物化合物tri
‑
linker
‑
1,于25℃震荡反应12小时,用20kd的分子滤膜除去小分子。dpbs溶解抗体得偶联抗体化合物35的dpbs溶液。质谱测得化合物35的平均偶联度为6。
[0304]
参照化合物tri
‑
linker
‑
1的合成技术方法,按照如下合成路线,得到化合物tri
‑
linker
‑
2:
[0305]
[0306][0307]
将化合物bvc
‑
1与等当量化合物szu
‑
163用hobt/edc/dipea(等当量)在干燥的dmso中反应缩合后,用tfa/dcm脱去保护基,hplc纯化得到化合物bvc
‑
t
‑
2。化合物bvc
‑
t
‑
2和化合物41等当量溶解在dmso中,继续用hobt/edc/dipea缩合反应,hplc纯化得化合物bvc
‑
t
‑
3。将取化合物bvc
‑
t
‑
3与6n盐酸室温搅拌过夜,减压蒸馏至干,得白色固体化合物bvc
‑
t
‑
4,真空干燥。
[0308]
将化合物bvc
‑
t
‑
4和化合物bi
‑
linker等摩尔比混合在dmso中,用hobt/edc/dipea缩合剂进行缩合反应,经hplc纯化和lc
‑
ms分子确证得化合物tri
‑
linker
‑
2:esi
‑
ms:m/z=1993.20[m h]
。各中间体质谱鉴定,化合物bvc
‑
t
‑
2:esi
‑
ms:m/z=585.5[m h]
;化合物bvc
‑
t
‑
3:esi
‑
ms:m/z=853.5[m h]
;化合物bvc
‑
t
‑
4:esi
‑
ms:m/z=839.4[m h]
。
[0309]
化合物41合成:
[0310][0311]
将化合物ho
‑
n3溶解在无水thf中,缓慢滴加含等当量的tscl(对甲苯磺酰氯)的thf溶液,室温搅拌30分钟,回流反应2小时。冷至室温,减压蒸馏除去溶剂得化合物ts
‑
n3,油状物。esi
‑
ms:m/z=270.10[m h]
。溶解在二氧六环中备用。
[0312]
将化合物37(5.3g,19mmol)溶于100ml无水二氧六环中,加入叔丁醇钾(2.36g,20.9mmol),在氮气保护下,60℃反应2小时;缓慢滴加化合物ts
‑
n3(5.1g,19mmol)的无水二氧六环(10ml)溶液,滴加完毕后升温至回流,反应20小时;反应液冷却至室温,抽滤,用乙醚洗涤,回收滤液,浓缩后经柱层析分离(石油醚:乙酸乙酯=6:4),得化合物38黄色油状液体3.6g,产率51%。esi
‑
ms:m/z=373.2[m h] 。
[0313]
将化合物38(3g,8mmol)加入2n盐酸酸10ml,加热回流,lc
‑
ms监测反应,反应完全后,减压蒸除溶剂,残余物溶解在饱和na2co3溶液中,缓慢滴加盐酸至析出固体,过滤得白色固体化合物39,0.85g,产率62%。esi
‑
ms:m/z=173[m h] 。
[0314]
取化合物39(0.8g,4.6mmol)混合在无水甲醇(10ml)中,冷却下(5
‑‑
10℃)缓慢滴加3ml的socl2,氮气保护下自然搅拌过夜。减压蒸馏除去溶剂,真空抽干,得化合物40的盐酸盐,收率97%,esi
‑
ms:m/z=187.2[m h] 。
[0315]
将化合物40的盐酸盐(0.5g,2.2mmol)溶解在5ml的dmso中,加入等当量的丁二酸酐和2当量的tea,于60℃搅拌反应4小时,反应物直接冷冻干燥,生成的固体溶解在饱和na2co3溶液中,用盐酸调节ph4,析出固体,过滤,真空干燥得化合物41,0.42g,收率67%。esi
‑
ms:m/z=287.2[m h] 。
[0316]
抗体化合物36的合成、纯化处理与化合物35相同得到抗体化合物36,质谱测得平均偶联度比(dar=6):
[0317][0318]
n3
‑
vc
‑
t合成:
[0319][0320]
将bvc
‑
t
‑
2与n3pegoh等摩尔,混合于dmso中,加入等当量的缩合剂(hobt,edc,dipea/dmso),室温搅拌8小时,反应混合物冷冻干燥,残余物溶解在少量甲醇,用hplc分离纯化,得n3
‑
vc
‑
t,esi
‑
ms:m/z=800.5[m h] 。
[0321]
ma
‑
vc
‑
t合成:
[0322][0323]
合成方法与n3
‑
vc
‑
t合成相同,只是将n3pegoh替换为ma
‑
oh,得ma
‑
vc
‑
t,esi
‑
ms:m/z=778.4[m h] 。
[0324]
ho
‑
vc
‑
t合成:
[0325][0326]
将bvc
‑
t
‑
2与succinic anhydride等摩尔比混合溶解在dmf中,加入2当量的tea,混合物于60℃搅拌反应4小时。反应混合物减压蒸馏(≤60℃)除去dmf,残余物加入饱和na2co3溶解,过滤得清液用醋酸调节ph4,过滤得纯品,esi
‑
ms:m/z=685.4[m h] 。
[0327]
svc
‑
t合成:
[0328][0329]
将bvc
‑
t
‑
2和fpegoh等摩尔量混合溶解在适量的dmso中,加入等当量的缩合剂(hobt,edc,dipea),室温搅拌8小时,继续加入等当量的piperidine,于60℃搅拌反应4小时。反应混合物冷冻干燥,残余物溶解在少量甲醇,用hplc分离纯化,得nvc
‑
t,esi
‑
ms:m/z=774.4[m h] 。
[0330]
将nvc
‑
t与等摩尔量的sc
‑
dimi溶解在干燥的适量的dmso中,加入2当量的tea,室温反应12小时,反应液直接冷冻干燥,hplc纯化得svc
‑
t,esi
‑
ms:m/z=816.3[m h] 。
[0331]
化合物n3
‑
vc
‑
t、ma
‑
vc
‑
t、ho
‑
vc
‑
t、svc
‑
t可以特殊用于抗体或者靶向药偶联,靶向表达tlr7的细胞内,降解tlr7激动剂,达到消除tlr7激动剂对此类细胞的增值作用。例如her2抗体偶联svc
‑
t,即37的合成:
[0332][0333]
将1倍当量的her2抗体的100ml的dpbs溶液中,加入6倍当量的svc
‑
t在5ml的dmso溶液,形成的混合液中加入12倍当量的tea,室温震荡反应12小时。用透析法除去小分子,得37,质谱测得平均偶联度(dar)=4。
[0334]
szu
‑
164的合成:
[0335][0336]
将1克szu
‑
163和0.3克的丁二酸酐(succinic anhydride)溶解在干燥的20ml的dmso中,加入1ml的三乙胺(tea),室温搅拌反应12小时。混合物冷冻干燥除去溶剂,残余加入水溶解,用洗盐酸调节ph=4,析出产品,过滤,干燥得szu
‑
164;1克,收率77%,esi
‑
ms:m/z=429.2[m h] 。
[0337]
本发明实施例提供的上述免疫激活型抗体及相应具有代表性的各化合物,可用于在制备抗肿瘤药物、抗病毒药物、免疫调节药物和/或消除靶点蛋白的制剂。
[0338]
本发明实施例还提供了上述免疫激活型抗体在制备抗肿瘤药物、抗病毒药物、免疫调节药物和/或消除靶点蛋白的制剂中的应用。
[0339]
由于本发明实施例提供免疫激活型抗体具有局部靶向激活免疫的作用,将其用于制备抗肿瘤药物、抗病毒药物、免疫调节药物、和/或消除靶点蛋白制剂中,不仅可以避免非特异性杀伤对正常组织的损伤副作用,而且具有激活目的免疫细胞(如t细胞、b细胞、nk细胞等)、逆转惰性的免疫细胞(如巨噬细胞转为m1型抗肿瘤巨噬细胞,提高m1/m2比例等)、将
免疫细胞转化为具有抗肿瘤活性的免疫细胞(如提高ifn
‑
γ cd8的细胞数量等)等多种作用,应用前景良好。
[0340]
为使本发明上述实施细节和操作能清楚地被本领域技术人员理解,以及本发明实施例免疫激活型抗体及其应用的进步性能显著的体现,以下通过以下实施例来举例说明上述技术方案。
[0341]
以下实施例中,her2抗体(invivomab anti
‑
human/rat her2(neu))、pd
‑
1和pd
‑
l1抗体(抗鼠抗体)均购自bioxcell;纯品处理用透析法。
[0342]
偶联物样品的制备步骤如下:
[0343]
取20μg待测样品于ep管中,加入2μl glycobuffer 2(10x)后,加入超纯水使体系最终体积为20μl。随后,在各样品中加入3μl pngase f于37℃水浴中反应48h。将上述样品稀释10倍(终浓度为0.1mg/ml),并按照下述检测参数测试待测样品。
[0344]
抗体检测参数和质谱条件如下:
[0345]
1.仪器设备
[0346][0347]
2.试剂,试液
[0348][0349][0350]
3.液相色谱条件
[0351]
(1)流动相梯度
[0352]
时间a相(含0.1%甲酸的水溶液)b相(含0.1%甲酸的乙腈溶液)1min80%20%2min10%90%4min10%90%4.1min80%20%7min80%20%
[0353]
(2)检测参数
[0354]
参数参数值
检测波长214nm流速0.3ml/min进样量20μl柱温80℃采集时间7min洗脱模式快速梯度洗脱
[0355]
4.质谱条件
[0356]
参数参数值离子源esi扫描模式tof ms扫描范围(da)1000
‑
5000喷雾气45psi辅助加热气45psi气帘气30psi温度450℃去簇电压300v
[0357]
实施例1化合物的tlr7激活作用检测(hek
‑
bluetm detection)
[0358]
取对数生长期的hek
‑
blue tmh tlr7细胞(购自invivogen),弃除生长用培养基(gibco,c11995500bt,invivo gen,ant
‑
nr),取适量37℃pbs(hyclone,sh30256.01)轻轻润洗细胞2次,弃除pbs。加入2
‑
5ml 37℃pbs,孵育1~2min,用细胞刮刀刮下细胞后轻柔吹打,使其分散成单细胞悬液。采用血球计数板对细胞进行计数并计算细胞浓度,使用hek
‑
bluetm dectetion溶液(购自invivo gen)将细胞悬液调整至2.5
×
104/180μl每孔在96孔细胞培养板上进行细胞铺板。按照化合物或药物浓度(例如0.01μm、0.1μm、1μm、5μm、15μm、30μm、40μm),刺激hek
‑
bluetm htlr7细胞,每个浓度设置3个复孔。37℃、5%二氧化碳条件下孵育6~16h。孵育结束后,采用全波长酶标仪(biotek
‑
epoch)650nm波长处读取吸光度值。结果如图1所示,纵坐标od值代表tlr7激活程度,横坐标代表化合物的浓度。
[0359]
实施例2各免疫激活型抗体的tlr7激动剂释放效果检测
[0360]
取各免疫激活型抗体,按照浓度(例如:0.1μm,1μm,5μm,10μm,20μm,40μm;)加入到her2阳性的skbr3(105个)细胞rpmi1640培养基中。混合培养12小时,取出各上清液,按照实施例1中的方法测试tlr7的激活效果。结果如图2和图3所示。
[0361]
实施例3代表性免疫激活型抗体的抗肿瘤效果实验
[0362]
鼠源的her2
ct26肿瘤细胞和模型,制备方法参考文献(“in vivo properties of three human her2/neu
‑
expressing murine cell lines in immunocompetent mice”,lab anim sci,1999apr;49(2):179
‑
88.)。
[0363]
小鼠结直肠癌肿瘤模型的建立:消化离心收集对数生长期的her2 ct26细胞,用pbs洗两遍后计数,将细胞浓度调整为2.3
×
105个/ml。小鼠为6周龄的spf级balb/c小鼠。用剃毛器将小鼠右侧背部的毛剃干净,用注射器吸取100μl细胞悬液,排净气泡后注射在小鼠后背皮下,待肿瘤直径达到4~5mm之间时,开始进行给药。
[0364]
荷瘤小鼠治疗效果的评价和化合物15
‑
4和34的抗肿瘤效果:将荷瘤小鼠(balb/c)
随机分为control组、tlr7激动剂组、her2抗体组、tlr7激动剂 her2抗体混合组(两者当量比为n:1)以及免疫激活型抗体组,每组8只。按照给药剂量配制注射剂(溶剂组分为混合:5%dmso; 40%peg300; 5%tween 80; 50%pbs),给药剂量tlr7激动剂3mg/kg,her2抗体20mg/kg,tlr7激动剂和her2抗体混合组(3mg/kg 20mg/kg),tlr7
‑
her2偶联抗体20mg/kg,瘤周注射,每次体积100μl。分别于种瘤后的第5天、第11天、第17天给药,第23天给药,一共注射4次,瘤周注射。给药的同时,先用游标卡尺量瘤并记录小鼠的生存情况,共记录7次。肿瘤体积计算方法为:0.5
×
a
×
b2,其中a为长径,b为短径。当小鼠肿瘤直径达到2cm时,应根据动物伦理学颈椎脱臼处死,并剥取其肿瘤组织进行瘤体积和重量计算。结果如图4和图5所示。图4的纵坐标是给药25天时的肿瘤重量,图5是肿瘤体积和时间的关系图。
[0365]
实施例4瘤内免疫细胞分析
[0366]
实施例3的动物第11天给药后48小时安乐死,分出肿瘤组织,流式细胞仪分析瘤内m1/m2标志物比例(mhc
‑
ii:cd206);以及cd8 ifn
‑
γ t细胞变化,pbs或原始抗体对照,结果如图6和图7所示。图6是各个给药组第11天时候肿瘤组织内的m1巨噬细胞和m2巨噬细胞的比例;图7是各个给药组第11天时候肿瘤组织内的cd8 ifn
‑
γ t细胞量相对值。
[0367]
实施例5 cck8法体外检测药物对肿瘤细胞的抑制活性
[0368]
将免疫激活型抗体直接和her2表达的肿瘤细胞混合培养48小时,按照标准cck8技术检测对肿瘤细胞的抑制活性,见图8和图9,结果显示在没有免疫细胞辅助的环境下,带有肿瘤抑制活性小分子和免疫激动剂的抗体对肿瘤细胞具有较强的抑制效果。
[0369]
实施例6
[0370]
化合物szu
‑
164和ho
‑
vc
‑
t、n3
‑
vc
‑
t、ma
‑
vc
‑
t、svc
‑
t对tlr7激活作用检测(hek
‑
bluetm detection):
[0371]
1)将ho
‑
vc
‑
t、n3
‑
vc
‑
t、ma
‑
vc
‑
t、svc
‑
t配制0.1、1、10、20μm的浓度,按照例1中的方法,测得该四个化合物对tlr7的激活结果,见图10。
[0372]
2)将szu
‑
164和ho
‑
vc
‑
t、n3
‑
vc
‑
t、ma
‑
vc
‑
t、svc
‑
t分别与cathepsin
‑
b(10μg,cat.#:10483
‑
h08h,sinobiological),在pbs中以1μm,5μm,10μm,20μm,40μm浓度,室温共孵育12小时;2k的分子膜过滤得到滤液,滤液用实施例1的方法测得szu
‑
164和各化合物对tlr7激活效果,结果说明在cathepsin
‑
b作用下,含val
‑
cit(缬氨酰
‑
瓜氨酰)的基团(如ho
‑
vc
‑
t,等化合物)可被降解,失去对tlr7的激活,见图11。
[0373]
有研究表明,在肿瘤细胞表达tlr7的情况下,激活tlr7会增加肿瘤细胞的数量。实施例6的结果说明1)在正常tlr7表达的细胞,ho
‑
vc
‑
t、n3
‑
vc
‑
t、ma
‑
vc
‑
t、svc
‑
t激活tlr7通路,有利于激活免疫系统;2)在表达tlr7的肿瘤细胞中,在cathepsin
‑
b作用下,ho
‑
vc
‑
t、n3
‑
vc
‑
t、ma
‑
vc
‑
t、svc
‑
t失活,有利于选择性激活免疫微环境的同时,不增长肿瘤细胞。同理,本发明中的其它含val
‑
cit的抗体或化合物可被cathepsin
‑
b作用降解,根据降解后的小分子产物,可产生或失去对tlr7的激活作用。
[0374]
以ho
‑
vc
‑
t为代表的酶(cathepsin
‑
b)作用tlr7激动剂降解示意如图12所示。
[0375]
实施例7.
[0376]
化合物szu
‑
128、gy209、5
‑2‑
1、5
‑2‑
2、17
‑
1和29
‑
1的tlr7通路激活功能实验
[0377]
1)将化合物szu
‑
128、gy209、5
‑2‑
1、5
‑2‑
2、17
‑
1和29
‑
1分别与cathepsin
‑
b(10μg,cat.#:10483
‑
h08h,sinobiological),在pbs中以0.01μm,0.1μm,1μm,5μm,10μm,20μm,40μm
浓度,室温共孵育3小时;2k的分子膜过滤得到滤液,各组滤液用实施例1的方法测得各化合物对tlr7激活效果,r848为标准阳性对照。其中,cathepsin酶催化裂解释放免疫激动剂如图16所示,各化合物在cathepsin
‑
b酶作用下的tlr7激活效果见图17。
[0378]
结果说明在cathepsin
‑
b作用下,含val
‑
cit或val
‑
ala(缬氨酰
‑
瓜氨酰或缬氨酰
‑
丙氨酰)的基团可被降解释放tlr7激动剂,对tlr7激活。
[0379]
2)将各化合物szu
‑
128、gy209、5
‑2‑
1、5
‑2‑
2、17
‑
1、29
‑
1和szu
‑
161分别配制浓度为1μm、0.1μm、0.01μm的三组,直接按照实施例1中的实验方法步骤,得到各化合物在无cathepsin
‑
b酶作用下对tlr7的激活效果,r848为标准阳性对照,见图18。可见,在不添加cathepsin
‑
b情况下,只有不含val
‑
cit或val
‑
ala(缬氨酰
‑
瓜氨酰或缬氨酰
‑
丙氨酰)基团的化合物(gy209,szu161,szu
‑
128和r848)才能够激活tlr7。
[0380]
实施例8.
[0381]
抗体17
‑
1和抗体29
‑
1对肿瘤细胞的抑制效果实验
[0382]
将各化合物按照浓度分组(0.6μm,1.8μm,5.5μm,16.6μm,25μm,50μm)加入相应的肿瘤细胞培养液中(105个细胞),共同孵育3小时后,加入20倍肿瘤细胞数的hpbmc,继续共同孵育48小时,按照标准cck8法测试细胞抑制率,如图19,图20所示。可见新抗体17
‑
1和29
‑
1显著提高了免疫抑制肿瘤细胞的效果。
[0383]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。