紫花苜蓿msspl12蛋白及其相关生物材料与它们在提高植物抗逆性中的应用
技术领域
1.本发明涉及生物技术领域,具体涉及紫花苜蓿msspl12蛋白及其相关生物材料与它们在提高植物抗逆性中的应用。
背景技术:
2.紫花苜蓿(medicago sativa l.)是豆科苜蓿属、异花授粉、同源四倍体的多年生优良牧草,营养丰富、适口性好,有“牧草之王”的美称。近年来,由于全球气候变化、灌溉水质不断下降等原因,我国苜蓿主产区(黄河流域以北的干旱和半干旱地区)干旱化、土壤盐渍化程度不断加剧,造成苜蓿减产、结瘤固氮能力减弱,干旱胁迫、土壤盐渍化已成为制约我国苜蓿产业发展的主要因素之一。因此,培育抗旱耐盐紫花苜蓿新品种,提高苜蓿的抗旱耐盐性是当前提高苜蓿草产量的重要策略。
技术实现要素:
3.本发明要解决的技术问题是如何提高植物的抗逆性。
4.为解决上述技术问题,本发明首先提供蛋白质或调控所述蛋白质编码基因的表达物质或调控所述蛋白质活性或含量的物质的应用,所述蛋白质可以是msspl12蛋白,所述msspl12蛋白可以是如下任一种的蛋白质:
5.a1)氨基酸序列是seq id no.2的蛋白质;
6.a2)将a1)所示的氨基酸序列经过一个以上氨基酸残基的取代和/或缺失和/或添加得到的与a1)所示的蛋白质具有80%以上的同一性且具有调控植物耐盐性功能的蛋白质;
7.a3)在a1)或a2)的n末端或/和c末端连接蛋白标签得到的融合蛋白质。
8.进一步地,上述应用中所述蛋白质可来源于苜蓿。
9.更具体地,所述蛋白质来源于紫花苜蓿。
10.其中,seq id no.1由434个氨基酸残基组成。
11.上述蛋白质可人工合成,也可先合成其编码基因,再进行生物表达得到。
12.本文中,所述蛋白质标签(protein
‑
tag)是指利用dna体外重组技术,与目的蛋白质一起融合表达的一种多肽或者蛋白质,以便于目的蛋白质的表达、检测、示踪和/或纯化。所述蛋白质标签可为flag标签、his标签、mbp标签、ha标签、myc标签、gst标签和/或sumo标签等。
13.本文中,所述同一性是指氨基酸序列或核苷酸序列的同一性。可使用国际互联网上的同源性检索站点测定氨基酸序列的同一性,如ncbi主页网站的blast网页。例如,可在高级blast2.1中,通过使用blastp作为程序,将expect值设置为10,将所有filter设置为off,使用blosum62作为matrix,将gap existence cost,per residue gap cost和lambda ratio分别设置为11,1和0.85(缺省值)并进行检索一对氨基酸序列的同一性进行计算,然
后即可获得同一性的值(%)。
14.本文中,所述80%以上的同一性可为至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的同一性。
15.上述应用中,所述调控所述蛋白质活性或含量的物质可为调控所述蛋白质的编码基因表达的物质。
16.上述应用中,所述调控基因表达的物质可为进行如下6种调控中至少一种调控的物质:1)在所述基因转录水平上进行的调控;2)在所述基因转录后进行的调控(也就是对所述基因的初级转录物的剪接或加工进行的调控);3)对所述基因的rna转运进行的调控(也就是对所述基因的mrna由细胞核向细胞质转运进行的调控);4)对所述基因的翻译进行的调控;5)对所述基因的mrna降解进行的调控;6)对所述基因的翻译后的调控(也就是对所述基因翻译的蛋白质的活性进行调控)。
17.进一步地,上述应用中所述调控植物抗逆性可为增强植物抗逆性。
18.具体地,上述应用中,所述调控基因表达可为提高或增加所述基因表达。
19.进一步地,所述的应用中,所述植物为下述任一种:
20.p1)双子叶植物;
21.p2)豆科植物;
22.p3)蝶形花亚科植物;
23.p4)苜蓿属植物;
24.p5)紫花苜蓿。
25.进一步地,上述应用中,所述提高或增加所述基因表达的物质可为与所述蛋白质相关的生物材料,所述生物材料可为下述b1)至b7)中的任一种:
26.b1)编码上述蛋白质的核酸分子;
27.b2)含有b1)所述核酸分子的表达盒;
28.b3)含有b1)所述核酸分子的重组载体、或含有b2)所述表达盒的重组载体;
29.b4)含有b1)所述核酸分子的重组微生物、或含有b2)所述表达盒的重组微生物、或含有b3)所述重组载体的重组微生物;
30.b5)含有b1)所述核酸分子的转基因植物细胞系、或含有b2)所述表达盒的转基因植物细胞系;
31.b6)含有b1)所述核酸分子的转基因植物组织、或含有b2)所述表达盒的转基因植物组织;
32.b7)含有b1)所述核酸分子的转基因植物器官、或含有b2)所述表达盒的转基因植物器官。
33.其中,b1)所述核酸分子可以是dna,如cdna、基因组dna或重组dna;所述核酸分子也可以是rna,如mrna或hnrna等。
34.进一步地,b1)所述核酸分子可为如下g1)或g2)所示的基因:
35.g1)编码链的编码序列是seq id no.1的cdna分子或dna分子;
36.g2)编码链的核苷酸是seq id no.1的cdna分子或dna分子;
37.其中,seq id no.2由1305个核苷酸组成,其开放阅读框(orf)为自5
′
末端起第1
位
‑
第1305位,编码氨基酸序列如seq id no.2所示的蛋白。
38.上述相关生物材料中,b2)所述的表达盒是指能够在宿主细胞中表达蛋白质msspl12的dna,该dna不但可包括启动msspl12基因转录的启动子,还可包括终止msspl12基因转录的终止子。进一步,所述表达盒还可包括增强子序列。可用于本发明的启动子包括但不限于:组成型启动子,组织、器官和发育特异的启动子和诱导型启动子。启动子的例子包括但不限于:花椰菜花叶病毒的组成型启动子35s;来自西红柿的创伤诱导型启动子,亮氨酸氨基肽酶("lap",chao等人(1999)plant physiol 120:979
‑
992);来自烟草的化学诱导型启动子,发病机理相关1(pr1)(由水杨酸和bth(苯并噻二唑
‑7‑
硫代羟酸s
‑
甲酯)诱导);西红柿蛋白酶抑制剂ii启动子(pin2)或lap启动子(均可用茉莉酮酸曱酯诱导);热休克启动子(美国专利5,187,267);四环素诱导型启动子(美国专利5,057,422);种子特异性启动子,如谷子种子特异性启动子pf128(cn101063139b(中国专利2007 1 0099169.7)),种子贮存蛋白质特异的启动子(例如,菜豆球蛋白、napin,oleosin和大豆beta conglycin的启动子(beachy等人(1985)embo j.4:3047
‑
3053)。它们可单独使用或与其它的植物启动子结合使用。此处引用的所有参考文献均全文引用。合适的转录终止子包括但不限于:农杆菌胭脂碱合成酶终止子(nos终止子)、花椰菜花叶病毒camv 35s终止子、tml终止子、豌豆rbcs e9终止子和胭脂氨酸和章鱼氨酸合酶终止子(参见,例如:odell等人(i
985
)nature 313:810;rosenberg等人(1987)gene,56:125;guerineau等人(1991)mol.gen.genet,262:141;proudfoot(1991)cell,64:671;sanfacon等人genes dev.,5:141;mogen等人(1990)plant cell,2:1261;munroe等人(1990)gene,91:151;ballad等人(1989)nucleic acids res.17:7891;joshi等人(1987)nucleic acid res.,15:9627)。
39.上述相关生物材料中,b3)所述重组载体可含有seq id no.1所示的用于编码蛋白质msspl12的dna分子。
40.可用植物表达载体构建含有所述msspl12蛋白编码基因表达盒的重组载体。
41.上述相关生物材料中,b4)所述重组微生物具体可为酵母、细菌、藻和真菌。
42.上述相关生物材料中,b6)所述植物组织可来源于根、茎、叶、花、果实、种子、花粉、胚和花药。
43.上述相关生物材料中,b7)所述转基因植物器官可为转基因植物的根、茎、叶、花、果实和种子。
44.上述相关生物材料中,所述转基因植物细胞系、转基因植物组织和转基因植物器官可包括繁殖材料,也可不包括繁殖材料。
45.第二个方面,本发明还提供一种提高植物抗逆性的方法,所述方法包括提高目的植物中上述蛋白的编码基因的表达量,从而提高目的植物的抗逆性。
46.所述提高目的植物中上述蛋白的编码基因的表达量可通过将所述蛋白质的编码基因导入所述目的植物实现。
47.上述方法中,所述蛋白质编码基因可通过携带有所述蛋白质编码基因的植物表达载体导入目的植物中。
48.携带有本发明所述蛋白质编码基因的植物表达载体可通过使用ti质粒、ri质粒、植物病毒载体、直接dna转化、微注射、电导、农杆菌介导等常规生物学方法转化植物细胞或组织,并将转化的植物细胞或组织培育成植株。
49.在本发明具体的实施方式中,所述重组载体为重组质粒pzh01
‑
msspl12。重组载体pzh01
‑
msspl12的结构为用seq id no.1所示的核苷酸序列替换pzh01载体bamhi和kpni限制性内切酶之间的片段(bamhi和kpni限制性内切酶之间的小片段),保持pzh01载体其他的核苷酸序列不变得到的重组载体。
50.上文中,所述抗逆性可为耐旱性和/或耐盐性。
51.进一步地,所述的方法中,所述受体植物为下述任一种:
52.p1)双子叶植物;
53.p2)豆科植物;
54.p3)蝶形花亚科植物;
55.p4)苜蓿属植物;
56.p5)紫花苜蓿。
57.第三个方面,本发明还提供上述蛋白质,和/或与上述蛋白相关的生物材料。
58.本发明提供了msspl12蛋白及其编码基因,并将msspl12蛋白的编码基因导入紫花苜蓿中,得到msspl12的转基因紫花苜蓿植株。将转基因植株进行干旱及盐胁迫处理,与对照相比,转基因株系耐旱及耐盐性增强。
59.本发明所提供的msspl12基因及其所编码的蛋白质在植物抗逆过程中起着重要的作用,在提高植物抗逆研究中具有重要的应用价值,在农业领域具有广阔的应用空间和市场前景。
附图说明
60.图1为过表达msspl12转基因苜蓿植株的pcr检测;注:m为marker,购自dna ladder al2000;wt1、wt2为野生型中苜1号紫花苜蓿植株;p为阳性对照:质粒(ox)pzh01
‑
msspl12;w为负对照:水;数字5、7、10、11、15、18、20分别表示潮霉素筛选出的转基因植株tg5、tg7、tg10、tg11、tg15、tg18和tg20。
61.图2a为生长3个月的过表达msspl12的转基因植株和野生型植株的植株整体生长外观。
62.图2b为生长3个月的过表达msspl12的转基因植株和野生型植株的枝条生长外观。
63.图2c为qrt
‑
pcr检测生长3个月的野生型和转基因植株中msspl12基因的相对表达量。
64.图2d为生长3个月的过表达msspl12的转基因植株和野生型植株高度。
65.图2e为生长3个月的过表达msspl12的转基因植株和野生型植株每个分支的节间数。
66.图2f为生长3个月的过表达msspl12的转基因植株和野生型植株的节间长度。
67.图2g为生长3个月的过表达msspl12的转基因植株和野生型植株初级分枝数量。
68.图2h为生长3个月的过表达msspl12的转基因植株和野生型植株节点平均叶片数量。
69.图2i为生长3个月的过表达msspl12的转基因植株和野生型植株次级分支的平均长度。
70.图2j为生长3个月的过表达msspl12的转基因植株和野生型植株地上干物质重量。
71.图3为过表达msspl12转基因植株耐旱性评价;图中(a)、(b)、(c)、(d)分别是干旱处理0天、7天、10天以及复水7天后的植株形态。
72.图4为植株干旱处理7天和10天时转基因植株和野生型植株的植株顶端形态。
73.图5a为干旱处理前和干旱处理后msspl12转基因植株和野生型植株叶片相对含水量。
74.图5b为干旱处理前和干旱处理后msspl12转基因植株和野生型植株的叶片电解质渗透率。
75.图5c为干旱处理前和干旱处理后野生型和转基因植株叶片中丙二醛含量。
76.图5d为干旱处理前和干旱处理后野生型和转基因植株叶片中过氧化氢含量。
77.图6a为盐胁迫处理前和盐胁迫处理11天后msspl12转基因植株和野生型植株的生长状态。
78.图6b为盐胁迫处理前和盐胁迫处理11天后野生型和转基因植株中电解质渗透率。
79.图6c为盐胁迫处理前和盐胁迫处理11天后野生型和转基因植株中丙二醛含量。
80.图6d为盐胁迫处理前和盐胁迫处理11天后野生型和转基因植株中k
/na
比。
具体实施方式
81.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
82.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
83.pzh01载体在文献“xiao h.,wang y.,liu d.,wang w.,li x.,zhao x.,xu j.,zhai w.,zhu l.(2003)functional analysis of the rice ap3 homologue osmads16 by rna interference.plant molecular biology,52,957
‑
966”中公开。
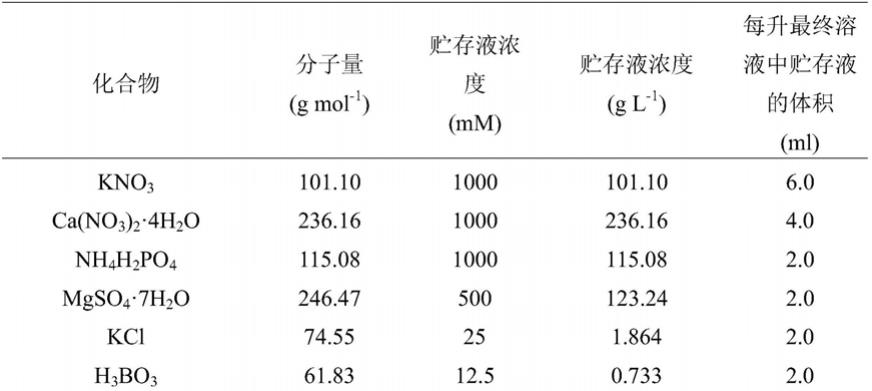
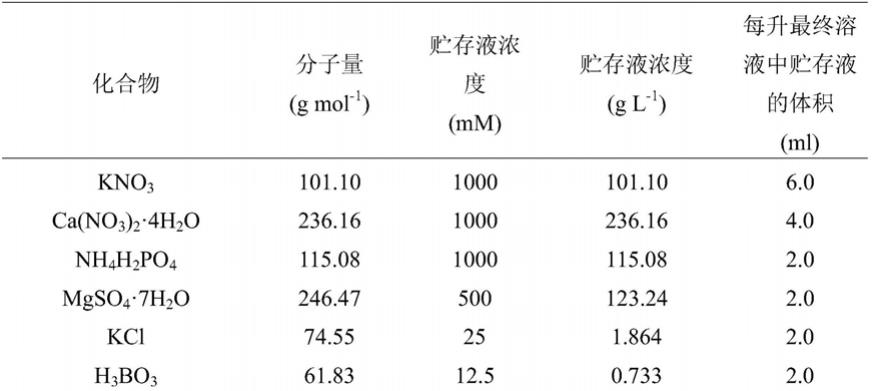
84.hoagland营养液的基础配方为:
85.表1 hoagland营养液组分
86.[0087][0088]
下述实施例采用sas 8.2统计软件对数据进行处理,实验结果以平均值
±
标准偏差表示,p<0.05(*)表示具有显著性差异,p<0.01(**)表示具有极显著性差异,p<0.001(***)表示具有极显著性差异。
[0089]
实施例1、msspl12基因克隆及表达载体构建
[0090]
msspl12基因的编码序列是seq id no.1,来源于紫花苜蓿,编码氨基酸序列是seq id no.2的蛋白质msspl12。
[0091]
提取紫花苜蓿(中苜1号)rna,反转录获得cdna。
[0092]
根据三代数据库数据设计覆盖整个cdna的序列的克隆引物如下:
[0093]
msspl12
‑
bamhi
‑
f:5'
‑
ggatccatggagtggaacgtgaaatctcccg
‑
3'(下划线区域为bamh i识别位点);
[0094]
msspl12
‑
kpni
‑
r:5'
‑
ggtaccttaatccagctggttgcaagggaaac
‑
3')(下划线区域为kpn i识别位点)。
[0095]
以cdna为模板,以msspl12
‑
bamhi
‑
f和msspl12
‑
kpni
‑
r为引物进行pcr,克隆得到的pcr产物包含两端带有酶切识别位点的msspl12编码区序列的dna分子。利用限制性内切酶bamh i和kpn i分别双酶切pcr产物和pzh01载体,将得到的酶切产物连接,获得的连接产物转入大肠杆菌dh5α菌株,挑取阳性克隆送测序,测序结果表明,重组载体的结构为用核苷酸序列是seq id no.1的msspl12基因替换pzh01载体的限制性内切酶bamh i和kpn i识别位点之间的片段(bamh i和kpn i限制性内切酶识别位点之间的小片段),保持载体pzh01其他的核苷酸序列不变得到的重组载体,命名为pzh01
‑
msspl12。pzh01
‑
msspl12为msspl12基因的表达载体。
[0096]
实施例2、过表达msspl12转基因植株的获得
[0097]
2.1、农杆菌介导的遗传转化
[0098]
采用热激转化方法将构建好的pzh01
‑
msspl12载体化至根癌农杆菌eha105中,在含有100mg/l卡那霉素和50mg/l利福平的yep培养基筛选阳性克隆,通过菌液pcr验证,确定植物表达载体成功转入eha105农杆菌中。
[0099]
然后利用本实验室前期发表的方法文献中的农杆菌介导的遗传转化方法进行遗传转化,所用受体植物为紫花苜蓿品种中苜1号,转化部位是成熟叶片。方法参考文献为:[1]李娟,张万军,王涛.黄花苜蓿高频植株再生体系建立的研究[j].草地学报,2014,22(04):834
‑
839;[2]wang kexin;liu yanrong;teng fengkui;cen huifang;yan jianping;
lin shiwen;li dayong;zhang wanjun*;heterogeneous expression of osa
‑
mir156bc increases abiotic stress resistance and forage quality of alfalfa,the crop journal,2021:https://doi.org/10.1016/j.cj.2020.11.009.
[0100]
通过潮霉素筛选,获得转msspl12基因的潮霉素抗性植株7株,即t0代转基因植株,植株编号分别为5(tg5)、7(tg7)、10(tg10)、11(tg11)、15(tg15)、18(tg18)和20(tg20)。
[0101]
2.2、msspl12转基因植株pcr检测
[0102]
为了检测含有目的基因的载体片段是否整合到植物基因组中,采用ctab法提取野生型及转msspl12基因的潮霉素抗性植株幼嫩叶片的基因组dna。以转基因抗性植株dna为模板,野生型紫花苜蓿中苜1号品种植株(wt,即受体植物)为阴性对照,以植物表达载体pzh01
‑
msspl12为阳性对照( ),利用35s_f:5
′‑
cgcacaatcccactatccttc
‑3′
和msspl12
‑
kpn1
‑
r为引物扩增msspl12基因特异片段。
[0103]
鉴定结果如图1所示,转基因阳性植株扩增得到与阳性对照( )大小一致的条带,阴性对照(wt)未扩增出目的条带,说明载体片段已整合进入植物基因组中。通过pcr检测确定获得转msspl12基因阳性植株7株。
[0104]
2.3、msspl12转基因植株qrt
‑
pcr检测
[0105]
为了检测转基因植株中目的基因表达量,通过qrt
‑
pcr对目的基因在转基因植株中的表达量进行检测和分析。以转基因pcr阳性植株cdna为模板,持家基因actin为内参基因,检测转基因植株中目的基因相对表达量,结果表明转msspl12基因阳性植株tg5、tg7、tg18、tg10和tg15的msspl12基因表达量显著高于紫花苜蓿中苜1号品种植株(wt,即受体植物)(图2c)。
[0106]
定量引物:
[0107]
msspl12
‑
f:5'
‑
cgtcgcaaacctcagcctgaag
‑
3',
[0108]
msspl12
‑
r:5'
‑
gcccattgtctgcctcccatc
‑
3'。
[0109]
内参引物:
[0110]
actin
‑
f:5'
‑
caaaagatggcagatgctgaggat
‑
3',
[0111]
actin
‑
r:5'
‑
catgacaccagtatgacgaggtcg
‑
3'
[0112]
实施例3、msspl12转基因植株表性分析
[0113]
3.1、msspl12转基因植株生长外观分析:
[0114]
t0代转基因植株通过枝条扦插的方式扩繁,株系编号分别为tg5、tg7、tg10、tg15和tg18。
[0115]
通过前期分子检测及植株表型的初步观察,本研究选择具有不同msspl12表达量的msspl12转基因阳性植株tg5、tg7、tg10、tg15、tg18进行深入研究。
[0116]
对生长3月的植株进行表型测定,用sas 8.2软件中的单因素方差分析程序对数据进行方差分析和多重比较,英文字母表示差异显著程度,具有至少一个相同字母的处理间在0.05水平无显著差异,没有相同字母的处理间在0.05水平有显著差异。
[0117]
野生型和转基因植株的整体生长状态如图2a所示,枝条生长外观如图2b所示。结果表明:野生型植株和转基因植株整体生长状态无显著差异。发现转基因植株的株高和每个分支的节数显著高于野生型(图2d、图2e),节间长度无显著差异(图2f)。另外,转基因植株与野生型相比,初级分枝数量无显著差异(图2中g),但是促进了节间次级分枝的伸长(图
2i),使得每个节点处叶片数量大约为wt的3倍(图2h),以上表型使得转基因植株地上干物质量显著高于野生型(图2中j)。
[0118]
3.2、过表达msspl12转基因植株耐旱性分析
[0119]
野生型株系(紫花苜蓿中苜1号品种,wt)、t0代转基因纯合株系tg5、tg7、tg10、tg15和tg18经过扦插扩繁,各植株生长3个月后,挑选生长一致的植株,每个株系3盆,每盆1株植株,进行耐旱生理实验。实验处理前将每盆植株浇透水,称量植株、花盆、土壤的总重量。然后开始进行断水处理。每隔一天称重一次,减少的重量记为水分消耗量。断水期间每天移动花盆保证水分蒸发一致。当水分消耗量达到50%时,记为干旱处理的0天。记录植株生长情况及取相同部位的叶片进行生理实验。
[0120]
结果如图3所示,干旱处理前,植株长势一致,生长良好(图3中a)。干旱处理7天后,野生型植株叶片开始失水萎蔫、失绿,转基因植株枝条顶部叶片及节点处次级分支幼嫩叶片无萎蔫表型,成熟叶片失绿(图3中b)。干旱处理10天后,野生型植株严重萎蔫,叶片干枯;转基因植株枝条顶部叶片开始出现萎蔫(图3中c)。干旱处理10天后复水,复水7天后,相比于野生型植株,转基因植株能够快速生长出新的枝条,存活率可达100%,而野生型植株仅有一株有生长迹象,其余植株全部死亡(图3中d)。
[0121]
植株干旱处理7天和10天时转基因植株和野生型植株的植株顶端形态如图4所示。结果表明,干旱处理7天后,野生型植株的顶端叶片萎蔫,而转基因植株无萎蔫现象;干旱处理10天后,野生型植株的顶端叶片萎蔫干枯,转基因植株的萎蔫状态显著轻于野生型植株。
[0122]
为了定量的评价野生型及转基因植株间的耐旱性能力,我们测定了干旱胁迫不同时期枝条顶端叶片的生理指标。如图5a、5b、5c和5d所示,干旱处理前,野生型植株和转基因植株的叶片相对含水量,电解质渗漏、丙二醛含量及过氧化氢含量无显著差异。干旱处理7天后,野生型植株叶片失水量达50%左右,而转基因植株嫩叶含水量与处理前相比下降约10%;干旱处理10d时,野生型植株的叶片含水量仅有20%,转基因植株的叶片含水量为40%左右(图5a)。叶片电解质渗漏实验测定结果发现,野生型植株幼嫩叶片干旱处理后电解质渗漏显著增加,而转基因植株幼嫩叶片的电解质渗漏保持在处理前的水平,无显著增加(图5b)。叶片丙二醛含量变化趋势与电解质渗漏相似(图5c)。叶片过氧化氢含量随着胁迫处理时间的延长而逐渐增加,其中野生型植株的增量显著大于转基因植株(图5d)。以上生理指标的测定结果表明过表达msspl12基因显著增加了紫花苜蓿的耐旱性。
[0123]
3.3、过表达msspl12转基因植株耐盐性分析
[0124]
选择长势一致的1月龄t0代转基因植株tg5、tg7和tg10扦插苗和1月龄野生型株系(紫花苜蓿中苜1号品种,wt),至装满石英砂的花盆中,在温室中光照培养,温度为25
±
2℃,光照16h/黑暗8h,水和营养液每天轮换浇灌。实验中共选取3个msspl12转基因株系tg5、tg7和tg10和野生型株系,每个株系设置3个重复,每盆1株植株。
[0125]
缓苗1个月后,开始进行盐胁迫处理。采用梯度增加nacl浓度的方法,从0mm开始,每24h提高50mm nacl浓度,浇灌含有相应的nacl浓度的1/2
×
hoagland营养液,直至nacl浓度达到250mm,之后隔一天浇一次,并观察植株的形态。盐胁迫11天后发现野生型叶片严重萎蔫干枯,枝条死亡;转基因植株叶片萎蔫程度显著低于野生型(图6a)。
[0126]
对盐胁迫处理11天的野生型植株和转基因植株进行生理检测,测定植株电解质渗透率、丙二醛含量、和k
/na
比值。结果表明:在正常条件下,转基因和野生型植株叶片的电
解质渗透率均保持在16%
‑
25%之间,且转基因植株的电解质渗透率显著高于野生型植株;在盐胁迫11天后,转基因植株和野生型植株的叶片的电解质渗透率均显著增加,且野生型植株的电解质渗透率增加的幅度高于转基因植株,野生型植株的电解质渗透率为98.56%,而转基因株系的电解质渗透率77%
‑
89%之间,显著低于野生型(图6b)。转基因植株的丙二醛含量在正常条件与盐胁迫条件下含量变化不大,维持在2~6μmol/g的范围;但野生型植株在盐胁迫处理后丙二醛含量增长近5.4倍(图5c)。盐胁迫后,测量植株底部叶片的k
/na
比,结果显示:盐胁迫后,msspl12表达量相对较低的5号株系k
/na
比与野生型相比无显著差异;但高表达msspl12的转基因株系tg10和tg7中k
/na
比显著高于野生型(图6d)。
[0127]
上述结果表明:盐胁迫处理下转基因植株丙二醛及电解质渗透率均显著低于野生型,说明植物脂体过氧化程度低,细胞膜受盐害程度低。k
/na
比的对比结果说明在盐胁迫下转基因植株底部叶片比野生型植株受到的离子毒害程度更轻。
[0128]
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。