1.本发明涉及一种人造毛发用纤维和人造毛发。本发明还涉及一种赋予其预定形状的人造毛发用纤维的制造方法和人造毛发的制造方法。
背景技术:
2.以往,作为假发及假发片等人造毛发的材料,使用人发或非天然纤维或合成纤维。作为人造毛发用的非天然纤维,一般使用聚酯纤维或丙烯酸纤维(例如,专利文献1)。非天然纤维具有以下优点:能够质量均匀地、稳定且大量地获得比人发强度高的所期望的长度的纤维。进一步地,还提出了一种再生胶原纤维等毛发用人造蛋白质纤维(例如,专利文献2),其有望进一步减小环境负荷。
3.然而,为了确保风格多样化,有时赋予人造毛发含有弯曲部分的形状或直线状的形状。
4.现有技术文献
5.专利文献
6.专利文献1:日本特开2007
‑
297737号公报
7.专利文献2:国际公开第2016/158702号
技术实现要素:
8.发明所要解决的问题
9.非天然纤维与人发相比,手感大不相同,而且特性也有很大差异。例如,人发具有在吸水时伸长到预定长度,然后干燥后恢复到原来长度的特性,与此相对地,非天然纤维不具有任何这样的特性。因此,当使用由非天然纤维构成的人造毛发用纤维时,难免与人发之间会产生不适感。因此,希望实现一种人造毛发,其与人发之间不易产生不适感。此外,从造型的观点出发,有时也要求人造毛发具有弯曲部分(卷曲部分)或直线状的形状等预定形状。
10.因此,本发明的一个方面提供一种赋予其预定形状的人造毛发用纤维,其可以在使用非天然纤维的同时,稳定地供给,并且可以抑制与人发之间所产生的不适感。
11.在人造毛发用非天然纤维的情况下,一般将合成纤维卷绕在铝管等芯材上,并且通过在该状态下加热合成纤维来赋予其含有弯曲部分的形状。为了充分地赋予所期望的形状并保持该形状,有时需要在100℃以上的高温下进行加热。高温加热容易引起人造毛发的手感变化、强度降低以及颜色变化。此外,从确保操作者的安全性的观点出发,优选在不需要高温加热的条件下就能够对人造毛发用合成纤维赋予所期望的形状。
12.因此,本发明的另一个方面提供一种获得人造毛发用纤维的方法,其在使用非天然纤维的同时,无需高温加热就可以赋予其预定形状。
13.在传统的毛发用人造蛋白质纤维的情况下,为了赋予其预定形状并确保所赋予的
形状的保持性能,需要将蛋白质纤维交联。此外,有时需要利用特殊处理液进行预处理。
14.因此,本发明的又一个方面提供一种在使用蛋白质纤维的同时,可以容易地获得所赋予的形状的保持性能优异的人造毛发用纤维的方法。
15.用于解决问题的方法
16.本发明人等发现,包含改造丝心蛋白在内的丝心蛋白纤维随着润湿和干燥与人发一样地进行伸缩,进而用简单的方法赋予其预定形状。即,本发明的一个侧面涉及以下内容。
17.[1]一种赋予其预定形状的人造毛发用纤维,其中,其由包含改造丝心蛋白的人造丝心蛋白纤维构成,当其处于润湿状态时伸长、并且当其从润湿状态干燥时收缩。
[0018]
[2]一种人造毛发,其中,其包含根据[1]所述的人造毛发用纤维。
[0019]
作为各种研究的结果,本发明人等发现,包含改造丝心蛋白在内的丝心蛋白纤维不需要高温加热,就可以赋予其预定形状。即,本发明的另一个侧面涉及以下内容。
[0020]
[1]一种赋予其预定形状的人造毛发用纤维的制造方法,其中,其包括在沿着预定形状的状态下保持包含改造丝心蛋白在内的丝心蛋白纤维的工序,所述预定形状是包含弯曲部分、直线状部分或这两者的形状。
[0021]
[2]根据[1]所述的方法,其中,所述丝心蛋白纤维通过卷绕在芯材上,保持在沿着包含弯曲部分的形状的状态下。
[0022]
[3]根据[1]或[2]所述的方法,其中,所述丝心蛋白纤维的直径大于30μm。
[0023]
[4]根据[1]至[3]中任一项所述的方法,其中,对保持在沿着所述预定形状的状态下的所述丝心蛋白纤维进行加热。
[0024]
[5]根据[4]所述的方法,其中,将保持在沿着所述预定形状的状态下的所述丝心蛋白纤维加热至小于100℃。
[0025]
[6]根据[1]至[5]中任一项所述的方法,其中,所述改造丝心蛋白包含改造蜘蛛丝丝心蛋白。
[0026]
[7]根据[1]至[6]中任一项所述的方法,其中,该方法还包括干燥所述丝心蛋白纤维的工序,干燥后的所述丝心蛋白纤维卷绕在所述芯材上。
[0027]
[8]一种人造毛发的制造方法,其中,其包括利用[1]至[7]中任一项所述的方法来获得赋予其预定形状的人造毛发纤维的工序。
[0028]
在这些方法中,丝心蛋白纤维可以是当其处于润湿状态时伸长、并且当其从润湿状态干燥时收缩的纤维。
[0029]
作为各种研究的结果,本发明人等发现,包含改造丝心蛋白在内的丝心蛋白纤维不一定需要利用化学反应进行交联、以及利用处理液进行预处理,其在沿着预定形状的状态下保持用水润湿的丝心蛋白纤维的同时进行加热,从而可以容易地赋予其预定形状,而且可以良好地保持所赋予的形状。即,本发明的一个侧面涉及以下内容。
[0030]
[1]一种赋予其预定形状的人造毛发用纤维的制造方法,其中,其包括将包含改造丝心蛋白且用水润湿的丝心蛋白纤维在沿着预定形状的状态下进行保持的同时进行加热的工序,所述预定形状是包含弯曲部分、直线状部分或这两者的形状。
[0031]
[2]根据[1]所述的方法,其中,该方法还包括在沿着所述预定形状的状态下保持所述丝心蛋白纤维之前,用水润湿所述丝心蛋白纤维的工序。
[0032]
[3]根据[1]或[2]所述的方法,其中,将保持在沿着所述预定形状的状态下的所述丝心蛋白纤维浸渍于水中。
[0033]
[4]根据[1]或[2]所述的方法,其中,将保持在沿着所述预定形状的状态下的所述丝心蛋白纤维暴露于水蒸气中。
[0034]
[5]根据[1]至[4]中任一项的方法,其中,所述丝心蛋白纤维通过卷绕在芯材上,保持在沿着包含弯曲部分的预定形状的状态下。
[0035]
[6]根据[1]至[5]中任一项所述的方法,其中,所述改造丝心蛋白包含改造蜘蛛丝丝心蛋白。
[0036]
[7]一种人造毛发的制造方法,其中,其包括利用[1]至[6]中任一项所述的方法来获得赋予其预定形状的人造毛发用纤维的工序。
[0037]
在这些方法中,丝心蛋白纤维也可以是当其处于润湿状态时伸长、并且当其从润湿状态干燥时收缩的纤维。
[0038]
发明效果
[0039]
根据本发明的一个方面,能够提供一种可赋予其预定形状的人造毛发用纤维,其可以在使用非天然纤维的同时,稳定地供给,并且可以抑制与人发之间所产生的不适感。
[0040]
根据本发明的另一个方面,在使用可稳定供给的非天然纤维的同时,不需要高温加热就可以获得赋予预定形状的人造毛发用纤维。
[0041]
根据本发明的又一个方面,在使用可稳定供给且环境负荷小的蛋白质纤维的同时,可以容易地获得所赋予的形状的保持性能优异的人造毛发用纤维。
附图说明
[0042]
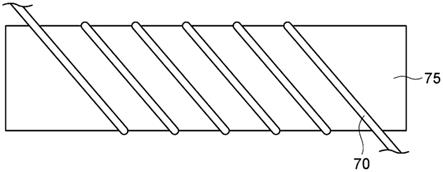
图1是表示赋予其含有弯曲部分的形状的人造毛发用纤维的制造方法的一例的示意图。
[0043]
图2是表示改造丝心蛋白的结构域序列的一例的示意图。
[0044]
图3是表示改造丝心蛋白的结构域序列的一例的示意图。
[0045]
图4是表示改造丝心蛋白的结构域序列的一例的示意图。
[0046]
图5是表示用于制造丝心蛋白纤维的纺丝装置的一例的示意图。
[0047]
图6是表示用于制造丝心蛋白纤维的制造装置的一例的示意图。
[0048]
图7是表示用于制造丝心蛋白纤维的制造装置的一例的示意图。
[0049]
图8是赋予其含有弯曲部分的形状的丝心蛋白纤维的图(图片)。
[0050]
图9是赋予其含有弯曲部分的形状的丝心蛋白纤维的图(图片)。
[0051]
图10是赋予其含有弯曲部分的形状的丝心蛋白纤维的图(图片)。
[0052]
图11是赋予其含有弯曲部分的形状的丝心蛋白纤维的图(图片)。
[0053]
图12是赋予其含有弯曲部分的形状的丝心蛋白纤维的图(图片)。
[0054]
图13是赋予其含有弯曲部分的形状的丝心蛋白纤维的图(图片)。
[0055]
图14是赋予其含有弯曲部分的形状的丝心蛋白纤维的图(图片)。
[0056]
图15是赋予其含有弯曲部分的形状的丝心蛋白纤维的图(图片)。
具体实施方式
[0057]
以下,对本发明具体实施方式详细进行说明。但是,本发明并不限于以下实施方式。
[0058]
(人造毛发用纤维的制造方法)
[0059]
赋予其预定形状的人造毛发用纤维的制造方法的一个实施方式包括在沿着预定形状的状态下保持包含改造丝心蛋白在内的丝心蛋白纤维(人造丝心蛋白纤维)的工序。预定形状可以是卷曲形状。赋予其预定形状的人造毛发用纤维的制造方法的一个实施方式还可以包括在沿着预定形状的状态下将包含改造丝心蛋白且用水润湿的丝心蛋白纤维进行保持的同时进行加热的工序。通过这些方法,可以容易地获得由赋予其预定形状的丝心蛋白纤维构成的人造毛发用纤维。这里的预定形状可以是包括弯曲部分、直线状部分或这两者的形状。含有弯曲部分的形状也可以是卷曲形状。
[0060]
图1是表示赋予其含有弯曲部分的形状(或者卷曲形状)的人造毛发用纤维的制造方法的一例的示意图。在图1所示的方法中,沿着圆柱状芯材75的外周面卷绕有丝心蛋白纤维70。沿着卷曲形状的状态下,在比较低的温度下保持丝心蛋白纤维70,以这种方式赋予丝心蛋白纤维70以与芯材75的外周面的形状相对应的卷曲形状。也可以通过在沿着卷曲形状的状态下保持丝心蛋白纤维70的同时进行加热,赋予丝心蛋白纤维70以与芯材75的外周面的形状相对应的卷曲形状。赋予了卷曲形状的丝心蛋白纤维70在从芯材75取下后,也能够维持所赋予的形状。
[0061]
芯材75的直径并没有特别限制,通常在1~100mm的范围内。芯材的形状并不限于圆柱状。
[0062]
在本实施方式所涉及的方法中,将通过干燥或用水润湿的丝心蛋白纤维70卷绕在芯材75上。这里的“干燥的丝心蛋白纤维”是指未用水润湿的丝心蛋白纤维。但是,干燥的丝心蛋白纤维70可以包含不可避免的少量水分。因此,本实施方式所涉及的方法还可以包括干燥卷绕在芯材75上之前的丝心蛋白纤维70。丝心蛋白纤维70例如通过将其保持在10~100℃的环境中来干燥。干燥后的丝心蛋白纤维70在不与水或含水的液体接触的情况下卷绕在芯材75上。
[0063]
将卷绕在芯材75上的丝心蛋白纤维70保持在预定温度的环境下。在卷绕于芯材75上的丝心蛋白纤维70为润湿状态的情况下,该预定温度可以是不伴随加热的温度,具体而言,例如可以为0℃以上、10℃以上、或者20℃以上。在卷绕在芯材75上的丝心蛋白纤维70为干燥状态的情况下,卷绕在芯材75上的丝心蛋白纤维70可以加热,也可以不加热。当加热卷绕在芯材75上的丝心蛋白纤维70时的加热温度可以为大于40℃、45℃以上、50℃以上、60℃以上、70℃以上、80℃以上、或者90℃以上,也可以小于100℃。为了加热,也可以将热风吹到丝心蛋白纤维70上。当在沿着预定形状的状态下保持丝心蛋白纤维的温度高时,具有容易在短时间内赋予丝心蛋白纤维以预定形状的倾向。
[0064]
对保持卷绕在芯材75上的丝心蛋白纤维70的时间进行调整,以赋予丝心蛋白纤维70形状。通常,保持时间可以在10~360分钟的范围内,也可以在30~90分钟的范围内。
[0065]
通过将用水润湿的丝心蛋白纤维70在沿着预定形状的状态下进行保持,即使丝心蛋白纤维没有通过化学反应等进行交联,也能够很容易地赋予其预定形状,而且也易于维持所赋予的形状。认为通过在有水的情况下保持丝心蛋白纤维70,或者在有水的情况下以
保持丝心蛋白纤维70的状态下进行加热,在丝心蛋白纤维中改造丝心蛋白的β
‑
折叠结构会增加。本发明人等推测,通过将该β
‑
折叠结构作为假交联发挥功能,改造丝心蛋白的分子链运动受到限制,由其结果可知,能够良好地维持所赋予的形状。
[0066]
也可以在将丝心蛋白纤维70卷绕在芯材75上之前,预先用水润湿丝心蛋白纤维70。通过预先用水润湿丝心蛋白纤维70,保持在沿着预定形状的状态下的丝心蛋白纤维70具有因吸湿而难以膨润的倾向。当抑制丝心蛋白纤维70的膨润时,能够更容易地赋予丝心蛋白纤维70以预定形状。例如,也可以通过将丝心蛋白纤维70浸渍在水或水溶液中,或者使包含丝心蛋白纤维70的多个单丝在内的纤维束含浸水或水溶液,以使丝心蛋白纤维70与水或水溶液接触。丝心蛋白纤维70不一定需要与纯水接触,也可以使丝心蛋白纤维70与添加成分或包含微量的不可避免的杂质的水溶液接触。以水溶液整体的质量为基准,与丝心蛋白纤维70接触的水溶液中的水以外的成分的浓度可以为1质量%以下、0.5质量%以下、或者小于0.05质量%。
[0067]
与丝心蛋白纤维70接触的水或水溶液的温度并没有特别限制,例如可以为10~80℃。浸渍或含浸的时间并没有特别限制,例如可以为5~60分钟。浸渍后的丝心蛋白纤维70在维持用水润湿的状态的期间,卷绕在芯材75上。只要丝心蛋白纤维70的表面用水润湿即可,也可以去除过多的水分。
[0068]
用水润湿后卷绕在芯材75上的丝心蛋白纤维70也可以在预定的加热温度下进行加热。加热温度可以为40℃以上、45℃以上、或者50℃以上,也可以为150℃以下、140℃以下、130℃以下、120℃以下、110℃以下、或者小于100℃。为了加热,也可以将热风吹到丝心蛋白纤维70上。当加热温度高时,所赋予的形状的保持性具有进一步提高的倾向。
[0069]
也可以将卷绕在芯材75上的丝心蛋白纤维70在润湿状态下放置在加热环境下、浸渍在加热到预定温度以上的水中、或者通过与水蒸气接触来加热。通过与水蒸气的接触,可以将丝心蛋白纤维70加热到超过100℃的温度。在将卷绕在芯材75上的丝心蛋白纤维70浸渍在加热的水中或暴露在水蒸气中的情况下,由于在此时间点丝心蛋白纤维70用水润湿,因此也可以不必预先用水润湿卷绕在芯材75上的丝心蛋白纤维70。
[0070]
对一边保持卷绕在芯材75上的丝心蛋白纤维70一边加热的时间进行调整,以赋予丝心蛋白纤维70形状。保持时间可以为5分钟以上、或者10分钟以上,也可以为240分钟以下、180分钟以下、或者120分钟以下。
[0071]
在该状态下对卷绕在芯材75上的丝心蛋白纤维70进行保持的期间,在经过润湿状态下的加热工序后,不需要维持用水润湿的状态,也可以最终处于干燥状态。也可以将卷绕在芯材75上的丝心蛋白纤维70或从芯材75取下的丝心蛋白纤维70用加热等任意方式进行干燥。
[0072]
可以将赋予其以预定形状或卷曲形状的丝心蛋白纤维70用作构成人造毛发的人造毛发用纤维。可以稳定地供给由丝心蛋白纤维构成的人造毛发用纤维,并且可以抑制其与人发之间产生不适感。人造毛发例如可以用作假头套用毛发、假发用毛发、直接戴在头部的增发用毛发、或者接发用毛发。
[0073]
(丝心蛋白纤维)
[0074]
丝心蛋白纤维70可以是以改造丝心蛋白为主要成分并且通过对改造丝心蛋白进行纺丝以形成的纤维。卷绕在芯材75上的丝心蛋白纤维70也可以是纺丝后不与液体水直接
接触的纤维。
[0075]
丝心蛋白纤维70可以是单丝,也可以是由多条单丝构成的纤维束。丝心蛋白纤维70的直径(单丝直径)例如可以为10~100μm。从赋予形状的难易度以及维持所赋予的形状的观点出发,丝心蛋白纤维70的单丝直径可以大于30μm,也可以为35μm以上、40μm以上、50μm以上、60μm以上、70μm以上、或者80μm以上。从同样的观点出发,丝心蛋白纤维70的单丝直径可以为90μm以下、85μm以下、小于80μm、或者70μm以下。
[0076]
在本说明书中,“改造丝心蛋白”是指人工制造的丝心蛋白(人造丝心蛋白)。改造丝心蛋白可以是其结构域序列与天然来源的丝心蛋白的氨基酸序列不同的丝心蛋白,也可以是与天然来源的丝心蛋白的氨基酸序列相同的丝心蛋白。
[0077]
改造丝心蛋白可以是包含式1:[(a)
n
基序
‑
rep]
m
或式2:[(a)
n
基序
‑
rep]
m
‑
(a)
n
基序所表示的结构域序列的蛋白质。可以在改造丝心蛋白的结构域序列的n末端侧和c末端侧中的任意一个末端侧或两个末端侧进一步附加有氨基酸序列(n末端序列和c末端序列)。n末端序列及c末端序列并不限定于此,典型地不具有丝心蛋白中的特征性的氨基酸基序的重复的区域,并且由100个残基左右的氨基酸构成。
[0078]“改造丝心蛋白”可以是直接利用天然来源的丝心蛋白的氨基酸序列的丝心蛋白,也可以是依据天然来源的丝心蛋白的氨基酸序列来改造该氨基酸序列的丝心蛋白(例如,通过对克隆出的天然来源的丝心蛋白的基因序列进行改造来改造氨基酸序列而得到的丝心蛋白),另外也可以为不依赖于天然来源的丝心蛋白而人工设计和合成的丝心蛋白(例如,通过对编码所设计的氨基酸序列的核酸进行化学合成而具有所期望的氨基酸序列的丝心蛋白)。
[0079]
在本说明书中,所谓“结构域序列”,为生成丝心蛋白特有的结晶区域(典型地,相当于氨基酸序列的(a)
n
基序)和非晶区域(典型地,相当于氨基酸序列的rep)的氨基酸序列,并且是指式1:[(a)
n
基序
‑
rep]
m
、或式2:[(a)
n
基序
‑
rep]
m
‑
(a)
n
基序所示的氨基酸序列。在此,(a)
n
基序表示以丙氨酸残基为主的氨基酸序列,并且氨基酸残基数为2~27。(a)
n
基序的氨基酸残基数可以为2~20、4~27、4~20、8~20、10~20、4~16、8~16或10~16的整数。此外,(a)
n
基序中的丙氨酸残基数相对于氨基酸残基总数的比例只要为40%以上即可,可以为60%以上、70%以上、80%以上、83%以上、85%以上、86%以上、90%以上、95%以上或100%。在结构域序列中存在的多个(a)
n
基序中的至少7个可以仅由丙氨酸残基构成。rep表示由2~200个氨基酸残基构成的氨基酸序列。rep可以是由10~200个氨基酸残基构成的氨基酸序列。m表示2~300的整数,并且可以为10~300的整数。两个以上存在的(a)
n
基序彼此可以为相同的氨基酸序列,也可以为不同的氨基酸序列。存在的多个rep可以是彼此相同的氨基酸序列,也可以是彼此不同的氨基酸序列。
[0080]
本实施方式所涉及的改造丝心蛋白例如可以通过对克隆出的天然来源的丝心蛋白的基因序列进行例如与置换、缺失、插入及/或添加一个或多个氨基酸残基相当的氨基酸序列的改造而得到的改造丝心蛋白。氨基酸残基的置换、缺失、插入及/或添加可以通过定点突变方法等本领域技术人员熟知的方法来进行。具体而言,可以根据nucleic acid res.10,6487(1982)、methods in enzymology,100,448(1983)等文献中记载的方法来进行。
[0081]
天然来源的丝心蛋白是包含式1:[(a)
n
基序
‑
rep]
m
、或者式2:[(a)
n
基序
‑
rep]
m
‑
ampullate silk protein 2[nephila clavipes](genbank登录号aac14591.1(氨基酸序列))、minor ampullate spidroin
‑
like protein[nephilengys cruentata](genbank登录号abr37278.1(氨基酸序列)。
[0086]
作为天然来源的丝心蛋白的更具体的示例,可以进一步列举在ncbi genbank中登记了序列信息的丝心蛋白。例如,可以通过从ncbi genbank中登记的序列信息中包含inv作为分类码(division)的序列中提取出在定义(definition)中记载了蛛丝蛋白、壶状腺、丝心蛋白、"丝和多肽"或"丝和蛋白质"作为关键词的序列、从cds中提取出指定产物的字符串、从来源(source)中提取出在组织类型(tissue type)中记载了指定字符串的序列来确认。
[0087]
本实施方式所涉及的改造丝心蛋白可以是改造蚕丝(丝绸)丝心蛋白(改造了蚕所产生的蚕丝蛋白的氨基酸序列的丝心蛋白),也可以是改造蜘蛛丝丝心蛋白(改造了蜘蛛类所产生的蛛丝蛋白的氨基酸序列的丝心蛋白)。改造丝心蛋白可以是改造蜘蛛丝丝心蛋白。
[0088]
作为改造丝心蛋白的具体实施例,可以列举出来自于蜘蛛的大壶状腺所产生的大吐丝管牵引丝蛋白的改造丝心蛋白(第1改造丝心蛋白)、具有降低了甘氨酸残基含量的结构域序列的改造丝心蛋白(第2改造丝心蛋白)、具有降低了(a)
n
基序含量的结构域序列的改造丝心蛋白(第3改造丝心蛋白)、降低了甘氨酸残基的含量及(a)
n
基序的含量的改造丝心蛋白(第4改造丝心蛋白)、具有局部包含疏水性指标大的区域的结构域序列的改造丝心蛋白(第5改造丝心蛋白)、及具有降低了谷氨酰胺残基的含量的结构域序列的改造丝心蛋白(第6改造丝心蛋白)。
[0089]
作为第1改造丝心蛋白可以例举包含式1:[(a)
n
基序
‑
rep]
m
所示的结构域序列的蛋白质。在第1改造丝心蛋白中,(a)
n
基序的氨基酸残基数可以为3~20、4~20、8~20、10~20、4~16、8~16或10~16。第1改造丝心蛋白在式1中构成rep的氨基酸残基的数量可以为10~200个残基、10~150个残基、20~100个残基、或者20~75个残基。在第1改造丝心蛋白中,式1:[(a)
n
基序
‑
rep]
m
所示的氨基酸序列所含的甘氨酸残基、丝氨酸残基及丙氨酸残基的合计残基数相对于氨基酸残基总数可以为40%以上、60%以上或者70%以上。
[0090]
第1改造丝心蛋白可以为以下这种多肽:包含式1:[(a)
n
基序
‑
rep]
m
所示的氨基酸序列的单元,并且c末端序列为序列号1~3中任意一个所示的氨基酸序列、或与序列号1~3中任意一个所示的氨基酸序列具有90%以上的同源性的氨基酸序列。
[0091]
序列号1所示的氨基酸序列与由adf3(gi:1263287、ncbi)的氨基酸序列的c末端的50个残基的氨基酸构成的氨基酸序列相同,序列号2所示的氨基酸序列与从序列号1所示的氨基酸序列的c末端除去20个残基后的氨基酸序列相同,序列号3所示的氨基酸序列与从序列号1所示的氨基酸序列的c末端除去29个残基后的氨基酸序列相同。
[0092]
作为第1改造丝心蛋白的更具体的例子,可以列举出包括与(1
‑
i)序列号4(recombinant spider silk protein adf3kailargenrsh1)所示的氨基酸序列、或者(1
‑
ii)序列号4所示的氨基酸序列具有90%以上的序列一致性的氨基酸序列的改造丝心蛋白。序列一致性可以为95%以上。
[0093]
序列号4所示的氨基酸序列为在n末端添加有由起始密码子、his10标签及hrv3c蛋白酶(human rhinovirus 3c蛋白酶)识别位点构成的氨基酸序列(序列号5)的adf3的氨基酸序列中,以使第1~13位的重复区域增加为约2倍、并且在第1154位氨基酸残基处终止翻
译的方式突变后得到。序列号4所示的氨基酸序列的c末端的氨基酸序列与序列号3所示的氨基酸序列相同。
[0094]
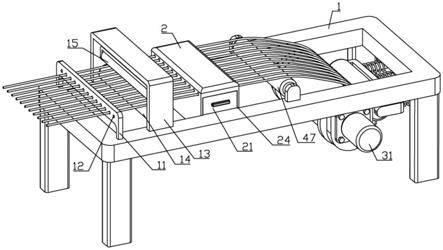
(1
‑
i)的改造丝心蛋白可以由序列号4所示的氨基酸序列构成。
[0095]
第2改造丝心蛋白具有其结构域序列与天然来源的丝心蛋白相比甘氨酸残基的含量降低的氨基酸序列。第2改造丝心蛋白与天然来源的丝心蛋白相比,可以具有与至少rep中的一个或多个甘氨酸残基被置换为其他氨基酸残基相当的氨基酸序列。
[0096]
第2改造丝心蛋白的结构域序列与天然来源的丝心蛋白相比,在rep中的选自ggx及gpgxx(其中,g表示甘氨酸残基,p表示脯氨酸残基,x表示甘氨酸以外的氨基酸残基)中的至少一种基序序列中,可以具有相当于至少一个或多个该基序序列中的一个甘氨酸残基被置换为其他氨基酸残基的氨基酸序列。
[0097]
第2改造丝心蛋白中,上述甘氨酸残基被置换为其他氨基酸残基的基序序列的比例相对于全部基序序列可以为10%以上。
[0098]
第2改造丝心蛋白包括式1:[(a)
n
基序
‑
rep]
m
所示的结构域序列并且可以具有下述氨基酸序列:当将从上述结构域序列中除去自位于最靠c末端侧的(a)
n
基序至上述结构域序列的c末端为止的序列后得到的序列中的全部rep所包含的由xgx(其中,x表示甘氨酸以外的氨基酸残基)构成的氨基酸序列的氨基酸残基总数设为z、并且将从上述结构域序列中除去自位于最靠c末端侧的(a)
n
基序至上述结构域序列的c末端为止的序列后得到的序列中的氨基酸残基总数设为w时,z/w为30%以上、40%以上、50%以上或50.9%以上。(a)
n
基序中的丙氨酸残基数相对于氨基酸残基总数可以为83%以上、86%以上、90%以上、95%以上或100%。丙氨酸残基数相对于总氨基酸残基数为100%,意味着(a)
n
基序仅由丙氨酸残基构成。
[0099]
第2改造丝心蛋白可以通过将ggx基序中的一个甘氨酸残基置换为其他氨基酸残基来提高由xgx构成的氨基酸序列的含有比例。在第2改造丝心蛋白中,由结构域序列中的ggx构成的氨基酸序列的含有比例可以为30%以下、20%以下、10%以下、6%以下、4%以下、或者2%以下。结构域序列中的由ggx构成的氨基酸序列的含有比例可以通过与下述的由xgx构成的氨基酸序列的含有比例(z/w)的计算方法相同的方法来计算。
[0100]
对z/w的计算方法进一步进行详细说明。首先,在包含式1:[(a)
n
基序
‑
rep]
m
所示的结构域序列的丝心蛋白(改造丝心蛋白或天然来源的丝心蛋白)中,从结构域序列中除去自位于最靠c末端侧的(a)
n
基序至结构域序列的c末端为止的序列后得到的序列所含的全部rep中,提取由xgx构成的氨基酸序列。构成xgx的氨基酸残基的总数为z。例如,当提取了50个由xgx构成的氨基酸序列时(没有重复),z为50
×
3=150。例如,如由xgxgx构成的氨基酸序列的情况那样,当包含在2个xgx中的x(中间的x)存在时,通过扣除重复部分来进行计算(当为xgxgx时,为5个氨基酸残基)。w为从结构域序列中除去自位于最靠c末端侧的(a)
n
基序至结构域序列的c末端为止的序列后得到的序列所含的氨基酸残基总数。例如,当为图2所示的结构域序列时,w为4 50 4 100 4 10 4 20 4 30=230(除去位于最靠c末端侧的(a)
n
基序)。然后,通过将z除以w,可以计算出z/w(%)。
[0101]
这里,对天然来源的丝心蛋白中的z/w进行说明。首先,如上所述,通过例示在ncbi genbank中登记有氨基酸序列信息的丝心蛋白的方法进行确认,提取出663种丝心蛋白(其中,来源于蜘蛛类的丝心蛋白为415种)。在所提取的所有丝心蛋白中,从包含式1:[(a)
n
基
序
‑
rep]
m
所表示的结构域序列且由丝心蛋白中的ggx构成的氨基酸序列的含有比例为6%以下的天然来源的丝心蛋白的氨基酸序列中,根据上述计算方法,计算出z/w。由其结果可确认,天然来源的丝心蛋白中的z/w均小于50.9%,最大为50.86%。
[0102]
在第2改造丝心蛋白中,z/w可以为50.9%以上、56.1%以上、58.7%以上、70%以上、或者80%以上。z/w的上限并没有特别限制,例如可以为95%以下。
[0103]
例如可以通过如下方式进行改造而获得第2改造丝心蛋白:从克隆出的天然来源的丝心蛋白的基因序列中,对编码甘氨酸残基的碱基序列的至少一部分进行置换并使其编码其他氨基酸残基。此时,作为改造的甘氨酸残基,可以选择ggx基序及gpgxx基序中的一个甘氨酸残基、另外也可以用将z/w设定为50.9%以上的方式进行置换。此外,例如,也可以通过根据天然来源的丝心蛋白的氨基酸序列设计满足上述方式的氨基酸序列,并通过对编码所设计的氨基酸序列的核酸进行化学合成后得到。在任何一种情况下,除了与在从天然来源的丝心蛋白的氨基酸序列中将rep中的甘氨酸残基置换为其他氨基酸残基相当的改造之外,还可以进一步进行与置换、缺失、插入及/或添加一个或多个氨基酸残基相当的氨基酸序列的改造。
[0104]
作为上述的其他氨基酸残基,只要是除甘氨酸残基以外的氨基酸残基即可,并没有特别限制,可以是缬氨酸(v)残基、亮氨酸(l)残基、异亮氨酸(i)残基、蛋氨酸(m)残基、脯氨酸(p)残基、苯丙氨酸(f)残基及色氨酸(w)残基等疏水性氨基酸残基、谷氨酰胺(q)残基、天冬酰胺(n)残基、丝氨酸(s)残基、赖氨酸(k)残基及谷氨酸(e)残基等亲水性氨基酸残基。其他氨基酸残基可以选自缬氨酸(v)残基、亮氨酸(l)残基、异亮氨酸(i)残基、苯丙氨酸(f)残基和谷氨酰胺(q)残基,也可以是谷氨酰胺(q)残基。
[0105]
作为第2改造丝心蛋白的更具体的例子,可以列举出包括与(2
‑
i)序列号6(met
‑
prt380)、序列号7(met
‑
prt410)、序列号8(met
‑
prt525)或序列号9(met
‑
prt799)所示的氨基酸序列、或者(2
‑
ii)序列号6、序列号7、序列号8或序列号9所示的氨基酸序列具有90%以上的序列一致性的氨基酸序列的改造丝心蛋白。
[0106]
对(2
‑
i)的改造丝心蛋白进行说明。序列号6所表示的氨基酸序列是将相当于天然来源的丝心蛋白的序列号10(met
‑
prt313)所表示的氨基酸序列的rep中的ggx全部置换为gqx而得到的氨基酸序列。序列号7所示的氨基酸序列通过在序列号6所示的氨基酸序列中从n末端侧向c末端侧使(a)
n
基序每隔2个发生缺失,并进一步在c末端序列的近前插入一个[(a)
n
基序
‑
rep]而得到。序列号8所示的氨基酸序列在序列号7所示的氨基酸序列的各个(a)
n
基序的c末端侧插入2个丙氨酸残基,进一步将部分谷氨酰胺(q)残基置换为丝氨酸(s)残基、并且使c末端侧的部分氨基酸缺失以使得其与序列号7的分子量几乎相同。序列号9所示的氨基酸序列在将序列号7所示的氨基酸序列中存在的20个结构域序列的区域(其中,该区域的c末端侧的数个氨基酸残基被置换)重复4次后的序列的c末端中添加预定的铰链序列和his标签序列。
[0107]
序列号10所示的氨基酸序列(相当于天然来源的丝心蛋白)中的z/w的值为46.8%。序列号6所示的氨基酸序列、序列号7所示的氨基酸序列、序列号8所示的氨基酸序列及序列号9所示的氨基酸序列中的z/w的值分别为58.7%、70.1%、66.1%及70.0%。此外,序列号10、序列号6、序列号7、序列号8及序列号9所示的氨基酸序列的锯齿比率(在下文中说明)为1:1.8~11.3的x/y的值分别为15.0%、15.0%、93.4%、92.7%及89.8%。
[0108]
(2
‑
i)的改造丝心蛋白可以由序列号6、序列号7、序列号8或序列号9所示的氨基酸序列构成。
[0109]
(2
‑
ii)的改造丝心蛋白包括与序列号6、序列号7、序列号8或序列号9所示的氨基酸序列具有90%以上的序列一致性的氨基酸序列。(2
‑
ii)的改造丝心蛋白也为包含式1:[(a)
n
基序
‑
rep]
m
所示的结构域序列的蛋白质。上述序列一致性可以为95%以上。
[0110]
(2
‑
ii)的改造丝心蛋白与序列号6、序列号7、序列号8或序列号9所示的氨基酸序列具有90%以上的序列一致性,并且当将rep中所含的由xgx(其中,x表示甘氨酸以外的氨基酸残基)构成的氨基酸序列的氨基酸残基总数设为z、将上述结构域序列中的rep的氨基酸残基总数设为w时,z/w可以为50.9%以上。
[0111]
第2改造丝心蛋白可以在n末端及c末端中的任意一端或两端包含标签序列。由此,可以实现改造丝心蛋白的分离、固定、检测及可视化等。
[0112]
作为标签序列,例如,可以列举出利用了与其他分子的特异性亲和性(结合性、亲和性)的亲和性标签。作为亲和性标签的具体实施例,可以列举出组氨酸标签(his标签)。his标签是由4至10个左右的组氨酸残基排列而成的短肽,具有与镍等的金属离子特异性结合的性质,因此可以用于通过金属螯合层析(chelating metal chromatography)进行的改造丝心蛋白的分离。作为标签序列的具体实施例,例如,可以列举出序列号11所示的氨基酸序列(包含his标签序列及铰链序列的氨基酸序列)。
[0113]
也可以利用与谷胱甘肽特异性结合的谷胱甘肽
‑
s
‑
转移酶(gst)、与麦芽糖特异性结合的麦芽糖结合蛋白(mbp)等标签序列。
[0114]
还可以使用利用了抗原抗体反应的“表位标签”。通过添加用于显示抗原性的肽(表位)作为标签序列,可以结合针对该表位的抗体。作为表位标签,可以列举出ha(流感病毒血凝素的肽序列)标签、myc标签、flag标签等。通过利用表位标签,可以很容易地以高特异性对改造丝心蛋白进行纯化。
[0115]
也可以使用利用特定的蛋白酶将标签序列切除而得到的标签。也可以通过对经由该标签序列吸附的蛋白质进行蛋白酶处理,来回收切除标签序列后的改造丝心蛋白。
[0116]
作为含有标签序列的改造丝心蛋白的更具体的例子,可以列举出包括与(2
‑
iii)序列号12(prt380)、序列号13(prt410)、序列号14(prt525)或序列号15(prt799)所示的氨基酸序列、或者(2
‑
iv)序列号12、序列号13、序列号14或序列号15所示的氨基酸序列具有90%以上的序列一致性的氨基酸序列的改造丝心蛋白。
[0117]
序列号16(prt313)、序列号12、序列号13、序列号14及序列号15所示的氨基酸序列分别在序列号10、序列号6、序列号7、序列号8及序列号9所示的氨基酸序列的n末端添加序列号11所示的氨基酸序列(包含his标签序列及铰链序列)。
[0118]
(2
‑
iii)的改造丝心蛋白可以由序列号12、序列号13、序列号14或序列号15所示的氨基酸序列构成。
[0119]
(2
‑
iv)的改造丝心蛋白包括与序列号12、序列号13、序列号14或序列号15所示的氨基酸序列具有90%以上的序列一致性的氨基酸序列。(2
‑
iv)的改造丝心蛋白也为包含式1:[(a)
n
基序
‑
rep]
m
所示的结构域序列的蛋白质。上述序列一致性可以为95%以上。
[0120]
(2
‑
iv)的改造丝心蛋白与序列号12、序列号13、序列号14或序列号15所示的氨基酸序列具有90%以上的序列一致性,并且当将rep中所含的由xgx(其中,x表示甘氨酸以外
的氨基酸残基)构成的氨基酸序列的氨基酸残基总数设为z、将上述结构域序列中的rep的氨基酸残基总数设为w时,z/w可以为50.9%以上。
[0121]
第2改造丝心蛋白可以含有用于将重组蛋白生产系统所生产的蛋白质释放到宿主外部的分泌信号。分泌信号的序列可以根据宿主的种类来进行适当设定。
[0122]
第3改造丝心蛋白具有其结构域序列与天然来源的丝心蛋白相比(a)
n
基序的含量降低的氨基酸序列。第3改造丝心蛋白的结构域序列与天然来源的丝心蛋白相比,具有相当于缺失了至少一个或多个(a)
n
基序的氨基酸序列。
[0123]
第3改造丝心蛋白可以具有相当于从天然来源的丝心蛋白中缺失了10~40%的(a)
n
基序的氨基酸序列。
[0124]
第3改造丝心蛋白的结构域序列与天然来源的丝心蛋白相比,其可以至少从n末端侧向c末端侧具有相当于每1~3个(a)
n
基序中缺失一个(a)
n
基序的氨基酸序列。
[0125]
第3改造丝心蛋白的结构域序列与天然来源的丝心蛋白相比,其可以至少从n末端侧向c末端侧具有相当于依次重复发生了2个连续的(a)
n
基序的缺失及一个(a)
n
基序的缺失的氨基酸序列。
[0126]
第3改造丝心蛋白的结构域序列可以至少从n末端侧向c末端侧具有相当于每隔2个发生一次缺失(a)
n
基序的氨基酸序列。
[0127]
第3改造丝心蛋白包括式1:[(a)
n
基序
‑
rep]
m
所示的结构域序列并且可以具有下述氨基酸序列:从n末端侧向c末端侧依次比较相邻的2个[(a)
n
基序
‑
rep]单元的rep的氨基酸残基数,将氨基酸残基数少的rep的氨基酸残基数设为1时,并且将另一个rep的氨基酸残基数的比为1.8~11.3的相邻的2个[(a)
n
基序
‑
rep]单元的氨基酸残基数相加而得到的合计值的最大值设为x、将结构域序列的氨基酸残基总数设为y时,x/y为20%以上、30%以上、40%以上或50%以上。(a)
n
基序中的丙氨酸残基数相对于氨基酸残基总数可以为83%以上、86%以上、90%以上、95%以上或100%。丙氨酸残基数相对于总氨基酸残基数为100%,意味着(a)
n
基序仅由丙氨酸残基构成。
[0128]
参照图2进一步地详细说明x/y的计算方法。图2示出了从改造丝心蛋白中除去n末端序列及c末端序列后的结构域序列。该结构域序列从n末端侧(左侧)起具有(a)
n
基序
‑
第1rep(50个氨基酸残基)
‑
(a)
n
基序
‑
第2rep(100个氨基酸残基)
‑
(a)
n
基序
‑
第3rep(10个氨基酸残基)
‑
(a)
n
基序
‑
第4rep(20个氨基酸残基)
‑
(a)
n
基序
‑
第5rep(30个氨基酸残基)
‑
(a)
n
基序的序列。
[0129]
以不重复的方式从n末端侧向c末端侧依次选择相邻的2个[(a)
n
基序
‑
rep]单元。此时,也可以存在未被选择的[(a)
n
基序
‑
rep]单元。图2示出了模式1(第1rep与第2rep的比较、以及第3rep与第4rep的比较)、模式2(第1rep与第2rep的比较、以及第4rep与第5rep的比较)、模式3(第2rep与第3rep的比较、以及第4rep与第5rep的比较)、模式4(第1rep与第2rep的比较)。另外,除此之外还存在选择方法。
[0130]
接下来,对于各模式,比较所选择的相邻的2个[(a)
n
基序
‑
rep]单元中的各rep的氨基酸残基数。通过求出将氨基酸残基数相对较少的一方设为1时的另一方的氨基酸残基数的比来进行比较。例如,在比较第1rep(50个氨基酸残基)和第2rep(100个氨基酸残基)的情况下,当将氨基酸残基数相对较少的第1rep设为1时,第2rep的氨基酸残基数的比为100/50=2。同样地,在比较第4rep(20个氨基酸残基)和第5rep(30个氨基酸残基)的情况下,当
将氨基酸残基数相对较少的第4rep设为1时,第5rep的氨基酸残基数的比为30/20=1.5。
[0131]
图2中,用实线表示当将氨基酸残基数相对较少的一方设为1时,另一方的氨基酸残基数的比为1.8~11.3的[(a)
n
基序
‑
rep]单元的组。在本说明书中,将该比率称为锯齿比率。用虚线表示当将氨基酸残基数相对较少的一方设为1时,另一方的氨基酸残基数的比小于1.8或大于11.3的[(a)
n
基序
‑
rep]单元的组。
[0132]
在各个模式中,将实线所示的相邻的2个[(a)
n
基序
‑
rep]单元的所有氨基酸残基数相加(不仅仅是rep,也是(a)
n
基序的氨基酸残基数。)。将相加后的合计值进行比较,并将该合计值最大的模式的合计值(合计值的最大值)设为x。在图2所示的例子中,模式1的合计值最大。
[0133]
接下来,可以通过将x除以结构域序列的氨基酸残基总数y来计算出x/y(%)。
[0134]
在第3改造丝心蛋白中,x/y可以为50%以上、60%以上、65%以上、70%以上、75%以上、或者80%以上。x/y的上限并没有特别限制,例如x/y可以为100%以下。锯齿比率可以为1:1.9~11.3,x/y可以为89.6%以上。锯齿比率可以为1:1.8~3.4,x/y可以为77.1%以上。锯齿比率可以为1:1.9~8.4,x/y可以为75.9%以上。锯齿比率可以为1:1.9~4.1,x/y可以为64.2%以上。
[0135]
当第3改造丝心蛋白为存在于结构域序列中的多个(a)
n
基序中的至少7个仅由丙氨酸残基构成的改造丝心蛋白的情况下,x/y可以为46.4%以上、50%以上、55%以上、60%以上、70%以上、或者80%以上。x/y的上限并没有特别限制,为100%以下即可。
[0136]
这里,对天然来源的丝心蛋白中的x/y进行说明。首先,如上所述,通过例示在ncbi genbank中登记有氨基酸序列信息的丝心蛋白的方法进行确认,提取出663种丝心蛋白(其中,来源于蜘蛛类的丝心蛋白为415种)。在所提取的所有丝心蛋白中,从由式1:[(a)
n
基序
‑
rep]
m
所表示的结构域序列构成的天然来源的丝心蛋白的氨基酸序列中,根据上述计算方法,计算出x/y。由其结果可知,天然来源的丝心蛋白中的x/y均小于64.2%,最大为64.14%。
[0137]
例如可以通过从克隆出的天然来源的丝心蛋白的基因序列中,以将x/y设为64.2%以上的方式使编码(a)
n
基序的序列中的一个或多个缺失,从而得到第3改造丝心蛋白。此外,例如也可以通过设计出相当于从天然来源的丝心蛋白的氨基酸序列中,以将x/y设为64.2%以上的方式使一个或多个(a)
n
基序发生缺失的氨基酸序列,并且对编码所设计的氨基酸序列的核酸进行化学合成后得到。在任何情况下,除了与在从天然来源的丝心蛋白的氨基酸序列中缺失(a)
n
基序相当的改造之外,还可以进一步进行与置换、缺失、插入及/或添加一个或多个氨基酸残基相当的氨基酸序列的改造。
[0138]
作为第3改造丝心蛋白的更具体的例子,可以列举出包括与(3
‑
i)序列号17(met
‑
prt399)、序列号7(met
‑
prt410)、序列号8(met
‑
prt525)或序列号9(met
‑
prt799)所示的氨基酸序列、或者(3
‑
ii)序列号17、序列号7、序列号8或序列号9所示的氨基酸序列具有90%以上的序列一致性的氨基酸序列的改造丝心蛋白。
[0139]
对(3
‑
i)的改造丝心蛋白进行说明。序列号17所示的氨基酸序列通过在相当于天然来源的丝心蛋白的序列号10(met
‑
prt313)所示的氨基酸序列中从n末端侧向c末端侧使(a)
n
基序每隔2个发生缺失,并进一步在c末端序列的近前插入一个[(a)
n
基序
‑
rep]而得到。序列号7、序列号8或序列号9所示的氨基酸序列如第2改造丝心蛋白中所说明的那样。
[0140]
序列号10所示的氨基酸序列(相当于天然来源的丝心蛋白)的锯齿比率为1:1.8~11.3中的x/y的值为15.0%。序列号17所示的氨基酸序列及序列号7所示的氨基酸序列中的x/y的值均为93.4%。序列号8所示的氨基酸序列中的x/y的值为92.7%。序列号9所示的氨基酸序列中的x/y的值为89.8%。序列号10、序列号17、序列号7、序列号8及序列号9所示的氨基酸序列中的z/w的值分别为46.8%、56.2%、70.1%、66.1%及70.0%。
[0141]
(3
‑
i)的改造丝心蛋白可以由序列号17、序列号7、序列号8或序列号9所示的氨基酸序列构成。
[0142]
(3
‑
ii)的改造丝心蛋白包括与序列号17、序列号7、序列号8或序列号9所示的氨基酸序列具有90%以上的序列一致性的氨基酸序列。(3
‑
ii)的改造丝心蛋白也为包含式1:[(a)
n
基序
‑
rep]
m
所示的结构域序列的蛋白质。上述序列一致性可以为95%以上。
[0143]
(3
‑
ii)的改造丝心蛋白与序列号17、序列号7、序列号8或序列号9所示的氨基酸序列具有90%以上的序列一致性,并且从n末端侧向c末端侧依次比较相邻的2个[(a)
n
基序
‑
rep]单元的rep的氨基酸残基数,将氨基酸残基数少的rep的氨基酸残基数设为1时,并且将另一个rep的氨基酸残基数的比为1.8~11.3(锯齿比率为1:1.8~11.3)的相邻的2个[(a)
n
基序
‑
rep]单元的氨基酸残基数相加而得到的合计值的最大值设为x、将结构域序列的氨基酸残基总数设为y时,x/y可以为64.2%以上。
[0144]
第3改造丝心蛋白可以在n末端及c末端中的任意一端或两端包含上述标签序列。
[0145]
作为含有标签序列的改造丝心蛋白的更具体的例子,可以列举出包括与(3
‑
iii)序列号18(prt399)、序列号13(prt410)、序列号14(prt525)或序列号15(prt799)所示的氨基酸序列、或者(3
‑
iv)序列号18、序列号13、序列号14或序列号15所示的氨基酸序列具有90%以上的序列一致性的氨基酸序列的改造丝心蛋白。
[0146]
序列号18、序列号13、序列号14及序列号15所示的氨基酸序列分别在序列号17、序列号7、序列号8及序列号9所示的氨基酸序列的n末端添加序列号11所示的氨基酸序列(包含his标签序列及铰链序列)。
[0147]
(3
‑
iii)的改造丝心蛋白可以由序列号18、序列号13、序列号14或序列号15所示的氨基酸序列构成。
[0148]
(3
‑
iv)的改造丝心蛋白包括与序列号18、序列号13、序列号14或序列号15所示的氨基酸序列具有90%以上的序列一致性的氨基酸序列。(3
‑
iv)的改造丝心蛋白也为包含式1:[(a)
n
基序
‑
rep]
m
所示的结构域序列的蛋白质。上述序列一致性可以为95%以上。
[0149]
(3
‑
iv)的改造丝心蛋白与序列号18、序列号13、序列号14或序列号15所示的氨基酸序列具有90%以上的序列一致性,并且从n末端侧向c末端侧依次比较相邻的2个[(a)
n
基序
‑
rep]单元的rep的氨基酸残基数,将氨基酸残基数少的rep的氨基酸残基数设为1时,并且将另一个rep的氨基酸残基数的比为1.8~11.3的相邻的2个[(a)
n
基序
‑
rep]单元的氨基酸残基数相加而得到的合计值的最大值设为x、将结构域序列的氨基酸残基总数设为y时,x/y可以为64.2%以上。
[0150]
第3改造丝心蛋白可以含有用于将重组蛋白生产系统所生产的蛋白质释放到宿主外部的分泌信号。分泌信号的序列可以根据宿主的种类来进行适当设定。
[0151]
第4改造丝心蛋白是其结构域序列与天然来源的丝心蛋白相比,除了降低(a)
n
基序的含量之外,还具有降低甘氨酸残基含量的氨基酸序列的丝心蛋白。第4改造丝心蛋白的
a protein
″
,j.mol.biol.,157,pp.105
‑
132)。具体而言,各氨基酸的疏水性指标(亲水指数,以下也记为
″
hi
″
)如下述表1所示。
[0160]
[表1]
[0161]
氨基酸hi氨基酸hi异亮氨酸(ile)4.5色氨酸(trp)
‑
0.9缬氨酸(val)4.2酪氨酸(tyr)
‑
1.3亮氨酸(leu)3.8脯氨酸(pro)
‑
1.6苯丙氨酸(phe)2.8组氨酸(his)
‑
3.2半胱氨酸(cys)2.5天冬酰胺(asn)
‑
3.5蛋氨酸(met)1.9天冬氨酸(asp)
‑
3.5丙氨酸(ala)1.8谷氨酰胺(gln)
‑
3.5甘氨酸(gly)
‑
0.4谷氨酸(glu)
‑
3.5苏氨酸(thr)
‑
0.7赖氨酸(lys)
‑
3.9丝氨酸(ser)
‑
0.8精氨酸(arg)
‑
4.5
[0162]
对p/q的计算方法进一步进行详细说明。在计算中,使用从式1:[(a)
n
基序
‑
rep]
m
所示的结构域序列中除去自位于最靠c末端侧的(a)
n
基序至结构域序列的c末端为止的序列后得到的序列(以下称为
″
序列a
″
)。首先,在序列a所包含的所有rep中,计算连续的4个氨基酸残基的疏水性指标的平均值。疏水性指标的平均值是通过将连续的4个氨基酸残基中所含有的各氨基酸残基的hi的总和除以4(氨基酸残基数)而求出的。疏水性指标的平均值是针对所有连续的4个氨基酸残基而求出的(各氨基酸残基用于1~4次平均值的计算)。接下来,确定连续的4个氨基酸残基的疏水性指标的平均值为2.6以上的区域。即使某个氨基酸残基属于多个“疏水性指标的平均值为2.6以上的连续的4个氨基酸残基”的情况下,也会作为一个氨基酸残基包含在区域中。而且,该区域中所含的氨基酸残基的总数为p。此外,序列a中所含的氨基酸残基的总数为q。
[0163]
例如,当提取到20处“疏水性指标的平均值为2.6以上的连续的4个氨基酸残基”时(没有重复),在连续的4个氨基酸残基的疏水性指标的平均值为2.6以上的区域中含有20处连续的4个氨基酸残基(没有重复),p为20
×
4=80。例如,在2处“疏水性指标的平均值为2.6以上的连续的4个氨基酸残基”仅有一个氨基酸残基重复存在的情况下,在连续的4个氨基酸残基的疏水性指标的平均值为2.6以上的区域中,含有7个氨基酸残基(p=2
×4‑
1=7。
“‑
1”为重复部分的扣除)。例如,在图3所示的结构域序列的情况下,“疏水性指标的平均值为2.6以上的连续的4个氨基酸残基”不重复且存在7个,因此p为7
×
4=28。此外,例如当为图3所示的结构域序列时,q为4 50 4 40 4 10 4 20 4 30=170(不包含位于c末端侧最后的(a)
n
基序)。然后,通过将p除以q,可以计算出p/q(%)。在图3的情况下,28/170=16.47%。
[0164]
在第5改造丝心蛋白中,p/q可以为6.2%以上、7%以上、10%以上、20%以上、或者30%以上。p/q的上限并没有特别限制,例如可以为45%以下。
[0165]
例如,对于克隆出的天然来源的丝心蛋白的氨基酸序列,通过将rep中的一个或多个亲水性氨基酸残基(例如疏水性指标为负的氨基酸残基)置换为疏水性氨基酸残基(例如疏水性指标为正的氨基酸残基)、及/或在rep中插入一个或多个疏水性氨基酸残基,以使其满足上述p/q的条件,并且通过将其改造成局部含有疏水性指标大的区域的氨基酸序列,从
而得到第5改造丝心蛋白。此外,例如,也可以通过根据天然来源的丝心蛋白的氨基酸序列设计满足上述p/q的条件的氨基酸序列,并通过对编码所设计的氨基酸序列的核酸进行化学合成后得到。在任何情况下,与天然来源的丝心蛋白相比,除了进行相当于rep中的一个或多个氨基酸残基被置换为疏水性指标大的氨基酸残基、及/或在rep中插入一个或多个疏水性指标大的氨基酸残基的改造之外,还可以进一步进行相当于置换、缺失、插入及/或添加一个或多个氨基酸残基的改造。
[0166]
疏水性指标大的氨基酸残基并没有特别限制,可以选自异亮氨酸(i)、缬氨酸(v)、亮氨酸(l)、苯丙氨酸(f)、半胱氨酸(c)、蛋氨酸(m)及丙氨酸(a)。疏水性指标大的氨基酸残基可以选自缬氨酸(v)、亮氨酸(l)和异亮氨酸(i)。
[0167]
作为第5改造丝心蛋白的更具体的例子,可以列举出包括与(5
‑
i)序列号19(met
‑
prt720)、序列号20(met
‑
prt665)或序列号21(met
‑
prt666)所示的氨基酸序列、或者(5
‑
ii)序列号19、序列号20或序列号21所示的氨基酸序列具有90%以上的序列一致性的氨基酸序列的改造丝心蛋白。
[0168]
对(5
‑
i)的改造丝心蛋白进行说明。序列号19所示的氨基酸序列是相对于序列号7(met
‑
prt410)所示的氨基酸序列,除c末端侧的终端的结构域序列之外,每隔一个rep插入2处分别由3个氨基酸残基构成的氨基酸序列(vli),进而将一部分的谷氨酰胺(q)残基置换为丝氨酸(s)残基,并且使c末端侧的一部分氨基酸缺失的氨基酸序列。序列号20所示的氨基酸序列相对于序列号8(met
‑
prt525)所示的氨基酸序列,每隔一个rep插入1处分别由3个氨基酸残基构成的氨基酸序列(vli)。序列号21所示的氨基酸序列相对于序列号8所示的氨基酸序列,每隔一个rep插入2处分别由3个氨基酸残基构成的氨基酸序列(vli)。
[0169]
(5
‑
i)的改造丝心蛋白可以由序列号19、序列号20或序列号21所示的氨基酸序列构成。
[0170]
(5
‑
ii)的改造丝心蛋白包括与序列号19、序列号20或序列号21所示的氨基酸序列具有90%以上的序列一致性的氨基酸序列。(5
‑
ii)的改造丝心蛋白也为包含式1:[(a)
n
基序
‑
rep]
m
所示的结构域序列的蛋白质。上述序列一致性可以为95%以上。
[0171]
(5
‑
ii)的改造丝心蛋白与序列号19、序列号20或序列号21所示的氨基酸序列具有90%以上的序列一致性,并且从结构域序列中除去自位于最靠c末端侧的(a)
n
基序至结构域序列的c末端为止的序列后得到的序列所含的所有rep中,将连续的4个氨基酸残基的疏水性指标的平均值为2.6以上的区域所含的氨基酸残基的总数设为p、将从结构域序列中除去自位于最靠c末端侧的(a)
n
基序至结构域序列的c末端为止的序列后得到的序列所含的氨基酸残基的总数设为q时,p/q可以为6.2%以上。
[0172]
第5改造丝心蛋白可以在n末端及c末端中的任意一端或两端包含标签序列。
[0173]
作为含有标签序列的改造丝心蛋白的更具体的例子,可以列举出包括与(5
‑
iii)序列号22(prt720)、序列号23(prt665)或序列号24(prt666)所示的氨基酸序列、或者(5
‑
iv)序列号22、序列号23或序列号24所示的氨基酸序列具有90%以上的序列一致性的氨基酸序列的改造丝心蛋白。
[0174]
序列号22、序列号23及序列号24所示的氨基酸序列分别在序列号19、序列号20及序列号21所示的氨基酸序列的n末端添加序列号11所示的氨基酸序列(包含his标签序列及铰链序列)。
[0175]
(5
‑
iii)的改造丝心蛋白可以由序列号22、序列号23或序列号24所示的氨基酸序列构成。
[0176]
(5
‑
iv)的改造丝心蛋白包括与序列号22、序列号23或序列号24所示的氨基酸序列具有90%以上的序列一致性的氨基酸序列。(5
‑
iv)的改造丝心蛋白也为包含式1:[(a)
n
基序
‑
rep]
m
所示的结构域序列的蛋白质。上述序列一致性可以为95%以上。
[0177]
(5
‑
iv)的改造丝心蛋白与序列号22、序列号23或序列号24所示的氨基酸序列具有90%以上的序列一致性,并且从结构域序列中除去自位于最靠c末端侧的(a)
n
基序至结构域序列的c末端为止的序列后得到的序列所含的所有rep中,将连续的4个氨基酸残基的疏水性指标的平均值为2.6以上的区域所含的氨基酸残基的总数设为p、将从结构域序列中除去自位于最靠c末端侧的(a)
n
基序至结构域序列的c末端为止的序列后得到的序列所含的氨基酸残基的总数设为q时,p/q可以为6.2%以上。
[0178]
第5改造丝心蛋白可以含有用于将重组蛋白生产系统所生产的蛋白质释放到宿主外部的分泌信号。分泌信号的序列可以根据宿主的种类来进行适当设定。
[0179]
第6改造丝心蛋白与天然来源的丝心蛋白相比,具有降低谷氨酰胺残基含量的氨基酸序列。
[0180]
第6改造丝心蛋白可以在rep的氨基酸序列中包含选自ggx基序及gpgxx基序中的至少1种基序。
[0181]
第6改造丝心蛋白在rep中包括gpgxx基序时,gpgxx基序含有率通常为1%以上,也可以为5%以上,或10%以上。gpgxx基序含有率的上限并没有特别限制,可以为50%以下或30%以下。
[0182]
在本说明书中,“gpgxx基序含有率”是通过以下方法计算出的值。
[0183]
在包含式1:[(a)
n
基序
‑
rep]
m
或式2:[(a)
n
基序
‑
rep]
m
‑
(a)
n
基序所示的结构域序列的丝心蛋白(改造丝心蛋白或天然来源的丝心蛋白)中,在从结构域序列中除去自位于最靠c末端侧的(a)
n
基序至结构域序列的c末端为止的序列后得到的序列所含的所有rep中,当将该区域所含的gpgxx基序的个数的总数乘以3而得到的数(即,相当于gpgxx基序中的g及p的总数)设为s,并且将从结构域序列中除去自位于最靠c末端侧的(a)
n
基序至结构域序列的c末端为止的序列且除去(a)
n
基序后得到的所有rep的氨基酸残基的总数设为t时,以s/t来计算gpgxx基序含有率。
[0184]
在gpgxx基序含有率的计算中,将“从结构域序列中除去自位于最靠c末端侧的(a)
n
基序至结构域序列的c末端为止的序列后得到的序列”作为对象是为了排除下述影响:“位于最靠c末端侧的(a)
n
基序至结构域序列的c末端为止的序列”(相当于rep的序列)中有时包含与丝心蛋白的特征性序列相关性低的序列,在m较小的情况下(也就是说,结构域序列短的情况下)会影响gpgxx基序含有率的计算结果。另外,在“gpgxx基序”位于rep的c末端的情况下,即使“xx”例如为“aa”时,也作为“gpgxx基序”来进行处理。
[0185]
图4是表示改造丝心蛋白的结构域序列的示意图。参照图4来具体说明gpgxx基序含有率的计算方法。首先,在图4所示的改造丝心蛋白的结构域序列(“[(a)
n
基序
‑
rep]
m
‑
(a)
n
基序”类型)中,所有rep都包含在“从结构域序列中除去自位于最靠c末端侧的(a)
n
基序至结构域序列的c末端为止的序列后得到的序列”(图4中“区域a”所示的序列)中,因此用于计算s的gpgxx基序的个数为7,s为7
×
3=21。同样地,由于所有rep都包含在“从结构域序列
中除去自位于最靠c末端侧的(a)
n
基序至结构域序列的c末端为止的序列后得到的序列”(图4中“区域a”所示的序列)中,因此从该序列中进一步除去(a)
n
基序后得到的所有rep的氨基酸残基的总数t为50 40 10 20 30=150。接下来,通过将s除以t,可以计算出s/t(%),在图4的改造丝心蛋白的情况下,为21/150=14.0%。
[0186]
第6改造丝心蛋白的谷氨酰胺残基含有率可以为9%以下、7%以下、4%以下、或者0%。
[0187]
在本说明书中,“谷氨酰胺残基含有率”是通过以下方法计算出的值。
[0188]
在包含式1:[(a)
n
基序
‑
rep]
m
或式2:[(a)
n
基序
‑
rep]
m
‑
(a)
n
基序所示的结构域序列的丝心蛋白(改造丝心蛋白或天然来源的丝心蛋白)中,在从结构域序列中除去自位于最靠c末端侧的(a)
n
基序至结构域序列的c末端为止的序列后得到的序列(相当于图4的“区域a”的序列)所含的所有rep中,当将该区域所含的谷氨酰胺残基的总数设为u,并且将从结构域序列中除去自位于最靠c末端侧的(a)
n
基序至结构域序列的c末端为止的序列且进一步除去(a)
n
基序后得到的所有rep的氨基酸残基的总数设为t时,以u/t来计算谷氨酰胺残基含有率。在谷氨酰胺残基含有率的计算中,以“从结构域序列中除去自位于最靠c末端侧的(a)
n
基序至结构域序列的c末端为止的序列后得到的序列”为对象的理由与上述的理由相同。
[0189]
第6改造丝心蛋白的结构域序列与天然来源的丝心蛋白相比,可以具有相当于使rep中的一个或多个谷氨酰胺残基发生缺失或置换为其他氨基酸残基的氨基酸序列。
[0190]“其他氨基酸残基”只要是谷氨酰胺残基以外的氨基酸残基即可,可以为疏水性指标大于谷氨酰胺残基的氨基酸残基。氨基酸残基的疏水性指标如表1所示。
[0191]
如表1所示,作为疏水性指标大于谷氨酰胺残基的氨基酸残基,可以列举出选自异亮氨酸(i)、缬氨酸(v)、亮氨酸(l)、苯丙氨酸(f)、半胱氨酸(c)、蛋氨酸(m)、丙氨酸(a)、甘氨酸(g)、苏氨酸(t)、丝氨酸(s)、色氨酸(w)、酪氨酸(y)、脯氨酸(p)及组氨酸(h)中的氨基酸残基。其中,可以为选自异亮氨酸(i)、缬氨酸(v)、亮氨酸(l)、苯丙氨酸(f)、半胱氨酸(c)、蛋氨酸(m)及丙氨酸(a)中的氨基酸残基,也可以为选自异亮氨酸(i)、缬氨酸(v)、亮氨酸(l)及苯丙氨酸(f)中的氨基酸残基。
[0192]
第6改造丝心蛋白的rep的疏水性程度可以为
‑
0.8以上、
‑
0.7以上、0以上、0.3以上、或者0.4以上。rep的疏水性程度的上限并没有特别限制,rep的疏水性程度可以为1.0以下、或者0.7以下。
[0193]
在本说明书中,“rep的疏水性程度”为通过以下方法而计算出的值。
[0194]
在包含式1:[(a)
n
基序
‑
rep]
m
或式2:[(a)
n
基序
‑
rep]
m
‑
(a)
n
基序所示的结构域序列的丝心蛋白(改造丝心蛋白或天然来源的丝心蛋白)中,在从结构域序列中除去自位于最靠c末端侧的(a)
n
基序至结构域序列的c末端为止的序列后得到的序列(相当于图4的“区域a”的序列)所含的所有rep中,当将该区域的各氨基酸残基的疏水性指标的总和设为v,并且将从结构域序列中除去自位于最靠c末端侧的(a)
n
基序至结构域序列的c末端为止的序列且进一步除去(a)
n
基序后得到的所有rep的氨基酸残基的总数设为t时,以v/t来计算rep的疏水性程度。在rep的疏水性程度的计算中,以“从结构域序列中除去自位于最靠c末端侧的(a)
n
基序至结构域序列的c末端为止的序列后得到的序列”为对象的理由与上述的理由相同。
[0195]
第6改造丝心蛋白的结构域序列与天然来源的丝心蛋白相比,其除了相当于缺失了rep中的一个或多个谷氨酰胺残基、及/或将rep中的一个或多个谷氨酰胺残基置换为其他氨基酸残基的改造之外,还可以进一步进行相当于置换、缺失、插入及/或添加一个或多个氨基酸残基的氨基酸序列的改造。
[0196]
例如可以通过在克隆出的天然来源的丝心蛋白的基因序列中使rep中的一个或多个谷氨酰胺残基发生缺失、及/或将rep中的一个或多个谷氨酰胺残基置换为其他氨基酸残基,从而得到第6改造丝心蛋白。此外,例如也可以通过设计出相当于在天然来源的丝心蛋白的氨基酸序列中,使rep中的一个或多个谷氨酰胺残基发生缺失、及/或将rep中的一个或多个谷氨酰胺残基置换为其他氨基酸残基的氨基酸序列,并且对编码所设计的氨基酸序列的核酸进行化学合成后得到。
[0197]
作为第6改造丝心蛋白的更具体的例子,可以列举出包括(6
‑
i)序列号25(met
‑
prt888)、序列号26(met
‑
prt965)、序列号27(met
‑
prt889)、序列号28(met
‑
prt916)、序列号29(met
‑
prt918)、序列号30(met
‑
prt699)、序列号31(met
‑
prt698)、序列号32(met
‑
prt966)、序列号41(met
‑
prt917)或序列号42(met
‑
prt1028)所示的氨基酸序列的改造丝心蛋白,或者包括与(6
‑
ii)序列号25、序列号26、序列号27、序列号28、序列号29、序列号30、序列号31、序列号32、序列号41或序列号42所示的氨基酸序列具有90%以上的序列一致性的氨基酸序列的改造丝心蛋白。
[0198]
对(6
‑
i)的改造丝心蛋白进行说明。序列号25所示的氨基酸序列是将序列号7所示的氨基酸序列(met
‑
prt410)中的qq全部置换为vl而得到的氨基酸序列。序列号26所表示的氨基酸序列是将序列号7所表示的氨基酸序列中的qq全部置换为ts、并且将剩余的q置换为a而得到的氨基酸序列。序列号27所表示的氨基酸序列是将序列号7所表示的氨基酸序列中的qq全部置换为vl、并且将剩余的q置换为i而得到的氨基酸序列。序列号28所表示的氨基酸序列是将序列号7所表示的氨基酸序列中的qq全部置换为vi、并且将剩余的q置换为l而得到的氨基酸序列。序列号29所表示的氨基酸序列是将序列号7所表示的氨基酸序列中的qq全部置换为vf、并且将剩余的q置换为i而得到的氨基酸序列。
[0199]
序列号30所示的氨基酸序列是将序列号8所示的氨基酸序列(met
‑
prt525)中的qq全部置换为vl而得到的氨基酸序列。序列号31所表示的氨基酸序列是将序列号8所表示的氨基酸序列中的qq全部置换为vl、并且将剩余的q置换为i而得到的氨基酸序列。
[0200]
序列号32所示的氨基酸序列是将序列号7所示的氨基酸序列(met
‑
prt410)中存在的20个结构域序列的区域重复2次后得到的序列中的qq全部置换为vf,并且将剩余的q置换为i而得到的氨基酸序列。
[0201]
序列号41所表示的氨基酸序列(met
‑
prt917)是将序列号7所表示的氨基酸序列中的qq全部置换为li、并且将剩余的q置换为v而得到的氨基酸序列。序列号42所表示的氨基酸序列(met
‑
prt1028)是将序列号7所表示的氨基酸序列中的qq全部置换为if、并且将剩余的q置换为t而得到的氨基酸序列。
[0202]
序列号25、序列号26、序列号27、序列号28、序列号29、序列号30、序列号31、序列号32、序列号41及序列号42所示的氨基酸序列的谷氨酰胺残基含有率均为9%以下(表2)。
[0203]
[表2]
[0204][0205]
(6
‑
i)的改造丝心蛋白可以由序列号25、序列号26、序列号27、序列号28、序列号29、序列号30、序列号31、序列号32、序列号41或序列号42所示的氨基酸序列构成。
[0206]
(6
‑
ii)的改造丝心蛋白包括与序列号25、序列号26、序列号27、序列号28、序列号29、序列号30、序列号31、序列号32、序列号41或序列号42所示的氨基酸序列具有90%以上的序列一致性的氨基酸序列。(6
‑
ii)的改造丝心蛋白也是包括式1:[(a)
n
基序
‑
rep]
m
、或式2:[(a)
n
基序
‑
rep]
m
‑
(a)
n
基序所示的结构域序列的蛋白质。上述序列一致性可以为95%以上。
[0207]
(6
‑
ii)的改造丝心蛋白的谷氨酰胺残基含有率可以为9%以下。此外,(6
‑
ii)的改造丝心蛋白的gpgxx基序含有率可以为10%以上。
[0208]
第6改造丝心蛋白可以在n末端及c末端中的任意一端或两端包含标签序列。由此,可以实现改造丝心蛋白的分离、固定、检测及可视化等。
[0209]
作为含有标签序列的改造丝心蛋白的更具体的例子,可以列举出包括(6
‑
iii)序列号33(prt888)、序列号34(prt965)、序列号35(prt889)、序列号36(prt916)、序列号37(prt918)、序列号38(prt699)、序列号39(prt698)、序列号40(prt966)、序列号43(prt917)或序列号44(prt1028)所示的氨基酸序列的改造丝心蛋白,或者包括与(6
‑
iv)序列号33、序列号34、序列号35、序列号36、序列号37、序列号38、序列号39、序列号40、序列号43或序列号44所示的氨基酸序列具有90%以上的序列一致性的氨基酸序列的改造丝心蛋白。
[0210]
序列号33、序列号34、序列号35、序列号36、序列号37、序列号38、序列号39、序列号40、序列号43及序列号44所示的氨基酸序列分别在序列号25、序列号26、序列号27、序列号28、序列号29、序列号30、序列号31、序列号32、序列号41及序列号42所示的氨基酸序列的n末端添加序列号11所示的氨基酸序列(包含his标签序列及铰链序列)。由于仅在n末端添加了标签序列,因此谷氨酰胺残基含有率没有变化,序列号33、序列号34、序列号35、序列号36、序列号37、序列号38、序列号39、序列号40、序列号43及序列号44所示的氨基酸序列的谷氨酰胺残基含有率均为9%以下(表3)。
[0211]
[表3]
[0212]
改造丝心蛋白谷氨酰胺残基含有率gpgxx基序含有率rep疏水性程度prt888(序列号33)6.3%27.9%
‑
0.07
prt965(序列号34)0.0%27.9%
‑
0.65prt889(序列号35)0.0%27.9%0.35prt916(序列号36)0.0%27.9%0.47prt918(序列号37)0.0%27.9%0.45prt699(序列号38)3.6%26.4%
‑
0.78prt698(序列号39)0.0%26.4%
‑
0.03prt966(序列号40)0.0%28.0%0.35prt917(序列号43)0.0%27.9%0.46prt1028(序列号44)0.0%28.1%0.05
[0213]
(6
‑
iii)的改造丝心蛋白可以由序列号33、序列号34、序列号35、序列号36、序列号37、序列号38、序列号39、序列号40、序列号43或序列号44所示的氨基酸序列构成。
[0214]
(6
‑
iv)的改造丝心蛋白包括与序列号33、序列号34、序列号35、序列号36、序列号37、序列号38、序列号39、序列号40、序列号43或序列号44所示的氨基酸序列具有90%以上的序列一致性的氨基酸序列。(6
‑
iv)的改造丝心蛋白也是包括式1:[(a)
n
基序
‑
rep]
m
、或式2:[(a)
n
基序
‑
rep]
m
‑
(a)
n
基序所示的结构域序列的蛋白质。上述序列一致性可以为95%以上。
[0215]
(6
‑
iv)的改造丝心蛋白的谷氨酰胺残基含有率可以为9%以下。此外,(6
‑
iv)的改造丝心蛋白的gpgxx基序含有率可以为10%以上。
[0216]
第6改造丝心蛋白可以含有用于将重组蛋白生产系统所生产的蛋白质释放到宿主外部的分泌信号。分泌信号的序列可以根据宿主的种类来进行适当设定。
[0217]
改造丝心蛋白可以为兼具第1改造丝心蛋白、第2改造丝心蛋白、第3改造丝心蛋白、第4改造丝心蛋白、第5改造丝心蛋白及第6改造丝心蛋白所具有的特征中的至少2种以上特征的改造丝心蛋白。
[0218]
由于改造丝心蛋白可以抑制因与水分接触而引起的收缩,因此其也可以是疏水性改造丝心蛋白。在本说明书中,“疏水性改造丝心蛋白”是指,求出构成改造丝心蛋白的所有氨基酸残基的疏水性指标(hi)的总和,然后将该总和除以所有氨基酸残基数而获得的值(平均hi)为0以上的改造丝心蛋白。改造丝心蛋白的疏水性指标的平均值(平均hi)可以为0.5以上、或者0.6以上。改造丝心蛋白的疏水性指标的平均值(平均hi)例如可以为1.2以下、或者0.9以下。疏水性指标如表1所示。此外,有时将平均hi小于0的改造丝心蛋白称为亲水性改造丝心蛋白。
[0219]
作为疏水性改造丝心蛋白,例如,可以列举出包含序列号27、序列号28、序列号29、序列号30、序列号31、序列号32、序列号33或序列号43所示的氨基酸序列、以及序列号35、序列号37、序列号38、序列号39、序列号40、序列号41或序列号44所示的氨基酸序列的改造丝心蛋白。
[0220]
作为亲水性改造丝心蛋白,例如,可以列举出包括序列号4所示的氨基酸序列,序列号6、序列号7、序列号8或序列号9所示的氨基酸序列,序列号13、序列号11、序列号14或序列号15所示的氨基酸序列,序列号18、序列号7、序列号8或序列号9所示的氨基酸序列,序列号17、序列号11、序列号14或序列号15所示的氨基酸序列,序列号19、序列号20或序列号21所示的氨基酸序列的改造丝心蛋白。
[0221]
例如,通过对具有编码该改造丝心蛋白的核酸序列和以可工作的方式连接于该核酸序列的一个或多个调控序列的表达载体进行转化的宿主来表达该核酸,从而也可以生产上述任一实施方式所涉及的改造丝心蛋白。
[0222]
编码改造丝心蛋白的核酸的制造方法并没有特别限制。例如,可以通过利用编码天然丝心蛋白的基因,并利用聚合酶链反应(pcr)等进行扩增、克隆后,利用通过基因工程方法进行改造的方法或化学合成方法来制造该核酸。核酸的化学合成方法也没有特别限制,例如,可以通过将基于由ncbi的网络数据库等获得的丝心蛋白的氨基酸序列信息、并且用akta oligopilot plus 10/100(ge healthcare
·
japan株式会社)等自动合成的寡核苷酸利用pcr等进行连接的方法来化学合成基因。此时,为了容易地进行丝心蛋白的纯化及/或确认,可以对编码在上述氨基酸序列n末端添加了由起始密码子及his10标签构成的氨基酸序列的氨基酸序列所构成的改造丝心蛋白的核酸进行合成。
[0223]
调控序列为控制宿主中的改造丝心蛋白的表达的序列(例如启动子、增强子、核糖体结合序列、转录终止序列等),并且可以根据宿主的种类进行适当选择。作为启动子,也可以使用在宿主细胞中发挥功能,可表达诱导改造丝心蛋白的诱导性启动子。诱导性启动子为可以通过诱导物质(表达诱导剂)的存在、阻遏分子的不存在或者温度、渗透压或ph值的上升或下降等物理因素来控制转录的启动子。
[0224]
表达载体的种类可以根据宿主的种类来适当地选择质粒载体、病毒载体、柯斯质粒载体、福斯质粒载体、人工染色体载体等。表达载体可以是在宿主细胞中能够自主复制、或者能够整合到宿主的染色体中且在能够转录编码改造丝心蛋白的核酸的位置处包含启动子的载体。
[0225]
作为宿主,可以使用原核生物以及酵母、丝状真菌、昆虫细胞、动物细胞及植物细胞等真核生物中的任意一个。
[0226]
作为原核生物宿主的示例,可以列举出属于埃希氏菌属、短芽孢杆菌属、沙雷氏菌属、芽孢杆菌属、微杆菌属、短杆菌属、棒杆菌属及假单胞菌属等的细菌。作为属于埃希氏菌属的微生物,例如,可以列举出大肠杆菌等。作为属于短芽孢杆菌属的微生物,例如,可以列举出土壤短芽孢杆菌等。作为属于沙雷氏菌属的微生物,例如,可以列举出液化沙雷氏菌等。作为属于芽孢杆菌属的微生物,例如,可以列举出枯草芽孢杆菌等。作为属于微杆菌属的微生物,例如,可以列举出嗜氨微杆菌等。作为属于短杆菌属的微生物,例如,可以列举出叉开短杆菌等。作为属于棒杆菌属的微生物,例如,可以列举出产氨棒杆菌等。作为属于假单胞菌(pseudomonas)属的微生物,例如,可以列举出恶臭假单胞菌等。
[0227]
在以原核生物作为宿主的情况下,作为导入编码改造丝心蛋白的核酸的载体,例如,可以列举出pbtrp2(勃林格殷格翰公司制)、pgex(pharmacia公司制)、puc18、pbluescriptii、psupex、pet22b、pcold、pub110、pnco2(日本特开2002
‑
238569号公报)等。
[0228]
作为真核生物宿主,例如,可以列举出酵母及丝状真菌(霉菌等)。作为酵母,例如,可以列举出属于酵母属、毕赤酵母属、裂殖酵母属等的酵母。作为丝状真菌,例如,可以列举出属于曲霉属、青霉属、木霉(trichoderma)属等的丝状真菌。
[0229]
在以真核生物作为宿主的情况下,作为导入编码改造丝心蛋白的核酸的载体,例如,可以列举出yep13(atcc37115)、yep24(atcc37051)等。作为向上述宿主细胞中导入表达载体的方法,只要是向上述宿主细胞中导入dna的方法都可以使用。例如,可以列举出使用
钙离子的方法〔proc.natl.acad.sci.usa,69,2110(1972)〕、电穿孔法、原生质球法、原生质体法、乙酸锂法、感受态法等。
[0230]
作为基于利用表达载体进行转化后的宿主的核酸表达方法,除了直接表达以外,还可以依据分子克隆第2版中记载的方法等进行分泌生产、融合蛋白表达等。
[0231]
改造丝心蛋白例如可以通过将利用表达载体进行了转化的宿主在培养用培养基中进行培养,使该改造丝心蛋白在培养用培养基中生成并蓄积,并从该培养用培养基中收集来进行制造。将宿主在培养用培养基中进行培养的方法可以按照宿主培养的通常使用方法来进行。
[0232]
在宿主为大肠杆菌等原核生物或酵母等真核生物的情况下,作为培养用培养基,只要是含有宿主可同化的碳源、氮源及无机盐类等、并且能够高效地进行宿主的培养的培养基,则可以使用天然培养基及合成培养基中的任意一种。
[0233]
作为碳源,只要是上述转化微生物可同化的物质即可,例如,可以使用葡萄糖、果糖、蔗糖以及含有这些糖的糖蜜、淀粉及淀粉水解物等碳水化合物、乙酸及丙酸等有机酸、以及乙醇及丙醇等醇类。作为氮源,例如,可以使用氨、氯化铵、硫酸铵、乙酸铵及磷酸铵等无机酸或有机酸的铵盐、其它含氮化合物、以及蛋白胨、肉提取物、酵母提取物、玉米浆、酪蛋白水解物、豆粕及豆粕水解物、各种发酵菌体及其消化产物。作为无机盐类,例如,可以使用磷酸氢钾、磷酸氢二钾、磷酸镁、硫酸镁、氯化钠、硫酸亚铁、硫酸锰、硫酸铜及碳酸钙。
[0234]
大肠杆菌等原核生物或酵母等真核生物的培养例如可以在振荡培养或深部通气搅拌培养等需氧条件下进行。培养温度例如为15~40℃。培养时间通常为16小时~7天。培养中的培养用培养基的ph可以保持在3.0~9.0。培养用培养基的ph的调整可以使用无机酸、有机酸、碱溶液、尿素、碳酸钙及氨等进行。
[0235]
此外,在培养中,可以根据需要在培养用培养基中添加氨苄西林及四环素等抗生素。当对通过使用诱导型启动子以作为启动子的表达载体进行转化后的微生物进行培养时,可以根据需要在培养基中添加诱导剂。例如,在对通过使用lac启动子的表达载体进行转化后的微生物进行培养时,可以在培养基中添加异丙基
‑
β
‑
d
‑
硫代半乳糖吡喃糖苷等;在对通过使用trp启动子的表达载体进行转化后的微生物进行培养时,可以在培养基中添加吲哚丙烯酸等。
[0236]
所表达的改造丝心蛋白的分离和纯化可以通过常用方法来进行。例如,在该改造丝心蛋白以溶解状态在细胞内进行表达的情况下,在培养结束后,通过离心分离回收宿主细胞,悬浮于水系缓冲液中后,利用超声波破碎机、弗氏压碎器、manton
‑
gaulin匀浆器和戴诺研磨机(dyno
‑
mill)等将宿主细胞破碎,得到无细胞提取液。从通过对该无细胞提取液进行离心分离而得到的上清液中,单独或组合使用蛋白质的分离纯化中通常使用的方法、即溶剂提取法、利用硫酸铵等的盐析法、脱盐法、利用有机溶剂的沉淀法、使用二乙氨基乙基(deae)
‑
琼脂糖、diaion hpa
‑
75(三菱化成公司制)等树脂的阴离子交换层析法、使用s
‑
sepharose ff(pharmacia公司制)等树脂的阳离子交换层析法、使用丁基琼脂糖、苯基琼脂糖等树脂的疏水性层析法、使用分子筛的凝胶过滤法、亲和层析法、色谱聚焦法、等电点电泳等电泳法等方法,能够得到纯化制备品。
[0237]
此外,在改造丝心蛋白在细胞内形成不溶体而进行表达的情况下,同样在回收宿主细胞后将其破碎并进行离心分离,由此以沉淀级分的形式回收改造丝心蛋白的不溶体。
回收的改造丝心蛋白的不溶体可以利用蛋白变性剂进行可溶化。该操作后,利用与上述同样的分离纯化法能够得到改造丝心蛋白的纯化制备品。在该改造丝心蛋白分泌到细胞外的情况下,可以从培养上清液中回收该改造丝心蛋白。即,通过利用离心分离等方法对培养物进行处理来获得培养上清液,通过使用与上述同样的分离纯化法,能够从该培养上清液中获得纯化制备品。
[0238]
赋予其预定形状或卷曲形状的丝心蛋白纤维也可以是当其处于润湿状态时伸长、并且当其从润湿状态干燥时收缩的纤维。通过利用上述方法赋予当其处于润湿状态时伸长、并且当其从润湿状态干燥时收缩的丝心蛋白纤维以预定形状,能够很容易地制造当其处于润湿状态时伸长、并且当其从润湿状态干燥时收缩的并赋予其预定形状的人造毛发用纤维。预定形状也可以是包括弯曲部分、直线状部分或这两者的形状。
[0239]
当其处于润湿状态时伸长、并且当其从润湿状态干燥时收缩的丝心蛋白纤维的由下述式(1)定义的恢复率可以为95%以上。
[0240]
式(1):恢复率=(从润湿状态干燥时的丝心蛋白纤维的长度/润湿状态前的丝心蛋白纤维的长度)
×
100(%)
[0241]
由式(1)定义的恢复率越高,润湿/干燥时的行为越接近人发,因此能够抑制在人造毛发与人发之间产生不适感。由式(1)定义的丝心蛋白纤维的恢复率可以为96%以上、97%以上、98%以上、或者99%以上。
[0242]
由下述式(4)定义的丝心蛋白纤维的伸长率可以为17%以下。由式(4)定义的伸长率是使丝心蛋白纤维处于润湿状态时的伸长特性的指标。
[0243]
式(4):伸长率={(处于润湿状态的丝心蛋白纤维的长度/润湿状态前的丝心蛋白纤维的长度)
‑
1}
×
100(%)
[0244]
由式(4)定义的伸长率例如可以为15%以下、13%以下、10%以下或5%以下。由式(4)定义的伸长率例如可以为大于0%、1%以上、2%以上、5%以上10%以上或13%以上。本实施方式所涉及的丝心蛋白纤维的伸长率例如可以为大于0%且17%以下、大于0%且15%以下、2%以上且15%以下、5%以上且15%以下、5%以上且13%以下、5%以上且10%以下、大于0%且10%以下、或者大于0%且5%以下。从进一步减小人造毛发与人发之间所产生的不适感的观点出发,由式(4)定义的伸长率也可以很小。
[0245]
由下述式(5)定义的丝心蛋白纤维的收缩率c也可以为17%以下。由式(5)定义的收缩率c是丝心蛋白纤维从润湿状态干燥时的收缩特性的指标。
[0246]
式(5):收缩率c={1
‑
(从润湿状态干燥时的丝心蛋白纤维的长度/处于润湿状态的丝心蛋白纤维的长度)}
×
100(%)
[0247]
由式(5)定义的收缩率c可以为15%以下、13%以下、10%以下或5%以下。由式(5)定义的收缩率c可以为大于0%、1%以上、2%以上、5%以上、10%以上或13%以上。本实施方式所涉及的丝心蛋白纤维的收缩率c例如可以大于0%且17%以下、大于0%且15%以下、2%以上且15%以下、5%以上且15%以下、5%以上且13%以下、5%以上且10%以下、大于0%且10%以下、或者大于0%且5%以下。从进一步减小人造毛发与人发之间所产生的不适感的观点出发,由式(5)定义的收缩率c也可以很小。
[0248]
丝心蛋白纤维也可以是在纺丝后通过与水接触而不可逆地进行收缩的具有收缩经历的纤维。在这种情况下,由下述式(2)定义的丝心蛋白纤维的收缩率a也可以为2%以
上。收缩率a为2%以上的丝心蛋白纤维在润湿/干燥时的行为更接近人发。
[0249]
式(2):收缩率a={1
‑
(纺丝后通过与水接触而不可逆地进行收缩的纤维的长度/纺丝后与水接触前的纤维的长度)}
×
100(%)
[0250]
由式(2)定义的收缩率a可以为2.5%以上、3%以上、3.5%以上、4%以上、4.5%以上、5%以上、5.5%以上、6%以上、10%以上、15%以上、20%以上或25%以上。由式(2)定义的收缩率a的上限并没有特别限定,收缩率a可以为80%以下、60%以下、40%以下、20%以下、10%以下、7%以下、6%以下、5%以下、4%以下或3%以下。
[0251]
丝心蛋白纤维也可以是在纺丝后通过与水接触而不可逆地进行收缩后,通过干燥进一步收缩的具有收缩经历的纤维。在这种情况下,由下述式(3)定义的丝心蛋白纤维的收缩率b也可以大于7%。式(3)定义的收缩率b大于7%的丝心蛋白纤维在润湿/干燥时的行为更接近于人发。
[0252]
式(3):收缩率b={1
‑
(纺丝后通过与水接触而不可逆地进行收缩后,通过干燥进一步收缩的纤维的长度/纺丝后与水接触前的纤维的长度)}
×
100(%)
[0253]
由式(3)定义的收缩率b可以为10%以上、15%以上、大于25%、32%以上、40%以上、48%以上、56%以上、64%以上或72%以上。由式(3)定义的收缩率b的上限并没有特别限定,但是收缩率b通常为80%以下。
[0254]
也可以在丝心蛋白纤维的表面形成有沿纤维轴方向延伸的凹部或凹槽。具有形成凹部或凹槽的表面的丝心蛋白纤维能够抑制光泽,并且可以实现与人发同样的外观。作为在丝心蛋白纤维的表面设置凹部的方法,例如,在对原料纤维进行纺丝时,可以采用通过湿法纺丝法进行纺丝的方法、延缓脱溶剂速度的方法(例如,在凝固液中添加纺丝原液的溶剂的方法)、国际公开第2016/201369号中记载的方法(例如,延长凝固浴中的停留时间的方法(60秒以上)、改变凝固浴中的溶剂比例的方法)。
[0255]
由下述式(6)定义的丝心蛋白纤维的热收缩率可以为4%以下。
[0256]
式(6):热收缩率={1
‑
(加热至160℃时的丝心蛋白纤维的长度/加热前的丝心蛋白纤维的长度)}
×
100(%)
[0257]
由包含改造丝心蛋白的丝心蛋白纤维构成的人造毛发用纤维具有比一般的合成纤维高并且与人发相匹敌的温度软化点。因此,160℃下的热收缩率(由式(6)定义的热收缩率)小。吹风机的热风温度为120~140℃,使用卷发棒的最适宜温度为170℃以下。由式(6)定义的热收缩率小,因此能够抑制使用吹风机、卷发棒时的损伤。由式(6)定义的热收缩率例如可以为4%以下、3%以下、或者2.5%以下。
[0258]
包含改造丝心蛋白的丝心蛋白纤维也可以作为无动物源性(不含动物来源成分)素材进行制作。
[0259]
丝心蛋白纤维70可以使用包含改造丝心蛋白的纺丝原液,通过常用的纺丝方法进行制造。例如,将改造丝心蛋白加入二甲基亚砜(dmso)、n,n
‑
二甲基甲酰胺(dmf)、甲酸或六氟异丙醇(hfip)等溶剂中,并根据需要同时添加作为溶解促进剂的无机盐,进行溶解后制成纺丝原液。使用该纺丝原液,并通过湿法纺丝、干法纺丝、或干湿法纺丝等纺丝方法进行纺丝,可以得到目标丝心蛋白纤维。纺丝方法可以是熔融纺丝。
[0260]
图5是表示用于制造丝心蛋白纤维的纺丝装置的一例的示意图。图5所示的纺丝装置10是干湿法纺丝用的纺丝装置的一例,具有挤出装置1、未拉伸丝制造装置2、湿热拉伸装
置3、干燥装置4。
[0261]
储存在储存槽7中的纺丝原液6通过齿轮泵8从喷丝头9挤出。在实验室级设备中,也可以将纺丝原液填充到气缸中,使用注射泵从喷嘴中挤出。接下来,所挤出的纺丝原液6经过气隙19供给到凝固液槽20的凝固液11内,去除溶剂,改造丝心蛋白凝固,并形成纤维状凝固体。接下来,将纤维状凝固体供给到拉伸浴槽21内的温水12中进行拉伸。拉伸倍率由供给夹持辊13和卷取夹持辊14的速度比决定。然后,将拉伸后的纤维状凝固体供给到干燥装置4,并在丝道22内干燥,以获得丝心蛋白纤维70作为卷丝体5。18a~18g是导丝器。
[0262]
凝固液11只要是能够脱溶剂的溶剂即可,可以列举例如甲醇、乙醇和2
‑
丙醇等碳原子数1~5的低级醇、以及丙酮等。凝固液11可以包含水。凝固液11的温度可以为0~30℃。在使用具有直径0.1~0.6mm的喷嘴的注射泵作为喷丝头9的情况下,挤出速度可以为每孔0.2~6.0ml/小时、或者1.4~4.0ml/小时。凝固的蛋白质通过凝固液11中的距离(实质上是从导丝器18a到导丝器18b的距离)只要是能够有效地进行脱溶剂的长度即可,例如可以为200~500mm。未拉伸丝的引离速度例如可以为1~20m/分钟、或者1~3m/分钟。凝固液11中的停留时间例如可以为0.01~3分钟、或者0.05~0.15分钟。可以在凝固液11中进行拉伸(预拉伸)。凝固液槽20可以设置多段,并且可以根据需要在各段或特定的段中进行拉伸。
[0263]
作为丝心蛋白纤维70的拉伸,例如,除了在上述凝固液槽20内进行的预拉伸、以及在拉伸浴槽21内进行的湿热拉伸之外,还可以采用干热拉伸。
[0264]
湿热拉伸可以是在温水中进行、或在温水中加入有机溶剂等的溶液中进行、或在蒸汽加热中进行。作为温度,例如可以为50~90℃、或者75~85℃。在湿热拉伸中,也可以将未拉伸丝(或预拉伸丝)拉伸为例如1~10倍、或者2~8倍。
[0265]
干热拉伸可以使用管式电热炉、干热板等来进行。干热拉伸的温度例如可以为140℃~270℃、或者160℃~230℃。在干热拉伸中,也可以将未拉伸丝(或预拉伸丝)拉伸为例如0.5~8倍、或者1~4倍。
[0266]
湿热拉伸和干热拉伸可以分别单独进行,另外也可以将它们以多步或组合进行。可以以湿热拉伸进行第一步拉伸,以干热拉伸进行第二步拉伸;或者第一步拉伸进行湿热拉伸,第二步拉伸进行湿热拉伸,进一步以干热拉伸进行第三步拉伸等,可以将湿热拉伸和干热拉伸适当组合进行。
[0267]
最终拉伸倍率可以为大于未拉伸丝(或预拉伸丝)的1倍、2倍以上、3倍以上、4倍以上、5倍以上、6倍以上、7倍以上、8倍以上或9倍以上,也可以是40倍以下、30倍以下、20倍以下、15倍以下、14倍以下、13倍以下、12倍以下、11倍以下或10倍以下。当丝心蛋白纤维是以2倍以上的拉伸倍率进行纺丝的纤维时,使丝心蛋白纤维与水接触而处于润湿状态时的收缩率进一步提高。
[0268]
也可以将通过纺丝形成的丝心蛋白纤维70进行收缩。经由收缩工序获得的丝心蛋白纤维可以具有当其处于润湿状态时伸长、并且当其从润湿状态干燥时收缩的性质。收缩工序例如可以包含在纺丝后,使与水接触前的丝心蛋白纤维70与水接触而不可逆地进行收缩的工序。与水接触后,也可以通过干燥使丝心蛋白纤维70进一步收缩。
[0269]
在丝心蛋白与水的接触工序中,纺丝后,使与水接触前的丝心蛋白纤维70与水接触,并使丝心蛋白纤维70处于润湿状态。润湿状态是指丝心蛋白纤维70中的至少一部分用水润湿的状态。由此,可以在不依赖外力的条件下使丝心蛋白纤维70进行不可逆的收缩。
[0270]
与丝心蛋白纤维70接触的水的温度可以低于沸点。由此,提高操作性能和收缩工序的作业性能等。从充分缩短收缩时间的观点出发,水的温度可以为10℃以上、40℃以上或70℃以上。水的温度可以为90℃以下。
[0271]
使水与丝心蛋白纤维70接触的方法并没有特别限定。作为该方法的例子,可以列举出将丝心蛋白纤维70浸渍在水中的方法、将水在常温下或加热的蒸汽等状态下对丝心蛋白纤维70进行喷雾的方法、以及将丝心蛋白纤维70暴露在充满水蒸气的高湿度环境下的方法。由于能够有效地缩短收缩时间,并且能够实现加工设备的简化等,因此也可以采用将丝心蛋白纤维70浸渍在水中的方法。
[0272]
当丝心蛋白纤维70在松弛的状态下与水接触时,丝心蛋白纤维70不仅会收缩,而且会以波浪状方式起皱。为了防止发生这种起皱,例如,可以使丝心蛋白纤维70在纤维轴方向上施加张力的同时与水接触等,以使丝心蛋白纤维70在不松弛的状态下与水接触。
[0273]
也可以通过干燥使处于润湿状态的丝心蛋白纤维70收缩。干燥例如可以是自然干燥,也可以是使用干燥设备的强制干燥。作为干燥设备,可以使用接触式或非接触式的公知干燥设备。干燥温度例如只要是比改造丝心蛋白分解或丝心蛋白纤维70受到热损伤的温度低即可,例如,可以为20~150℃或50~100℃。干燥时间根据干燥温度等适当设定,例如,采用能够尽可能地排除过度干燥对丝心蛋白纤维70的品质和物理性能等的影响的时间等。
[0274]
图6是表示用于制造丝心蛋白纤维的制造装置的一例的示意图。图6所示的制造装置40是用于收缩通过纺丝而形成的丝心蛋白纤维70的装置。制造装置40具有送出丝心蛋白纤维70的进料辊42、卷绕收缩后的丝心蛋白纤维70的卷线机44、用于使丝心蛋白纤维70与水接触的水浴46、用于干燥处于润湿状态的丝心蛋白纤维70的干燥机48。
[0275]
在进料辊42上安装有丝心蛋白纤维70的卷绕物。通过电动机等的旋转,连续且自动地送出丝心蛋白纤维70。卷线机44通过电动机的旋转,连续且自动地卷绕收缩后的丝心蛋白纤维70。利用进料辊42送出丝心蛋白纤维70的送出速度和利用卷线机44卷绕丝心蛋白纤维70的卷绕速度可以彼此独立控制。卷线机44的卷绕速度也可以比进料辊42的送出速度慢。由此,由于丝心蛋白纤维70在以进料辊42和卷线机44之间不松弛的方式张紧的状态下,通过与水47的接触而进行收缩,因此能够防止发生起皱。通过与水47的接触,丝心蛋白纤维70不可逆地进行收缩。
[0276]
水浴46和干燥机48在进料辊42和卷线机44之间从丝心蛋白纤维70的进料方向的上游侧开始依次配置。制造装置40具有转送丝心蛋白纤维70的转送辊50和52。
[0277]
水浴46具有加热器54,通过该加热器54加热的水47被容纳在水浴46内。张紧辊56在浸渍在水47中的状态下,设置在水浴46内。从进料辊42送出的丝心蛋白纤维70在水浴46内以卷绕在张紧辊56上的状态下浸渍在水47中,并向卷线机44侧移动。
[0278]
干燥机48具有一对热辊58。在一对热辊58上卷绕有从水浴46内脱离并向卷线机44侧移动的丝心蛋白纤维70。处于润湿状态的丝心蛋白纤维70在干燥机48内通过一对加热辊58进行加热,从而进行干燥。通过该干燥,丝心蛋白纤维70进一步收缩。干燥后的丝心蛋白纤维70卷绕在卷线机44上。
[0279]
通过控制进料辊42的送出速度和卷线机44的卷绕速度之间的比率,可以进一步使丝心蛋白纤维70收缩,也可以不使丝心蛋白纤维70的长度发生变化。
[0280]
图7是表示用于制造丝心蛋白纤维的制造装置的另一例的示意图。图7的制造装置
也是用于收缩通过纺丝而形成的丝心蛋白纤维70的装置,其具备用于使丝心蛋白纤维70与水接触的加工装置60和用于干燥处于润湿状态的丝心蛋白纤维70的干燥装置62,并且它们独立设置。
[0281]
图7(a)的加工装置60具备进料辊42、水浴46以及卷线机44,它们从丝心蛋白纤维70的移动方向的上游向下游侧依次配置。从进料辊42送出的丝心蛋白纤维70浸渍在水浴46内的水47中。由此,丝心蛋白纤维70收缩。浸渍后的丝心蛋白纤维70卷绕在卷线机44上。也可以省略进料辊42和卷线机44,将丝心蛋白纤维以所谓的间歇式浸渍在水中。
[0282]
图7(b)的干燥装置62具有进料辊42、卷线机44、以及配置在它们之间的干热板64。从进料辊43卷出的丝心蛋白纤维70通过一边与干热板64的干燥面66接触一边移动来进行干燥。通过控制进料辊42的送出速度和卷线机44的卷绕速度之间的比率,可以进一步使丝心蛋白纤维70收缩,也可以不使丝心蛋白纤维70的长度发生变化。利用干燥装置62进行干燥并不是必须的。
[0283]
实施例
[0284]
下面,将基于实施例等更具体地说明本发明。但是,本发明并不限于以下实施例。
[0285]
1.丝心蛋白纤维
[0286]
(1)改造丝心蛋白
[0287]
合成编码序列号40所示的改造丝心蛋白(prt966)的核酸。合成的核酸中,在5'末端附加有ndei位点、在终止密码子下游附加有ecori位点。将核酸克隆到克隆载体(puc118)上。然后,用ndei和ecori对该核酸进行限制酶处理后切下。将切下的核酸重组为蛋白质表达载体pet
‑
22b( )后获得表达载体。
[0288]
用得到的pet
‑
22b( )表达载体转化大肠杆菌blr(de3)。将该转化的大肠杆菌在含有氨苄西林的2ml lb培养基中培养15小时。将该培养液添加到含有氨苄西林的100ml的种子培养用培养基(表4)中,以使od
600
达到0.005。将培养液温度保持于30℃,进行约15小时烧瓶培养直至od
600
达到5为止,得到种子培养液。
[0289]
[表4]
[0290][0291]
将该种子培养液添加到加有500ml的生产培养基(表5)的发酵罐中,以使od
600
达到0.05。将培养液温度保持在37℃,将ph恒定控制在6.9下进行培养。此外,将培养液中的溶解氧浓度维持在溶解氧饱和浓度的20%。
[0292]
[表5]
[0293][0294]
在生产培养基中的葡萄糖完全消耗后,立即以1ml/分钟的速度添加进料液(葡萄糖455g/1l、酵母提取物120g/1l)。将培养液温度保持在37℃,将ph恒定控制在6.9下进行培养。将培养液中的溶解氧浓度维持在溶解氧饱和浓度的20%,培养20小时。然后,向培养液中添加1m的异丙基
‑
β
‑
硫代半乳糖吡喃糖苷(iptg)以使其最终浓度为1mm,并表达诱导作为目标的改造丝心蛋白。在添加iptg后经过20个小时,离心分离培养液,并且回收菌体。使用由添加iptg前和添加iptg后的培养液制备的菌体进行sds
‑
page,根据相当于目标改造丝心蛋白尺寸的条带的出现,确认到目标改造丝心蛋白的表达,该目标改造丝心蛋白依赖于iptg添加。
[0295]
将自添加iptg起2小时后回收的菌体用20mm tris
‑
hcl buffer(ph7.4)洗涤。将洗涤后的菌体悬浮在含有约1mm的pmsf的20mm tris
‑
hcl缓冲液(ph7.4)中,用高压均质器(gea niro soavi公司)来破碎细胞。对破碎后的细胞进行离心分离,得到沉淀物。将得到的沉淀物用20mm tris
‑
hcl缓冲液(ph7.4)洗涤,直至达到高纯度为止。将洗涤后的沉淀物以达到100mg/ml的浓度的方式在8m胍缓冲液(8m盐酸胍、10mm磷酸二氢钠、20mm nacl、1mm tris
‑
hcl、ph7.0)中悬浮,并在60℃下用搅拌器搅拌30分钟,以使其溶解。溶解后,使用透析管(三光纯药株式会社制的纤维素管36/32)用水进行透析。通过离心分离来回收透析后获得的白色凝聚蛋白质。用冷冻干燥机从回收的凝聚蛋白质中去除水,获得目标改造丝心蛋白的冷冻干燥粉末。
[0296]
(2)丝心蛋白纤维的制作
[0297]
使用溶解有4.0质量%的氯化锂的二甲基亚砜(dmso)作为溶剂,将改造丝心蛋白的冷冻干燥粉末溶解在其中。然后,除去不溶物和气泡,得到改造丝心蛋白溶液。通过使用所获得的改造丝心蛋白溶液作为纺丝原液的干湿法纺丝来制作丝心蛋白纤维。拉伸倍率为6倍。
[0298]
将长度为30cm的多根丝心蛋白纤维的单丝捆扎,以获得纤度为150旦尼尔的纤维束。在各个纤维束上安装0.8g的铅锤。在该状态下将纤维束在40℃的水中浸渍10分钟,从而收缩丝心蛋白纤维。然后,通过将从水中取出的纤维束在室温下放置2小时以使其干燥。由此,获得了包含改造丝心蛋白的单丝直径为15μm、30μm、40μm、60μm或80μm的干燥的丝心蛋白纤维的纤维束。将所获得的纤维束用于下面丝心蛋白纤维的形状赋予试验。
[0299]
2.形状赋予试验
[0300]
(试验1)
[0301]
将干燥后的丝心蛋白纤维卷绕在直径约为25mm的金属圆柱状芯材上。将卷绕在芯材上的丝心蛋白纤维在恒温恒湿槽中以20℃、40℃、60℃或90℃的温度保持60分钟。但是,在20℃或40℃下保持单丝直径为15μm或30μm的丝心蛋白纤维时,保持时间为180分钟。在同样的条件下,也进行丝绸纤维的形状赋予试验。
[0302]
观察从芯材上拆下的丝心蛋白纤维,按照以下标准判断赋予卷曲形状的程度。
[0303]
a:保持卷曲的清晰形状。
[0304]
b:与“a”相比,虽然弱,但是确认到在某种程度上保持形状。
[0305]
c:未确认到保持卷曲形状。
[0306]
[表6]
[0307][0308]
如表6所示,确认到通过在沿着预定形状的状态下保持处于干燥状态的丝心蛋白纤维,能够对丝心蛋白纤维赋予预定形状(这里为卷曲形状)。图8是形状赋予试验后的单丝直径为40μm的丝心蛋白纤维的图片。图9是形状赋予试验后的单丝直径为60μm的丝心蛋白纤维的图片。在图8和图9中,从左向右依次为在20℃、40℃、60℃或90℃下保持形状的丝心蛋白纤维。
[0309]
(试验2
‑
1)
[0310]
将干燥后的各个丝心蛋白纤维在室温(约20℃)的水中浸渍20分钟。然后,将处于润湿状态的丝心蛋白纤维卷绕在直径约为25mm的金属圆柱状芯材上。将卷绕在芯材上的丝心蛋白纤维在恒温恒湿槽中以20℃、40℃、60℃或90℃的温度进行加热的同时保持1小时。
[0311]
观察从芯材上拆下的丝心蛋白纤维,按照与试验1相同的标准判断赋予卷曲形状的程度。
[0312]
[表7]
[0313][0314]
如表7所示,确认到通过在沿着预定形状的状态下保持处于润湿状态的丝心蛋白纤维,能够对丝心蛋白纤维赋予预定形状(这里为卷曲形状)。图10是形状赋予试验后的单
丝直径为40μm的丝心蛋白纤维的图片。图11是形状赋予试验后的单丝直径为60μm的丝心蛋白纤维的图片。在图10和图11中,从左向右依次为处于润湿状态下在20℃、40℃、60℃或90℃下保持形状的丝心蛋白纤维。
[0315]
(试验2
‑
2)
[0316]
将单丝直径为80μm的丝心蛋白纤维在室温(约20℃)的水中浸渍20分钟。然后,将处于润湿状态的丝心蛋白纤维卷绕在直径约为5mm或25mm的金属圆柱状芯材上。将卷绕在芯材上的丝心蛋白纤维在20℃、40℃、60℃或90℃的水中浸渍1小时的状态下进行加热的同时保持。通过在卷绕于芯材的状态下将从水中取出的丝心蛋白纤维在60℃的高温恒湿槽中加热1小时以使其干燥。观察从芯材上拆下的丝心蛋白纤维,按照与试验1相同的标准判断赋予卷曲形状的程度。结果如表8所示。图12是20℃或90℃形状赋予试验后的丝心蛋白纤维的图片。
[0317]
[表8]
[0318][0319]
(试验2
‑
3)
[0320]
将单丝直径为80μm的丝心蛋白纤维在室温(约20℃)的水中浸渍20分钟。然后,将处于润湿状态的丝心蛋白纤维卷绕在直径约为25mm的金属圆柱状芯材上。在高压釜中,将卷绕在芯材上的丝心蛋白纤维在115℃或125℃的水蒸气中暴露2小时的状态下进行加热并保持。通过在卷绕于芯材的状态下将从高压釜中取出的丝心蛋白纤维在70℃的高温恒湿槽中加热20分钟以使其干燥。观察从芯材上拆下的丝心蛋白纤维,按照与试验1相同的标准判断赋予卷曲形状的程度,其结果为“a”。图13是115℃或125℃形状赋予试验后的丝心蛋白纤维的图片。更强地赋予了卷曲形状。
[0321]
(试验2
‑
4:形状保持性评估)
[0322]
根据通过浸水使其润湿后在90℃的环境中保持丝心蛋白纤维的试验2
‑
1的条件、在90℃的热水中保持丝心蛋白纤维的试验2
‑
2的条件、或者在暴露于115℃的蒸汽中的状态下保持的试验2
‑
3的条件,对单丝直径为80μm的丝心蛋白纤维赋予卷曲形状。为了评估形状保持性,将其用于水洗试验,即,将赋予形状的丝心蛋白纤维在室温(约20℃)的水中浸渍20分钟,将浸渍后的丝心蛋白纤维用干燥机干燥。
[0323]
图14是根据试验2
‑
1的条件赋予其形状的丝心蛋白纤维在水洗试验前后的图片。图14(a)是通过保持在90℃的环境下以赋予其形状的丝心蛋白纤维,图14(b)是水洗试验后的同一丝心蛋白纤维。水洗后,确认有一定程度的卷曲形状残留。
[0324]
图15是根据试验2
‑
2或试验2
‑
3的条件赋予其卷曲形状的丝心蛋白纤维在洗涤试验前后的图片。图15(a1)是根据保持在90℃的热水中的试验2
‑
2的条件以赋予其形状的丝心蛋白纤维,图15(a2)是水洗试验后的同一丝心蛋白纤维。图15(b1)是根据保持在115℃的蒸汽中的试验2
‑
3的条件以赋予其形状的丝心蛋白纤维,图15(b2)是水洗试验后的同一丝心蛋白纤维。确认了通过保持在热水或水蒸气中以赋予其形状的丝心蛋白纤维在形状保持
性方面更加优异。
[0325]
(试验例2
‑
5:形状保持性评估)
[0326]
在如表9所示那样地变更水蒸气温度和保持时间的同时,在试验2
‑
3的条件下对单丝直径为80μm的丝心蛋白纤维赋予卷曲形状。将赋予其卷曲形状的各个丝心蛋白纤维反复进行与试验2
‑
4相同的洗涤试验。记录直到所赋予的形状实质上消失为止的洗涤试验次数。
[0327]
[表9]
[0328][0329]
吸水伸缩性
[0330]
分别测量赋予形状前的丝心蛋白纤维、以及试验例1或试验例2
‑
1中获得的且赋予其卷曲形状的丝心蛋白在干燥状态下的长度(润湿状态前的丝心蛋白纤维的长度)。接下来,在各个丝心蛋白纤维上安装0.8g的铅锤,并且在该状态下将丝心蛋白纤维在40℃的水中浸渍10分钟。然后,在水中测量各个丝心蛋白纤维的长度(处于润湿状态时的丝心蛋白纤维的长度)。为了消除各个丝心蛋白纤维的起皱,在各个丝心蛋白纤维上安装0.8g的铅锤的情况下对各个丝心蛋白纤维在水中的长度实施测量。接下来,将从水中取出的各个丝心蛋白纤维在安装0.8g的铅锤的情况下在室温下干燥2小时。干燥后,测量各个丝心蛋白纤维的长度(从润湿状态干燥后的丝心蛋白纤维的长度)。从获得的测量值中,按照下述式(1)、式(4)和式(5),计算各个丝心蛋白纤维的恢复率、伸长率和收缩率c。
[0331]
式(1):恢复率=(从润湿状态干燥时的丝心蛋白纤维的长度/润湿状态前的丝心蛋白纤维的长度)
×
100(%)
[0332]
式(4):伸长率={(处于润湿状态时的丝心蛋白纤维的长度/润湿状态前的丝心蛋白纤维的长度)
‑
1}
×
100(%)
[0333]
式(5):收缩率c={1
‑
(从润湿状态干燥时的丝心蛋白纤维的长度/处于润湿状态时的丝心蛋白纤维的长度)}
×
100(%)
[0334]
赋予其卷曲形状的各实施例的丝心蛋白纤维显示出2~17%的伸长率、2~17%的收缩率c及95~100%的恢复率。即,这些丝心蛋白纤维显示出当其处于润湿状态时伸长并且当其从润湿状态干燥时收缩的特性。
[0335]
符号说明
[0336]
1挤出装置
[0337]
2未拉伸丝制造装置
[0338]
3湿热拉伸装置
[0339]
4干燥装置
[0340]
6纺丝原液
[0341]
10纺丝装置
[0342]
20凝固液槽
[0343]
21拉伸浴槽
[0344]
40制造装置
[0345]
42进料辊
[0346]
44卷线机
[0347]
46水浴
[0348]
48干燥机
[0349]
54加热器
[0350]
56张紧辊
[0351]
58热辊
[0352]
60加工装置
[0353]
62干燥装置
[0354]
64干热板
[0355]
70丝心蛋白纤维
[0356]
75芯材。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。