修饰细胞的扩增及其用途
1.相关申请的交叉引用
2.本技术是2019年6月19日提交的美国申请16/445,965和2019年4月17日提交的美国申请16/387,166的部分连续案。本技术还要求2019年11月8日提交的美国临时申请62/932,587;2019年9月19日提交的美国临时申请62/902,766;2019年8月23日提交的美国临时申请62/891,131;2019年8月21日提交的美国临时申请62/889,926;2019年5月16日提交的美国临时申请62/848,961;2019年5月10日提交的美国临时申请62/846,563;2019年3月12日提交的美国临时申请62/817,322;2019年3月11日提交的美国临时申请62/816,497;2019年1月31日提交的美国临时申请62/799,462;以及2019年1月10日提交的美国临时申请62/790,783的权益,所述美国临时申请特此以引用的方式整体并入。
3.序列表信息
4.2020年1月6日左右创建的标题为“sequence listing_st25.txt”的计算机可读文本文件,文件大小为约1.20mb,包含本技术的序列表,并且特此以引用的方式整体并入。
技术领域
5.本公开涉及用于扩增和维持修饰的细胞(包括基因修饰的细胞)的组合物和方法,以及其在疾病(包括癌症)治疗中的用途。
背景技术:
6.嵌合抗原受体(car)t细胞疗法在诸如b细胞急性淋巴细胞白血病(b
‑
all)、慢性淋巴细胞白血病(cll)和淋巴瘤等癌症中已取得良好的临床疗效。然而,对实体瘤的治疗进展相对缓慢。为了使car t细胞疗法有效,长期维持患者体内的cart细胞对于肿瘤治疗中患者的预后至关重要。例如,如果可以维持cart细胞长期存在,则该技术可以有效减少肿瘤复发。
7.癌症又称为恶性肿瘤,其涉及异常细胞生长,并有可能侵袭或扩散到身体的其他部位。人类中存在一百多种癌症。一个实例是存在于乳房上皮组织中的乳腺癌。由于乳腺癌细胞失去了正常细胞的特征,因此失去了乳腺癌细胞之间的联系。一旦癌细胞脱落,它们就会通过血液和/或淋巴系统扩散到整个身体,因此会危及生命。目前,乳腺癌已成为对女性身心健康的常见威胁之一。虽然已证明免疫疗法(例如,cart)对治疗某些癌症有效,但是仍需要对免疫疗法进行改进,以便有效治疗包括涉及实体瘤等的更多癌症。
技术实现要素:
8.由于患者可以在b细胞耗竭的情况下存活,因此可使用car t细胞的第一抗原结合结构域将患者的b细胞用来扩增患者体内的car t细胞。因此,可在患者体内及时扩增更多的car t细胞,从而增加car t细胞的效力。患者体内及时扩增的car t细胞可增加car t细胞与肿瘤细胞接触的机会,尤其是具有与第二car结合的抗原的实体瘤细胞。
9.本公开描述了基因修饰的细胞,所述基因修饰的细胞包括一个或多个不同的抗原
结合结构域。基因修饰的细胞可以包括至少两个不同的抗原结合结构域:用于扩增和/或维持基因修饰细胞的第一抗原结合结构域,和用于杀死靶细胞(诸如肿瘤细胞)的第二抗原结合结构域。例如,第一抗原结合结构域结合表面标志物,诸如白细胞(wbc)的细胞表面分子,第二抗原结合结构域结合肿瘤细胞的靶抗原。在实施方案中,细胞表面分子是wbc的表面抗原。car可以包括第一或第二抗原结合结构域。修饰的细胞包括第一和第二抗原结合结构域。在实施方案中,修饰的细胞包括以下情况的修饰细胞:(1)包括第一抗原结合结构域的第一组修饰细胞;和(2)包括第二抗原结合结构域的第二组修饰细胞。在实施方案中,修饰的细胞是包含两个不同组的修饰细胞的混合群。
10.car可以是双特异性car。例如,两个抗原结合结构域在同一car上(双特异性car或串联car(tancar))、在不同car分子上、或在car和t细胞受体(tcr)上。单个car可以包括至少两个不同的抗原结合结构域,或两个不同的抗原结合结构域各自在单独的car上。
11.本公开还描述了编码第一car分子和第二car分子或tcr的一种或多种核酸。第一car包括第一抗原结合结构域,第二car或tcr包括第二抗原结合结构域。在实施方案中,第一car和第二car或tcr被表达为单独的多肽,并由至少两种单独的核酸编码。在实施方案中,单个car至少包含本文描述的第一抗原结合结构域和第二抗原结合结构域,并由单种核酸编码。在实施方案中,两个不同的抗原结合结构域可以由多于一种核酸编码。此外,本公开描述了包含本文描述的核酸的载体,以及包含本文描述的核酸的细胞。在实施方案中,细胞包括基因修饰的细胞,例如基因修饰的t细胞,诸如car t细胞。
12.本公开还描述了修饰细胞群(诸如混合修饰t细胞群),其有效用于在患者中扩增和/或维持基因修饰的细胞。在实施方案中,混合基因修饰细胞群包括至少两种不同的基因修饰细胞:第一基因修饰细胞,其表达用来扩增和/或维持修饰细胞的抗原结合结构域;和第二基因修饰细胞,其表达用来杀死靶细胞(诸如肿瘤细胞)的抗原结合结构域。两个抗原结合结构域是不同的分子并且结合不同的抗原。在实施方案中,混合基因修饰细胞群还包括表达至少两个不同的抗原结合结构域的第三基因修饰细胞,所述两个不同的抗原结合结构域为:用于扩增和/或维持基因修饰细胞的第一抗原结合结构域;和用于杀死靶细胞的第二抗原结合结构域(其中两个不同的抗原结合结构域在同一细胞上表达)。
13.在实施方案中,混合修饰细胞群包括表达至少两个不同的抗原结合结构域的基因修饰细胞,所述两个不同的抗原结合结构域为:用于扩增和/或维持修饰细胞的第一抗原结合结构域;和用于杀死靶细胞的第二抗原结合结构域(其中两个不同的抗原结合结构域在同一细胞上表达)。
14.在实施方案中,混合修饰细胞群包括表达用来杀死靶细胞的抗原结合结构域的修饰细胞;以及表达至少两个抗原结合结构域的修饰细胞,所述两个抗原结合结构域为:用于扩增和/或维持修饰t细胞的第一抗原结合结构域;和用于杀死靶细胞的第二抗原结合结构域(其中两个不同的抗原结合结构域在同一修饰细胞上表达)。
15.在实施方案中,混合修饰细胞群包括表达用来扩增和/或维持修饰t细胞的抗原结合结构域的修饰细胞;以及表达至少两个抗原结合结构域的修饰细胞,所述两个抗原结合结构域为:用于扩增和/或维持修饰细胞的第一抗原结合结构域;和用于杀死靶细胞的第二抗原结合结构域(其中两个不同的抗原结合结构域在同一修饰细胞上表达)。
16.本公开描述了包含本文描述的混合修饰细胞群的组合物。
17.在实施方案中,修饰细胞是修饰的t细胞、修饰的nk细胞、修饰的巨噬细胞或修饰的树突状细胞。在实施方案中,修饰的t细胞是car t细胞。在实施方案中,表达两个不同的抗原结合结构域的修饰细胞可以是单一car t细胞。在实施方案中,单一car t细胞可以是双特异性car t细胞。
18.在实施方案中,用于扩增和/或维持修饰细胞的抗原结合结构域结合wbc的表面抗原,用于杀死靶细胞的抗原结合结构域结合肿瘤抗原。在实施方案中,wbc是b细胞。在实施方案中,b细胞的表面抗原是cd19,肿瘤抗原是tmuc1、tshr、gucy2c、acpp、cldn18.2(18.2)、psma、upk2或其他肿瘤抗原。
19.此外,本公开描述了本文所述的组合物或混合修饰细胞群在有需要的患者中增强car t细胞的扩增和/或维持的用途。car t细胞的扩增和维持增强可提高car t细胞疗法的疗效。本公开描述了使用本文所述的混合修饰细胞群治疗患有肿瘤的患者的方法。在实施方案中,混合基因修饰细胞群可扩增和/或维持患者体内的修饰细胞,并有效抑制肿瘤生长。在实施方案中,肿瘤是实体瘤。
20.此外,本公开描述了响应于混合修饰细胞群的引入而进行的细胞因子释放。
21.本发明内容既不旨在标识所要求保护的主题的关键特征或必要特征,也不旨在用于限制所要求保护的主题的范围。
附图说明
22.参照附图描述具体实施方式。在不同附图中使用相同的参考号指示相似或相同的项目。
23.图1是包括两个car分子的修饰细胞的细胞膜的示例性部分的示意图。
24.图2是示出混合修饰细胞群的示意图,所述混合修饰细胞群包括两种具有不同car分子的修饰细胞。
25.图3是示出包括car分子和tcr分子的细胞膜的示例性部分的示意图。
26.图4是示出混合修饰细胞群的示意图,所述混合修饰细胞群包括:包含car分子的修饰细胞;和包含t细胞受体(tcr)的修饰细胞。
27.图5是示出包括双特异性car分子的细胞膜的示例性部分的示意图。
28.图6示出来自小鼠的外周血样品的细胞因子数据。
29.图7示出双特异性car的设计和表达测定结果。
30.图8示出表达双特异性car的t细胞的细胞因子释放。
31.图9示出表达双特异性car的t细胞和对应靶细胞的共培养测定结果。
32.图10示出双特异性car的另一种设计和表达测定结果。
33.图11示出用于图10测定中的双特异性car的表达测定结果。
34.图12示出car分子的核酸构建体的示意图。
35.图13示出图12中所示的car分子的表达。
36.图14示出car t细胞与肿瘤细胞共培养的ifnγ(ifng)释放结果。
37.图15示出描绘了car t细胞与肿瘤细胞共培养的cd137表达的流式细胞测定结果。
38.图16示出相对于输注表达单个car(tmuc1 car或tshr car)的t细胞后的天数,患者的car拷贝数变化。
39.图17示出相对于输注表达tmuc1 car和cd19 car的t细胞后的天数,患者的car拷贝数变化。
40.图18示出相对于输注表达tmuc1 car的t细胞后的天数,患者的cart细胞数变化。
41.图19示出相对于输注表达tmuc1 car和cd19 car的混合car t细胞群后的天数,患者的car t细胞数变化。
42.图20和21示出相对于输注表达muc1 car和cd19 car的混合cart细胞后的天数,若干患者的cart细胞数变化。
43.图22、23、24、25、26、27、28、29、30、31和32示出响应于输注混合car t细胞,患者的各种测定结果。
44.图33、34和35示出输注混合car t细胞之前和之后,患者的ct和/或pet ct扫描图像。
45.图36示出存在或不存在k19细胞的情况下,cd19 car t细胞与tmuc1 car t细胞共培养的流式细胞分析结果。
46.图37示出用于图36测定中的细胞培养物中pbmc和单核细胞的激活。
47.图38示出由tmuc1 cart细胞和cd19 car t细胞产生的ifnγ释放。
48.图39示出由tmuc1cart细胞和cd19 cart细胞产生的gzmb释放。
49.图40和41示出不同实施方案中muc1car t细胞的增殖。
50.图42示出不同实施方案中cd19 car t细胞的增殖。
51.图43示出实施方案中的细胞因子释放。
52.图44示出不同细胞培养物中的cd137表达。
53.图45示出细胞激活的流式细胞分析结果。
54.图46示出图44所述的细胞培养物中pbmc和单核细胞的激活。
55.图47示出cd19 car t细胞的激活引起acpp car t细胞释放细胞内ifnγ。
56.图48和49示出在细胞培养物中将细胞共培养24小时后的细胞因子释放。
57.图50示出不同细胞培养物中的cd137表达。
58.图51示出不同car t细胞与kato3 细胞共培养48小时的流式细胞分析结果。
59.图52示出图50所述的体系中pbmc和单核细胞的激活。
60.图53和54示出cldn18.2 car t细胞的激活引起cd19 car t细胞释放细胞内ifnγ。
61.图55示出不同细胞培养物的杀伤测定结果。
62.图56示出cldn18.2 car t细胞的增殖。
63.图57示出cldn18.2 car和cd19 car体系中cd19 car t细胞的增殖。
64.图58、59和60示出不同细胞培养物中的细胞因子释放。
65.图61示出免疫治疗系统的示意图。
66.图62示出图61的免疫治疗系统的实施方式的示意图。
67.图63示出图61的免疫治疗系统的另一种实施方式的示意图。
68.图64是示例性条件基因表达系统的示意图。
69.图65是树突状细胞激活的示例性实施方式的示意图。
70.图66示出使用流式细胞分析进行若干标志物在car t细胞和tancar t细胞上表
达。
71.图67示出car t细胞和tancar t细胞的细胞因子释放。
72.图68示出用对应底物细胞刺激5天后,每组中细胞的扩增。
73.图69示出杀伤测定结果,所述结果表明6917抑制mcf
‑
7,并且6921抑制pc3
‑
acpp。
74.图70示出使用流式细胞分析测定的若干标志物在car t细胞和tancar t细胞上的表达,以及car t细胞和tancar t细胞的细胞因子释放。
75.图71示出响应于底物细胞,不同car t细胞和tancar t细胞的细胞因子释放。
76.图72示出患者009中单核细胞的pdl1表达。
77.图73、74和75示出响应于修饰t细胞输注,患者011中car t细胞的扩增。
78.图76示出响应于修饰t细胞输注,患者011中的细胞因子释放。
79.图77a和77b示出结合分子的示例性结构。
80.图78示出使用流式细胞术确定所关注的基因的表型和表达。
81.图79示出使用流式细胞术识别共培养的细胞。
82.图80示出对包括cd19 car t细胞和nyeso
‑
1 tcrts的共培养细胞的激活进行的流式细胞分析结果。箭头114和116以及方框102、104、106和108是指比较组。
83.图81示出对包括cd19 car t细胞和nyeso
‑
1 tcrts的共培养细胞的增殖进行的流式细胞分析结果。箭头208以及方框202、204和206是指比较组。
84.图82示出对包括cd19 car t细胞和afp tcrts的共培养细胞的激活进行的流式细胞分析结果。箭头314和316以及方框302、304、306和308是指比较组。
85.图83示出对包括cd19 car t细胞和afp tcrts的共培养细胞的增殖进行的流式细胞分析结果。箭头408以及方框402、404和406是指比较组。
86.图84示出不同细胞培养物中cd137表达的其他直方图。
87.图85示出gucy2c car t细胞的增殖。
88.图86示出在细胞培养物中将细胞共培养24小时后的细胞因子释放。
89.图87a
‑
87d示出编码重组蛋白的多核苷酸的示例性构建体,以及抗体的示例性结构。
具体实施方式
90.下面结合具体实施例对本发明进一步进行描述。
91.除非另外定义,否则本文所用的所有技术术语和科学术语具有与本公开所属领域中的普通技术人员所通常理解的相同的含义。尽管可在本公开的实践或测试中使用与本文描述的那些方法和材料类似或等效的任何方法和材料,但还是描述了优选的方法和材料。为了本公开的目的,以下术语定义如下。
92.本文使用冠词“一个/种(a/an)”是指一个或多于一个(即,至少一个)物品的语法对象。举例来说,“一种要素”意指一种要素或多于一种要素。
[0093]“大约”意指数量、水平、值、数目、频率、百分比、尺寸、大小、量、重量或长度相对于参考数量、水平、值、数目、频率、百分比、尺寸、大小、量、重量或长度变化多达20%、15%、10%、9%、8%、7%、6%、5%、4%、3%、2%或1%。
[0094]
如本文所用,术语“激活”是指已被充分刺激以诱导可检测的细胞增殖的细胞状
态。激活也可以与诱导的细胞因子产生和可检测的效应子功能相关。术语“激活的t细胞”尤其是指正在进行细胞分裂的t细胞。
[0095]
术语“抗体”的使用范围最广,是指单克隆抗体(包括全长单克隆抗体)、多克隆抗体、多特异性抗体(例如,双特异性抗体)和抗体片段,只要它们表现出所需的生物学活性或功能即可。本公开中的抗体可以以各种形式存在,包括例如多克隆抗体、单克隆抗体、fv、fab、fab’和f(ab’)2片段;以及单链抗体和人源化抗体(harlow等人,1999,in:using antibodies:a laboratory manual,cold spring harbor laboratory press,ny;harlow等人,1989,in:antibodies:a laboratory manual,cold spring harbor,new york;houston等人,1988,proc.natl.acad.sci.usa 85:5879
‑
5883;bird等人,1988,science 242:423
‑
426)。
[0096]
术语“抗体片段”是指全长抗体的一部分,例如,抗体的抗原结合或可变区。抗体片段的其他实例包括fab、fab’、f(ab’)2和fv片段;双抗体;线性抗体;单链抗体分子;以及由抗体片段形成的多特异性抗体。
[0097]
术语“fv”是指包含完整抗原识别和抗原结合位点的最小抗体片段。该片段由紧密、非共价缔合的一个重链可变区结构域和一个轻链可变区结构域的二聚体组成。通过这两个结构域的折叠,产生了六个高变环(3个环来自h链,3个环来自l链),其贡献了用于抗原结合的氨基酸残基并赋予抗体抗原结合特异性。然而,即使单个可变结构域(或仅包含对抗原具有特异性的三个互补决定区(cdr)的fv的一半)也具有识别和结合抗原的能力,尽管其亲和力低于整个结合位点(二聚体)。
[0098]
如本文所用的“抗体重链”是指以其天然存在的构型存在于所有抗体分子中的两种类型的多肽链中的较大者。如本文所用的“抗体轻链”是指以其天然存在的构型存在于所有抗体分子中的两种类型的多肽链中的较小者。κ和λ轻链是指两种主要的抗体轻链同种型。
[0099]
术语“合成抗体”是指使用重组dna技术生成的抗体,诸如例如由噬菌体表达的抗体。所述术语还包括通过合成编码抗体的dna分子和表达dna分子以获得抗体或获得编码抗体的氨基酸而生成的抗体。使用本领域可用和众所周知的技术来获得合成dna。
[0100]
术语“抗原”是指引起免疫应答的分子,其可涉及抗体产生或特异性免疫能力细胞的激活或两者。抗原包括任何大分子,所述大分子包括所有蛋白质或肽,或衍生自重组或基因组dna的分子。例如,包含编码引发免疫应答的蛋白质或肽的核苷酸序列或部分核苷酸序列的dna,因此编码如本文所用的术语“抗原”。抗原不必仅由基因的全长核苷酸序列编码。抗原可以从生物样品中生成、合成或衍生自生物样品,所述生物样品包括组织样品、肿瘤样品、细胞或生物流体。
[0101]
如本文所用,术语“抗肿瘤作用”是指与肿瘤体积减小、肿瘤细胞数减少、转移数减少、肿瘤细胞增殖减少、肿瘤细胞存活减少、具有肿瘤细胞的受试者的预期寿命增加或与癌性病状相关的各种生理症状改善相关的生物作用。首先,也可以通过肽、多核苷酸、细胞和抗体在预防肿瘤发生方面的能力来表现出“抗肿瘤作用”。
[0102]
术语“自体抗原”是指被免疫系统误认为是外来的内源性抗原。自体抗原包括细胞蛋白、磷蛋白、细胞表面蛋白、细胞脂质、核酸、糖蛋白,包括细胞表面受体。
[0103]
术语“自体的”用于描述衍生自受试者的材料,其随后被重新引入同一受试者中。
[0104]
术语“同种异体的”用于描述衍生自相同物种的不同受试者的移植物。作为实例,供体受试者可以与受体受试者相关或不相关,但是供体受试者具有与受体受试者相似的免疫系统标志物。
[0105]
术语“异种的”用于描述衍生自不同物种的受试者的移植物。作为实例,供体受试者与受体受试者来自不同的物种,并且供体受试者和受体受试者可以是遗传学和免疫学上不相容的。
[0106]
术语“癌症”用于指特征在于异常细胞快速且不受控制生长的疾病。癌细胞可以局部扩散,或通过血流和淋巴系统扩散至身体的其他部位。各种癌症的实例包括乳腺癌、前列腺癌、卵巢癌、子宫颈癌、皮肤癌、胰腺癌、结肠直肠癌、肾癌、肝癌、脑癌、淋巴瘤、白血病、肺癌等。
[0107]
在整个说明书中,除非上下文另外要求,否则词语“包含(comprise)”、“包括(includes)”和“包括(including)”将被理解为暗示包括所述步骤或要素或步骤或要素的组,但不排除任何其他步骤或要素或步骤或要素的组。
[0108]
短语“由......组成”意指包括并且限于短语“由......组成”之后的任何内容。因此,短语“由......组成”指示所列出的要素是必需或强制性的,并且可不存在其他要素。
[0109]
短语“基本上由......组成”意指包括在短语之后列出的任何要素,并且可以包括不干扰或不影响本公开中针对所列要素所指定的活动或动作的其他要素。因此,短语“基本上由......组成”指示所列出的要素是必需的或强制性的,但是其他要素是可选的,并且取决于它们是否影响所列要素的活动或动作,可以存在或可以不存在。
[0110]
术语“互补的”和“互补性”是指通过碱基配对规则关联在一起的多核苷酸(即核苷酸序列)。例如,序列“a
‑
g
‑
t”与序列“t
‑
c
‑
a”互补。互补性可以是“部分的”,其中仅一些核酸的碱基根据碱基配对规则匹配,或在核酸之间可以存在“完全的”或“全部的”互补性。核酸链之间的互补程度对核酸链之间的杂交效率和强度有重要作用。
[0111]
术语“对应于(corresponds to)”或“对应于(corresponding to)”是指(a)具有与参考多核苷酸序列的全部或一部分基本上相同或互补,或者编码与肽或蛋白质中的氨基酸序列相同的氨基酸序列的核苷酸序列的多核苷酸;或(b)具有与参考肽或蛋白质中的氨基酸序列基本上相同的氨基酸序列的肽或多肽。
[0112]
术语“共刺激配体”是指抗原呈递细胞(例如,apc、树突状细胞、b细胞等)上的分子,其特异性结合t细胞上的同源共刺激分子,从而提供除了由例如tcr/cd3复合物与载有肽的mhc分子结合提供的主要信号外的一种信号,所述信号介导t细胞应答,包括增殖、激活、分化和其他细胞应答的至少一种。共刺激配体可以包括b7
‑
1(cd80)、b7
‑
2(cd86)、pd
‑
l1、pd
‑
l2、4
‑
1bbl、ox40l、诱导型共刺激配体(icos
‑
l)、细胞间粘附分子(icam)、cd30l、cd40、cd70、cd83、hla
‑
g、mica、micb、hvem、淋巴毒素β受体、3/tr6、ilt3、ilt4、hvem、cd7的配体、结合toll配体受体的激动剂或抗体以及与b7
‑
h3特异性结合的配体。共刺激配体还尤其包括与t细胞上存在的共刺激分子特异性结合的激动剂或抗体,诸如cd27、cd28、4
‑
1bb、ox40、cd30、cd40、pd
‑
1、icos、淋巴细胞功能相关抗原
‑
1(lfa
‑
1)、cd2、cd7、light、nkg2c、b7
‑
h3以及特异性结合cd83的配体。
[0113]
术语“共刺激分子”是指t细胞上的同源结合伴侣,其与共刺激配体特异性结合,从而介导t细胞的共刺激应答,诸如增殖。共刺激分子包括mhc i类分子、btla和toll样受体。
[0114]
术语“共刺激信号”是指与主要信号(诸如tcr/cd3连接)结合,导致t细胞增殖和/或关键分子上调或下调的信号。
[0115]
术语“疾病”和“病状”可以互换使用,或可以不同,因为特定的疾病或病状可能没有已知的致病物(因此病因尚未得到解决),因此它还不是公认的疾病,但仅是一种不良病状或综合症,其中临床医生已鉴定出或多或少的特定症状的集合。术语“疾病”是受试者的健康状态,其中受试者不能维持体内平衡,并且其中如果疾病没有得到改善,则受试者的健康继续恶化。相比之下,受试者的“病症”是一种健康状态,其中动物能够维持体内平衡,但是其中动物的健康状态要比没有病症的情况下不利。如果不及时治疗,病症不一定会导致动物健康状态进一步下降。
[0116]
术语“有效”是指足以实现期望的、预期的或意图的结果。例如,在治疗背景下的“有效量”可以是足以产生治疗或预防益处的化合物的量。
[0117]
术语“编码”是指多核苷酸诸如基因、cdna或mrna中的特定核苷酸序列在生物过程中用作合成其他聚合物和大分子的模板的固有特性,所述生物过程具有确定的核苷酸序列(即,rrna、trna和mrna)或确定的氨基酸序列以及由此产生的生物特性。因此,如果对应于基因的mrna的转录和翻译在细胞或其他生物系统中产生蛋白质,则所述基因编码所述蛋白质。其核苷酸序列与mrna序列相同(除了用“u”代替“t”以外)并且通常提供在序列表中的编码链以及用作基因或cdna转录的模板的非编码链可被称为编码所述基因或cdna的蛋白质或其他产物。
[0118]
术语“外源的”是指并非天然存在于野生型细胞或生物体中,但通常通过分子生物学技术引入细胞中的分子。外源多核苷酸的实例包括编码所需蛋白质的载体、质粒和/或人造核酸构建体。关于多核苷酸和蛋白质,术语“内源的”或“天然的”是指可以在给定的野生型细胞或生物体中发现的天然存在的多核苷酸或氨基酸序列。同样,通过分子生物学技术从第一生物体分离并转移至第二生物体的特定多核苷酸序列通常被认为是相对于第二生物体的“外源”多核苷酸或氨基酸序列。在具体实施方案中,可以通过分子生物学技术将多核苷酸序列“引入”已经含有这种多核苷酸序列的微生物中,例如,以产生原本天然存在的多核苷酸序列的一个或多个其他拷贝,从而促进编码多肽的过表达。
[0119]
术语“表达或过表达”是指例如由其启动子驱动,将特定核苷酸序列转录和/或翻译成前体或成熟蛋白。“过表达”是指在转基因生物或细胞中的基因产物产量超过正常或未转化的生物或细胞中的产量水平。如本文所定义,术语“表达”是指表达或过表达。
[0120]
术语“表达载体”是指包含重组多核苷酸的载体,所述重组多核苷酸包含可操作连接至待表达的核苷酸序列的表达控制(调节)序列。表达载体包括足够的用于表达的顺式作用要素;用于表达的其他要素可以由宿主细胞提供或提供在体外表达系统中。表达载体包括本领域已知的并入重组多核苷酸的所有载体,诸如粘粒、质粒(例如,裸露的或包含在脂质体中)和病毒(例如,慢病毒、逆转录病毒、腺病毒和腺相关病毒)。
[0121]
病毒可以用于将核酸体外和体内(在受试者体内)递送到细胞中。可用于将核酸递送到细胞中的病毒的实例包括逆转录病毒、腺病毒、单纯疱疹病毒、牛痘病毒和腺相关病毒。
[0122]
还存在用于将核酸递送到细胞中的非病毒方法,例如电穿孔、基因枪、声波穿孔、磁转染,以及使用寡核苷酸、脂质体、树状聚合物和无机纳米颗粒。
[0123]
术语“同源的”是指当两个比较的序列中的一个位置被相同的碱基或氨基酸单体亚基占据时,两个多肽之间或两个多核苷酸之间的序列相似性或序列同一性,例如,如果两个dna分子中的每个中的一个位置被腺嘌呤占据,则分子在所述位置上是同源的。两个序列之间的同源性百分比是两个序列享有的匹配或同源位置数除以所比较的位置数
×
100的函数。例如,如果两个序列中10个位置中有6个是匹配或同源的,则两个序列是60%同源的。举例来说,dna序列attgcc和tatggc享有50%的同源性。当比对两个序列时进行比较,以得到最大同源性。
[0124]
术语“免疫球蛋白”或“ig”是指用作抗体的一类蛋白质。包括在此类蛋白质中的五个成员是iga、igg、igm、igd和ige。iga是存在于身体分泌物,诸如唾液、眼泪、母乳、胃肠道分泌物和呼吸道与泌尿生殖道的粘液分泌物中的一抗。igg是最常见的循环抗体。在大多数受试者中,igm是初次免疫应答中产生的主要免疫球蛋白。它是凝集、补体固定和其他抗体应答中最有效的免疫球蛋白,并且对于防御细菌和病毒很重要。igd是不具有已知抗体功能但可以充当抗原受体的免疫球蛋白。ige是通过暴露于过敏原时,引起肥大细胞和嗜碱性粒细胞释放介体而介导速发型超敏反应的免疫球蛋白。
[0125]
术语“分离的”是指基本上或实质上不含在其天然状态下通常伴随其的组分的材料。所述材料可以是细胞或大分子,诸如蛋白质或核酸。例如,如本文所用的“分离的多核苷酸”是指已从以天然存在状态的方式位于其侧翼的序列中纯化的多核苷酸,例如已从通常与片段相邻的序列中去除的dna片段。或者,如本文所用的“分离的肽”或“分离的多肽”等是指从其天然细胞环境以及从其与细胞的其他组分的缔合中体外分离和/或纯化肽或多肽分子。
[0126]
术语“基本上纯化的”是指基本上不含在其天然状态下通常与其缔合的组分的材料。例如,基本上纯化的细胞是指在其天然存在或天然状态下从通常与其缔合的其他细胞类型中分离的细胞。在一些情况下,基本上纯化的细胞群是指同质的细胞群。在其他情况下,该术语简单地是指在其天然状态下从与其天然缔合的细胞中分离的细胞。在实施方案中,细胞在体外培养。在实施方案中,细胞并非在体外培养。
[0127]
在本公开的上下文中,使用了以下常见存在的核酸碱基的缩写。“a”是指腺苷,“c”是指胞嘧啶,“g”是指鸟苷,“t”是指胸苷,并且“u”是指尿苷。
[0128]
除非另有说明,否则“编码氨基酸序列的核苷酸序列”包括彼此为简并形式并且编码相同氨基酸序列的所有核苷酸序列。编码蛋白质或rna的短语核苷酸序列也可以包括内含子,其程度为编码蛋白质的核苷酸序列在某些形式中可以包含一个或多个内含子。
[0129]
术语“慢病毒”是指逆转录病毒科的一个属。慢病毒在逆转录病毒中是独特的,其能够感染非分裂细胞;它们可以将大量的遗传信息递送到宿主细胞的dna中,因此它们是基因递送载体的最有效方法之一。此外,使用慢病毒能够将遗传信息整合到宿主染色体中,从而产生稳定转导的遗传信息。hiv、siv和fiv是慢病毒的所有实例。衍生自慢病毒的载体提供了在体内实现显著水平的基因转移的手段。
[0130]
术语“调节”是指与不存在治疗或化合物的情况下受试者中的反应水平相比,和/或与其他相同但未治疗的受试者中的反应水平相比,介导受试者中反应水平的可检测的增加或降低。所述术语涵盖干扰和/或影响天然信号或反应,从而在受试者、优选地人中介导有益的治疗反应。
[0131]
当核酸与另一个核酸序列处于功能关系时,所述核酸是“可操作连接的”。例如,如果前序列或分泌前导序列的dna表达为参与多肽分泌的前蛋白,则所述dna可操作地连接至多肽的dna;如果启动子或增强子影响序列的转录,则所述启动子或增强子可操作地连接至编码序列;或如果核糖体结合位点被定位以便于翻译,则所述核糖体结合位点可操作地连接至编码序列。
[0132]
术语“在转录控制下”是指启动子可操作地连接至多核苷酸并相对于多核苷酸并处于正确的位置和方向,以控制由rna聚合酶进行的转录开始和多核苷酸表达。
[0133]
术语“过表达的”肿瘤抗原或肿瘤抗原的“过表达”旨在指示相对于来自特定组织或器官的正常细胞中的表达水平,来自患者的所述组织或器官中的疾病区域(例如实体瘤)的细胞中肿瘤抗原的异常表达水平。可以通过本领域已知的标准测定来确定患有特征在于肿瘤抗原过表达的实体瘤或血液恶性肿瘤的患者。
[0134]
实体瘤是通常不包含囊肿或液体区域的异常组织块。实体瘤可以是良性或恶性的。不同类型的实体瘤根据形成它们的细胞类型而命名(诸如肉瘤、癌瘤和淋巴瘤)。实体瘤诸如肉瘤和癌瘤的实例包括纤维肉瘤、粘肉肉瘤、脂肪肉瘤、软骨肉瘤、骨肉瘤、滑膜瘤、间皮瘤、尤因氏肿瘤、平滑肌肉瘤、横纹肌肉瘤、结肠癌、淋巴性恶性肿瘤、胰腺癌、乳腺癌、肺癌、卵巢癌、前列腺癌、肝细胞癌、鳞状细胞癌、基底细胞癌、腺癌、汗腺癌、甲状腺髓样癌、乳头状甲状腺癌、嗜铬细胞瘤皮脂腺癌、乳头状癌、乳头状腺癌、髓样癌、支气管癌、肾细胞癌、肝癌、胆管癌、绒毛膜癌、威尔姆斯瘤、宫颈癌、睾丸肿瘤、精原细胞瘤、膀胱癌、黑色素瘤和cns(中枢神经系统)肿瘤(诸如神经胶质瘤(诸如脑干神经胶质瘤和混合神经胶质瘤)、胶质母细胞瘤(也称为多形性成胶质细胞瘤)、星形胶质细胞瘤、cns淋巴瘤、生殖细胞瘤、髓母细胞瘤、神经鞘瘤、颅咽管瘤、室管膜瘤、松果体瘤、血管母细胞瘤、听神经瘤、少突胶质细胞瘤、脑膜瘤、神经母细胞瘤、视网膜母细胞瘤和脑转移)。
[0135]
实体瘤抗原是在实体瘤上表达的抗原。在实施方案中,实体瘤抗原也在健康组织上低水平表达。实体瘤抗原及其相关疾病肿瘤的实例提供在表1中。
[0136]
表1
[0137]
[0138]
[0139][0140]
术语组合物的“肠胃外施用”包括例如皮下(s.c)、静脉内(i.v.)、肌内(i.m.)、胸骨内注射或输注技术。
[0141]
术语“患者”、“受试者”和“个体”等在本文可互换使用,并且是指适用于本文描述的方法的任何人或动物。在某些非限制性实施方案中,患者、受试者或个体是人或动物。在实施方案中,术语“受试者”旨在包括在其中可以引发免疫应答的活生物体(例如,哺乳动物)。受试者的实例包括人和动物,诸如狗、猫、小鼠、大鼠及其转基因物种。
[0142]
需要治疗或其有需要的受试者包括患有需要治疗的疾病、病状或病症的受试者。其有需要的受试者还包括需要治疗以预防疾病、病状或病症的受试者。
[0143]
术语“多核苷酸”或“核酸”是指mrna、rna、crna、rrna、cdna或dna。所述术语通常是指长度至少为10个碱基的聚合形式核苷酸,核糖核苷酸或脱氧核苷酸或修饰形式的任一类型核苷酸。所述术语包括所有形式的核酸,包括单链和双链形式的核酸。
[0144]
术语“多核苷酸变体”和“变体”等是指与参考多核苷酸序列显示基本序列同一性的多核苷酸或在下文定义的严格条件下与参考序列杂交的多核苷酸。这些术语还涵盖通过添加、缺失或替换至少一个核苷酸而与参考多核苷酸区分开的多核苷酸。因此,术语“多核苷酸变体”和“变体”包括其中一个或多个核苷酸已被添加或缺失或被不同核苷酸代替的多核苷酸。就这一点而言,本领域众所周知,可以对参考多核苷酸进行某些改变,包括突变、添加、缺失和替换,从而使改变后的多核苷酸保留参考多核苷酸的生物功能或活性或相对于参考多核苷酸具有增加的活性(即优化的)。多核苷酸变体包括例如与本文描述的参考多核苷酸序列具有至少50%(和至少51%至至少99%以及其间的所有整数百分比,例如90%、95%或98%)序列同一性的多核苷酸。术语“多核苷酸变体”和“变体”还包括天然存在的等位基因变体和直系同源物。
[0145]
术语“多肽”、“多肽片段”、“肽”和“蛋白质”在本文中可互换使用,是指氨基酸残基的聚合物及其变体和合成类似物。因此,这些术语适用于氨基酸聚合物,其中一个或多个氨基酸残基是合成的非天然存在的氨基酸,诸如相应天然存在的氨基酸的化学类似物,以及适用于天然存在的氨基酸聚合物。在某些方面,多肽可以包括酶促多肽或“酶”,其通常催化各种化学反应(即,增加其速率)。
[0146]
术语“多肽变体”是指通过添加、缺失或替换至少一个氨基酸残基而与参考多肽序列区分开的多肽。在某些实施方案中,多肽变体通过一个或多个替换而与参考多肽区分开,所述一个或多个替换可以是保守的或非保守的。在某些实施方案中,多肽变体包含保守替换,并且就这一点而言,在本领域中众所周知,可以将一些氨基酸改变为具有大致相似特性的其他氨基酸,而不改变多肽活性的性质。多肽变体还涵盖其中一个或多个氨基酸已被添加或缺失或被不同氨基酸残基代替的多肽。
[0147]
术语“启动子”是指由细胞的合成机制识别或引入合成机制,开始多核苷酸序列的特异性转录所需要的dna序列。术语“表达控制(调节)序列”是指在特定宿主生物体中表达可操作连接的编码序列所必需的dna序列。适用于原核生物的控制序列例如包括启动子,任选地操纵子序列和核糖体结合位点。已知真核细胞利用启动子、聚腺苷酸化信号和增强子。
[0148]
术语“结合(bind)”、“结合(binds)”或“与......相互作用”是指识别并粘附于样品或生物体中第二分子但基本上不识别或粘附于样品中其他结构无关分子的分子。如本文所用关于抗体的术语“特异性结合”,是指识别特异性抗原但基本上不识别或结合样品中其他分子的抗体。例如,特异性结合来自一种物种的抗原的抗体也可以结合来自一种或多种物种的抗原。但是,这种种间反应性本身并不会改变抗体的特异性分类。在另一个实例中,特异性结合抗原的抗体也可以结合不同等位基因形式的抗原。然而,这种交叉反应性本身并不会改变抗体的特异性分类。在一些情况下,术语“特异性结合(specific binding)”或“特异性结合(specifically binding)”可用于指抗体、蛋白质或肽与第二化学物种的相互作用,意味着相互作用取决于化学物种上的特定结构(例如,抗原决定簇或表位)存在;例如,抗体识别并结合特定的蛋白质结构,而不是结合任何蛋白质。如果抗体对表位“a”具有特异性,则在包含标记“a”和抗体的反应中存在包含表位a(或游离、未标记的a)的分子将减少与抗体结合的标记a的量。
[0149]“统计学上显著的”意指结果不太可能是偶然发生的。统计学显著性可以通过本领域已知的任何方法确定。常用的显著性度量包括p值,所述p值是在虚假设为真时观察到的事件发生的频率或概率。如果获得的p值小于显著性水平,则拒绝虚假设。在简单情况下,显著性水平被定义为0.05或更小的p值。“减少”或“降低”或“较少”的量通常是“统计学上显著的”或生理上显著的量,并且可包括与本文描述的量或水平相比约1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、2.5、3、3.5、4、4.5、5、6、7、8、9、10、15、20、30、40或50或更多倍(例如,100、500、1000倍)(包括介于1和大于1之间的所有整数和小数点,例如1.5、1.6、1.7、1.8等)的减少量。
[0150]
术语“刺激”是指由刺激分子(例如,tcr/cd3复合物)与其同源配体结合从而介导信号转导事件而诱导的初次应答,诸如经由tcr/cd3复合物进行的信号转导。刺激可以介导某些分子表达的改变,诸如tgf
‑
β的下调和/或细胞骨架结构的再组织。
[0151]
术语“刺激分子”是指t细胞上与存在于抗原呈递细胞上的同源刺激配体特异性结合的分子。例如,来源于刺激分子的功能性信号传导结构域是与t细胞受体复合物缔合的ζ链。刺激分子包括负责进行信号传导的结构域。
[0152]
术语“刺激配体”是指以下配体,所述配体当存在于抗原呈递细胞(例如,apc、树突状细胞、b细胞等)上时,可以与细胞例如t细胞上的同源结合伴侣(本文称为“刺激分子”)特异性结合,从而介导t细胞的初次应答,包括激活、免疫应答的开始、增殖和相似过程。刺激配体在本领域中是众所周知的,并且尤其涵盖载有肽的mhc i类分子、抗cd3抗体、超激动剂抗cd28抗体和超激动剂抗cd2抗体。
[0153]
术语“治疗的”是指治疗和/或预防。通过抑制、缓解或根除疾病状态或减轻疾病状态的症状可获得治疗效果。
[0154]
术语“治疗有效量”是指本发明的化合物的量,其将引发研究人员、兽医、医生或另外临床医生所寻求的组织、系统或受试者的生物或医学反应。术语“治疗有效量”包括当施
用时足以防止所治疗的病症或疾病的一种或多种病征或症状的发展或在某种程度上对其减轻的化合物的量。治疗有效量将取决于化合物、疾病及其严重程度以及待治疗受试者的年龄、体重等而变化。
[0155]
术语“治疗疾病”是指降低受试者经历的疾病或病症的至少一种病征或症状的频率或严重程度。
[0156]
术语“转染的”或“转化的”或“转导的”是指将外源核酸转移或引入宿主细胞中的过程。“转染的”或“转化的”或“转导的”细胞是已用外源核酸转染、转化或转导的细胞。所述细胞包括原代受试者细胞及其后代。
[0157]
术语“载体”是指包含分离的核酸并且可用于将分离的核酸递送至细胞内部的多核苷酸。在本领域中已知许多载体,包括线性多核苷酸、与离子或两亲化合物缔合的多核苷酸、质粒和病毒。因此,术语“载体”包括自主复制质粒或病毒。所述术语还包括促进核酸转移到细胞中的非质粒和非病毒化合物,诸如例如聚赖氨酸化合物、脂质体等。病毒载体的实例包括腺病毒载体、腺伴随病毒载体、逆转录病毒载体等。例如,慢病毒是复杂的逆转录病毒,其除了常见的逆转录病毒基因gag、pol和env外,还包含具有调节或结构功能的其他基因。慢病毒载体是本领域众所周知的。慢病毒的一些实例包括人免疫缺陷病毒:hiv
‑
1、hiv
‑
2和猿猴免疫缺陷病毒:siv。慢病毒载体是通过多重减毒hiv毒力基因生成的,例如,使基因env、vif、vpr、vpu和nef缺失,从而使得载体具有生物安全性。
[0158]
范围:在整个公开内容中,可以以范围形式来呈现本公开的各个方面。应当理解,范围形式的描述仅是为了方便和简洁,而不应被解释为对本公开范围的不可改变的限制。因此,对范围的描述应被认为已明确公开了所有可能的子范围以及所述范围内的各个数值。例如,对范围的描述诸如从1到6应被认为已明确公开了子范围,诸如从1到3、从1到4、从1到5、从2到4、从2到6、从3到6等,以及所述范围内的各个数,例如1、2、2.7、3、4、5、5.3和6。无论范围的宽度如何,这都适用。
[0159]“嵌合抗原受体(car)”分子是至少包括细胞外结构域、跨膜结构域和细胞质结构域或细胞内结构域的重组多肽。在实施方案中,car的结构域在同一多肽链上,例如嵌合融合蛋白。在实施方案中,所述结构域在不同多肽链上,例如结构域是不连续的。
[0160]
car分子的细胞外结构域包括抗原结合结构域。抗原结合结构域可用于扩增和/或维持修饰的细胞(诸如car t细胞),或用于杀死肿瘤细胞(诸如实体瘤)。在实施方案中,用于扩增和/或维持修饰细胞的抗原结合结构域可结合抗原,例如wbc表面上的细胞表面分子或标志物。在实施方案中,wbc是以下各项中的至少一种:gmp(粒细胞巨噬细胞前体)、mdp(单核细胞
‑
巨噬细胞/树突状细胞前体)、cmop(常见单核细胞前体)、嗜碱性粒细胞、嗜酸性粒细胞、嗜中性粒细胞、satm(含七叶形核的非典型单核细胞)、巨噬细胞、单核细胞、cdp(常见树突状细胞前体)、cdc(常规dc)、pdc(浆细胞样dc)、clp(常见淋巴细胞前体)、b细胞、ilc(先天性淋巴细胞)、nk细胞、巨核细胞、成髓细胞、前髓细胞、髓细胞、后髓细胞、杆状核粒细胞、淋巴母细胞、前淋巴细胞、成单核细胞、成巨核细胞、前巨核细胞、巨核细胞、血小板或msdc(髓源性抑制细胞)。在实施方案中,wbc是粒细胞、单核细胞和/或淋巴细胞。在实施方案中,wbc是淋巴细胞,例如b细胞。在实施方案中,wbc是b细胞。在实施方案中,b细胞的细胞表面分子包括cd19、cd22、cd20、bcma、cd5、cd7、cd2、cd16、cd56、cd30、cd14、cd68、cd11b、cd18、cd169、cd1c、cd33、cd38、cd138或cd13。在实施方案中,b细胞的细胞表面分子是cd19、
cd20、cd22或bcma。在实施方案中,b细胞的细胞表面分子是cd19。
[0161]
本文描述的细胞,包括诸如car细胞和修饰t细胞等的修饰细胞,可以来源于干细胞。干细胞可以是成人干细胞、胚胎干细胞、更具体地非人类干细胞、脐带血干细胞、祖细胞、骨髓干细胞、诱导型多能干细胞、全能干细胞、或造血干细胞。修饰的细胞还可以是树突状细胞、nk细胞、b细胞或t细胞,所述t细胞选自炎性t淋巴细胞、细胞毒性t淋巴细胞、调节性t淋巴细胞或辅助性t淋巴细胞。在实施方案中,修饰的细胞可以来源于cd4 t淋巴细胞和cd8 t淋巴细胞。在对本发明的细胞进行扩增和基因修饰之前,可以通过各种非限制性方法从受试者中获得细胞来源。t细胞可获自多种非限制性来源,包括外周血单核细胞、骨髓、淋巴结组织、脐带血、胸腺组织、感染部位的组织、腹水、胸腔积液、脾脏组织和肿瘤。在本发明的某些实施方案中,可以使用本领域技术人员可获得和已知的任何数量的t细胞系。在实施方案中,修饰的细胞可来源于健康供体,来源于诊断患有癌症的患者或诊断为感染的患者。在实施方案中,修饰的细胞是呈现不同表型特征的混合细胞群的一部分。
[0162]
细胞群是指两个或更多个细胞的组。细胞群中的细胞可以是相同的,以使得细胞群是同质细胞群。细胞群中的细胞可以是不同的,以使得细胞群是混合细胞群或异质细胞群。例如,混合细胞群可以包括:含有第一car的修饰细胞;以及含有第二car的细胞,其中第一car和第二car结合不同抗原。
[0163]
术语“干细胞”是指具有自我更新能力和分化成其他类型细胞能力的某些类型的细胞中的任何一种。例如,干细胞产生两个子干细胞(如在体外与胚胎干细胞培养时发生)或一个干细胞和经历分化的细胞(如在可产生血细胞的造血干细胞中发生)。不同类别的干细胞可以基于其来源和/或其分化成其他类型细胞的能力程度来加以区分。例如,干细胞可以包括胚胎干(es)细胞(即多能干细胞)、体干细胞、诱导型多能干细胞以及任何其他类型干细胞。
[0164]
多能胚胎干细胞可存在于胚泡内细胞团中,并且具有先天分化能力。例如,多能胚胎干细胞具有在体内形成任何类型细胞的潜力。当体外长时间生长时,es细胞保持多能性,因为子代细胞保留了多向分化的潜力。
[0165]
体干细胞可以包括胎儿干细胞(来自胎儿)和成人干细胞(存在于各种组织中,诸如骨髓)。这些细胞被认为具有低于多能es细胞的分化能力,其中胎儿干细胞的能力大于成人干细胞的能力。体干细胞显然仅分化成有限数量类型的细胞,并被描述为专能的(multipotent)。“组织特异性”干细胞通常仅产生一种类型的细胞。例如,胚胎干细胞可以分化成血液干细胞(例如,造血干细胞(hsc)),其可以进一步分化成各种血细胞(例如,红细胞、血小板、白细胞等)。
[0166]
诱导型多能干细胞(即ips细胞或ipsc)可以包括通过诱导特定基因表达而人工衍生自非多能细胞(例如,成人体细胞)的一种多能干细胞。诱导型多能干细胞在许多方面类似于天然存在的多能干细胞(诸如胚胎干(es)细胞),所述方面诸如某些干细胞基因和蛋白质的表达、染色质甲基化模式、倍增时间、类胚体形成、畸胎瘤形成、可活嵌合体形成以及潜力和可分化性。诱导型多能细胞可获自成人胃、肝、皮肤和血液细胞。
[0167]
在实施方案中,用于杀死肿瘤的抗原结合结构域可结合肿瘤表面上的抗原,例如肿瘤抗原或肿瘤标志物。肿瘤抗原是由肿瘤细胞产生的引发免疫应答的蛋白质,特别是t细胞介导的免疫应答。肿瘤抗原是本领域众所周知的,并且包括例如肿瘤相关的muc1
(tmuc1)、神经胶质瘤相关抗原、癌胚抗原(cea)、β
‑
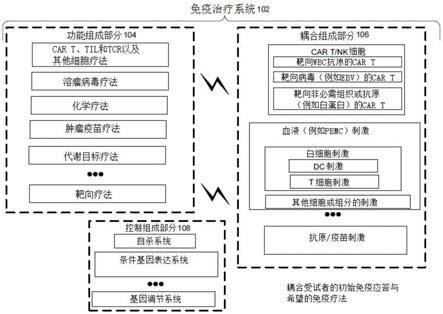
人绒毛膜促性腺激素、甲胎蛋白(afp)、凝集素反应性afp、甲状腺球蛋白、rage
‑
1、mn
‑
ca ix、人端粒酶逆转录酶、ru1、ru2(as)、肠羧酸酯酶、mut hsp70
‑
2、m
‑
csf、前列腺酶(prostase)、前列腺特异性抗原(psa)、pap、ny
‑
eso
‑
1、lage
‑
1a、p53、前列腺特异性蛋白(prostein)、psma、her2/neu、存活素、端粒酶、前列腺癌肿瘤抗原
‑
1(pcta
‑
1)、mage、elf2m、中性粒细胞弹性蛋白酶、肝配蛋白b2、cd22、胰岛素生长因子(igf)
‑
i、igf
‑
ii、igf
‑
i受体、cd19和间皮素。例如,当肿瘤抗原是cd19时,其car可被称为cd19 car或19car,所述cd19 car或19car是包括结合cd19的抗原结合结构域的car分子。
[0168]
在实施方案中,car的细胞外抗原结合结构域包括至少一个scfv或至少单域抗体。作为实例,在car上可以存在两个scfv。scfv包括通过柔性接头连接的靶抗原特异性单克隆抗体的轻链可变(vl)区和重链可变(vh)区。通过使用短连接肽连接轻链可变区和/或重链可变区可制备单链可变区片段(bird等人,science 242:423
‑
426,1988)。连接肽的实例是具有氨基酸序列(ggggs)3(seq id:278)的gs接头,其在一个可变区的羧基末端和另一可变区的氨基末端之间桥接约3.5nm。已设计并使用了其他序列的接头(bird等人,1988,同上)。通常,接头可以是短的柔性多肽,并且优选包含约20个或更少的氨基酸残基。单链变体可以重组或合成产生。针对scfv的合成产生,可以使用自动合成仪。针对scfv的重组产生,可以将合适的含有编码scfv的多核苷酸的质粒引入合适的宿主细胞中,所述宿主细胞可以是真核生物,诸如酵母、植物、昆虫或哺乳动物细胞,或者可以是原核生物,诸如大肠杆菌。编码感兴趣的scfv的多核苷酸可以通过常规操作诸如多核苷酸的连接来制备。可以使用本领域已知的标准蛋白质纯化技术分离所得的scfv。
[0169]
本文描述的car分子的细胞质结构域包括一个或多个共刺激结构域和一个或多个信号传导结构域。共刺激结构域和信号传导结构域的功能在于响应于抗原结合而传递信号并激活分子,诸如t细胞。一个或多个共刺激结构域衍生自刺激分子和/或共刺激分子,信号传导结构域衍生自初级信号传导结构域,诸如cd3ζ结构域。在实施方案中,信号传导结构域还包括一个或多个衍生自共刺激分子的功能性信号传导结构域。在实施方案中,共刺激分子是用于激活针对抗原的细胞应答所必需的细胞表面分子(除抗原受体或其配体以外)。
[0170]
在实施方案中,共刺激结构域包括以下的细胞内结构域:cd27、cd28、4
‑
1bb、ox40、cd30、cd40、pd
‑
1、icos、淋巴细胞功能相关抗原
‑
1(lfa
‑
1)、cd2、cd7、light、nkg2c、b7
‑
h3、与cd83特异性结合的配体、或其任何组合。在实施方案中,信号传导结构域包括衍生自t细胞受体的cd3ζ结构域。
[0171]
本文描述的car分子还包括跨膜结构域。将跨膜结构域并入car分子可使分子稳定。在实施方案中,car分子的跨膜结构域是cd28或4
‑
1bb分子的跨膜结构域。
[0172]
在car的细胞外结构域与跨膜结构域之间,可以并入间隔域。如本文所用,术语“间隔域”通常意指在多肽链上起到将跨膜结构域连接至细胞外结构域和/或细胞质结构域作用的任何寡肽或多肽。间隔域可以包含高达300个氨基酸,优选地10至100个氨基酸,并且最优选地25至50个氨基酸。
[0173]
本公开描述了用于体外细胞制备的方法,该方法包括:准备细胞;将细胞与(1)第一载体和(2)第二载体接触以获得修饰细胞群,第一载体包含编码第一抗原结合分子的多核苷酸,所述第一抗原结合分子结合第一抗原,第二载体包含编码第二抗原结合分子的多核苷酸,所述第二抗原结合分子结合第二抗原,其中第一抗原与第二抗原不同。
[0174]
本公开还描述了用于增强患有癌症的受试者中细胞扩增的方法,该方法包括:从受试者或健康供体中获得细胞;将细胞与(1)第一载体和(2)第二载体接触以获得修饰细胞群,第一载体包含编码第一抗原结合分子的多核苷酸,所述第一抗原结合分子结合第一抗原,第二载体包含编码第二抗原结合分子的多核苷酸,所述第二抗原结合分子结合第二抗原;以及向受试者施用有效量的修饰细胞,其中:第一抗原与第二抗原不同;并且与施用有效量的与第一载体接触而没有与第二载体接触的细胞的受试者中细胞扩增水平相比,施用有效量的修饰细胞的受试者中细胞扩增水平更高。
[0175]
本公开还描述了用于治疗患有癌症的受试者的方法,该方法包括:从受试者或健康供体中获得细胞;将细胞与(1)第一载体和(2)第二载体接触以获得修饰细胞群,第一载体包含编码第一抗原结合分子的多核苷酸,所述第一抗原结合分子结合第一抗原,第二载体包含编码第二抗原结合分子的多核苷酸,所述第二抗原结合分子结合第二抗原;以及向受试者施用有效量的修饰细胞,其中:第一抗原与第二抗原不同。
[0176]
本公开还描述了用于增强患有癌症的受试者的治疗的方法,该方法包括:从受试者或健康供体中获得细胞;将细胞与(1)第一载体和(2)第二载体接触以获得修饰细胞群,第一载体包含编码第一抗原结合分子的多核苷酸,所述第一抗原结合分子结合第一抗原,第二载体包含编码第二抗原结合分子的多核苷酸,所述第二抗原结合分子结合第二抗原;以及向受试者施用有效量的修饰细胞,其中:第一抗原与第二抗原不同;并且与有效量的与第二载体接触而没有与第一载体接触的细胞所引起的肿瘤生长抑制水平相比,有效量的修饰细胞所引起的肿瘤生长抑制水平更高。
[0177]
本公开还描述了用于体外细胞制备的方法,该方法包括:将第一载体引入第一细胞群中,第一载体包含编码第一抗原结合分子的多核苷酸,所述第一抗原结合分子结合第一抗原;将第二载体引入第二细胞群中,第二载体包含编码第二抗原结合分子的多核苷酸,所述第二抗原结合分子结合第二抗原;以及培养第一细胞群和第二细胞群,其中第一抗原与第二抗原不同。
[0178]
本公开还描述了用于增强患有癌症的受试者中细胞扩增的方法,该方法包括:将第一载体引入第一细胞群中以获得第一修饰细胞群,第一载体包含编码第一抗原结合分子的多核苷酸,所述第一抗原结合分子结合第一抗原;将第二载体引入第二细胞群中以获得第二修饰细胞群,第二载体包含编码第二抗原结合分子的多核苷酸,所述第二抗原结合分子结合第二抗原;以及向受试者施用有效量的第一修饰细胞群和第二修饰细胞群,其中:第一抗原与第二抗原不同;并且与施用有效量的第二修饰细胞群而非第一修饰细胞群的受试者中细胞扩增水平相比,施用有效量的第一修饰细胞群和第二修饰细胞群的受试者中细胞扩增水平更高。
[0179]
本公开还描述了用于治疗患有癌症的受试者的方法,该方法包括:将第一载体引入第一细胞群中以获得第一修饰细胞群,第一载体包含编码第一抗原结合分子的多核苷酸,所述第一抗原结合分子结合第一抗原;将第二载体引入第二细胞群中以获得第二修饰细胞群,第二载体包含编码第二抗原结合分子的多核苷酸,所述第二抗原结合分子结合第二抗原;以及向受试者施用有效量的第一修饰细胞群和第二修饰细胞群,其中:第一抗原与第二抗原不同。
[0180]
本公开还描述了用于增强患有癌症的受试者的治疗的方法,该方法包括:将第一
载体引入第一细胞群中以获得第一修饰细胞群,第一载体包含编码第一抗原结合分子的多核苷酸,所述第一抗原结合分子结合第一抗原;将第二载体引入第二细胞群中以获得第二修饰细胞群,第二载体包含编码第二抗原结合分子的多核苷酸,所述第二抗原结合分子结合第二抗原;以及向受试者施用有效量的第一修饰细胞群和第二修饰细胞群,其中:第一抗原与第二抗原不同;并且与施用有效量的第二修饰细胞群而非第一修饰细胞群的受试者中肿瘤生长抑制水平相比,施用有效量的第一修饰细胞群的受试者中肿瘤生长抑制水平更高。
[0181]
本公开还描述了用于增强t细胞应答的方法,该方法包括:将第一载体引入第一细胞群中,第一载体包含编码第一抗原结合分子的多核苷酸,所述第一抗原结合分子结合第一抗原;将第二载体引入第二细胞群中,第二载体包含编码第二抗原结合分子的多核苷酸,所述第二抗原结合分子结合第二抗原;将表达第二抗原的细胞与第一细胞群和第二细胞群接触;以及测量t细胞应答水平,其中与响应于与第二细胞群接触而没有与第一细胞群接触的细胞的t细胞应答水平相比,响应于与第一细胞群和第二细胞群接触的细胞的t细胞应答水平更高。
[0182]
本公开还描述了用于增强t细胞应答的方法,该方法包括:将细胞群与第一载体和第二载体接触以获得修饰细胞群,第一载体包含编码第一抗原结合分子的多核苷酸,所述第一抗原结合分子结合第一抗原,第二载体包含编码第二抗原结合分子的多核苷酸,所述第二抗原结合分子结合第二抗原;将表达第二抗原的细胞与修饰细胞群接触;以及测量t细胞应答水平,其中:与接触过第二载体而没有接触过第一载体的细胞群接触的细胞中t细胞应答水平相比,与通过第一载体和第二载体接触获得的修饰细胞群接触的细胞中t细胞应答水平更高。
[0183]
细胞包括巨噬细胞、树突状细胞或淋巴细胞,诸如t细胞或nk细胞。在实施方案中,细胞是t细胞。在实施方案中,第一抗原结合分子可结合wbc的细胞表面分子。在实施方案中,wbc是粒细胞、单核细胞或淋巴细胞。在实施方案中,wbc是b细胞。在实施方案中,wbc的细胞表面分子是cd19、cd22、cd20、bcma、cd5、cd7、cd2、cd16、cd56、cd30、cd14、cd68、cd11b、cd18、cd169、cd1c、cd33、cd38、cd138或cd13。在实施方案中,wbc的细胞表面分子是cd19、cd20、cd22或bcma。在实施方案中,wbc的细胞表面分子是cd19。
[0184]
在实施方案中,第二抗原结合分子可结合实体瘤抗原。在实施方案中,实体瘤抗原是肿瘤相关muc1(tmuc1)、prlr、clca1、muc12、gucy2c、gpr35、cr1l、muc 17、tmprss11b、muc21、tmprss11e、cd207、slc30a8、cfc1、slc12a3、sstr1、gpr27、fzd10、tshr、siglec15、slc6a3、cldn18.2、kiss1r、qrfpr、gpr119、cldn6、upk2、adam12、slc45a3、acpp、muc21、muc16、ms4a12、alpp、cea、epha2、fap、gpc3、il13
‑
ra2、间皮素、psma、ror1、vegfr
‑
ii、gd2、fr
‑
α、erbb2、epcam、egfrviii或egfr。
[0185]
在实施方案中,第一结合分子和第二结合分子是car。在实施方案中,car包括细胞外结构域、跨膜结构域和细胞内结构域,并且细胞外结构域结合肿瘤抗原。在一些实施方案中,细胞内结构域包含共刺激结构域,所述共刺激结构域包括选自以下各项的共刺激分子的细胞内结构域:cd27、cd28、4
‑
1bb、ox40、cd30、cd40、pd
‑
1、icos、淋巴细胞功能相关抗原
‑
1(lfa
‑
1)、cd2、cd7、light、nkg2c、b7
‑
h3及其任何组合。在实施方案中,细胞内结构域包含cd3ζ信号传导结构域。
[0186]
在实施方案中,第一结合分子是car,第二结合分子是tcr。在实施方案中,t细胞包
括修饰的t细胞受体(tcr)。在实施方案中,tcr来源于患者中自发产生的肿瘤特异性t细胞。在实施方案中,tcr结合肿瘤抗原。在实施方案中,肿瘤抗原包括cea、gp100、mart
‑
1、p53、mage
‑
a3或ny
‑
eso
‑
1。在实施方案中,tcr包括tcrγ和tcrδ链、或tcrα和tcrβ链、或其组合。
[0187]
在实施方案中,第二细胞群来源于肿瘤浸润淋巴细胞(til)。在实施方案中,可以分离t细胞克隆物,所述t细胞克隆物可表达对靶抗原具有高亲和力的tcr。可以在肽负载的抗原呈递细胞(apc)存在下培养til或外周血单核细胞(pbmc),所述肽表示当存在于特定hla等位基因背景下时已知可引起显性t细胞应答的表位。然后可以基于mhc
‑
肽四聚体染色和/或识别和裂解靶细胞的能力来选择高亲和力克隆物,所述靶细胞用低滴定浓度的同源肽抗原负载。在选择克隆物后,通过分子克隆鉴定和分离tcrα和tcrβ链或tcrγ和tcrδ链。例如,对于tcrα和tcrβ链,然后使用tcrα和tcrβ基因序列来生成表达构建体,所述表达构建体可理想地促进人t细胞中两条tcr链的稳定、高水平表达。然后可生成转导媒介物(例如γ逆转录病毒或慢病毒)并测试其功能性(抗原特异性和功能亲合力),将其用于产生大量的临床载体。等分试样的最终产品然后可用于转导靶t细胞群(通常从患者pbmc中纯化),所述靶t细胞群在输注到患者之前进行扩增。
[0188]
可实施各种方法来获得编码肿瘤反应性tcr的基因。更多信息提供在kershaw等人,clin transl immunology.2014年5月;3(5):e16中。在实施方案中,特异性tcr可来源于患者中自发产生的肿瘤特异性t细胞。此类别中包括的抗原包括黑色素细胞分化抗原mart
‑
1和gp100,以及mage抗原和ny
‑
eso
‑
1,它们在更广泛的癌症中表达。只要病毒蛋白由转化细胞表达,对病毒相关的恶性肿瘤具有特异性的tcr也可以被分离。此类别中的恶性肿瘤包括与肝炎和乳头瘤病毒相关的肝癌和宫颈癌,以及与爱泼斯坦
‑
巴尔病毒相关的恶性肿瘤。在实施方案中,tcr的靶抗原包括cea(例如,针对结肠直肠癌)、gp100、mart
‑
1、p53(例如,针对黑色素瘤)、mage
‑
a3(例如,黑色素瘤、食管肉瘤和滑膜肉瘤)和ny
‑
eso
‑
1(例如,针对黑色素瘤和肉瘤以及多发性骨髓瘤)。
[0189]
在实施方案中,可以按照下列方式实施肿瘤浸润淋巴细胞(til)的制备和输注。例如,在无菌条件下获得来自外科手术或活检样本的肿瘤组织,并将其运送到冰箱中的细胞培养室中。去除坏死组织和脂肪组织。将肿瘤组织切成约1
‑
3立方毫米的小块。加入胶原酶、透明质酸酶和dna酶,并在4℃下消化过夜。用0.2μm过滤器进行过滤,并通过淋巴细胞分离液在1500rpm下离心5min分离和收集细胞。在包含pha、2
‑
巯基乙醇和cd3单克隆抗体的培养基中扩增细胞,并且可以加入小剂量的il
‑
2(10
‑
20iu/ml)来诱导激活和增殖。在37℃、5%co2下,仔细测量细胞密度并将其维持在0.5
‑2×
106/ml的范围内7
‑
14天。可以通过共培养筛选出具有杀死同源癌细胞能力的til阳性细胞。可以在含有高剂量的il
‑
2(5000
‑
6000iu/ml)的无血清培养基中扩增til阳性细胞,直到获得大于1
×
10
11
的til。为了施用til,首先使用连续离心法将其收集在盐水中,然后通过血小板施用装置过滤至200
‑
300ml的体积,其中含有5%的白蛋白和450000iu的il
‑
2。可以在30
‑
60分钟内通过中心静脉导管将til输注到患者体内。在实施方案中,可以将til输注到2至4个单独的袋子中,并且每次输注可以间隔若干小时。
[0190]
在实施方案中,修饰细胞群包括:包含第一结合分子的细胞;和包含第二结合分子的细胞。在实施方案中,修饰细胞群包括:包含第一结合分子的细胞、包含第二结合分子的细胞、以及包含第一结合分子和第二结合分子两者的细胞。
[0191]
在实施方案中,t细胞应答的增加是基于car拷贝数的增加和/或释放的细胞因子
(例如il
‑
6和ifn
‑
γ)量的增加。在实施方案中,t细胞应答包括细胞因子释放、细胞扩增和/或激活水平。在实施方案中,第一载体还包含编码il
‑
6或ifnγ或其组合的多核苷酸。在实施方案中,第一载体还包含编码il
‑
12的多核苷酸。在实施方案中,多核苷酸包括编码nfat和/或vhl的多核苷酸。在实施方案中,修饰细胞群包括:表达第一结合分子以及il
‑
6或ifnγ或其组合的细胞,表达第二结合分子的细胞,表达第一结合分子和第二结合分子的细胞;和/或表达第一结合分子和il
‑
12的细胞。在实施方案中,修饰细胞群包括:表达第二结合分子以及il
‑
6或ifnγ或其组合的细胞;表达第二结合分子的细胞;表达第一结合分子和第二结合分子的细胞;和/或表达第一结合分子和il
‑
12的细胞。在实施方案中,修饰细胞群包括:表达第二结合分子以及il
‑
6或ifnγ或其组合的细胞;表达第二结合分子的细胞;表达第一结合分子和第二结合分子的细胞;和/或表达第二结合分子和il
‑
12的细胞。在实施方案中,修饰细胞群包括表达显性失活形式pd
‑
1的细胞。
[0192]
本公开描述了编码至少两个不同抗原结合结构域的核酸。在实施方案中,存在与wbc表面上的抗原结合的第一抗原结合结构域,并且存在与肿瘤上的抗原结合的第二抗原结合结构域,肿瘤上的抗原不同于wbc表面上的抗原。第一抗原结合结构域的功能在于使细胞扩增,所述细胞中引入了第一抗原结合结构域,而第二抗原结合结构域的功能在于与靶抗原结合后,抑制含有靶肿瘤抗原的肿瘤细胞生长或杀死所述肿瘤细胞。在实施方案中,本文描述的核酸编码同一核酸分子上的第一抗原结合结构域和第二抗原结合结构域两者。在实施方案中,两个抗原结合结构域由两个单独的核酸分子编码。例如,第一核酸编码第一抗原结合结构域,第二核酸编码第二抗原结合结构域。
[0193]
在实施方案中,本公开描述了编码结合分子的第一抗原结合结构域和结合分子的第二抗原结合结构域的核酸,其中第一抗原结合结构域结合wbc的细胞表面分子,第二抗原结合结构域结合与wbc的细胞表面分子不同的抗原。在实施方案中,第一抗原结合结构域可结合b细胞的细胞表面抗原或b细胞标志物。在实施方案中,第二结合结构域不与b细胞标志物结合。在实施方案中,第二结合结构域包括scfv,其包含seq id no:264或265的氨基酸序列。例如,第二抗原结合结构域在具有seq id no:271
‑
277的氨基酸序列之一的car上。
[0194]
在实施方案中,第一抗原结合结构域和第二抗原结合结构域在两个不同的结合分子(第一结合分子和第二结合分子)上,诸如第一car和第二car。作为实例,第一car包括与b细胞表面上的标志物结合的细胞外结合结构域,第二car包括与肿瘤细胞的靶抗原结合的细胞外结合结构域。在实施方案中,第一car和第二car由不同核酸编码。在实施方案中,第一car和第二car是两个不同的结合分子,但由单个核酸编码。
[0195]
在实施方案中,两个不同的抗原结合结构域可在同一结合分子上,例如在双特异性car上,并由单个核酸编码。在实施方案中,双特异性car可具有由接头连接在一起的两个不同的scfv分子。双特异性car的实例提供在表2中。
[0196]
双特异性car的一个实例在图5中示出。如图5所示,双特异性car(或串联car(tancar))可包括两个结合结构域:scfv1和scfv2。在实施方案中,scfv1结合白细胞抗原(例如,cd19),scfv2结合实体瘤抗原(例如,tmuc1)。在实施方案中,scfv1结合一种实体瘤抗原,scfv2结合另一种实体瘤抗原(例如,tmuc1和cldn 18.2)。claudin18.2(cldn 18.2)是claudin
‑
18的胃特异性亚型。cldn 18.2在胃癌和胰腺癌中高度表达。在实施方案中,scfv1结合在肿瘤细胞上而非正常组织上表达的抗原(例如,tmuc1);scfv2结合在与实体瘤
相关的非必需组织上表达的抗原,并且杀死组织的正常细胞不会对受试者造成危及生命的事件(例如,并发症)(例如,tshr、gucy2c)。非必需组织的实例包括诸如前列腺、乳腺这样的器官、或黑色素细胞。在实施方案中,scfv1和scfv2结合在相同非必需组织上表达的不同抗原(例如,针对前列腺癌的acpp和slc45a3,以及针对尿路上皮癌的siglec15和upk2)。双特异性car及其组成部分的序列可见于表2中。
[0197]
表2
[0198][0199]
[0200][0201]
3*(ggggs)是(ggggs)3,4*(ggggs)是(ggggs)4。
[0202]
在实施方案中,两个不同的抗原结合结构域可在car和t细胞受体(tcr)上并由单独的核酸编码。tcr的结合结构域可靶向肿瘤细胞上的特异性肿瘤抗原或肿瘤标志物。在实施方案中,tcr结合结构域是靶向特异性肿瘤抗原的tcrα结合结构域或tcrβ结合结构域。在实施方案中,tcr包含tcrγ和tcrδ链或tcrα和tcrβ链。
[0203]
本公开还描述了包含本文所述的核酸的载体。在实施方案中,单个载体包含编码第一car和第二car或tcr(含有第二抗原结合结构域)的核酸。在实施方案中,第一载体包含编码第一car的第一核酸,第二载体包含编码第二car或tcr的核酸。在实施方案中,载体包含编码双特异性car的核酸,所述双特异性car至少包括两个不同的抗原结合结构域。在实施方案中,包括本文所述的核酸的载体是慢病毒载体。
[0204]
此外,本公开描述了包含本文所述的核酸或载体的修饰细胞。将细胞与本文所述的核酸或载体一起引入,并表达至少一个或多个不同的抗原结合结构域。在实施方案中,细胞表达一个抗原结合结构域。在实施方案中,细胞包括第一抗原结合结构域和第二抗原结合结构域,其中第一抗原结合结构域结合wbc的细胞表面分子,第二抗原结合结构域结合与wbc的细胞表面分子不同的抗原。在实施方案中,第二抗原结合结构域可结合肿瘤抗原。在实施方案中,细胞是修饰的t细胞。在实施方案中,修饰的t细胞是car t细胞,所述car t细胞包括编码第一抗原结合结构域和/或第二抗原结合结构域的一种或多种核酸。在实施方案中,修饰的细胞包括含有tcr的t细胞,所述tcr包括第二抗原结合结构域。
[0205]
此外,本公开描述了包含本文所述的混合修饰细胞群的组合物。在实施方案中,修饰的细胞包括修饰的淋巴细胞、修饰的树突状细胞和修饰的巨噬细胞。在实施方案中,修饰的淋巴细胞是修饰的t细胞或修饰的nk细胞。在实施方案中,修饰的t细胞是car t细胞。
[0206]
本公开还描述了混合修饰细胞群,其有效用于在患者中扩增和/或维持修饰的细
胞。在实施方案中,混合修饰细胞群的实例包括以下各项:(1)表达用于扩增和/或维持修饰细胞的抗原结合结构域的第一修饰细胞以及表达用于杀死靶细胞(诸如肿瘤细胞)的抗原结合结构域的第二修饰细胞;(2)(1)的修饰细胞以及表达至少两个不同抗原结合结构域的其他修饰细胞,所述两个不同抗原结合结构域为:用于扩增和/或维持修饰细胞的第一抗原结合结构域;和用于杀死靶细胞的第二抗原结合结构域(其中两个不同的抗原结合结构域在同一细胞上表达);(3)表达至少两个不同抗原结合结构域的修饰细胞,所述两个不同抗原结合结构域为:用于扩增和/或维持修饰细胞的第一抗原结合结构域;和用于杀死靶细胞的第二抗原结合结构域(其中两个不同的抗原结合结构域在同一细胞上表达);(4)表达用于杀死靶细胞的抗原结合结构域的修饰细胞以及表达至少两个抗原结合结构域的修饰细胞,所述两个抗原结合结构域为:用于扩增和/或维持修饰细胞的第一抗原结合结构域;和用于杀死靶细胞的第二抗原结合结构域(其中两个不同的抗原结合结构域在同一细胞上表达);或(5)表达用于扩增和/或维持修饰细胞的抗原结合结构域的修饰细胞以及表达至少两个抗原结合结构域的修饰细胞,所述两个抗原结合结构域为:用于扩增和/或维持修饰细胞的第一抗原结合结构域;和用于杀死靶细胞的第二抗原结合结构域(其中两个不同的抗原结合结构域在同一细胞上表达)。在实施方案中,两个抗原结合结构域是不同的分子。在实施方案中,用于扩增修饰细胞的抗原结合结构域(第一抗原结合结构域)是结合wbc(诸如b细胞)的抗原结合结构域,用于杀死靶细胞(诸如肿瘤细胞)的抗原结合结构域(第二抗原结合结构域)是结合肿瘤的抗原结合结构域。在实施方案中,结合b细胞的抗原结合结构域结合b细胞的表面抗原,例如cd19,结合肿瘤的抗原结合结构域结合肿瘤抗原,例如tmuc1。在实施方案中,肿瘤细胞是实体瘤细胞。
[0207]
在实施方案中,混合修饰细胞群可包括以下修饰细胞中的至少一种:第一修饰细胞,其表达用来扩增和/或维持修饰细胞的抗原结合结构域;第二修饰细胞,其表达用来杀死靶细胞(诸如肿瘤细胞)的抗原结合结构域;以及第三修饰细胞,其表达用来扩增和/或维持修饰细胞的抗原结合结构域和用来杀死靶细胞的抗原结合结构域两者。例如,混合修饰细胞群包括第一修饰细胞和第二修饰细胞,第一修饰细胞和第三修饰细胞,或第二修饰细胞和第三修饰细胞。在实施方案中,第一修饰细胞表达结合wbc抗原(例如,cd19)的car;第二修饰细胞表达结合实体瘤抗原的car或tcr;第三修饰细胞表达结合wbc抗原的car和结合实体瘤抗原的car/tcr。据报道,持续的抗原暴露可引起t细胞耗竭。因此,与混合修饰细胞群相比,包括第三修饰细胞的修饰细胞群的耗竭率更高。例如,在wbc抗原存在下,与包括第一修饰细胞和第二修饰细胞的混合修饰细胞群相比,包括单独第三修饰细胞的修饰细胞群的耗竭率更高。tcr的实体瘤抗原的实例包括tpo、tgm3、tdgf1、trop2、ly6k、tnfsf13b、heg1、ly75、hla
‑
g、ceacam8、ceacam6、epha2、gprc5d、plxdc2、havcr1、clec12a、cd79b、or51e2、cdh17、ifitm1、meltf、dr5、slc6a3、itgam、slc44a1、rhoc、cd109、abcg2、abca10、abcg8、5t4、hhla2、prame、cdh6、esr1、slc2a1、gja5、alpp、fgd2、pmel、cyp19a1、mlana、steap1、ssx2、plac1、ankrd30a、cpa2、ttn、zdhhc23、arpp21、rbpms、pax5、mia、ciz1、amacr、bap31、ido1、pgr、rad51、usp17l2、olah、igf2bp3、sts、igf2、acta1、或ctag1。
[0208]
本文所述的混合修饰细胞群包括约1%至10%的表达第一抗原结合结构域的修饰细胞;50%至60%的表达第二抗原结合结构域的修饰细胞;以及约10%的表达第一抗原结合结构域和第二抗原结合结构域两者的修饰细胞(其中第一抗原结合结构域和第二抗原结
合结构域在单个细胞中表达)。
[0209]
本公开还描述了培养本文所述的细胞的方法。本文所述的方法包括获得包含第一抗原结合结构域和/或第二抗原结合结构域的细胞,其中第一抗原结合结构域结合wbc的细胞表面分子,第二抗原结合结构域结合与wbc的细胞表面分子不同的抗原;以及在一种试剂的存在下培养细胞,所述试剂衍生自wbc的细胞表面分子或衍生自第二抗原结合结构域所结合的抗原。在实施方案中,试剂是wbc的细胞表面分子的细胞外结构域。
[0210]
本公开还描述了培养本文所述的混合细胞群的方法。本文所述的方法包括获得包含第一抗原结合结构域和/或第二抗原结合结构域的混合细胞群,其中第一抗原结合结构域结合wbc的细胞表面分子,第二抗原结合结构域结合与wbc的细胞表面分子不同的抗原;以及在一种试剂的存在下培养细胞,所述试剂衍生自wbc的细胞表面分子或衍生自第二抗原结合结构域所结合的抗原。在实施方案中,试剂是wbc的细胞表面分子的细胞外结构域。
[0211]
本公开描述了用于体外细胞制备的方法,其中方法包括提供细胞;将本文所述的编码第一抗原结合结构域和/或第二抗原结合结构域的一种或多种核酸引入细胞中,其中第一抗原结合结构域结合wbc的细胞表面分子,第二抗原结合结构域结合与wbc的细胞表面分子不同的抗原;以及在一种试剂的存在下培养细胞,所述试剂衍生自wbc的细胞表面分子或衍生自第二抗原结合结构域所结合的抗原。方法提供了包括第一抗原结合结构域的基因修饰细胞,包括第二抗原结合结构域的细胞,以及包括第一抗原结合结构域和第二抗原结合结构域两者的细胞。方法提供了具有单个抗原结合结构域的细胞以及表达两个抗原结合结构域的细胞。方法还提供了混合细胞群,所述混合细胞群包括含有单个抗原结合结构域的细胞以及表达两个抗原结合结构域的细胞。此外,方法提供了包含本文所述的混合细胞群的组合物。
[0212]
本公开描述了使用所制备的细胞制剂、混合细胞群、或混合细胞群的组合物来增强和维持患癌受试者中的t细胞扩增,以便有效杀死受试者中的致癌细胞。在实施方案中,方法包括将本文所述的多种核酸引入t细胞中,获得混合修饰t细胞群,所述多种核酸编码结合实体瘤抗原的嵌合抗原受体(car)或tcr和/或编码结合wbc抗原的car;以及向受试者施用有效量的混合修饰细胞群,其中混合修饰细胞群的实例包括以下各项:(1)含有结合实体瘤抗原的car或tcr的t细胞以及含有结合wbc抗原的car的t细胞;(2)(1)的t细胞以及另外的含有(i)结合实体瘤抗原的car或tcr和(ii)结合wbc抗原的car两者的t细胞((i)和(ii)两者在单个修饰t细胞中);(3)含有(i)结合实体瘤抗原的car或tcr和(ii)结合wbc抗原的car两者的t细胞((i)和(ii)两者在单个修饰t细胞中);(4)含有结合实体瘤抗原的car或tcr的t细胞以及含有(i)结合实体瘤抗原的car或tcr和(ii)结合wbc抗原的car两者的t细胞((i)和(ii)两者在单个修饰t细胞中);或(5)含有结合wbc抗原的car的t细胞以及含有(i)结合实体瘤抗原的car或tcr和(ii)结合wbc抗原的car两者的t细胞((i)和(ii)两者在单个修饰t细胞中)。在实施方案中,wbc是b细胞。此外,本公开描述了用于在受试者中引入和/或增强淋巴细胞(t细胞)应答的方法,其中应答针对治疗剂(例如细胞因子)或针对治疗受试者的疗法。本文描述的实施方案涉及扩增和/或维持淋巴细胞的机制以及涉及car与肿瘤细胞结合的机制。在实施方案中,第一种机制涉及与扩增和/或维持受试者中淋巴细胞相关的分子,而另一种机制涉及与抑制受试者中肿瘤细胞生长或杀死受试者中肿瘤细胞的分子。在实施方案中,这些机制涉及信号转导,并且负责信号转导的分子或分子的结构域也涉
及本文所述的机制。例如,第一种机制包括结合与血液(诸如血细胞和血浆)或非必需组织相关的抗原的car,另一种机制包括靶向与肿瘤细胞相关的抗原的car或tcr。非必需组织的实例包括乳腺、结肠、胃腺、卵巢、血液组分(诸如wbc)和甲状腺。在实施方案中,第一种机制涉及分子的第一抗原结合结构域,另一种机制涉及分子的第二抗原结合结构域。在实施方案中,第一种机制和另一种机制由混合修饰细胞群执行。在实施方案中,一种机制涉及表达与肿瘤细胞相关的抗原的细胞,而另一种机制涉及表达细胞表面抗原的淋巴细胞(诸如b细胞)。在实施方案中,结合实体瘤抗原的car是双特异性car。在实施方案中,结合wbc抗原的car是双特异性car。
[0213]
本文所述的方法涉及表达扩增分子和功能分子的淋巴细胞。在实施方案中,扩增分子扩增和/或维持受试者中的淋巴细胞,功能分子抑制受试者中肿瘤细胞的生长或杀死受试者中的肿瘤细胞。在实施方案中,扩增分子和功能分子在单个car分子上,例如双特异性car分子。在实施方案中,扩增分子和功能分子在单独的分子上,例如,car和tcr或两个不同的car。扩增分子可以包括结合与血液(例如血细胞和血浆)或非必需组织相关的抗原的car,功能分子可以包括靶向与肿瘤细胞相关的抗原的car或tcr。
[0214]
受试者中的淋巴细胞或t细胞应答是指与辅助细胞、杀伤细胞、调节细胞和其他类型的t细胞相关的细胞介导免疫。例如,t细胞应答可包括诸如在免疫过程中协助其他wbc以及鉴定和破坏病毒感染的细胞和肿瘤细胞的活动。受试者中的t细胞应答可通过各种指标进行测量,诸如:t细胞杀死的病毒感染细胞和/或肿瘤细胞的数量;在体内和/或与病毒感染细胞和/或肿瘤细胞共同培养时t细胞释放的细胞因子(例如,il
‑
6和ifn
‑
γ)的量,这表明受试者中的t细胞增殖水平,t细胞的表型改变(例如记忆t细胞的改变)以及受试者中t细胞的寿命或生命水平。
[0215]
在实施方案中,本文所的增强t细胞应答的方法可有效地治疗有需要的受试者,例如,诊断有肿瘤的受试者。术语肿瘤是指肿块,其可以是诸如血液的流体聚集体,或者是实体肿块。肿瘤可以是恶性的(癌性的)或良性的。血液癌症的实例包括慢性淋巴细胞性白血病、急性髓细胞性白血病、急性淋巴细胞性白血病和多发性骨髓瘤。
[0216]
实体瘤通常不包含囊肿或液体区域。恶性实体瘤的主要类型包括肉瘤和癌瘤。肉瘤是在称为间质细胞的软组织细胞中发展的肿瘤,其可以存在于血管、骨骼、脂肪组织、韧带淋巴管、神经、软骨、肌肉、韧带或肌腱中,而癌瘤是在上皮细胞中形成的肿瘤,其存在于皮肤和粘膜中。最常见的肉瘤类型包括涉及软组织和骨细胞的未分化多形性肉瘤;涉及遍布血管、胃肠道和子宫的平滑肌细胞的平滑肌肉瘤;涉及骨细胞的骨肉瘤以及涉及脂肪细胞的脂肪肉瘤。肉瘤的一些实例包括尤文氏肉瘤、横纹肌肉瘤、软骨肉瘤、间皮瘤、纤维肉瘤和神经胶质瘤。
[0217]
五种最常见的癌瘤包括涉及产生流体或粘液的器官(诸如乳腺和前列腺)的腺癌;涉及皮肤最外层细胞的基底细胞癌,例如皮肤癌;涉及皮肤基底细胞的鳞状细胞癌;以及影响泌尿道中的移行细胞的移行细胞癌,所述泌尿道包括膀胱、肾脏和输尿管。癌瘤的实例包括甲状腺癌、乳腺癌、前列腺癌、肺癌、肠癌、皮肤癌、胰腺癌、肝癌、肾癌和膀胱癌以及胆管癌。
[0218]
本文描述的方法可用于治疗诊断有癌症的受试者。癌症可以是血癌或可以是实体瘤,诸如肉瘤或癌瘤。治疗方法包括向受试者施用有效量的本文所述的混合t细胞群以提供
t细胞应答,所述混合t细胞群包含第一抗原结合结构域和/或第二抗原结合结构域,其中第一抗原结合结构域结合wbc的细胞表面分子,第二抗原结合结构域结合与wbc的细胞表面分子不同的抗原。在实施方案中,增强受试者中的t细胞应答包括在体内选择性增强t细胞的增殖,所述t细胞表达第一抗原结合结构域和第二抗原结合结构域。
[0219]
用于增强受试者中t细胞应答的方法包括向受试者施用包含car或双特异性car的t细胞,所述双特异性car包括两个不同的抗原结合结构域;以及施用包含第一car和第二car的t细胞,其中第一car和第二car各自包括不同的抗原结合结构域。
[0220]
在实施方案中,本文所述的用于增强受试者中t细胞应答的方法包括向受试者施用包含car分子和tcr分子的t细胞。car分子靶向或结合白细胞的表面标志物,tcr分子结合在肿瘤细胞表面或内部表达的肿瘤标志物或抗原。
[0221]
在实施方案中,用于增强有需要的受试者中t细胞应答的方法包括向受试者施用混合修饰细胞群或包含混合修饰细胞群的组合物。混合修饰t细胞群的实例包括以下各项:(1)含有结合wbc抗原的car的t细胞以及含有结合肿瘤抗原的car或tcr的t细胞;(2)(1)的t细胞以及另外的含有(i)结合肿瘤抗原的car或tcr和(ii)结合wbc抗原的car两者的t细胞((i)和(ii)两者在单个修饰t细胞中);(3)含有(i)结合肿瘤抗原的car或tcr和(ii)结合wbc抗原的car两者的t细胞((i)和(ii)两者在单个修饰t细胞中);(4)含有结合肿瘤抗原的car或tcr的t细胞以及含有(i)结合实体瘤抗原的car或tcr和(ii)结合wbc抗原的car两者的t细胞;或(5)含有结合wbc抗原的car的t细胞以及含有(i)结合实体瘤抗原的car或tcr和(ii)结合wbc抗原的car两者的t细胞((i)和(ii)两者在单个修饰t细胞中)。在实施方案中,受试者被诊断具有实体瘤。在实施方案中,肿瘤抗原是实体瘤抗原,例如tmuc1。在实施方案中,wbc是b细胞,抗原是b细胞抗原。在实施方案中,b细胞抗原是cd19。在实施方案中,肿瘤抗原是tmuc1,wbc的抗原是cd19。
[0222]
本公开描述了在体内扩增和/或维持表达抗原结合结构域的细胞的方法。方法包括向受试者施用有效量的本文所述的混合修饰细胞群或包含混合修饰细胞群的组合物。本文所述的这些方法可用于扩增t细胞、nk细胞、巨噬细胞和/或树突状细胞。
[0223]
本文所述的混合修饰t细胞群包括第一car和/或第二car或tcr。在实施方案中,第一car包含第一抗原结合结构域,第二car或tcr包含第二抗原结合结构域。例如,第一car和第二car或tcr包括细胞外抗原结合结构域、跨膜结构域和细胞质结构域。第一car和第二car的细胞质结构域包括用于传递信号以激活细胞应答的共刺激结构域和cd3ζ结构域。在实施方案中,第一car和第二car或tcr在不同修饰t细胞上表达。在实施方案中,第一car和第二car或tcr在同一修饰t细胞上表达。
[0224]
在实施方案中,在本文所述的混合修饰t细胞群中,第一car的细胞质结构域包括一个或多个共刺激结构域且不存在cd3ζ结构域,使得激活或刺激第一car扩增wbc(诸如淋巴细胞),而不会引入和/或激活靶向wbc的修饰t细胞的杀伤功能,其中所述第一car包含用于扩增和/或维持修饰t细胞的抗原结合结构域。在实施方案中,淋巴细胞是t细胞。在实施方案中,当第一car的细胞质结构域包括一个或多个共刺激结构域且不存在cd3ζ结构域时,第二car包括cd3ζ结构域。
[0225]
在实施方案中,第一抗原结合结构域和第二抗原结合结构域在同一car(第一car)上,例如具有细胞外抗原结合结构域、跨膜结构域和细胞质结构域的双特异性car。细胞外
抗原结合结构域包括至少两个scfv,并且scfv中的至少一个用作结合wbc的细胞表面分子的第一抗原结合结构域。在实施方案中,双特异性car在修饰t细胞上表达。
[0226]
在实施方案中,与wbc的细胞表面分子不同的抗原是cd19、cd22、cd20、bcma、cd5、cd7、cd2、cd16、cd56、cd30、cd14、cd68、cd11b、cd18、cd169、cd1c、cd33、cd38、cd138、cd13、b7
‑
h3、caix、cd123、cd133、cd171、cd171/l1
‑
cam、cea、claudin 18.2、cmet、cs1、cspg4、dectin1、egfr、egfr viii、epha2、erbb受体、erbb t4、erbb2、fap、叶酸受体1、fitc、叶酸受体1、fsh、gd2、gpc3、ha
‑
1h/hla
‑
a2、her2、il
‑
11ra、il13受体a2、il13r、il13rα2(zetakine)、kappa、白血病相关抗原、lewisy、间皮素、muc1、nkg2d、ny
‑
eso
‑
1、psma、ror
‑
1、trail受体1或vegfr2。
[0227]
在实施方案中,muc1是人muc1的肿瘤排他性表位,并且第一car和第二car或tcr被表达为单独的多肽。在实施方案中,muc1是人muc1的肿瘤形式(tmuc1)。
[0228]
在实施方案中,在本文所述的混合修饰细胞群中,第一car可包括共刺激结构域且不具有cd3ζ结构域的信号传导结构域,所述第一car包括用于扩增和/或维持修饰细胞的抗原结合结构域,而car(第二car)可包括muc1结合结构域、跨膜结构域、共刺激和cd3ζ结构域。
[0229]
如本文所用,术语“muc1”是指如下所定义的分子。muc1是上皮粘蛋白家族分子之一。muc1是通常在主要器官的所有腺上皮细胞上表达的跨膜粘蛋白糖蛋白。在正常细胞中,muc1仅在腔面上表达,并被碳水化合物隔离的核心蛋白高度糖基化。随着细胞转化为恶性表型,muc1的表达增加数倍,并且表达不再局限于腔面,而是遍布细胞表面和细胞质中。另外,肿瘤相关的muc1(tmuc1)的糖基化异常,其中肽核的暴露量比正常组织中表达的muc1中存在的量更大。
[0230]
muc1在许多上皮癌中广泛表达,并且异常糖基化使其在结构和抗原上相异于非恶性细胞表达的muc1(参见,例如barratt
‑
boyes,1996;price等人,1998;peterson等人,1991)。muc1的主要形式是一种高分子量分子,其包含具有大量的二十个氨基酸串联重复单元的高度免疫原性细胞外粘蛋白样结构域、跨膜区和胞质尾区(quin等人,2000;mcgucken等人,1995;dong等人,1997)。
[0231]
在包括乳腺和胰腺在内的大多数上皮腺癌中,muc1是过表达且异常糖基化的。乳腺和胰腺的腺癌不仅过表达muc1,而且使muc1进入循环。高muc1血清水平与进行性疾病相关。由于抗原内表达的表位具有复杂性和异质性,因此muc1被用作未来的生物标志物。由癌性组织合成的muc1(例如,肿瘤相关的muc1)通常表现出异常的低聚糖特性(profile),这会引起新标志物(neomarker)诸如唾液酸化
‑
lea(在ca19
‑
9测试中测定)、唾液酸化
‑
lex和唾液酸化
‑
tn(tag
‑
72),以及隐性表位诸如tn的表达。
[0232]
几种针对muc1的抗体正在开发用于治疗。培妥木单抗(pemtumomab)(又称为hmfg1)作为将放射性同位素钇
‑
90递送到卵巢癌肿瘤中的载体正处于iii期临床试验中(scott等人对其进行了综述,2012)。ca15
‑
3(又称为hmfg1抗体)、ca27
‑
29和ca19
‑
9均是muc1的抗体,其用于评定患有癌症的患者中循环muc1的水平。然而,这些抗体作为治疗剂或作为生物标志物的作用有限,因为它们不能有效地区分正常的上皮细胞与转化的肿瘤上皮细胞上表达的muc1。换句话说,这些抗体似乎都没有靶向肿瘤相关muc1(tmuc1)表位。
[0233]
对肿瘤相关形式的muc1(tmuc1)具有高度特异性的新抗体称为tab
‑
004,其描述在
美国专利号8,518,405中(还参见curry等人,2013)。虽然使用人乳脂肪球作为抗原开发出培妥木单抗(hmfg1)(parham等人,1988),但使用表达muc1的改变形式的肿瘤开发了tab
‑
004(tinder等人,2008)。tab
‑
004可识别muc1串联重复序列内改变的糖基化表位。该区域可用于tmuc中的抗原检测,但由于糖基化的大分支而无法在正常muc1中进行抗原检测(gendler,2001;mukherjee等人,2003b;hollingsworth&swanson,2004;kufe,2009)。重要地,tab
‑
004与其他muc1抗体识别的表位不同,其具有独特的重链和轻链的互补决定区(cdr)。该抗体以3ng/ml(20pm)的高结合亲和力与靶抗原结合,并且不会与无关的抗原结合(curry等人,2013)。因此,tab
‑
004可区分muc1的正常形式与肿瘤形式,而hmfg1(培妥木单抗)不能(参见美国专利号8,518,405)。
[0234]
在实施方案中,第一car包含第一抗原结合结构域、跨膜结构域、共刺激结构域和cd3ζ结构域,和/或第二car包含第二抗原结合结构域、跨膜结构域、共刺激结构域和cd3ζ结构域。
[0235]
在实施方案中,抗原结合结构域是fab或scfv。在实施方案中,第一car包含seq id no:5、6和53
‑
58之一的氨基酸序列;第二car包含seq id no:5
‑
17、29、33、37、71和72之一的氨基酸序列或由seq id no:41、45、63、67和68之一的核酸序列编码的氨基酸序列。在实施方案中,编码第一car的核酸序列包含seq id no:59或60的核酸序列,编码第二car的核酸序列包含seq id no:61的核酸序列。在实施方案中,核酸包含seq id no:62
‑
69的核酸序列之一。在实施方案中,第一car和第二car被表达为单独的多肽。
[0236]
在实施方案中,第一抗原结合结构域在car上,第二抗原结合结构域在t细胞受体(tcr)上。在实施方案中,tcr是修饰的tcr。在实施方案中,tcr来源于患者中自发产生的肿瘤特异性t细胞。在实施方案中,tcr结合肿瘤抗原。在实施方案中,肿瘤抗原包括cea、gp100、tmuc1、mart
‑
1、p53、mage
‑
a3或ny
‑
eso
‑
1。
[0237]
如本文所使用,“甲状腺抗原”是指在甲状腺细胞上表达或由甲状腺细胞表达的抗原。甲状腺细胞的实例包括滤泡细胞和滤泡旁细胞。人tshr是促甲状腺激素(tsh)的受体,其存在于甲状腺膜(seq id no:20)上。当垂体分泌的tsh与甲状腺滤泡细胞膜上的tshr结合时,甲状腺分泌具有代谢功能的t3和t4。tshr是具有约95,000至100,000道尔顿分子量的七次跨膜受体。据报道,人促甲状腺激素受体(tshr)包括三个结构域:富含亮氨酸的结构域(lrd;氨基酸36281)、切割结构域(cd;氨基酸282409)和跨膜结构域(tmd;氨基酸410
‑
699)。发现人促甲状腺激素(htsh)α链可结合lrd表面和cd表面上的许多氨基酸。如本文所使用,“tshr”是指人促甲状腺激素受体。该术语应解释为不仅包括人促甲状腺激素受体,而且还包括其变体、同源物、片段和部分,其程度是其变体、同源物、片段和部分保留了人促甲状腺激素受体与本文所公开的人促甲状腺激素受体的抗体或配体结合的能力。
[0238]
在某些实施方案中,抗原是胃或结肠的抗原。例如,结肠抗原是具有seq id no:23的鸟苷酸环化酶2c(gucy2c)。如本文所使用,“结肠抗原”是指在结肠细胞上表达或由结肠细胞表达的抗原。结肠细胞的实例包括杯状细胞和肠上皮细胞。鸟苷酸环化酶2c(gucy2c)主要在小肠上皮细胞中表达。gucy2c是腹泻性细菌肠毒素(st)和肠旁分泌激素鸟苷蛋白和尿鸟苷蛋白的受体。这些配体调节小肠上皮细胞和肾上皮细胞中的水和电解质运输,并最终导致急性分泌性腹泻。如本文所使用,“gucy2c”是指人鸟苷酸环化酶2c。该术语应解释为不仅包括人鸟苷酸环化酶2c,而且还包括其变体、同源物、片段和部分,其程度是其变体、同
id:84的氨基酸序列。在实施方案中,第一car的结合结构域包含seq id:5或6的氨基酸序列。在实施方案中,第二car的结合结构域包含seq id:70
‑
72和79
‑
81的氨基酸序列之一。
[0244]
在实施方案中,第一car包含第一抗原结合结构域、跨膜结构域、共刺激结构域和cd3ζ结构域,和/或第二car包含第二抗原结合结构域、跨膜结构域、共刺激结构域和cd3ζ结构域。
[0245]
在实施方案中,第一car和第二car被表达为单独的多肽。
[0246]
在实施方案中,第二car的细胞质结构域或跨膜结构域被修饰使得第二car能够通过表达cd19的细胞来激活修饰的t细胞,同时不会损害表达cd19的细胞。
[0247]
本文所述的实施方案涉及双特异性嵌合抗原受体,其包含:第一抗原结合结构域、第二抗原结合结构域、细胞质结构域和跨膜结构域,其中第一抗原结合结构域识别第一抗原,第二抗原结合结构域识别第二抗原,第一抗原与第二抗原不同。
[0248]
在实施方案中,第一抗原和第二抗原不在同一细胞上表达。在实施方案中,第一抗原是血液组分的抗原,第二抗原是实体瘤的抗原。
[0249]
血细胞是指红细胞(rbc)、白细胞(wbc)、血小板或其他血细胞。例如,rbc是通过血流流经循环系统而将氧气(o2)递送到身体组织的血细胞。血小板是参与止血的细胞,致使血块形成。wbc是涉及防御身体免受传染性疾病和异物侵害的免疫系统的细胞。存在许多不同类型和子类型的wbc,每种都有不同的作用。例如,粒细胞、单核细胞和淋巴细胞是白细胞的3种主要类型。存在三种不同形式的粒细胞:中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞。
[0250]
wbc的细胞表面分子是指在wbc表面上表达的分子。例如,淋巴细胞的细胞表面分子可包括cd19、cd22、cd20、bcma、cd5、cd7、cd2、cd16、cd56和cd30。b细胞的细胞表面分子可包括cd19、cd20、cd22、bcma。单核细胞的细胞表面分子可包括cd14、cd68、cd11b、cd18、cd169和cd1c。粒细胞的细胞表面分子可包括cd33、cd38、cd138和cd13。
[0251]
在实施方案中,第一抗原是cd19,第二抗原是肿瘤相关的muc1(tmuc1)。在实施方案中,第一抗原结合结构域包含seq id:5和6的氨基酸序列之一。在实施方案中,第二抗原结合结构域包含seq id:70
‑
72和79
‑
81的氨基酸序列之一。
[0252]
在实施方案中,本公开描述了增强有需要的受试者中t细胞应答或治疗受试者肿瘤的方法,方法包括:向受试者施用有效量的本文所述的混合修饰t细胞群或包含混合修饰t细胞群的组合物,从而提供t细胞应答,使得通过表达cd19的细胞在受试者血液中扩增cart细胞。在实施方案中,方法还可以包括将b细胞输注到受试者中以继续激活和/或扩增cart细胞。例如,可在cart细胞输注之前获得并储存受试者的b细胞或来自健康供体的基因修饰b细胞。在实施方案中,方法还可以包括施用表达cd19的细胞或至少包含cd19的细胞外结构域的多肽或car t细胞识别的抗原。例如,表达cd19的细胞可包括用编码cd19的核酸序列转导的细胞系,诸如k562和nk92。在实施方案中,方法还可以包括识别表达第一car和第二car两者的cart细胞,以及向受试者施用标识物cart细胞。例如,muc1可以与分选标志物相关,使得可及时识别表达muc1的car t细胞。
[0253]
在实施方案中,肿瘤相关的muc1(tmuc1)在肿瘤细胞上表达,但不在相应的非恶性细胞上表达。在实施方案中,针对肿瘤相关的muc1的scfv直接与邻糖基化的gsta基序(seq id no.88)相互作用。
[0254]
在实施方案中,本公开描述了体内细胞扩增和维持的方法。在实施方案中,方法可
包括向有需要的受试者施用有效量的本文所述的混合修饰t细胞群,从而提供t细胞应答;以及施用有效量的表达可溶性试剂的呈递细胞(例如,t细胞),所述可溶性试剂为car的细胞外结构域可识别的。在实施方案中,方法可实施以增强有需要的受试者中的t细胞应答。方法可包括向受试者施用有效量的包含car的混合修饰t细胞群,从而提供t细胞应答;以及施用有效量的表达可溶性试剂的呈递细胞以增强受试者中的t细胞应答,所述可溶性试剂为car的细胞外结构域可识别的。在某些实施方案中,呈递细胞是t细胞、树突状细胞和/或抗原呈递细胞。在某些实施方案中,增强受试者中的t细胞应答可以包括选择性增强包含car的t细胞的增殖。在实施方案中,方法可用于使用修饰t细胞来增强对受试者病状的治疗。方法可包括施用表达试剂的细胞群或施用被配制成疫苗的试剂。在这些情况下,修饰t细胞包含编码car的核酸,并且car的细胞外结构域可识别所述试剂。在实施方案中,方法可实施以增强患有疾病的受试者中修饰t细胞的增殖。方法可包括制备包含car的修饰t细胞;向受试者施用有效量的修饰t细胞;将编码试剂的核酸引入细胞中,所述试剂是car的细胞外结构域可识别的;以及向受试者施用有效量的细胞(所述引入了所述编码试剂的核酸)。在实施方案中,可基于t细胞基因组dna中car分子拷贝数的增加来测量t细胞扩增。在实施方案中,可基于对t细胞上表达的分子进行的流式细胞分析来测量t细胞扩增。
[0255]
本文所述的实施方案涉及混合修饰t细胞群,所述混合修饰t细胞群包括在单独t细胞和/或在同一t细胞中的第一car和第二car或tcr,其中第一car的抗原结合结构域结合诸如cd19、cd33、cd14和bcma等的抗原,第二car的抗原结合结构域结合肿瘤相关的muc。在实施方案中,肿瘤相关的muc是muc1(例如tmuc1)或muc2。本文所述的实施方案涉及包含混合修饰t细胞群的组合物,并且涉及增强有需要的受试者中t细胞应答或治疗受试者肿瘤的方法,方法包括:施用有效量的混合修饰t细胞群。
[0256]
在实施方案中,第一car包含seq id no:207的氨基酸序列,第二car包含seq id:202的氨基酸序列。在实施方案中,第一car包含seq id no:203、207、216或219的氨基酸序列,第二car包含seq id:202或205的氨基酸序列。在实施方案中,第二car的抗原结合结构域包含seq id no:70的氨基酸序列。在实施方案中,第二car的抗原结合结构域包含seq id no:5或6的氨基酸序列。在实施方案中,本文所述的修饰t细胞包含seq id no:201、204、206、208、215、217、218或220的核酸序列。在实施方案中,第一car和第二car各自包含抗原结合结构域、跨膜结构域和细胞质结构域。
[0257]
在实施方案中,本文所述的car分子的细胞质结构域包含共刺激结构域和cd3ζ结构域。在实施方案中,本文所述的car分子可包含共刺激结构域且不具有相应的cd3ζ结构域组分。在实施方案中,本文所述的car分子可包含cd3ζ结构域且不具有共刺激结构域。
[0258]
在实施方案中,修饰的细胞包含以下受体的显性失活变体:程序性死亡1(pd
‑
1)、细胞毒性t淋巴细胞抗原
‑
4(ctla
‑
4)、b淋巴细胞和t淋巴细胞弱化因子(btla)、t细胞免疫球蛋白粘蛋白
‑
3(tim
‑
3)、淋巴细胞激活蛋白3(lag
‑
3)、具有ig和itim结构域的t细胞免疫受体(tigit)、白细胞相关的免疫球蛋白样受体1(lair1)、自然杀伤细胞受体2b4(2b4)或cd 160。在实施方案中,修饰的细胞还包含编码自杀基因的核酸序列,和/或自杀基因包括hsv
‑
tk自杀基因系统。在实施方案中,与相应的野生型t细胞相比,分离的t细胞包含减少量的tcr。
[0259]
显性失活突变具有改变的基因产物,所述基因产物对野生型等位基因起拮抗作
用。这些突变通常导致分子功能改变(通常是无活性的),并且特征在于显性或半显性表型。在实施方案中,本文所述的修饰细胞包含显性失活(dn)形式的pd
‑
1受体。在实施方案中,dn pd
‑
1受体在本文所述的修饰细胞中的表达由诱导型基因表达系统调节。在实施方案中,诱导型基因表达系统是lac系统、四环素系统或半乳糖系统。
[0260]
本公开描述了药物组合物。药物组合物包含以下各项中的一种或多种:本文所述的car分子、tcr分子、修饰的car t细胞、包含car或tcr的修饰细胞、混合修饰细胞群、核酸以及载体。药物组合物以适合于待治疗(或预防)的疾病的方式施用。尽管可以通过临床试验确定适当的剂量,但是施用的数量和频率将由诸如患者的病状以及患者疾病的类型和严重程度等因素来确定。
[0261]
术语“药学上可接受的”意指由美国联邦或州政府的监管机构或ema(欧洲药品管理局)批准或在《美国药典》(美国药典
‑
33/国家处方
‑
28重新发行,由美国药典公约公司,马里兰州罗克维尔(rockville)出版,出版日期:2010年4月)或其他公认的药典中列出可用于动物,尤其是人类。
[0262]
术语“载体”是指与治疗剂一起施用的稀释剂、佐剂(例如弗氏佐剂(完全的和不完全的))、赋形剂或媒介物。药学上可接受的载体可以是无菌液体,诸如水和油,包括石油,动物、植物或合成来源的油,诸如花生油、大豆油、矿物油、芝麻油等。当静脉内施用药物组合物时,水是优选的载体。盐溶液以及葡萄糖水溶液和甘油溶液也可以用作液体载体,特别是用于可注射溶液。
[0263]
本公开还描述了药物组合物,其包含本文所述的第一细胞群和第二细胞群。本文所述的药物组合物包含适用于癌症治疗的第一细胞群和第二细胞群,所述第一细胞群包含第一抗原结合分子,所述第二细胞群包含第二抗原结合分子。例如,第一抗原结合分子与抗原的结合可增强适用于癌症治疗的细胞的扩增。
[0264]
本公开还描述了使用本文所述的适用于癌症治疗的细胞来增强癌症治疗的方法。方法包括向患有表达肿瘤抗原的癌症形式的受试者施用有效量的第一组合物,第一组合物包含第一细胞(例如,t细胞)群,所述第一细胞群包含结合第一抗原的第一抗原结合分子(例如,car);以及向受试者施用有效量的第二组合物,第二组合物包含具有第二抗原结合分子的细胞群。可以同时地或分开地,例如依次地执行第一组合物和第二组合物的施用。关于适用于癌症治疗的细胞的更多信息,可以参见eyileten等人,immune cells in cancer therapy and drug delivery,mediators inflamm.2016;2016:5230219,所述参考文献以引用的方式并入本文。
[0265]
在实施方案中,方法包括施用有效量的结合wbc抗原的car t细胞群;以及施用有效量的结合实体瘤抗原的car t细胞群。在实施方案中,方法包括施用有效量的结合wbc抗原的car t细胞群;以及施用有效量的结合实体瘤抗原的t细胞(用于tcr和til治疗的t细胞)群。在实施方案中,方法包括施用有效量的结合wbc抗原的car t细胞群;以及施用有效量的表达结合实体瘤抗原的car的nk细胞群或nk细胞。在实施方案中,方法包括施用有效量的结合wbc抗原的car t细胞群;以及施用有效量的表达结合实体瘤抗原的car的dc细胞群或dc细胞。在实施方案中,方法包括施用有效量的结合wbc抗原的car t细胞群;以及施用有效量的表达结合实体瘤抗原的car的巨噬细胞群或巨噬细胞。在实施方案中,方法包括施用有效量的结合wbc抗原的cart细胞群;以及施用有效量的表达结合实体瘤抗原的car的中性
粒细胞群或中性粒细胞。在实施方案中,方法包括施用有效量的结合wbc抗原的cart细胞群;以及施用有效量的结合或靶向实体瘤抗原的淋巴细胞群。在实施方案中,实体瘤抗原可位于细胞表面上(例如,tshr)、肿瘤微环境的细胞外基质上(例如,αvβ5整联蛋白)和/或肿瘤细胞内(例如,gp100)。
[0266]
当指示“免疫学有效量”、“抗肿瘤有效量”、“肿瘤抑制有效量”或“治疗有效量”时,可以由医生考虑患者(受试者)的年龄、体重、肿瘤大小、感染或转移程度以及病状的个体差异来确定待施用的本公开的组合物的精确量。可以这样说,包含本文所述的修饰细胞的药物组合物可以在104至109个细胞/kg体重的剂量下施用,优选地在105至106个细胞/kg体重的剂量下施用,包括那些范围内的所有整数值。修饰细胞组合物还可以在这些剂量下施用多次。可以通过使用免疫疗法中通常已知的输注技术来施用细胞(参见,例如rosenberg等人,new eng.j.of med.319:1676,1988)。通过监测患者的疾病病征并相应地调整治疗,医学领域的技术人员可以容易地确定针对特定患者的最佳剂量和治疗方案。在某些实施方案中,可需要向受试者施用激活的t细胞,然后再抽血(或进行单采),收集激活的和扩增的t细胞,并向患者再输注这些激活的和扩增的t细胞。此过程可以每几周进行多次。在某些实施方案中,可以从10cc至400cc的抽血中激活t细胞。在某些实施方案中,从20cc、30cc、40cc、50cc、60cc、70cc、80cc、90cc或100cc的抽血中激活t细胞。不受理论的束缚,使用这种多次抽血/多次再输注的方案可以选择出某些t细胞群。
[0267]
在实施方案中,可向有需要的受试者依次或同时施用治疗有效量的混合修饰细胞群。作为两种不同修饰细胞的混合群的一个实例,可以在施用治疗有效量的含有用于杀死靶细胞的抗原结合结构域的修饰细胞之前、之后或同时,施用治疗有效量的含有用于扩增和/或维持修饰细胞的抗原结合结构域的修饰细胞。作为两种不同修饰细胞的混合群的另一个实例,可以在施用治疗有效量的同时含有扩增和/或维持修饰细胞的抗原结合结构域以及杀死靶细胞的抗原结合结构域的修饰细胞(在单个修饰细胞中)之前、之后或同时,施用治疗有效量的含有用于杀死靶细胞的抗原结合结构域的修饰细胞。作为三种不同修饰细胞的混合群的一个实例,所述混合群包括(1)含有用于扩增和/或维持修饰细胞的抗原结合结构域的修饰细胞,(2)含有用于杀死靶细胞的抗原结合结构域的修饰细胞,以及(3)同时含有扩增和/或维持修饰细胞的抗原结合结构域和杀死靶细胞的抗原结合结构域两者的修饰细胞(在单个修饰细胞中),可以根据任何顺序依次(1、2、3;2、3、1;3、1、2;1、3、2;2、1、3;或3、2、1)或同时(1 2 3同时)施用有效量的(1)、(2)和(3)。此外,可以将三种修饰细胞中的两种进行组合,并与在组合之前或之后施用的第三种一起施用。例如,可以在(3)之前或之后施用(1)和(2)的组合;或可以在(2)之前或之后施用(1)和(3)的组合;或可以在(1)之前或之后施用(2)和(3)的组合。
[0268]
本文所述的药物组合物的施用可以在任何方便的方式下进行,包括通过雾化吸入、注射、摄取、输注、植入或移植。本文所述的组合物可以皮下、皮内、肿瘤内、结节内、髓内、肌内、通过静脉内(i.v.)注射或或腹膜内向患者施用。在实施方案中,本文所述的修饰细胞组合物通过皮内或皮下注射向受试者施用。在实施方案中,本公开的t细胞组合物通过静脉内注射来施用。修饰细胞的组合物可以直接注射到肿瘤、淋巴结或感染部位。在实施方案中,可结合任何数量的相关治疗方法(例如,在之前、同时或之后)向患者施用细胞,例如作为联合疗法,所述细胞通过使用本文描述的方法或本领域已知的其他方法进行激活和扩
增,其中t细胞被扩增至治疗水平;所述相关治疗方法包括但不限于:使用抗病毒疗法的试剂西多福韦和白介素
‑
2、阿糖孢苷(也称为ara
‑
c)的治疗;或针对ms患者的那他珠单抗治疗;或针对牛皮癣患者的依法珠单抗治疗或针对pml患者的其他治疗。在进一步的实施方案中,本文描述的t细胞可与以下各项组合使用:化学疗法、放射、免疫抑制剂(诸如环孢菌素、硫唑嘌呤、甲氨蝶呤、霉酚酸酯和fk506)、抗体或其他免疫消除剂(诸如cam path)、抗cd3抗体或其他抗体疗法、细胞毒素、氟达立滨、环孢菌素、fk506、雷帕霉素、霉酚酸、类固醇、fr901228、细胞因子和辐照。这些药物抑制钙依赖性磷酸酶钙调磷酸酶(环孢菌素和fk506)或抑制对生长因子诱导的信号传导至关重要的p70s6激酶(雷帕霉素)。(liu等人,cell 66:807
‑
815,1991;henderson等人,immun 73:316
‑
321,1991;bierer等人,curr.opin.immun5:763
‑
773,1993;isoniemi(同上))。在实施方案中,将本文描述的细胞组合物与骨髓移植、t细胞消融疗法(使用诸如氟达拉滨的化学治疗剂)、外部束放射疗法(xrt)、环磷酰胺或抗体(诸如okt3或campath)结合(例如在之前、同时或之后)向受试者施用。在实施方案中,在b细胞消融疗法之后施用本文描述的细胞组合物。例如,可向患者施用与cd20反应的试剂,例如利妥昔单抗(rituxan)。在实施方案中,受试者可以经历高剂量化学疗法的标准治疗,接着进行外周血干细胞移植。在某些实施方案中,在移植之后,受试者接受输注本公开的扩增的免疫细胞。在实施方案中,在手术之前或之后施用扩增的细胞。待向有需要的受试者施用的上述治疗的剂量将随所治疗的病状的确切性质和治疗的接受者而变化。可以根据各种因素,由医师根据本领域公认的实践来进行用于人类施用的剂量缩放比例。关于使用修饰细胞进行癌症治疗的方法的其他信息可参见美国专利号us8,906,682,所述美国专利以引用的方式整体并入。
[0269]
本文所述的实施方案涉及用于体外制备修饰细胞的方法。方法可以包括从受试者中获得细胞样品。例如,样品可以包括t细胞或t细胞祖细胞。方法还可以包括用至少编码car的dna转染细胞样品,以及在培养基中离体培养细胞样品,所述培养基可选择性增强表达car的t细胞的增殖。细胞样品可以是本文所述的混合修饰细胞群。
[0270]
在实施方案中,样品是冷冻保存的样品。在实施方案中,细胞样品来自脐带血,或来自受试者的外周血样品。在实施方案中,细胞样品通过单采或静脉穿刺获得。在实施方案中,细胞样品是t细胞亚群。
[0271]
本公开的实施方案涉及锌指核酸酶(zfn),其包含dna结合结构域和dna切割结构域,所述dna结合结构域包含锌指dna结合蛋白,所述dna切割结构域包含切割结构域和/或切割半结构域。锌指dna结合蛋白可包含1、2、3、4、5、6或更多个锌指,每个锌指均具有与靶基因中的靶亚位点结合的识别螺旋。在实施方案中,锌指蛋白包含3、4、5、6个指状物(其中指状物被命名为f1、f2、f3、f4、f5和f6,并且从n末端至c末端顺序排列为f1至f3、f4或f5或f6),并且指状物包含表5所示的识别区的氨基酸序列。切割结构域和/或切割半结构域的实例包括野生型或工程化的foki切割半结构域。在实施方案中,dna切割结构域包括野生型切割结构域或切割半结构域(例如,foki切割半结构域)。在实施方案中,切割结构域和/或切割半结构域包括工程化的(非天然存在的)切割结构域或切割半结构域,例如,形成专性异二聚体的工程化foki切割半结构域。在实施方案中,基因是人类基因。在实施方案中,切割结构域包括野生型或工程化的foki切割结构域。实施方案涉及多核苷酸,其编码本文所述的分离的zfn。实施方案涉及包含多核苷酸的载体。在实施方案中,载体是腺病毒或慢病毒
载体。实施方案涉及分离的细胞或细胞系,其包含本文所述的分离的zfn。在实施方案中,分离的细胞是干细胞、t细胞或自然杀伤(nk)细胞。在实施方案中,细胞是t细胞,所述t细胞衍生自从人类供体分离的原代人t细胞。在实施方案中,细胞对以下内源基因的表达降低:ctla4、lag3、btla、tim3、foxp3、siva1或lgals9。在实施方案中,各种基因编辑技术或过表达技术(例如,cas9、talen和zfn)可用于通过敲除、敲低、过表达或插入一个或多个基因来调节t/nk细胞功能。例如,与相应的野生型细胞相比,修饰的细胞降低或增加了列表1和列表2(参见第268段)中肽的生物合成或运输途径的一个或多个基因的表达。在实施方案中,靶基因是runx3。例如,与相应的野生型细胞相比,修饰的t/nk细胞增加了runx3的表达。作为实例,增加runx3的表达可有助于t细胞在肿瘤细胞内浸润或长期驻留,从而增加t细胞杀伤作用。在实施方案中,修饰的细胞是修饰的干细胞、修饰的t细胞或修饰的自然杀伤(nk)细胞。在实施方案中,修饰的细胞是t细胞,所述t细胞衍生自从人类供体分离的原代人t细胞。在实施方案中,细胞降低以下内源基因的表达:ctla4、lag3、btla、tim3、foxp3、siva1和lgals9。
[0272]
ctla4是用作t细胞应答的主要负调节因子的抑制性受体。t淋巴细胞受体ctla
‑
4以比刺激性共受体cd28更高的亲合力与共刺激分子cd80(b7
‑
1)和cd86(b7
‑
2)结合,并且负调节t细胞激活。lag3是免疫球蛋白超家族的成员,并且在激活的t细胞和nk细胞的表面上表达。也在b细胞、树突状细胞、til和treg的表面上检测到lag3。阻断lag3可显著增加t细胞增殖和功能。tim3是由cd4 t辅助细胞1(th1)、cd8 t细胞毒性1细胞(tc1)和th17细胞组成性表达的免疫检查点受体。tim3与其配体半乳凝集素
‑
9lgals9之间的相互作用被认为可导致t细胞应答的抑制。foxp3是转录调节因子的叉头状/有翼状螺旋家族的成员,其对调节性t细胞(treg)的发育和抑制功能至关重要。siva1诱导cd27介导的细胞凋亡,抑制bcl2l1亚型bcl
‑
x(l)抗凋亡活性,抑制nf
‑
kb的激活,并且促进t细胞受体介导的细胞凋亡。
[0273]
实施方案涉及修饰的细胞,其包含编码嵌合抗原受体(car)的分离的核酸序列,其中使用zfn使内源基因失活。
[0274]
在实施方案中,car包含抗原结合结构域、跨膜结构域、共刺激结构域和cd3ζ信号传导结构域。
[0275]
在实施方案中,与原代人t细胞的移植物抗宿主疾病(gvhd)应答相比,修饰的t细胞在生物不相容的人受体中的gvhd应答降低。
[0276]
在实施方案中,car的抗原结合结构域与fzd10、tshr、prlr、muc17、gucy2c、cd207、cd19或cd20结合。
[0277]
在实施方案中,car的抗原结合结构域与以下各项中的至少一种结合:b7、bcma、caix、cd123、cd133、cd138、cd171、cd171/l1
‑
cam、cd19、cd2、cd22、cd30、cd33、cea、cmet、cs1、cspg4、dectin1、egfr、egfr viii、epha2、erbb受体、erbb t4、erbb2、fap、叶酸受体1、fitc、叶酸受体1、gd2、gpc3、ha
‑
1 h/hla
‑
a2、her2、il
‑
11ra、il13受体a2、il13r、il13rα2(zetakine)、kappa、lewisy、间皮素、muc1、nkg2d、ny
‑
eso
‑
1、psma、ror
‑
1、trail
‑
受体1或vegfr2。
[0278]
在实施方案中,car的共刺激结构域包括选自以下各项的共刺激分子的细胞内结构域:cd27、cd28、4
‑
1bb、ox40、cd30、cd40、pd
‑
1、icos、淋巴细胞功能相关抗原
‑
1(lfa
‑
1)、cd2、cd7、light、nkg2c、b7
‑
h3及其任何组合。
[0279]
在实施方案中,修饰的细胞包含编码htert的核酸序列、或编码sv40lt的核酸或其组合。在实施方案中,修饰的细胞包含编码htert的核酸序列和编码sv40lt的核酸。在实施方案中,htert的表达由诱导型表达系统调节。在实施方案中,sv40lt基因的表达由诱导型表达系统调节。在实施方案中,诱导型表达系统是rtta
‑
tre,其增加或激活sv40lt基因或htert基因或其组合的表达。在实施方案中,修饰的细胞包含编码自杀基因的核酸序列。在实施方案中,自杀基因包括hsv
‑
tk自杀基因系统。在这些情况下,可诱导修饰的细胞发生凋亡。
[0280]
本公开描述了治疗受试者中的癌症的方法,方法包括向受试者施用本文所述的混合修饰细胞群,其中癌症选自以下各项:肺癌、胰腺癌、肝癌、骨癌、乳腺癌、结肠直肠癌、白血病、卵巢癌、淋巴瘤和脑癌。
[0281]
本文所述的方法包括修饰的t细胞和/或修饰的nk细胞,与相应的野生型细胞相比,所述修饰的t细胞和/或修饰的nk细胞包含减少的量的一种或多种肽,所述一种或多种肽包括pd1、pdl1、pdl2、ctla4、lrba、lag3、tim3、bila、cd160、2b4、socs1、socs3、foxp3、ccr4、pvrig、cd16b、siva1、cd33、lagls9、cd122、ido1、cd45、cvp1b1、tnfaip8l2、id02、td02、dnmt3a和/或癌胚抗原细胞粘附分子
‑
1(ceacam
‑
1)(列表1)。在实施方案中,治疗受试者中的癌症的方法包括将混合基因修饰t细胞群施用到受试者中时,增强这些t细胞和/或nk细胞(具有减少的量的上面所列的一种或多种肽)的修饰t细胞和/或nk细胞应答。方法包括修饰的t细胞和/或修饰的nk细胞,与相应的野生型细胞相比,所述修饰的t细胞和/或修饰的nk细胞包含增加的量的一种或多种肽,所述一种或多种肽包括runx3、lexm、pilra、ptnns1l3、fcgr3a、nat8、cc19、hck、trem2、cc16、cd36、igf1、ctss、gzmc、batf、cxc12、tnfaip8l3、i11b、trpv1、trpv2、trpv3、trpv4、rgs1、plscr1、itgb2、c3ar1、itga3、itga5、itgal、batf、batf3、cxc12、card11和/或cd83(列表2)。在实施方案中,治疗受试者中的癌症的方法包括将修饰的t细胞和/或修饰的nk细胞施用到受试者中时,增强这些t细胞和/或nk细胞(具有增加的量的上面所列的一种或多种肽)的t细胞和/或nk细胞应答。在实施方案中,各种基因编辑技术或过表达技术(例如,cas9、talen和zfn)可用于通过敲除/敲低/过表达/插入一个或多个基因来调节t细胞和/或nk细胞的功能,所述一个或多个基因可编码列表1或2中的一种或多种肽。例如,与相应的野生型细胞相比,基因修饰的t细胞降低或增加了列表1和列表2(参见上文)中的生物合成或运输途径的肽的一个或多个基因的表达。
[0282]
在实施方案中,靶基因是runx3。例如,与相应的野生型细胞相比,修饰的t细胞增加了runx3的表达。在这些情况下,增加runx3的表达可有助于例如修饰t细胞在肿瘤细胞内浸润或长期驻留,因此增加了t细胞的杀伤作用。
[0283]
例如,受试者中的t细胞应答是指与辅助、杀伤、调节和其他类型的t细胞相关的细胞介导免疫。例如,t细胞应答可以包括诸如在免疫过程中协助其他白细胞以及鉴定和破坏病毒感染的细胞和肿瘤细胞的活动。受试者中的t细胞应答可通过各种指标进行测量,诸如:t细胞杀死的病毒感染细胞和/或肿瘤细胞的数量,与病毒感染细胞和/或肿瘤细胞共同培养时t细胞释放的细胞因子的量,受试者中t细胞的增殖水平,t细胞的表型改变(例如记忆t细胞的改变)以及受试者中t细胞的寿命或生命期限。
[0284]
t细胞应答还包括细胞因子释放。虽然细胞因子释放通常与疾病的全身性炎症和并发症相关,但细胞因子释放似乎也与car t细胞疗法的疗效相关。诸如在car t细胞疗法
中,细胞因子释放可与过继性转移细胞的扩增和进行性免疫激活相关。本公开描述了效应子细胞因子(诸如ifn
‑
γ)以及促炎性和抗炎性细胞因子(诸如il
‑
6)的释放,所述释放响应于本文所述的混合修饰t细胞群,尤其响应于第一car和第二car或tcr的存在,所述第一car包含用于扩增细胞的抗原结合结构域,所述第二car或tcr包含用于杀死靶细胞的抗原结合结构域。在实施方案中,本公开描述了在受试者中释放il
‑
6和ifn
‑
γ,所述受试者被引入了本文所述的第一car和第二car或tcr。在实施方案中,受试者是有癌症治疗需要的,并且癌症治疗是胰腺癌治疗。在实施方案中,本公开描述了通过测量细胞因子释放的水平来确定car t细胞疗法的疗效或监测其疗效。在实施方案中,与使用包含第二car而不包含第一car的t细胞的car t细胞疗法相比,响应于使用本文所述的混合修饰t细胞群的car t细胞疗法在受试者中进行的细胞因子(例如,il
‑
6和/或ifn
‑
γ)释放更多。
[0285]
在实施方案中,本文所述的修饰细胞还可以包含以下受体的显性失活变体:程序性死亡1(pd
‑
1)、细胞毒性t淋巴细胞抗原=4(ctla
‑
4)、b淋巴细胞和t淋巴细胞弱化因子(btla)、t细胞免疫球蛋白粘蛋白
‑
3(tim
‑
3)、淋巴细胞激活蛋白3(lag
‑
3)、具有ig和itim结构域的t细胞免疫受体(tigit)、白细胞相关的免疫球蛋白样受体1(lair1)、自然杀伤细胞受体2b4(2b4)或cd 160,使得可以增强由混合修饰细胞群诱导的t细胞应答。在实施方案中,本文所述的修饰细胞还可以包含编码自杀基因的核酸序列,和/或包含hsv
‑
tk自杀系统的自杀基因,使得可以控制修饰细胞的命运。例如,如果治疗对受试者有危险,和/或受试者遭受不良影响,或者如果治疗已经完成,满足一定的要求条件,和/或超过了预定时间,则可以诱导t细胞发生凋亡。
[0286]
本公开描述了包含本文所述的混合修饰细胞群的组合物。在实施方案中,存在第一修饰细胞群和第二修饰细胞群,所述第一修饰细胞群包含结合第一抗原的第一car,所述第二修饰细胞群包含结合与第一抗原不同的第二抗原的第二car或tcr。第一抗原可以是wbc的抗原,诸如b细胞,而第二抗原是肿瘤抗原。本公开描述了增强第二修饰细胞群的扩增和维持的方法,所述第二修饰细胞群可用于杀死肿瘤细胞。方法包括向受试者施用有效量的包含混合修饰细胞群的组合物,所述受试者具有的癌症形式与第二car识别并结合的肿瘤抗原相关。实施方案还包括增强有需要的受试者中t细胞应答或治疗患癌受试者的方法。方法包括向受试者施用有效量的本文所述的组合物,所述受试者具有的癌症形式与第二car识别并结合的肿瘤抗原相关。其他实施方案包括增强受试者中修饰细胞的扩增和/或维持的方法,方法包括:使t细胞与第一载体和第二载体接触,从而获得本文所述的混合修饰细胞群的组合物,所述第一载体包含编码第一car的第一核酸序列,所述第二载体包含编码第二car的第二核酸序列;以及向受试者施用有效量的组合物,所述受试者具有的癌症形式与第二car识别并结合的肿瘤抗原相关。其他实施方案包括增强有需要的受试者中t细胞应答或治疗患癌受试者的方法,方法包括:使t细胞与第一载体和第二载体接触,从而获得本文所述的混合修饰细胞群的组合物,所述第一载体包含编码第一car的第一核酸序列,所述第二载体包含编码第二car的第二核酸序列;以及向受试者施用有效量的组合物,所述受试者具有的癌症形式与第二car识别并结合的肿瘤抗原相关。实施方案包括增强受试者中修饰细胞的扩增和维持的方法,方法包括:施用有效量的本文所述的混合修饰细胞群的组合物。
[0287]
在实施方案中,组合物至少包含第一修饰细胞群和第二修饰细胞群。第一修饰细
胞群包含编码第一car(例如,cd19、cd22和bcma car)的多核苷酸和编码一种或多种细胞因子(例如,il
‑
6、il12和ifny)的多核苷酸。第二修饰细胞群包含编码第二car的多核苷酸,所述第二car结合实体瘤抗原。例如,组合物包含第一修饰细胞群、第二修饰细胞群、第三修饰细胞群和第四修饰细胞群。第一修饰细胞群包含编码car的多核苷酸,所述car结合wbc抗原和il
‑
6(例如,图87b)。第二修饰细胞群包含编码car的多核苷酸,所述car结合实体瘤抗原(例如,图87a)。第三修饰细胞群包含编码car的多核苷酸,所述car结合wbc抗原和il
‑
12(例如,图87b)。第四修饰细胞群包含编码car的多核苷酸,所述car结合wbc抗原和ifnγ(例如,图87b)。这些wbc抗原可以是相同的(例如,cd19)或不同的(例如,cd19和bcma)。基于第一预定比率,可以将第一修饰细胞群、第三修饰细胞群和第四修饰细胞群进行混合,得到修饰细胞组,然后可以基于第二预定比率将所述修饰细胞组与第二修饰细胞群进行混合,获得包含混合修饰细胞群的组合物。预定比率用来控制受试者中一种或多种细胞因子的表达量,从而在受试者中实现可控、持续且有效的细胞因子效用,同时细胞毒性降低。在实施方案中,设定第一修饰细胞群、第三修饰细胞群和第四修饰细胞群的第一预定比率,使得包含编码ifnγ的多核苷酸的修饰细胞多于包含编码il
‑
12或il
‑
6的多核苷酸的修饰细胞。例如,第一预定比率为1∶1∶10。在实施方案中,确定第二预定比率,使得包含编码第二car的修饰细胞(例如,第二修饰细胞群)多于包含编码第一car的多核苷酸的修饰细胞(例如,第一修饰细胞群、第三修饰细胞群和/或第四修饰细胞群)。例如,第一修饰细胞群和第二修饰细胞群的第二预定比率小于1∶1,但大于1∶10,000。在实施方案中,第二预定比率为1∶1、1∶10、1∶100、1∶1000和1∶104,以及所述范围内的各个数,例如1∶10、1∶100或1∶1000。在实施方案中,第二预定比率在1∶10与1∶1000之间。在实施方案中,第二预定比率在1∶10与1∶100之间。在实施方案中,第二预定比率在1∶1与1∶100之间。在实施方案中,从受试者或健康供体中获得细胞(例如,nk细胞、t细胞、b细胞、髓源性细胞等),并将其分成至少两组。这些细胞组可以分别用两个或更多个载体转移。如果从健康供体中获得,这些细胞还可以被进一步修饰。在实施方案中,第二修饰细胞群不表达一种或多种细胞因子。
[0288]
在实施方案中,编码第一car的多核苷酸以重组dna构建体、mrna或病毒载体的形式存在于修饰细胞中。在实施方案中,多核苷酸是mrna,其并未整合到修饰细胞的基因组中,从而使得修饰细胞在有限的时间段内表达第一car(例如,cd19 car)。
[0289]
在实施方案中,混合修饰细胞群还包括表达第三car的第三修饰细胞群和/或表达第四car的第四修饰细胞群,从而使得由不同修饰细胞群引起的免疫应答可以耦合以增强car t治疗。在实施方案中,car可以被tcr或car和tcr的组合替代。
[0290]
实施方案涉及通过及时实施多次car t细胞输注来增强car t疗法的方法。方法包括从受试者或健康供体中获得pbmc;使用所获得的pbmc制备car t细胞;培养car t细胞,例如培养预定的时间;向受试者施用一部分的培养car t细胞;观察和/或测量受试者血液中的car t细胞;当血液中的car t细胞水平达到预定值时或当car t细胞回到器官(例如,淋巴结)时,施用第二部分的培养car t细胞。例如,最先输注的car t细胞可以在器官中被选择性激活和扩增,并引起受试者的免疫应答。因此,输注第二部分的car t细胞可以与所述免疫应答耦合以增强第二car t细胞群的激活和/或扩增,从而增强car t疗法。
[0291]
本公开描述了包含修饰细胞群的组合物,所述修饰细胞群包括第一修饰细胞群和/或第二修饰细胞群,所述第一修饰细胞群包含第一car而不具有第二car,所述第二修饰
细胞群包含第二car而不具有第一car。本公开还描述了包含修饰细胞群的组合物,所述修饰细胞群包含第一car和第二car(在单个修饰细胞中)。在实施方案中,组合物包含第一修饰细胞群和第二修饰细胞群以及第三修饰细胞群,这些修饰细胞群包含编码同一修饰细胞中的第一car和第二car的一种或多种核酸序列。在实施方案中,组合物包含第二修饰细胞群和第三修饰细胞群,而不包含第一基因修饰细胞群,所述第三修饰细胞群包含编码同一修饰细胞中的第一car和第二car的一种或多种核酸序列。
[0292]
实施方案涉及使用编码抗原结合分子的多核苷酸和/或治疗剂来增强修饰细胞扩增或增强受试者中t细胞应答的方法,或者涉及编码抗原结合分子的多核苷酸和/或治疗剂在增强修饰细胞扩增或增强受试者中t细胞应答的用途。方法或用途包括:提供包含载体基因组的病毒颗粒(例如,aav、慢病毒或其变体),所述载体基因组包含多核苷酸,其中多核苷酸与赋予多核苷酸转录的表达控制元件可操作地连接;以及向受试者施用一定量的病毒颗粒,使得多核苷酸在受试者中表达。在实施方案中,aav制剂可以包含aav载体颗粒、空衣壳和宿主细胞杂质,从而提供了基本上不含aav空衣壳的aav产品。关于病毒颗粒施用和制备的更多信息可参见美国专利号9840719和milani等人,sci.transl.med.11,eaav7325(2019),2019年5月22日,所述参考文件以引用的方式并入本文。
[0293]
在实施方案中,多核苷酸可整合到修饰细胞的基因组中,并且修饰细胞的后代也将表达多核苷酸,从而产生稳定转染的修饰细胞。在实施方案中,修饰细胞表达编码car的多核苷酸,但多核苷酸并未整合到修饰细胞的基因组中,从而使得修饰细胞在有限的时间段内(例如,几天)表达瞬时转染的多核苷酸,其后多核苷酸会通过细胞分裂或其他因素而失去。例如,多核苷酸以重组dna构建体、mrna或病毒载体的形式存在于修饰细胞中,和/或多核苷酸是mrna,所述多核苷酸并未整合到修饰细胞的基因组中。
[0294]
在实施方案中,第一细胞群包含第一car和第二car,第二细胞群包含第一car但不包含第二car。在实施方案中,第一细胞群包含第一car和第二car,第二细胞群包含第一car和第二car。在实施方案中,第一细胞群包含第一car但不包含第二car,第二细胞群包含第一car和第二car。在实施方案中,第一细胞群包含第一car但不包含第二car,第二细胞群包含第二car但不包含第一car。在实施方案中,第一细胞群包含第二car但不包含第一car,第二细胞群包含第一car和第二car。在实施方案中,第一细胞群包含第一car但不包含第二car;第二细胞群包含第二car但不包含第一car;第三细胞群包含第一car和第二car。如本文所述,第一car包括用于扩增和/或维持修饰细胞的抗原结合结构域,第二car包括用于杀死靶细胞诸如肿瘤的抗原结合结构域。
[0295]
在实施方案中,抗原结合结构域结合一种抗原,所述抗原是或包括白细胞(wbc)的细胞表面分子、肿瘤抗原或实体瘤抗原。在实施方案中,wbc是t细胞、nk细胞或树突状细胞。
[0296]
在实施方案中,wbc是粒细胞、单核细胞或淋巴细胞。在实施方案中,wbc是b细胞。在实施方案中,b细胞的细胞表面分子或抗原是cd19、cd22、cd20、bcma、cd5、cd7、cd2、cd16、cd56、cd30、cd14、cd68、cd11b、cd18、cd169、cd1c、cd33、cd38、cd138或cd13。在实施方案中,b细胞的细胞表面分子或抗原是cd19、cd20、cd22或bcma。在实施方案中,b细胞的细胞表面分子或抗原是cd19。
[0297]
在实施方案中,肿瘤抗原是实体瘤抗原。在实施方案中,实体瘤抗原是tmuc1、prlr、clca1、muc12、gucy2c、gpr35、cr1l、muc 17、tmprss11b、muc21、tmprss11e、cd207、
slc30a8、cfc1、slc12a3、sstr1、gpr27、fzd10、tshr、siglec15、slc6a3、kiss1r、qrfpr、gpr119、cldn6、upk2、adam12、slc45a3、acpp、muc21、muc16、ms4a12、alpp、cea、epha2、fap、gpc3、il13
‑
rα2、间皮素、psma、ror1、vegfr
‑
ii、gd2、fr
‑
α、erbb2、epcam、egfrviii、b7
‑
h3或egfr。在实施方案中,实体瘤抗原是或包括肿瘤相关muc1(tmuc1)、tshr、gucy2c、acpp、cldn18.2(18.2)、psma或upk2。
[0298]
在实施方案中,car包含抗原结合结构域、跨膜结构域、共刺激结构域和cd3ζ结构域。在实施方案中,共刺激结构域包括以下的细胞内结构域:cd27、cd28、4
‑
1bb、ox40、cd30、cd40、pd
‑
1、icos、淋巴细胞功能相关抗原
‑
1(lfa
‑
1)、cd2、cd7、light、nkg2c、b7
‑
h3、与cd83特异性结合的配体、或其组合。在实施方案中,第二car包括结合tmuc1的结合结构域和包括cd28的细胞内结构域的共刺激结构域;和/或第一car包括结合cd19的结合结构域和包括4
‑
1bb的细胞内结构域的共刺激结构域。
[0299]
在实施方案中,第一细胞群和/或第二细胞群还包含存在于t细胞上的显性失活形式的检查点蛋白或检查点蛋白受体(例如,pd
‑
1)。在实施方案中,第一细胞群包含载体,所述载体包含编码第一car和显性失活形式pd
‑
1的核酸。
[0300]
在实施方案中,第二car包含结合tmuc1的scfv、4
‑
1bb或cd28的细胞内结构域、cd3ζ结构域;第二car包含结合cd19的scfv、4
‑
1bb或cd28的细胞内结构域、cd3ζ结构域。在实施方案中,第一car包含seq id no:5的scfv,第二car包含seq id no:70的scfv。相应的序列列于表5中。
[0301]
实施方案涉及包括向患癌患者施用有效量的第二t细胞群的方法,所述第二t细胞群包括含有结合tmuc1的scfv的第二car。第二car还可以包含4
‑
1bb或cd28的细胞内结构域、cd3ζ结构域。在实施方案中,方法还包括向患者施用有效量的第一t细胞群,所述第一t细胞群包括含有结合cd19的scfv的第一car,从而增强患者中第二t细胞群的扩增。所述car还可以包含4
‑
1bb或cd28的细胞内结构域、以及cd3ζ结构域。
[0302]
在实施方案中,第二car包含cd28的细胞内结构域,第一car包含4
‑
1bb的细胞内结构域。在这种情况下,与包含4
‑
1bb的细胞内结构域的第二car和/或包含cd28的细胞内结构域的第一car相比,包含cd19的第一t细胞群可对患者产生较少的不良反应(例如,crs),和/或包含tmuc1的第二t细胞群可产生增强的t细胞应答(例如,杀伤作用)。在实施方案中,第二car包含cd28的细胞内结构域,使得与包含4
‑
1bb的细胞内结构域的第二car相比,第二t细胞群可产生增强的t细胞应答(例如,杀伤作用)。在实施方案中,第一car包含4
‑
1bb的细胞内结构域,使得与包含cd28的细胞内结构域的第一car相比,第一t细胞群可对患者产生较少的不良反应(例如,crs)。
[0303]
在实施方案中,第二细胞群包含结合实体瘤抗原的scfv,但不包含结合b细胞抗原的scfv;第一细胞群包含结合与实体瘤抗原不同的抗原(例如,wbc抗原或b细胞抗原)的scfv,但不包含结合肿瘤抗原的scfv。在这些情况下,由第一t细胞群与抗原(例如,cd19)之间的结合而诱导的患者t细胞应答可导致第一t细胞群和第二t细胞群扩增。因此,可以向患者施用混合的基因工程化t细胞群,所述混合基因修饰t细胞群主要由第一细胞群和第二细胞群组成。在实施方案中,可以向患者施用第二基因工程化t细胞群和一种或多种重组蛋白(例如,细胞因子il6和/或tnfγ)或表达和分泌一种或多种重组蛋白的细胞,这可诱导与第一t细胞群引起的t细胞应答相似或增强的t细胞应答。在实施方案中,可以向患者施用第二
t细胞群和激素类药物(例如,氟维司群),这可诱导与第一t细胞群引起的t细胞应答相似或增强的t细胞应答。
[0304]
在实施方案中,第一修饰细胞群还可以包含第三car,所述第三car包含结合tmuc1的scfv、4
‑
1bb或cd28的细胞内结构域、以及cd3ζ结构域。在实施方案中,第二细胞群不包含结合cd19的scfv。在实施方案中,第一细胞群不包含结合tmuc1的scfv。
[0305]
在实施方案中,将本文所述的增强受试者中细胞扩增和/或细胞应答的方法与其中仅向受试者施用一种car(例如,仅第一car或仅第二car)和/或并未向受试者施用本文所述的混合细胞群的方法进行比较。在实施方案中,本文所述的混合细胞群可增强细胞的扩增和/或细胞应答。
[0306]
实施方案涉及用于治疗患癌患者或增强受试者t细胞应答的组合物和方法。方法包括向受试者施用有效量的具有第一car的修饰细胞群。第一car包含抗原结合结构域、跨膜结构域、cd28的共刺激结构域、和/或cd3ζ结构域。方法还可以包括监测和/或测量由修饰细胞诱导的t细胞应答的一个或多个参数。例如,一个或多个参数包括细胞因子释放、淋巴细胞数、以及car t细胞扩增和耗竭水平。方法还可以包括响应于预定时间(例如,输注后一周或两周)和/或与所测量的参数相关的状况(例如,car的拷贝数和car t细胞数)而向受试者施用有效量的包括第二car的修饰细胞群。第二car包含抗原结合结构域、跨膜结构域、4
‑
1bb的共刺激结构域、和/或cd3ζ结构域。据报道,cd28 car t细胞和4
‑
1bb cart细胞在实验室和在临床上表现不同。因此,所述方法通过将强烈的初始免疫应答与长期而持久的免疫应答结合起来,实现结合两个共刺激结构域的优点。例如,包括cd28的第一car可引发强烈的t细胞激活,并与效应子样分化相关。虽然第一car可引起t细胞耗竭,但它旨在诱导受试者免疫系统的强烈初始应答。包括4
‑
1bb的第二car可减少t细胞耗竭,增强持久性并增加中枢记忆分化和线粒体生物发生,这是专为持久性cart疗法而设计的。在实施方案中,由第一car诱导的初始应答可增强持久性cart疗法。在实施方案中,可同时向受试者施用包括第一car的修饰细胞群和包括第二car的修饰细胞群。例如,组合物可包含包括第一car的修饰细胞群和包括第二car的修饰细胞群。在实施方案中,第一car结合wbc的抗原,第二car结合实体瘤抗原。在实施方案中,第一car和第二car结合相同或不同的实体瘤抗原。例如,将一种修饰细胞群与另一种修饰细胞群混合在一起,获得混合修饰细胞,所述的一种修饰细胞群包括结合实体瘤抗原(例如,tshr)并包含4
‑
1bb共刺激结构域的car,所述的另一种修饰细胞群包括结合实体瘤抗原(例如,tshr)或另一种实体瘤抗原(例如,tmuc1)并包含cd28共刺激结构域的car。在实施方案中,可以进一步向受试者施用修饰细胞。在实施方案中,可以连同包括结合wbc抗原(例如,cd19)的car的修饰细胞群一起,进一步向受试者施用修饰细胞。
[0307]
在实施方案中,本文所述的car分子包含用于结合感兴趣抗原的一个或多个互补决定区(cdr)。cdr是用于结合特异性抗原的免疫球蛋白和t细胞受体中的可变结构域的一部分。每个可变结构域存在3个cdr。由于存在可变重结构域和可变轻结构域,因此存在6个用于结合抗原的cdr。此外,由于抗体具有两条重链和两条轻链,因此抗体总共具有12个用于结合抗原的cdr。在实施方案中,本文所述的car分子包含用于结合抗原的一个或多个cdr。在实施方案中,一个或多个cdr可结合wbc(诸如b细胞)的抗原。作为实例,一个或多个cdr可结合cd19(b细胞的细胞表面抗原)。在实施方案中,一个或多个cdr可结合肿瘤抗原,例如tmuc1、tshr、gucy2c、acpp、cldn18.2(18.2)、psma或upk2。
[0308]
实施方案涉及免疫治疗系统及其在治疗受试者癌症中的用途。如图61所示,免疫治疗系统102包括:功能组成部分104,其配置用于抑制肿瘤细胞生长;耦合组成部分106,其配置用于将受试者的免疫应答与肿瘤细胞生长抑制耦合;以及控制组成部分108,其配置用于控制抑制和/或耦合。在实施方案中,免疫治疗系统102是组合物,所述组合物包含一种或多种适用于治疗癌症的药物组分(例如抗体和细胞)。
[0309]
功能组成部分104的实例包括car t、til和tcr以及其他细胞疗法、溶瘤病毒疗法、化学疗法、肿瘤疫苗疗法、代谢目标疗法和靶向疗法。在实施方案中,功能组成部分104包括以下各项中的至少一种:调节免疫代谢的抑制剂(例如,ido抑制剂和腺苷抑制剂);免疫调节剂(例如,imid);对抗单核细胞或树突状细胞的激动剂(例如,tlr/sting);溶瘤病毒疗法;肿瘤疫苗(例如,dc疫苗);肿瘤浸润t细胞(例如,til);巨噬细胞重编程剂(macrophage
‑
reprogramming agent)(例如,ccr2
‑
ccl2抑制剂、csf
‑
1r抑制剂、ppar
‑
γ激动剂/抑制剂和cd
‑
40激动剂);化疗药物(例如,环磷酰胺、氟达拉滨和依鲁替尼);单克隆抗体靶向药物(例如,抗her2);或非单克隆抗体靶向药物(例如,alk抑制剂、egf/vegf抑制剂)。tcr疗法的示例性靶标列于表6中。在实施方案中,功能组成部分104可由bite分子(例如,tshr
‑
cd3)实现。在实施方案中,如图77a所示,bite分子包含第一结合结构域和第二结合结构域,其中第一结合结构域结合实体瘤抗原,第二结合结构域结合例如t细胞cd3受体复合体或cd28。第二结合结构域还可以结合其他t细胞分子,诸如4
‑
1bb、ox40、gttr、icos、nkg20等。
[0310]
耦合组成部分106的实例包括由car t/nk细胞引发的免疫应答、dc刺激、t细胞刺激、以及抗原/疫苗刺激。car t/nk细胞包括本公开描述的修饰细胞。例如,修饰细胞包括结合wbc抗原(例如,cd19)、ebv抗原和/或白蛋白的car。t细胞刺激可由bite分子(例如,cd19
‑
cd3)实现。dc细胞刺激可通过向受试者施用car t/nk细胞,或向受试者的淋巴器官(例如淋巴结)施用小分子、小肽、疫苗或抗原来实现。在实施方案中,如图77a所示,bite分子可包含第一结合结构域和第二结合结构域,其中第一结合结构域结合抗原,第二结合结构域结合例如t细胞cd3受体复合体或cd28。第二结合结构域可结合其他t细胞分子,诸如4
‑
1bb、ox40、gitr、icos、nkg20等。第一结合结构域可结合wbc抗原(例如,cd19和bcma)。在实施方案中,car t细胞可表达bite分子。在实施方案中,可向受试者同时或分开地施用cart细胞和bite分子。
[0311]
在实施方案中,免疫治疗系统102可包含治疗癌症的各种bite抗体。在实施方案中,免疫治疗系统102包含第一bite分子和第二bite分子。第一bite分子可包含第一结合结构域和第二结合结构域,其中第一结合结构域结合实体瘤抗原,第二结合结构域结合例如t细胞cd3受体复合体或cd28。第二bite分子可包含第三结合结构域和第四结合结构域,其中第三结合结构域结合抗原,第四结合结构域结合例如t细胞cd3受体复合体或cd28。在实施方案中,免疫治疗系统102包含修饰的双特异性抗体或三特异性抗体(例如,图87c和87d)以及第一bite抗体和/或第二bite抗体。在这些例子中,可在肿瘤微环境或接近肿瘤微环境下,使用抗体技术刺激细胞分泌一种或多种细胞因子(例如,il
‑
6、il
‑
12、il
‑
15、il
‑
7和ifnγ)。组成部分8702可实现刺激物的功能,其刺激各种细胞增强细胞因子释放。例如,刺激物可包括直接或间接引起受试者分泌一种或多种细胞因子(例如,il
‑
6、il
‑
12、il
‑
7、il
‑
15和ifnγ)的激动剂或配体。在实施方案中,可以将第一bite分子和/或第二bite分子的使用与人重组形式的一种或多种细胞因子的施用结合起来。在实施方案中,治疗剂可以是分离的、
合成的、天然的或重组的人细胞因子。在实施方案中,施用有效量的人重组细胞因子包括静脉内递送每千克体重约0.5
‑
50ug范围的量的il
‑
6。在实施方案中,人重组细胞因子包括il
‑
6或il
‑
7。重组il
‑
15可以每日推注方式,以3mcg/kg/天和1mcg/kg/天施用预定时间或预定天数。重组ifnγ可在每日200万单位的剂量下,在预定时间内每周5天施用。在实施方案中,施用有效量的人重组细胞因子包括施用有效量的人重组细胞因子,以使得受试者血液中的细胞因子(诸如il
‑
6和/或ifn
‑
γ)浓度可增加5
‑
1000倍(例如,50倍)。施用il
‑
6、il
‑
15和/或ifnγ的方法可参见美国专利申请us5178856a和cytokines in the treatment of cancer,volume 00,number 00,2018 of journal of interferon&cytokine research,所述参考文献以引用的方式整体并入本文。在实施方案中,重组il
‑
12可在30ng/kg的初始剂量下施用,并在输注car t细胞后每周两次升至500ng/kg。施用il
‑
12的方法可参见leuk res.2009年11月;33(11):1485
‑
1489,所述参考文献以引用的方式并入本文。在实施方案中,人重组细胞因子可以自细胞施用后第0天、第1天、第2天、第3天、第4天、第5天、第6天、第7天、第8天、第9天、第10天、第11天、第12天、第13天、第14天、第15天、第16天、第17天、第18天、第19天、第20天、第21天、第22天、第23天、第24天、第25天、第26天、第27天、第28天、第29或第30天向受试者施用。
[0312]
在实施方案中,可使用慢病毒载体将耦合组成部分106和功能组成部分104结合并实施,所述慢病毒载体编码结合实体瘤抗原的car和超抗原,从而导致受试者免疫系统过度激活。例如,修饰细胞群包含编码car和超抗原的慢病毒载体,超抗原是阿拉万病毒核蛋白(aravan virus nucleoprotein)、澳大利亚蝙蝠丽沙病毒核蛋白、杜文黑基病毒核蛋白、欧洲蝙蝠病毒1型核蛋白、伊尔库特病毒核蛋白、库贾德病毒核蛋白、玉米矮小花叶病毒核蛋白(maize mosaic virus nucleoprotein)、莫科拉病毒核蛋白、小鼠乳腺肿瘤病毒蛋白pr73、狂犬病病毒核蛋白、水稻黄矮病毒核蛋白、金黄色葡萄球菌肠毒素、芋叶脉缺绿病毒核蛋白或西高加索蝙蝠病毒核蛋白。可通过添加细胞外信号肽来修饰这些核蛋白。在实施方案中,cart细胞可以与双特异性或三特异性抗体结合来治疗肿瘤。cart细胞可结合实体瘤抗原。在实施方案中,可向受试者同时或分开地施用car t细胞和抗体。在实施方案中,car t细胞可表达抗体。双特异性抗体可包含靶向cd3、cd28、4
‑
1bb、gitr、ox40等的第一抗体片段以及靶向实体瘤抗原或wbc抗原的第二抗体片段。如图77b所示,三特异性抗体可包含靶向例如cd3、tlr、fcr或nkg2d的第一抗体片段;靶向例如cd28、4
‑
1bb、gitr或ox40的第二抗体片段;以及靶向例如wbc抗原或实体瘤抗原的第三抗体片段。
[0313]
本公开还描述了修饰细胞群,所述修饰细胞群包含编码car和上述双特异性抗体或三特异性抗体的多核苷酸。本公开还描述了修饰细胞群,所述修饰细胞群表达car和上述双特异性抗体或三特异性抗体。
[0314]
如图65所示,存在三种激活树突状细胞(dc)的方法。第一种方法是将抗原(例如,cea、psa或tert)递送到dc。例如,包含抗原的癌症疫苗或纳米颗粒可以激活dc,这进而可以激活免疫系统。第二种方法是通过递送激动剂(例如,细胞因子)来加速dc成熟并直接或间接释放相关的细胞因子。第三种方法是递送帮助dc激活的细胞因子或蛋白质。也可以实施其他方法来激活dc。例如,可以通过各种方法来刺激dc,诸如lps、各种病毒、疟原虫抗原、细胞因子和疫苗。在实施方案中,小分子(例如,cpg寡核苷酸和咪喹莫特原型药物)可以结合白蛋白递送到淋巴结来刺激dc,然后这可以选择性地引起回到淋巴结的car t细胞扩增。本
公开的实施例表明一些t细胞(例如,中枢记忆t细胞)由于t细胞上的诸如ccr7和cd62l等的分子而在输注后不能稳定存在于血液中,而是进入淋巴器官诸如淋巴结中。因此,对dc的直接和/或间接刺激可以选择性地扩增和/或激活car t细胞,表现出更多的记忆样表型,从而增强t细胞疗法的功效。关于实施方式的更多信息可以参见ma等人,science 365,162
‑
168(2019),所述参考文献以引用的方式并入。
[0315]
可以通过以下实施方案来实施抗原/疫苗刺激。作为实例,方法包括:向有需要的受试者施用有效量的t细胞(例如,til、car t、tcr细胞)来治疗肿瘤(例如,实体瘤),以及施用有效量的直接或间接激活t细胞的试剂。在实施方案中,试剂包括t细胞识别的抗原。在实施方案中,试剂包括表达可溶试剂的呈递细胞,所述可溶试剂可被car的细胞外结构域识别。在实施方案中,试剂包括衍生自抗原的疫苗。例如,试剂包括与白蛋白结合的抗原,使得所述试剂可激活例如淋巴结中的t细胞,然后激活dc,从而引发t细胞扩增。
[0316]
控制组成部分108的实例包括自杀系统(例如,自杀基因)、条件基因表达系统(例如,lac、四环素或半乳糖系统)和基因调节系统(例如,hifla、nfat、foxp3和/或nfkb)。
[0317]
图62示出免疫治疗系统,例如免疫治疗系统102。在实施方案中,修饰细胞群包含两种类型的细胞:功能组成部分的细胞和耦合组成部分的细胞。功能组成部分的细胞能够抑制肿瘤细胞。在实施方案中,功能组成部分的细胞包括结合肿瘤抗原(例如,实体瘤抗原)的结合分子。例如,结合分子可以是或包括结合实体瘤的car或tcr。在实施方案中,耦合组成部分的细胞包括靶向白细胞抗原的car。在实施方案中,耦合组成部分的细胞包括:一种修饰细胞,其包含连接至hif vhl结合结构域的编码il12的核酸序列;和/或另一种修饰细胞,其包含由2a肽连接的编码il6和ifnγ的核酸序列。
[0318]
图62示出将car t细胞与肿瘤浸润淋巴细胞(til)组合的示例性方法的示意图。可以使用本公开所述的各种方法来获得受试者的pbmc,并且制备靶向wbc的抗原(例如,cd19)的cart。在实施方案中,car t细胞可以是图61中所述的耦合组成部分的细胞。然后可对受试者进行淋巴细胞清除(lymphodeplete)。可使用各种方法制备til。方法的一个实例是til 102的制备。例如,在切除后,将肿瘤转移消化成24孔板中的单细胞悬浮液。然后在il
‑
2的存在下,对这些悬浮液/片段进行培养。在实施方案中,通过使用ifnγ elisa测量培养基中分泌的ifnγ来检测自体黑色素瘤细胞的识别(例如,黑色素瘤细胞系或新鲜冷冻的肿瘤消化液,如果没有的话,还可以是一组hla匹配的同种异体肿瘤细胞系)。在实施方案中,可以省略肿瘤反应性的选择步骤。然后,通过用可溶性抗cd3单克隆抗体和高浓度il
‑
2以及经过辐照的同种异体饲养细胞刺激,将til培养物扩增至治疗水平。在纯化til培养物获得产物细胞之后,准备向产物细胞输注car t细胞,所述car t细胞可增强受试者中的til扩增。关于til制备的信息可以参见国际申请号:wo2018/081473和wo2018/094167,以及molecular oncology,第9卷,第10期,2015年12月,第1918
‑
1935页,所述参考文献以引用的方式并入本文。
[0319]
t细胞克服实体瘤需要解决三个理论问题。第一个问题是确定可识别肿瘤的t细胞。不仅要识别一个靶标,而且还必须要识别尽可能多的异种癌细胞。在这方面,til(肿瘤浸润性t淋巴细胞)疗法似乎很有前景。第二个挑战是让这些经过筛选的可识别肿瘤的t细胞克服对肿瘤微环境的抑制。第三个挑战是让这些经过筛选的可识别肿瘤、克服微环境抑制并充分扩增的t细胞群对抗晚期肿瘤,并且逆转疾病进程。普通的til技术在体外被大量
扩增,但是成本高、周期长。成本过高会导致未来药品价格高,而周期过长会使晚期癌症患者无法负担,这将挑战产品未来在治疗方面的应用。因此,免疫治疗系统102可以帮助解决后两个挑战。耦合组成部分106可以耦合受试者免疫应答与til疗法,例如以便扩增受试者中的til,从而通过维持受试者中的til群来降低成本并缩短与til疗法相关的周期和/或克服对肿瘤微环境的抑制。
[0320]
本公开描述了用于治疗血癌(例如,白血病、黑色素瘤和淋巴瘤)的组合物。血癌的实例包括慢性淋巴细胞性白血病(cll)和非霍奇金淋巴瘤(nhl)。组合物包含混合修饰细胞群,所述混合修饰细胞群包含至少两组修饰细胞,其中所述至少两组修饰细胞各自具有编码结合血癌抗原(例如,cd19、cd20和bcma)的car的多核苷酸。混合修饰细胞群中的一组修饰细胞还包含编码一种或多种重组蛋白(例如,il
‑
6、il
‑
12、il
‑
7、il
‑
15和ifnγ)的多核苷酸。例如,混合修饰细胞群包含第一组修饰细胞,以及第二组修饰细胞、第三组修饰细胞和第四组修饰细胞中的至少一种;所述第一组修饰细胞包含编码cd19 car的多核苷酸(例如,图87a),第二组修饰细胞包含编码cd19 car和il
‑
6的多核苷酸,第三组修饰细胞包含编码cd19 car和il
‑
12的多核苷酸,并且第四组修饰细胞包含编码cd19 car和ifnγ的多核苷酸(例如,图87b)。可以将这些修饰细胞的组混合以获得混合修饰细胞群,向患有b细胞白血病和淋巴瘤的受试者施用所述混合修饰细胞群。在实施方案中,混合修饰细胞群可以基于预定比率混合,从而获得混合修饰细胞群。预定比率可用来控制受试者中一种或多种细胞因子的表达量,从而在受试者中实现可控、持久且有效的细胞因子作用,同时经历更少的细胞毒性作用。在实施方案中,设定第一组、第二组、第三组和第四组修饰细胞的预定比率,使得在混合修饰细胞群中,第一组修饰细胞比第二组、第三组或第四组修饰细胞多。例如,第一组修饰细胞与第二组、第三组或第四组修饰细胞的预定比率为10∶1。在实施方案中,预定比率为1∶1、10∶1、100∶1、1000∶1和104∶1,以及所述范围内的各个数,例如10∶1、100∶1或1000∶1。在实施方案中,第二预定比率在10∶1与1000∶1之间。在实施方案中,第二预定比率在10∶1与1∶100之间。在实施方案中,第二预定比率在1∶1与100∶1之间。
[0321]
本公开描述了用于治疗实体瘤的组合物。组合物包含两个修饰细胞群。第一修饰细胞群包含两个或更多个组的修饰细胞。一组修饰细胞包含编码第一car(例如,cd19、cd22、bcma car)的多核苷酸,至少另一组修饰细胞包含编码一种或多种细胞因子(例如,il
‑
6、il12和ifn)或编码一种或多种细胞因子和第一car的多核苷酸。在实施方案中,第一car结合wbc抗原。例如,第一修饰细胞群包含第一组修饰细胞和第二组修饰细胞;所述第一组修饰细胞包含编码cd19 car的多核苷酸(例如,图87a),第二组修饰细胞包含编码cd19 car和细胞因子的多核苷酸(例如,图87的实施例2)。将第一组修饰细胞和第二组修饰细胞混合,以获得第一修饰细胞群。在实施方案中,基于第三预定比率混合第一组修饰细胞和第二组修饰细胞,使得在第一修饰细胞群中,第一组修饰细胞比第二组修饰细胞多。例如,第一组修饰细胞与第二组修饰细胞的第三预定比率为10∶1。在实施方案中,第二修饰细胞群包含结合实体瘤抗原的car。在实施方案中,第二修饰细胞群不表达一种或多种细胞因子。可以将第一修饰细胞群和第二修饰细胞群混合,以获得混合修饰细胞群,在受试者中输注所述混合修饰细胞群。在实施方案中,可以基于第四预定比率混合第一修饰细胞群和第二修饰细胞群,使得第二修饰细胞群比第一修饰细胞群多。例如,第一修饰细胞群和第二修饰细胞群的第二预定比率小于1∶1,但大于1∶10,000。在实施方案中,第四预定比率为1∶1、1∶
1、1∶10、1∶100、1∶1000和1∶104,以及所述范围内的各个数,优选1∶10、1∶100或1∶1000。在实施方案中,第四预定比率在1∶10与1∶1000之间。在实施方案中,第二预定比率在1∶10与1∶100之间。在实施方案中,第二预定比率在1∶1与1∶100之间。预定比率用来控制受试者中一种或多种细胞因子的表达量,从而在受试者中实现可控、持续且有效的细胞因子作用,同时细胞毒性降低。
[0322]
通过参考以下示例性实施方案和实施例进一步描述本公开。提供这些示例性实施方案和实施例仅出于说明的目的,除非另有说明,否则它们不意图构成限制。因此,本公开决不应解释为限于以下示例性实施方案和实施例,而应解释为涵盖由于本文提供的教导而变得显而易见的任何和所有变型。
[0323]
示例性实施方案
[0324]
以下是示例性实施方案:
[0325]
1.一种修饰细胞群,其有效用于在患者中扩增和/或维持修饰细胞,其中修饰细胞群包含至少两种不同的修饰细胞:第一修饰细胞和第二基因修饰细胞,所述第一修饰细胞包含用于扩增和/或维持修饰细胞的抗原结合结构域,第二修饰细胞包含用于杀死靶细胞(诸如肿瘤细胞)的抗原结合结构域。在实施方案中,修饰细胞是修饰的t细胞。在实施方案中,至少两种不同的修饰细胞包括两种不同的修饰t细胞、两种不同的修饰免疫细胞、或其组合。在实施方案中,修饰的免疫细胞包括修饰的t细胞、dc细胞和/或巨噬细胞。
[0326]
2.如实施方案1所述的修饰细胞群,其中抗原结合结构域结合不同抗原。
[0327]
3.如实施方案1所述的修饰细胞群,其中修饰细胞群还包含表达至少两个不同抗原结合结构域的第三修饰细胞,所述两个不同的抗原结合结构域为:用于扩增和/或维持修饰细胞的第一抗原结合结构域;和用于杀死靶细胞的第二抗原结合结构域,并且其中两个不同的抗原结合结构域在同一细胞上表达。
[0328]
4.如实施方案1所述的修饰细胞群,其中修饰细胞群包含表达用来杀死靶细胞的抗原结合结构域的修饰细胞;以及表达至少两个抗原结合结构域的修饰细胞,所述两个抗原结合结构域为:用于扩增和/或维持修饰细胞的第一抗原结合结构域;和用于杀死靶细胞的第二抗原结合结构域,并且其中两个不同的抗原结合结构域在同一修饰细胞上表达。
[0329]
5.如实施方案1所述的修饰细胞群,其中修饰细胞群包含表达用来扩增和/或维持修饰细胞的抗原结合结构域的修饰细胞;以及表达至少两个抗原结合结构域的修饰细胞,所述两个抗原结合结构域为:用于扩增和/或维持修饰细胞的第一抗原结合结构域;和用于杀死靶细胞的第二抗原结合结构域,并且其中两个不同的抗原结合结构域在同一修饰细胞上表达。
[0330]
6.如实施方案1
‑
5中任一项所述的修饰细胞群,其中修饰细胞是修饰的t细胞、修饰的nk细胞、修饰的巨噬细胞或修饰的树突状细胞。
[0331]
7.如实施方案1
‑
6中任一项所述的修饰细胞群,其中用于扩增和/或维持修饰细胞的抗原结合结构域结合wbc的表面抗原,用于杀死靶细胞的抗原结合结构域结合肿瘤抗原。
[0332]
8.如实施方案7所述的修饰细胞群,其中wbc是b细胞。
[0333]
9.如实施方案7所述的修饰细胞群,其中wbc的细胞表面抗原是cd19、cd22、cd20、bcma、cd5、cd7、cd2、cd16、cd56、cd30、cd14、cd68、cd11b、cd18、cd169、cd1c、cd33、cd38、cd138或cd13。
[0334]
10.如实施方案1
‑
9中任一项所述的修饰细胞群,其中实体瘤抗原是tmuc1、prlr、clca1、muc12、gucy2c、gpr35、cr1l、muc 17、tmprss11b、muc21、tmprss11e、cd207、slc30a8、cfc1、slc12a3、sstr1、gpr27、fzd10、tshr、siglec15、slc6a3、kiss1r、qrfpr、gpr119、cldn6、upk2、adam12、slc45a3、acpp、muc21、muc16、ms4a12、alpp、cea、epha2、fap、gpc3、il13
‑
rα2、间皮素、psma、ror1、vegfr
‑
ii、gd2、fr
‑
α、erbb2、epcam、egfrviii、b7
‑
h3、egfr、或表1中所列之一。
[0335]
11.如实施方案7所述的修饰细胞群,其中wbc的细胞表面抗原是cd19、cd20、cd22或bcma。
[0336]
12.如实施方案7所述的修饰细胞群,其中b细胞的细胞表面抗原是cd19,肿瘤抗原是tmuc1、tshr、gucy2c、acpp、cldn18.2(18.2)、psma或upk2。
[0337]
13.一种组合物,其包含第一细胞群和第二细胞群,所述第一细胞群包含结合第一抗原的第一car,所述第二细胞群包含结合第二抗原的第二car,其中第二抗原是肿瘤抗原,第一抗原和第二抗原是不同的抗原。
[0338]
14.如实施方案13所述的组合物,其中第一细胞群不包含第二car,和/或第二细胞群不包含第一car。
[0339]
15.如实施方案14所述的组合物,其中组合物还包含第三细胞群,所述第三细胞群包含第一car和第二car。
[0340]
16.如实施方案13所述的组合物,其中第二细胞群还包含第一car,第一细胞群不包含第二car;或第一细胞群还包含第二car。
[0341]
17.如实施方案13所述的组合物,其中第二细胞群不包含第一car,第一细胞群包含第二car。
[0342]
18.一种增强第二细胞群扩增的方法,其中第二细胞群是靶向实体瘤的细胞,所述方法包括向受试者施用有效量的如实施方案13
‑
17中任一项所述的组合物,所述受试者具有的癌症形式与肿瘤抗原相关或表达肿瘤抗原。
[0343]
19.一种增强受试者中t细胞应答或治疗患癌受试者的方法,所述方法包括向受试者施用有效量的如实施方案13
‑
17中任一项所述的组合物,所述受试者具有的癌症形式与肿瘤抗原相关或表达肿瘤抗原。
[0344]
20.一种增强受试者中细胞扩增的方法,所述方法包括:使细胞与第一载体和第二载体接触,从而获得如实施方案13
‑
17中任一项所述的组合物,所述第一载体包含编码第一car的第一核酸序列,所述第二载体包含编码第二car的第二核酸序列;以及向受试者施用有效量的组合物,所述受试者具有的癌症形式与肿瘤抗原相关或表达肿瘤抗原。
[0345]
21.一种增强有需要的受试者中t细胞应答或治疗患癌受试者的方法,所述方法包括:使细胞与第一载体和第二载体接触,从而获得如实施方案13
‑
17中任一项所述的组合物,所述第一载体包含编码第一car的第一核酸序列,所述第二载体包含编码第二car的第二核酸序列;以及向受试者施用有效量的组合物,所述受试者具有的癌症形式与肿瘤抗原相关或表达肿瘤抗原。
[0346]
22.一种增强受试者中细胞扩增的方法,所述方法包括:施用有效量的如实施方案13
‑
17中任一项所述的组合物的第一细胞群;以及施用有效量的第二细胞群。
[0347]
23.如实施方案20
‑
22中任一项所述的方法,其中第一载体和第二载体包括慢病毒
载体。
[0348]
24.如实施方案13
‑
23中任一项所述的组合物或方法,其中第一抗原或第二抗原是或包括白细胞(wbc)的表面分子、肿瘤抗原、或实体瘤抗原。
[0349]
25.如实施方案13
‑
24中任一项所述的组合物或方法,其中细胞是修饰的t细胞、修饰的nk细胞、修饰的巨噬细胞或修饰的树突状细胞。
[0350]
26.如实施方案24所述的组合物或方法,其中wbc是粒细胞、单核细胞或淋巴细胞。
[0351]
27.如实施方案26所述的组合物或方法,其中wbc是b细胞。
[0352]
28.如实施方案27所述的组合物或方法,其中wbc的细胞表面分子是cd19、cd22、cd20、bcma、cd5、cd7、cd2、cd16、cd56、cd30、cd14、cd68、cd11b、cd18、cd169、cd1c、cd33、cd38、cd138或cd13。
[0353]
29.如实施方案26所述的组合物或方法,其中wbc的细胞表面分子是cd19、cd20、cd22或bcma。
[0354]
30.如实施方案26所述的组合物或方法,其中wbc的细胞表面分子是cd19。
[0355]
31.如实施方案26所述的组合物或方法,其中肿瘤抗原是实体瘤抗原。
[0356]
32.如实施方案26所述的组合物或方法,其中实体瘤抗原是tmuc1、prlr、clca1、muc12、gucy2c、gpr35、cr1l、muc 17、tmprss11b、muc21、tmprss11e、cd207、slc30a8、cfcl、slc12a3、sstr1、gpr27、fzd10、tshr、siglec15、slc6a3、kiss1r、qrfpr、gpr119、cldn6、upk2、adam12、slc45a3、acpp、muc21、muc16、ms4a12、alpp、cea、epha2、fap、gpc3、il13
‑
rα2、间皮素、psma、ror1、vegfr
‑
ii、gd2、fr
‑
α、erbb2、epcam、egfrviii、b7
‑
h3、cldn18.2或egfr。
[0357]
33.如实施方案26所述的组合物或方法,其中实体瘤抗原是或包括tmuc1。
[0358]
34.如实施方案13
‑
33中任一项所述的组合物或方法,其中car包含抗原结合结构域、跨膜结构域、共刺激结构域和cd3ζ结构域。
[0359]
35.如实施方案34所述的组合物或方法,其中共刺激结构域包括以下的细胞内结构域:cd27、cd28、4
‑
1bb、ox40、cd30、cd40、pd
‑
1、icos、淋巴细胞功能相关抗原
‑
1(lfa
‑
1)、cd2、cd7、light、nkg2c、b7
‑
h3、与cd83特异性结合的配体、或其组合。
[0360]
36.如实施方案34所述的组合物或方法,其中第二car的共刺激结构域包括或是4
‑
1bb的细胞内结构域,第二car的抗原结合结构域结合tmuc1;和/或第一car的抗原结合结构域结合cd19,第二car的共刺激结构域包括或是cd28的细胞内结构域。
[0361]
37.如实施方案13
‑
36中任一项所述的组合物或方法,其中第一细胞群和/或第二细胞群还包含显性失活形式的pd
‑
1。
[0362]
38.如实施方案37所述的组合物或方法,其中第一细胞群包含编码第一car和显性失活形式pd
‑
1的载体。
[0363]
39.如实施方案13
‑
38中任一项所述的组合物或方法,其中第一car包含结合tmuc1的scfv、4
‑
1bb或cd28的细胞内结构域以及cd3ζ结构域;第二car包含结合cd19的scfv、4
‑
1bb或cd28的细胞内结构域以及cd3ζ结构域。
[0364]
40.如实施方案13
‑
39中任一项所述的组合物或方法,其中第一car包含seq id no:5,第二car包含seq id no:70。
[0365]
41.如实施方案13
‑
40中任一项所述的组合物或方法,其中第二细胞群包含编码第一car和治疗剂的慢病毒载体,第一细胞群包含编码第二car和显性失活形式pd
‑
1的慢病毒
载体。
[0366]
42.如实施方案13
‑
41中任一项所述的组合物或方法,其中第一细胞群包含第一car和治疗剂,第二细胞群包含第二car和显性失活形式的pd
‑
1。
[0367]
43.如实施方案41或42所述的组合物或方法,其中治疗剂包括或是细胞因子。
[0368]
44.如实施方案43所述的组合物或方法,其中细胞因子是il6和/或infγ。
[0369]
45.一种方法,其包括向受试者施用有效量的包含一种car的第一t细胞群,从而增强受试者中第一t细胞群的扩增,所述car包含结合cd19的scfv、4
‑
1bb或cd28的细胞内结构域以及cd3ζ结构域;以及向患者施用有效量的包含另一种car的第二t细胞群,所述car包含结合tmuc1的scfv、4
‑
1bb或cd28的细胞内结构域以及cd3ζ结构域。
[0370]
46.如实施方案45所述的方法,其中第一细胞群还包含其他car,所述car包含结合tmuc1的scfv、4
‑
1bb或cd28的细胞内结构域、以及cd3ζ结构域。
[0371]
47.如实施方案45所述的方法,其中第二细胞群不包含结合cd19的scfv。
[0372]
48.如实施方案45所述的方法,其中第一细胞群不包含结合tmuc1的scfv。
[0373]
49.一种用于增强对患癌受试者治疗的方法,所述方法包括:
[0374]
向受试者施用靶向wbc抗原的car t细胞;以及
[0375]
向受试者施用肿瘤浸润淋巴细胞(til)。
[0376]
50.一种用于扩增患癌受试者中til的方法,所述方法包括:
[0377]
向受试者施用靶向wbc抗原的car t细胞;以及
[0378]
向受试者施用肿瘤浸润淋巴细胞(til)。
[0379]
51.如实施方案49或50所述的方法,其中til通过以下方式制备:
[0380]
(i)从受试者切除的肿瘤中获得第一til群;
[0381]
(ii)通过在包含il
‑
2的细胞培养基中培养第一til群进行第一扩增,产生第二til群;
[0382]
(iii)通过用额外的il
‑
2、okt
‑
3和抗原呈递细胞(apc)补充第二til群的细胞培养基进行第二扩增,产生第三til群,其中第三til群的数量比第二til群的数量大至少100倍,并且其中第二扩增进行至少14天以便获得第三til群,其中第三til群是一种治疗性的til群,相对于第二til群,第三til群包含增加的效应子t细胞和/或中枢记忆t细胞亚群;以及
[0383]
(iv)向受试者施用治疗有效剂量的第三til群。
[0384]
52.如实施方案51所述的方法,其中所述方法还包括在步骤(iv)之前,通过用额外的il
‑
2、额外的okt
‑
3和额外的apc补充第三til群的细胞培养基来再次进行第二扩增的步骤,其中再次进行的第二扩增持续至少14天以获得比步骤(iii)中更大的治疗性til群,其中相对于第三til群,更大的治疗性til群包含增加的效应子t细胞和/或中枢记忆t细胞亚群。
[0385]
53.如实施方案51所述的方法,其中在步骤(ii)之后,在实施方案51的第二扩增之前,将细胞从细胞培养基中移除并且冷冻保存在存储介质中。
[0386]
54.如实施方案53所述的方法,其中在实施方案51的第二扩增之前,将细胞解冻。
[0387]
55.如实施方案51所述的方法,其中将步骤(iii)重复进行一至四次,以便在治疗性til群中获得足够的til以用于治疗有效剂量的til。
[0388]
56.如实施方案49至55中任一项所述的方法,其中apc是外周血单核细胞(pbmc)。
[0389]
57.如实施方案49至55中任一项所述的方法,其中效应子t细胞和/或中枢记忆t细胞表现出一种或多种特性,所述特性选自以下各项:相对于第三细胞群中的效应子t细胞和/或中枢记忆t细胞,可表达cd27、表达cd28、端粒更长、对cd57的表达增加以及对cd56的表达降低。
[0390]
58.如实施方案49至55中任一项所述的方法,其中效应子t细胞和/或中枢记忆t细胞表现相对于第三细胞群中的效应子t细胞和/或中枢记忆t细胞,对cd57的表达增加和对cd56的表达降低。
[0391]
59.如实施方案49至55中任一项所述的方法,其中癌症选自以下各项:黑色素瘤、宫颈癌、头颈癌、胶质母细胞瘤、卵巢癌、肉瘤、胰腺癌、膀胱癌、乳腺癌、三阴性乳腺癌和非小细胞肺癌。
[0392]
60.如实施方案49
‑
59中任一项所述的方法,其中car结合cd19、cd20、cd22、或bcma。
[0393]
61.如实施方案49
‑
60中任一项所述的方法,其中与用til输注的受试者中的til数相比,用car t细胞和til两者输注的受试者中的til数更多。
[0394]
62.如实施方案49
‑
60中任一项所述的方法,其中car t细胞包括图63的修饰细胞2和修饰细胞1。
[0395]
63.一种增强有需要的受试者中细胞扩增或治疗患癌受试者的方法,所述方法包括:
[0396]
向患有表达肿瘤抗原的癌症形式的受试者施用有效量的组合物,所述组合物包含第一细胞群和第二细胞群,所述第一细胞群包含结合第一抗原的第一car,所述第二细胞群包含结合第二抗原的第二car,其中第二抗原是肿瘤抗原并且与第一抗原不同。
[0397]
64.如实施方案63所述的方法,其中细胞是t细胞、nk细胞或树突状细胞。
[0398]
65.如实施方案63所述的方法,其中第一抗原包括白细胞(wbc)的细胞表面分子、肿瘤抗原、或实体瘤抗原。
[0399]
66.如实施方案65所述的方法,其中wbc是粒细胞、单核细胞或淋巴细胞。
[0400]
67.如实施方案66所述的方法,其中淋巴细胞是b细胞。
[0401]
68.如实施方案65所述的方法,其中wbc的细胞表面分子是cd19、cd22、cd20、bcma、cd5、cd7、cd2、cd16、cd56、cd30、cd14、cd68、cd11b、cd18、cd169、cd1c、cd33、cd38、cd138或cd13。
[0402]
69.如实施方案65所述的方法,其中wbc的细胞表面分子是cd19、cd20、cd22或bcma。
[0403]
70.如实施方案65所述的方法,其中wbc的细胞表面分子是cd19。
[0404]
71.如实施方案63所述的方法,其中肿瘤抗原是实体瘤抗原。
[0405]
72.如实施方案71所述的方法,其中实体瘤抗原是tmuc1、prlr、clca1、muc12、gucy2c、gpr35、cr1l、muc 17、tmprss11b、muc21、tmprss11e、cd207、slc30a8、cfc1、slc12a3、sstr1、gpr27、fzd10、tshr、siglec15、slc6a3、kiss1r、qrfpr、gpr119、cldn6、upk2、adam12、slc45a3、acpp、muc21、muc16、ms4a12、alpp、cea、epha2、fap、gpc3、il13
‑
rα2、间皮素、psma、ror1、vegfr
‑
ii、gd2、fr
‑
α、erbb2、epcam、egfrviii、b7
‑
h3、cldn18.2或egfr。
[0406]
73.如实施方案71所述的方法,其中实体瘤抗原包括tmuc1。
[0407]
74.如实施方案63所述的方法,其中car包含抗原结合结构域、跨膜结构域、共刺激结构域和cd3ζ结构域。
[0408]
75.如实施方案74所述的方法,其中共刺激结构域包括以下的细胞内结构域:cd27、cd28、4
‑
1bb、ox40、cd30、cd40、pd
‑
1、icos、淋巴细胞功能相关抗原
‑
1(lfa
‑
1)、cd2、cd7、light、nkg2c、b7
‑
h3、结合cd83的配体、或其组合。
[0409]
76.如实施方案63所述的方法,其中第一car包含结合cd19的scfv、4
‑
1bb或cd28的细胞内结构域以及cd3ζ结构域;第二car包含结合tmuc1的scfv、4
‑
1bb或cd28的细胞内结构域以及cd3ζ结构域。
[0410]
77.如实施方案63所述的方法,其中第一car的抗原结合结构域包含seq id no:5,第二car的抗原结合结构域包含seq id no:70。
[0411]
78.如实施方案63所述的方法,其中第二细胞群包含编码第二car和显性失活形式pd
‑
1的慢病毒载体。
[0412]
79.如实施方案63所述的方法,其中第一细胞群包含编码第一car和治疗剂的慢病毒载体。
[0413]
80.如实施方案79所述的方法,其中治疗剂包括细胞因子。
[0414]
81.如实施方案80所述的方法,其中细胞因子是il6和/或infγ。
[0415]
82.如实施方案80所述的方法,其中细胞因子是以下各项中的至少一种:il6、il12、il7、il15、tnf
‑
α或ifnγ。
[0416]
83.一种用于体外细胞制备的方法,所述方法包括:将细胞与(1)第一载体和(2)第二载体接触以获得修饰细胞群,从而获得混合修饰细胞群,第一载体包含编码第一抗原结合分子的多核苷酸,所述第一抗原结合分子结合第一抗原,第二载体包含编码第二抗原结合分子的多核苷酸,所述第二抗原结合分子结合第二抗原,其中第一抗原与第二抗原不同。
[0417]
84.一种用于增强患有癌症的受试者中细胞扩增的方法,所述方法包括:从受试者或健康供体中获得细胞;将细胞与(1)第一载体和(2)第二载体接触以获得混合修饰细胞群,第一载体包含编码第一抗原结合分子的多核苷酸,所述第一抗原结合分子结合第一抗原,第二载体包含编码第二抗原结合分子的多核苷酸,所述第二抗原结合分子结合第二抗原;以及向受试者施用有效量的混合修饰细胞群,其中:第一抗原与第二抗原不同;并且与施用有效量的与第一载体接触而没有与第二载体接触的修饰细胞群的受试者中细胞扩增水平相比,施用有效量的混合修饰细胞群的受试者中细胞扩增水平更高。
[0418]
85.一种用于治疗患有癌症的受试者的方法,所述方法包括:从受试者或健康供体中获得细胞;将细胞与(1)第一载体和(2)第二载体接触以获得混合修饰细胞群,第一载体包含编码第一抗原结合分子的多核苷酸,所述第一抗原结合分子结合第一抗原,第二载体包含编码第二抗原结合分子的多核苷酸,所述第二抗原结合分子结合第二抗原;以及向受试者施用有效量的混合修饰细胞群,其中:第一抗原与第二抗原不同。
[0419]
86.一种用于增强治疗患癌受试者的方法,所述方法包括:从受试者或健康供体中获得细胞;将细胞与(1)第一载体和(2)第二载体接触以获得混合修饰细胞群,第一载体包含编码第一抗原结合分子的多核苷酸,所述第一抗原结合分子结合第一抗原,第二载体包含编码第二抗原结合分子的多核苷酸,所述第二抗原结合分子结合第二抗原;以及向受试者施用有效量的混合修饰细胞群,其中:第一抗原与第二抗原不同;并且与施用有效量的与
第二载体接触而没有与第一载体接触的修饰细胞群的受试者中肿瘤生长抑制水平相比,施用有效量的混合修饰细胞群的受试者中肿瘤生长抑制水平更高。
[0420]
87.一种用于体外细胞制备的方法,所述方法包括:将第一载体引入第一细胞群中,第一载体包含编码第一抗原结合分子的多核苷酸,所述第一抗原结合分子结合第一抗原;将第二载体引入第二细胞群中,第二载体包含编码第二抗原结合分子的多核苷酸,所述第二抗原结合分子结合第二抗原;以及分开培养第一细胞群和第二细胞群,其中第一抗原与第二抗原不同。
[0421]
88.一种用于增强患有癌症的受试者中细胞扩增的方法,所述方法包括:将第一载体引入第一细胞群中以获得第一修饰细胞群,第一载体包含编码第一抗原结合分子的多核苷酸,所述第一抗原结合分子结合第一抗原;将第二载体引入第二细胞群中以获得第二修饰细胞群,第二载体包含编码第二抗原结合分子的多核苷酸,所述第二抗原结合分子结合第二抗原;以及向受试者施用有效量的第一修饰细胞群和第二修饰细胞群,其中:第一抗原与第二抗原不同;并且与施用有效量的第二修饰细胞群而非第一修饰细胞群的受试者中细胞扩增水平相比,施用有效量的第一修饰细胞群和第二修饰细胞群的受试者中细胞扩增水平更高。在实施方案中,同时或依次施用第一修饰细胞群和第二修饰细胞群。
[0422]
89.一种用于治疗患有癌症的受试者的方法,所述方法包括:将第一载体引入第一细胞群中以获得第一修饰细胞群,第一载体包含编码第一抗原结合分子的多核苷酸,所述第一抗原结合分子结合第一抗原;将第二载体引入第二细胞群中以获得第二修饰细胞群,第二载体包含编码第二抗原结合分子的多核苷酸,所述第二抗原结合分子结合第二抗原;以及向受试者施用有效量的第一修饰细胞群和第二修饰细胞群,其中:第一抗原与第二抗原不同。在实施方案中,同时或依次施用第一修饰细胞群和第二修饰细胞群。
[0423]
90.一种用于增强治疗患癌受试者的方法,所述方法包括:将第一载体引入第一细胞群中以获得第一修饰细胞群,第一载体包含编码第一抗原结合分子的多核苷酸,所述第一抗原结合分子结合第一抗原;将第二载体引入第二细胞群中以获得第二修饰细胞群,第二载体包含编码第二抗原结合分子的多核苷酸,所述第二抗原结合分子结合第二抗原;以及向受试者施用有效量的第一修饰细胞群和第二修饰细胞群,其中:第一抗原与第二抗原不同;并且与施用有效量的第二修饰细胞群而无第一修饰细胞群的受试者中肿瘤生长抑制水平相比,施用有效量的第一修饰细胞群和第二修饰细胞群的受试者中肿瘤生长抑制水平更高。在实施方案中,同时或依次施用第一修饰细胞群和第二修饰细胞群。
[0424]
91.一种用于增强t细胞应答的方法,所述方法包括:将第一载体引入第一细胞群中,第一载体包含编码第一抗原结合分子的多核苷酸,所述第一抗原结合分子结合第一抗原;将第二载体引入第二细胞群中,第二载体包含编码第二抗原结合分子的多核苷酸,所述第二抗原结合分子结合第二抗原;将表达第二抗原的细胞与第一细胞群和第二细胞群接触;以及测量t细胞应答水平,其中与第二细胞群接触而没有与第一细胞群接触的细胞中的t细胞应答水平相比,与第一细胞群和第二细胞群接触的细胞中的t细胞应答水平更高。
[0425]
92.一种用于增强t细胞应答的方法,所述方法包括:将细胞群与第一载体和第二载体接触以获得混合修饰细胞群,第一载体包含编码第一抗原结合分子的多核苷酸,所述第一抗原结合分子结合第一抗原,第二载体包含编码第二抗原结合分子的多核苷酸,所述第二抗原结合分子结合第二抗原;将表达第二抗原的细胞与混合修饰细胞群接触;以及测
量t细胞应答水平,其中:与接触过第二载体而非第一载体的细胞群接触的细胞中t细胞应答水平相比,与混合修饰细胞群接触的细胞中t细胞应答水平更高。
[0426]
93.如实施方案83
‑
92中任一项所述的方法,其中细胞是t细胞、nk细胞或树突状细胞。在实施方案中,细胞是t细胞。
[0427]
94.如实施方案83
‑
93中任一项所述的方法,其中第一抗原结合分子结合wbc的细胞表面分子。
[0428]
95.如实施方案94所述的方法,其中wbc是粒细胞、单核细胞或淋巴细胞。
[0429]
96.如实施方案94所述的方法,其中wbc是b细胞。
[0430]
97.如实施方案94所述的方法,其中wbc的细胞表面分子是cd19、cd22、cd20、bcma、cd5、cd7、cd2、cd16、cd56、cd30、cd14、cd68、cd11b、cd18、cd169、cd1c、cd33、cd38、cd138或cd13。
[0431]
98.如实施方案94所述的方法,其中wbc的细胞表面分子是cd19、cd20、cd22或bcma。
[0432]
99.如实施方案94所述的方法,其中wbc的细胞表面分子是cd19。
[0433]
100.如实施方案83
‑
99中任一项所述的方法,其中第二抗原结合分子结合实体瘤抗原。
[0434]
101.如实施方案100所述的方法,其中实体瘤抗原是tmuc1、prlr、clca1、muc12、gucy2c、gpr35、cr1l、muc 17、tmprss11b、muc21、tmprss11e、cd207、slc30a8、cfc1、slc12a3、sstr1、gpr27、fzd10、tshr、siglec15、slc6a3、kiss1r、qrfpr、gpr119、cldn6、upk2、adam12、slc45a3、acpp、muc21、muc16、ms4a12、alpp、cea、epha2、fap、gpc3、il13
‑
rα2、间皮素、psma、ror1、vegfr
‑
ii、gd2、fr
‑
α、erbb2、epcam、egfrviii、cldn18.2或egfr。
[0435]
102.如实施方案83
‑
101中任一项所述的方法,其中第一结合分子和第二结合分子是car。
[0436]
103.如实施方案102所述的方法,其中car包含细胞外结构域、跨膜结构域和细胞内结构域,并且细胞外结构域结合肿瘤抗原。
[0437]
104.如权利要求103所述的方法,其中细胞内结构域包含共刺激结构域,所述共刺激结构域包括选自以下的共刺激分子的细胞内结构域:cd27、cd28、4
‑
1bb、ox40、cd30、cd40、pd
‑
1、icos、淋巴细胞功能相关抗原
‑
1(lfa
‑
1)、cd2、cd7、light、nkg2c、b7
‑
h3或其组合。
[0438]
105.如实施方案105所述的方法,其中细胞内结构域包含cd3ζ信号传导结构域。
[0439]
106.如实施方案83
‑
101中任一项所述的方法,其中第一结合分子是car,第二结合分子是tcr。
[0440]
107.如实施方案106所述的方法,其中t细胞包括修饰的t细胞受体(tcr)。
[0441]
108.如实施方案106所述的方法,其中tcr来源于患者中自发产生的肿瘤特异性t细胞。
[0442]
109.如实施方案106所述的方法,其中tcr结合肿瘤抗原。
[0443]
110.如实施方案109所述的方法,其中肿瘤抗原包括cea、gp100、mart
‑
1、p53、mage
‑
a3或ny
‑
eso
‑
1。
[0444]
111.如实施方案106所述的方法,其中tcr包括tcrγ和tcrδ链、tcrα和tcrp链、或
其组合。
[0445]
112.如实施方案106所述的方法,其中第二细胞群来源于til。
[0446]
113.如实施方案83
‑
112中任一项所述的方法,其中修饰细胞群包括:包含第一结合分子的细胞;和包含第二结合分子的细胞。
[0447]
114.如实施方案83
‑
112中任一项所述的方法,其中修饰细胞群包括:包含第一结合分子的细胞、包含第二结合分子的细胞、以及包含第一结合分子和第二结合分子两者的细胞。
[0448]
115.如实施方案83
‑
112中任一项所述的方法,其中t细胞应答通过car的拷贝数和/或释放的细胞因子量来测量。在实施方案中,释放的细胞因子是il
‑
6和/或ifn
‑
γ。
[0449]
116.如实施方案83
‑
112中任一项所述的方法,其中t细胞应答包括细胞因子释放、细胞扩增和/或激活水平。
[0450]
117.如实施方案83
‑
112中任一项所述的方法,其中第一载体还包含编码il
‑
6、ifn
‑
γ或其组合的多核苷酸。
[0451]
118.如实施方案83
‑
112中任一项所述的方法,其中第一载体还包含编码il
‑
12的多核苷酸。
[0452]
119.如实施方案116和117中任一项所述的方法,其中多核苷酸包括编码nfat和/或vhl的多核苷酸。
[0453]
120.如实施方案83
‑
119中任一项所述的方法,其中修饰细胞群包括:表达第一结合分子以及il
‑
6、ifnγ或其组合的细胞;表达第二结合分子的细胞;表达第一结合分子和第二结合分子的细胞;和/或表达第一结合分子和il
‑
12的细胞。
[0454]
121.如实施方案83
‑
120中任一项所述的方法,其中修饰细胞群包括:表达第二结合分子以及il
‑
6、ifnγ或其组合的细胞;表达第二结合分子的细胞;表达第一结合分子和第二结合分子的细胞;和/或表达第一结合分子和il
‑
12的细胞。
[0455]
122.如实施方案83
‑
121中任一项所述的方法,其中修饰细胞群包括:表达第二结合分子以及il
‑
6、ifnγ或其组合的细胞;表达第二结合分子的细胞;表达第一结合分子和第二结合分子的细胞;和/或表达第二结合分子和il
‑
12的细胞。
[0456]
123.如实施方案83
‑
122中任一项所述的方法,其中修饰细胞群包括表达显性失活形式pd
‑
1的细胞。
[0457]
124.一种双特异性嵌合抗原受体,其包含:第一抗原结合结构域、第二抗原结合结构域、细胞质结构域和跨膜结构域,其中第一抗原结合结构域识别第一抗原,第二抗原结合结构域识别第二抗原,第一抗原与第二抗原不同。
[0458]
125.如实施方案124所述的双特异性嵌合抗原受体,其中第一抗原和第二抗原不在同一细胞上表达。
[0459]
126.如实施方案124或125所述的双特异性嵌合抗原受体,其中第一抗原是血液组分的抗原,第二抗原是实体瘤的抗原。
[0460]
127.如实施方案124
‑
126中任一项所述的双特异性嵌合抗原受体,其中第一抗原是cd19,第二抗原是肿瘤相关的muc1。
[0461]
128.如实施方案124
‑
127中任一项所述的双特异性嵌合抗原受体,其中第一抗原结合结构域包含seq id:5或6的氨基酸序列。
[0462]
129.如实施方案124
‑
128中任一项所述的双特异性嵌合抗原受体,其中第二抗原结合结构域包含seq id:70、71、72、79、80或81的氨基酸序列之一。
[0463]
130.如实施方案124所述的双特异性嵌合抗原受体,其中car包含列于表5中的任一tancar的氨基酸序列。
[0464]
131.如实施方案124所述的双特异性嵌合抗原受体,其中第一结合结构域结合非必需组织抗原,第二结合结构域结合肿瘤组织抗原。在实施方案中,第一结合结构域结合tshr或gucy2c。在实施方案中,第二结合结构域结合tmuc1、mage
‑
e1、或上皮肿瘤抗原(eta)。
[0465]
132.如实施方案124所述的双特异性嵌合抗原受体,其中第一结合结构域结合组织特异性抗原,第二结合结构域结合在多于一种组织上表达的抗原。在实施方案中,第一结合结构域结合tshr或prlr。在实施方案中,第二结合结构域结合tmuc1、mage
‑
e1或eta。
[0466]
133.如实施方案124所述的双特异性嵌合抗原受体,其中第一结合结构域结合正常组织抗原,第二结合结构域结合在肿瘤组织上表达的抗原。在实施方案中,第一结合结构域结合acpp、tshr、gucy2c、upk2、cldn18.2、psma、dpep3、cxcr5、b7
‑
h3、muc16、siglec
‑
15、cldn6、muc17、prlr或fzd10。在实施方案中,第二结合结构域结合tmuc1、mage
‑
e1或eta。
[0467]
134.如实施方案123所述的双特异性嵌合抗原受体,其中第一结合结构域结合在非恶性细胞上表达的抗原,第二结合结构域结合在肿瘤细胞上表达,但在相应的非恶性细胞上不表达的抗原。
[0468]
135.一种细胞,其包含如实施方案123
‑
134中任一项所述的双特异性car。
[0469]
136.一种核酸,其编码如实施方案123
‑
134中任一项所述的双特异性car。
[0470]
137.一种增强t细胞应答、增强治疗癌症、治疗受试者中的癌症、治疗患有肿瘤的受试者或抑制肿瘤生长的方法,所述方法包括:施用有效量的如实施方案135所述的细胞。
[0471]
138.如实施方案1
‑
135中任一项所述的细胞、双特异性car、修饰细胞群、组合物或方法在用于治疗有需要的受试者中的用途。
[0472]
139.如实施方案136所述的细胞、双特异性car、修饰细胞群、组合物或方法的用途,其中受试者患有癌症。
[0473]
实施例
[0474]
实施例1.双特异性car
[0475]
产生编码各个car分子的慢病毒载体,并用t细胞转染,详细说明如下。与细胞培养、细胞毒性t淋巴细胞测定构建相关的技术可参见“control of large,established tumor xenografts with genetically retargeted human t cells containing cd28 and cd137 domains”,pnas,2009年3月3日,第106卷第9期,第3360
‑
3365页以及“chimeric receptors containing cd137 signal transduction domains mediate enhanced survival of tcells and increased antileukemic efficacy in vivo,”molecular therapy,2009年,第17卷第8期,第1453
‑
1464页,所述参考文献以引用的方式整体并入本文。
[0476]
在第0天,从健康志愿者中抽取外周血,并分选以收集cd3 t细胞。以1∶1的比率,将cd3/cd28dynabead加入收集的cd3 t细胞中。在第1天,用包括cd19 car(moi=15;car的结合结构域是seqid no:5)的载体和包括tshr car(moi=92;car的结合结构域是seq id no:
8)的载体以及包括tshr
‑
cd19双特异性car(moi=92;car的结合结构域是seq id no:435)的载体转染激活的cd3 t细胞。更多结构和序列的信息提供于图7和表5中。在第2天,更换培养基。去除慢病毒,并且将细胞重新悬浮在新鲜培养基中。在第5天,进行car表达的流式检测。观察各种表达率(cd19 car 17.45%,tshr car 76.84%,tshr
‑
cd19双特异性car 20.59%)。另外,在第0天,从健康志愿者中抽取外周血,并分选以收集cd3 t细胞。以1∶1的比率,将cd3/cd28 dynabead加入收集的cd3 t细胞中。在第1天,用包括cd19 car(moi=2;car的结合结构域是seq id no:5)的载体、包括tmuc1 car(moi=30;car的结合结构域是seq id no:70)的载体、包括tmuc1
‑
cd19双特异性car(moi=95;car的结合结构域是seq id no:437)的载体以及包括cldn18.2
‑
cd19(18.2
‑
cd19)双特异性car(moi=180,car的结合结构域是seq id no:439)的载体转染激活的cd3 t细胞。更多序列信息提供于图10、12和13以及表5中。在第2天,更换培养基。去除慢病毒,并且将细胞重新悬浮在新鲜培养基中。在第5天,进行car表达的流式检测。观察各种表达率(cd19car 68.28%,tmuc1car 31.58%,tmuc1cd19双特异性car 28.11%和35.11%)。
[0477]
如图8所示,将0.2x 104或1x 104个car t细胞和1x 104个nalm6或b
‑
cpab
‑
b肿瘤细胞共培养24小时,收集上清液。检测ifnγ释放。nalm6是cd19阳性肿瘤细胞,b
‑
cpab
‑
b是tshr阳性肿瘤细胞。如图8的左图所示,与响应于b
‑
cpab
‑
b而释放的ifnγ相比,cd19 car t细胞响应于nalm6而释放的ifnγ更多。如图8的中间的图所示,与响应于nalm6而释放的ifnγ相比,tshr car t细胞响应于b
‑
cpab
‑
b而释放的ifnγ更多。如右图所示,双特异性car t细胞响应于nalm6和b
‑
cpab
‑
b中的每一种均释放出显著量的ifnγ。这些结果表明cd19阳性细胞或tshr阳性细胞均可刺激双特异性car t细胞。将105个car t细胞和105个nalm6或b
‑
cpab
‑
b肿瘤细胞共培养24小时,然后通过流式细胞术检测car t cd8阳性细胞的cd137表达。图9的左图示出未与肿瘤细胞共培养的car t细胞的cd137表达,而中间和右边的图示出与nalm6或b
‑
cpab
‑
b共培养的cart细胞的cd137表达。结果表明nalm6和b
‑
cpab
‑
b均可激活双特异性car t(tshr
‑
cd19双特异性car)。进行类似的细胞因子释放测定,并且表明nalm6和表达cldn18.2的细胞均可激活双特异性car t(cldn18.2
‑
cd19双特异性car或cldn18.2
‑
19tan car)细胞(图12
‑
15)。
[0478]
图12示出编码car分子的载体构建体的示意性结构。图13示出图12中所示的car分子的表达。由于cd19 car包括人源化抗体,所以18.2car是鼠抗体。因此,人car抗体和鼠car抗体均用于检测。用双特异性car检测这两种抗体的表达率,所述表达率接近1∶1,从而表明双特异性car的表达符合预期。图14示出共培养的cart细胞和肿瘤细胞的ifnγ释放结果。通过将0.2x 104或1x 104个cart细胞和1x 104个293t或kato iii
‑
18.2 或nalm
‑
6细胞共培养来进行实验。在24小时之后,收集上清液,检测ifn
‑
γ。nalm
‑
6是cd19 t细胞;kato iii
‑
18.2 是过表达cldn18.2的细胞;293t是不表达cd19和cldn18.2的双阴性细胞。如图所示,当与katoiii
‑
18.2 细胞共培养时,18.2cart示出显著的ifn
‑
γ释放,从而表明katoiii
‑
18.2 可由18.2 car t细胞识别并且释放ifn
‑
γ以杀死靶细胞;nalm
‑
6也可由cd19 car t细胞识别并且释放ifn
‑
γ以杀死靶细胞;当与katoiii
‑
18.2 和nalm
‑
6共培养时,18.2
‑
cd19双特异性car(18.2
‑
19tan car)具有显著的ifn
‑
γ释放。此外,nalm
‑
6不能刺激18.2 car t细胞释放ifn
‑
γ,cd19 car t细胞不能通过kato iii
‑
18.2 刺激ifn
‑
γ的释放,从而表明这两种car t细胞是特异性的。总之,18.2
‑
cd19双特异性car t细胞可特异性识别18.2
和cd19阳性靶细胞,并且释放ifn
‑
γ以杀死靶细胞。
[0479]
图15示出描绘了cart细胞与肿瘤细胞共培养的cd137表达的流式细胞测定结果。将1x 104个cart细胞与1x 104个293t
‑
wt或katoiii
‑
18.2 或nalm
‑
6细胞共培养。在48小时之后,通过流式细胞术测量car t cd8 细胞的cd137表达。左列示出与293t共培养的car t细胞的cd137表达。在cd19 car组、18.2car组和18.2
‑
19tan car组中不存在cd19 car表达。可以看出,293t不具有特异性抗原表达,不能激活car t细胞。在中间列中,将car t细胞与高表达18.2蛋白的kato iii
‑
18.2 细胞共培养。在18.2car组中,cd137的表达率为8.77%,在18.2
‑
19双特异性car组中,cd137的表达率为6.36%。在cd19 car组中未观察到cd137的表达。18.2
‑
car t和18.2
‑
cd19双特异性car t识别和激活katoiii
‑
18.2 中的18.2蛋白;cd19 car t不能。右列是car t细胞与nalm
‑
6细胞的共培养,所述nalm
‑
6细胞是由cd19 car t细胞特异性识别并激活的cd19 细胞。结果表明,在cd19 car组中cd137的表达率为11.14%,在18.2
‑
19双特异性car组中cd137的表达率为10.55%,在18.2car组中表达率是不可检测的。cd19 car和18.2
‑
cd19双特异性car可由nalm
‑
6激活,而18.2car不能激活nalm
‑
6。总之,结果表明18.2
‑
cd19双特异性cart细胞可特异性识别18.2抗原和cd19抗原。由于cd137是用于t细胞激活的标志蛋白,因此与car t细胞和底物靶细胞共培养后,car t细胞的cd137上调水平可用于确定car t细胞是否被激活。
[0480]
已知糖基化异常在许多肿瘤中是常见的,诸如muc1(tmuc1)的糖基化异常。结合tmuc1的car可包括基于5e5抗体的scfv。许多肿瘤特异性表达某些特征靶标。关于肿瘤标志物及其相应癌症类型的更多信息列于表3中。实例包括由接头连接的两个scfv,形成包含两个scfv的串联car(tancar)。
[0481]
表3:car t细胞和底物细胞
[0482][0483][0484]
在第0天,从健康志愿者中抽取外周血。用pan t试剂盒分选cd3 t细胞,并以3∶1的比率用cd3/cd28dynabead激活。在第1天,感染激活的cd3 t细胞。用基于表4的载体感染数个细胞组(每组1.00e 06个t细胞),剩余细胞用作nt(未转染的)。在第2天,将慢病毒和
dynabead移除,替换培养基。在第6天,使用流式细胞测定来测量各组car t细胞的car比率和细胞表型。由于抗acpp抗体是人源化抗体,抗muc1抗体是鼠抗体,因此兔抗人car抗体和兔抗鼠car抗体分别用于检测这两种scfv的表达。在第7天,根据表4进行实验。在完全激活24小时之后,对样品进行流式染色。收集上清液用于检测流式细胞小球微阵列(cba),进行羧基荧光素琥珀酰亚胺酯(cfse)染色来观察增殖。将细胞与荧光底物细胞共培养,观察具有荧光底物的细胞的存活以确定杀伤作用。
[0485]
表4:用于共培养测定的细胞
[0486][0487]
图66提供了直方图,所述直方图示出使用流式细胞测定进行若干标志物在car t细胞和tancar t细胞上的表达。将nt、6917、6921、2529、2530、2533以及2534和底物细胞(mcf
‑
7、pc3
‑
acpp、293t细胞)共培养24小时,在第8天进行流式细胞测定。将cart细胞和三种底物细胞(293t、mcf
‑
7、pc3
‑
acpp)共培养24小时。在car t细胞激活之后,进行流式细胞测定。图66中,纵坐标分别是car cd137 细胞(总car 细胞)和car cd25 (总car 细胞)。从cd137和cd25的表达可知,四种类型的tancar细胞可由对应的底物细胞有效激活。在将cart细胞与底物细胞(293t、mcf
‑
7和pc3
‑
acpp)共培养24小时之后,通过流式细胞术对cd40l的表达进行统计分析。四种类型的tancar细胞表达cd40l,它们可激活cd40 细胞和免疫系统的其他免疫细胞,诸如b细胞、激活的单核细胞、dc等。
[0488]
图67提供了直方图,所述直方图示出car t细胞和tancar t细胞的细胞因子释放。将nt、6917、6921、2529、2530、2533以及2534和底物细胞(mcf
‑
7、pc3
‑
acpp、293t细胞)共培养24小时,在第8天测量细胞因子释放。
[0489]
图68示出用对应底物细胞刺激5天后,每组中细胞的扩增。与对照组相比,tancar组示出响应于这两种底物细胞产生明显的扩增。在与底物细胞(mcf
‑
7、pc3
‑
acpp、293t细胞)共培养5天之后,在第12天测量6917、6921、2529、2530、2533、2534和nt的增殖。
[0490]
图69示出杀伤测定结果。结果表明6917抑制mcf
‑
7,6921抑制pc3
‑
acpp。四组tancar t细胞可杀死这两种底物细胞。nt的实验结果是阴性的。对照仅包含肿瘤细胞。在与底物细胞共培养五天之后,进行6917、6921、2529、2530、2533、2534和nt细胞的杀伤测定。
[0491]
图70提供了直方图,所述直方图示出使用流式细胞测定进行若干标志物在其他car t细胞和tancar t细胞上的表达以及细胞因子释放。将2407、163和2517与mcf
‑
7、kato3 和293t细胞共培养24小时,在第8天进行细胞因子释放测定。mcf
‑
7和kato3 底物细胞均可
激活tancar 2517,强度和比例接近单一car。将相应的car t细胞与底物细胞(293t、mcf
‑
7和kato3 )共培养24小时,通过流式细胞术检测cd40l的表达。
[0492]
图71示出响应于底物细胞,不同car t细胞和tancar t细胞的细胞因子释放。实验方法和实验设计类似于上述实验。
[0493]
表5:序列号和相应的标识物
[0494]
[0495]
[0496]
[0497]
[0498]
[0499]
[0500][0501]
表6:tcr疗法的示例性靶标
[0502][0503]
实施例2.患者中的car t细胞扩增和抗肿瘤活性
[0504]
临床研究设计的目的在于评定将自体t细胞输注到患者中的安全性和疗效,所述自体t细胞经过修饰可表达几种实体瘤标志物特异性car/4
‑
1bb/cd3
‑
ζ。在研究的第一组(arm)中,患者仅接受实体瘤标志物特异性car t细胞。实体瘤标志物包括tshr和tmuc1。在第二组中,患者接受针对cd19和实体瘤抗原(例如,tshr、tmuc1或gucy2c)的car t细胞。获得患者的t细胞,对所述t细胞进行修饰并输注到患者中。测量来自第一组和第二组的患者的t细胞应答并使用以下方案进行比较,所述方案由进行试验的医院批准。向所有患者提供书面知情同意书。关于这些患者的信息提供在下表9中(sd:疾病稳定;pd:进行性疾病;pr:部分缓解;cr:完全缓解;nr:无应答)。
[0505]
从患者中获得pbmc。产生各种慢病毒载体,然后将其转染到t细胞中,所述t细胞被进一步培养数日,而后进行共培养测定。更多信息可参见下表7、9和10。与细胞培养、细胞毒性t淋巴细胞测定构建相关的技术可参见“control of large,established tumor xenografts with genetically retargeted human t cells containing cd28 and cd137 domains”,pnas 2009年3月3日,第106卷第9期,第3360
‑
3365页,所述参考文献以引用的方式整体并入本文。
[0506]
使用多种方法来产生car t细胞。针对患者001
‑
003,从pbmc中获得cd3 细胞,并使用含有il
‑
2的x
‑
vivo 15培养基进行培养。例如,可使用包括cd14、cd15、cd16、cd19、cd34、cd36、cd56、cd123和cd235a的抗体试剂盒收集cd3 t细胞,以便去除不希望的细胞。使用cd3/cd28 dynabead激活cd3 t细胞,然后在感染前取样并计数。获得待感染的细胞数。组1的细胞数为6x 107,组2的细胞数为7x 107。根据需要的载体moi来计算相应载体数和载体体积(参见表10)。针对患者004
‑
010,使用含有il
‑
2的texmacs培养基对pbmc进行培养。cd4和cd8磁珠用来分类和选择pbmc中的t细胞。选择适当的起始培养量,并使用transact激活剂对t细胞进行激活。gmp t细胞transact
tm
包括胶体聚合物纳米基质,所述纳米基质共价连接到对抗人cd3和cd28的人源化重组激动剂上。由于采用了纳米基质,因此可以对macs gmp t细胞transact进行无菌过滤,并且可以通过离心和以下常规上清液替换或简单通过培养基洗涤来去除多余试剂。此试剂适用于自动化培养系统,诸如clinimacs仪器。根据需要的载体moi来计算相应载体数和载体体积(参见表10)。确切地说,针对患者004
‑
008和010,将含有多种载体的慢病毒载体与t细胞混合24小时。进一步洗涤t细胞并培养8天,而后运送到医院。针对患者009,将t细胞分成四组,将每组t细胞与慢病毒载体混合24小时,所述慢病毒载体包含一种或多种载体(参见表7),对这些t细胞进行洗涤并培养8天。混合这四组转染t细胞,然后运送到医院。
[0507]
表7:
[0508][0509]
针对新鲜细胞,在移除磁珠之后,对转导的细胞进行离心或用95%复合电解质和
5%人白蛋白的溶液进行替换,装入回收袋中,密封后在15
‑
25℃下运输。直接回收新鲜制剂。针对冷冻保存的细胞,使用包含33.75%复合电解质溶液、33.75%葡聚糖40葡萄糖溶液、25%人血白蛋白和7.5%二甲基亚砜的培养基来进行冷冻保存。将细胞悬浮液装入冻存袋中,然后将袋子冷却至
‑
90℃并转移至用于存储的气相液氮罐中。在冷冻制剂复苏后的30分钟内完成冷冻制剂的复原。通过白细胞分离术从患者中获得外周血单核细胞(pbmc)以用于cart细胞制备,并将cart输注的第一天设为研究的第0天。
[0510]
数名患者接受了针对car t细胞输注的淋巴切除术的调理治疗。基于氟达拉滨和环磷酰胺的调理治疗会根据骨髓(bm)和外周血(pb)中的肿瘤负荷而变化。一些患者在调理治疗后的1
‑
3天施用长效g
‑
csf,剂量约为6mg或100μg/kg体重,以增强患者的嗜中性白细胞,这对抵抗感染至关重要。将car t细胞输给患者。每天将car t细胞运送到医院,洗涤,计数,检查生存力,然后准备向患者施用,接着密切观察患者至少2小时。根据修订的分级系统对细胞因子释放综合征(crs)进行分级(参见lee dw.等人,blood 2014;124:188
‑
95)。根据美国国立卫生研究院不良事件通用术语标准4.0版(http://ctep.cancer.gov/)评定治疗期间和治疗后的其他毒性。通过流式细胞术和形态分析评定治疗响应。当可能时,通过嵌合基因表达水平评定患者。
[0511]
将car t细胞输注后的骨髓(bm)和外周血(pb)样品收集在k2edta bd采血管中。通过facs确定cd19 car t细胞在患者pb和bm中的持久性。基于所测量的绝对cd3 t淋巴细胞计数,计算每微升的循环car t细胞数。同时,car dna拷贝被评估为确定cart细胞扩增和持久性的另一种方法。使用qiaamp dna血液微型试剂盒(qiagen),从冷冻保存的pb和bm中提取基因组dna。如补充材料中所述,通过定量实时pcr评定car dna拷贝。根据制造商的说明书,以多重形式测量血清和csf中的细胞因子ifn
‑
γ、tnf
‑
α、il
‑
4、il
‑
6、il
‑
10、il
‑
17等的水平。
[0512]
使用qiaamp dna血液微型试剂盒(qiagen),从冷冻保存的外周血和骨髓中提取基因组dna。在7500实时pcr系统(applied biosystems)中使用abi 2
×
taqman universal master mix与amperase ung(applied biosystems)一式三份实时进行定量pcr(qpcr)。从含有102‑
108个拷贝/微升的纯化car质粒的10倍系列稀释液的标准曲线中计算每微克基因组dna的拷贝数。使用内参基因的扩增进行dna量的标准化。特异于car转基因和内参基因的引物/探针如先前所述(参见n.等人,blood2012;120:2032
‑
41和o
′
brien s.等人,j clin oncol 2013;31:676
‑
83)。
[0513]
基于各个car的car拷贝数来观察car t细胞扩增,并示于图16和17中。如这些图所示,患者004和005中的car t细胞扩增显著高于患者002、003和001中的cart细胞扩增,从而表明表达cd19car和/或cd19 car和tmuc1 car的t细胞可增强cart细胞扩增(还可参见表10)。计算表达cd19car、实体瘤car(例如,tmuc1、tshr、gucy2c car)和双car(cd19 car和实体瘤car)的t细胞。例如,使用以下方程式计算表达cd19 car、tmuc1 car和双car(cd19 car和tmuc1 car)的t细胞:
[0514]
wbc x cd3%x((tmuc1car cd19car
‑
)/cd3);
[0515]
wbc x cd3%x((tmuc1car
‑
cd19car )/cd3);以及
[0516]
wbc x cd3%x((tmuc1car cd19car )/cd3);
[0517]
其中wbc是wbc数;cd3%是wbc中cd3阳性细胞百分比;(tmuc1car cd19car
‑
)/cd3
是cd3阳性细胞中表达tmuc1 car而不表达cd19 car的t细胞百分比;(tmuc1car
‑
cd19car )/cd3是cd3阳性细胞中表达cd19 car而不表达tmuc1 car的t细胞百分比;以及(tmuc1car cd19car )/cd3是cd3阳性细胞中表达cd19 car和tmuc1 car的t细胞百分比。结果示于图18和19中。如这些图所示,cd19 car细胞显著增加tmuc1 car t细胞的扩增,从而表明cd19car的存在可增强tmuc1 car t细胞扩增。在患者006
‑
010中观察到类似的结果(参见图20和21)。上述体外结果和以下实施例中的体内结果结合表明:激活靶向wbc抗原的car t细胞可以增强靶向实体瘤抗原的cart细胞的扩增。
[0518]
患者008接受甲状腺切除术。输注后28天,右边肿瘤消失,左边肿瘤尺寸减小。pet ct扫描图像的实例示于图33中。输注后三个月,右边肿瘤未复发,左边肿瘤消失。pet ct图像(未示出)示出在手术区域内没有肿瘤复发或复发。在增强扫描信号之后,在上述区域内未观察到异常增强信号。颈部ii和iii的双区域显示出多个小淋巴结,最大短径不超过10mm。双侧颌下腺形态和信号均无异常。同时,颈脊髓形态和ct信号均正常。看来患者已达到至少部分缓解(pr)。在治疗期间,在患者008中未观察到严重的crs(例如,不大于2级crs)。评估患者以达到pr。
[0519]
患者009被诊断为甲状腺低分化滤泡性乳头状癌伴神经内分泌癌。患者009接受了甲状腺双叶切除术,随后接受检查并确认具有多处肺转移。在纵隔中发现多个淋巴结肿大。在输注car t细胞后的30天,ct扫描显示小肿瘤消失,两个大肿瘤的尺寸减小70%以上(参见表8)。图34示出大肿瘤缩小,小肿瘤消失(参见图34中的直线和圆圈)。评估患者以达到pr。
[0520]
表8:患者009的肿瘤尺寸减小
[0521][0522]
患者010被诊断为结肠直肠癌,并且在car t细胞输注之前经历了8个周期的化疗以及其他治疗,诸如手术。输注后的一个月,pet
‑
ct扫描结果表明大部分目标病灶显著减少(大于50%),综合计算肿瘤减少量为44.7%。评估患者以达到pr(参见图35中的箭头)。
[0523]
患者011被诊断为甲状腺癌。收集患者的pbmc并使用prodigy进行分选以获得cd3 细胞,然后将其分成六组。如表19所示,将六组细胞中的每组与含有相应载体的培养基混合。在这六组细胞中,不存在表达cd19 car和tshr car两者的细胞。随后,在适当条件下,将六组细胞用无载体的培养基培养至第7天,并计算细胞数。然后从每组中获得一定数量的细胞,如表19所示将其混合在一起以获得混合细胞群,将所述混合细胞群运送到医院进行输注。图73示出响应于输注,患者011的淋巴细胞(包括car t细胞)、自然杀伤细胞(nk细胞)、自然杀伤t细胞(nkt细胞)和单核细胞有所增加。图74和图75示出响应于细胞输注,患者011的各个car t细胞数和car t细胞总数有所增加。测量各个car t细胞的拷贝数以计算患者011血液中每种类型的car t细胞数和car t细胞总数。使用拷贝数和流式细胞术数据来进行线性回归分析,并计算各个car t细胞的数量。线性回归分析和各个car t细胞扩增示于图75中。这些数据以及来自先前患者的数据表明:(1)cd19 car t细胞增强实体瘤car t细
胞(例如,tshr car)扩增;(2)cd19 car t细胞增强非car t细胞扩增(参见图73中单独的淋巴细胞数增加)。此外,这些数据表明:这种增强作用是由cd19 car的激活所引发,并通过患者体内的免疫细胞(例如dc)介导。因此,结合wbc抗原(例如,cd19和bcma)的car t细胞还可用于增强基于其他t细胞的疗法(例如,nk、tcr和til)。例如,可以将cd19 car t细胞与nk和/或t细胞组合向患者施用,所述nk和/或t细胞可表达经操控的tcr或til,并且cd19 car t细胞的激活可以增强患者中这些淋巴细胞的扩增。图76示出响应于细胞输注,患者011的细胞因子释放。
[0524]
表19用于患者011的car t细胞和载体
[0525][0526]
上述体外结果和本实施例的体内结果结合表明:激活靶向wbc抗原的car t细胞可以增强靶向实体瘤抗原的car t细胞的抗肿瘤活性。
[0527]
图72示出第0天、第1天和第4天,患者009中单核细胞的pdl1表达。在混合car t细胞(cd19car tmuc1 car、cd19car gucy2c car和cd19car tshr car)输注到患者之前和之后,从数名患者中获得单核细胞。使用流式细胞术分析单核细胞以测量标志物(诸如pdl1)的表达。流式细胞术结果表明:输注混合cart细胞之后患者单核细胞中pdl1表达上调。实例示于图72中。单核细胞中pdl1上调表明单核细胞激活,从而进一步证明患者的免疫系统被激活。
[0528]
表9:临床试验数据
[0529][0530]
表10:用于临床试验的细胞生产
[0531]
[0532][0533]
实施例3.耦合/混合t细胞的激活
[0534]
将混合car t细胞(耦合car t细胞)分成三组进行关于激活的测定:cd19 car和tmuc1 car(第1组)、抗cd19 car和acpp car(第2组)、以及cd19和cldn18.2car(第3组)。收集健康志愿者的外周血。用pan t试剂盒分选cd3 t细胞,并以1∶1的比率加入cd3/cd28 dynabead。然后用慢病毒转染cd3 t细胞。将慢病毒和dynabead移除,加入新鲜培养基。确定
car比率和细胞表型。测量这三组细胞中的car表达。选择cd19 car t细胞、tmuc1 car t细胞和靶细胞,并且将其混合24小时或48小时。测量相应细胞中各种标志物的表达。将20x 104个car t细胞和20x 104个底物细胞共培养24小时。通过流式细胞术测量t细胞中诸如hcar(人源化scfv)、mcar(鼠scfv)、cd25和cd137等分子的表达。例如,cd25和cd137阳性染色表明t细胞被激活。测量响应于抗原激活而从各种t细胞中释放的细胞因子量,并减去相应t细胞的背景。
[0535]
表11、12和13分别提供了第1组、第2组和第3组的car t细胞和相应底物细胞的信息。例如,car 1204是人源的car,其可以用人car抗体和cd137抗体标记。car2407(tmuc1 car)是鼠car,其可以用鼠car抗体和cd137抗体标记来进行激活。表达car 1204的细胞(cd19 car t细胞)可以由表达cd19的k562细胞激活,从而引起cd137表达上调。将car 1204细胞、car 2407细胞和表达cd19的k562细胞共培养以诱导cd19 car t细胞激活。cd19 car和tmuc1 car的结合结构域分别包括seq id no:5和seq id no:70。基于cd137的表达来检测和测量2407 car t细胞的激活,这证明了cd19 car t细胞的间接激活。
[0536]
表11:用于第1组的car t细胞和底物细胞
[0537][0538]
图36示出存在或不存在k19细胞的情况下,cd19 car t细胞与tmuc1 car t细胞共培养的流式细胞分析结果。
[0539]
在第0天,收集健康志愿者的外周血。用pan t试剂盒分选cd3 t细胞,并以1∶1的比率将cd3/cd28dynabead加入收集的cd3 t细胞中。在第1天,将激活的cd3 t细胞分成两个亚组,每个亚组各自用编码单个car(cd19 car或tmuc1 car)的慢病毒进行转染。因此,获得两个car t细胞亚组:表达cd19 car的一个car t细胞亚组,和表达tmuc1 car的另一个car t细胞亚组。cd19 car和tmuc1 car的结合结构域分别包括seq id no:5和seq id no:70。在第2天,将慢病毒和dynabead移除,加入新鲜培养基。在第7天,将cart细胞和靶细胞共培养24小时,在第8天进行各种测定。可以将细胞亚组混合并与相应底物细胞共培养(参见图36
‑
60)。
[0540]
图36提供了直方图,所述直方图示出不同细胞培养物中的cd137表达。在每种细胞培养物中,将car t细胞与相应底物细胞进行培养,使用流式细胞术测量cd137表达(gate mcar :tmuc1car)。细胞培养物包括(1)tmuc1car t细胞和k19,(2)tmuc1car t细胞、k19和pbmc,(3)tmuc1car t细胞、cd19car t细胞和k19,(4)tmuc1car car t细胞、cd19 car t细胞、k19和pbmc。还对cd8 t细胞进行计数。如图36所示,在存在k19的情况下观察到tmuc1car t细胞的激活(即cd137表达),并且muc1 car t细胞的激活水平高于单一组的激活水平。此外,在加入pbmc之后激活水平更高(例如,cd137的mfi)。这些结果表明k19对cd19 car t细胞的激活会在没有tmuc1 car结合的抗原(tmuc1)的情况下激活tmuc1 car t细胞,并且这种激活会因pbmc的存在而增强。实验结果基于表达率作为测量差异的主要依据(左图)。当比例差异不显著时,将表达强度(mfi)用作差异的度量(右图)。
[0541]
图37示出图36所述的细胞培养物中pbmc和单核细胞的激活。在pbmc中进行单核细胞(cd14 )和激活的单核细胞(cd14 cd80 )的流式细胞测定,并且图37示出测定的统计分
析直方图。h19car是人源化cd19car,细胞培养物包括(1)单独pbmc,(2)pbmc k19,(3)pbmc和cd19car t细胞,(4)pbmc、k19和cd19car t细胞。如图37所示,最后一组pbmc显示出激活(cd80表达)。这些结果表明car t细胞的激活能够使包括单核细胞的pbmc激活。图36和37中示出的结果结合表明:k19对cd19 car t细胞的激活会在没有tmuc1 car结合的抗原的情况下激活tmuc1car t细胞,并且这种激活可以至少部分地通过pbmc介导。
[0542]
图38提供了直方图,所述直方图示出由tmuc1 car t细胞和cd19 car t细胞产生的ifnγ释放。在第7天,培养各种细胞,在第8天进行流式细胞测定。所述图为对流图(convective graph)的统计分析。在这些测定中,nt(未转染的t细胞)用作对照。与对照相比,包括cd19 car t细胞和tmuc1 car t细胞的细胞培养物显示出cd19 car t和muc1 car t细胞中细胞内ifnγ增加,从而表明k19激活的cd19car t细胞可释放ifnγ并激活tmuc1car t细胞以释放ifnγ。pbmc组上调了cd19car t细胞和tmuc1car t细胞释放的ifnγ的比率。与表达单个car(cd19 car或tmuc1 car)的细胞相比,耦合car组中累积的ifnγ更多,并且加入pbmc可上调这种作用。mcar组并非全部是cd19 car阳性细胞,其统计值是相对的。结果表明cd19 car t细胞的激活诱导了tmuc1 car t细胞表达更多的ifnγ,因而在没有tmuc1 car结合的抗原(tmuc1)的情况下释放ifnγ。
[0543]
图39提供了直方图,所述直方图示出由tmuc1 car t细胞和cd19 car t细胞产生的gzmb释放。在第7天,培养各种细胞,在第8天进行流式细胞测定。流式细胞测定示出由激活的cd19 car t细胞和muc1 car t细胞产生的gzmb释放。对流图的统计分析(mfi比例比较)表明cd19 car t细胞的激活可以引起muc1 car t细胞释放gzmb,并且在pbmc的存在下可增强这种释放。mcar组并非全部是cd19 car阳性细胞,其统计值是相对的。这些结果表明cd19 car t细胞的激活诱导了muc1 car t细胞释放细胞内gzmb。
[0544]
图40和41示出不同实施方案中muc1 car t细胞的增殖。进行cfse反应并将其用于指示细胞增殖水平。在第7天,培养各种细胞,在第8天进行流式细胞测定。如图40所示,第一行是与两种底物细胞共培养的耦合car t细胞实验组,第二行是与两种底物细胞共培养的muc1 car t细胞对照组。如第一行和第二行中的第三列和第四列所示,k19对cd19 car t细胞的激活诱导了muc1 car t细胞的增殖。第五列和第六列示出mcf
‑
7可激活和诱导muc1car t细胞的增殖。图41示出图40中所示的流式细胞术的结果。进行体积校准,门控tmuc1 car细胞群,并且统计分析每组tmuc1 car的细胞数。如图41所示,与对照组相比,包括cd19 car t细胞和tmuc1car t细胞的组中的细胞数更高,并且在pbmc存在下,包括cd19 car t细胞和tmuc1car t细胞的组的增殖最高。结果表明cd19 car t细胞的激活可以增强muc1 car t细胞的增殖,这种增强作用可以通过pbmc来增强和/或介导。
[0545]
图12示出不同实施方案中cd19 car t细胞的增殖。进行cfse反应并将其用于指示细胞增殖水平。在第7天,培养各种细胞,在第8天进行流式细胞测定。包含cd19 car t细胞、tmuc1 car t细胞、mcf
‑
7的细胞组在存在或不存在pbmc的情况下均显示出cd19 car t细胞的增殖。这些结果表明tmuc1 car t细胞的激活可以增强cd19 car t细胞的增殖,这种增强作用可以通过pbmc来增强和/或介导。图40
‑
42所示的结果结合表明:cd19car t细胞和tmuc1 car t细胞的混合物可通过pbmc形成正向循环,使得cd19 car t细胞或tmuc1 car t细胞的激活可进一步彼此激活,以增强cd19 car t细胞和tmuc1 car t细胞的增殖和/或由cd19 car t细胞和tmuc1 car t细胞产生的细胞因子释放,这种增强作用可通过pbmc来介
导和/或增强(参见图62)。这些结果还可以解释以下原因:与输注包含单一类型cart细胞的细胞群的受试者相比,输注包含耦合cart细胞的细胞群的受试者(例如,患者001
‑
003)中,tmuc1 car t细胞扩增程度更高。耦合cart细胞(例如,cd19 car t细胞和tmuc1 car t细胞)可有助于这种增强的细胞扩增。
[0546]
图43示出实施方案中的细胞因子释放。在第7天,培养各种细胞,在第8天进行流式细胞测定。如图43所示,对照组中ifn
‑
γ释放是有限的。分别使用实线和虚线标记耦合car组和单一car组。在没有pbmc存在下,所释放的ifn
‑
γ水平类似。当加入pbmc时,所释放的ifn
‑
γ水平增加。il6主要由pbmc分泌,在激活的体系中其释放量增加。在此,tmuc1car细胞因子释放量相对较低。
[0547]
表12:用于第2组的car t细胞和底物细胞
[0548][0549]
图44示出不同细胞培养物中cd137表达的其他直方图。在第0天,收集健康志愿者的外周血。用pant试剂盒分选并收集cd3 t细胞,并以1∶1的比率将cd3/cd28 dynabead加入收集的cd3 t细胞中。在第1天,分别用编码cd19 car和acpp car的慢病毒转染cd3 t细胞。cd19 car和acpp car的结合结构域分别包括seq id no:5和seq id no:489。在第2天,将慢病毒和dynabead移除,加入新鲜培养基。在第7天,将car t细胞和靶细胞共培养24小时,在第8天进行各种测定。进行流式细胞测定,并且结果显示cd19 car和acpp car t细胞的表达。如图44所示,acpp car t细胞的激活程度更高,在存在pbmc的情况下激活程度增加。这些结果表明nalm6对cd19 car t细胞的激活可以使acpp car t细胞激活,并且通过pbmc增强了这种作用。
[0550]
图45示出激活分析的流式细胞测定。cd45ro和cd62l可用于将cart细胞分成四个状态。nalm6可激活cd19 car t细胞上cd45ro和cd62l的表达,并且acpp car t细胞中效应子细胞比例增加。这些结果表明cd19 car t细胞的激活诱导了acpp car t细胞成为功能性状态,这充当对acpp car t细胞的预激活。
[0551]
图46示出图44所述的细胞培养物中pbmc和单核细胞的激活。流式细胞测定示出了pbmc中的单核细胞(cd14 )和激活的单核细胞(cd14 和cd80 )。h19car是人源化cd19car,这些组包括(1)单独pbmc,(2)pbmc k19,(3)pbmc和cd19car t细胞,(4)pbmc、k19和cd19car t细胞。这些结果表明car t细胞的激活能够使pbmc激活。
[0552]
图47示出cd19 car t细胞的激活诱导了acpp car t细胞释放细胞内ifnγ。与上述内容类似,在第7天培养各种细胞,在第8天进行流式细胞测定。当这两种cart细胞均存在并且在体系中存在pbmc时,acpp car t细胞还示出增强的ifnγ释放。
[0553]
图48和49示出在细胞培养物中将细胞共培养24小时后的细胞因子释放。在对照组中,tnf
‑
α、ifn
‑
γ、gzmb释放量是有限的。分别用实线和虚线标记耦合car组(cd19 car t细胞和acpp car t细胞)和单一car组(cd19 car t细胞或acpp cart细胞)。在没有pbmc存在下,所释放的tnf
‑
α、ifn
‑
γ、gzmb水平类似。当加入pbmc时,所释放的tnf
‑
a、ifn
‑
γ、gzmb量增加。il6主要由pbmc分泌,并且在pbmc存在下,耦合car组中的细胞因子释放量增强。
[0554]
表13:用于第3组的car t细胞和底物细胞
[0555][0556]
图50提供了其他直方图,所述直方图示出不同细胞培养物中的cd137表达。在第0天,收集健康志愿者的外周血。用pant试剂盒分选cd3 t细胞,并以1∶1的比率加入cd3/cd28 dynabead。在第1天,分别用编码cd19 car和cldn 18.2 car的慢病毒转染cd3 t细胞。cd19 car和cldn 18.2 car的结合结构域分别包括seq id no:5和seq id no:437。在第2天,将慢病毒和dynabead移除,加入新鲜培养基。在第7天,将car t细胞和靶细胞共培养24或48小时,在第8天进行各种测定。如图50所示,cldn18.2 car t细胞的激活程度更高,在存在pbmc的情况下激活程度增加。这些结果表明k19对cd19cart细胞的激活可以间接使cldn18.2 car t细胞激活,并且通过pbmc增强了这种作用。
[0557]
图51示出不同car t细胞与kato3 细胞共培养48小时的流式细胞分析结果。从直方图中可看出,在kato3 细胞存在下,与单一car t组(cd19 car t细胞或cldn 18.2 car)相比,耦合car t组(cd19 car t细胞和cldn 18.2 car)中的cd19 car t细胞激活水平更高。在存在pbmc的情况下被激活之后,cd19 car t细胞的激活水平更高(例如,cd25和cd137的比率),从而表明kato3 细胞对cldn18.2 car t细胞的激活可以使cd19 car t细胞激活,通过pbmc增强了这种作用。cd40l主要由cd4t细胞表达(与pbmc中的cd40l 细胞相互作用,诸如b细胞、激活的单核细胞、dc)。结果表明kato3 细胞对cldn18.2 car t细胞的激活可以上调cd19car t细胞对cd40l的表达,这可以激活b细胞和单核细胞。通过pbmc增强了这种作用。
[0558]
图52示出图50所述的体系中pbmc和单核细胞的激活。h19car是人源化cd19 car,这些组包括(1)单独pbmc,(2)pbmc和k19,(3)pbmc和cd19 car t细胞,(4)pbmc、k19和cd19 car t细胞。如图52所示,最后一列pbmc示出了激活,从而表明car t细胞的激活能够使pbmc激活。
[0559]
图53和54示出cldn18.2 car t细胞的激活诱导了cd19 car t细胞释放细胞内ifnγ。与图39中所示的类似,与单一类型car t细胞组(cd19 car t细胞或cldn 18.2 car)相比,耦合car t细胞组(cd19 car t细胞和cldn 18.2 car)中释放的ifnγ量更多,并且加入pbmc可以上调这种作用。
[0560]
图55示出针对不同细胞培养物进行的杀伤测定。两种底物细胞的起始量为2.0x 105/600ul或3.33x105/ml。图55示出杀伤三天后底物细胞的细胞密度。pbmc帮助了底物细胞的杀伤,并且耦合car t细胞组(cd19 car t细胞和cldn 18.2 car)增强了单独cd19 car t细胞或单独cldn18.2 car t细胞的杀伤作用。在pbmc存在下,耦合car t细胞具有更好的杀伤作用,从而证明激活的car t细胞可以使pbmc激活,并且当耦合car t体系中的一种类型的car t细胞被激活时,进一步激活耦合car t细胞组中的另一种类型的car t细胞以释放细胞因子,增强功效。
[0561]
图56示出cldn18.2 car t细胞的增殖。在第7天,培养各种细胞,在第8天进行流式细胞测定。此外,测量cfse反应以评估增殖水平。如图56所示,第一行是包括与两种底物细胞共培养的耦合car的实验组,第二行是包括与两种底物细胞共培养的cldn18.2car的对照组。图56示出k19对cd19 car t细胞的激活可以诱导cldn18.2car t细胞的增殖。kato3细胞
可以由cldn18.2car t细胞有效激活,然后增殖。pbmc的存在可以进一步增强增殖。结果证明:在耦合car组中k19有效激活cd19 car,并且激活的cd19 cart可以激活cldn18.2car t细胞以促进cldn18.2细胞增殖,这可以通过pbmc进一步增强。
[0562]
图57示出cd19 car t细胞的增殖。在第7天,培养各种细胞,在第8天进行流式细胞测定。此外,测量cfse反应以评估增殖水平。如图57所示,第一行是包括与两种底物细胞共培养的耦合car t细胞的实验组,第二行是包括与两种底物细胞共培养的cd19 car t细胞的对照组。图57示出kato3 细胞对cldn18.2 car t细胞的激活可以诱导cd19 car t细胞的增殖。第五列和第六列示出pbmc可以进一步增强cd19 car t细胞的增殖。结果证明:在耦合car组中kato3 细胞激活了cldn18.2 car t细胞,并且激活的cldn18.2 car t细胞可以激活cd19 car t细胞以促进cd19 car t细胞增殖,这可以通过pbmc进一步增强。
[0563]
图58
‑
60示出不同细胞培养物中的细胞因子释放。在第7天,培养各种细胞,在第8天进行流式细胞测定。如所示出的,对照组中il12、ifnγ和gzmb的释放量是有限的。分别用实线和虚线标记耦合car t细胞组和单一car t细胞组。在没有pbmc存在下,所释放的il12、ifnγ和gzmb量类似。当加入pbmc时,所释放的il12、ifn
‑
γ和gzmb量增加。
[0564]
表20:用于第4组的car t细胞和底物细胞
[0565][0566]
图84示出不同细胞培养物中cd137表达的其他直方图。在第0天,收集健康志愿者的外周血。用pan t试剂盒分选并收集cd3 t细胞,并以1∶1的比率将cd3/cd28 dynabead加入收集的cd3 t细胞中。在第1天,分别用编码bcma car和gucy2c car的慢病毒转染cd3 t细胞。cd19 car和acpp car的结合结构域分别包括seq id no:60和seq id no:488。在第2天,将慢病毒和dynabead移除,加入新鲜培养基。在第7天,将cart细胞和靶细胞(例如,8226)共培养24小时,在第8天进行各种测定。进行流式细胞测定,并且结果显示cd19 car和acpp car t细胞的表达。如图84所示,gucy2c car t细胞的激活程度更高,在存在pbmc的情况下激活程度增加。这些结果表明8226对bcma car t细胞的激活可以使gucy2c car t细胞激活,并且通过pbmc增强了这种作用。由于pbmc包括包含有bcma的b细胞和浆细胞,因此pbmc可以激活bcma car t细胞。pmbc对bcma car t细胞的激活可通过gucy2c car t细胞增强。
[0567]
图85示出gucy2c car t细胞的增殖。在第7天,培养各种细胞,在第8天进行流式细胞测定。此外,测量cfse反应以评估增殖水平。pmbc包括b细胞和浆细胞,所述b细胞和浆细胞包含bcma。如图85所示,pmbc对bcma car t细胞的激活可以诱导gucy2c car t细胞的增殖。
[0568]
图86示出在细胞培养物中将细胞共培养24小时后的细胞因子释放。在对照组中,il
‑
6、ifn
‑
γ、gzmb释放量是有限的。在没有pbmc存在下,所释放的il
‑
6和gzmb水平类似。当加入pbmc时,所释放的il
‑
6和gzmb量增加。在pbmc存在下,耦合car组中的细胞因子释放量增强。
[0569]
将ny
‑
eso
‑
1转导的t细胞(nyeso
‑
1tcrts或8302)和afp转导的t细胞(afp tcrts或dw105)分别与cd19 car t细胞(1234)混合,并与各种相应的靶细胞(例如,k19:k562
‑
cd19)共培养。图78示出使用流式细胞术确定所关注的基因的表型和表达。在共培养混合细胞7天
之后,使用流式细胞术检测细胞的表型和所关注的基因的表达。例如,(a)描绘活细胞的大致范围,(b)去除粘附细胞,(c)进行dapi染色以描绘活细胞群,(d)描绘cd3阳性细胞群(即t细胞)。使用流式细胞术确定细胞表型和car表达。针对nt(不表达car的t细胞)组和cd19 car t组,nyeso
‑
1 tcrts和afp tcrts的cd8百分比分别为70.32%、56.44%、73.85%和72.74%。cd19 car的表达率为63.71%,nyeso
‑
1tcr的表达率为88.80%,afp tcr的表达率为71.61%。细胞表达表型正常;cd137表达率较低;细胞已经处于静止状态,可用于后续实验。
[0570]
图79示出使用流式细胞术识别共培养的细胞。为了区分共培养后的两种t细胞,将cd19 car细胞用violet染色,用紫色荧光标记。通过流式细胞仪v450
‑
pb通道将细胞分成两组:阳性组为cd19 car细胞,阴性组为nyeso
‑
1/afp tcrts(c)。cd3阳性群为t细胞。
[0571]
图80示出对包括cd19 car t细胞和nyeso
‑
1tcrts的共培养细胞的激活进行的流式细胞分析结果。将不同细胞组共培养24小时,使用流式细胞术测量这些细胞的激活。在对照组nc中,nyeso
‑
1tcrts的激活程度非常低(1.43%mfi=5559)。在pc组中,nyeso
‑
1tcrts激活正常(15.02%,mfi=23301)。与nc组相比,a组中的nyeso
‑
1tcrts激活程度(2.56%,mfi=6087)更高(参见102和104)。与a组(2.56%,mfi=6087)相比,b组中的nyeso
‑
1tcrts激活程度(5.28%,mfi=12352)更高(参见106和108)。与b组(5.28%,mfi=12352)相比,c组中的nyeso
‑
1tcrts激活程度(6.80%,mfi=12352)更高(参见110和112)。与a组相比,c组中的nyeso
‑
1tcrts激活程度更高(参见114和116)。
[0572]
图81示出对包括cd19 car t细胞和nyeso
‑
1tcrts的共培养细胞的增殖进行的流式细胞分析结果。将不同细胞组共培养96小时,使用流式细胞术测量这些细胞的增殖。进行细胞增殖的比较。在nc对照组中,nyeso
‑
1tcrts细胞的增殖率为2.46%。在a组中,nyeso
‑
1tcrts细胞的增殖率为28.17%,这与nc组相比有所增加(参见202)。b组nyeso
‑
1tcrts细胞的增殖率为41.60%,高于a组(参见204)。c组nyeso
‑
1tcrts细胞的增殖率为47.79%,高于b组41.60%(参见206)并且高于a组(参见208)。
[0573]
图82示出对包括cd19 car t细胞和afp tcrts的共培养细胞的激活进行的流式细胞分析结果。将不同细胞组共培养24小时,使用流式细胞术测量这些细胞的激活。对照组nc的afp tcrts没有被激活(0.70%mfi=4568)。pc组afp tcrts激活正常(38.58%,mfi=23327)。与nc组相比,a组afp tcrts的激活程度(1.24%,mfi=4884)更高(参见302和304)。与a组(1.24%,mfi=4884)相比,b组afp tcrts的激活程度(4.17%,mfi=13112)更高(参见306和308)。c组afp tcrts的激活程度(6.47%,mfi=14218)高于b组(4.17%,mfi=13112)(参见310和312),并且高于a组(参见314和316)。此外,tcr阴性t细胞也被部分激活(nc=0.51%;a=1.46%;b=2.84%;c=5.12%)。组与组之间的关系与阳性部分相同。
[0574]
图83示出对包括cd19 car t细胞和afp tcrts的共培养细胞的增殖进行的流式细胞分析结果。将不同细胞组共培养96小时,使用流式细胞术测量这些细胞的激活。进行细胞增殖的比较。nc对照组afp tcrts的增殖率为3.11%。a组afp tcrts的增殖率为36.44%,这与nc组相比有所增加(402)。b组afp tcrts的增殖率为39.59%,高于a组的36.44%(404)。c组afp tcrts的增殖率为51.97%,高于b组的39.59%(406)并且高于a组(408)。因此,cd19 car t细胞通过增加其增殖率而增强tcrt细胞的扩增。
[0575]
这些数据表明,在耦合car t细胞(例如,cd19 car t细胞和cldn18.2 car t细胞)
中,激活的第一类型的cart细胞可以激活第二类型的car t细胞。例如,激活的第一类型的car t细胞增强了激活、细胞因子释放以及第二类型car t细胞的细胞增殖。当存在pbmc时,这种作用增强。鉴于pbmc和单核细胞被激活,第一类型的car t细胞可以激活单核细胞(例如dc),然后可以激活第二类型的cart细胞。此处提供的数据和本公开体内实例所示的数据结合表明:受试者的树突状细胞(dc)作为媒介,将第一类型car t细胞的激活与第二类型car t细胞的激活相关联,并形成正向激活循环,由于免疫稳态的扩增,这可以有助于受试者(患者004
‑
011)中观察到的cart细胞的扩增。这些数据和上述临床数据表明:耦合或混合的t细胞实现了增强的t细胞应答,包括t细胞扩增和/或细胞因子释放。耦合或混合的t细胞的实例包括bcma和gucy2c car t细胞以及cd19 car t细胞和nyeso
‑
1tcrts。将混合t细胞输注到患者之后,第一组t细胞(例如,cd19和bcma car t细胞)结合b细胞抗原并且被激活。在其激活之后,第一组car t细胞上调某些细胞膜分子(例如,cd28、ox40、4
‑
1bb、cd40l等)并且释放某些细胞因子(例如,ifnγ和gm
‑
csf)。这些表面分子和细胞因子激活和/或募集诸如单核细胞(例如dc)和嗜中性粒细胞细胞等的细胞。募集和/或激活的细胞释放细胞因子(例如,tnfa、il6、il12)以形成炎症样环境。鉴于炎症样环境,这些激活的免疫细胞上调了一些蛋白质(例如cd80,cd80和cd40),所述蛋白质激活了第二组t细胞(例如nt、靶向实体瘤的cart细胞和nyeso
‑
1tcrts)。此外,由第一组t细胞分泌的细胞因子(例如ifnγ)也激活第二组t细胞。
[0576]
实施例4.使用zfn、talen和/或cas9的修饰细胞
[0577]
构建多种基因特异性zfn以使得能够位点特异性引入突变。基本上如mala等人(2005)biochem biophys res commun 335(2):447
‑
57,liu等人(2002)j bio chem 277(6):3850
‑
6,sander等人(2011)nat methods.8(1):67
‑
9,urnov等人(2005)nature 435(7042):646
‑
651和美国专利公布2008/0131962所述,设计各种zfn并将其并入质粒载体中。zfn包括锌指结合结构域(例如zfn左和zfn右结合域)的各种组合,这些组合列于表14和表15中。zfn的切割结构域包含工程化的foki切割结构域(seq id no:280、281或282)。
[0578]
表14:示例性zfn对以及靶序列(靶位点:zfn的靶序列包含由6个碱基对的间隔隔开的两个9个碱基对的识别位点(即大写字母))
[0579][0580][0581]
使用fugene转染试剂分别将zfn左臂质粒载体和zfn右臂质粒载体转染到hela细胞中。转染24小时后,用1μg/ml嘌呤霉素处理hela细胞48小时,获得富含zfn的细胞。然后收集hela细胞。使用对各种基因(即ctla4、lag3、btla、tim3、foxp3、s1va1或lgals9)和hela细胞基因组具有特异性的引物作为模板,通过pcr扩增含有zfn的裂解dna片段。使用正向引物对dna片段进行测序。将dna片段克隆到载体中。对具有约30个单克隆细胞的dna片段进行测序以确定dna片段是否包含突变。测序结果示于表15中。
[0582]
表15:靶向基因片段并通过pcr扩增的zfn的单克隆测序结果
[0583][0584]
构建多种基因特异性zfn以使得能够位点特异性引入突变。基本上如mala等人(2005)biochem biophys res commun 335(2):447
‑
57;liu等人(2002)j bio chem 277(6):3850
‑
6;sander等人(2011)nat methods.8(1):67
‑
9;handel等人(2009)mol ther.jan;17(1):104
‑
11;umov等人(2005)nature435(7042):646
‑
651和美国专利公布2008/0131962所述,设计各种zfn并将其并入质粒载体中,所述参考文献以引用的方式整体并入。zfn包括锌指结合结构域(例如zfn左和zfn右结合域)的各种组合,这些组合列于表16中。zfn的切割结构域包含工程化的foki切割结构域(seq id nos.:96、97或98)。
[0585]
表16:示例性zfn对以及靶序列(靶位点:zfn的靶序列包含由6个碱基对的间隔隔开的两个9个碱基对的识别位点(即大写字母))
[0586][0587]
使用fugene转染试剂分别将zfn左臂质粒载体和zfn右臂质粒载体转染到hela细胞中。转染24小时后,用1μg/ml嘌呤霉素处理hela细胞48小时,获得富含zfn的细胞。然后收集hela细胞。使用对各种基因(即b2m和ciita)和hela细胞基因组具有特异性的引物作为模板,通过pcr扩增含有zfn的裂解dna片段。使用正向引物对dna片段进行测序。将dna片段克隆到载体中。对具有约30个单克隆细胞的dna片段进行测序以确定dna片段是否包含突变。测序结果示于表18中。使t细胞引入具有trac特异性zfn,所述trac特异性zfn被构建以使得能够在trac基因处位点特异性引入突变。基本上如urnov等人(2005)nature 435(7042):646
‑
651;lombardo等人(2007)nat biotechnol.november;25(11):1298
‑
306和美国专利公布2008/0131962所述,设计各种zfn并将其并入质粒载体中,所述参考文献以引用的方式整体并入。zfn包括锌指结合结构域(例如zfn左和zfn右结合域)的各种组合,这些组合列于表17中。zfn的切割结构域包含foki切割结构域(seq id no:96、97或98)。将编码一对zfn的mrna(参见表17)引入转导的细胞中,以修饰与tcr的α链相关的靶基因组基因座。
[0588]
表17
[0589][0590]
针对ciita的talen目的在于靶向外显子2(2l1:gctgaccccctgtgcct(seq id no:426);2l2:gaccccctgtgcctct(seq id no:427);2r1:ctccagccaggtccatct(seq id no:419);2r2:tctccagccaggtccat(seq id no:420))和外显子3(3l1:tcagcaggctgttgt(seq id no:421);3l2:tcagcaggctgttgtgt(seq id no:422);3r1:ccctggtctcttcat(seq id no:423);3r2:aagcctccctggtctt(seq id no:424);3r3:aagcctccctggtct(seq id no:425))。如前所述,用fasttale talen组装试剂盒(sidansai)构建talen,并且在293t细胞中证实其活性。将构建的talen转染到293t细胞中并且用2μg/ml嘌呤霉素(sigma)选择。选择后收获293t细胞的基因组dna。随后,进行pcr和测序以检验talen的效率。使用fugene转染试剂,将表达cas9和grna的质粒共转染到293t细胞中。72小时后,收集293t细胞,并且通过流式细胞术检测b2m和hla蛋白的表达。
[0591]
表18:靶向不同基因片段并通过pcr扩增的zfn的单克隆测序结果
[0592][0593]
本说明书中引用的所有出版物、专利和专利申请均以引用的方式整体并入本文,就好像每个单独的出版物、专利或专利申请被明确地并单独地指示以引用的方式并入。尽管已根据各种实施方案描述了前述内容,但是本领域技术人员将理解,可以在不脱离其精神的情况下进行各种修改、替换、省略和改变。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。