血浆外泌体中组蛋白h3作为中暑患者预后生物标志物的应用
技术领域
1.本发明涉及血浆外泌体中组蛋白h3作为中暑患者预后生物标志物的应用。
背景技术:
2.中暑(hs)是一种以核心体温升高>40℃和中枢神经系统障碍为特征的疾病。hs被认为是一种严重和普遍的疾病,可能导致继发性全身炎症反应和多器官功能障碍综合征(mods)。流行病学研究表明,中国hs患者平均病死率为10
‑
15%,重症hs死亡率甚至高达40%。因此,早期识别危重患者并及时有效的干预对提高hs患者的生存率至关重要。然而,目前没有预判hs严重程度和预后的可靠方法。
3.近年研究表明,外泌体在各种疾病的发病机制中起着重要作用,包括致病性免疫反应、炎症、肿瘤和感染。外泌体是直径为30
‑
150纳米的囊泡样结构,含有多种生物活性分子,包括蛋白质、核酸和脂质。根据以前的研究,血浆外泌体的数量在健康人和患有各种疾病(如脓毒症、心源性休克和酒精性肝炎)的患者之间有差异,外泌体内含物的表达谱与疾病高度相关且具有疾病特异性。此外,与血浆中游离物质相比,受外泌体双层膜保护的外泌体中内含物更稳定,更容易在循环系统内远距离运输而不被降解,拥有更宽的检测时间窗。综上所述,血浆外泌体及其内含物可用作新型的和更可靠的疾病生物标志物。
技术实现要素:
4.本发明拟探讨监测血浆外泌体中组蛋白h3水平是否可用于预测hs预后。对hs诱导的外泌体进行蛋白质组学分析发现,组蛋白h3被鉴定为hs外泌体中上调最明显的前10位蛋白质之一。本发明旨在通过调查hs患者血浆外泌体中组蛋白h3水平的变化,并评估其与器官功能障碍,疾病严重程度和死亡风险的相关性,以期探索hs预后新的生物标记物及潜在的临床治疗干预靶点。
5.本发明通过对入住重症监护室的hs患者(36名存活者和8名死亡者)在入院时和入院后4天采集血样,另外15名来自体检中心的健康志愿者作为对照组采集血样。使用超高速差速离心法分离血浆外泌体。检测组蛋白h3水平与器官功能和疾病严重程度之间的相关性。结果表明,外泌体组蛋白h3在hs患者血浆外泌体中存在差异表达(存活者,249.3
±
104.6pg/100μg;死亡者,500.4
±
216.8pg/100μg;健康对照者,161.1
±
52.49pg/100μg;p<0.05)。外泌体组蛋白h3表达的增加与疾病严重程度和病情演变有关,且与器官功能障碍指标显著相关(p<0.0001)。其分辨存活者与死亡者的roc曲线下面积为0.9668,在外泌体组蛋白水平为307pg/100g的折点上预测死亡风险具有最佳敏感性(95%)和特异性(91.67%),表明血浆外泌体中组蛋白h3水平可能是hs预后的可靠生物标志物。
附图说明
6.图1为健康对照组与存活组和死亡组的hs患者血浆外泌体的特征鉴定。(图1a)透射电镜下血浆外泌体的形态。白色箭头指示囊泡呈直径约100nm的双层圆形或椭圆形结构
(比例尺=100nm)。(图1b)纳米粒子追踪分析检测到的外泌体大小分布。(图1c)蛋白质印迹分析检测特征性外泌体表面标记蛋白cd9、cd63和cd81的表达,所有实验均重复三次。
7.图2为第1天和第4天健康对照组和hs患者(存活者组和死亡者组)血浆外泌体和血浆中游离的组蛋白h3水平。
8.图3为血浆外泌体中组蛋白h3分辨hs患者中存活者和死亡者的roc曲线。
具体实施方式
9.为使本发明要解决的技术问题、技术方案和优点更加清楚,下面将结合具体实施例进行详细描述。
10.本发明的研究旨在探讨检测血浆外泌体中组蛋白h3水平是否可用于预判hs预后。
11.研究的材料和方法
12.1.患者招募和临床数据收集:在2016年6月至2019年6月期间,44名在hs发生后24小时内入住中国人民解放军南部战区总医院重症监护室(icu)的患者被纳入研究。确诊hs的标准根据中国人民解放军中暑防治专家组和危重病委员会颁布的《中国热射病诊治专家共识(2019年版)》。诊断标准如下:1)暴露于高温高湿环境或2)有高强度运动病史;临床表现为:1)中枢神经系统功能障碍(如昏迷、惊厥、谵妄或异常行为),2)核心体温>40℃,3)多个(≥2)器官功能障碍,无法用其他病因解释。排除患有恶性肿瘤、慢性肝脏或肾脏疾病、慢性心功能不全(心功能纽约分级3
‑
4级)、慢性肺功能不全、潜在中枢神经系统疾病或代谢紊乱的患者。患者分为存活者(36例)和死亡者(8例)。来自体检中心的健康受试者(15名)被纳入为对照组。在入住icu第1天记录基线特征及用耳温计测量核心体温。在入icu第1天和第4天收集血样,由检验科检测反映器官功能的生化参数[乳酸(lac)、白蛋白(alb)、丙氨酸氨基转移酶(alt)、天冬氨酸氨基转移酶(ast)、尿素氮(bun)、肌酸激酶(ck)、肌酸激酶
‑
同工酶(ck
‑
mb)、肌酐(cr)、肌钙蛋白i(ctni)、纤维蛋白降解产物(fdp)、纤维蛋白原(fib)、国际标准化比值(inr)、肌红蛋白(myo)、动脉血氧分压(pao2)、降钙素原(pct)、血小板(plt)、凝血酶原时间(pt)、总胆红素(tbil)、白细胞计数(wbc)和d
‑
二聚体(d
‑
dimer)水平],同时记录了心率(hr),对机械通气(mv),血管活性药物及持续性血液滤过(crrt)的需求,吸入氧浓度(fio2),平均动脉压(map),格拉斯哥昏迷评分(gcs),急性生理和慢性健康评分(apache)ii和序贯性器官衰竭评估(sofa)评分。所有患者或其家属均签署书面知情同意书,本研究得到了中国人民解放军南部战区总医院医学伦理审查委员会的批准。
[0013]
2.血样采集和外泌体分离:对每个患者和对照组的健康受试者用装有乙二胺四乙酸抗凝剂的采血管收集10毫升外周静脉血。将采血管在22
‑
27℃下垂直放置30分钟。然后将全血在4℃下以2500
×
g离心10分钟以分离血浆。每个血浆样品用等量的磷酸盐缓冲盐水(pbs)稀释,并在4℃下进行三轮离心(2500
×
g离心30分钟,12000
×
g离心45分钟,110000
×
g离心2小时)。最后,将沉淀物(外泌体)重新悬浮在50
‑
200μl的pbs中,并储存在
‑
80℃。
[0014]
3.透射电镜观察外泌体形态:从健康对照组、轻症hs(未合并多器官衰竭)患者和重症hs(合并多器官衰竭)患者(随机选择)获得外泌体样品,在透射电镜(tem)下观察外泌体形态。将外泌体固定在载样铜网上:重悬100,000g离心的外泌体沉淀到50~100μl 2%福尔马林中。将5μl外泌体悬液加到formvar
‑
carbon载样铜网上。每份外泌体样品准备2~3个铜网。盖上盖子,在干燥环境中让formvar膜吸收20min。也可将5~10μl外泌体悬液滴加到
封口膜上,将铜网formvar膜面朝下放在悬液上;将100μl pbs加到封口膜上。用镊子将铜网(formvar膜面朝下)放在pbs液滴上清洗,在所有步骤中,都应保持formvar膜面湿润,而另一面干燥;将铜网放在50μl 1%戊二醛液滴上5min;将铜网放在100μl ddh2o中洗涤2min(共8次);将铜网放在50μl草酸双氧铀液滴上5min;将铜网放在50μl甲基纤维素
‑
ua液滴上10min,冰上操作;用不锈钢环移开铜网,在滤纸上轻轻吸去多余液体,留下一薄层纤维素膜,应将甲基纤维素膜的厚度控制在适当范围,这会影响到影像的对比度。不锈钢环被固定在1ml蓝枪头上;铜网仍在不锈钢环上,空气中干燥5~10min;干燥后,蓝
‑
金色的干涉条纹说明甲基纤维素膜的厚度合适、均匀;将铜网放在盒子里,飞利浦cm10透射电子显微镜(型号:jem
‑
2100f;飞利浦医疗保健)80kv下拍摄电镜照片。
[0015]
4.纳米粒子跟踪分析(nta):确定分离的外泌体的数量和大小分布(马尔文帕纳科;spectris plc)。简而言之,外泌体样本在无菌pbs中稀释至最终比例为1:5000,每个样本使用nanosight的自动分析设置分析三次,每次60秒。
[0016]
5.蛋白质印迹分析:使用裂解缓冲液(ripa:pmsf:ck=100:1:1)从血浆外泌体中提取蛋白质。使用bca检测试剂盒测定蛋白质浓度(biosharp life sciences;cat.no.bl507a)。使用10%十二烷基硫酸钠
‑
聚丙烯酰胺凝胶电泳加载和分离蛋白质(10μg/泳道),并电转移到0.2μm硝酸纤维素膜上。用牛血清白蛋白(gibco;thermo fisher scientific,inc.)封闭非特异性结合位点后在25℃下孵育1小时,将膜与一抗(稀释1:1000)在4℃下孵育过夜,然后与二抗(goat anti
‑
mouse igg h&l;cat.no.ab6789;1:5,000)在25℃孵育1小时。使用的一抗如下:抗cd63(abcam,cat.no.ab216130),抗cd9(abcam,cat.no.ab223052),抗cd81(abcam,cat.no.ab155760),抗tsg
‑
101(abcam,cat.no.ab30871))和抗gadph(abcam,cat.no.ab8245)。
[0017]
6.外泌体组蛋白h3水平检测:使用商品化的酶联免疫试剂盒(human histone h3 elisa kit;cat.no.mm
‑
51796h;jiangsu enzyme free industrial co.,ltd.)。
[0018]
7.统计学分析:kurtosis检验用于检查数据的正态分布性。正态分布数据表示为平均值
±
标准差,而非正态分布数据表示为中位数
±
四分位区间。两组间的统计学比较使用双尾student's t检验(针对正态分布数据),kruskal
‑
wallis h检验(针对非正态数据)和fisher's精确检验(针对分类数据)进行。对于两组以上的比较,使用two
‑
way anova分析和事后检验(simple main effects with a bonferroni correction),而对于分类数据,使用mcnemar's检验。相关性分析使用spearman's rank检验。通过受试者操作特征(roc)曲线分析来检验血浆外泌体中组蛋白h3对存活者和死亡者的分辨效力,并与血浆alt和ast进行比较。p值<0.05被认为具有统计学意义。所有统计学分析均使用graphpad软件7.0版(graphpad软件公司)进行。
[0019]
结果
[0020]
1.健康对照和hs患者基线特征的比较
[0021]
所有hs患者和健康对照者均为男性,既往均无基础病史。健康对照组和hs患者的平均年龄分别为25
±
6岁(17
‑
40)和21
±
4岁(16
‑
38)。临床特征和检验数据汇总于表1至表3。hs患者的28天死亡率为18.2%(8/44)。死亡者住icu时间明显长于存活者(中位数:10天vs.7天;p<0.001)。入院时体温在存活者和死亡者之间无统计学差异(分别为38.58
±
1.62℃和39.11
±
1.81℃;p>0.05),而存活者和死亡者均显著高于健康对照组(36.42
±
0.46℃;
p均<0.001)。大多数患者在入院前都进行了降温,降温策略见表2。在第4天,存活者和死亡者中都观察到高热的显著消退(与第1天相比p均<0.001;表1)。
[0022]
表1入icu第1天和第4天患者特征比较
[0023][0024]
apache,急性生理学和慢性健康评估;sofa,序贯性器官衰竭评估。与健康对照组的第1天相比:
a
p<0.05,
b
p<0.001;与与健康对照组的第4天相比:
c
p<0.05,
d
p<0.001:与死亡组的第1天相比:
e
p<0.001;与存活组的第4天相比:
f
p<0.001。
[0025]
表2患者住院时间及入院前处置措施的比较
[0026][0027]
icu,重症监护室;iqr,四分位数范围;crrt,持续肾脏替代治疗;hs,中暑。
[0028]
2.健康对照组,hs存活与死亡组各脏器功能指标的比较
[0029]
表3中暑患者和健康对照者的临床特征和脏器功能指标的比较
[0030]
[0031][0032]
alb,白蛋白;alt,谷丙转氨酶;ast,天冬氨酸转氨酶;bun,尿素氮;ck,肌酸激酶;ck
‑
mb,肌酸激酶
‑
同工酶;cns,中枢神经系统;cr,肌酐;ctni,肌钙蛋白i;fdp,纤维蛋白降解产物;fib,纤维蛋白;fio2,吸入氧浓度;gcs,格拉斯哥昏迷量表;hr,心率;inr,国际标准化比值;map,平均动脉压;mv,机械通气;myo,肌红蛋白;pao2,动脉氧分压;pct,降钙素原;plt,血小板;pt,凝血酶原时间;tbil,总胆红素;wbc,白细胞计数;lac,乳酸。与健康对照组第1天相比:
a
p<0.05,
b
p<0.01,
c
p<0.001;与健康对照组第4天相比:
d
p<0.05,
e
p<0.01,
f
p<0.001;与存活者第1天相比:
g
p<0.05,
h
p<0.01,
i
p<0.001;与死亡者第1天相比:
j
p<0.05,
k
p<0.01,
l
p<0.001;与存活者第4天相比:
m
p<0.05,
n
p<0.01,
o
p<0.001。
[0033]
从表3可知,在第1天时,反映器官功能障碍的常规生化参数在死亡者和存活者之间几乎没有显著差异。包括血流动力学不稳定(对血管活性药物的需求和lac水平升高)、呼吸功能障碍(对机械通气的需求)、对持续肾脏替代治疗的需求和凝血紊乱[延长的inr、fdp和fib水平降低]、横纹肌溶解(ck和肌红蛋白myo水平增加)和中枢神经功能障碍(gcs评分降低)。同时,存活者和死亡者在hr、map、pao2/fio2比值、肝功能障碍(tbil,alt和ast水平)、肾功能障碍(cr、bun水平和尿量)、pt和d
‑
二聚体水平、心肌损伤指标(ctni)和炎症标记物pct水平方面没有显著差异。hs存活者的myo水平明显高于健康对照组,但死亡者的myo水平低于存活者。值得注意的是,在第4天之前,死亡者和存活者之间的tbil水平、肾脏功能参数以及d
‑
dimer和ctni水平没有显著差异。在第1天,用于评估总体疾病严重程度的apache ii和sofa评分在死亡者和存活者之间没有显著差异,而sofa评分仅在第4天在死亡者中显著高于存活者。与第1天相比,第4天死亡者的血流动力学指标、mv比率、tbil水平和肾脏功能参数显著恶化,而其余器官功能指标保持不变。在存活者中,除wbc和pct水平外,大多数变量在第1天和第4天之间没有显著差异(表1
‑
3)。
[0034]
3.血浆外泌体的鉴定
[0035]
图1所示为健康对照组与hs存活组和死亡组患者血浆外泌体的特征。(图1a)透射电镜下可见的血浆外泌体形态。白色箭头表示直径约100nm的双层圆形囊泡(比例尺=100nm)。(图1b)纳米粒子追踪分析检测到的外泌体直径大小分布。(图1c)蛋白质印迹分析特征性外泌体表面标记蛋白cd9、cd63和cd81的表达,所有实验重复三次。
[0036]
对从健康对照、存活者和死亡者的hs患者获得的分离的血浆外泌体样品进行透射
电镜检查。在每组样品中观察到直径约100nm的双层膜囊泡样结构(图1a)。根据nta结果,存活者和死亡者的血浆外泌体数量均高于对照组(6.10
×
109及3.37
×
109vs.0.66
×
109颗粒/ml),而三组之间的直径分布相近,健康对照组的峰值为76nm,存活者组为78nm,死亡者组为67nm;健康对照组中直径分布在30
‑
200纳米范围之间的颗粒的比例为94.7%,而存活组为78.2%,死亡组为97.1%(图1b)。直径>200nm的颗粒比例在hs组中高于对照组,可能是由于细胞损伤/死亡增加导致hs组中污染物微粒/微泡的增加。蛋白质印迹分析表明,特征性的外泌体表面标记cd9、cd63和cd81在健康对照组以及存活组和死亡组中都显著高表达(图1c)。综上所述,经多方面鉴定,提取的囊泡符合血浆外泌体特征。
[0037]
4.健康对照组,hs存活组及死亡组血浆外泌体中组蛋白h3水平的比较
[0038]
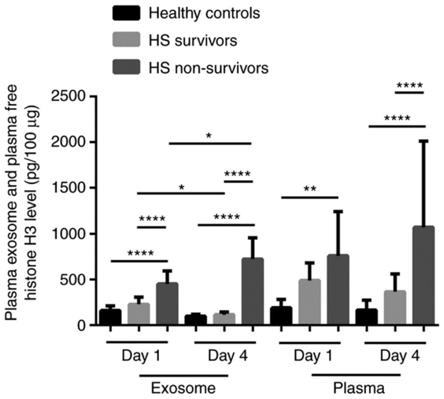
图2所示为第1天和第4天健康对照组和hs患者(存活组和死亡组)血浆外泌体和血浆中游离的组蛋白h3水平。在第1天和第4天,死亡组的血浆外泌体中组蛋白h3水平明显高于健康对照组和存活组。死亡组血浆外泌体中组蛋白h3水平在第4天明显高于第1天。第4天与第1天相比,存活组血浆外泌体组蛋白h3水平显著降低,而健康对照组没有显著变化。第4天与第1天相比,死亡组血浆游离组蛋白h3水平升高,存活组血浆游离组蛋白水平保持不变。*p<0.05,**p<0.01,***p<0.0001。
[0039]
如图2所示,入院后第1天和第4天,hs死亡组血浆外泌体中组蛋白h3水平均显著高于hs存活组和健康对照组(p均<0.001)。入院时,与存活组相比,死亡者的血浆外泌体组蛋白h3水平增加了2.0倍。然而,存活组和健康对照之间血浆外泌体组蛋白h3水平没有显著差异(p>0.05)。第4天与第1天相比,死亡组血浆外泌体组蛋白h3水平显著增加(p<0.05),而在存活组中显著降低(p<0.05)。第4天与第1天相比,血浆中游离组蛋白h3水平在死亡组中显著升高(p<0.001),但在存活组中无显著变化(p>0.05)(图2)。由此可见,血浆外泌体组蛋白h3水平相对于游离组蛋白h3水平更能反应病程的演变及与预后的相关性。
[0040]
5.hs患者血浆外泌体组蛋白h3水平与器官功能和疾病严重程度的相关性
[0041]
重症监护室入院时血浆外泌体中的组蛋白h3水平与许多器官功能参数显著正相关,包括心率、乳酸水平、谷丙转氨酶水平、肌酐水平、尿素氮水平、凝血酶原水平、inr和d
‑
二聚体水平,以及第1天和第4天的apache ii和sofa评分;第1天谷草转氨酶、总胆红素、肌红蛋白和肌钙蛋白
‑
1水平;和第4天的果糖二磷酸钠水平。相比之下,组蛋白h3的血浆外泌体水平与第1天和第4天的pao2/fio2比率、尿量、纤维蛋白原水平、血小板计数和gcs评分以及第4天的白蛋白水平呈负相关(表4)。然而,除了d
‑
二聚体水平(r=0.78)外,第1天血浆组蛋白h3外泌体水平与器官功能指标之间的相关性较差(均r<0.6),而血浆组蛋白h3外泌体水平与器官功能指标之间的相关性在第4天有所改善。
[0042]
表4第1天血浆外泌体组蛋白h3水平与第1天和第4天脏器功能指标的相关性
[0043]
[0044][0045]
alb,白蛋白;alt,谷丙转氨酶;ast,天冬氨酸转氨酶;bun,尿素氮;ck,肌酸激酶;ck
‑
mb,肌酸激酶
‑
同工酶;cns,中枢神经系统;cr,肌酐;ctni,肌钙蛋白i;fdp,纤维蛋白降解产物;fib,纤维蛋白;fio2,吸入氧浓度;gcs,格拉斯哥昏迷量表;hr,心率;inr,国际标准化比值;map,平均动脉压;mv,机械通气;myo,肌红蛋白;pao2,动脉氧分压;pct,降钙素原;plt,血小板;pt,凝血酶原时间;tbil,总胆红素;wbc,白细胞计数;lac,乳酸;apache,急性生理和慢性健康评分;sofa,序贯性器官衰竭评估。
[0046]
6.血浆外泌体组蛋白h3水平分辨hs存活者与死亡者的效力
[0047]
图3所示为血浆外泌体组蛋白h3水平分辨hs患者存活者和死亡者的roc曲线,并于血浆ast和alt的roc曲线进行对比。
[0048]
如图3所示,血浆外泌体组蛋白h3水平用于区分死亡者和存活者的的roc曲线下面积为0.9668[95%置信区间(ci),0.9231
‑
1.014;p<0.001],其分辨效力高。血浆组蛋白h3外泌体含量在307pg/100μg的折点上时,其预测死亡风险的敏感性和特异性分别为95%和91.67%(图3)。血浆外泌体组蛋白h3的roc曲线下面积高于血浆ast(0.7882;95%ci,0.5602
‑
1.016;p=0.01158)及alt(0.9028;95%ci,0.8121
‑
0.9935;p<0.001,图3)。
[0049]
因此,本发明旨在评估hs患者血浆外泌体组蛋白h3水平的变化,其与器官功能和疾病严重程度的相关性及对预后的评判价值。重症hs患者的死亡率高达18.2%,死亡者的特点是住icu时间延长,入院时高热更严重,随后多器官功能障碍的发生率更高。组蛋白h3在hs患者的血浆外体中富集,在死亡者中的表达水平高于存活者。随着病程演变,血浆外泌体组蛋白h3的丰度在存活者中降低,但在死亡者中增加。血浆外泌体组蛋白h3水平与器官功能障碍(通过sofa评分评估)和疾病严重程度(通过apache ii评分评估)之间存在显著相关性。血浆外泌体组蛋白h3水平区分死亡者和存活者的效力高(roc曲线下面积:0.9250)。在307pg/100μg的折点上时,其预测死亡风险的敏感性和特异性最优。
[0050]
在本发明中,血浆外泌体中组蛋白h3水平作为hs潜在预后评判指标的价值得到了临床验证。细胞外形式的组蛋白通常是由于严重损伤后期细胞死亡崩解后染色质破坏而被动释放的,而外泌体的释放是相对早期的事件,通过不依赖于细胞死亡的主动模式发生在损伤的初始阶段。因此,外泌体中组蛋白水平比其血浆游离态作为诊断标记物更敏感。
[0051]
组蛋白是高度保守的核内蛋白质,正常状态下其功能未为维持染色质的结构构象和稳定性。但在在不同类型的病理应激(如损伤或感染)下,其可释放到细胞外,起到内源性损伤相关分子模式的作用,诱导细胞死亡,炎症反应和组织损伤。给小鼠施用亚致死剂量的组蛋白导致肺部肺泡内出血以及中性粒细胞浸润。脓毒症中组蛋白为内皮功能障碍和器官衰竭的主要介质。在刀豆球蛋白a和对乙酰氨基酚肝损伤模型中,组蛋白为诱导肝细胞死亡的关键介质。相反,在急性器官损伤的动物模型中,拮抗组蛋白可降低死亡率。
[0052]
在本发明的研究中,hs患者外泌体组蛋白水平的升高及其与疾病严重程度的相关性也表明外泌体及其内组蛋白可能是减轻hs诱导脏器损伤的潜在靶点。目前有三种治疗策略可以拮抗组蛋白的有害作用:阻断组蛋白的释放、中和循环组蛋白和抑制细胞内信号转导。在动物模型中,这些策略已被证明有利于减少与脓毒症、创伤和中毒等相关的急性器官损伤。然而,在这些研究中使用的药物是针对循环组蛋白或中性粒细胞胞外陷阱相关组蛋白的,而干扰胞内信号通路可能会破坏dna结构或功能,可能导致灾难性的副作用。本研究的结果表明,阻断外泌体中的组蛋白可能提供新的治疗靶点,用gw4869抑制外泌体的产生已被证明能减轻脓毒症相关心脏损伤。
[0053]
总之,目前的研究表明,血浆外泌体中的组蛋白h3可能是严重hs患者病情严重程度分层和预后预测的一个新型和有效的标志物,可能具有潜在的临床应用。
[0054]
以上所述是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明所述原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。