1.本发明涉及经皮给药技术领域,特别是涉及一种基于超声及微流控的智能经皮给药装置、方法。
背景技术:
2.经皮给药系统是指药物透过皮肤经毛细血管吸收后进入血液循环达到有效的血药浓度,发挥疾病治疗或预防作用的控释药物系统。相对于传统的口服给药和注射给药而言,经皮给药的方式具有控制释放药物、延长有效作用时间、避免肝脏首过效应和对胃肠道的副作用、避免注射给药带来的疼痛、患者可自主用药以及减少人体血药浓度出现峰谷的变化等优势。
3.在经皮给药系统中,药物转运、吸收是依靠皮肤进行的。但同时,起最大阻碍作用的也是皮肤,皮肤由角质层、活性表皮、真皮和皮下脂肪组织组成,其中角质层是一种类似于“砖”和“水泥”型的结构,是影响药物透皮吸收的主要障碍。但是通过一些物理、化学的辅助手段,可以提高药物分子的经皮渗透率,从而达到有效的治疗效果,根据是否使用外部能量源,将经皮给药方法分为被动方法和主动方法。其中被动方法包括添加透皮促渗剂、制成前体药物、使用药物载体(如微乳、脂质体、凝胶等)等;主动方法如离子导入、电穿孔、激光技术、微针技术和超声导入等。
4.被动方法一定程度上提高了透过效率,药物载体的使用可实现药物的缓释及靶向,但目前被动方法效率低,透皮量不足,可控性差,未能克服经皮给药的透皮速率和渗透量的瓶颈,难于达到临床应用的需求。而主动方法的经皮给药大多采用单一方式给药,功能简单,给药速度慢,效率低,治疗效果不显著。如:专利号为"zl201120526790.9",名称为“离子导入透皮给药装置”的专利,该装置只包含有离子导入功能;公开号为"cn102397621a",名称为“封闭式激光冲击波透皮给药装置”的专利,采用激光方式工作;公开号为"cn1403173",名称为“经皮给药电穿孔系统”的专利,采用了电致孔药物导入法;公开号为“cn108126272a”,名称为“一种应用超声波加强经皮给药效果的装置”的专利,该装置只包含超声波发射功能,公开号为“cn206715039u”,名称为“一种基于微针的智能给药装置”的专利,该装置只涉及微针给药结构。
5.为了克服以上的缺点,很多研究者开始将目光投向了复合给药的领域,目前提出了如:微针联合超声、微针联合纳米载体、以及微针联合超声和纳米载体等,但是微针为微创,产生疼痛感,易造成感染,并且微针给药的深度受限,只能到达表皮层;超声联合纳米载体首先由于超声的输出功率和时间不可控,其超声的热效应可能会导致皮肤损伤等不良反应的发生,使其在安全性和可控性方面存在不足;再者是纳米载体的制备问题,现目前的载体制备主要采用薄膜分散法、溶剂冻干法、喷雾干燥法、反相蒸发法等传统方法,耗时长,包封率低,制备重复性差,载体粒径均一性和质量难于保证;其次,现目前的超声联合纳米载体的经皮给药未将载体制备装置与超声发生装置整合在一起,导致其在使用纳米载体给药时步骤繁琐,且有些载体需现配现用,无法转移或保存,没有集成制备的一体化仪器。总而
言之,目前复合给药尚存在许多问题有待解决,难于投入临床使用。
技术实现要素:
6.鉴于以上所述现有技术的缺点,本发明的目的在于提供一种将超声和微流控载体制备整合为一体并结合智能化实时反馈控制的经皮给药技术方案,用于解决上述技术问题。
7.为实现上述目的及其他相关目的,本发明提供一种基于超声及微流控的智能经皮给药装置,至少包括:
8.超声发生与接收系统,输出超声波并接收所述超声波的回波;
9.微流控载体制备系统,与所述超声发生与接收系统连接,制备输出载药载体并在所述超声波的作用下对患者经皮给药;
10.给药智能控制系统,分别与所述超声发生与接收系统、所述微流控载体制备系统连接,采集所述患者的初始皮肤参数及经皮给药实时反馈参数,根据所述初始皮肤参数制定所述患者的经皮给药参数,并根据所述经皮给药实时反馈参数调节所述经皮给药参数;
11.其中,所述经皮给药参数至少包括所述超声波的输出参数和所述载药载体的输出参数,所述超声波的输出参数至少包括所述超声波的输出功率及所述超声波的输出时间,所述载药载体的输出参数至少包括所述载药载体的粒径及所述载药载体在单位时间内的输出量。
12.可选地,所述超声发生与接收系统至少包括:
13.第一功放单元,产生并输出第一电信号;
14.第一换能单元,与所述第一功放单元连接,将所述第一电信号转换为促渗超声波;
15.第二功放单元,产生并输出第二电信号;
16.第二换能单元,与所述第二功放单元连接,将所述第二电信号转换为检测超声波,或者接收所述检测超声波的回波并将其转换为第三电信号;
17.第三功放单元,与所述第二换能单元连接,接收所述第三电信号;
18.其中,所述第一功放单元、所述第二功放单元和所述第三功放单元均与所述给药智能控制系统连接,所述给药智能控制系统通过所述第一功放单元调节控制所述促渗超声波的输出参数,所述第三功放单元将所述检测超声波的回波参数反馈给所述给药智能控制系统。
19.可选地,所述第一换能单元包括手持部及第一超声探头,所述第一超声探头固定设置在所述手持部的一端,且所述第一超声探头通过电缆引线与所述第一功放单元连接;所述第二换能单元包括第二超声探头,所述第二超声探头固定设置在所述手持部的一端,所述第二超声探头通过电缆引线与所述第二功放单元及所述第三功放单元连接,且所述第二超声探头包括发射相控阵换能器和接收相控阵换能器,所述发射相控阵换能器与所述第二功放单元连接,所述接收相控阵换能器与所述第三功放单元连接。
20.可选地,所述微流控载体制备系统设置在所述手持部的内部,沿着所述手持部的轴向,所述微流控载体制备系统包括依次设置的进液管道层、封装层、微通道层及蓄液池,所述第一超声探头安装设置在所述封装层的一侧,且所述第一超声探头与所述蓄液池接触。
21.可选地,所述进液管道层中设有相互独立设置的药物进液管道、内水相进液管道、有机相进液管道及外水相进液管道,所述微通道层中设有相互独立的药物腔室、内水相腔室、有机相腔室及外水相腔室,所述药物进液管道穿过所述封装层与所述药物腔室连通,所述内水相进液管道穿过所述封装层与所述内水相腔室连通,所述有机相进液管道穿过所述封装层与所述有机相腔室连通,所述外水相进液管道穿过所述封装层与所述外水相腔室连通。
22.可选地,所述微流控载体制备系统还包括微流体泵,所述药物进液管道、所述内水相进液管道、所述有机相进液管道及所述外水相进液管道的进液端分别设有所述微流体泵,所述微流体泵与所述给药智能控制系统连接,所述给药智能控制系统通过所述微流体泵调节控制所述载药载体的输出参数。
23.可选地,所述微通道层中还设有混合微通道、有机相微通道、外水相微通道、交汇口及载药载体出口,所述混合微通道分别与所述药物腔室、所述内水相腔室连通,所述有机相微通道与所述有机相腔室连通,所述外水相微通道与所述外水相腔室连通,所述混合微通道、所述有机相微通道及所述外水相微通道三者在所述交汇口处交汇连通,且所述交汇口通过所述载药载体出口与所述蓄液池连通。
24.可选地,所述给药智能控制系统包括控制单元、皮肤温度检测单元、皮肤阻抗检测单元及蓄液池检测单元,所述控制单元分别与所述第一功放单元、所述第二功放单元、所述第三功放单元、所述微流体泵、所述皮肤温度检测单元、所述皮肤阻抗检测单元及所述蓄液池检测单元连接,所述控制单元通过所述第一功放单元调节控制所述促渗超声波的输出参数,所述第三功放单元将所述检测超声波的回波参数反馈给所述控制单元,所述控制单元通过所述检测超声波的回波参数计算所述患者的皮肤参数及所述载药载体的渗透区域,所述控制单元通过所述微流体泵调节控制所述载药载体的输出参数,所述控制单元通过所述皮肤温度检测单元检测所述患者的施药处皮肤温度变化,所述控制单元通过所述皮肤阻抗检测单元检测所述患者的施药处皮肤阻抗变化,所述控制单元通过所述蓄液池检测单元检测所述蓄液池的液面高度变化并根据所述蓄液池的液面高度变化计算所述载药载体的输出量。
25.可选地,所述皮肤参数包括所述初始皮肤参数和实时皮肤参数,所述经皮给药实时反馈参数至少包括所述载药载体的输出量、所述载药载体的渗透区域、所述实时皮肤参数和皮肤温度。
26.可选地,所述初始皮肤参数和所述实时皮肤参数至少包括:皮肤的厚度、皮肤的致密程度及皮肤附属器的密度。
27.可选地,所述控制单元还与远程服务器连接,所述远程服务器采集存储以往患者的初始皮肤参数与对应的经皮给药参数,并形成所述初始皮肤参数与所述经皮给药参数之间的映射关系。
28.此外,为实现上述目的及其他相关目的,本发明还提供一种基于超声及微流控的智能经皮给药方法,包括步骤:
29.向患者的施药处输出检测超声波,并采集接收所述检测超声波的回波;
30.根据所述检测超声波的回波计算所述患者的初始皮肤参数;
31.根据所述患者的初始皮肤参数与预设的映射关系,获得经皮给药参数的粗值范
围,所述粗值范围至少包括促渗超声波的输出功率范围、促渗超声波的输出时间范围及所述载药载体的粒径范围;
32.向所述患者的施药处输出载药载体,并向所述患者的施药处输出所述促渗超声波,使得所述载药载体在所述促渗超声波的作用下透过所述患者的皮肤,实现经皮给药,且对应的经皮给药参数位于所述粗值范围之内。
33.可选地,所述映射关系由以往多个患者的初始皮肤参数与对应的经皮给药参数映射形成,所述智能经皮给药方法还包括步骤:
34.在经皮给药的过程中,向所述患者的施药处输出检测超声波,并采集接收所述检测超声波的回波;
35.根据所述检测超声波的回波计算出所述患者的实时皮肤参数和所述载药载体的渗透区域;
36.获取所述患者的皮肤温度,获取所述患者的皮肤阻抗,获取所述载药载体的输出量,结合所述实时皮肤参数和所述载药载体的渗透区域,得到所述患者的经皮给药实时反馈参数;
37.根据所述患者的经皮给药实时反馈参数对所述患者的经皮给药参数进行微调,可微调的经皮给药参数至少包括所述促渗超声波的输出功率、所述促渗超声波的输出时间及所述载药载体在单位时间内的输出量。
38.可选地,至少根据所述皮肤温度、所述实时皮肤参数、所述皮肤阻抗及所述载药载体的输出量对所述促渗超声波的输出时间进行微调。
39.如上所述,本发明的基于超声及微流控的智能经皮给药装置、方法至少具有以下有益效果:
40.1)、将超声发生与接收系统、微流控载体制备系统集成结合到一起,利用超声波与微流控制备载体的协同作用,实现了超声波与载药载体的复合给药,显著提高了经皮给药的给药效率和给药量,从而避免了传统经皮给药的方法引起的诸如皮肤损伤、疼痛、过敏、感染等的发生,最终使药物安全有效的透过机体,实用效果更好;
41.2)、引入给药智能控制系统,通过该给药智能控制系统采集获得患者的初始皮肤参数及经皮给药实时反馈参数,并根据初始皮肤参数及经皮给药实时反馈参数调节患者治疗时的经皮给药参数,能快速有效地确定最适合的经皮给药参数,一方面由于经皮给药的控制更精确,进一步提高了经皮给药的渗透率和仪器的工作效率,另一方面通过给药智能控制系统对超声输出功率、输出时间、皮肤状态以及温度等多个参数进行监测,进一步提高了给药时的安全性。
附图说明
42.图1显示为本发明实施例中基于超声及微流控的智能经皮给药装置的结构框图。
43.图2显示为本发明实施例中基于超声及微流控的智能经皮给药装置的局部结构框图。
44.图3显示为本发明实施例中基于超声及微流控的智能经皮给药装置的局部结构剖视图。
45.图4显示为图3中微通道层5的内部的结构示意图。
46.图5显示为本发明实施例中基于超声及微流控的智能经皮给药装置的工作流程图。
47.图6显示为本发明实施例中基于超声及微流控的智能经皮给药方法的步骤示意图。
48.附图标记说明
49.0-手持部,1-第一超声探头,2-第二超声探头,3-进液管道层,301-药物加载口,302-内水相加载口,303-有机相加载口,304-外水相加载口,311-药物进液管道,312-内水相进液管道,313-有机相进液管道,314-外水相进液管道,321、322、323、324-微流体泵,4-封装层,5-微通道层,50-外水相腔室,51-有机相腔室,52-药物腔室,53-内水相腔室,54外水相微通道,55-有机相微通道,56-混合微通道,57-交汇口,58-载药载体出口,6-皮肤温度检测单元,7-皮肤阻抗检测单元,8-蓄液池检测单元,a-蓄液池。
具体实施方式
50.发明人研究发现:在现有的经皮给药中,纳米载体一定程度上提高了透过效率,药物载体的使用可实现药物的缓释及靶向,但其效率低,透皮量不足,可控性差,未能克服经皮给药的透皮速率和渗透量的瓶颈,难于达到临床应用的需求;而超声的经皮给药大多采用单一方式给药,功能简单,给药速度慢,效率低,治疗效果不显著,少数涉及超声与纳米载体复合给药的研究也存在“载体制备重复性差,载体粒径均一性和质量难于保证,载体制备装置与经皮给药装置难于整合,使用时步骤繁琐,需要现配现用,无法转移或保存,没有集成制备的一体化仪器,难于投入临床使用”等缺点。
51.基于此,本发明提出一种经皮给药装置:一方面,将超声发生接收系统、微流控载体制备系统集成结合到一起,利用超声波与微流控制备载体的协同作用,实现超声波与载药载体的复合给药;另一方面,引入给药智能控制系统,通过该给药智能控制系统采集获得患者的初始皮肤参数及经皮给药实时反馈参数,根据初始皮肤参数制定患者的经皮给药参数,并根据经皮给药实时反馈参数调节经皮给药参数,以快速有效地确定最适合治疗的经皮给药参数。
52.以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
53.请参阅图1至图6。需要说明的是,本实施例中所提供的图示仅以示意方式说明本发明的基本构想,遂图式中仅显示与本发明中有关的组件而非按照实际实施时的组件数目、形状及尺寸绘制,其实际实施时各组件的型态、数量及比例可为一种随意的改变,且其组件布局型态也可能更为复杂。本说明书所附图式所绘示的结构、比例、大小等,均仅用以配合说明书所揭示的内容,以供熟悉此技术的人士了解与阅读,并非用以限定本发明可实施的限定条件,故不具技术上的实质意义,任何结构的修饰、比例关系的改变或大小的调整,在不影响本发明所能产生的功效及所能达成的目的下,均应仍落在本发明所揭示的技术内容得能涵盖的范围内。
54.参见图1,本发明提供一种基于超声及微流控的智能经皮给药装置,其至少包括:
55.超声发生与接收系统,输出超声波并接收超声波的回波;
56.微流控载体制备系统,与超声发生与接收系统连接,制备输出载药载体并在超声波的作用下对患者经皮给药;
57.给药智能控制系统,分别与超声发生与接收系统、微流控载体制备系统连接,采集患者的初始皮肤参数及经皮给药实时反馈参数,根据初始皮肤参数制定患者的经皮给药参数,并根据经皮给药实时反馈参数调节经皮给药参数;
58.其中,经皮给药参数至少包括超声波的输出参数和载药载体的输出参数,超声波的输出参数至少包括超声波的输出功率及超声波的输出时间,载药载体的输出参数至少包括载药载体的粒径及载药载体在单位时间内的输出量。
59.详细地,如图2所示,超声发生与接收系统至少包括:
60.第一功放单元,产生并输出第一电信号;
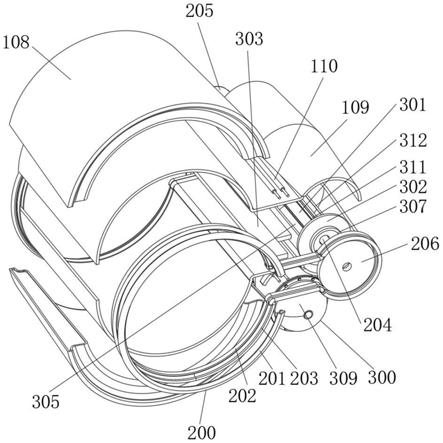
61.第一换能单元,与第一功放单元连接,将第一电信号转换为促渗超声波;
62.第二功放单元,产生并输出第二电信号;
63.第二换能单元,与第二功放单元连接,将第二电信号转换为检测超声波,或者接收检测超声波的回波并将其转换为第三电信号;
64.第三功放单元,与第二换能单元连接,接收第三电信号;
65.其中,第一功放单元、第二功放单元和第三功放单元均与给药智能控制系统连接,给药智能控制系统通过第一功放单元调节控制促渗超声波的输出参数,第三功放单元将检测超声波的回波参数反馈给给药智能控制系统。
66.详细地,如图3所示,第一换能单元包括手持部0及第一超声探头1,第一超声探头1固定设置在手持部0的一端,且第一超声探头1通过电缆引线与第一功放单元连接;第二换能单元包括第二超声探头2,第二超声探头2固定设置在手持部0的一端,第二超声探头2通过电缆引线与第二功放单元及第三功放单元连接,且第二超声探头2包括发射相控阵换能器和接收相控阵换能器,发射相控阵换能器与第二功放单元连接,接收相控阵换能器与第三功放单元连接。
67.更详细地,如图3所示,第一超声探头1设置在手持部0的内部且与蓄液池a接触,第二超声探头2设置在手持部0的外部且与施药面接触;第一超声探头1呈圆盘状,第二超声探头2在施药口的外围呈圆环设置。
68.更详细地,如图3所示,手持部0为具有4个开口的空腔结构:第一个开口用于手持部0内部的第一超声探头1、手持部0外部的第二超声探头2、微流控载体制备系统及给药智能控制系统的部分结构对外的电连接,第二个开口用作微流控载体制备系统中蓄液池a的给药出口即施药口,第三个开口用于微流控载体制备系统中蓄液池a与大气压的连通,第四个开口用于手持部0外部的第二超声探头2的电连接。
69.其中,第一超声探头1用于促渗超声波的发射,第二超声探头2用于检测超声波的发射及检测超声波回波的接收,主要为基于超声换能器的阵列结构,详细结构可参考现有技术,在此不再赘述。
70.此外,可以理解的是,超声发生与接收系统还包括电源管理单元、散热单元及显示单元等结构,详情可参见现有技术,在此不再赘述。
71.详细地,如图3所示,微流控载体制备系统设置在手持部0的内部,沿着手持部0的轴向,微流控载体制备系统包括从上到下依次设置的进液管道层3、封装层4、微通道层5及蓄液池a,超声探头2安装设置在封装层4的一侧,且超声探头2与蓄液池a接触。
72.更详细地,如图3所示,进液管道层3中设有相互独立设置的药物进液管道311、内水相进液管道312、有机相进液管道313及外水相进液管道314,进液管道层3中还设有相互独立设置在手持部1侧壁上的药物加载口301、内水相加载口302、有机相加载口303及外水相加载口304,药物进液管道311与药物加载口301连通,内水相进液管道312与内水相加载口302连通,有机相进液管道313与有机相加载口303连通,外水相进液管道314与外水相加载口304连通。
73.更详细地,如图3所示,微流控载体制备系统还包括微流体泵321、322、323及324,药物进液管道311的进液端设有微流体泵321,内水相进液管道312的进液端设有微流体泵322,有机相进液管道313的进液端设有微流体泵323,外水相进液管道314的进液端设有微流体泵324,微流体泵321、322、323及324分别与给药智能控制系统中的控制单元连接,给药智能控制系统通过微流体泵321、322、323及324调节控制载药载体的输出参数,通过调节控制药物、内水相、有机相及外水相的流速即可调节控制最终基于微流控形成的载药载体的粒径及载药载体在单位时间内的输出量。
74.此外,微通道层5中设有相互独立的药物腔室、内水相腔室、有机相腔室及外水相腔室(图3中未示出),药物进液管道311穿过封装层4与药物腔室连通,内水相进液管道312穿过封装层4与内水相腔室连通,有机相进液管道313穿过封装层4与有机相腔室连通,外水相进液管道314穿过封装层4与外水相腔室连通。
75.更详细地,如图4所示,微通道层5中设有相互独立的药物腔室52、内水相腔室53、有机相腔室51及外水相腔室50,微通道层5中还设有混合微通道56、有机相微通道55、外水相微通道54、交汇口57及载药载体出口58,混合微通道56分别与药物腔室52、内水相腔室53连通,有机相微通道55与有机相腔室51连通,外水相微通道54与外水相腔室50连通,混合微通道56、有机相微通道55及外水相微通道54三者在交汇口57处交汇连通,在此处形成载药载体,且交汇口57通过载药载体出口58与蓄液池a连通。
76.在本发明的一可选实施例中,混合微通道56、有机相微通道55及外水相微通道54的宽度为150μm,深度为100μm,长度为30mm左右,总流速37.50ul/min,有机相 内水相的流速为3.41ul/min,外水相的流速为34.1ul/min,最终制备得到的载药载体粒径为109nm。
77.详细地,如图1
‑
图3所示,给药智能控制系统包括控制单元、皮肤温度检测单元6、皮肤阻抗检测单元7及蓄液池检测单元8,控制单元分别与第一功放单元、第二功放单元、第三功放单元、微流体泵321~324、皮肤温度检测单元6、皮肤阻抗检测单元7及蓄液池检测单元8连接,控制单元通过第一功放单元调节控制促渗超声波的输出参数,第三功放单元将检测超声波的回波参数反馈给控制单元,控制单元通过检测超声波的回波参数计算患者的皮肤参数及载药载体的渗透区域,控制单元通过微流体泵321~324调节控制载药载体的输出参数,控制单元通过皮肤温度检测单元6检测患者的施药处皮肤温度变化,控制单元通过皮肤阻抗检测单元7检测患者的施药处皮肤阻抗变化,控制单元通过蓄液池检测单元8检测蓄液池a的液面高度变化并根据蓄液池a的液面高度变化计算载药载体的输出量。
78.其中,皮肤温度检测单元6可选用薄膜式贴片温度传感器如基于铂电阻的贴片温
度传感器,皮肤温度检测单元6可以包括多个呈点状或网格状分布的温度传感器,多点检测皮肤温度后求平均值,皮肤温度的检测精度至少在0.1℃及以上;皮肤阻抗检测单元7包括两个电极片和与电极片连接的处理模块,检测电压通过两个电极片施加到患者的施药处,处理模块对检测结果进行计算分析,得出施药处的皮肤阻抗值及其变化,皮肤阻抗的变化反映出载药载体的渗透情况;蓄液池检测单元8可以采用基于浮球、电感、超声、压力、光电等检测原理的传感器如电容式液位传感器,蓄液池检测单元8设置在蓄液池a的侧壁以检测蓄液池a中的液面高度,液面高度的检测精度至少在1mm及以上,基于该液面高度的检测可以大概计算一段时间内的液面高度变化进而得到输出的载药载体的大致数量,基于该液面高度的检测还可以及时有效地开启促渗超声波(如在某个液面高度范围之内即可开启促渗超声波)。
79.详细地,皮肤参数包括初始皮肤参数和实时皮肤参数,经皮给药实时反馈参数至少包括载药载体的渗透数量、载药载体的渗透区域、实时皮肤参数和皮肤温度。
80.更详细地,初始皮肤参数和实时皮肤参数至少包括:皮肤的厚度(尤其是角质层的厚度)、皮肤的致密程度(尤其是角质层的致密程度)及皮肤附属器的密度。在条件允许的情况下,还可进一步对皮肤进行细分检测,如检测表皮层的厚度及致密层度,检测真皮层的厚度及致密程度等,在此不再赘述。
81.详细地,如图1所示,给药智能控制系统中的控制单元还与远程服务器连接,即远程服务器与多个基于超声及微流控的智能经皮给药装置连接,远程服务器采集存储以往患者的初始皮肤参数与对应的经皮给药参数,基于多个智能给药装置采集上传的数据,建立并训练模型,形成初始皮肤参数与经皮给药参数之间的映射关系。
82.可以理解的是,还可以进一步根据患者的人种、性别、年龄及地区等因素,基于深度神经网络学习,对模型进行细化,获得更切合实际、更精准的映射关系,在此不作限定。
83.详细地,如图5所示,本发明中基于超声及微流控的智能经皮给药装置的具体工作流程如下:
84.1)、在经皮给药之前:首先,通过超声发生与接收系统向患者的施药处输出检测超声波;其次,通过超声发生与接收系统采集接收检测超声波的回波;再次,给药智能控制系统根据检测超声波的回波计算患者的初始皮肤参数;最后,给药智能控制系统根据患者的初始皮肤参数与映射关系对患者的经皮给药参数进行粗调,得到经皮给药参数的粗值范围;
85.2)、在经皮给药时:首先,通过微流控载体制备系统向蓄液池中输出载药载体;当蓄液池中载药载体的液面高度达标(即适合开启促渗超声波进行复合给药)之后,通过微流控载体制备系统向患者的施药处输出载药载体,并通过超声发生与接收系统向患者的施药处输出促渗超声波,使得载药载体在促渗超声波的作用下透过患者的皮肤,实现复合给药;其次,通过超声发生与接收系统向患者的施药处输出检测超声波,并接收检测超声波的回波;再次,在给药智能控制系统中,控制单元根据检测超声波的回波计算出患者的实时皮肤参数和载药载体的渗透区域,通过皮肤温度检测单元获取患者的皮肤温度,通过皮肤阻抗检测单元获取患者的皮肤阻抗,通过蓄液池检测单元获取载药载体的输出量,得到患者的经皮给药实时反馈参数;最后,给药智能控制系统根据患者的经皮给药实时反馈参数对患者的经皮给药参数进行细调。
86.在本发明的一可选实施例中,在经皮给药之前,根据患者的初始皮肤参数与映射关系能确定的经皮给药参数包括促渗超声波的输出功率、促渗超声波的输出时间及载药载体的粒径;在经皮给药之时,根据经皮给药实时反馈参数需要调节的经皮给药参数包括促渗超声波的输出功率、促渗超声波的输出时间及载药载体在单位时间内的输出量。
87.此外,基于上述工作流程,本发明还提供一种基于超声及微流控的智能经皮给药方法,如图6所示,其包括步骤:
88.s1、向患者的施药处输出检测超声波,并采集接收检测超声波的回波;
89.s2、根据检测超声波的回波计算患者的初始皮肤参数;
90.s3、根据患者的初始皮肤参数与预设的映射关系,获得经皮给药参数的粗值范围,所述粗值范围至少包括促渗超声波的输出功率范围、促渗超声波的输出时间范围及载药载体的粒径范围;
91.s4、向患者的施药处输出载药载体,并向患者的施药处输出促渗超声波,使得载药载体在促渗超声波的作用下透过患者的皮肤,实现经皮给药,且对应的经皮给药参数位于所述粗值范围之内。
92.在步骤s3中,根据以往患者的施药经验,确定适合当前患者的经皮给药参数范围,主要是根据表皮层的厚度和表皮层的致密程度确定促渗超声波的输出功率范围、促渗超声波的输出时间范围及载药载体的粒径范围。
93.详细地,如图6所示,所述基于超声及微流控的智能经皮给药方法还包括步骤:
94.s5、在经皮给药的过程中,向患者的施药处输出检测超声波,并采集接收检测超声波的回波;
95.s6、根据检测超声波的回波计算出患者的实时皮肤参数和载药载体的渗透区域;
96.s7、获取患者的皮肤温度,获取患者的皮肤阻抗,获取载药载体的输出量,结合实时皮肤参数和载药载体的渗透区域,得到患者的经皮给药实时反馈参数;
97.s8、根据患者的经皮给药实时反馈参数对患者的经皮给药参数进行微调,可微调的经皮给药参数至少包括促渗超声波的输出功率、促渗超声波的输出时间及载药载体在单位时间内的输出量。
98.在本发明的一可选实施例中,至少根据皮肤温度(间接反映给药对皮肤的伤害程度)、实时皮肤参数(皮肤致密程度的变化)、皮肤阻抗(反映载药载体的渗透量)及载药载体的输出量(给药量)对促渗超声波的输出时间进行微调,如皮肤温度过高(如超过50℃)、载药载体的渗透量过多则应先停止复合给药(停止促渗超声波和载药载体输出),过一段时间后先检测皮肤状态确认无恙且需要继续给药后再进行复合给药,并适当缩短促渗超声波的输出时间、减少载药载体的输出量;如皮肤温度正常、载药载体的渗透量不足则适当延长促渗超声波的输出时间、增加载药载体的输出量等,在保证安全的前提下做到充分给药。
99.此外,超声波的输出参数还可以包括超声波的输出频率,可根据实际情况调节超声波的输出频率,在此不作限定;如在本发明的一可选实施例中,在复合经皮给药时,正常皮肤选用20khz的促渗超声波,瘢痕疙瘩选用60khz的促渗超声波。
100.综上所述,在本发明提供的基于超声及微流控的智能经皮给药装置及给药方法中,一方面,将超声发生与接收系统、微流控载体制备系统集成结合到一起,利用超声波与微流控制备载体的协同作用,实现了超声波与载药载体的复合给药,显著提高了经皮给药
的给药效率和给药量,从而避免了传统的经皮给药方法引起的诸如皮肤损伤、疼痛、过敏、感染等发生,最终使药物安全有效的透过机体,实用效果更好;另一方面,引入给药智能控制系统,通过该给药智能控制系统采集获得患者的初始皮肤参数及经皮给药实时反馈参数,并根据初始皮肤参数及经皮给药实时反馈参数确定调节患者治疗时的经皮给药参数,由于经皮给药的控制更精确,提高了经皮给药的渗透率和仪器的工作效率,通过给药智能控制系统对超声输出功率、输出时间、皮肤参数状态以及皮肤温度等方面进行实时监测,进一步提高了安全性。
101.上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。