gsk872在制备治疗肠道病毒71型感染导致的疾病的药物中的用途
技术领域
1.本发明涉及制药领域,尤其是涉及gsk872在制备治疗肠道病毒71型感染导致的疾病的药物中的用途。
背景技术:
2.肠道病毒71型(enterovirus 71,ev71)是引起婴幼儿手足口病(hand, foot and mouth disease,hfmd)的主要病原体,ev71感染导致重症的比例较高,病死率亦较高。
3.目前针对ev71我国采取的为以注射ev71病毒疫苗为主的预防手段。尚缺乏安全有效的抗病毒治疗药物,这给ev71的防控及治疗带来严峻挑战。因此,防治手足口病的有效药物是亟待解决的问题。
技术实现要素:
4.本发明的目的在于,提供蛋白激酶3抑制剂gsk872的新用途,以及用于实现该用途的药物。
5.为了解决上述技术问题,实现上述目的,本发明提供了以下技术方案:
6.第一方面,本发明提供了蛋白激酶3抑制剂gsk872在制备治疗或预防肠道病毒71型感染导致的疾病的药物中的用途,该用途为发明人无意间发现,并经实验验证。
7.本发明提供的gsk872是一种有效的、特异性的蛋白激酶3抑制剂,与rip3激酶区域以高亲和力结合(ic50为1.8nm),抑制酶活性的ic50 为1.3nm,仅具微弱交叉反应,其分子结构式为:
[0008][0009]
本发明所述的肠道病毒71型感染导致的疾病包括婴幼儿手足口病、疱疹性咽峡炎、支气管炎、肺炎、胃肠炎、无菌性脑膜炎、急性弛缓性麻痹和脑炎。
[0010]
上述的婴幼儿手足口病为蛋白激酶3参与肠道病毒71型复制导致的疾病,和/或,婴幼儿手足口病为蛋白激酶3参与肠道病毒71型引发细胞坏死导致的疾病。
[0011]
第二方面,本发明提供一种以gsk872为抗病毒成分的治疗或预防肠道病毒71型感染导致的疾病的药物,药物在细胞基质中发挥药效。
[0012]
优选地,所述肠道病毒71型感染导致的疾病包括婴幼儿手足口病。
[0013]
在可选的实施方式中,本发明提供的药物包括药学上有效剂量的 gsk872和药学
上可应用的药物载体。所述的“药学上可以接受的载体”指的是:一种或多种相容性固体或液体填料或凝胶物质,它们适合于人使用,而且必须有足够的纯度和足够低的毒性。“相容性”在此指载体和gsk872 组合,不明显降低gsk872的药效。药学上可以接受的载体部分例子有纤维素及其衍生物(如羧甲基纤维素钠、乙基纤维素钠、纤维素乙酸酯等)、明胶、滑石、固体润滑剂(如硬脂酸、硬脂酸镁)、硫酸钙、植物油(如豆油、芝麻油、花生油、橄榄油等)、多元醇(如丙二醇、甘油、甘露醇、山梨醇等)、乳化剂润湿剂(如十二烷基硫酸钠)、着色剂、调味剂、稳定剂、抗氧化剂、防腐剂、无热原水等。
[0014]
在可选的实施方式中,所述药物中gsk872的有效剂量为2.5μm以上,优选为2.5μm,所述有效剂量是指gsk872的用量足以明显改善病情,而不至于产生严重的副作用。
[0015]
在可选的实施方式中,所述药物载体包括负载有靶向剂的纳米硒颗粒。
[0016]
优选地,所述靶向剂包括nε羧甲基赖氨酸。
[0017]
在可选实施方式中,所述gsk872与nε羧甲基赖氨酸摩尔比为1:0.8~ 1.2。
[0018]
在可选实施方式中,上述药物采用口服方式给药,用于口服给药的药物包括固体剂型,如胶囊剂、片剂、丸剂、散剂和颗粒剂。在这些固体剂型中,gsk872与至少一种常规惰性赋形剂(或载体)混合,如柠檬酸钠或磷酸二钙,或与下述成分混合:(a)填料或增容剂,例如,淀粉、乳糖、蔗糖、葡萄糖、甘露醇和硅酸;(b)粘合剂,例如,羟甲基纤维素、藻酸盐、明胶、聚乙烯基吡咯烷酮、蔗糖和阿拉伯胶;(c)保湿剂,例如,甘油;(d)崩解剂,例如,琼脂、碳酸钙、马铃薯淀粉或木薯淀粉、藻酸、某些复合硅酸盐、和碳酸钠;(e)缓溶剂,例如石蜡;(f)吸收加速剂,例如,季胺化合物;(g) 润湿剂,例如鲸蜡醇和单硬脂酸甘油酯;(h)吸附剂,例如,高岭土;和(i) 润滑剂,例如,滑石、硬脂酸钙、硬脂酸镁、固体聚乙二醇、十二烷基硫酸钠,或其混合物。在胶囊剂、片剂和丸剂中,剂型也可包含缓冲剂。
[0019]
上述固体剂型如片剂、糖丸、胶囊剂、丸剂和颗粒剂可采用包衣和壳材制备,如肠衣和其它本领域公知的材料。它们可包含不透明剂,并且,这种组合物中活性化合物的释放可以延迟的方式在消化道内的某一部分中释放。可采用的包埋组分的实例是聚合物质和蜡类物质。必要时,活性化合物也可与上述赋形剂中的一种或多种形成微胶囊形式。
[0020]
用于口服给药的液体剂型包括药学上可接受的乳液、溶液、悬浮液、糖浆或酊剂。除了活性化合物外,液体剂型可包含本领域中常规采用的惰性稀释剂,如水或其它溶剂,增溶剂和乳化剂,例知,乙醇、异丙醇、碳酸乙酯、乙酸乙酯、丙二醇、1,3
‑
丁二醇、二甲基甲酰胺以及油,特别是棉籽油、花生油、玉米胚油、橄榄油、蓖麻油和芝麻油或这些物质的混合物等。
[0021]
除了这些惰性稀释剂外,组合物也可包含助剂,如润湿剂、乳化剂和悬浮剂、甜味剂、矫味剂和香料。
[0022]
除了活性化合物外,悬浮液可包含悬浮剂,例如,乙氧基化异十八烷醇、聚氧乙烯山梨醇和脱水山梨醇酯、微晶纤维素、甲醇铝和琼脂或这些物质的混合物等。
[0023]
本发明将药学上有效剂量的gsk872和药学上可应用的负载有靶向剂的纳米硒颗粒载体制作成配方颗粒剂,通过口服,使得药物在小肠内被充分吸收,而后在靶向剂的引导下,纳米硒颗粒将有效剂量的gsk872输送至已感染病原体的细胞的细胞基质,通过阻断肠道病毒71型复制,和/或,阻止正常vero坏死,实现对肠道病毒71型感染引发婴幼儿手足口病的治疗作用,该可行的药物组合简单有效,适宜商品化推广,具有广泛的应用前景。
[0024]
本发明首次通过实验验证了蛋白激酶3抑制剂gsk872能够有效抑制肠道病毒71型引起的细胞病变,并结合vero细胞存活实验,得到了可用于治疗肠道病毒71型感染导致的婴幼儿手足口病的gsk872的安全剂量,为进一步开发治疗婴幼儿手足口病药物提供了指导。
附图说明
[0025]
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
[0026]
图1为本发明实施例1中不同浓度gsk872对vero细胞的毒性镜检结果;
[0027]
图2为本发明实施例1中不同浓度gsk872对vero细胞毒性的cck8 检测结果;
[0028]
图3为本发明实施例1中不同浓度gsk872对vero细胞保护作用的镜检结果;
[0029]
图4为本发明实施例1中不同浓度gsk872对vero细胞保护作用的 cck8检测结果;
[0030]
图5为本发明实施例3中流式细胞仪检测结果。
具体实施方式
[0031]
为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。通常在此处附图中描述和示出的本发明实施例的组件可以以各种不同的配置来布置和设计。
[0032]
因此,以下对在附图中提供的本发明的实施例的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0033]
为了确定gsk872及以gsk872为主要成分的药物具有治疗肠道病毒 71型感染导致的婴幼儿手足口病的作用,本发明提供了如下检测方法:
[0034]
1、判断gsk872具有抗肠道病毒71型的作用的方法,包括以下步骤:
[0035]
(1)gsk872溶液的制备
[0036]
使用dmso将gsk872配置成10μm、5μm、2.5μm、1.25μm和0.625μm 四个浓度,待用;
[0037]
(2)肠道病毒71型毒力测定
[0038]
将肠道病毒71型分别用dmem梯度稀释成10
‑1、10
‑2、10
‑3、10
‑4、10
‑5、 10
‑6、10
‑7和10
‑8共计8个浓度的病毒稀释液,将每个浓度的病毒稀释液按每孔100μl加入到细胞培养板中,细胞培养板的每个待测孔中含有vero细胞浓度为4
×
104cells/ml,设置只添加dmem的正常对照组,将细胞培养板放置细胞培养箱中培养,培养结束后,弃上清用pbs清洗,而后每个待测孔加200μl dmem,继续培养,然后显微镜下观察细胞状态,运用 reed
‑
muench法计算病毒tcid50,实验重复三次,计算肠道病毒71型的 tcid50,并记录;
[0039]
(3)gsk872溶液对vero细胞的毒性检测
[0040]
vero细胞以4
×
104个/孔铺于细胞培养板中,于37℃,5%co2培养箱中培养,然后第
一组待测孔中分别加入浓度为10μm、5μm、2.5μm、1.25μm 和0.625μm的gsk872处理vero细胞,第二组待测孔中加入dmem(即对照组),继续培养后进行细胞存活率检测,测定各孔od570值,并记录;
[0041]
(4)gsk872溶液抗肠道病毒71型作用测定
[0042]
将培养的vero细胞用0.25%胰蛋白酶消化,以4
×
104个/孔铺于细胞板中,于37℃,5%co2培养箱中培养,然后加入100tcid50剂量的肠道病毒71型孵育2h,弃上清并清洗,然后第一组加入浓度为10μm、5μm、2.5μm、 1.25μm和0.625μm的gsk872处理,第二组加入dmem(即对照组),继续培养,然后进行细胞存活率实验,测定各孔od570值,并记录。
[0043]
2、判断以gsk872为主要药用成分治疗肠道病毒71型感染导致的婴幼儿手足口病药物具有抗肠道病毒71型作用的方法,包括以下步骤:
[0044]
(1)待测药物试样及gsk872溶液的制备
[0045]
使用dmso将gsk872配置成10μm、5μm、2.5μm、1.25μm和0.625μm 四个浓度,待用;
[0046]
将待测药物试样研磨溶解,使用dmso溶解,测定溶液中gsk872浓度,取gsk872对应浓度为10μm、5μm、2.5μm、1.25μm和0.625μm的待测药物试样研磨溶液,待用;
[0047]
所述待测药物的制备方法为,将nε羧甲基赖氨酸溶于dmso中,而后加入甲醇稀释为10μm、5μm、2.5μm、1.25μm和0.625μm四个浓度,将gsk872溶液和nε羧甲基赖氨酸溶液等摩尔混合后,加入羟基化处理的纳米硒颗粒,搅拌后,喷雾干燥得到待测药物试样。
[0048]
(2)肠道病毒71型毒力测定
[0049]
将肠道病毒71型分别用dmem梯度稀释成10
‑1、10
‑2、10
‑3、10
‑4、10
‑5、 10
‑6、10
‑7和10
‑8共计8个浓度的病毒稀释液,将每个浓度的病毒稀释液按每孔100μl加入到细胞培养板中,细胞培养板的每个待测孔中含有vero细胞的浓度为4
×
104个/ml,设置只添加dmem的正常对照组,将细胞培养板放置细胞培养箱中培养,培养结束后,弃上清用pbs清洗,而后每个待测孔加200μl dmem,继续培养,然后显微镜下观察细胞状态,运用 reed
‑
muench法计算病毒tcid50,实验重复三次,计算肠道病毒71型的 tcid50,并记录;
[0050]
(3)待测药物试样vero细胞的毒性检测
[0051]
vero细胞以4
×
104个/孔铺于细胞培养板中,于37℃,5%co2培养箱中培养,然后第一组待测孔中分别加入浓度为10μm、5μm、2.5μm、1.25μm 和0.625μm的gsk872处理vero细胞,第二组待测孔中加入对应浓度待测药物试样溶液,第三组待测孔中加入dmem(即对照组),继续培养后进行细胞存活率检测,测定各孔od570值,并记录;
[0052]
(4)待测药物试样抗肠道病毒71型作用测定
[0053]
将培养的vero细胞用0.25%胰蛋白酶消化,以4
×
104个/孔铺于细胞板中,于37℃,5%co2培养箱中培养,然后加入100tcid50剂量的肠道病毒71型孵育2h,弃上清并清洗,然后第一组加入浓度为10μm/μl、5μm/μl、2.5μm/μl、1.25μm/μl和0.625μm/μl的gsk872处理,第二组加入对应浓度待测药物试样溶液,第三组加入dmem(即对照组),继续培养,然后进行细胞存活率实验,测定各孔od570值,并记录。
[0054]
上述判断gsk872具有抗肠道病毒71型的作用的方法和判断治疗肠道病毒71型感染导致的婴幼儿手足口病药物具有抗肠道病毒71型作用的方法的检测结果均证实了gsk872具有抗肠道病毒71型的作用,并且通过将含有有效剂量药物的抗肠道病毒71型效果与gsk872溶液抗肠道病毒71 型效果进行对比,能够更好地确定gsk872肠道病毒71型感染
导致的婴幼儿手足口病药物中gsk872的用量,为开发以gsk872为主要抗病毒组分药物提供依据。
[0055]
下面将结合实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0056]
实施例1gsk872在制备抗肠道病毒71型药物中的用途
[0057]
一、试剂和材料
[0058]
本实施例所用的肠道病毒71型(genbank号fj439769.1)来自广州市妇女儿童医疗中心,中心实验室临床分离株。(钟家禹,朱冰,华亮,王长兵,邝璐,谢嘉慧,陈翊.2008年和2010年肠道病毒71型广州分离株全基因组序列分析中华流行病学杂志〔j〕.2011,32(7):700
‑
704).
[0059]
本实施例所用的vero细胞购自中国科学院上海生命科学研究院细胞库, 目录号:gno10。
[0060]
本实施例所用的gsk872购自美国mce公司,cat.no.:hy
‑
101872。
[0061]
二、肠道病毒71型毒力测定
[0062]
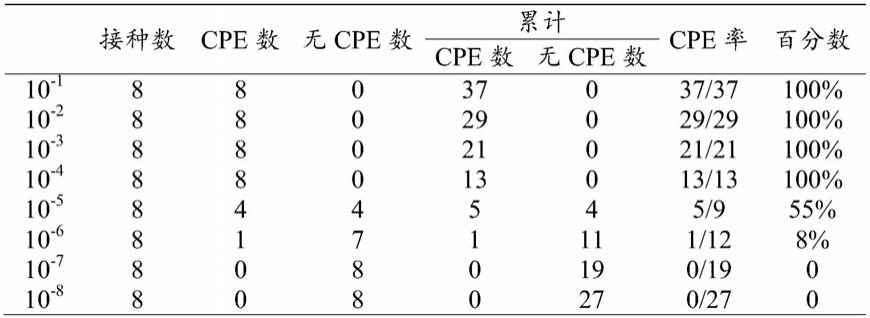
将肠道病毒71型分别用dmem梯度稀释成10
‑1、10
‑2、10
‑3、10
‑4、10
‑5、 10
‑6、10
‑7和10
‑8共计8个浓度,将病毒液按每孔100μl加入到vero细胞中,设置正常vero细胞对照组,将96孔板放置细胞培养箱中培养2h,弃上清用pbs洗3次,每孔加200μl dmem,继续培养,并统计cpe数,如表1所示,而后运用reed
‑
muench法计算病毒tcid50,实验重复三次,经计算ev71的tcid50为1*10
‑
5.11
,计算过程如下:
[0063]
表1 cpe数统计结果
[0064][0065]
按reed和muench两氏法计算ccid50。公式为:
[0066]
距离比=(高于50%病变率的百分数
‑
50%)/(高于50%病变率的百分数
‑
低于50%病变率的百分数)
[0067]
=(55
‑
50)/(55
‑
8)
[0068]
=0.11
[0069]
igtcid50=距离比例*稀释度对数之间的差 高于50%病变率的稀释度对数
[0070]
=0.11*(
‑
1) (
‑
5)
[0071]
=
‑
5.11
[0072]
tcid50=10
‑
5.11
,即将该病毒稀释10
‑
5.11
,接种100μl,可使50%的细胞发生病变。
[0073]
三、gsk872对vero细胞的毒性检测
[0074]
vero细胞以4
×
104个/孔铺于96孔板中,于37℃,5%co2培养箱中培养24h后,分别加入浓度为10μm、5μm、2.5μm、1.25μm和0.625μm的 gsk872处理vero细胞。培养48h后,于光学显微镜下观察gsk872对vero 细胞的损伤情况,结果如图1所示,从图中可以看出gsk872在浓度为0.625μm及1.25μm时未见有细胞毒性,当gsk872浓度为2.5μm~10μm时,随着gsk872浓度的增加,细胞毒性越来越明显。总培养时间48h后采用 cck8法进行细胞存活率检测,向培养板加入浓度为5mg/ml的cck8试剂 10μl/孔,充分混匀后37℃孵育30min,然后吸弃培养板中的液体,测定各孔od570值。以vero细胞对照组od570值为100%,按照细胞存活率(%) =(od
570
实验组/od
570
对照组)
×
100%进行计算,计算结果以柱形图展示,见图2,其中*:p<0.05,**:p<0.01,从图中可以看出,用0.625μm和1.25 μm的gsk处理的vero细胞的存活率与control组细胞存活率无差异,gsk 浓度为2.5μm、5μm和10μm处理的vero细胞存活率随着gsk浓度增加, vero细胞的存活率随之降低。说明gsk浓度为0.625μm和1.25μm时对 vero细胞无毒性。
[0075]
四、gsk872抗肠道病毒71型对vero细胞的保护作用检测
[0076]
将培养的vero细胞用0.25%胰蛋白酶消化,以4
×
104个/孔铺于96孔板中,于37℃,5%co2培养箱中培养24h,次日加入100tcid50剂量的肠道病毒71型孵育2h,弃上清用pbs洗3次,然后分别加入浓度为10μm、 5μm、2.5μm、1.25μm和0.625μm的gsk872处理。继续培养48h后,于光学显微镜下观察gsk872对vero细胞的损伤情况,结果如图3所示,从图中可以看出gsk872在浓度为0.625μm及1.25μm时,无治疗ev71病毒的作用,细胞病变明显。当gsk872浓度为2.5μm时,治疗作用明显,细胞病变减轻。当gsk872浓度为5μm及10μm时,具有细胞毒性,细胞病变明显。而后进行细胞存活率cck8实验,向培养板加入浓度为5mg/ml 的cck8试剂10μl/孔,充分混匀后37℃孵育30min,然后吸弃培养板中的液体,测定各孔od570值。以vero细胞对照组od570值为100%,按照细胞存活率(%)=(od
570
实验组/od
570
对照组)
×
100%进行计算,计算结果以柱形图展示,见图4,其中*:p<0.05,**:p<0.01,从图中可以看出,用10μm和5μm的gsk872处理的vero细胞的存活率与control组细胞存活率无差异,gsk872浓度为2.5μm、1.25μm和0.625μm处理的vero 细胞存活率随着gsk872浓度降低,vero细胞的存活率随之降低,说明 gsk872对病毒感染的vero细胞有一定的保护作用,且gsk872抑制病毒的作用呈浓度依赖性。考虑到gsk872在2.5μm时对vero细胞无毒性,且对病毒感染的vero细胞有保护性。
[0077]
ripk3广泛表达于胚胎和大量成熟组织中,已报道表达ripk3的组织有:肝、肾、脑、肺、心脏、睾丸、脾、前列腺、淋巴细胞、胎盘、胰腺、骨骼肌、结肠等。ripk3具有丝氨酸/苏氨酸激酶活性,能够感受细胞内环境变化,是调控细胞坏死的关键性蛋白,此外,ripk3在感染性疾病以及无菌性炎症性疾病中也发挥着重要的作用,有研究报道了ripk3还参与炎症小体激活以及多种炎症信号的调控,但ripk3在不同条件下如何决定及调控不同的信号机制还不清楚,尤其是ripk3是否在肠道病毒71型感染引发的手足口病过程的信号传导路径中发挥作用,以及能够藉此开发出更加安全有效的抗肠道病毒71型药物也未见报道。
[0078]
实施例2gsk872抗肠道病毒71型药物的制备
[0079]
本实施例提供一种用于口服的颗粒剂药物,将nε羧甲基赖氨酸溶于 dmso中,而后
加入甲醇稀释为1.25μm,将gsk872溶液和nε羧甲基赖氨酸溶液等摩尔混合后,加入羟基化处理的纳米硒颗粒,搅拌后,喷雾干燥得到待测药物试样。
[0080]
实施例3以gsk872为主要药用成分抗肠道病毒71型作用检测
[0081]
一、试剂和材料
[0082]
本实施例所用的肠道病毒71型(genbank号fj439769.1)与实施例1 相同,来自广州市妇女儿童医疗中心,中心实验室临床分离株。(钟家禹,朱冰,华亮,王长兵,邝璐,谢嘉慧,陈翊.2008年和2010年肠道病毒71 型广州分离株全基因组序列分析中华流行病学杂志〔j〕.2011,32(7): 700
‑
704)。
[0083]
本实施例所用的vero细胞与实施例1相同,购自中国科学院上海生命科学研究院细胞库,目录号:gno10。
[0084]
本实施例所用的gsk872与实施例1相同,购自美国mce公司,cat.no.: hy
‑
101872。
[0085]
本实施例所用药物为实施例2中制备得到的以gsk872为主要成分的抗肠道病毒71型药物。
[0086]
二、待测药物试样及gsk872溶液的制备
[0087]
使用dmso将gsk872配置成5μm、2.5μm、1.25μm和0.625μm四个浓度,待用;
[0088]
三、流式细胞仪检测
[0089]
培养vero细胞,当细胞密度为4
×
104个/孔时加入ev71病毒孵育2h,加入含有不同浓度gsk872药物组,培养48h后收集细胞,调整细胞数至 1~5
×
106个/ml,1000r/min离心5min。细胞沉淀用0.2ml预冷的pbs溶液轻轻重悬,室温1000r/min离心5min。细胞沉淀用0.2ml预冷的结合缓冲液轻轻重悬。加入5μl annexin v
‑
fitc,5μl pi染色,轻轻混匀,室温避光孵育10~15min,用流式细胞仪检测。
[0090]
检测结果如图5所示,由图5可以看出,病毒组细胞凋亡较高,gsk872 药物组随浓度(0.625μm、1.25μm、2.5μm)增加,细胞凋亡减少,说明 gsk872能有效抑制ev71引起的细胞凋亡。当gsk872浓度为5μm时,因对细胞有毒性,细胞凋亡增高。
[0091]
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。