抗her2抗体-吡咯并苯并二氮杂卓衍生物偶联物
技术领域
1.本发明涉及一种新型抗her2抗体和包含该抗体的抗体-药物偶联物。
背景技术:
2.抗体-药物偶联物(antibody-drug conjugate;adc)在癌症治疗等中得以使用,例如,与癌细胞表面所表达的抗原结合,对于通过该结合能够将抗原在细胞内内化的抗体,结合具有细胞毒活性的药物。adc能够通过将药物高效地送达癌细胞,能够期待使药物蓄积于癌细胞内,使癌细胞死亡。
3.作为adc所使用的药物中有效药物之一,可举出吡咯并苯并二氮杂卓(pbd)。pbd通过与dna小沟的pugpu序列等结合而显示细胞毒性。作为来源于天然的pbd的安曲霉素(anthramycin)在1965年被首次发现,至此以后各种来源于天然、或其类似物的pbd被发现(非专利文献1~4)。
4.pbd的结构通式由下述的式表示。
[0005][0006]
已知pbd在a、c环部上的取代基的数目、种类、部位各不相同,此外,在b、c环部的不饱和度各不相同。
[0007]
已知pbd通过形成二聚体结构而使细胞毒性大幅度地提高(非专利文献5、6),也有将二聚体pbd进行adc化的各种报告(专利文献1~15)。然而,在c2位具有螺环的pbd或其adc体是未知的。
[0008]
人上皮生长因子受体2(her2)为属于受体蛋白质酪氨酸激酶的上皮生长因子受体亚家族的膜贯通受体(非专利文献7~12)。
[0009]
报告了her2在乳腺癌、胃癌等各种癌症种类中过量表达(非专利文献13~18),在乳腺癌中为负的预后因素(非专利文献19、20)。作为对于her2过量表达癌症有效的抗her2药,已知曲妥珠单抗(trastuzumab)、曲妥单抗(kadcyla)、帕妥珠单抗(pertuzumab)、拉帕替尼(lapatinib)等。
[0010]
然而,响应性、活性的强度、以及适应范围还不充分,以her2作为标的的不充足的需求尚存。
[0011]
现有技术文献
[0012]
专利文献
[0013]
专利文献1:国际公开第2013/173496号
[0014]
专利文献2:国际公开第2014/130879号
[0015]
专利文献3:国际公开第2017/004330号
[0016]
专利文献4:国际公开第2017/004025号
[0017]
专利文献5:国际公开第2017/020972号
[0018]
专利文献6:国际公开第2016/036804号
[0019]
专利文献7:国际公开第2015/095124号
[0020]
专利文献8:国际公开第2015/052322号
[0021]
专利文献9:国际公开第2015/052534号
[0022]
专利文献10:国际公开第2016/115191号
[0023]
专利文献11:国际公开第2015/052321号
[0024]
专利文献12:国际公开第2015/031693号
[0025]
专利文献13:国际公开第2011/130613号
[0026]
专利文献14:国际公开第2005/040170号
[0027]
专利文献15:国际公开第2017/137556号
[0028]
非专利文献
[0029]
非专利文献1:angewandte chemie internationl edition 2016,55,2-29
[0030]
非专利文献2:chemical reviews 2010,111,2815-2864
[0031]
非专利文献3:in antibiotics iii.springer verlag,new york,pp.3-11
[0032]
非专利文献4:accounts of chemical research 1986,19,230
[0033]
非专利文献5:journal of the american chemical society 1992,114,4939
[0034]
非专利文献6:journal of organic chemistry 1996,61,8141
[0035]
非专利文献7:science.1985;230(4730):1132-1139.
[0036]
非专利文献8:embo j.1997;16:1647-1655.
[0037]
非专利文献9:embo j.1996;15:254-264.
[0038]
非专利文献10:j biom chem.1994;269:14661-14665.
[0039]
非专利文献11:science.1987;237:178-182.
[0040]
非专利文献12:proc natl acad sci u s a.1987;84:7159-7163.
[0041]
非专利文献13:eur.j surg oncol.1997(23):30-35.
[0042]
非专利文献14:oncogene.2008;27(47):6120-6130.
[0043]
非专利文献15:oncol rep.2006;15(1):65-71.
[0044]
非专利文献16:science.1987;235:177-182.
[0045]
非专利文献17:ann oncol 19:1523-1529,2008.
[0046]
非专利文献18:mol cell biol 6:955-958,1986.
[0047]
非专利文献19:science.1989;244:707-712.
[0048]
非专利文献20:diagn mol pathol 10:139-152,2001.
技术实现要素:
[0049]
发明所要解决的课题
[0050]
本发明提供新型抗her2抗体和该抗体-吡咯并苯并二氮杂卓(pbd)衍生物偶联物、以及新型pbd衍生物。
[0051]
此外,本发明提供具有抗肿瘤活性的抗her2抗体和抗her2抗体-pbd衍生物偶联物、以及含有新型pbd衍生物的医药组合物。
[0052]
进而,本发明提供抗her2抗体和抗her2抗体-pbd衍生物偶联物、以及使用了新型pbd衍生物的癌的治疗方法。
[0053]
用于解决课题的方法
[0054]
本发明人等进行了深入研究,结果发现,新型抗her2抗体-吡咯并苯并二氮杂卓(pbd)衍生物偶联物具有强抗肿瘤活性,从而完成本发明。
[0055]
即,本技术发明涉及下述技术方案。
[0056]
[1]下式所示的抗体-药物偶联物。
[0057][0058]
(式中,m1表示1或2的整数。
[0059]
d为选自下述的组中的任一者。
[0060][0061]
在此,式中,星号(*)表示与l结合。
[0062]
l为将ab的asn297所结合的糖链(n297糖链)与d进行连接的连接子。
[0063]
n297糖链任选地被重构。
[0064]
ab表示与her2特异性结合的抗体或该抗体的功能性片段,所述抗体或该抗体的功能性片段包含重链以及轻链,所述重链含有:由序列号1所述的氨基酸序列形成的cdrh1、由序列号2所述的氨基酸序列形成的cdrh2以及由序列号3所述的氨基酸序列或该氨基酸序列的一个~多个氨基酸被取代而成的氨基酸序列形成的cdrh3,所述轻链含有:由序列号5所述的氨基酸序列形成的cdrl1、由序列号6的氨基酸号1~3所述的氨基酸序列形成的cdrl2以及由序列号7所述的氨基酸序列或该氨基酸序列的一个~多个氨基酸被取代而成的氨基酸序列形成的cdrl3。)。
[0065]
[2]根据[1]所述的抗体-药物偶联物,其中,l由-lb-la-lp-nh-b-ch2-o(c=o)-*表示。
[0066]
在此,式中,星号(*)表示与d结合。
[0067]
b为1,4-苯基、2,5-吡啶基、3,6-吡啶基、2,5-嘧啶基或2,5-噻吩基。
[0068]
lp表示选自下述的组中的任一者。
[0069]
-ggva-、-gg-(d-)va-、-va-、-ggfg-、-ggpi-、-ggvcit-、-ggvk-以及-ggpl-。
[0070]
la表示选自下述的组中的任一者。
[0071]
-c(=o)-ch2ch2-c(=o)-、-c(=o)-(ch2ch2)2-c(=o)-。
[0072]
-c(=o)-ch2ch2-c(=o)-nh-(ch2ch2)2-c(=o)-。
[0073]
-c(=o)-ch2ch2-c(=o)-nh-(ch2ch2o)2-ch2-c(=o)
‑
。
[0074]
-c(=o)-ch2ch2-nh-c(=o)-(ch2ch2o)4-ch2ch2-c(=o)-、-ch2-oc(=o)-以及-oc(=o)-。
[0075]
lb由下式表示。
[0076][0077][0078]
或者
[0079][0080]
在此,在以上所示的lb的结构式中,星号(*)表示与la结合,波浪线表示与n297糖链或被重构的n297糖链结合。
[0081]
[3]根据[1]或[2]所述的抗体-药物偶联物,其中,l表示选自下述的组中的任一者。
[0082]
-z1-c(=o)-ch2ch2-c(=o)-ggva-nh-b-ch2-oc(=o)
‑
。
[0083]
-z1-c(=o)-ch2ch2-c(=o)-gg-(d-)va-nh-b-ch2-oc(=o)-。
[0084]
-z1-c(=o)-ch2ch2-c(=o)-va-nh-b-ch2-oc(=o)
‑
。
[0085]
-z1-c(=o)-(ch2ch2)2-c(=o)-va-nh-b-ch2-oc(=o)-。
[0086]
-z1-c(=o)-ch2ch2-c(=o)-ggpi-nh-b-ch2-oc(=o)
‑
。
[0087]
-z1-c(=o)-ch2ch2-c(=o)-ggfg-nh-b-ch2-oc(=o)
‑
。
[0088]
-z1-c(=o)-ch2ch2-c(=o)-ggvcit-nh-b-ch2-oc(=o)-。
[0089]
-z1-c(=o)-ch2ch2-c(=o)-ggvk-nh-b-ch2-oc(=o)-。
[0090]
-z1-c(=o)-ch2ch2-c(=o)-ggpl-nh-b-ch2-oc(=o)
‑
。
[0091]
-z1-c(=o)-ch2ch2-c(=o)-nh-(ch2ch2)2-c(=o)-va-nh-b-ch2-oc(=o)-。
[0092]
-z1-c(=o)-ch2ch2-c(=o)-nh-(ch2ch2o)2-ch2-c(=o)-va-nh-b-ch2-oc(=o)-。
[0093]
-z1-c(=o)-ch2ch2-nh-c(=o)-(ch2ch2o)4-ch2ch2-c(=o)-va-nh-b-ch2-oc(=o)-。
[0094]
-z2-oc(=o)-ggva-nh-b-ch2-oc(=o)-。
[0095]
-z3-ch2-oc(=o)-ggva-nh-b-ch2-oc(=o)-。
[0096]
在此,b表示1,4-苯基。
[0097]
z1表示下述的结构式。
[0098][0099]
z2表示下述的结构式。
[0100][0101]
z3表示下述的结构式。
[0102][0103]
在此,在z1、z2和z3的结构式中,星号(*)表示与所邻接的c(=o)、oc(=o)或ch2结合,波浪线表示与n297糖链或被重构的n297糖链结合。
[0104]
[4]根据[3]所述的抗体-药物偶联物,其中,l表示选自下述的组中的任一者。
[0105]
-z1-c(=o)-ch2ch2-c(=o)-ggva-nh-b-ch2-oc(=o)
‑
。
[0106]
-z1-c(=o)-ch2ch2-c(=o)-va-nh-b-ch2-oc(=o)
‑
。
[0107]
-z1-c(=o)-(ch2ch2)2-c(=o)-va-nh-b-ch2-oc(=o)-。
[0108]
-z1-c(=o)-ch2ch2-c(=o)-ggvcit-nh-b-ch2-oc(=o)-。
[0109]
-z1-c(=o)-ch2ch2-c(=o)-nh-(ch2ch2)2-c(=o)-va-nh-b-ch2-oc(=o)-。
[0110]
-z1-c(=o)-ch2ch2-c(=o)-nh-(ch2ch2o)2-ch2-c(=o)-va-nh-b-ch2-oc(=o)-。
[0111]
-z1-c(=o)-ch2ch2-nh-c(=o)-(ch2ch2o)4-ch2ch2-c(=o)-va-nh-b-ch2-oc(=o)-。
[0112]
在此,b为1,4-苯基。
[0113]
z1表示下述的结构式。
[0114][0115]
在此,在上述z1的结构式中,星号(*)表示与邻接于z1的c(=o)结合,波浪线表示与n297糖链或被重构的n297糖链结合。
[0116]
[5]根据[1]~[4]中任一项所述的抗体-药物偶联物,其中,d为选自下述的组中的任一者。
[0117][0118]
在此,式中,星号(*)表示与l结合。
[0119]
[6]根据[1]~[5]中任一项所述的抗体-药物偶联物,其中,抗体包含:含有下述的(a)~(c)所述的cdrh1、cdrh2和cdrh3的重链;以及,含有下述的(a)~(c)所述的cdrl1、cdrl2和cdrl3的轻链。
[0120]
(a)由序列号1所述的氨基酸序列形成的cdrh1、由序列号2所述的氨基酸序列形成的cdrh2以及由序列号4所述的氨基酸序列形成的cdrh3、以及由序列号5所述的氨基酸序列形成的cdrl1、由序列号6的氨基酸号1~3所述的氨基酸序列形成的cdrl2以及由序列号8所述的氨基酸序列形成的cdrl3。
[0121]
(b)由序列号1所述的氨基酸序列形成的cdrh1、由序列号2所述的氨基酸序列形成的cdrh2以及由序列号3所述的氨基酸序列形成的cdrh3、以及由序列号5所述的氨基酸序列形成的cdrl1、由序列号6的氨基酸号1~3所述的氨基酸序列形成的cdrl2以及由序列号8所述的氨基酸序列形成的cdrl3。
[0122]
或者,(c)由序列号1所述的氨基酸序列形成的cdrh1、由序列号2所述的氨基酸序列形成的cdrh2以及由序列号3所述的氨基酸序列形成的cdrh3、以及由序列号5所述的氨基酸序列形成的cdrl1、由序列号6的氨基酸号1~3所述的氨基酸序列形成的cdrl2以及由序列号7所述的氨基酸序列形成的cdrl3。
[0123]
[7]根据[1]~[6]中任一项所述的抗体-药物偶联物,其中,抗体包含由选自下述的(a)~(d)所构成的组中的氨基酸序列形成的重链可变区、以及由选自(e)~(i)所构成的组中的氨基酸序列形成的轻链可变区。
[0124]
(a)序列号13所述的氨基酸序列。
[0125]
(b)序列号17所述的氨基酸序列。
[0126]
(c)相对于(a)或(b)的序列中各cdr序列以外的骨架区的序列具有至少95%以上的同源性的氨基酸序列。
[0127]
(d)(a)或(b)的序列中的各cdr序列以外的骨架区的序列中,缺失一个或多个氨基酸、取代一个或多个氨基酸或添加一个或多个氨基酸而成的氨基酸序列。
[0128]
(e)序列号21所述的氨基酸序列。
[0129]
(f)序列号25所述的氨基酸序列。
[0130]
(g)序列号29所述的氨基酸序列。
[0131]
(h)相对于(e)~(g)的序列中各cdr序列以外的骨架区的序列具有至少95%以上的同源性的氨基酸序列。
[0132]
(i)(e)~(g)的序列中的各cdr序列以外的骨架区的序列中,缺失一个或多个氨基酸、取代一个或多个氨基酸或添加一个或多个氨基酸而成的氨基酸序列。
[0133]
[8]根据[7]所述的抗体-药物偶联物,其中,抗体包含下述的(a)~(c)所述的重链可变区和轻链可变区。
[0134]
(a)由序列号17所述的氨基酸序列形成的重链可变区以及由序列号25所述的氨基酸序列形成的轻链可变区。
[0135]
(b)由序列号13所述的氨基酸序列形成的重链可变区以及由序列号29所述的氨基酸序列形成的轻链可变区,或
[0136]
(c)由序列号13所述的氨基酸序列形成的重链可变区以及由序列号21所述的氨基酸序列形成的轻链可变区。
[0137]
[9]根据[1]~[8]中任一项所述的抗体-药物偶联物,其中,抗体为嵌合抗体。
[0138]
[10]根据[1]~[8]中任一项所述的抗体-药物偶联物,其中,抗体为人源化抗体。
[0139]
[11]根据[9]或[10]所述的抗体-药物偶联物,其中,抗体包含人igg1、人igg2或人igg4的重链恒定区。
[0140]
[12]根据[11]所述的抗体-药物偶联物,其中,抗体的重链恒定区为人igg1的重链恒定区,在该重链恒定区中,由eu index表示的234位和235位的亮氨酸被丙氨酸取代。
[0141]
[13]根据[10]~[12]中任一项所述的抗体-药物偶联物,其中,抗体包含下述的(a)或(b)所述的重链和轻链。
[0142]
(a)由序列号15的氨基酸号20~469所述的氨基酸序列形成的重链以及由序列号23的氨基酸号21~234所述的氨基酸序列形成的轻链(h01l02)。
[0143]
(b)由序列号11的氨基酸号20~469所述的氨基酸序列形成的重链以及由序列号27的氨基酸号21~234所述的氨基酸序列形成的轻链(hwtl05)。
[0144]
[14]根据[10]~[12]中任一项所述的抗体-药物偶联物,其中,抗体包含下述的(a)或(b)所述的重链和轻链。
[0145]
(a)由序列号11中氨基酸号20~469所述的氨基酸序列形成的重链以及由序列号19中氨基酸号21~234所述的氨基酸序列形成的轻链。
[0146]
或者,(b)由序列号31中氨基酸号20~469所述的氨基酸序列形成的重链以及由序列号32中氨基酸号21~234所述的氨基酸序列形成的轻链。
[0147]
[15]根据[1]~[14]中任一项所述的抗体-药物偶联物,其中,抗体包含选自由n-连接糖基化、o-连接糖基化、n末端的加工、c末端的加工、脱酰胺化、天冬氨酸的异构化、蛋氨酸的氧化、n末端的蛋氨酸残基的添加、脯氨酸残基的酰胺化、以及重链的羧基末端的一个或两个氨基酸残基的缺失构成的组中的一种或两种以上的修饰。
[0148]
[16]根据[15]所述的抗体-药物偶联物,其中,在抗体的重链的羧基末端缺失一个或多个氨基酸残基。
[0149]
[17]根据[16]所述的抗体-药物偶联物,其中,在抗体的两条重链双方的羧基末端缺失一个氨基酸残基。
[0150]
[18]根据[1]~[5]中任一项所述的抗体-药物偶联物,其中,抗体与[6]~[17]中任一项所述的抗体在与her2的结合上竞争,或者,结合于[6]~[17]中任一项所述的抗体所识别的her2上的部位。
[0151]
[19]根据[1]~[18]所述的抗体-药物偶联物,其中,n297糖链为被重构的糖链。
[0152]
[20]根据[1]~[19]所述的抗体-药物偶联物,其中,n297糖链表示具有下式所示
的结构的n297-(fuc)msg1、n297-(fuc)msg2或它们的混合物、或n297-(fuc)sg中的任一者。
[0153][0154]
上述式中,波浪线表示与抗体的asn297结合。
[0155]
n297糖链中的l(peg)表示-nh-ch2ch2-(o-ch2ch2)n5-*。
[0156]
在此,n5表示2~5的整数,左端的氨基与n297糖链的β-man支链的1-3链侧或/和1-6链侧的非还原末端的唾液酸的2位羧酸经由酰胺键而键合,右端的星号(*)表示与l中的z1的三唑环上的1位或3位的氮原子结合。
[0157]
[21]根据[20]所述的抗体-药物偶联物,其中,n5为3。
[0158]
[22]下式所示的抗体-药物偶联物。
[0159][0160]
(在以上所示的各个结构式中,m1表示1或2的整数。
[0161]
ab表示与her2特异性结合的抗体或该抗体的功能性片段,所述抗体或该抗体的功能性片段包含重链以及轻链,所述重链含有:由序列号1所述的氨基酸序列形成的cdrh1、由序列号2所述的氨基酸序列形成的cdrh2以及由序列号3所述的氨基酸序列或该氨基酸序列的一个~多个氨基酸被取代而成的氨基酸序列形成的cdrh3,所述轻链含有:由序列号5所述的氨基酸序列形成的cdrl1、由序列号6的氨基酸号1~3所述的氨基酸序列形成的cdrl2以及由序列号7所述的氨基酸序列或该氨基酸序列的一个~多个氨基酸被取代而成的氨基酸序列形成的cdrl3。
[0162]
n297糖链为具有下式所示的结构的n297-(fuc)msg1、n297-(fuc)msg2或它们的混合物、或n297-(fuc)sg。
[0163][0164][0165]
式中,波浪线表示与抗体的asn297结合。
[0166]
n297糖链中的l(peg)表示-nh-ch2ch2-(o-ch2ch2)3-*。
[0167]
在此,左端的氨基与n297糖链的β-man支链的1-3链侧或/和1-6链侧的非还原末端的唾液酸的2位羧酸经由酰胺键而键合,右端的星号(*)表示与上述结构式中的三唑环上的1位或3位的氮原子结合)。
[0168]
[23]下式所示的抗体-药物偶联物。
[0169][0170]
(在以上所示的各个结构式中,m1表示1或2的整数。
[0171]
ab表示与her2特异性结合的抗体或该抗体的功能性片段,所述抗体或该抗体的功能性片段包含重链以及轻链,所述重链含有:由序列号1所述的氨基酸序列形成的cdrh1、由序列号2所述的氨基酸序列形成的cdrh2以及由序列号3所述的氨基酸序列或该氨基酸序列的一个~多个氨基酸被取代而成的氨基酸序列形成的cdrh3,所述轻链含有:由序列号5所述的氨基酸序列形成的cdrl1、由序列号6的氨基酸号1~3所述的氨基酸序列形成的cdrl2以及由序列号7所述的氨基酸序列或该氨基酸序列的一个~多个氨基酸被取代而成的氨基酸序列形成的cdrl3。
[0172]
n297糖链为具有下式所示的结构的n297-(fuc)msg1、n297-(fuc)msg2或它们的混合物、或n297-(fuc)sg。
[0173]
[0174]
式中,波浪线表示与抗体的asn297结合。
[0175]
n297糖链中的l(peg)表示-nh-ch2ch2-(o-ch2ch2)3-*。
[0176]
在此,左端的氨基与n297糖链的β-man支链的1-3链侧或/和1-6链侧的非还原末端的唾液酸的2位羧酸经由酰胺键而键合,右端的星号(*)表示与上述结构式中的三唑环上的1位或3位的氮原子结合)。
[0177]
[24]下式所示的抗体-药物偶联物。
[0178][0179]
(在以上所示的各个结构式中,m1表示1或2的整数。
[0180]
ab表示与her2特异性结合的抗体或该抗体的功能性片段,所述抗体或该抗体的功能性片段包含重链以及轻链,所述重链含有:由序列号1所述的氨基酸序列形成的cdrh1、由序列号2所述的氨基酸序列形成的cdrh2以及由序列号3所述的氨基酸序列或该氨基酸序列的一个~多个氨基酸被取代而成的氨基酸序列形成的cdrh3,所述轻链含有:由序列号5所述的氨基酸序列形成的cdrl1、由序列号6的氨基酸号1~3所述的氨基酸序列形成的cdrl2以及由序列号7所述的氨基酸序列或该氨基酸序列的一个~多个氨基酸被取代而成的氨基酸序列形成的cdrl3。
[0181]
n297糖链为具有下式所示的结构的n297-(fuc)msg1、n297-(fuc)msg2或它们的混合物、或n297-(fuc)sg。
[0182]
[0183][0184]
式中,波浪线表示与抗体的asn297结合。
[0185]
n297糖链中的l(peg)表示-nh-ch2ch2-(o-ch2ch2)3-*。
[0186]
在此,左端的氨基与n297糖链的β-man支链的1-3链侧或/和1-6链侧的非还原末端的唾液酸的2位羧酸经由酰胺键而键合,右端的星号(*)表示与上述结构式中的三唑环上的1位或3位的氮原子结合)。
[0187]
[25]下式所示的抗体-药物偶联物。
[0188][0189]
(在以上所示的各个结构式中,m1表示1或2的整数。
[0190]
ab表示与her2特异性结合的抗体或该抗体的功能性片段,所述抗体或该抗体的功能性片段包含重链以及轻链,所述重链含有:由序列号1所述的氨基酸序列形成的cdrh1、由序列号2所述的氨基酸序列形成的cdrh2以及由序列号3所述的氨基酸序列或该氨基酸序列的一个~多个氨基酸被取代而成的氨基酸序列形成的cdrh3,所述轻链含有:由序列号5所述的氨基酸序列形成的cdrl1、由序列号6的氨基酸号1~3所述的氨基酸序列形成的cdrl2以及由序列号7所述的氨基酸序列或该氨基酸序列的一个~多个氨基酸被取代而成的氨基酸序列形成的cdrl3。
[0191]
n297糖链为具有下式所示的结构的n297-(fuc)msg1、n297-(fuc)msg2或它们的
混合物、或n297-(fuc)sg。
[0192][0193]
式中,波浪线表示与抗体的asn297结合。
[0194]
n297糖链中的l(peg)表示-nh-ch2ch2-(o-ch2ch2)3-*。
[0195]
在此,左端的氨基与n297糖链的β-man支链的1-3链侧或/和1-6链侧的非还原末端的唾液酸的2位羧酸经由酰胺键而键合,右端的星号(*)表示与上述结构式中的三唑环上的1位或3位的氮原子结合)。
[0196]
[26]根据[22]~[25]中任一项所述的抗体-药物偶联物,其中,抗体包含重链以及轻链,所述重链含有:由序列号1所述的氨基酸序列形成的cdrh1、由序列号2所述的氨基酸序列形成的cdrh2以及由序列号4所述的氨基酸序列形成的cdrh3,所述轻链含有:由序列号5所述的氨基酸序列形成的cdrl1、由序列号6的氨基酸号1~3所述的氨基酸序列形成的cdrl2以及由序列号8所述的氨基酸序列形成的cdrl3。
[0197]
[27]根据[22]~[25]中任一项所述的抗体-药物偶联物,其中,抗体包含重链以及轻链,所述重链含有:由序列号1所述的氨基酸序列形成的cdrh1、由序列号2所述的氨基酸序列形成的cdrh2以及由序列号3所述的氨基酸序列形成的cdrh3,所述轻链含有:由序列号5所述的氨基酸序列形成的cdrl1、由序列号6的氨基酸号1~3所述的氨基酸序列形成的cdrl2以及由序列号8所述的氨基酸序列形成的cdrl3。
[0198]
[28]根据[22]~[25]中任一项所述的抗体-药物偶联物,其中,抗体包含重链以及轻链,所述重链含有:由序列号1所述的氨基酸序列形成的cdrh1、由序列号2所述的氨基酸序列形成的cdrh2以及由序列号3所述的氨基酸序列形成的cdrh3,所述轻链含有:由序列号5所述的氨基酸序列形成的cdrl1、由序列号6的氨基酸号1~3所述的氨基酸序列形成的cdrl2以及由序列号7所述的氨基酸序列形成的cdrl3。
[0199]
[29]根据[22]~[26]中任一项所述的抗体-药物偶联物,其中,抗体包含由序列号17所述的氨基酸序列形成的重链可变区以及由序列号25所述的氨基酸序列形成的轻链可变区。
[0200]
[30]根据[22]~[25]和[27]中任一项所述的抗体-药物偶联物,其中,抗体包含由序列号13所述的氨基酸序列形成的重链可变区以及由序列号29所述的氨基酸序列形成
的轻链可变区。
[0201]
[31]根据[22]~[25]和[28]中任一项所述的抗体-药物偶联物,其中,抗体包含由序列号13所述的氨基酸序列形成的重链可变区以及由序列号21所述的氨基酸序列形成的轻链可变区。
[0202]
[32]根据[22]~[26]和[29]中任一项所述的抗体-药物偶联物,其中,抗体包含由序列号15的氨基酸号20~469所述的氨基酸序列形成的重链以及由序列号23的氨基酸号21~234所述的氨基酸序列形成的轻链。
[0203]
[33]根据[22]~[25]、[27]和[30]中任一项所述的抗体-药物偶联物,其中,抗体包含由序列号11的氨基酸号20~469所述的氨基酸序列形成的重链以及由序列号27的氨基酸号21~234所述的氨基酸序列形成的轻链。
[0204]
[34]根据[22]~[25]、[28]和[31]中任一项所述的抗体-药物偶联物,其中,抗体包含由序列号11中氨基酸号20~469所述的氨基酸序列形成的重链以及由序列号32中氨基酸号21~234所述的氨基酸序列形成的轻链。
[0205]
[35]根据[22]~[25]、[28]和[31]中任一项所述的抗体-药物偶联物,其中,抗体包含由序列号31中氨基酸号20~469所述的氨基酸序列形成的重链以及由序列号32中氨基酸号21~234所述的氨基酸序列形成的轻链。
[0206]
[36]根据[22]~[35]中任一项所述的抗体-药物偶联物,其中,抗体包含选自由n-连接糖基化、o-连接糖基化、n末端的加工、c末端的加工、脱酰胺化、天冬氨酸的异构化、蛋氨酸的氧化、n末端的蛋氨酸残基的添加、脯氨酸残基的酰胺化、以及重链的羧基末端的一个或两个氨基酸残基的缺失构成的组中的一种或两种以上的修饰。
[0207]
[37]一种与her2特异性结合的抗体或该抗体的功能性片段,所述抗体或该抗体的功能性片段包含重链以及轻链,所述重链含有:由序列号1所述的氨基酸序列形成的cdrh1、由序列号2所述的氨基酸序列形成的cdrh2以及由序列号3所述的氨基酸序列或该氨基酸序列的一个~多个氨基酸被取代而成的氨基酸序列形成的cdrh3,所述轻链含有:由序列号5所述的氨基酸序列形成的cdrl1、由序列号6的氨基酸号1~3所述的氨基酸序列形成的cdrl2以及由序列号7所述的氨基酸序列或该氨基酸序列的一个~多个氨基酸被取代而成的氨基酸序列形成的cdrl3。
[0208]
[38]根据[37]所述的抗体或该抗体的功能性片段,所述抗体或该抗体的功能性片段包含:含有下述的(a)或(b)所述的cdrh1、cdrh2和cdrh3的重链;以及,含有下述的(a)或(b)所述的cdrl1、cdrl2和cdrl3的轻链。
[0209]
(a)由序列号1所述的氨基酸序列形成的cdrh1、由序列号2所述的氨基酸序列形成的cdrh2以及由序列号4所述的氨基酸序列形成的cdrh3、以及由序列号5所述的氨基酸序列形成的cdrl1、由序列号6的氨基酸号1~3所述的氨基酸序列形成的cdrl2以及由序列号8所述的氨基酸序列形成的cdrl3。
[0210]
或者,(b)由序列号1所述的氨基酸序列形成的cdrh1、由序列号2所述的氨基酸序列形成的cdrh2以及由序列号3所述的氨基酸序列形成的cdrh3、以及由序列号5所述的氨基酸序列形成的cdrl1、由序列号6的氨基酸号1~3所述的氨基酸序列形成的cdrl2以及由序列号8所述的氨基酸序列形成的cdrl3。
[0211]
[39]根据[37]或[38]所述的抗体或该抗体的功能性片段,所述抗体或该抗体的功
能性片段包含:由选自下述的(a)~(e)所构成的组中的氨基酸序列形成的重链可变区;以及,由选自(f)~(k)所构成的组中的氨基酸序列形成的轻链可变区。
[0212]
(a)序列号13所述的氨基酸序列。
[0213]
(b)序列号17所述的氨基酸序列。
[0214]
(c)相对于(a)或(b)的序列中各cdr序列以外的骨架区的序列具有至少95%以上的同源性的氨基酸序列。
[0215]
(d)(a)或(b)的序列中的各cdr序列以外的骨架区的序列中,缺失一个或多个氨基酸、取代一个或多个氨基酸或添加一个或多个氨基酸而成的氨基酸序列。
[0216]
(e)序列号25所述的氨基酸序列。
[0217]
(f)序列号29所述的氨基酸序列。
[0218]
(g)相对于(e)或(f)的序列中各cdr序列以外的骨架区的序列具有至少95%以上的同源性的氨基酸序列。
[0219]
(h)(e)或(f)的序列中的各cdr序列以外的骨架区的序列中,缺失一个或多个氨基酸、取代一个或多个氨基酸或添加一个或多个氨基酸而成的氨基酸序列。
[0220]
[40]根据[39]所述的抗体或该抗体的功能性片段,所述抗体或该抗体的功能性片段包含下述的(a)或(b)所述的重链可变区和轻链可变区。
[0221]
(a)由序列号17所述的氨基酸序列形成的重链可变区以及由序列号25所述的氨基酸序列形成的轻链可变区,或
[0222]
(b)由序列号13所述的氨基酸序列形成的重链可变区以及由序列号29所述的氨基酸序列形成的轻链可变区。
[0223]
[41]根据[37]~[40]中任一项所述的抗体或该抗体的功能性片段,其为嵌合抗体或人抗体。
[0224]
[42]根据[37]~[40]中任一项所述的抗体或该抗体的功能性片段,其为人源化抗体。
[0225]
[43]根据[41]或[42]所述的抗体或该抗体的功能性片段,其包含人igg1、人igg2或人igg4的重链恒定区。
[0226]
[44]根据[43]所述的抗体或该抗体的功能性片段,重链恒定区为人igg1的重链恒定区,在该重链恒定区中,由eu index表示的234位和235位的亮氨酸被丙氨酸取代。
[0227]
[45]根据[42]~[44]中任一项所述的抗体或该抗体的功能性片段,其包含下述的(a)或(b)所述的重链和轻链。
[0228]
(a)由序列号15的氨基酸号20~469所述的氨基酸序列形成的重链以及由序列号23的氨基酸号21~234所述的氨基酸序列形成的轻链(h01l02)。
[0229]
或者,(b)由序列号11的氨基酸号20~469所述的氨基酸序列形成的重链以及由序列号27的氨基酸号21~234所述的氨基酸序列形成的轻链(hwtl05)。
[0230]
[46]一种抗体或该抗体的功能性片段,其与[37]~[45]中任一项所述的抗体在与her2的结合上竞争,或者,结合于[37]~[45]中任一项所述的抗体所识别的her2上的部位。
[0231]
[47]一种多核苷酸,其编码[37]~[46]中任一项所述的抗体或该抗体的功能性片段。
[0232]
[48]一种表达载体,其含有[47]所述的多核苷酸。
[0233]
[49]一种宿主细胞,其是利用[48]所述的表达载体转化而成的。
[0234]
[50]根据[49]所述的宿主细胞,宿主细胞为真核细胞。
[0235]
[51]根据[49]或[50]所述的宿主细胞,宿主细胞为动物细胞。
[0236]
[52][37]~[46]中任一项所述的抗体或该抗体的功能性片段的制造方法,其特征在于,包括下述工序:培养[49]~[51]中任一项所述的宿主细胞的工序;以及从由该工序得到的培养物采集目标抗体的工序。
[0237]
[53]一种抗体或该抗体的功能性片段,其特征在于,其通过[52]所述的制造方法得到。
[0238]
[54]根据[37]~[46]和[53]中任一项所述的抗体或该抗体的功能性片段,其包含选自由n-连接糖基化、o-连接糖基化、n末端的加工、c末端的加工、脱酰胺化、天冬氨酸的异构化、蛋氨酸的氧化、n末端的蛋氨酸残基的添加、脯氨酸残基的酰胺化、以及重链的羧基末端的一个或两个氨基酸残基的缺失构成的组中的一种或两种以上的修饰。
[0239]
[55]根据[54]所述的抗体或该抗体的功能性片段,在重链的羧基末端缺失一个或多个氨基酸残基。
[0240]
[56]根据[55]所述的抗体或该抗体的功能性片段,在两条重链双方的羧基末端缺失一个氨基酸残基。
[0241]
[57]根据[53]~[56]中任一项所述的抗体或该抗体的功能性片段,重链的羧基末端的脯氨酸残基进一步被酰胺化。
[0242]
[58]一种糖链重构抗体的制造方法,其包括下述的工序。
[0243]
i)培养[49]~[51]中任一项所述的宿主细胞,从所得的培养物采集目标抗体的工序。
[0244]
ii)利用水解酶处理由工序i)得到的抗体,制造(fucα1,6)glcnac-抗体的工序。
[0245]
iii)在糖基转移酶存在下,使(fucα1,6)glcnac-抗体与糖链供体分子进行反应的工序,所述糖链供体分子是在msg(9)或sg(10)的唾液酸的2位羧酸的羰基导入具有叠氮基的peg连接子,且使还原末端恶唑啉化而得到的。
[0246]
[59]根据[58]所述的制造方法,其还包括下述工序:对于工序ii)的反应液,通过利用羟基磷灰石柱的精制,将(fucα1,6)glcnac-抗体进行精制。
[0247]
[60]一种糖链重构抗体,其特征在于,其通过[58]或[59]所述的制造方法得到。
[0248]
[61][1]~[36]中任一项所述的抗体-药物偶联物的制造方法,其包括下述工序:使[60]所述的糖链重构抗体与药物连接子进行反应。
[0249]
[62]一种抗体-药物偶联物,其特征在于,由[60]所述的制造方法得到。
[0250]
[63]根据[1]~[36]中任一项所述的抗体-药物偶联物,其中,该抗体为[53]~[57]和[60]中任一项所述的抗体。
[0251]
[64]根据[1]~[36]、[62]和[63]中任一项所述的抗体-药物偶联物,其中,n297糖链为n297-(fuc)msg1。
[0252]
[65]根据[1]~[36]和[62]~[64]中任一项所述的抗体-药物偶联物,其中,m1为1的整数。
[0253]
[66]根据[1]~[36]和[62]~[65]中任一项所述的抗体―药物偶联物,其中,抗体―药物偶联物中的每一分子抗体的平均药物结合数为1~3或3~5。
[0254]
[67]一种医药组合物,其特征在于,其包含[1]~[36]和[62]~[66]中任一项所述的抗体-药物偶联物、或[37]~[47]、[53]~[57]和[60]中任一项所述的抗体或该抗体的功能性片段。
[0255]
[68]根据[67]所述的医药组合物,其特征在于,其为抗肿瘤药。
[0256]
[69]根据[68]所述的医药组合物,其特征在于,肿瘤表达her2。
[0257]
[70]一种肿瘤的治疗方法,其特征在于,将[1]~[36]和[62]~[66]中任一项所述的抗体-药物偶联物、或[37]~[47]、[53]~[57]和[60]中任一项所述的抗体或该抗体的功能性片段给药至个体。
[0258]
[71]根据[70]所述的肿瘤的治疗方法,其特征在于,肿瘤表达her2。
[0259]
[72]一种肿瘤的治疗方法,其特征在于,将包含[1]~[36]和[62]~[66]中任一项所述的抗体-药物偶联物、或[37]~[47]、[53]~[57]和[60]中任一项所述的抗体或该抗体的功能性片段的医药组合物、以及至少一种抗肿瘤药同时、分开或连续地给药至个体。
[0260]
[73]根据[37]~[47]、[53]~[57]和[60]中任一项所述的抗体或该抗体的功能性片段,其进一步与化合物偶联。
[0261]
发明效果
[0262]
本发明提供的新型抗her2抗体-吡咯并苯并二氮杂卓(pbd)衍生物偶联物具有优异的抗肿瘤活性和安全性,因此作为抗肿瘤剂是有用的。此外,本发明的新型her2抗体识别肿瘤细胞所表达的抗原或与该抗原结合,因此作为该偶联物的抗体是有用的。
附图说明
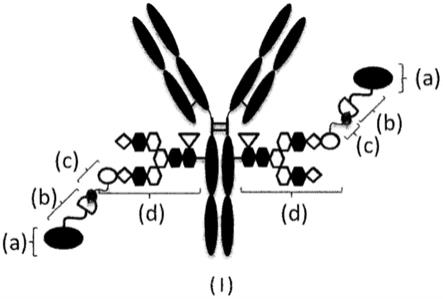
[0263]
图1为示意性表示本发明的抗体-药物偶联物((i)的分子)的图。(a)表示药物d,(b)表示连接子l,(c)表示n3-l(peg)-,(d)表示n297糖链(在此,白色的椭圆表示neuac(sia),白色的六角形表示man,涂黑的六角形表示glcnac,白色的菱形表示gal,以及白色的倒三角形表示fuc)。(b)和(c)由于(c)的叠氮基(黑色的泪珠型)与(b)的间隔子(白色的半圆形)中的炔烃结构反应,从而形成三唑环而结合。y字型表示抗体ab。此外,在本示意图中,为了方便将n297糖链表示为n297-(fuc)msg,并且示出各个n297糖链中仅一侧的支链具有与含有叠氮基的peg连接子(n3-l(peg)-)所结合的唾液酸,另一侧的支链的非还原末端不具有唾液酸的形态,但是也可以通过采用n297-(fuc)sg,在两方的支链的非还原末端具有与含有叠氮基的peg连接子所结合的唾液酸的形态。这样的示意方法只要没有特别说明,就适用于整个本说明书。
[0264]
图2为表示作为本发明的抗体-药物偶联物的制造中间体的(fucα1,6)glcnac-抗体(图2的a的(ii)的分子)以及msg型糖链重构抗体(图2的b的(iii)的分子)的结构的示意图。两图中,y字型与图1同样地表示抗体ab。图2的a中,(e)表示仅由在fuc的1位和6位进行α糖苷键的glcnac形成的n297糖链。图2的b中,(d)与图1同样地表示n297糖链,(f)为具有叠氮基的peg连接子部分的结构,表示供于在末端与连接子l结合的叠氮基。具有叠氮基的peg连接子的结合方式与图1的说明同样。
[0265]
图3为由动物细胞中产生的抗体制造msg型糖链重构抗体的工序的示意图。图中的分子(ii)、(iii)与图2同样,分别表示(fucα1,6)glcnac-抗体和msg型糖链重构抗体。(iv)的分子为动物细胞中产生的抗体,为n297糖链不均匀的分子的混合物。图3的a表示通过利
用endos那样的水解酶处理(iv)的不均匀的n297糖链,从而制作均匀的(fucα1,6)glcnac-抗体(ii)的工序。图3的b表示使用endos d233q/q303l变异体那样的糖基转移酶对于抗体(ii)的n297糖链的glcnac,使msg型糖链供体分子的糖链进行糖链转移,从而制作(iii)的msg型糖链重构抗体的工序。在此所使用的msg型糖链供体分子为msg的非还原末端的唾液酸用具有叠氮基的peg连接子进行了修饰的分子,在制作的msg型n297糖链重构抗体中,如图2的b所说明的那样,非还原末端的唾液酸受到同样的修饰。在图3的b中,为了方便,作为供体分子示出msg,但是将sg(10)作为糖链供体,由此合成在n297糖链的两个非还原末端与具有叠氮基的连接子分子结合的糖链重构抗体作为(iii)的重构抗体。
[0266]
图4表示曲妥珠单抗a1、a2和hwtl05抗体重链(hwt)的cdrh1~3的氨基酸序列(序列号1~3)。
[0267]
图5表示h01l02抗体重链(h01)的cdrh1~3的氨基酸序列(序列号1、2、4)。
[0268]
图6表示曲妥珠单抗a1、a2的轻链的cdrl1~3的氨基酸序列(序列号5、6(氨基酸号1~3所述的氨基酸序列)、7)。
[0269]
图7表示h01l02抗体和hwtl05抗体轻链(l02、l05)的cdrl1~3的氨基酸序列(序列号5、6、8)。
[0270]
图8表示曲妥珠单抗a1的重链(hwt)的氨基酸序列(序列号11)。
[0271]
图9表示a1、a2和hwtl05的重链可变区的氨基酸序列(序列号13)。氨基酸序列中的下划线表示cdr序列。
[0272]
图10表示h01l02抗体重链(h01)的氨基酸序列(序列号15)。
[0273]
图11表示h01l02抗体的重链可变区的氨基酸序列(序列号17)。氨基酸序列中的下划线表示cdr序列。
[0274]
图12表示曲妥珠单抗a1的轻链(lwt)的氨基酸序列(序列号19)。
[0275]
图13表示曲妥珠单抗a1、a2的轻链可变区的氨基酸序列(序列号21)。氨基酸序列中的下划线表示cdr序列。
[0276]
图14表示h01l02抗体轻链(l02)的氨基酸序列(序列号23)。
[0277]
图15表示h01l02抗体的轻链可变区的氨基酸序列(序列号25)。氨基酸序列中的下划线表示cdr序列。
[0278]
图16表示hwtl05抗体轻链(l05)的氨基酸序列(序列号27)。
[0279]
图17表示hwtl05抗体的轻链可变区的氨基酸序列(序列号29)。氨基酸序列中的下划线表示cdr序列。
[0280]
图18表示抗her2抗体-药物偶联物adc1和adc2对于皮下移植的作为人乳腺癌株的kpl-4细胞的效果。
[0281]
图19表示抗her2抗体-药物偶联物adc1和adc2对于皮下移植的作为人乳腺癌株的jimt-1细胞的效果。
[0282]
图20表示抗her2抗体-药物偶联物adc1和adc2对于皮下移植的作为人胰腺癌株的cfpac-1细胞的效果。
[0283]
图21表示曲妥珠单抗a2的重链的氨基酸序列(序列号31)。
[0284]
图22表示曲妥珠单抗a2的轻链的氨基酸序列(序列号32)。
[0285]
图23表示抗her2抗体-药物偶联物adc5对于皮下移植的作为人乳腺癌株的kpl-
4细胞的效果。
具体实施方式
[0286]
〔抗体-药物偶联物〕
[0287]
本发明的抗her2抗体-药物偶联物为在能够识别肿瘤细胞所表达的抗原或能够与该抗原结合的抗体上,经由连接子结构部分来结合抗肿瘤性化合物的抗肿瘤性药物。
[0288]
本发明的抗体―药物偶联物由下式表示。
[0289][0290]
m1为1或2的整数(优选为1),d表示药物,l表示将n297糖链与d进行连接的连接子,ab表示抗体或该抗体的功能性片段,n297糖链表示与上述抗体的asn297的侧链结合的糖链。n297糖链可以为被重构的糖链。
[0291]
<药物>
[0292]
本发明的药物d优选为抗肿瘤性化合物。本抗肿瘤性化合物使本发明的抗体-药物偶联物的连接子的一部分或全部在肿瘤细胞内被切断,抗肿瘤性化合物部分游离,表达抗肿瘤效果。
[0293]
本发明的抗体-药物偶联物中的药物即pbd衍生物为选自下述的组中的任一者。
[0294][0295]
在此,式中,星号(*)表示与l结合。
[0296]
本发明的pbd衍生物如下述部分结构i(a)或i(b)所示那样,11’位存在不对称碳,由此存在光学异构体。
[0297][0298]
因此,上述本发明的pbd衍生物分别包含光学异构体和光学异构体的任意比例的混合物。pbd衍生物的11’位的绝对立体构型能够通过结晶性的生成物或中间体或它们的衍生物的x射线晶体结构解析、mosher法等的nmr来决定。此时,立体构型可以使用利用已知的具有不对称中心的试剂被衍生物化的结晶性的生成物或中间体来确定绝对立体构型。立体异构体能够通过根据需要使用通常的光学分割法或分离法将合成的本发明涉及的化合物离析来得到。
[0299]
本发明的抗体-药物偶联物、其游离药物或其制造中间体有时存在立体异构体或来源于不对称碳原子的光学异构体、几何异构体、互变异构体或d体、l体、阻转异构体等光学异构体,这些异构体、光学异构体和它们的混合物中的任一者都包含于本发明中。
[0300]
作为本发明的pbd衍生物的部分结构,优选为上述i(a)。例如,选自下述的组中的任一者。
[0301][0302]
在此,式中,星号(*)表示与l结合。
[0303]
<连接子结构>
[0304]
本发明的连接子l为将n297糖链与d进行连接的连接子。
[0305]
该连接子l下述的式表示。
[0306]
-lb-la-lp-nh-b-ch2-o(c=o)-*
[0307]
星号(*)表示与药物d的n10’位的氮原子结合,lb表示将la与n297糖链或被重构的n297糖链进行结合的间隔子。
[0308]
b表示苯基或杂芳基,优选为1,4-苯基、2,5-吡啶基、3,6-吡啶基、2,5-嘧啶基、2,5-噻吩基,更优选为1,4-苯基。
[0309]
lp表示生物体内或靶细胞中能够切断的由氨基酸序列形成的连接子。lp例如,通过酯酶、肽酶等酶的作用而被切断。
[0310]
lp为由2~7个(优选为2~4个)的氨基酸构成的肽残基。即,由2~7个氨基酸通过肽键结合而成的寡肽残基来构成。
[0311]
lp在n末端与lb-la-的la的羰基结合,在c末端与连接子的-nh-b-ch2-o(c=o)-部分的氨基(-nh-)形成酰胺键。lp的c末端与-nh-间的结合被上述酯酶等酶切断。
[0312]
构成lp的氨基酸没有特别限定,例如为l-或d-氨基酸,优选为l-氨基酸。此外,除了α-氨基酸以外,可以为β-丙氨酸、ε-氨基己酸、γ-氨基丁酸等结构的氨基酸,进一步可以为例如被n-甲基化的氨基酸等非天然型的氨基酸。
[0313]
lp的氨基酸序列没有特别限定,作为构成的氨基酸,可举出甘氨酸(gly;g)、缬氨酸(val;v)、丙氨酸(ala;a)、苯丙氨酸(phe;f)、谷氨酸(glu;e)、异亮氨酸(ile;i)、脯氨酸(pro;p)、瓜氨酸(cit)、亮氨酸(leu;l)、丝氨酸(ser;s)、赖氨酸(lys;k)和天冬氨酸(asp;d)等。其中,优选为甘氨酸(gly;g)、缬氨酸(val;v)、丙氨酸(ala;a)、瓜氨酸(cit)。
[0314]
这些氨基酸可以重复,具有包含任意地选择的氨基酸的氨基酸序列。此外,能够根据氨基酸的种类,控制药物游离的样式。
[0315]
作为连接子lp的具体例,可举出:-ggva-、-gg-(d-)va-、-va-、-ggfg-、-ggpi-、-ggvcit-、-ggvk-、-gg(d-)pi-、-ggpl-、-eggva、-pi-、-
ggf-、-dggf-、(d-)d-ggf-、-eggf-、-sggf-、-kggf-、-dggfg-、-ggfgg-、-ddggfg-、-kdggfg-、-ggfgggf-。
[0316]
在此,上述“(d-)v”表示d-缬氨酸,“(d-)p”表示d-脯氨酸,“(d-)d”表示d-天冬氨酸。
[0317]
连接子lp优选如下。
[0318]
-ggva-、-gg-(d-)va-、-va-、-ggfg-、-ggpi-、-ggvcit-、-ggvk-、-gg(d-)pi-、-ggpl-。
[0319]
连接子lp更优选如下。
[0320]
-ggva-、-ggvcit-、-va-。
[0321]
la表示选自下述的组中的任一者。
[0322]
-c(=o)-(ch2ch2)n2-c(=o)-、-c(=o)-(ch2ch2)n2-c(=o)-nh-(ch2ch2)n3-c(=o)-。
[0323]
-c(=o)-(ch2ch2)n2-c(=o)-nh-(ch2ch2o)n3-ch2-c(=o)-。
[0324]
-c(=o)-(ch2ch2)n2-nh-c(=o)-(ch2ch2o)n3-ch2ch2-c(=o)-、-(ch2)n4-o-c(=o)-。
[0325]
在此,式中,n2表示1~3的整数(优选为1或2),n3表示1~5的整数(优选为2~4的整数,更优选为2或4),n4表示0~2的整数(优选为0或1)。
[0326]
la优选表示选自下述的组中的任一者。
[0327]
-c(=o)-ch2ch2-c(=o)-、-c(=o)-(ch2ch2)2-c(=o)-。
[0328]
-c(=o)-ch2ch2-c(=o)-nh-(ch2ch2)2-c(=o)-。
[0329]
-c(=o)-ch2ch2-c(=o)-nh-(ch2ch2o)2-ch2-c(=o)
‑
。
[0330]
-c(=o)-ch2ch2-nh-c(=o)-(ch2ch2o)4-ch2ch2-c(=o)-。
[0331]
-ch2-oc(=o)-以及-oc(=o)-。
[0332]
la更优选为-c(=o)-ch2ch2-c(=o)-或-c(=o)-(ch2ch2)2-c(=o)-。
[0333]
lb的间隔子没有特别限定,可举出例如下式所示的间隔子。
[0334][0335]
[0336]
在以上所示的lb的各个结构式中,星号(*)表示与la的左端的-(c=o)、或-(ch2)n4结合,波浪线表示与ab的糖链或被重构的糖链结合。
[0337]
在以上所示的lb(lb-1、lb-2或lb-3)的各个结构式中,由叠氮基与dbco(二苯基环辛炔(dibenzocyclooctyne))的点击反应(click reaction)形成的三唑环部位具有几何异性结构,在一个lb中,以这两种结构的任一方,或它们的混合物的形式存在。即,本发明的抗体-药物偶联物在一分子中存在两个或四个(m1为1或2)的“-l-d”,两个或四个“-l-d”中的各个l中的各个lb(lb-1、lb-2或lb-3)以这两种结构的任一方,或这两者混合存在。
[0338]
l优选由-lb-la-lp-nh-b-ch2-o(c=o)-*表示。
[0339]
b为1,4-苯基。
[0340]
lp表示选自下述的组中的任一者。
[0341]
-ggva-、-gg-(d-)va-、-va-、-ggfg-、-ggpi-、-ggvcit-、-ggvk-、-ggpl-。
[0342]
la表示选自下述的组中的任一者。
[0343]
-c(=o)-ch2ch2-c(=o)-、-c(=o)-(ch2ch2)2-c(=o)-。
[0344]
-c(=o)-ch2ch2-c(=o)-nh-(ch2ch2)2-c(=o)-。
[0345]
-c(=o)-ch2ch2-c(=o)-nh-(ch2ch2o)2-ch2-c(=o)
‑
。
[0346]
-c(=o)-ch2ch2-nh-c(=o)-(ch2ch2o)4-ch2ch2-c(=o)-、-ch2-oc(=o)-、-oc(=o)-。
[0347]
lb表示以上所示的lb的任一结构式。
[0348]
l更优选为选自下述的组中的任一者。
[0349]
-z1-c(=o)-ch2ch2-c(=o)-ggva-nh-b-ch2-oc(=o)
‑
。
[0350]
-z1-c(=o)-ch2ch2-c(=o)-gg-(d-)va-nh-b-ch2-oc(=o)-。
[0351]
-z1-c(=o)-ch2ch2-c(=o)-va-nh-b-ch2-oc(=o)
‑
、
[0352]
-z1-c(=o)-(ch2ch2)2-c(=o)-va-nh-b-ch2-oc(=o)-。
[0353]
-z1-c(=o)-ch2ch2-c(=o)-ggpi-nh-b-ch2-oc(=o)
‑
。
[0354]
-z1-c(=o)-ch2ch2-c(=o)-ggfg-nh-b-ch2-oc(=o)
‑
。
[0355]
-z1-c(=o)-ch2ch2-c(=o)-ggvcit-nh-b-ch2-oc(=o)-。
[0356]
-z1-c(=o)-ch2ch2-c(=o)-ggvk-nh-b-ch2-oc(=o)-。
[0357]
-z1-c(=o)-ch2ch2-c(=o)-ggpl-nh-b-ch2-oc(=o)
‑
。
[0358]
-z1-c(=o)-ch2ch2-c(=o)-nh-(ch2ch2)2-c(=o)-va-nh-b-ch2-oc(=o)-。
[0359]
-z1-c(=o)-ch2ch2-c(=o)-nh-(ch2ch2o)2-ch2-c(=o)-va-nh-b-ch2-oc(=o)-。
[0360]
-z1-c(=o)-ch2ch2-nh-c(=o)-(ch2ch2o)4-ch2ch2-c(=o)-va-nh-b-ch2-oc(=o)-。
[0361]
-z2-oc(=o)-ggva-nh-b-ch2-oc(=o)-、-z3-ch2-oc(=o)-ggva-nh-b-ch2-oc(=o)-。
[0362]
在此,z1表示上述lb的下述所示的结构式。
[0363][0364]
z2表示上述lb的下述所示的结构式。
[0365][0366]
z3表示上述lb的下述所示的结构式。
[0367][0368]
b为1,4-苯基。
[0369]
l最优选为下述中的任一者。
[0370]
-z1-c(=o)-ch2ch2-c(=o)-ggva-nh-b-ch2-oc(=o)
‑
。
[0371]
-z1-c(=o)-ch2ch2-c(=o)-va-nh-b-ch2-oc(=o)
‑
。
[0372]
-z1-c(=o)-(ch2ch2)2-c(=o)-va-nh-b-ch2-oc(=o)-。
[0373]
-z1-c(=o)-ch2ch2-c(=o)-ggvcit-nh-b-ch2-oc(=o)-、-z1-c(=o)-ch2ch2-c(=o)-nh-(ch2ch2)2-c(=o)-va-nh-b-ch2-oc(=o)-。
[0374]
-z1-c(=o)-ch2ch2-c(=o)-nh-(ch2ch2o)2-ch2-c(=o)-va-nh-b-ch2-oc(=o)-。
[0375]
-z1-c(=o)-ch2ch2-nh-c(=o)-(ch2ch2o)4-ch2ch2-c(=o)-va-nh-b-ch2-oc(=o)-。
[0376]
在此,b为1,4-苯基。
[0377]
z1为上述lb的下述所示的结构式。
[0378][0379]
<游离药物>
[0380]
本发明的抗体-药物偶联物的游离药物为选自下述的组中的一者。
[0381][0382]
本发明的游离药物在本发明的抗体-药物偶联物转移至肿瘤细胞内之后,抗体-药物偶联物中的连接子l部分被切断而生成。该游离药物确认了抗肿瘤细胞效果。
[0383]
<抗体>
[0384]
在本发明中,“癌”和“肿瘤”用于相同含义。
[0385]
在本发明中,“基因”是指包含编码蛋白质的氨基酸的核苷酸序列的核苷酸或核苷酸序列、或其互补链,例如,作为包含编码蛋白质的氨基酸的核苷酸序列的核苷酸序列或其互补链的多核苷酸、寡核苷酸、dna、mrna、cdna、rna等包含于“基因”的含义。作为“her2基因”,可举出例如包含编码her2蛋白质的氨基酸序列的核苷酸序列的dna、mrna、cdna、crna等。
[0386]
在本发明中,“核苷酸”、“多核苷酸”或“核苷酸序列”与“核酸”含义相同,例如,dna、rna、探针、寡核苷酸、多核苷酸、引物等也包括在“核苷酸”或“核苷酸序列”的含义中。
[0387]
在本发明中,“多肽”、“肽”、“蛋白质”没有区别地使用。
[0388]
在本发明中,“her2”以与her2蛋白质相同的含义使用。
[0389]
在本发明中,“细胞”中也包括动物个体内的细胞、培养细胞。
[0390]
在本发明中,“细胞毒活性”是指以某种形式,引起细胞病理的变化,并不限于直接的外伤,还包括引起dna的切断、碱基的二聚体的形成、染色体的切断、细胞分裂装置的损伤、各种酶活性的降低等所有细胞的结构、功能上的损伤。
[0391]
在本发明中,“抗原决定基”是指与特定的抗体(例如,抗her2抗体)结合的抗原的部分肽或部分立体结构(例如,her2的部分肽或部分立体结构)。作为上述部分肽(例如,her2的部分肽)的抗原决定基能够通过免疫测定法等本领域技术人员周知的方法来确定。
[0392]
本发明中的“cdr”是指互补性决定区(cdr:complementarity determining region)。已知抗体分子的重链和轻链分别有三处cdr。cdr也称为高变区(hypervariable region),是处于抗体的重链和轻链的可变区内,一级结构的变异性特别高的部位,在重链和轻链的多肽链的一级结构上分别分离于三处。本说明书中,对于抗体的cdr,从重链氨基酸序列的氨基末端侧将重链的cdr表述为cdrh1、cdrh2、cdrh3,从轻链氨基酸序列的氨基末端侧将轻链的cdr表述为cdrl1、cdrl2、cdrl3。这些部位在立体结构上彼此接近,并决定对于结合的抗原的特异性。
[0393]
在本发明中,“在严格的条件下杂交”是指在市售的杂交溶液expresshyb hybridization solution(clontech公司)中,在68℃进行杂交,或在如下条件或与其同等的条件下进行杂交:在使用固定有dna的过滤器在0.7-1.0m的nacl存在下,在68℃进行杂交之后,使用0.1-2倍浓度的ssc溶液(1倍浓度ssc包含150mm nacl、15mm柠檬酸钠),在68℃进行洗涤,由此能够鉴定。
[0394]
在本发明中,“一个~多个”是指1~10个、1~9个、1~8个、1~7个、1~6个、1~5
个、1~4个、1~3个或1~2个。
[0395]
在本发明中,有时将识别her2或结合的抗体标记为“抗her2抗体”。这样的抗体包括嵌合化抗体、人源化抗体、人抗体等。
[0396]
抗体与肿瘤细胞的结合性能够使用流式细胞仪来确认。抗体向肿瘤细胞内的吞入能够使用下述的方式进行确认:(1)使用与治疗抗体结合的二次抗体(荧光标识)并通过荧光显微镜将吞入细胞内的抗体可视化的测定法(cell death and differentiation(2008)15,751-761),(2)使用与治疗抗体结合的二次抗体(荧光标识)测定吞入细胞内的荧光量的测定法(molecular biology of the cell vol.15,5268-5282,december 2004)或(3)使用与治疗抗体结合的免疫毒素,当被吞入细胞内时,毒素被放出从而抑制细胞增殖这样的mab-zap测定法(bio techniques 28:162-165,january 2000)。作为免疫毒素,也能够使用白喉毒素的催化区与蛋白质g的重组复合蛋白质。
[0397]
在本发明中,“高内化能力”是指添加了该抗体和皂草素标记抗小鼠或大鼠igg抗体的靶点抗原表达细胞(例如,her2表达细胞)的生存率(以未添加抗体时的细胞生存率为100%而得的相对率表示)优选为70%以下,更优选为60%以下。
[0398]
以下,对于在本发明中使用的抗her2抗体进行说明。需要说明的是,以下所说明的实施方式表示本发明的代表性的实施方式的一例,由此,并不狭窄地解释本发明的范围。
[0399]
1.her2
[0400]
人her2蛋白由n末端22氨基酸残基形成的信号序列、由630氨基酸残基形成的细胞外结构域、由23氨基酸残基形成的细胞膜贯通结构域、由580氨基酸残基形成的细胞内结构域来构成。
[0401]
人her2的氨基酸序列和dna序列公开于公开数据库中,例如,能够根据m11730(genbank)、np_004439.2(ncbi)等登录号进行参照。
[0402]
2.抗her2抗体
[0403]
本发明的抗her2抗体为能够将肿瘤细胞作为靶点的抗体,即具备能够识别肿瘤细胞的特性、能够与肿瘤细胞结合的特性、以及被吞入肿瘤细胞内而内化的特性等。因此,能够将本发明的抗her2抗体与具有抗肿瘤活性的化合物经由连接子而结合,从而制成抗体-药物偶联物。
[0404]
本发明的抗her2抗体可以具有抗肿瘤活性。
[0405]
本发明的抗her2抗体能够通过使用本领域中通常实施的方法,使作为抗原的多肽对于动物进行免疫,采集并精制生物体内产生的抗体来得到。此外,还能够通过上述公知的方法,使产生针对抗原的抗体的抗体产生细胞与骨髓瘤细胞融合而建立杂交瘤,得到单克隆抗体。
[0406]
作为本发明的抗her2抗体,期望具有下述的特性。
[0407]
(1)一种抗体,其特征在于,具有下述的(a)和(b)的特性。
[0408]
(a)识别或结合her2。
[0409]
本发明的抗体识别her2。换句话说,本发明的抗体与her2结合。本发明的抗体优选与her2结合,更优选与her2特异性结合。
[0410]
在本发明中,“特异性识别”,即“特异性结合”是指不是非特异性吸附的结合。作为判定结合是否为特异性的基准,可举出例如解离常数(dissociation constant:以下,“称
为kd”)。本发明的适当的抗体对于her2的kd值为1
×
10
-5
m以下,5
×
10
-6
m以下,2
×
10
-6
m以下或1
×
10
-6
m以下,更适合为5
×
10
-7
m以下,2
×
10
-7
m以下或1
×
10
-7
m以下。
[0411]
本发明中的抗原与抗体的结合能够通过elisa法、ria法、表面等离子体共振(surface plasmon resonance)(以下,称为“spr”)解析法等进行测定或判定。细胞表面上表达的抗原与抗体的结合能够通过流式细胞术法等来测定。
[0412]
(b)具有通过与her2结合而在her2表达细胞中内化的活性。
[0413]
(2)根据上述(1)所述的抗体,her2为人her2。
[0414]
本发明的抗her2抗体只要为识别或结合her2的抗体,就没有特别限制,优选为由本技术的序列表所示的氨基酸序列特定的抗体。
[0415]
本发明的抗her2单克隆抗体的取得方法通常经由下述那样的工序,但并不限定于此。
[0416]
(使用杂交瘤的方法)
[0417]
(a)用作抗原的生物体高分子的精制、或抗原表达细胞的制备以及该生物体高分子或抗原表达细胞给药至动物。
[0418]
(b)从诱发免疫反应的上述动物,采集包含抗体产生细胞的组织(例如淋巴结)。
[0419]
(c)骨髓瘤细胞(下述的称为“骨髓瘤”)(例如,小鼠骨髓瘤sp2/0-ag14细胞)的制备。
[0420]
(d)抗体产生细胞与骨髓瘤的细胞融合。
[0421]
(e)挑选产生目标抗体的杂交瘤组。
[0422]
(f)分裂成单细胞克隆(克隆化)。
[0423]
(g)在该情况下,培养杂交瘤以大量制造单克隆抗体,或饲养移植有杂交瘤的动物。
[0424]
(h)这样操作而制造的单克隆抗体的生理活性(内化活性)及其结合特异性的研究,或作为标识试剂的特性的测定。
[0425]
作为在此所使用的抗体效价的测定法,可举出例如流式细胞仪或cell-elisa法,但不限制于这些方法。
[0426]
进而,再次实施“抗her2抗体的制造”(a)~(h)的工序,并且即使在另行独立地取得单克隆抗体的情况、通过其它方法另行取得单克隆抗体的情况下,也能够取得具有与通过上述方法得到的抗her2抗体同等的内化活性的抗体。作为这样的抗体的一例,可举出与通过上述方法得到的抗her2抗体结合于同一抗原决定基的抗体。如果新制作的单克隆抗体结合于上述抗her2抗体所结合的部分肽或部分立体结构,则能够判定该单克隆抗体结合于同一抗原决定基。此外,通过确认该单克隆抗体在上述抗her2抗体与her2的结合中存在竞争(即,该单克隆抗体妨碍上述抗her2抗体与her2的结合),即使未确定具体的抗原决定基的序列或结构,也能够判定该单克隆抗体与抗her2抗体结合于同一抗原决定基。在确认到抗原决定基相同的情况下,强烈地期待该单克隆抗体具有与上述抗her2抗体同等的抗原结合能力、生物活性和/或内化活性。
[0427]
本发明的抗体除了上述相对于her2的单克隆抗体以外,还包括以使相对于人的异种抗原性降低等为目的而进行了人工修饰的基因重组型抗体,例如,还包含嵌合抗体、人源化抗体、人抗体等。这些抗体能够使用已知的方法来制造。
[0428]
(1)嵌合抗体
[0429]
作为嵌合抗体,可举出抗体的可变区与恒定区互为异种的抗体,例如将来源于小鼠或大鼠的抗体的可变区与来源于人的恒定区接合而成的嵌合抗体(proc.natl.acad.sci.u.s.a.,81,6851-6855,(1984)等)。
[0430]
(2)人源化抗体
[0431]
作为人源化抗体,可举出仅仅将互补性决定区(cdr;complementarity determining region)掺入至来源于人的抗体的抗体(nature(1986)321,p.522-525等),通过cdr移植法将除了cdr的序列以外一部分骨架的氨基酸残基也移植于人抗体的抗体(wo90/07861),进而,改变了一部分cdr的氨基酸序列的抗体(wo2012/075581、wo2011/084496、us2018/0501692)、使用基因变换突变诱导(gene conversion mutagenesis)策略(strategy)进行了人化的抗体(us5821337)。cdr的氨基酸序列能够通过kabat的定义、chothia的定义、abm的定义、imgt等公知的方法来确定,本发明中的cdr可以通过任一方法来定义。
[0432]
作为本发明的人化抗her2抗体,可举出h01l02抗体、hwtl05抗体或曲妥珠单抗a1(hwtlwt)、曲妥珠单抗a2。作为本发明的抗her2抗体,只要保持h01l02抗体、hwtl05抗体、曲妥珠单抗a1(hwtlwt)或曲妥珠单抗a2的全部六种的cdr序列,并具有her2结合活性,则并不限定于特定的人源化抗体,进一步只要修饰了一个~多个(优选为1~2个,更优选为1个)的cdr的氨基酸序列的人源化抗体变异体识别her2蛋白质或具有该抗体的her2蛋白质结合活性,则并不限定于特定的人源化抗体。
[0433]
作为本发明的抗her2人源化抗体或其功能性片段,可举出例如包含重链和轻链。
[0434]
所述重链具有可变区,所述可变区包含由序列表的序列号1(图4)所示的氨基酸序列或该氨基酸序列的一个~多个(优选为1~2个)的氨基酸被取代而成的氨基酸序列的cdrh1。
[0435]
由序列表的序列号2(图4)所示的氨基酸序列或该氨基酸序列的一个~多个(优选为1~2个)的氨基酸被取代而成的氨基酸序列形成的cdrh2。
[0436]
由序列表的序列号3(图4)所示的氨基酸序列或该氨基酸序列的一个~多个(优选为1~2个)的氨基酸被取代而成的氨基酸序列形成的cdrh3。
[0437]
所述轻链具有可变区,所述可变区包含由序列表的序列号5(图6)所示的氨基酸序列或该氨基酸序列的一个~多个(优选为1~2个)的氨基酸被取代而成的氨基酸序列形成的cdrl1。
[0438]
由序列表的序列号6(图6)的氨基酸号1~3所示的氨基酸序列或该氨基酸序列的一个~多个(优选为1~2个)的氨基酸被取代而成的氨基酸序列形成的cdrl2。
[0439]
由序列表的序列号7(图6)所示的氨基酸序列或该氨基酸序列的一个~多个(优选为1~2个)的氨基酸被取代而成的氨基酸序列形成的cdrl3。
[0440]
本发明的识别her2蛋白质或具有该抗体的her2蛋白质结合活性的抗体或该抗体的功能性片段等。
[0441]
作为上述抗her2人源化抗体或其功能性片段中的cdr的氨基酸取代的例子,优选可举出上述cdlh3或cdrl3的一个~多个(优选为1~2个或1个)的氨基酸取代,可以例示将序列表的序列号3的氨基酸号9号的氨基酸进行了取代的序列表的序列号4(图5)所示的
cdrh3、或将序列表的序列号7的氨基酸号4号的氨基酸进行了取代的序列表的序列号8(图7)所示的cdrl3。
[0442]
作为本发明的包含含有cdrh1、cdrh2、cdrh3的重链和含有cdrl1、cdrl2、cdrl3的轻链的抗体,可以例示包含下述的(a)和(b)的抗体。
[0443]
(a)由序列号1所述的氨基酸序列形成的cdrh1、由序列号2所述的氨基酸序列形成的cdrh2以及由序列号4所述的氨基酸序列形成的cdrh3、以及由序列号5所述的氨基酸序列形成的cdrl1、由序列号6的氨基酸号1~3所述的氨基酸序列形成的cdrl2以及由序列号8所述的氨基酸序列形成的cdrl3(h01l02)。
[0444]
(b)由序列号1所述的氨基酸序列形成的cdrh1、由序列号2所述的氨基酸序列形成的cdrh2以及由序列号3所述的氨基酸序列形成的cdrh3、以及由序列号5所述的氨基酸序列形成的cdrl1、由序列号6的氨基酸号1~3所述的氨基酸序列形成的cdrl2以及由序列号8所述的氨基酸序列形成的cdrl3(hwtl05)。
[0445]
(c)由序列号1所述的氨基酸序列形成的cdrh1、由序列号2所述的氨基酸序列形成的cdrh2以及由序列号3所述的氨基酸序列形成的cdrh3、以及由序列号5所述的氨基酸序列形成的cdrl1、由序列号6的氨基酸号1~3所述的氨基酸序列形成的cdrl2以及由序列号7所述的氨基酸序列形成的cdrl3(曲妥珠单抗a1或a2)。
[0446]
作为具有上述cdrh1~3的人源化抗体的重链可变区,可以例示序列表的序列号13(图9)所示的氨基酸序列和序列表的序列号17(图11)所示的氨基酸序列,作为具有上述cdrl1~3的人源化抗体的轻链可变区,可以例示序列表的序列号21(图13)所示的氨基酸序列、序列表的序列号25(图15)所示的氨基酸序列、以及序列表的序列号29(图17)所示的氨基酸序列。
[0447]
作为上述包含重链可变区和轻链可变区的组合的人源化抗体,可以适当例示下述人源化抗体。
[0448]
由包含由序列表的序列号17(图11)所示的氨基酸序列形成的重链可变区、以及由序列表的序列号25(图15)所示的氨基酸序列形成的轻链可变区形成的人源化抗体(h01l02)。
[0449]
由包含由序列表的序列号13(图9)所示的氨基酸序列形成的重链可变区、以及由序列表的序列号29(图17)所示的氨基酸序列形成的轻链可变区形成的人源化抗体(hwtl05)。
[0450]
由包含由序列表的序列号13(图9)所示的氨基酸序列形成的重链可变区、以及由序列表的序列号21(图13)所示的氨基酸序列形成的轻链可变区形成的人源化抗体(曲妥珠单抗a1(hwtlwt)、曲妥珠单抗a2)。
[0451]
所示的由包含由氨基酸序列形成的轻链可变区形成的人源化抗体。
[0452]
作为由包含含有上述重链可变区的重链和含有轻链可变区的轻链的组合形成的人源化抗体,可以例示下述人源化抗体。
[0453]
由包含由序列表的序列号15(图10)的氨基酸号20~469所示的氨基酸序列形成的重链、以及由序列表的序列号23(图14)的氨基酸号21~234所示的氨基酸序列形成的轻链形成的人源化抗体(h01l02)。
[0454]
由包含由序列表的序列号11(图8)的氨基酸号20~469所示的氨基酸序列形成的
重链、以及由序列表的序列号27(图16)的氨基酸号21~234所示的氨基酸序列形成的轻链形成的人源化抗体(hwtl05)。
[0455]
由包含由序列表的序列号11(图8)的氨基酸号20~469所示的氨基酸序列形成的重链、以及由序列表的序列号19(图12)的氨基酸号21~234所示的氨基酸序列形成的轻链形成的人源化抗体(曲妥珠单抗a1(hwtlwt))。
[0456]
由包含由序列表的序列号31(图21)的氨基酸号20~469所示的氨基酸序列形成的重链、以及由序列表的序列号32(图22)的氨基酸号21~234所示的氨基酸序列形成的轻链形成的人源化抗体(曲妥珠单抗a2)。
[0457]
上述人源化抗体h01l02、hwtl05、曲妥珠单抗a1、曲妥珠单抗a2的重链的羧基末端如后述那样,可以缺失一个或两个氨基酸,该缺失体也包含于本发明中。
[0458]
作为缺失体的重链,可举出包含序列表的序列号11、15、31的氨基酸号第20~468号所述的氨基酸序列的重链。
[0459]
作为该缺失体,可以例示下述抗体。
[0460]
由包含由序列表的序列号15(图10)的氨基酸号20~468所示的氨基酸序列形成的重链、以及由序列表的序列号23(图14)的氨基酸号21~234所示的氨基酸序列形成的轻链形成的人源化抗体(h01l02)。
[0461]
由包含由序列表的序列号11(图8)的氨基酸号20~468所示的氨基酸序列形成的重链、以及由序列表的序列号27(图16)的氨基酸号21~234所示的氨基酸序列形成的轻链形成的人源化抗体(hwtl05)。
[0462]
由包含由序列表的序列号11(图8)的氨基酸号20~468所示的氨基酸序列形成的重链、以及由序列表的序列号19(图12)的氨基酸号21~234所示的氨基酸序列形成的轻链形成的人源化抗体(曲妥珠单抗a1(hwtlwt))。
[0463]
由包含由序列表的序列号31(图21)的氨基酸号20~468所示的氨基酸序列形成的重链、以及由序列表的序列号32(图22)的氨基酸号21~234所示的氨基酸序列形成的轻链形成的人源化抗体(曲妥珠单抗a2)。
[0464]
需要说明的是,在序列表的序列号11(图8)、15(图10)或31(图21)所示的重链氨基酸序列中,由第1~19号的氨基酸残基形成的氨基酸序列为信号序列,由第20~139号的氨基酸残基形成的氨基酸序列为重链可变区,由第140~469号的氨基酸残基形成的氨基酸序列为重链恒定区。
[0465]
此外,在序列表的序列号19(图12)、23(图14)、27(图16)或32(图22)所示的轻链氨基酸序列中,由第1~20号的氨基酸残基形成的氨基酸序列为信号序列,由第21~127号的氨基酸残基形成的氨基酸序列为轻链可变区,由第128~234号的氨基酸残基形成的氨基酸序列为轻链恒定区。
[0466]
编码上述人源化抗体h01l02的重链氨基酸序列的碱基序列为序列号16,编码轻链氨基酸序列的碱基序列为序列号24。
[0467]
编码人源化抗体hwtl05的重链氨基酸序列的碱基序列为序列号12,编码轻链氨基酸序列的碱基序列为序列号28。
[0468]
编码人源化抗体曲妥珠单抗a1的重链氨基酸序列的碱基序列为序列号12,编码轻链氨基酸序列的碱基序列为序列号20所示的多核苷酸。
academicpublishers,1999,proc.natl.acad.sci.usa(2000)97,p.722-727,investigative ophthalmology&visual science.(2002)43(7),p.2301-2308,briefings in functional genomics and proteomics(2002),1(2),p.189-203,ophthalmology(2002)109(3),p.427-431,nature biotechnology(2005),23,(9),p.1105-1116,wo92/01047,wo92/20791,wo93/06213,wo93/11236,wo93/19172,wo95/01438,wo95/15388,annu.rev.immunol(1994)12,p.433-455等)。
[0481]
通过以上方法得到的嵌合抗体、人源化抗体或人抗体等能够通过公知的方法等来评价对于抗原的结合性,筛选适当的抗体。
[0482]
作为比较抗体的性质时的其它指标的一例,可举出抗体的稳定性。差示扫描量热计(dsc)是一种能够快速且准确地测定蛋白的相对结构稳定性良好的指标即热变性中点(tm)的装置。通过使用dsc来测定tm值,并比较该值,从而能够比较热稳定性的差异。已知抗体的保存稳定性与抗体的热稳定性显示出一定程度的相关(pharmaceutical development and technology(2007)12,p.265-273),以热稳定性为指标,能够筛选适当的抗体。作为用于筛选抗体的其它指标,可举出适当的宿主细胞中产量高、以及在水溶液中的凝集性低的指标。例如产量最高的抗体不一定显示最高的热稳定性,因此需要基于以上所述的指标进行综合地判断,筛选对于人给药时最适合的抗体。
[0483]
本发明的抗体也包括与本发明提供的抗her2抗体在“相同的部位结合的抗体”。即,本发明的曲妥珠单抗a1(hwtlwt)、曲妥珠单抗a2、h10l02抗体或h02l05抗体所识别的her2蛋白质上的部位结合的抗体也包含于本发明中。
[0484]
本发明的抗体也包括抗体的修饰体。该修饰体是指对于本发明的抗体实施了化学或生物学的修饰而得的产物。化学的修饰体包括化学部分对于氨基酸骨架的结合、n-连接或o-连接碳水化合物链的化学修饰体等。生物学的修饰体包括翻译后修饰(例如,n-连接或o-连接糖基化、n末或c末端的加工、脱酰胺化、天冬氨酸的异构化、蛋氨酸的氧化)的产物、通过使用原核生物宿主细胞来表达,在n末端添加了蛋氨酸残基的修饰体等。此外,能够用于检测或离析本发明的抗体或抗原的而标识的标识物,例如,酶标识体、荧光标识体、亲和标识体也包含在这样的修饰体的含义中。这样的本发明的抗体的修饰体对于抗体的稳定性和血中滞留性的改善、抗原性的减少、抗体或抗原的检测或离析等是有用的。
[0485]
此外,通过调节与本发明的抗体结合的糖链修饰(糖基化、脱岩藻糖化等),从而能够增强抗体依赖性细胞毒活性。作为抗体的糖链修饰的调节技术,已知wo1999/54342、wo2000/61739、wo2002/31140、wo2007/133855、wo2013/120066等,但不限定于此。本发明的抗体中包括调节了该糖链修饰的抗体。
[0486]
这样的修饰可以在抗体或其功能性片段中的任意的位置、或所希望的位置来实施,也可以在一个或两个以上的位置进行相同或两种以上不同的修饰。
[0487]
在本发明中“抗体片段的修饰体”也包括“抗体的修饰体的片段”。
[0488]
暂时离析抗体基因之后,在导入至适当的宿主中以制作抗体的情况下,能够使用适当的宿主与表达载体的组合。作为抗体基因的具体例,可举出编码本说明书中记载的抗体的重链序列等的基因、与编码轻链序列等的基因的组合。在将宿主细胞转化时,重链序列基因等与轻链序列基因等能够插入同一表达载体,或者也能够插入不同的表达载体。
[0489]
在将真核细胞用作宿主的情况下,能够使用动物细胞、植物细胞、真核微生物。特
别是作为动物细胞,可举出哺乳类细胞,例如,作为猴的细胞的cos细胞(cell(1981)23,p.175-182,atcc crl-1650)、小鼠成纤维细胞nih3t3(atcc no.crl-1658)、中国仓鼠卵巢细胞(cho细胞,atcc ccl-61)的二氢叶酸还原酶缺陷株(proc.natl.acad.sci.u.s.a.(1980)77,p.4126-4220),freestyle 293f细胞(invitrogen公司)。
[0490]
在使用原核细胞的情况下,可举出例如大肠杆菌、枯草菌。
[0491]
通过将目标的抗体基因通过转化导入至这些细胞中,并在体外培养转化后的细胞以得到抗体。在该培养中,有时根据抗体的序列而产量不同,能够从具有同等的结合活性的抗体中,以产量为指标选择容易作为药物生产的抗体。因此,本发明的抗体也包括通过下述抗体的制造方法而得的抗体,所述制造方法的特征在于包括:培养上述转化的宿主细胞的工序;以及从由该工序得到的培养物中采集目标抗体或该抗体的功能性片段的工序。
[0492]
上述抗体基因优选为包含下述的(a)~(e)中任一项所述的多核苷酸的多核苷酸。
[0493]
(a)编码h1l02抗体、hwtl05抗体、曲妥珠单抗a1(hwtlwt)、曲妥珠单抗a2中的任一者的抗体的重链氨基酸序列的多核苷酸与编码轻链氨基酸序列的多核苷酸的组合。
[0494]
(b)编码包含h1l02抗体、hwtl05抗体、曲妥珠单抗a1(hwtlwt)、曲妥珠单抗a2中的任一者的抗体的cdrh1~cdrh3的重链氨基酸序列的多核苷酸与编码包含cdrl1~cdrl3的轻链氨基酸序列的多核苷酸的组合。
[0495]
(c)编码包含h1l02抗体、hwtl05抗体、曲妥珠单抗a1(hwtlwt)、曲妥珠单抗a2中的任一者的抗体的重链可变区的氨基酸序列的重链氨基酸序列的多核苷酸与编码包含轻链可变区的氨基酸序列的轻链氨基酸序列的多核苷酸的组合。
[0496]
(d)与由与(a)~(c)中任一项所述的多核苷酸互补的多核苷酸形成的核苷酸在严格的条件下杂交,且编码与her2结合的抗体的氨基酸序列的多核苷酸。
[0497]
(e)编码(a)~(c)中任一项所述的多核苷酸中1~50个、1~45个、1~40个、1~35个、1~30个、1~25个、1~20个、1~15个、1~10个、1~8个、1~6个、1~5个、1~4个、1~3个、1或2个、或1个氨基酸被取代、缺失、添加或插入形成的多肽的氨基酸序列,且编码与her2结合的抗体的氨基酸序列的多核苷酸。
[0498]
本发明包括编码本发明的抗体或其功能性片段或其修饰体的核苷酸、插入该基因的重组载体、以及导入该基因或该载体的细胞。
[0499]
此外,本发明也包括抗体或其功能性片段或其修饰体的制造方法,所述制造方法包括:培养上述细胞的工序;以及从其培养物中回收抗体或其功能性片段或其修饰体的工序。
[0500]
需要说明的是,已知在哺乳类培养细胞中产生的抗体的重链的羧基末端的赖氨酸残基缺失(journal of chromatography a,705:129-134(1995)),此外,已知在相同的重链羧基末端的甘氨酸、赖氨酸这两个氨基酸残基缺失,新位于羧基末端的脯氨酸残基被酰胺化(analytical biochemistry,360:75-83(2007))。然而,这些重链序列的缺失和修饰对于抗体的抗原结合能力和效应功能(补体的活化、抗体依赖性细胞毒作用等)不产生影响。因此,本发明涉及的抗体还包括受到该修饰的抗体和该抗体的功能性片段,在重链羧基末端有一个或两个氨基酸缺失的缺失体、以及被酰胺化的该缺失体(例如,羧基末端部位的脯氨酸残基被酰胺化的重链)等。其中,只要保持抗原结合能力和效应功能,本发明涉及的抗体的重链的羧基末端的缺失体并不受上述种类的限定。构成本发明涉及的抗体的两条重
链可以为选自全长和上述缺失体中的重链的任一种,或者可以为任意两种的组合。各缺失体的量比可能受到产生本发明涉及的抗体的哺乳类培养细胞的种类和培养条件的影响,但是作为本发明涉及的抗体的主成分,可举出两条重链两者中羧基末端的一个氨基酸残基缺失的情况。
[0501]
作为本发明的抗her2抗体的同种型(isotype),可举出例如igg(igg1、igg2、igg3、igg4)等,优选可举出igg1、igg2或igg4。
[0502]
在使用igg1作为本发明的抗体的同种型的情况下,能够通过取代恒定区的氨基酸残基的一部分,从而调整效应功能。作为减少或减弱效应功能的igg1的变异体,可举出igg1 lala(igg1-l234a、l235a)、igg1 laga(igg1-l235a、g237a)等,优选为igg1 lala。需要说明的是,上述l234a、l235a表示由eu index(proc.natl.acad.sci.u.s.a.,vol.63,no.1(may 15,1969),p.78-85)确定的234位、235位的亮氨酸被丙氨酸取代,g237a表述由eu index确定的237位的甘氨酸被丙氨酸取代。
[0503]
作为抗体的生物活性,一般可举出抗原结合活性、与抗原结合从而在表达该抗原的细胞中内化的活性、中和抗原的活性的活性、增强抗原的活性的活性是本发明涉及的抗体所具有的功能相对于her2的结合活性,优选为通过与her2结合从而在her2表达细胞中内化的活性。
[0504]
所得的抗体能够精制直至均匀。抗体的分离、精制使用通常的蛋白质中使用的分离、精制方法即可。如果适当选择、组合例如柱色谱法、过滤器过滤、超滤、盐析、渗析、制备用聚丙烯酰胺凝胶电泳、等电点电泳等,则能够分离、精制抗体(strategies for protein purification and characterization:a laboratory course manual,daniel r.marshak et al.eds.,cold spring harbor laboratory press(1996);antibodies:a laboratory manual.ed harlow and david lane,cold spring harbor laboratory(1988)),但并不限定于此。
[0505]
作为色谱法,可举出亲和色谱法、离子交换色谱法、疏水性色谱法、凝胶过滤色谱法、反相色谱法、吸附色谱法等。
[0506]
这些色谱法能够使用hplc、fplc等液体色谱法来进行。
[0507]
作为亲和色谱法所使用的柱,可举出蛋白质a柱、蛋白质g柱。
[0508]
此外,也能够使用已固定化的抗原的载体,利用与抗原的结合性来精制抗体。
[0509]
<n297糖链>
[0510]
近年来,报告了通过酶反应等重构不均匀的抗体的糖蛋白,并均匀地导入具有官能团的糖链的方法(acs chemical biology 2012,7,110,acs medicinal chemistry letters 2016,7,1005,bioconjugate chemistry 2015,26,2233,angew.chem.int.ed.2016,55,2361-2367,us2016361436)。
[0511]
本发明的糖链的重构首先利用水解酶,切除添加到蛋白质(抗体等)中的不均匀的糖链而仅仅残留末端的glcnac,制备添加了glcnac的均匀的蛋白质部分(以下,称为“受体”)。接下来,准备另行制备的任意的糖链(以下,称为“供体”),使用糖基转移酶连接该受体和供体。由此,能够合成具有任意糖链结构的均匀的糖蛋白质。
[0512]
在本发明中,“糖链”是指两个以上的单糖通过糖苷键而结合的结构单元。具体的单糖、糖链有时如例如”glcnac-”、”msg-”那样,以缩写的方式进行标记。结构式中利用这
些缩写记载的情况下,除非具有特别的定义的情况,否者还原末端上归属于与其它结构单元的糖苷键的氧原子或氮原子并不包含在表示该糖链的缩写中。
[0513]
在本发明中,除非另行规定的情况,为了方便,对于作为糖链的基本单元的单糖的记载中,将其环结构中,与构成环的氧原子结合,且与羟基(或归属于糖苷键的氧原子)直接结合的碳原子标记为1位(仅唾液酸中为2位)。实施例化合物的名称以化学结构整体来标记,并不一定适用该规则。
[0514]
在本发明中,以符号(例如,gly、sg、msg、glcnac等)来表示糖链的情况下,除非另行定义的情况,否则连还原末端的碳都包含在该符号中,但归属于n-或o-糖苷键的n或o不包含在该符号中。
[0515]
在本发明中,只要没有特别的记载,氨基酸的侧链中与糖链连接的情况下的部分结构用括号表示侧链部分,例如,“(sg-)asn”这样的表述。
[0516]
本发明的抗体―药物偶联物由下述的式表示。
[0517][0518]
抗体ab或其功能性片段从n297糖链或被重构的n297糖链与l结合,优选从ab的被重构的n297糖链与l结合。
[0519]
本发明中的ab的糖链为n连接型糖链、o连接型糖链,优选为n连接型糖链。
[0520]
n连接型糖链通过n糖苷键与抗体的氨基酸侧链结合,o连接型糖链通过o糖苷键与抗体的氨基酸侧链结合。
[0521]
已知igg在其重链的fc区中的第297号的天冬酰胺残基(以下,称为“asn297或n297”)中具有高度保守的n连接型糖链,有助于抗体分子的活性、动态等(biotechnol.prog.,2012,28,608-622,anal.chem.,2013,85,715-736)。
[0522]
igg的恒定区中的氨基酸序列被高度保守,在edelman et al.,(proc.natl.acad.sci.u.s.a.,vol.63,no.1(may 15,1969),p.78-85)中,各个氨基酸被eu编号(eu index)确定。例如,fc区中n连接型糖链加成的asn297相当于eu编号中的297位,即使由于分子的片段化、区域缺损而实际的氨基酸位置发生变动的情况下,也通过eu编号表示而唯一地确定氨基酸。
[0523]
本发明的抗体-药物偶联物中,更优选抗体或其功能性片段从与其asn297的侧链结合的糖链(以下,称为“n297糖链”)与l结合,进一步优选抗体或其功能性片段从上述n297糖链与l结合,该n297糖链为被重构的n297糖链。
[0524]
sgp为唾液酸糖肽(sialyl glycopeptide)的简称,是n连接型复合糖链的代表性例子。能够从鸡蛋的蛋黄中根据例如,wo2011/0278681所述的方法离析、精制sgp。此外,sgp的精制品能够由(东京化成(株)、(株)伏见制药所)市售,购入。仅由在sg的糖链部分中缺失了一个还原末端的glcnac的糖链(以下,“sg(10)”)构成的二唾液酸八糖(东京化成(株))等也被市售。
[0525]
在本发明中,将仅sg(10)的β-man支链中的任一方缺失了非还原末端的唾液酸的糖链结构称为msg(9),将仅在支链的1-3糖链具有唾液酸的糖链称为msg1,将仅在支链的1-6糖链具有唾液酸的糖链称为msg2。
[0526]
本发明的被重构的糖链为n297-(fuc)msg1、n297-(fuc)msg2或n297-(fuc)msg1与n297-(fuc)msg2的混合物、或n297-(fuc)sg,优选为n297-(fuc)msg1、n297-(fuc)msg2或n297-(fuc)sg,更优选为n297-(fuc)msg1或n297-(fuc)msg2。
[0527]
n297-(fuc)msg1由下述的结构式或序列式表示。
[0528][0529][0530]
上述式中,波浪线表示与抗体的asn297结合。
[0531]
l(peg)表示-nh-ch2ch2-(o-ch2ch2)n5-*,左端的氨基与n297糖链的β-man支链的1-3链侧的非还原末端的唾液酸的2位羧酸经由酰胺键而键合,右端的星号(*)表示与上述连接子l中的lb的1,2,3-三唑环上的1位或3位的氮原子结合。
[0532]
在此,n5为2~10的整数,优选为2~5的整数。
[0533]
n297-(fuc)msg2由下述的结构式或序列式表示。
[0534][0535]
上述式中,波浪线表示与抗体的asn297结合。
[0536]
l(peg)表示-nh-ch2ch2-(o-ch2ch2)n5-*,左端的氨基与n297糖链的β-man支链的1-6链侧的非还原末端的唾液酸的2位羧酸经由酰胺键而键合,右端的星号(*)表示与上述连接子l中的lb的1,2,3-三唑环上的1位或3位的氮原子结合。
[0537]
在此,n5为2~10的整数,优选为2~5的整数。
[0538]
n297-(fuc)sg由下述的结构式或序列式表示。
[0539][0540]
上述式中,波浪线表示与抗体的asn297结合。
[0541]
l(peg)表示-nh-ch2ch2-(o-ch2ch2)n5-*,左端的氨基与n297糖链的β-man支链的1-3链侧和1-6链侧的双方的非还原末端的唾液酸的2位羧酸经由酰胺键而键合,右端的星号(*)表示与上述连接子l中的lb的1,2,3-三唑环上的1位或3位的氮原子结合。
[0542]
在此,n5为2~10的整数,优选为2~5的整数。
[0543]
在本发明的抗体-药物偶联物中的抗体的n297糖链为n297-(fuc)msg1或n297-(fuc)msg2或它们的混合物的情况下,抗体为二聚体,因此抗体―药物偶联物成为结合有两个药物连接子(-l-d)的分子(上述m1=1)(参照图1)。
[0544]
例如,实施例9:adc1是n297糖链为n297-(fuc)msg1的情况。
[0545]
在本发明的抗体-药物偶联物中的抗体的n297糖链为n297-(fuc)sg的情况下,抗体为二聚体,因此抗体-药物偶联物成为结合有四个药物连接子(-l-d)的分子(上述m1=2)。
[0546]
n297糖链优选为n297-(fuc)msg1或n297-(fuc)msg2或n297-(fuc)sg,更优选为n297-(fuc)msg1或n297-(fuc)msg2,最优选为n297-(fuc)msg1。
[0547]
在n297糖链为n297-(fuc)msg1或n297-(fuc)msg2或n297-(fuc)sg的情况下,能够取得均匀的品质的adc。
[0548]
本发明提供包括下述的i)~iii)的工序的糖链重构抗体或该抗体的功能性片段的制造方法。
[0549]
i)培养上述宿主细胞(例如,动物细胞(cho细胞等)),从所得的培养物采集目标抗体的工序。
[0550]
ii)利用水解酶处理由工序i)得到的抗体,制造n297糖链为(fucα1,6)glcnac的抗体((fucα1,6)glcnac-抗体)的工序(图3的a)。
[0551]
优选还包括:通过包括对于该反应液,通过利用羟基磷灰石柱的精制工序,将(fucα1,6)glcnac-抗体进行精制的工序。
[0552]
iii)在糖基转移酶存在下,使(fucα1,6)glcnac-抗体与糖链供体分子进行反应,合成在唾液酸中导入有叠氮基的糖链重构抗体的工序,所述糖链供体分子是在msg(9)或sg(10)的唾液酸的2位羧酸的羰基导入具有叠氮基的peg连接子-(n3-l(peg)),且使还原末端恶唑啉化而得到的(图3的b)。
[0553]
此外,通过这样的制造方法得到的糖链重构抗体或其功能性片段、或它们的修饰体也包含于本发明中。
[0554]
上述本抗体―药物偶联物的制造中间体具有dbco(二苯基环辛炔)等与叠氮基反应的炔烃结构(参照实施例2-3)。因此,通过使该制造中间体与在上述i)~iii)的工序中得到的糖链的唾液酸中导入有具有叠氮基的peg连接子的msg1型、msg2型或sg型糖链重构抗体或该抗体的功能性片段进行反应,从而能够制造本发明的抗体―药物偶联物。
[0555]
在本发明的n297糖链中,还原末端的添加有岩藻糖的glcnac-(fucα1,6)glcnac)来源于动物细胞所产生的抗体,由此,非还原末端侧的糖链优选为重构成与上述msg(msg1、msg2)或sg同样的糖链结构。在任一情况下,均利用与该非还原末端的唾液酸2位结合的羧酸,与l(peg)结合。
[0556]
这样的具有msg(msg1、msg2)或sg型n297糖链的糖链重构抗体能够按照例如wo2013/120066等所述的方法,利用图3所示那样的方法进行制造。按照公知的方法使用动物细胞作为宿主,以基因重组蛋白质的方式产生抗体的情况下(上述工序i),虽然n297糖链具有添加岩藻糖的n连接型糖链结构作为基本结构,但是得到的是具有在非还原末端的结构、构成糖被进行了多种修饰后的各种结构所形成的糖链的抗体或其片段的混合物(图3的a的iv)。这样,动物细胞所产生的抗体通过利用endos等水解酶进行处理,从而还原末端的壳二糖结构的glcnacβ1-4glcnac之间的糖苷键被水解,得到具有仅具有(fucα1,6)glcnac作为n297糖链的单一的糖链结构的抗体分子(称为“(fucα1,6)glcnac-抗体”,参照图2的a)(图3的a)(上述工序ii))。
[0557]
作为n297糖链的水解反应所使用的酶,能够使用endo s或保持其水解活性的变异酶等。
[0558]
将通过上述水解反应得到的(fucα1,6)glcnac-抗体作为糖链受体分子,使用endos d233q或endos d233q/q303l变异体那样的糖基转移酶(wo2017010559等),使其与msg(msg1、msg2)或sg型糖链供体分子进行反应,从而能够得到具有由上述结构形成的msg(msg1、msg2)或sg型n297糖链的抗体(参照图2的b)(图3的b)(上述工序iii)-1、iii)-2)。
[0559]
抗体-药物偶联物中的每一分子抗体的药物结合数m1为1的情况下,采用具有msg(msg1、msg2)作为糖链的糖链供体分子。这样的糖链还能够采用以市售的monosialo-asn free(1s2g/1g2s-10nc-asn,(株)糖链工学研究所,以下,称为“(msg-)asn”)作为原料,根据实施例3所述的方法分离为(msg-)asn1或(msg2-)asn后使用,也能够不进行分离而作为混合物使用。
[0560]
抗体-药物偶联物中的每一分子抗体的药物结合数m1为2的情况下,在该糖转移反应中使用具有sg(10)作为糖链的糖链供体分子。这样的sg(10)糖链可以使用例如由sgp通过水解等而取得的糖链,也可以使用市售的二唾液酸八糖(东京化成工业(株))那样的sg
(10)糖链。
[0561]
供体分子所包含的msg(msg1、msg2)或sg型糖链在其唾液酸的2位具有包含叠氮基的peg连接子(n3-l(peg))。
[0562]
供体分子所包含的msg(msg1、msg2)或sg型糖链的还原末端的glcnac优选通过例如用2-氯-1,3-二甲基-1h-苯并咪唑-3-鎓盐酸盐处理而恶唑啉化那样的形式活化后的物质(j.org.chem.,2009,74(5),2210-2212.)。
[0563]
作为糖转移反应所使用的酶(糖基转移酶),只要具有使复合型糖链转移成n297糖链的活性,就能够采用各种各样的酶,优选将endos的第233号的asp取代为gln,从而抑制了水解反应的变体即endos d233q。对于使用了endos d233q的糖转移反应,记载于wo2013/120066等。此外,也可以利用对于endos d233q,进一步施加变异后的endos d233q/q303l那样的变体酶(wo2017010559)。
[0564]
抗体的糖链重构(糖水解和糖链转移反应)后的抗体的精制操作的目的在于,与反应中使用的低分子化合物和酶的分离,这样的精制通常使用凝胶过滤色谱法、离子交换色谱法、亲和色谱法等,也可以进一步使用羟基磷灰石柱进行追加精制。即,本发明提供一种抗体-药物偶联物的制造方法,在从抗体的糖水解后的反应液的中间体的精制工序中,还包括利用羟基磷灰石柱的精制工序。根据糖链重构报告例(jacs.2012,134,12308-12318.,angew.chem.int.ed.2016,55,2361-2367),将利用水解酶处理抗体后的反应液仅利用蛋白质a柱(亲和色谱法柱)进行精制,但是表明在该精制方法中,不能完全除去水解酶(endos等),由于残留酶的影响,对于下一个糖转移反应带来影响。在此,研究精制法的结果是将利用水解酶处理抗体后的反应液按照蛋白质a柱、羟基磷灰石柱(cht柱,bio-rad laboratories,inc.)的顺序进行精制,由此残留酶的影响消失,提高下一次糖链转移反应的反应效率。
[0565]
本发明的抗体-药物偶联物最优选为选自下述组中的一种抗体-药物偶联物。
[0566]
[0567]
[0568]
[0569][0570]
在以上所示的各个结构式中,m1表示1或2的整数(优选m1为1的整数)。
[0571]
抗体ab为上述抗her2抗体或其功能性片段。
[0572]
n297糖链表示n297-(fuc)msg1、n297-(fuc)msg2或它们的混合物或n297-(fuc)sg(优选为n297-(fuc)msg1)中的任一者。
[0573]
l(peg)表示-nh-ch2ch2-(o-ch2ch2)3-*,左端的氨基与n297糖链的β-man支链的1-3链侧或/和1-6链侧(优选为1-3链侧)的非还原末端的唾液酸的2位羧酸经由酰胺键而键合,右端的星号(*)表示与上述连接子l中的lb的三唑环上的1位或3位的氮原子结
合。
[0574]
为了方便,作为上述最优选的抗体-药物偶联物,记载有在一分子偶联物中具有两个或四个(m1=1或2)“n297糖链与l中的lb的三唑环上的1位氮原子结合的“-(n297糖链)-l-d”(“(n297糖链)-(n1lb)l-d”),或者具有两个或四个(m1=1或2)“n297糖链与l中的lb的三唑环上的3位的氮原子结合的“-(n297糖链)-l-d”(“(n297糖链)-(n3lb)l-d”)”的结构,但是,也包括在一分子偶联物中具有“(n297糖链)-(n1lb)l-d”(m1=1的情况下为一个,m1=2的情况下为1、2、3个)和“(n297糖链)-(n3lb)l-d”(m1=1的情况下为一个,m1=2的情况下为3、2、一个)这两者的抗体-药物偶联物。即,一分子偶联物中仅存在“(n297糖链)-(n1lb)l-d”或“(n297糖链)-(n3lb)l-d”中的任一者,或这两者混合存在。
[0575]
本发明的抗her2抗体或抗her2抗体-药物偶联物显示强的肿瘤活性(体内抗肿瘤活性、体外抗细胞活性)、良好的体内动态和物性,并且安全性高,因此作为医药品是有用的。
[0576]
在本发明的抗体-药物偶联物中,与一分子抗体的药物的结合数是影响其有效性、安全性的重要因素。抗体-药物偶联物的制造是通过规定反应的原料/试剂的使用量等反应条件以使药物的结合数成为一定数的方式来实施,但是与低分子化合物的化学反应不同,通常得到的是不同数目的药物结合而成的混合物。对于一分子抗体的药物的结合数能够以平均值,即,平均药物结合数(dar:drug to antibody ratio)的方式来特定。吡咯并苯并二氮杂卓衍生物对于抗体分子的结合数能够控制,作为每一个抗体的平均药物结合数(dar),能够结合1~10个的范围的吡咯并苯并二氮杂卓衍生物,优选为1~8个,更优选为1~5个。
[0577]
在本发明的抗体-药物偶联物中,抗体从抗体的被重构的糖链与l结合的情况下,抗体―药物偶联物中的每一分子抗体的药物结合数m2为1或2的整数。该糖链为n297糖链,糖链为n297-(fuc)msg1、n297-(fuc)msg2或n297-(fuc)msg1与n297-(fuc)msg2的混合物的情况下,m2为1,dar为1~3的范围(优选为1.0~2.5的范围,更优选为1.2~2.2或1.6~2.2的范围)。在n297糖链为n297-(fuc)sg的情况下,m2为2,dar为3~5的范围(优选为3.2~4.8的范围,更优选为3.5~4.2的范围)。
[0578]
需要说明的是,如果为本领域技术人员,则能够根据本技术的实施例的记载来设计抗体与需要的数目的药物结合的反应,能够取得控制了吡咯并苯并二氮杂卓衍生物的结合数的抗体。
[0579]
需要说明的是,本发明的抗体-药物偶联物、游离药物或制造中间体放置于大气中,或发生再结晶,从而有时吸收水分,附着有吸附水,或形成水合物,包含这样的含水的化合物和盐也包含于本发明中。
[0580]
本发明的抗体-药物偶联物、游离药物或制造中间体在具有氨基等碱性基团的情况下,能够根据需要制成医药上可接受的盐。作为这样的盐,可举出例如盐酸盐、氢碘酸盐等氢卤酸盐;硝酸盐、高氯酸盐、硫酸盐、磷酸盐等无机酸盐;甲磺酸盐、三氟甲磺酸盐、乙磺酸盐等低级链烷磺酸盐;苯磺酸盐、对甲苯磺酸盐等芳基磺酸盐;甲酸、乙酸、苹果酸、富马酸盐、琥珀酸盐、柠檬酸盐、酒石酸盐、草酸盐、马来酸盐等有机酸盐;以及,鸟氨酸盐、谷氨酸盐、天冬氨酸盐等氨基酸盐。
[0581]
在本发明的抗体-药物偶联物、游离药物或制造中间体具有羧基等酸性基团的情况下,一般而言能够形成碱加成盐。作为医药上可接受的盐,可举出例如钠盐、钾盐、锂盐等碱金属盐;钙盐、镁盐等碱土金属盐;铵盐等无机盐;二苄基胺盐、吗啉盐、苯基甘氨酸烷基酯盐、乙二胺盐、n-甲基葡萄糖胺盐、二乙胺盐、三乙胺盐、环己胺盐、二环己胺盐、n,n’-二苄基乙二胺盐、二乙醇胺盐、n-苄基-n-(2-苯基乙氧基)胺盐、哌嗪盐、四甲基铵盐、三(羟甲基)氨基甲烷盐等有机胺盐等。
[0582]
本发明的抗体-药物偶联物、游离药物或制造中间体也通过吸收空气中的水分等以水合物的方式存在。作为本发明的溶剂合物,只要是药学上能够容许的,就没有特别限定,具体而言,优选为水合物、乙醇合物、2-丙醇合物等。此外,在本发明的抗体-药物偶联物、游离药物或制造中间体中存在氮原子的情况下,可以形成n-氧化物,这些溶剂合物和n-氧化物也包含在本发明的范围中。
[0583]
此外,本发明也包括被各种放射性或非放射性同位素标记的化合物。构成本发明的抗体-药物偶联物、游离药物或制造中间体的一个以上原子也可以包含非天然比例的原子同位素。作为原子同位素,可举出例如氘(2h)、氚(3h)、碘-125(
125
i)或碳-14(
14
c)等。此外,本发明化合物例如,也能够利用氚(3h)、碘-125(
125
i)或碳-14(
14
c)那样的放射性同位素进行放射性标识。被放射性标识的化合物作为治疗或预防剂、研究试剂例如,测定法试剂、以及诊断剂例如,体内诊断显像剂是有用的。本发明的抗体-药物偶联物的所有同位素变体不论是否具有放射性,都包含在本发明的范围内。
[0584]
[制造方法]
[0585]
r法:抗her2抗体的制备
[0586]
糖链重构抗体能够按照例如wo2013/120066等所述的方法,利用图3所示那样的方法来制造。
[0587][0588]
r-1工序:还原末端的壳二糖结构的glcnacβ1-4glcnac之间的糖苷键的水解。
[0589]
本工序为对于目标抗体,使用公知的酶反应切断与抗体的氨基酸序列第297号的天冬酰胺结合的n连接型糖链(n297结合糖链),制备糖链切断抗体的工序。
[0590]
将目标抗体(20mg/ml)在缓冲溶液(50mm磷酸缓冲溶液等)中,在0℃~40℃,使用endos酶等水解酶实施还原末端的壳二糖结构的glcnacβ1与4glcnac之间的糖苷键的水解反应。反应时间为10分钟~72小时,优选为1小时~6小时。野生型endos酶相对于抗体100mg,使用0.1~10mg,优选使用0.1~3mg。反应结束后,通过实施后述的亲和色谱法精制和/或羟基磷灰石柱精制,从而能够制造glcnacβ1与4glcnac之间的糖链被水解的(fucα1,6)glcnac-抗体。
[0591]
r-2工序:糖链转移反应。
[0592]
本工序为对于上述(fucα1,6)glcnac-抗体,使用酶反应与具有包含叠氮基的peg
连接子的msg(msg1、msg2)或sg型糖链恶唑啉体(以下,“叠氮基糖链恶唑啉体”)结合,制造糖链重构抗体的工序。
[0593]
使上述糖链切断抗体在缓冲溶液(磷酸缓冲溶液等)中,在0℃~40℃,在催化量的endos(d233q/q303l)等糖基转移酶存在下,与叠氮基糖链恶唑啉体进行反应,从而实施糖链转移反应。反应时间为10分钟~72小时,优选为1小时~6小时。endos酶(d233q/q303l)相对于抗体100mg,使用1~10mg,优选为1~3mg,叠氮基糖链恶唑啉体使用2~过剩当量,优选为2~20当量。
[0594]
反应结束后,通过实施亲和色谱法精制和羟基磷灰石柱精制,从而能够得到精制的糖链重构抗体。
[0595]
叠氮基糖链恶唑啉体能够根据实施例3~5所述的方法来制备。能够在msg(msg(9)、msg1、msg2)或二唾液酸八糖(sg(10),东京化成工业(株))中利用有机合成科学领域中公知的反应(缩合反应等),导入作为包含叠氮基的peg连接子(n3-l(peg))的n3-(ch2ch2-o)n5-ch2ch2-nh2。即,导向唾液酸2位的羧酸与n3-(ch2ch2-o)n5-ch2ch2-nh2的右末端的氨基通过公知的缩合反应而形成酰胺键。
[0596]
需要说明的是,msg、msg1或msg2能够通过将上述(msg-)asn或分离精制的(msg1-)asn或(msg2-)asn利用endom等水解酶进行水解来得到。
[0597]
在上述糖链重构抗体的制备中,抗体水溶液的浓缩、浓度测定、缓冲液交换能够根据下述的共通操作a~c进行。
[0598]
(共通操作a:抗体水溶液的浓缩)
[0599]
在amicon ultra(30000~50000,mwco,millipore co.)的容器内,加入抗体或抗体-药物偶联物溶液,通过使用了离心机(allegra x-15r,beckman coulter,inc.)的离心操作(以2000g~4000g离心5~20分钟),将抗体和后述的抗体-药物偶联物溶液进行浓缩。
[0600]
(共通操作b:抗体的浓度测定)
[0601]
使用uv测定仪(nanodrop 1000,thermo fisher scientific inc.),按照制造商规定的方法,进行抗体浓度的测定。此时,使用对于每种抗体不同的280nm吸光系数(1.3mlmg
-1
cm
-1
~1.8mlmg
-1
cm
-1
)。
[0602]
(共通操作c:抗体的缓冲液交换)
[0603]
对于抗体水溶液,添加缓冲溶液(磷酸缓冲生理盐水(ph6.0)、磷酸缓冲液(ph6.0)等),利用共通操作a进行了浓缩。将该操作进行数次之后,使用共通操作b,进行抗体浓度的测定,使用缓冲溶液(磷酸缓冲生理盐水(ph6.0)、磷酸缓冲液(ph6.0)等),将抗体浓度调整为10mg/ml。
[0604]
s法:偶联。
[0605]
本制造法是通过spaac反应(strain-promoted alkyne azide cycloaddition:jacs.2004,126,15046-15047)使上述糖链重构抗体与制造中间体(2)结合,从而制造抗体-药物偶联物的方法。
[0606]
[0607]
式中ab表示糖链重构抗体。
[0608]
la’、lp’、b’与la、lp、b含义相同。
[0609]
j表示下述所示的任一结构式。
[0610]
式中,星号(*)表示与la’结合。
[0611][0612]
j-la’-lp’-nh-b’-ch2-o(c=o)-pbd能够通过实施例2-1~2-6所述的方法等来合成。
[0613]
通过将抗体ab的缓冲溶液(乙酸钠溶液、磷酸钠、硼酸钠溶液等或它们的混合物)与在适当的溶剂(二甲亚砜(dmso)、二甲基甲酰胺(dmf)、二甲基乙酰胺(dma)、n-甲基-2-吡啶酮(nmp)、丙二醇(pg)等或它们的混合物)中溶解化合物(2)而形成的溶液混合,从而进行spaac反应。
[0614]
相对于抗体1摩尔,化合物(2)为2摩尔~过剩摩尔,优选为1摩尔~30摩尔,有机溶剂的比率相对于抗体的缓冲液优选为1~200%v/v。反应温度为0℃~37℃,优选为10℃~25℃,反应时间为1~150小时,优选为6小时~100小时。反应时的ph优选为5~9。
[0615]
抗体-药物偶联物能够通过上述共通操作a~c和后述共通操作d~f进行缓冲液交换、精制、抗体浓度以及每一分子抗体的平均药物结合数的测定,进行抗体-药物偶联物的鉴定。
[0616]
(共通操作d:抗体-药物偶联物的精制)
[0617]
利用市售的包含山梨糖醇(5%)的乙酸缓冲液(10mm,ph5.5;本说明书称为abs)使nap-25柱平衡化。在该nap-25柱中,载置抗体-药物偶联物反应水溶液(约1.5~2.5ml),利用制造商规定的量的缓冲液使其溶出,从而分离抗体馏分。将该分离馏分再次置于nap-25柱,利用缓冲液进行溶出,将以上凝胶过滤精制操作合计重复2~3次,从而得到除去了未结合的药物连接子、二甲亚砜、丙二醇的抗体-药物偶联物。根据需要,通过共通操作a和c,制备出抗体-药物偶联物溶液的浓度。
[0618]
(共通操作e:抗体-药物偶联物中的抗体浓度的测定)
[0619]
抗体-药物偶联物中的结合药物浓度能够使用下述所示的lambert-beer定律,算出。
[0620]
下述的表示使用lambert-beer定律的式(i)。
[0621][0622]
在此,a280表示抗体-药物偶联物水溶液的280nm时的吸光度,ε280表示抗体-药物偶联物的280nm时的摩尔吸光系数,c(mol
·
l
-1
)表示抗体-药物偶联物的摩尔浓度。
[0623]
根据上述式(i),抗体-药物偶联物的摩尔浓度c(mol
·
l
-1
)按照下述的式(ii)来求得。
[0624]
[0625]
进而,两边乘以抗体-药物偶联物的摩尔质量mw(g
·
mol
-1
),从而能够求出抗体-药物偶联物的重量浓度c’(mg
·
ml
-1
)(式(iii))。
[0626][0627]
以下,使用上述式,记载适用于本实施例的各值。
[0628]
吸光度a280使用抗体-药物偶联物水溶液的280nm时的uv吸光度的实测值。摩尔质量mw(g
·
mol
-1
)使用由抗体的氨基酸序列求得的抗体分子量的计算推定值作为抗体-药物偶联物的摩尔质量的近似值。光程长l(cm)在1cm下测定。
[0629]
抗体药物偶联物的摩尔吸光系数ε280能够按照下述的式(iv)来求出。
[0630]
ε
280
=抗体摩尔吸光系数ε
ab、280
药物摩尔吸光系数ε
dl、280
×
药物结合数式(iv)
[0631]
在此,ε
ab、280
表示280nm时的抗体的摩尔吸光系数,ε
dl、280
表示280nm时的药物的摩尔吸光系数。
[0632]
ε
ab、280
能够根据抗体的氨基酸序列,通过已知的计算方法(protein science,1995,vol.4,2411-2423)来推定。实施例中,曲妥珠单抗a1抗体的摩尔吸光系数使用ε
ab、280
=215057(计算推定值)。曲妥珠单抗a2的摩尔吸光系数使用ε
ab
、
280
=215380(计算推定值)。h01l02抗体的摩尔吸光系数使用ε
ab、280
=210014(计算推定值),hwtl05抗体的摩尔吸光系数使用ε
ab、280
=212834(计算推定值),lps抗体的摩尔吸光系数使用ε
ab、280
=230300(计算推定值)。
[0633]
ε
dl、280
使用每次利用uv测定得到的实测值算出的值。即,测定使偶联物前体(药物)溶解成某一摩尔浓度的溶液的吸光度,使用lambert-beer的定律,通过式(i)而得到的值。
[0634]
(共通操作f:抗体-药物偶联物中的每一分子抗体的平均药物结合数的测定)
[0635]
抗体-药物偶联物中的每一分子抗体的平均药物结合数能够通过使用下述的方法的高效液相色谱法(hplc)分析来求得。
[0636]
[f-1.hplc分析用样品的制备(抗体-药物偶联物的还原)]
[0637]
将抗体-药物偶联物溶液(约1mg/ml,60μl)与二硫苏糖醇(dtt)水溶液(100mm,15μl)进行混合。将混合物在37℃保温30分钟,从而将抗体-药物偶联物的l链和h链间的二硫键断裂的样品用于hplc分析。
[0638]
[f-2.hplc分析]
[0639]
在下述测定条件下进行hplc分析。
[0640]
hplc系统:agilent 1290hplc系统(agilent technologies)。
[0641]
检测器:紫外吸光度计(测定波长:280nm,329nm)。
[0642]
柱:beh phenyl(2.1
×
50mm,1.7μm,waters acquity)。
[0643]
柱温度:75℃。
[0644]
流动相a:0.1%三氟乙酸(tfa),15%异丙醇水溶液。
[0645]
流动相b:0.075%tfa,15%异丙醇乙腈溶液。
[0646]
梯度程序:14%-36%(0分钟-15分钟),36%-80%(15-17分钟),80%-14%(17分钟―17.1分钟),14%-14%(17.1分钟―23分钟)。
[0647]
样品进样量:5μl。
[0648]
[f-3.数据解析]
[0649]
〔f-3-1〕相对于未与药物结合的抗体的h链(h0),与药物结合的h链(与一个药物结合的h链:h1,与二个药物结合的h链:h2)的疏水性与所结合的药物的数目成比例地增加,保留时间成比例地变大,因此按照l0、h0、h1、h2的顺序被溶出。通过l0与h0的保留时间的比较,能够将检测峰分配给l0、h0、h1、h2中的任一者。此外药物的结合即使在药物的特定的329nm的波长吸收也能够确认。
[0650]
〔f
‑3‑
2〕由于药物连接子具有uv吸收,因此根据药物连接子的结合数,使用l链、h链和药物连接子的摩尔吸光系数,根据下式进行峰面积值的校正。
[0651][0652]
在此,各抗体中的l链和h链的摩尔吸光系数(280nm)能够使用通过已知的计算方法(protein science,1995,vol.4,2411
‑
2423),由各抗体的l链和h链的氨基酸序列来推定的值。在曲妥珠单抗a1的情况下,根据其氨基酸序列,使用81488作为h链的摩尔吸光系数的推定值。在曲妥珠单抗a2的情况下,根据其氨基酸序列,使用81478作为h链的摩尔吸光系数的推定值。同样,h01l02抗体的情况下,使用79989作为h链的摩尔吸光系数,hwtl05抗体的情况下,使用81488作为h链的摩尔吸光系数,lps抗体的情况下,使用77470作为h链的摩尔吸光系数,药物连接子的摩尔吸光系数(280nm)使用作为偶联物前体的药物连接子1(实施例2
‑
3)的实测的摩尔吸光系数(280nm)。
[0653]
〔f
‑3‑
3〕根据下式计算相对于峰面积校正值合计的各链峰面积比(%)。
[0654][0655]
ahi:hi各峰的峰面积校正值
[0656]
〔f
‑3‑
4〕按照下式计算抗体
‑
药物偶联物中的每一分子抗体的平均药物结合数。
[0657]
平均药物结合数=(l0峰面积比x0 l0峰面积比x1 h0峰面积比x0 h1峰面积比x1)/100x2
[0658]
<药物>
[0659]
本发明的抗体一药物偶联物对于癌细胞显示出细胞毒活性,因此作为药物,特别能够用作针对癌的治疗剂和/或预防剂。
[0660]
作为适用本发明的抗体
‑
药物偶联物的癌的种类,可举出肺癌、尿道上皮癌、大肠癌、前列腺癌、卵巢癌、胰腺癌、乳腺癌、膀胱癌、胃癌、胃肠间质肿瘤、子宫颈癌、食道癌、扁平上皮癌、腹膜癌、肝癌、肝细胞癌、结肠癌、直肠癌、结肠直肠癌、子宫内膜癌、子宫癌、唾液腺癌、肾癌、外阴部癌、甲状腺癌、或阴茎癌以及它们的转移型形态等,但作为治疗对象的癌细胞中,只要是表达抗体-药物偶联物中的抗体能够识别的蛋白质的癌细胞,就并不限定于此。
[0661]
本发明的抗体-药物偶联物能够适合给药至哺乳动物,更优选为人。
[0662]
作为含有本发明的抗体-药物偶联物的医药组合物中使用的物质,能够根据给药量、给药浓度,从该领域通常使用的制剂添加物中适当选择进行应用。
[0663]
本发明的抗体-药物偶联物能够以包含一种以上药学相容性成分的药学组合物的方式给药。例如,上述药学组合物代表性地包含一种以上的药学载体(例如,灭菌的液体(例如,包含水以及油(石油、起源于动物、植物或合成的油(例如,花生油、大豆油、矿物油、芝麻油等)))。在上述药学组合物被静脉内给药的情况下,水是更具有代表性的载体。盐水
溶液以及葡萄糖水溶液和甘油水溶液也可以用作液体载体,特别是可用于注射用溶液。适当的药学赋形剂在该领域是公知的。上述组合物根据需要,还可以包含微量的湿润剂或乳化剂、或ph缓冲剂。适当的药学载体的例子记载于e.w.martin的“remington’s pharmaceutical sciences”。该配方对应于给药方式。
[0664]
各种递送系统是公知的,能够用于本发明的抗体-药物偶联物的给药。作为导入方法,可举出皮内、肌内、腹腔内、静脉内和皮下途径,但不限定于此。给药例如,可以通过注入或大剂量注射进行。在特定的优选实施方式中,上述配体药物结合体的给药通过注入进行。非经口的给药是优选的给药途径。
[0665]
在代表性的实施方式中,上述药学组合物根据常规的步骤设计适合于对人静脉内给药的药学组合物的配方。代表性的用于静脉内给药的组合物为灭菌等渗性的水性缓冲液中的溶液。必要的情况下,上述药物还可以包含增溶剂和用于缓和注射部位疼痛的局部麻醉剂(例如,利多卡因)。一般而言,上述成分例如以显示活性剂的量的安瓿或药囊(sachet)等经过密封而封口的容器中的干燥冻干粉末或无水浓缩物的形式分开供给,或在单位剂型中一起混合供给。在预定上述药物通过注入给药的情况下,例如,可以通过包含灭菌制药用级的水或盐水的注入瓶来给药。在通过注射来给药上述药物的情况下,注射用灭菌水或盐水的安瓿例如,能够在给药上述成分之前被混合而得的方式来提供。
[0666]
本发明的医药组合物可以为仅包含本发明的抗体-药物偶联物的医药组合物,也可以为包含抗体-药物偶联物和至少一种该抗体-药物偶联物以外的癌治疗剂的医药组合物。本发明的抗体-药物偶联物还能够与其它癌治疗剂一起给药,由此能够增强抗癌效果。以这样的目的使用的其它抗癌剂可以与抗体-药物偶联物同时、分开或连续地给药至个体,也可以改变各自的给药间隔进行给药。作为这样的癌治疗剂,可举出紫杉醇(abraxane)、卡铂(carboplatin)、顺铂(cisplatin)、吉西他滨(gemcitabine)、伊立替康(irinotecan)(cpt-11)、紫杉醇(paclitaxel)、培美曲塞(pemetrexed)、索拉非尼(sorafenib)、长春花碱(vinblastin)或wo2003/038043号小册子所述的药剂、以及lh-rh类似物(亮丙瑞林、戈舍瑞林等)、磷酸雌莫司汀、雌激素拮抗剂(他莫昔芬、雷洛昔芬等)、芳香化酶抑制剂(阿那曲唑、来曲唑、依西美坦等)等,只要是具有抗肿瘤活性的药剂就不受限定。
[0667]
这样的医药组合物配制成具有所选择的组成和所需的纯度的制剂,以冻干制剂或液状制剂的方式制剂化即可。在作为冻干制剂制剂化时,可以为包含该领域中使用的适当的制剂添加物的制剂。此外同样地,液体制剂也能够制剂化成包含该领域使用的各种制剂添加物的液状制剂。
[0668]
医药组合物的组成和浓度根据给药方法而变化,但本发明的医药组合物所包含的抗体-药物偶联物就抗体-药物偶联物对于抗原的亲和性,即,相对于抗原的解离常数(kd值)这一点而言,亲和性越高(kd值越低),即使少量的给药量也能够发挥药效。因此,在决定抗体-药物偶联物的给药量时,还能够基于抗体-药物偶联物与抗原的亲和性的状况来设定给药量。在将本发明的抗体-药物偶联物对于人给药时,例如,将约0.001~100mg/kg以一次给药,或以每1~180天一次的间隔多次给药即可。
[0669]
此外,本发明的抗体或该抗体的功能性片段还能够用作药物。在该情况下,能够将上述<药物>相关的“抗体-药物偶联物”相关的记载适当替换为“抗体或该抗体的功能性
片段”相关的记载。
[0670]
进而,本发明的游离药物(新型pbd衍生物化合物)、其盐或它们的水合物也能够用作药物。在该情况下,能够将上述<药物>相关的“抗体-药物偶联物”相关的记载适当替换为“游离药物(新型pbd衍生物化合物)、其盐或它们的水合物”相关的记载。
[0671]
实施例
[0672]
实施例1:曲妥珠单抗a2抗体和曲妥珠单抗变体
[0673]
曲妥珠单抗a2抗体的制作
[0674]
在本说明书中,“曲妥珠单抗”有时也被称为herceptin(注册商标)、humab4d5-8、rhumab4d5-8,为包含由序列号33的氨基酸号1~450所述的氨基酸序列形成的重链以及由序列号34的氨基酸号1~214所述的氨基酸序列形成的轻链而成的人化igg1抗体(us5821337)。
[0675]
本说明书所使用的曲妥珠单抗a2抗体为使曲妥珠单抗的重链氨基酸序列的第237号和第238号的亮氨酸(l)变异为丙氨酸(a)的曲妥珠单抗的恒定区改变igg1抗体。曲妥珠单抗的重链氨基酸序列记载为序列号33,轻链氨基酸序列记载为序列号34。曲妥珠单抗a2抗体的重链氨基酸序列记载为序列号31,轻链氨基酸序列记载为序列号32。
[0676]
曲妥珠单抗变体(曲妥珠单抗a1(hwtlwt)、h01l02抗体和hwtl05抗体)的设计。
[0677]
1-1:曲妥珠单抗变体的设计。
[0678]
1-1-1:曲妥珠单抗a1的重链的设计。
[0679]
设计出具有曲妥珠单抗的重链可变区,为igg1的同种型,并且将由eu index确定的234位、235位的亮氨酸取代为丙氨酸的重链(本说明书中,称为“曲妥珠单抗a1的重链”或“hwt”)。将编码序列号11的氨基酸序列的核苷酸序列记载为序列号12。
[0680]
1-1-2:曲妥珠单抗的可变区变体的制备。
[0681]
在hwt氨基酸序列中,将由eu index确定的第105号的酪氨酸取代为苯丙氨酸的重链命名为h01。将h01的氨基酸序列记载为序列号15。将编码序列号15的氨基酸序列的核苷酸序列记载为序列号16。
[0682]
在曲妥珠单抗的轻链氨基酸序列中,将由eu index确定的第92号的酪氨酸取代为丙氨酸的轻链命名为l02。将l02的氨基酸序列记载为序列号23。将编码序列号23的氨基酸序列的核苷酸序列记载为序列号24。
[0683]
在曲妥珠单抗的轻链氨基酸序列中,将由eu index确定的第46号的亮氨酸和第92号的酪氨酸取代为丙氨酸的轻链命名为l05。将l05的氨基酸序列记载为序列号27。将编码序列号27的氨基酸序列的核苷酸序列记载为序列号28。
[0684]
1-1-3:利用重链和轻链的组合的曲妥珠单抗变体的设计。
[0685]
将由hwt和lwt形成的抗体称为“曲妥珠单抗a1”、“hwtlwt抗体”或“hwtlwt”。将由h01和l02形成的抗体称为“h01l02抗体”或“h01l02”。将由hwt和l05形成的抗体称为“hwtl05抗体”或“hwtl05”。
[0686]
1-2:曲妥珠单抗a1(hwtlwt)、h01l02抗体和hwtl05抗体的制作。
[0687]
1-2-1:轻链表达质粒pcma-lk的构建。
[0688]
使用in-fusion hd pcr克隆试剂盒(clontech公司),将通过用限制性酶xbai和pmei消化质粒pcdna3.3-topo/lacz(invitrogen公司)而得的约5.4kb的片段与包含编码
序列号9所示的人轻链信号序列和人κ链恒定区的dna序列的dna片段进行结合,制作出pcdna3.3/lk。通过从pcdna3.3/lk除去新霉素表达单元,从而构建pcma-lk。
[0689]
1-2-2:igg1lala类型重链表达质粒pcma-g1lala的构建。
[0690]
使用in-fusion hd pcr克隆试剂盒(clontech公司),将通过用xbai和pmei消化pcma-lk而除去了轻链信号序列和人κ链恒定区的dna片段与包含编码序列号10所示的人重链信号序列和人igg1lala恒定区的dna序列的dna片段进行结合,构建出pcma-g1lala。
[0691]
1-2-3:曲妥珠单抗a1重链表达质粒的构建。
[0692]
合成出编码序列号12所示的曲妥珠单抗a1的重链(hwt)的核苷酸序列的核苷酸编号36~434所示的dna片段(geneart公司)。使用in-fusion hd pcr克隆试剂盒(clontech公司),在将pcma-g1lala利用限制性酶blpi切断的地方插入合成的dna片段,从而构建出表达质粒。
[0693]
1-2-4:h01表达质粒的构建。
[0694]
合成出编码序列号16所示的h01的核苷酸序列的核苷酸编号36~434所示的dna片段(geneart公司)。利用与实施例1-2-3同样的方法构建出表达质粒。
[0695]
1-2-5:曲妥珠单抗a1轻链表达质粒的构建。
[0696]
合成出编码序列号20所示的曲妥珠单抗a1的轻链(lwt)的核苷酸序列的核苷酸编号37~402所示的dna片段(geneart公司)。使用in-fusion hd pcr克隆试剂盒(clontech公司),在将pcma-lk利用限制性酶bsiwi切断的地方插入合成的dna片段,从而构建出表达质粒。
[0697]
1-2-6:l02表达质粒的构建。
[0698]
合成出序列号24所示的l02的核苷酸序列的核苷酸编号37~402所示的dna片段(geneart公司)。利用与实施例1-2-5同样的方法构建出表达质粒。
[0699]
1-2-7:l05表达质粒的构建
[0700]
合成出序列号28所示的l05的核苷酸序列的核苷酸编号37~402所示的dna片段(geneart公司)。利用与实施例1-2-5同样的方法构建出表达质粒。
[0701]
1-3:曲妥珠单抗a1、h01l02抗体和hwtl05抗体的制备。
[0702]
1-3-1:曲妥珠单抗a1、h01l02抗体和hwtl05抗体的生产。
[0703]
freestyle 293f细胞(invitrogen公司)按照手册,进行了传代、培养。将对数生长期的1.2
×
109个freestyle 293f细胞(invitrogen公司)接种于3l fernbach erlenmeyer flask(corning公司),利用freestyle293 expression medium(invitrogen公司)进行稀释,制备成2.0
×
106细胞/ml。在40ml的opti-pro sfm培养基(invitrogen公司)中添加0.24mg的重链表达质粒、0.36mg的轻链表达质粒以及1.8mg的聚乙烯亚胺(polyscience#24765),平稳地搅拌,进一步放置5分钟之后,添加至freestyle 293f细胞。在37℃、8%co2培养箱中以90rpm振荡培养4小时后,添加600ml的ex-cell vpro培养基(safc biosciences公司)、18ml的glutamax i(gibco公司)和30ml的yeastolate ultrafiltrate(gibco公司),在37℃、8%co2培养箱中以90rpm振荡培养7天而得的培养上清液利用disposable capsule filter(advantec#ccs-045-e1h)进行过滤。
[0704]
通过实施例1-1-3所示的重链与轻链的组合相对应的重链表达质粒与轻链表达质粒的组合,从而生产曲妥珠单抗a1、h01l02抗体和hwtl05抗体。
[0705]
1-3-2:曲妥珠单抗a1、h01l02抗体和hwtl05抗体的精制。
[0706]
将由实施例1-3-1得到的培养上清液以rprotein a亲和色谱法的1阶段工序进行精制。将培养上清液应用于填充利用pbs进行了平衡化的mabselectsure的柱(ge healthcare bioscience公司制)之后,利用柱容量的2倍以上的pbs来洗涤柱。接下来,利用2m精氨酸盐酸盐溶液(ph4.0)溶出,收集包含抗体的馏分。将该馏分通过渗析(thermo scientific公司,slide-a-lyzer dialysis cassette)进行向50mm磷酸缓冲溶液(ph6.0)的缓冲液置换。利用centrifugal uf filter device vivaspin20(组分分子量uf10k,sartorius公司)将抗体进行浓缩,将igg浓度制备成20mg/ml以上。最后利用minisart-plus filter(sartorius公司)进行过滤,制成精制样品。
[0707]
1-4:曲妥珠单抗变体的活性测定。
[0708]
1-4-1:曲妥珠单抗变体的结合性评价。
[0709]
由实施例1-3制备的曲妥珠单抗a1、h01l02抗体、hwtl05抗体和人her2的解离常数测定使用biacore t200(ge healthcare bioscience公司制),在使用human antibody capture kit(ge healthcare bioscience公司制)进行了固定化的anti-human igg(fc)antibody上将抗体作为配体进行捕捉(capture),利用将抗原作为分析物(analyte)进行测定的捕捉法来进行。作为电泳缓冲液使用hbs-ep (ge healthcare bioscience公司制),作为传感器芯片使用cm5(ge healthcare bioscience公司制)。在芯片上将0.1μg/ml或0.2μg/ml的抗体以10μl/分钟添加60秒之后,将作为抗原的recombinant human her2/erbb2(acro biosystems)的稀释系列溶液(0.5~8μg/ml)以流速30μl/分钟添加120秒,接着,相对于曲妥珠单抗a1,监视600秒的解离相,相对于h01l02,监视300秒的解离相,相对于hwtl05,监视120秒的解离相。作为再生溶液,将3m magnesium chloride(ge healthcare bioscience公司制)以流速20μl/分钟添加30秒。数据的解析使用1:1结合模型,算出结合速度常数ka、解离速度常数kd和解离常数(kd;kd=kd/ka)。将结果示于表1中。
[0710]
[表1]
[0711]
抗体与人her2的解离常数
[0712]
名称kd(nm)曲妥珠单抗a11.11h01l0215.4hwtl05187
[0713]
〔制造中间体(药物连接子)的合成〕
[0714]
实施例2
[0715]
[实施例2-1:中间体1]
[0716][0717]
工序1:(6s)-6-(羟甲基)-5-氮杂螺[2.4]庚烷-5-羧酸苄酯(1-2)。
[0718]
在5-苄基6-甲基(6s)-5-氮杂螺[2.4]庚烷-5,6-二羧酸酯(1-1)(104mmol,wo2012087596)的四氢呋喃(500ml)溶液中,将氢化硼锂(4.30g,178mmol)在0℃分次少量添加。在0℃搅拌30分钟之后,在室温下搅拌2小时。在0℃添加水(180ml)、2当量盐酸(186ml),进行了减压蒸馏除去。将所得的残渣利用乙酸乙酯提取四次,将有机层利用饱和盐水洗涤之后,利用无水硫酸钠进行了干燥。减压蒸馏除去,将所得的残渣(1-2)(27.9g,90%)直接用于接下来的反应。
[0719]
工序2:(6s)-6-({[叔丁基(二甲基)硅烷基]氧基}甲基)-5-氮杂螺[2.4]庚烷-5-羧酸苄酯(1-3)。
[0720]
在由上述工序1得到的化合物(1-2)(27.9g,107mmol)和咪唑(14.5g,214mmol)的二氯甲烷(300ml)溶液中,在室温下添加叔丁基二甲基氯硅烷(24.2g,160mmol),在室温下搅拌18小时。将反应溶液利用饱和柠檬酸水溶液、饱和碳酸氢钠水溶液、饱和盐水进行洗涤,利用无水硫酸钠进行干燥之后,进行了减压蒸馏除去。将所得的残渣利用硅胶柱色谱法[己烷:乙酸乙酯=100:0(v/v)~50:50(v/v)]进行精制,得到了目标物质(1-3)(32.5g,81%)。
[0721]
ms(apci)m/z:376(m h)
[0722]
工序3:(6s)-6-({[叔丁基(二甲基)硅烷基]氧基}甲基)-5-氮杂螺[2.4]庚烷(1-4)。
[0723]
在由上述工序2得到的化合物(1-3)(32.5g,86.5mmol)的乙醇(400ml)溶液中,在室温下添加7.5%钯碳催化剂(54%水分,5.00g),在室温,氢气气氛下,搅拌6小时。将反应溶液进行硅藻土过滤,将滤液减压蒸馏除去,得到了目标物质(1-4)(21.3g,定量的)。
[0724]
ms(apci,esi)m/z:242(m h)
[0725]
工序4:[(6s)-6-({[叔丁基(二甲基)硅烷基]氧基}甲基)-5-氮杂螺[2.4]庚-5-基](5-甲氧基-2-硝基-4-{[三(丙烷-2-基)硅烷基]氧基}苯基)甲酮(1-5)。
[0726]
在5-甲氧基-2-硝基-4-{三(丙烷-2-基)硅烷基]氧基}苯甲酸(52.2g,141mmol,us20150283262)和1-羟基苯并三唑一水合物(23.8g,155mmol)的二氯甲烷(500ml)溶液中,在用冰冷却下添加n,n’-二环己基碳二亚胺(35.0g,170mmol)。将反应混
合物在室温下进行搅拌。羧酸消失后,在-60℃缓慢地滴加由上述工序3得到的化合物(1-4)(34.1g,141mmol)和三乙胺(29.4ml,212mmol)的二氯甲烷(100ml)溶液。将反应溶液在室温下搅拌一晚之后,在反应混合物中添加饱和碳酸氢钠水溶液,将反应混合物利用氯仿进行提取。将有机层利用水和饱和盐水进行洗涤,利用无水硫酸镁进行了干燥。在减压蒸馏除去而得的残渣中添加乙酸乙酯和二乙醚,通过过滤除去固体成分,将滤液减压蒸馏除去,将所得的残渣利用硅胶柱色谱法[己烷:乙酸乙酯=100:0(v/v)~25:75(v/v)]进行精制,得到了目标物质(1-5)(55.0g,66%)。
[0727]
ms(apci,esi)m/z:593(m h)
[0728]
工序5:(2-氨基-5-甲氧基-4-{[三(丙烷-2-基)硅烷基]氧基}苯基)[(6s)-6-({[叔丁基(二甲基)硅烷基]氧基}甲基)-5-氮杂螺[2.4]庚-5-基]甲酮(1-6)。
[0729]
在由上述工序4得到的化合物(1-5)(55.0g,92.8mmol)的乙醇(300ml)溶液中,在氮气气氛下,添加7.5%钯碳(10.0g)。将氮气球直接更换为氢气球,将反应混合物在氢气气氛下,在室温下剧烈地搅拌。原料消失后,将反应混合物进行过滤,将滤液减压蒸馏除去,将所得的目标物质(1-6)(52.2g,100%)直接用于接下来的反应。
[0730]
ms(apci,esi)m/z:563(m h)
[0731]
工序6:n-[(丙-2-烯-1-基氧基)羰基]-l-缬氨酰-n-[4-({[(2-{[(6s)-6-({[叔丁基(二甲基)硅烷基]氧基}甲基)-5-氮杂螺[2.4]庚-5-基]羰基}-4-甲氧基-5-{[三(丙烷-2-基)硅烷基]氧基}苯基)氨基甲酰基]氧基}甲基)苯基]-l-丙氨酸酰胺(1-7)。
[0732]
在由上述工序5得到的化合物(1-6)(18.6g,33.0mmol)和三乙胺(6.26ml,45.2mmol)的thf(300ml)溶液中,在乙醇-冰浴上,缓慢地添加三光气(4.22g,14.2mmol)。添加后,在用冰冷却的反应混合物中,缓慢地滴加n-[(丙-2-烯-1-基氧基)羰基]-l-缬氨酰-n-[4-(羟甲基)苯基]-l-丙氨酸酰胺(11.4g,30.2mmol,wo2011130598)和三乙胺(6.26ml,45.2mmol)的四氢呋喃(100ml)、n,n-二甲基甲酰胺(30ml)混合溶液。滴加后,除去冰浴,将反应混合物在氮气气氛下,在40℃进行搅拌。原料消失后,在反应混合物中添加水,将反应混合物利用乙酸乙酯进行提取。将有机层利用饱和盐水进行洗涤,利用无水硫酸钠进行干燥。过滤后,将减压蒸馏除去而得的残渣利用硅胶柱色谱法[己烷:乙酸乙酯=100:0(v/v)~40:60(v/v)]进行精制,得到了目标物质(1-7)(23.5g,74%)。
[0733]
ms(apci,esi)m/z:966(m h)
[0734]
工序7:n-[(丙-2-烯-1-基氧基)羰基]-l-缬氨酰-n-[4-({[(2-{[(6s)-6-(羟甲基)-5-氮杂螺[2.4]庚-5-基]羰基}-4-甲氧基-5-{[三(丙烷-2-基)硅烷基]氧基}苯基)氨基甲酰基]氧基}甲基)苯基]-l-丙氨酸酰胺(1-8)。
[0735]
在由上述工序6得到的化合物(1-7)(23.5g,24.3mmol)的四氢呋喃(50ml)、甲醇(50ml)、水(44ml)溶液中,在室温下,添加乙酸(200ml)。将反应混合物在室温下进行搅拌。原料消失后,将反应混合物利用乙酸乙酯进行提取。将有机层利用水和饱和盐水进行洗涤,利用无水硫酸钠进行干燥。过滤后,将减压蒸馏除去而得的残渣利用硅胶柱色谱法[己烷:乙酸乙酯=100:0(v/v)~0:100(v/v)]进行精制,得到了目标物质(1-8)(18.0g,87%)。
[0736]
ms(apci,esi)m/z:852(m h)
[0737]
工序8:n-[(丙-2-烯-1-基氧基)羰基]-l-缬氨酰-n-{4-[({[(11’s,11a’s)-11’-羟基-7’-甲氧基-5’-氧代-8’-{[三(丙烷-2-基)硅烷基]氧基}-11’,11a’-二氢-1’h-螺[环丙烷-1,2’-吡咯并[2,1-c][1,4]苯并二氮杂卓]-10’(5’h)-基]羰基}氧基)甲基]苯基}-l-丙氨酸酰胺(1-9)。
[0738]
在二甲亚砜(3.75ml,52.8mmol)的二氯甲烷(300ml)溶液中,在氮气气氛下,在-78℃,缓慢地滴加乙二酰氯(2.17ml,25.3mmol)。滴加后,将反应混合物在-78℃进行搅拌。在反应混合物中,缓慢地滴加由上述工序7得到的化合物(1-8)(18.0g,21.1mmol)的二氯甲烷(50.0ml)溶液。在反应溶液中在-78℃,添加三乙胺(14.6ml,105mmol)。添加后,除去冷却介质浴,缓慢地升温直至室温。原料消失后,在反应混合物中添加水,将反应混合物利用氯仿(200ml)进行提取。将有机层利用水和饱和盐水进行洗涤,利用无水硫酸镁进行了干燥。过滤后,将减压蒸馏除去而得的残渣利用硅胶柱色谱法[己烷:乙酸乙酯=100:0(v/v)~0:60(v/v)]进行精制,得到了目标物质(1-9)(16.5g,92%)。
[0739]
ms(apci,esi)m/z:850(m h)
[0740]
工序9:n-[(丙-2-烯-1-基氧基)羰基]-l-缬氨酰-n-{4-[({[(11’s,11a’s)-11’-{[叔丁基(二甲基)硅烷基]氧基}-7’-甲氧基-5’-氧代-8’-{[三(丙烷-2-基)硅烷基]氧基}-11’,11a’-二氢-1’h-螺[环丙烷-1,2’-吡咯并[2,1-c][1,4]苯并二氮杂卓]-10’(5’h)-基]羰基}氧基)甲基]苯基}-l-丙氨酸酰胺(1-10)。
[0741]
由上述工序8得到的化合物(1-9)(12.0g,14.1mmol)和2,6-卢剔啶(6.58ml,56.5mmol)的二氯甲烷(200ml)溶液中,在氮气气氛下,在0℃,缓慢地滴加三氟甲基磺酸叔丁基二甲基甲硅烷酯(9.73ml,42.3mmol)。用冰冷却下,搅拌10分钟之后,除去冰浴,在室温下进行搅拌。原料消失后,在反应混合物中添加水,将反应混合物利用氯仿进行提取,利用水和饱和盐水进行洗涤,利用无水硫酸钠进行干燥。过滤后,将减压蒸馏除去而得的残渣利用硅胶柱色谱法[己烷:乙酸乙酯=100:0(v/v)~25:75(v/v)]进行精制,得到了目标物质(1-10)(8.12g,60%)。
[0742]
ms(apci,esi)m/z:964(m h)
[0743]
工序10:n-[(丙-2-烯-1-基氧基)羰基]-l-缬氨酰-n-{4-[({[(11’s,11a’s)-11’-{[叔丁基(二甲基)硅烷基]氧基}-8’-羟基-7’-甲氧基-5’-氧代-11’,11a’-二氢-1’h-螺[环丙烷-1,2’-吡咯并[2,1-c][1,4]苯并二氮杂卓]-10’(5’h)-基]羰基}氧基)甲基]苯基}-l-丙氨酸酰胺(1-11)。
[0744]
在由上述工序9得到的化合物(1-10)(8.12g,8.42mmol)的n,n-二甲基甲酰胺(90ml)、水(2ml)溶液中,添加乙酸锂(0.611g,9.26mmol),在室温下进行搅拌。原料消失后,在反应混合物中添加水,将反应混合物利用乙酸乙酯进行提取。将有机层利用水和饱和盐水进行洗涤,利用无水硫酸钠进行干燥。过滤后,将减压蒸馏除去而得的残渣利用硅胶柱色谱法[己烷:乙酸乙酯=100:0(v/v)~0:100(v/v)]进行精制,得到了目标物质(1-11)(5.48g,81%)。
[0745]1h-nmr(400mhz,cdcl3,20.9℃)δ:8.76-8.60(1h,m),7.45-7.44(2h,m),7.21(1h,s),7.10-7.09(2h,m),6.81-6.74(1h,m),6.65(1h,s),6.23(1h,s),6.01-5.99(1h,m),5.95-5.84(1h,m),5.41-5.20(2h,m),5.16(1h,m),4.84(1h,m),4.67-4.54(4h,m),4.05-4.03(1h,m),3.87(3h,s),3.71(1h,m),3.55-3.51(1h,m),3.26(1h,m),2.35(1h,
m),2.18-2.12(1h,m),1.55-1.42(4h,m),0.97-0.92(6h,m),0.81(9h,s),0.76-0.61(4h,m),0.20-0.06(6h,m)
[0746]
ms(apci,esi)m/z:808(m h)
[0747]1h-nmr(500mhz,cdcl3,27℃)δ:8.76(1h,s),7.43(2h,brd),7.20(1h,s),7.08(2h,d,j=8.3hz),7.00(1h,br),6.66(1h,s),6.44(1h,s),6.00(1h,h11’,d,j11’,11’a=9.2hz),5.89(1h,m),5.53(1h,brd),5.30(1h,d,j=17.2hz),5.20(1h,d,j=10.3hz),5.15(1h,d,jabq=12.5hz),4.85(1h,d,jabq=12.5hz),4.66(1h,m),4.60-4.52(2h,m),4.07(1h,m),3.84(3h,s),3.71(1h,h-3’β,d,jgem=11.7hz),3.53(1h,h-11’a,m),3.26(1h,h-3’α,d,jgem=11.7hz),2.35(1h,h-1’β,dd,j1’β,11’a=8.30hz,jgem=13.1hz),2.14(1h,m),1.54(1h,h-1’α,d,jgem=13.1hz),1.41(3h,d,j=6.90hz),0.95(3h,d,j=6.80hz),0.92(3h,d,j=6.80hz),0.81(9h,s),0.80-0.70(1h,m),0.70-0.59(3h,m),0.2-0.06(6h,m)
[0748]
对于化合物(1-11),由selective 1d roesy光谱得到的相关(下图),进行11’位的绝对立体构型的解析。认为1’α-h与11’-h、3’α-h与11’-h、以及1’β-h与3’β-h间具有相关,由此可知11’位的绝对立体构型为s构型。
[0749][0750]
由selective 1d roesy光谱得到的显著的相关
[0751]
因此,可知使用化合物(1-11)、具有与该化合物(1-11)相同的绝对立体构型的化合物(1-9)和化合物(1-10)、化合物(1-11)而合成的化合物(3-11)、化合物(3-12)、化合物(3-13)和药物连接子1(化合物(3-14))、化合物(4-9)、化合物(4-10)、化合物(4-11)和药物连接子2(化合物(4-12))、以及化合物(6-10)、化合物(6-11)、化合物(6-12)和药物连接子4(化合物(6-13))中的11’位的绝对立体构型为s构型。此外,决定由同样的合成手法得到的化合物(5-9)、化合物(5-10)和药物连接子3(化合物(5-11))的11’位的绝对立体构型为s构型。
[0752]
[实施例2-2:中间体2]
[0753][0754]
工序1:n-[4-(11,12-二脱氢二苯并[b,f]吖辛因-5(6h)-基)-4-氧代丁酰]甘氨酰甘氨酸(2-2)。
[0755]
在甘氨酰甘氨酸(0.328g,2.49mmol)、n,n-二异丙基乙基胺(0.433ml,2.49mmol)的n,n-二甲基甲酰胺(20ml)溶液中,在室温下添加1-{[4-(11,12-二脱氢二苯并[b,f]吖辛因-5(6h)-基)-4-氧代丁酰]氧基}吡咯烷-2,5-二酮(2-1)(1.00g,2.49mmol,click chemistry tools),水(10ml),在相同温度搅拌一晚。减压蒸馏除去,将所得的残渣利用硅胶柱色谱法[氯仿~氯仿:甲醇:水=7:3:1(v/v/v)的分配有机层]进行精制,得到了目标物质(0.930g,89%)。
[0756]
1h-nmr(dmso-d6)δ:12.58(1h,s),8.14-8.12(1h,m),8.08-8.07(1h,m),7.69-7.68(1h,m),7.62-7.61(1h,m),7.53-7.45(3h,m),7.40-7.29(3h,m),5.05-5.01(1h,m),3.73-3.72(2h,m),3.66-3.60(3h,m),2.66-2.60(1h,m),2.33-2.24(1h,m),2.08-2.04(1h,m),1.81-1.77(1h,m).
[0757]
ms(apci,esi)m/z:420[(m h) ].
[0758]
[实施例2-3:药物连接子1]
[0759][0760]
工序1:(2r,11as)-2-{[叔丁基(二甲基)硅烷基]氧基}-8-羟基-7-甲氧基-10-{[2-(三甲基硅烷基)乙氧基]甲基}-2,3-二氢-1h-吡咯并[2,1-c][1,4]苯并二氮杂卓-5,11(10h,11ah)-二酮(3-2)。
[0761]
在(2r,11as)-8-(苄氧基)-2-{[叔丁基(二甲基)硅烷基]氧基}-7-甲氧基-10-{[2-(三甲基硅烷基)乙氧基]甲基}-2,3-二氢-1h-吡咯并[2,1-c][1,4]苯
并二氮杂卓-5,11(10h,11ah)-二酮(3-1)(25.5g,41.6mmol,wo2016149546)的四氢呋喃(150ml)、乙醇(150ml)溶液中,在氮气气氛下,添加5%钯碳(54%水分,10.0g)之后,将反应溶液在氢气气氛下,在室温下搅拌三天。在反应溶液中添加氯仿,硅藻土过滤之后,将滤液进行了减压蒸馏除去。将所得的残渣利用硅胶柱色谱法[己烷:乙酸乙酯=100:0(v/v)~50:50(v/v)]进行精制,得到了目标物质(3-2)(19.4g,89%)。
[0762]
ms(apci,esi)m/z:523(m h)
[0763]
工序2:(2r,11as)-8-[(5-溴戊基)氧基]-2-{[叔丁基(二甲基)硅烷基]氧基}-7-甲氧基-10-{[2-(三甲基硅烷基)乙氧基]甲基}-2,3-二氢-1h-吡咯并[2,1-c][1,4]苯并二氮杂卓-5,11(10h,11ah)-二酮(3-3)。
[0764]
在由上述工序1得到的化合物(3-2)(10.8g,20.7mmol)的n,n-二甲基甲酰胺(30ml)溶液中,在室温下添加1,5-二溴戊烷(23.8g,103mmol)、碳酸钾(3.43g,24.8mmol)。在室温下搅拌3小时之后,在反应溶液中添加水,利用乙酸乙酯进行了提取。将所得的有机层利用饱和盐水进行洗涤,利用硫酸钠进行干燥之后,进行了减压蒸馏除去。将所得的残渣利用硅胶柱色谱法[己烷:乙酸乙酯=90:10(v/v)~50:50(v/v)]进行精制,得到了目标物质(3-3)(14.5g,定量的)。
[0765]
ms(apci,esi)m/z:673[81br,(m h) ],671[79br,(m h) ].
[0766]
工序3:(2r,11as)-8-[(5-溴戊基)氧基]-2-羟基-7-甲氧基-10-{[2-(三甲基硅烷基)乙氧基]甲基}-2,3-二氢-1h-吡咯并[2,1-c][1,4]苯并二氮杂卓-5,11(10h,11ah)-二酮(3-4)。
[0767]
在由上述工序2得到的化合物(3-3)(21.5mmol)的四氢呋喃(40ml)溶液中,在0℃添加1mol/l的四丁基氟化铵四氢呋喃溶液(28.0ml,28.0mmol)。在室温下搅拌30分钟之后,在反应溶液中添加水,利用乙酸乙酯进行提取,将所得的有机层利用饱和盐水进行了洗涤。利用硫酸钠进行干燥之后,进行了减压蒸馏除去。将所得的残渣利用硅胶柱色谱法[氯仿:甲醇=97.5:2.5(v/v)~92.5:7.5(v/v)]进行精制,得到了目标物质(3-4)(11.3g,94%)。
[0768]
ms(apci,esi)m/z:559[81br,(m h) ],557[79br,(m h) ].
[0769]
工序4:(11as)-8-[(5-溴戊基)氧基]-7-甲氧基-10-{[2-(三甲基硅烷基)乙氧基]甲基}-1h-吡咯并[2,1-c][1,4]苯并二氮杂卓-2,5,11(3h,10h,11ah)-三酮(3-5)。
[0770]
使由上述工序3得到的化合物(3-4)(11.3g,20.2mmol)、四丁基溴化铵(0.325g,1.01mmol)、溴化钾(0.240g,2.02mmol,)溶解于饱和碳酸氢钠水溶液(60ml)、二氯甲烷(60ml),将nor-azado(0.0279g,0.202mmol)、次氯酸钠五水合物(2.03g,27.2mmol)在0℃进行添加,在0℃搅拌30分钟。由于残存原料,因此在0℃添加次氯酸钠五水合物(1.00g,13.4mmol),在0℃搅拌15分钟。进一步在0℃添加次氯酸钠五水合物(0.300g,4.03mmol),在0℃搅拌15分钟,利用tlc确认原料的消失。在反应溶液中添加硫代硫酸钠水溶液,利用氯仿进行提取,将所得的有机层利用硫酸钠进行了干燥。减压蒸馏除去,将所得的残渣利用硅胶柱色谱法[己烷:乙酸乙酯=75:25(v/v)~40:60(v/v)]进行精制,得到了目标物质(3-5)(9.74g,87%)。
[0771]
ms(apci,esi)m/z:557[81br,(m h) ],555[79br,(m h) ].
[0772]
工序5:(11as)-8-[(5-溴戊基)氧基]-7-甲氧基-5,11-二氧代-10-
{[2-(三甲基硅烷基)乙氧基]甲基}-5,10,11,11a-四氢-1h-吡咯并[2,1-c][1,4]苯并二氮杂卓-2-基三氟甲磺酸酯(3-6)。
[0773]
在由上述工序4得到的化合物(3-5)(9.74g,17.5mmol)的二氯甲烷(160ml)溶液中,在-40℃添加2,6-卢剔啶(8.17ml,70.1mmol),在-40℃搅拌10分钟。在反应溶液中在-40℃添加无水三氟甲磺酸(8.85ml,52.6mmol),在-40℃搅拌30分钟。在反应溶液中添加10%柠檬酸水溶液,利用氯仿进行提取,将所得的有机层利用硫酸钠进行了干燥。减压蒸馏除去,将所得的残渣利用硅胶柱色谱法[己烷:乙酸乙酯=95:5
→
70:35]进行精制之后,利用nh2硅胶色谱法[己烷:乙酸乙酯=95:5(v/v)~65:35(v/v)]进行精制,得到了目标物质(3-6)(7.10g,59%)。
[0774]
ms(apci,esi)m/z:689[81br,(m h) ],687[79br,(m h) ].
[0775]
工序6:(11as)-8-[(5-溴戊基)氧基]-7-甲氧基-2-(4-甲氧基苯基)-10-{[2-(三甲基硅烷基)乙氧基]甲基}-1h-吡咯并[2,1-c][1,4]苯并二氮杂卓-5,11(10h,11ah)-二酮(3-7)。
[0776]
在室温下在由上述工序5得到的化合物(3-6)(2.00g,2.91mmol)、4-甲氧基苯基硼酸(0.884g,5.82mmol)、四(三苯基膦)钯(0)(0.336g,0.291mmol)、碳酸钠(1.23g,11.6mmol)的混合物中添加甲苯(20ml)、乙醇(10ml)、水(10ml)。将反应溶液在室温下搅拌30分钟之后,将反应溶液利用乙酸乙酯进行提取,利用水、饱和盐水进行了洗涤。将有机层利用硫酸钠干燥之后,进行了减压蒸馏除去。将所得的残渣利用硅胶柱色谱法[己烷:乙酸乙酯=90:10(v/v)~50:50(v/v)]进行精制,得到了目标物质(3-7)(1.71g,91%)。
[0777]
ms(apci,esi)m/z:647[81br,(m h) ],645[79br,(m h) ].
[0778]
工序7:(11as)-8-[(5-溴戊基)氧基]-7-甲氧基-2-(4-甲氧基苯基)-1,11a-二氢-5h-吡咯并[2,1-c][1,4]苯并二氮杂卓-5-酮(3-8)。
[0779]
将由上述工序6得到的化合物(3-7)(0.789g,1.22mmol)溶解于乙醇(10ml)、四氢呋喃(10ml)中,在0℃添加2.0m的氢化硼锂四氢呋喃溶液(6.11ml,12.2mmol),在0℃搅拌3小时。在反应溶液中添加水,利用氯仿进行提取,将所得的有机层利用硫酸钠进行了干燥。减压蒸馏除去,将所得的残渣溶解于二氯甲烷(10ml)、乙醇(20ml)、水(10ml),在室温下添加硅胶(4g),在室温下搅拌4天。将硅胶通过过滤除去,添加水,利用氯仿进行提取,将所得的有机层利用硫酸钠进行了干燥。减压蒸馏除去,将所得的残渣利用硅胶柱色谱法[己烷:乙酸乙酯=60:40(v/v)~25:75(v/v)]进行精制,得到了目标物质(3-8)(0.496g,81%)。
[0780]
ms(apci,esi)m/z:501[81br,(m h) ],499[79br,(m h) ].
[0781]
工序8:(11as)-8-[(5-溴戊基)氧基]-7-甲氧基-2-(4-甲氧基苯基)-1,10,11,11a-四氢-5h-吡咯并[2,1-c][1,4]苯并二氮杂卓-5-酮(3-9)。
[0782]
在0℃在由上述工序7得到的化合物(3-8)(0.496g,0.992mmol)的二氯甲烷(20ml)溶液中添加三乙酰氧基硼氢化钠(0.421g,1.99mmol)。在室温下搅拌2小时之后,添加饱和碳酸氢钠水溶液,利用氯仿进行提取。将有机层利用硫酸钠进行干燥,进行了减压蒸馏除去之后,将所得的残渣利用硅胶柱色谱法[己烷:乙酸乙酯=60:40(v/v)~25:75(v/v)]进行精制,得到了目标物质(3-9)(0.426g,86%)。
[0783]
ms(apci,esi)m/z:503[81br,(m h) ],501[79br,(m h) ].
[0784]
工序9:丙-2-烯-1-基(11as)-8-[(5-溴戊基)氧基]-7-甲氧基-2-
(5’h)-基]羰基}氧基)甲基]苯基}-l-丙氨酸酰胺(3-13)。
[0794]
在室温下在由上述工序11得到的化合物(3-12)(0.140mmol)的二氯甲烷(2ml)溶液中,添加吡咯烷(0.0579ml,0.700mmol)、四(三苯基膦)钯(0)(0.0162g,0.0140mmol),在室温下搅拌15分钟。进行了减压蒸馏除去之后,将所得的残渣利用硅胶色谱法[氯仿:甲醇=99.5:0.5(v/v)~92.5:7.5(v/v)]进行精制,得到了目标物质(3-13)(0.143g,99%)。
[0795]
ms(apci,esi)m/z:1030(m h)
[0796]
工序13:n-[4-(11,12-二脱氢二苯并[b,f]吖辛因-5(6h)-基)-4-氧代丁酰]甘氨酰甘氨酰-l-缬氨酰-n-{4-[({[(11’s,11a’s)-11’-羟基-7’-甲氧基-8’-[(5-{[(11as)-7-甲氧基-2-(4-甲氧基苯基)-5-氧代-5,10,11,11a-四氢-1h-吡咯并[2,1-c][1,4]苯并二氮杂卓-8-基]氧基}戊基)氧基]-5’-氧代-11’,11a’-二氢-1’h-螺[环丙烷-1,2’-吡咯并[2,1-c][1,4]苯并二氮杂卓]-10’(5’h)-基]羰基}氧基)甲基]苯基}-l-丙氨酸酰胺(3-14)。
[0797]
在室温下,在由实施例2-2工序1得到的化合物(2-2)(0.0640g,0.153mmol)、n-乙氧基羰基-2-乙氧基-1,2-二氢喹啉(0.0446g,0.180mmol)的混合物中添加二氯甲烷(2ml),在室温下搅拌15分钟。在反应溶液中添加由上述工序12得到的化合物(3-13)(0.143g,0.139mmol)的二氯甲烷(2ml)溶液,在室温下搅拌五小时之后,进行了减压蒸馏除去。将所得的残渣利用硅胶色谱法氯仿:甲醇=99.5:0.5(v/v)~92.5:7.5(v/v)]进行精制,得到了目标物质(3-14)(0.103g,52%)。
[0798]
1h-nmr(dmso-d6)δ:9.93(1h,s),8.21-8.16(2h,m),8.07-8.04(1h,m),7.83-7.64(2h,m),7.60-7.55(3h,m),7.51-7.28(10h,m),7.19-7.16(2h,m),7.10-7.04(1h,m),6.92-6.90(2h,m),6.76-6.70(1h,m),6.39(1h,s),5.77-5.75(1h,m),5.21-5.18(1h,m),5.03-4.99(1h,m),4.82-4.79(1h,m),4.37-4.35(1h,m),4.21-4.20(2h,m),4.02-3.24(26h,m),3.16-3.13(1h,m),2.79-2.59(2h,m),2.39-2.28(2h,m),2.05-1.97(2h,m),1.91-1.77(4h,m),1.57-1.54(3h,m),1.28-1.23(3h,m),0.85-0.80(6h,m),0.67-0.61(4h,m).
[0799]
ms(apci,esi)m/z:1431(m h)
[0800]
[实施例2-4:药物连接子2]
[0801][0802]
工序1:(2r,11as)-8-(3-溴丙氧基)-2-{[叔丁基(二甲基)硅烷基]氧基}-7-甲氧基-10-{[2-(三甲基硅烷基)乙氧基]甲基}-2,3-二氢-1h-吡咯并[2,1-c][1,4]苯并二氮杂卓-5,11(10h,11ah)-二酮(4-1)。
[0803]
使由实施例2-3工序1得到的化合物(3-2)(5.06g,9.67mmol)和1,3-二溴丙烷(4.93ml,48.4mmol)与实施例2-3工序2同样地反应,得到了目标物质(4-1)(4.85g,78%)。
[0804]
ms(apci,esi)m/z:645[81br,(m h) ],643[79br,(m h) ].
[0805]
工序2:(2r,11as)-8-(3-溴丙氧基)-2-羟基-7-甲氧基-10-{[2-(三甲基硅烷基)乙氧基]甲基}-2,3-二氢-1h-吡咯并[2,1-c][1,4]苯并二氮杂卓-5,11(10h,11ah)-二酮(4-2)
[0806]
使由上述工序1得到的化合物(4-1)(4.85g,7.54mmol)与实施例2-3工序3同样地反应,得到了目标物质(4-2)(4.05g,定量的)。
[0807]
ms(apci,esi)m/z:531[81br,(m h) ],529[79br,(m h) ].
[0808]
工序3:(11as)-8-(3-溴丙氧基)-7-甲氧基-10-{[2-(三甲基硅烷基)乙氧基]甲基}-1h-吡咯并[2,1-c][1,4]苯并二氮杂卓-2,5,11(3h,10h,11ah)-三酮(4-3)。
[0809]
使由上述工序2得到的化合物(4-2)(7.54mmol)与实施例2-3工序4同样地反应,得到了目标物质(4-3)(3.73g,93%)。
[0810]
1h-nmr(cdcl3)δ:7.34(1h,s),7.29(1h,s),5.56-5.53(1h,m),4.72-4.69(1h,m),4.67-4.61(1h,m),4.23-4.17(3h,m),3.97-3.88(4h,m),3.82-3.75(1h,m),3.74-3.56(4h,m),2.82-2.77(1h,m),2.43-2.38(2h,m),1.06-0.94(2h,m),0.08-0.00(9h,m).
[0811]
工序4:(11as)-8-(3-溴丙氧基)-7-甲氧基-5,11-二氧代-10-{[2-(三
甲基硅烷基)乙氧基]甲基}-5,10,11,11a-四氢-1h-吡咯并[2,1-c][1,4]苯并二氮杂卓-2-基三氟甲磺酸酯(4-4)。
[0812]
使由上述工序3得到的化合物(4-3)(3.73g,7.08mmol)与实施例2-3工序5同样地反应,得到了目标物质(4-4)(3.27g,70%)。
[0813]
ms(apci,esi)m/z:661[81br,(m h) ],659[79br,(m h) ].
[0814]
工序5:(11as)-8-(3-溴丙氧基)-7-甲氧基-2-(4-甲氧基苯基-10-{[2-(三甲基硅烷基)乙氧基]甲基}-1h-吡咯并[2,1-c][1,4]苯并二氮杂卓-5,11(10h,11ah)-二酮(4-5)。
[0815]
使由上述工序4得到的化合物(4-4)(3.27g,4.96mmol)与实施例2-3工序6同样地反应,得到了目标物质(4-5)(2.49g,81%)。
[0816]
ms(apci,esi)m/z:619[81br,(m h) ],617[79br,(m h) ].
[0817]
工序6:(11as)-8-(3-溴丙氧基)-7-甲氧基-2-(4-甲氧基苯基)-1,11a-二氢-5h-吡咯并[2,1-c][1,4]苯并二氮杂卓-5-酮(4-6)。
[0818]
使由上述工序5得到的化合物(4-5)(2.49g,4.04mmol)与实施例2-3工序7同样地反应,得到了目标物质(4-6)(1.59g,84%)。
[0819]
ms(apci,esi)m/z:473[81br,(m h) ],471[79br,(m h) ].
[0820]
工序7:(11as)-8-(3-溴丙氧基)-7-甲氧基-2-(4-甲氧基苯基)-1,10,11,11a-四氢-5h-吡咯并[2,1-c][1,4]苯并二氮杂卓-5-酮(4-7)。
[0821]
使由上述工序6得到的化合物(4-6)(1.59g,3.38mmol)与实施例2-3工序8同样地反应,得到了目标物质(4-7)(1.39g,87%)。
[0822]
ms(apci,esi)m/z:475[81br,(m h) ],473[79br,(m h) ].
[0823]
工序8:丙-2-烯-1-基(11as)-8-(3-溴丙氧基)-7-甲氧基-2-(4-甲氧基苯基)-5-氧代-11,11a-二氢-1h-吡咯并[2,1-c][1,4]苯并二氮杂卓-10(5h)-羧酸酯(4-8)。
[0824]
使由上述工序7得到的化合物(4-7)(1.40g,2.95mmol)与实施例2-3工序9同样地反应,得到了目标物质(4-8)(0.885g,54%)。
[0825]
ms(apci,esi)m/z:559[81br,(m h) ],557[79br,(m h) ].
[0826]
工序9:n-{[(丙-2-烯-1-基)氧基]羰基}-l-缬氨酰-n-[4-({[(11’s,11’as)-11’-{[叔丁基(二甲基)硅烷基]氧基}-7’-甲氧基-8’-(3-{[(11as)-7-甲氧基-2-(4-甲氧基苯基)-5-氧代-10-{[(丙-2-烯-1-基)氧基]羰基}-5,10,11,11a-四氢-1h-吡咯并[2,1-c][1,4]苯并二氮杂卓-8-基]氧基}丙氧基)-5’-氧代-11’,11’a-二氢-1’h,3’h-螺[环丙烷-1,2’-吡咯并[2,1-c][1,4]苯并二氮杂卓]-10’(5’h)-羰基]氧基}甲基)苯基]-l-丙氨酸酰胺(4-9)。
[0827]
使由上述工序8得到的化合物(4-8)(0.0381g,0.0683mmol)以及由实施例2-1工序10得到的化合物(1-11)(0.0552g,0.0683mmol)与实施例2-3工序10同样地反应,得到了目标物质(4-9)(0.0712g,81%)。
[0828]
ms(apci,esi)m/z:1284(m h) .
[0829]
工序10:n-{[(丙-2-烯-1-基)氧基]羰基}-l-缬氨酰-n-[4-({[(11’s,11’as)-11’-羟基-7’-甲氧基-8’-(3-{[(11as)-7-甲氧基-2-(4-甲氧基苯
基)-5-氧代-10-{[(丙-2-烯-1-基)氧基]羰基}-5,10,11,11a-四氢-1h-吡咯并[2,1-c][1,4]苯并二氮杂卓-8-基]氧基}丙氧基)-5’-氧代-11’,11’a-二氢-1’h,3’h-螺[环丙烷-1,2’-吡咯并[2,1-c][1,4]苯并二氮杂卓]-10’(5’h)-羰基]氧基}甲基)苯基]-l-丙氨酸酰胺(4-10)。
[0830]
使由上述工序9得到的化合物(4-9)(0.0712g,0.0554mmol)与实施例2-3工序11同样地反应,得到了目标物质(4-10)(0.0671g,定量的)。
[0831]
ms(apci,esi)m/z:1170(m h) .
[0832]
工序11:l-缬氨酰-n-[4-({[(11’s,11’as)-11’-羟基-7’-甲氧基-8’-(3-{[(11as)-7-甲氧基-2-(4-甲氧基苯基)-5-氧代-5,10,11,11a-四氢-1h-吡咯并[2,1-c][1,4]苯并二氮杂卓-8-基]氧基}丙氧基)-5’-氧代-11’,11’a-二氢-1’h,3’h-螺[环丙烷-1,2’-吡咯并[2,1-c][1,4]苯并二氮杂卓]-10’(5’h)-羰基]氧基}甲基)苯基]-l-丙氨酸酰胺(4-11)。
[0833]
使由上述工序10得到的化合物(4-10)(0.0571mmol)与实施例2-3工序12同样地反应,得到了目标物质(4-11)(0.0574g,99%)。
[0834]
1h-nmr(cdcl3)δ:9.16(1h,s),7.93-7.91(1h,m),7.55-7.52(1h,m),7.50-7.47(3h,m),7.35-7.32(2h,m),7.21(1h,s),7.13-7.11(2h,m),6.90-6.87(2h,m),6.40(1h,s),6.08(1h,s),5.90-5.87(1h,m),5.37-5.34(1h,m),4.73-4.53(3h,m),4.23-4.08(5h,m),3.89(3h,s),3.82(3h,s),3.78-3.72(5h,m),3.57-3.51(3h,m),3.38-3.30(3h,m),2.76-2.71(1h,m),2.36-2.24(4h,m),1.78-1.42(6h,m),1.00-0.98(3h,m),0.87-0.84(3h,m),0.74-0.62(4h,m).
[0835]
ms(apci,esi)m/z:1002(m h) .
[0836]
工序12:n-[4-(11,12-二脱氢二苯并[b,f]吖辛因-5(6h)-基)-4-氧代丁酰]甘氨酰甘氨酰-l-缬氨酰-n-[4-({[(11’s,11’as)-11’-羟基-7’-甲氧基-8’-(3-{[(11as)-7-甲氧基-2-(4-甲氧基苯基)-5-氧代-5,10,11,11a-四氢-1h-吡咯并[2,1-c][1,4]苯并二氮杂卓-8-基]氧基}丙氧基)-5’-氧代-11’,11’a-二氢-1’h,3’h-螺[环丙烷-1,2’-吡咯并[2,1-c][1,4]苯并二氮杂卓]-10’(5’h)-羰基]氧基}甲基)苯基]-l-丙氨酸酰胺(4-12)。
[0837]
使由上述工序11得到的化合物(4-11)(0.189g,0.189mmol)以及由实施例2-2工序1得到的化合物(2-2)(0.087g,0.207mmol)与实施例2-3工序13同样地反应,得到了目标物质(4-12)(0.169g,64%)。
[0838]
ms(apci,esi)m/z:1402(m h) .
[0839]
[实施例2-5:药物连接子3]
[0840][0841]
工序1:二甲基(6s,6’s)-5,5’-{1,5-戊烷二基双[氧基(5-甲氧基-2-硝基苯-4,1-二基)羰基]}双(5-氮杂螺[2.4]庚烷-6-羧酸酯)(5-2)。
[0842]
在0℃在4,4’-[1,5-戊烷二基双(氧基)]双(5-甲氧基-2-硝基苯甲酸)(5-1)(5.41g,10.9mmol,journal of medicinal chemistry 2004,47,1161)的二氯甲烷(50ml)溶液中,添加乙二酰氯(5.63ml,65.7mmol),滴加n,n-二甲基甲酰胺(0.0844ml,1.09mmol)。将反应溶液升温直至室温,搅拌2小时。将减压蒸馏除去而得的残渣溶解于二氯甲烷(100ml)中,在甲基(6s)-5-氮杂螺[2.4]庚烷-6-羧酸酯盐酸盐(4.28g,24.1mmol,tetrahedron letters 2012.53.3847)和三乙胺(6.07ml,43.8mmol)的二氯甲烷溶液(100ml)中在氮气气氛下,在-40℃进行滴加。将反应溶液升温至0℃,搅拌2小时。在反应混合物中添加1当量盐酸(100ml),将有机层利用水、饱和盐水进行洗涤,利用无水硫酸钠进行干燥。减压蒸馏除去,得到了目标物质(5-2)(8.40g,定量的)。
[0843]
ms(apci,esi)m/z:769(m h) .
[0844]
工序2:{1,5-戊烷二基双[氧基(5-甲氧基-2-硝基苯-4,1-二基)]}双{[(6s)-6-(羟甲基)-5-氮杂螺[2.4]庚-5-基]甲酮}(5-3)
[0845]
在由上述工序1得到的化合物(5-2)(8.40g,10.9mmol)的四氢呋喃(100ml)溶液中,添加硼氢化锂(714mg,32.8mmol),在0℃搅拌30分钟,升温至室温,搅拌1小时。在0℃添加1当量盐酸之后,利用乙酸乙酯进行提取,利用饱和盐水进行洗涤之后,利用无水硫酸钠使其干燥。在减压下进行溶剂蒸馏除去,得到了目标物质(5-3)(7.70g,99%)。
[0846]
ms(apci,esi)m/z:713(m h) .
[0847]
工序3:戊烷-1,5-二基双[氧基(5-甲氧基-2-硝基苯-4,1-二基)羰基(6s)-5-氮杂螺[2.4]庚烷-5,6-二基甲烷二基]二乙酸酯(5-4)
[0848]
将由上述工序2得到的化合物(5-3)(7.70g,10.8mmol)溶解于吡啶(20ml)和乙酸酐(10ml,105.9mmol)中,在室温下进行搅拌。减压蒸馏除去,得到了目标物质(5-4)(8.38g,97%)。
[0849]
ms(apci,esi)m/z:797(m h) .
[0850]
工序4:1,5-戊烷二基双[氧基(2-氨基-5-甲氧基苯-4,1-二基)羰基(6s)-
5-氮杂螺[2.4]庚烷-5,6-二基甲烷二基]二乙酸酯(5-5)。
[0851]
在由上述工序3得到的化合物(5-4)(8.28g,10.4mmol)的n,n-二甲基甲酰胺(100ml)溶液中,添加5%钯碳(54%水分,1.00g)之后,将反应溶液在氢气气氛下,在室温下剧烈地搅拌6小时。硅藻土过滤之后,将滤液减压蒸馏除去而得的残渣利用硅胶柱色谱法[氯仿:甲醇=100:0(v/v)~90:10(v/v)]进行精制,得到了目标物质(5-5)(5.05g,66%)。
[0852]
ms(apci,esi)m/z:737(m h) .
[0853]
工序5:{(6s)-5-[4-({5-[4-({(6s)-6-[(乙酰氧基)甲基]-5-氮杂螺[2.4]庚-5-基}羰基)-5-氨基-2-甲氧基苯氧基]戊基}氧基)-5-甲氧基-2-{[(丙-2-烯-1-基氧基)羰基]氨基}苯甲酰]-5-氮杂螺[2.4]庚-6-基}甲基乙酸酯(单烯丙基氧基羰基体)(5-6)。
[0854]
在由上述工序4得到的化合物(5-5)(5.05g,6.85mmol)的二氯甲烷(100ml)溶液中,添加吡啶(1.10ml,13.7mmol),在氮气气氛下,在-78℃添加氯甲酸烯丙酯(0.725ml,6.85mmol),搅拌2小时。将减压蒸馏除去而得的残渣利用硅胶柱色谱法[己烷:乙酸乙酯=70:30(v/v)~100:0(v/v),氯仿:甲醇=100:0(v/v)~90:10(v/v)]进行精制,得到了作为目标物质的单烯丙基氧基羰基体(5-6)(2.63g,47%)。
[0855]
ms(apci,esi)m/z:821(m h) .
[0856]
工序6:n-[(2-丙烯-1-基氧基)羰基]-l-缬氨酰-n-{4-[({[2-({(6s)-6-[(乙酰氧基)甲基]-5-氮杂螺[2.4]庚-5-基}羰基)-5-({5-[4-({(6s)-6-[(乙酰氧基)甲基]-5-氮杂螺[2.4]庚-5-基}羰基)-2-甲氧基-5-{[(2-丙烯-1-基氧基)羰基]氨基}苯氧基]戊基}氧基)-4-甲氧基苯基]氨基甲酰基}氧基)甲基]苯基}-l-丙氨酸酰胺(5-7)。
[0857]
使由上述工序5得到的单烯丙基氧基羰基体(5-6)(2.00g,2.44mmol)和n-[(丙-2-烯-1-基氧基)羰基]-l-缬氨酰-n-[4-(羟甲基)苯基]-l-丙氨酸酰胺(1.10g,2.92mmol,wo2011130598)与实施例2-1工序6同样地反应,得到了目标物质(5-7)(2.64g,89%)。
[0858]
ms(apci,esi)m/z:1224(m h) .
[0859]
工序7:n-[(2-丙烯-1-基氧基)羰基]-l-缬氨酰-n-[4-({[(2-{[(6s)-6-(羟甲基)-5-氮杂螺[2.4]庚-5-基]羰基}-5-{[5-(4-{[(6s)-6-(羟甲基)-5-氮杂螺[2.4]庚-5-基]羰基}-2-甲氧基-5-{[(2-丙烯-1-基氧基)羰基]氨基}苯氧基)戊基]氧基}-4-甲氧基苯基)氨基甲酰基]氧基}甲基)苯基]-l-丙氨酸酰胺(5-8)。
[0860]
在由上述工序6得到的化合物(5-7)(2.64g,2.16mmol)的甲醇(10ml)溶液中,添加碳酸钾(1.49g,10.8mmol),在室温下搅拌3小时。在反应混合物中添加饱和氯化铵水溶液(100ml),利用乙酸乙酯进行了提取。将有机层利用无水硫酸钠使其干燥。减压蒸馏除去,得到了目标物质(5-8)(2.21g,90%)。
[0861]
ms(apci,esi)m/z:1140(m h) .
[0862]
工序8:n-[(2-丙烯-1-基氧基)羰基]-l-缬氨酰-n-{4-[({[(11’s,11a’s)-11’-羟基-8’-{[5-({(11’s,11a’s)-11’-羟基-7’-甲氧基-5’-氧代-10’-[(2-丙烯-1-基氧基)羰基]-5’,10’,11’,11a’-四氢-1’h-螺[环丙烷-1,
2’-吡咯并[2,1-c][1,4]苯并二氮杂卓]-8’-基}氧基)戊基]氧基}-7’-甲氧基-5’-氧代-11’,11a’-二氢-1’h-螺[环丙烷-1,2’-吡咯并[2,1-c][1,4]苯并二氮杂卓]-10’(5’h)-基]羰基}氧基)甲基]苯基}-l-丙氨酸酰胺(5-9)。
[0863]
在由上述工序7得到的化合物(5-8)(2.03g,1.78mmol)的二氯甲烷(50ml)溶液中,添加戴斯-马丁氧化剂(1.59g,3.74mmol),在室温下搅拌一晚。在反应混合物中添加饱和碳酸氢钠水溶液(100ml),利用氯仿进行提取。将有机层利用无水硫酸钠使其干燥。将减压蒸馏除去而得的残渣利用硅胶柱色谱法[氯仿:甲醇=100:0(v/v)~90:10(v/v)]进行精制,得到了目标物质(5-9)(2.05g,定量的)。
[0864]
ms(apci,esi)m/z:1136(m h) .
[0865]
工序9:l-缬氨酰-n-{4-[({[(11’s,11a’s)-11’-羟基-7’-甲氧基-8’-[(5-{[(11a’s)-7’-甲氧基-5’-氧代-5’,11a’-二氢-1’h-螺[环丙烷-1,2’-吡咯并[2,1-c][1,4]苯并二氮杂卓]-8’-基]氧基}戊基)氧基]-5’-氧代-11’,11a’-二氢-1’h-螺[环丙烷-1,2’-吡咯并[2,1-c][1,4]苯并二氮杂卓]-10’(5’h)-基]羰基}氧基)甲基]苯基}-l-丙氨酸酰胺(5-10)。
[0866]
使由上述工序8得到的化合物(5-9)(2.05g,1.80mmol)与实施例2-3工序12同样地反应,得到了目标物质(5-10)(1.02g,60%)。
[0867]
ms(apci,esi)m/z:950(m h) .
[0868]
工序10:n-[4-(11,12-二脱氢二苯并[b,f]吖辛因-5(6h)-基)-4-氧代丁酰]甘氨酰甘氨酰-l-缬氨酰-n-{4-[({[(11’s,11a’s)-11’-羟基-7’-甲氧基-8’-[(5-{[(11a’s)-7’-甲氧基-5’-氧代-5’,11a’-二氢-1’h-螺[环丙烷-1,2’-吡咯并[2,1-c][1,4]苯并二氮杂卓]-8’-基]氧基}戊基)氧基]-5’-氧代-11’,11a’-二氢-1’h-螺[环丙烷-1,2’-吡咯并[2,1-c][1,4]苯并二氮杂卓]-10’(5’h)-基]羰基}氧基)甲基]苯基}-l-丙氨酸酰胺(5-11)。
[0869]
将由上述工序9得到的化合物(5-10)(0.710g,0.747mmol)以及由实施例2-2工序1得到的化合物(2-2)(0.313g,0.747mmol)溶解于二氯甲烷(1.5ml)和甲醇(0.1ml)的混合溶剂中。添加4-(4,6-二甲氧基-1,3,5-三嗪-2-基)-4-甲基吗啉氯化鎓(0.264g,0.897mmol),在室温下搅拌1小时。将减压蒸馏除去而得的残渣利用硅胶柱色谱法[氯仿:甲醇=100:0(v/v)~80:20(v/v)]进行精制,得到了目标物质(5-11)(0.671g,66%)。
[0870]
1h-nmr(dmso-d6)δ:9.91(1h,s),8.32(1h,s),8.23-7.91(3h,m),7.81-7.19(14h,m),7.04(1h,m),6.80-6.62(3h,m),5.77-5.75(1h,m),5.20(1h,m),5.01(1h,m),4.79(1h,m),4.46-4.35(1h,m),4.04(4h,m),3.86-3.38(18h,m),3.22-3.15(2h,m),2.67-2.63(1h,m),2.46-2.23(3h,m),2.09-1.91(2h,m),1.80-1.78(5h,m),1.57(3h,m),1.27(3h,s),1.11-1.04(1h,m),0.87-0.79(6h,m),0.63-0.55(6h,m).
[0871]
ms(apci,esi)m/z:1351(m h) .
[0872]
[实施例2-6:药物连接子4]
[0873][0874]
工序1:(6s)-5-[4-(苄氧基)-5-甲氧基-2-硝基苯甲酰]-5-氮杂螺[2.4]庚烷-6-羧酸甲酯(6-2)。
[0875]
在4-(苄氧基)-5-甲氧基-2-硝基苯甲酸(6-1)(6.07g,20.0mmol,tetrahedron 1995,51,5617)、n,n-二甲基甲酰胺(1.08ml,13.9mmol)的二氯甲烷(100ml)溶液中,在用冰冷却下,经5分钟滴加乙二酰氯(3.43ml,40.0mmol)。在室温下将反应溶液搅拌5小时之后,减压蒸馏除去,使所得的残渣溶解于二氯甲烷(20ml)中,进行了减压蒸馏除去。将该操作重复三次之后,使残渣悬浮于二氯甲烷(5ml),在其中添加过剩的二乙醚和己烷,过滤,在减压下,使其干燥,从而得到了粗制酰氯。使所得的酰氯溶解于二氯甲烷中,冷却至-40℃(干冰-乙腈浴),缓慢地添加甲基(6s)-5-氮杂螺[2.4]庚烷-6-羧酸酯盐酸盐(4.22g,22.0mmol,tetrahedron letters 2012.53.3847)、三乙胺(3.36ml,24.2mmol)。将反应混合物经一晚升温直至室温。在反应混合物中添加1当量盐酸,将反应混合物利用二氯甲烷进行提取。将有机层利用水、饱和碳酸氢钠水溶液和饱和盐水进行洗涤,利用无水硫酸钠进行干燥。将减压蒸馏除去而得的残渣利用硅胶柱色谱法[己烷:乙酸乙酯=100:0~50:50]进行精制,得到了目标物质(6-2)(6.55g,80%)。
[0876]
ms(apci,esi)m/z:441(m h)
[0877]
工序2:(11a’s)-8’-(苄氧基)-7’-甲氧基-1’h-螺[环丙烷-1,2’-吡咯并[2,1-c][1,4]苯并二氮杂卓]-5’,11’(10’h,11a’h)-二酮(6-3)。
[0878]
在由上述工序1得到的化合物(6-2)(6.55g,16.0mmol)的乙醇(150ml)、四氢呋喃(150ml)溶液中,在氮气气氛下,添加雷尼镍(7.00g)。在反应混合物中添加肼一水合物(7ml),缓慢升温直至50℃。在50℃搅拌2小时之后,添加雷尼镍(3.00g)、肼一水合物(3ml),搅拌1小时。在反应混合物中添加thf(100ml),硅藻土过滤。将减压蒸馏除去而得的残渣利用硅胶柱色谱法[己烷:乙酸乙酯=100:0~25:75]进行精制,得到了目标物质(6-3)(4.42g,73%)。
[0879]
ms(apci,esi)m/z:379(m h)
[0880]
工序3:(11a’s)-8’-(苄氧基)-7’-甲氧基-10’-{[2-(三甲基硅烷基)乙氧基]甲基}-1’h-螺[环丙烷-1,2’-吡咯并[2,1-c][1,4]苯并二氮杂卓]-5’,11’(10’h,11a’h)-二酮(6-4)。
[0881]
在-40℃,在由上述工序2得到的化合物(6-3)(10.0g,26.4mmol)的四氢呋喃(150ml)溶液中,缓慢地滴加2.6mol/l的正丁基锂正己烷溶液(12.0ml,31.8mmol)。将反应溶液在-40℃搅拌15分钟之后,缓慢地滴加2-(氯甲氧基)乙基三甲基硅烷(5.57ml,31.7mmol)。将反应溶液在室温下搅拌3小时之后,添加水,利用乙酸乙酯进行了提取。将有机层利用水和饱和盐水进行洗涤,利用无水硫酸钠进行干燥。将减压蒸馏除去而得的残渣利用硅胶柱色谱法[己烷:乙酸乙酯=100:0~30:70]进行精制,得到了目标物质(6-4)(11.8g,88%)。
[0882]
ms(apci,esi)m/z:509(m h)
[0883]
工序4:(11a’s)-8’-羟基-7’-甲氧基-10’-{[2-(三甲基硅烷基)乙氧基]甲基}-1’h-螺[环丙烷-1,2’-吡咯并[2,1-c][1,4]苯并二氮杂卓]-5’,11’(10’h,11a’h)-二酮(6-5)。
[0884]
在由上述工序3得到的化合物(6-4)(18.7g,36.8mmol)的四氢呋喃(50ml),乙醇(100ml)溶液中,在氮气气氛下,添加5%的钯碳催化剂(5.00g)。直接将氮气球更换为氢气球,将反应混合物在氢气气氛下搅拌6小时。在反应混合物中添加氯仿进行稀释,进行硅藻土过滤之后,将滤液减压蒸馏除去而得的残渣利用硅胶柱色谱法[己烷:乙酸乙酯=100:0~25:75]进行精制,得到了目标物质(6-5)(15.1g,98%)。
[0885]
ms(apci,esi)m/z:419(m h)
[0886]
工序5:(11a’s)-8’-[(5-溴戊基)氧基]-7’-甲氧基-10’-{[2-(三甲基硅烷基)乙氧基]甲基}-1’h-螺[环丙烷-1,2’-吡咯并[2,1-c][1,4]苯并二氮杂卓]-5’,11’(10’h,11a’h)-二酮(6-6)。
[0887]
使由上述工序4得到的化合物(6-5)(2.77g,6.62mmol)与实施例2-3工序2同样地反应,得到了目标物质(6-6)(3.31g,88%)。
[0888]
1h-nmr(cdcl3)δ:7.36(1h,s),7.25(1h,s),5.55(1h,m),4.65(1h,m),4.24-4.23(1h,m),4.11-4.03(2h,m),3.93(3h,s),3.85-3.78(1h,m),3.72-3.69(2h,m),3.46-3.39(3h,m),2.47-2.44(1h,m),2.25-2.22(1h,m),1.95-1.91(4h,m),1.67-1.59(1h,m),1.03-0.95(2h,m),0.90-0.85(1h,m),0.70-0.66(4h,m),0.05(9h,s).
[0889]
工序6:(11a’s)-8’-[(5-溴戊基)氧基]-7’-甲氧基-1’,11a’-二氢-5’h-螺[环丙烷-1,2’-吡咯并[2,1-c][1,4]苯并二氮杂卓]-5’-酮(6-7)。
[0890]
使由上述工序5得到的化合物(6-6)(3.31g,5.83mmol)与实施例2-3工序7同样地反应,得到了目标物质(6-7)(1.11g,45%)。
[0891]
1h-nmr(cdcl3)δ:7.81(1h,m),7.53(1h,s),6.82(1h,s),4.13-4.06(2h,m),3.97(3h,s),3.88-3.83(1h,m),3.69(1h,m),3.52-3.39(3h,m),2.55-2.52(1h,m),2.06-1.89(5h,m),1.67-1.63(2h,m),0.76-0.72(4h,m).
[0892]
工序7:(11a’s)-8’-[(5-溴戊基)氧基]-7’-甲氧基-1’,10’,11’,11a’-四氢-5’h-螺[环丙烷-1,2’-吡咯并[2,1-c][1,4]苯并二氮杂卓]-5’-酮(6-8)。
[0893]
使由上述工序6得到的化合物(6-7)(2.56g,6.08mmol)与实施例2-3工序8同样地反应,得到了目标物质(6-8)(1.15g,45%)。
[0894]
1h-nmr(cdcl3)δ:7.60(1h,s),6.07(1h,s),4.11-4.04(1h,m),3.99(2h,m),3.87-3.84(1h,m),3.85(3h,s),3.73(1h,m),3.58-3.53(2h,m),3.47-3.42(3h,m),2.03-1.78(6h,m),1.65-1.63(2h,m),0.77-0.56(4h,m).
[0895]
工序8:丙-2-烯-1-基(11a’s)-8’-[(5-溴戊基)氧基]-7’-甲氧基-5’-氧代-11’,11a’-二氢-1’h-螺[环丙烷-1,2’-吡咯并[2,1-c][1,4]苯并二氮杂卓]-10’(5’h)-羧酸酯(6-9)。
[0896]
使由上述工序7得到的化合物(6-8)(1.15g,2.72mmol)与实施例2-3工序9同样地反应,得到了目标物质(6-9)(1.14g,82%)。
[0897]
1h-nmr(cdcl3)δ:7.23(1h,s),6.69(1h,s),5.79(1h,s),5.13-5.10(2h,m),4.68-4.66(1h,m),4.48-4.45(2h,m),4.01(2h,m),3.92(3h,s),3.76(1h,m),3.54-3.37(3h,m),2.39(1h,m),1.95-1.90(4h,m),1.68-1.61(3h,m),1.44(1h,m),0.75-0.66(4h,m).
[0898]
工序9:n-[(丙-2-烯-1-基氧基)羰基]-l-缬氨酰-n-{4-[({[(11’s,11a’s)-11’-{[叔丁基(二甲基)硅烷基]氧基}-7’-甲氧基-8’-{[5-({(11a’s)-7’-甲氧基-5’-氧代-10’-[(丙-2-烯-1-基氧基)羰基]-5’,10’,11’,11a’-四氢-1’h-螺[环丙烷-1,2’-吡咯并[2,1-c][1,4]苯并二氮杂卓]-8’-基}氧基)戊基]氧基}-5’-氧代-11’,11a’-二氢-1’h-螺[环丙烷-1,2’-吡咯并[2,1-c][1,4]苯并二氮杂卓]-10’(5’h)-基]羰基}氧基)甲基]苯基}-l-丙氨酸酰胺(6-10)。
[0899]
使由上述工序8得到的化合物(6-9)(0.374g,0.737mmol)以及由实施例2-1工序10得到的化合物(1-11)(0.452g,0.56mmol)与实施例2-3工序10同样地反应,得到了目标物质(6-10)(0.589g,65%)。
[0900]
ms(apci,esi)m/z:1234(m h)
[0901]
工序10:n-[(丙-2-烯-1-基氧基)羰基]-l-缬氨酰-n-{4-[({[(11’s,11a’s)-11’-羟基-7’-甲氧基-8’-{[5-({(11a’s)-7’-甲氧基-5’-氧代-10’-[(丙-2-烯-1-基氧基)羰基]-5’,10’,11’,11a’-四氢-1’h-螺[环丙烷-1,2’-吡咯并[2,1-c][1,4]苯并二氮杂卓]-8’-基}氧基)戊基]氧基}-5’-氧代-11’,11a’-二氢-1’h-螺[环丙烷-1,2’-吡咯并[2,1-c][1,4]苯并二氮杂卓]-10’(5’h)-基]羰基}氧基)甲基]苯基}-l-丙氨酸酰胺(6-11)。
[0902]
使由上述工序9得到的化合物(6-10)(0.589g,0.477mmol)与实施例2-3工序11同样地反应,得到了目标物质(6-11)(0.382g,71%)。
[0903]
1h-nmr(cdcl3)δ:8.90(1h,s),7.55(2h,m),7.25-7.21(2h,m),6.74(2h,m),6.38(1h,s),5.90-5.87(5h,m),5.33-5.09(8h,m),4.66-4.60(8h,m),3.98-3.91(10h,m),3.77-3.30(12h,m),2.42-2.36(2h,m),1.77-1.39(6h,m),0.91-0.70(14h,m).
[0904]
工序11:l-缬氨酰-n-{4-[({[(11’s,11a’s)-11’-羟基-7’-甲氧基-8’-[(5-{[(11a’s)-7’-甲氧基-5’-氧代-5’,10’,11’,11a’-四氢-1’h-螺[环丙烷-1,2’-吡咯并[2,1-c][1,4]苯并二氮杂卓]-8’-基]氧基}戊基)氧基]-5’-氧代-11’,11a’-二氢-1’h-螺[环丙烷-1,2’-吡咯并[2,1-c][1,4]苯并二氮杂卓]-
10’(5’h)-基]羰基}氧基)甲基]苯基}-l-丙氨酸酰胺(6-12)。
[0905]
使由上述工序10得到的化合物(6-11)(0.382g,0.341mmol)与实施例2-3工序12同样地反应,得到了目标物质(6-12)(0.200g,62%)。
[0906]
ms(apci,esi)m/z:952(m h)
[0907]
工序12:n-[4-(11,12-二脱氢二苯并[b,f]吖辛因-5(6h)-基)-4-氧代丁酰]甘氨酰甘氨酰-l-缬氨酰-n-{4-[({[(11’s,11a’s)-11’-羟基-7’-甲氧基-8’-[(5-{[(11a’s)-7’-甲氧基-5’-氧代-5’,10’,11’,11a’-四氢-1’h-螺[环丙烷-1,2’-吡咯并[2,1-c][1,4]苯并二氮杂卓]-8’-基]氧基}戊基)氧基]-5’-氧代-11’,11a’-二氢-1’h-螺[环丙烷-1,2’-吡咯并[2,1-c][1,4]苯并二氮杂卓]-10’(5’h)-基]羰基}氧基)甲基]苯基}-l-丙氨酸酰胺(6-13)。
[0908]
使由上述工序11得到的化合物(6-12)(0.0560g,0.0588mmol)以及由实施例2-2工序1得到的化合物(2-2)(0.022g,0.053mmol)与实施例2-3工序13同样地反应,得到了目标物质(6-13)(0.0500g,63%)。
[0909]
ms(apci,esi)m/z:1354(m h)
[0910]
〔糖链供体的合成〕
[0911]
实施例3:[n3-peg(3)]-msg1-ox
[0912][0913]
工序1:(msg1-)asn
[0914]
将作为市售品的monosialo-asn free(1s2g/1g2s-10nc-asn,(株)糖链工学研究所制)(称为“(msg-)asn”)(500mg)在下述的条件下进行反相hplc分离精制,分离出作为第一主峰溶出的(msg1-)asn(保留时间15~19分钟附近)和作为第二主峰溶出的(msg2-)asn(保留时间21~26分钟附近)。使用0.1%甲酸水溶液作为洗脱液,装置使用els-pda触发分取系统(日本分光株式会社制),柱使用inertsil ods-3(10um,30φx250mm,glsciences公司制),流速为30ml/min。分离溶出中被uv检测(210nm)出的最初的峰的峰,进行冷冻干燥,得到了目标物质(238mg)。
[0915]
工序2:msg1
[0916]
使由上述工序1得到的化合物(229mg)溶解于200mm磷酸缓冲溶液(ph6.25)(1145μl)中,添加endom(东京化成工业(株)制,1u/ml))水溶液(100μl),在35℃保温6天。反应结束后,使用vivaspin 15r(hydrosart膜,30k,6000xg)将反应液进行超滤,将所得的通过液体进行了反相hplc分离精制。使用0.1%三氟乙酸水溶液作为洗脱液,装置使用els-pda触发分取系统(日本分光株式会社制),柱使用inertsil ods-3(glsciences公司制)。分离溶出
中被uv检测(210nm)出的目标物质的峰,进行冷冻干燥,得到了目标物质(117mg)。
[0917]
工序3:[n3-peg(3)]-msg1
[0918]
在5ml取样管((株)ina optika)中,添加11-叠氮基-3,6,9-三氧杂十一烷-1-胺(0.108ml,0.541mmol)以及由上述工序2得到的msg1(117mg,0.068mmol)的水溶液(1.2ml),搅拌1小时之后,进行冷冻干燥。在冷冻干燥后的5ml取样管中,添加o-(7-氮杂苯并三唑-1-基)-n,n,n’,n’-四甲基脲鎓六氟磷酸酯(103mg,0.27mmol)的n,n-二甲基甲酰胺溶液(1.2ml)和二异丙基乙基胺(0.046ml,0.27mmol),在37℃搅拌3小时。反应结束后,在预先添加有二乙醚(20ml)的离心管(50ml)中转移反应液。利用小型离心机(日立工机,cf16rx),使固体物质沉淀,除去上清液。进一步添加二乙醚(10ml),离心分离操作后,进行倾析。接着,添加乙腈(10ml),离心分离后,将倾析的操作重复两次之后,减压下干燥,得到了粗生成物。将所得的固体物质以与上述工序2同样的条件进行反相hplc精制,得到了目标物质(94.2mg)。
[0919]
工序4:[n3-peg(3)]-msg1-ox
[0920]
在5ml取样管((株)ina optika制)中,添加由上述工序3合成的化合物(100mg),2-氯-1,3-二甲基-1h-苯并咪唑-3-鎓-氯化物(伏见制药所制,56mg,0.257mmol)的水溶液(520μl)。在用冰冷却后的反应液中添加磷酸三钾(165mg,0.78mmol)的水溶液(520μl),用冰冷却下,搅拌3小时。使用amicon ultra(ultracel 30k,merck millipore制)将所得的反应液进行超滤,除去固体物质。将该通过液体利用凝胶过滤色谱法进行精制。装置使用purif-rp2(昭光scientific制),柱使用hiprep 26/10desalting(ge health care制),流动相使用0.03%-nh3水溶液,使流速为10ml/min,使分级容量为10ml。将包含溶出中被uv检测(220nm)出的目标物质的馏分收集为一个,添加1n氢氧化钠水溶液(104μl,0.104mmol),进行冷冻干燥,得到了目标物质(84mg)。
[0921]
实施例4:[n3-peg(3)]-msg-ox
[0922][0923]
工序1:(msg-)asn的制备
[0924]
使作为市售品的1s2g/1g2s-10nc-asn-fmoc((株)糖链工学研究所制)(称为“fmoc-(msg-)asn”)(1000mg)溶解于乙醇/水(1/1)(10ml),添加1当量的氢氧化钠水溶液(1.75ml,4当量),在室温下搅拌3小时。反应结束后,使用amicon ultra(30k,millipore公司制)将反应液进行超滤,除去固体物质,在所得的通过液体中添加1n盐酸(832μl,1.9当量)。使用高速浓缩装置v-10(biotage公司制),除去溶剂。添加乙腈,使用高速浓缩装置v-10(biotage公司制),除去溶剂之后,进行反相hplc分离精制。将0.1%三氟乙酸水溶液和0.1%三氟乙酸乙腈溶液作为洗脱液,装置使用purif-rp2(昭光scientific制),柱使用inertsil ods-3(glsciences制)。将包含溶出中被uv检测(220nm)出的目标物质的馏分收集为一个,进行冷冻干燥。再次使其溶解于纯水时,则利用ph试纸确认为酸性,由此添加18%氨水(150μl),利用ph试纸确认成为碱性,再次进行冷冻干燥。将所得的目标物质(840mg)直接用于接下来的反应。
[0925]
工序2:msg的合成
[0926]
使由工序1得到的化合物(840mg)溶解于200mm磷酸缓冲溶液(ph6.25)(6000μl),添加endom(东京化成工业(株)制,1u/ml))水溶液(200μl),在28℃保温26小时。反应没有结束,因此添加endom(东京化成工业(株)制,1u/ml))水溶液(50μl),在28℃保温2小时之后,在室温下放置直至反应结束。反应结束后,使用amicon ultra(30k,millipore公司制)将反应液进行超滤。在所得的通过液体中添加三氟乙酸(80μl),进行反相hplc分离精制。将0.1%三氟乙酸水溶液和0.1%三氟乙酸乙腈溶液作为洗脱液,装置使用purif-rp2(昭光scientific制),柱使用inertsil ods-3(glsciences制)。将包含溶出中被uv检测(220nm)
出的目标物质的馏分收集为一个,进行冷冻干燥。以除去残留三氟乙酸为目的,使其再次溶解于纯水,得到作为无色固体的目标化合物(618mg)。
[0927]
esi-ms:c
66
h
110
n4o
49
:[m h]
理论值1743.62,实测值1743.63
[0928]
工序3:[n3-peg(3)]-msg的合成
[0929]
使用由上述工序2得到的化合物(120mg),按照与实施例3工序3同样的手法,得到了目标物质(88.6mg)。
[0930]
esi-ms:c
73
h
124
n8o
51
:[m 2h]
2
理论值965.37,实测值965.37
[0931]
工序4[n3-peg(3)]-msg-ox的合成
[0932]
使用由上述工序3得到的合成的化合物(100mg),按照与实施例3工序4同样的手法,得到了目标物质(88mg)。
[0933]
实施例5:[n3-peg(3)]2-sg(10)-ox
[0934][0935]
工序1:[n3-peg(3)]2-sg(10)
[0936]
在5ml取样管((株)inaoptika)中,添加11-叠氮基-3,6,9-三氧杂十一烷-1-胺(0.096ml,0.485mmol)、二唾液酸八糖(50mg,0.24mmol)的水溶液(0.5ml),搅拌1小时之后,进行冷冻干燥。在冷冻干燥后的5ml取样管中,添加o-(7-氮杂苯并三唑-1-基)-n,n,n’,n’-四甲基脲鎓六氟磷酸酯(92mg,0.24mmol)的n,n-二甲基甲酰胺溶液(0.6ml)和二异丙基乙基胺(0.042ml,0.24mmol),在37℃搅拌4小时。反应结束后,在预先添加有二乙醚(20ml)的离心管(50ml)中转移反应液。利用小型离心机(日立工机,cf16rx),使固体物质沉淀,除去上清液。添加二乙醚(20ml),进行了倾析。接着,添加乙腈(20ml),进行了倾析之后,减压下干燥,得到了粗生成物。使所得的固体物质溶解于适量的0.2%三氟乙酸水溶液中,进行反相hplc分离精制。将0.1%三氟乙酸水溶液和0.1%三氟乙酸乙腈溶液作为洗脱液,装置使用purif-rp2(昭光scientific制),柱使用inertsil ods-3(glsciences制)。将包含溶出中被uv检测(220nm)出的目标物质的馏分收集为一个,进行冷冻干燥,得到了目标物质(42mg)。
[0937]
工序2:[n3-peg(3)]2-sg(10)-ox
[0938]
在5ml取样管((株)inaoptika制)中,添加由上述工序1合成的化合物(40mg)、2-氯-1,3-二甲基-1h-苯并咪唑-3-鎓-氯化物(伏见制药所制,17.9mg,0.083mmol)的水溶液(200μl)。在用冰冷却后的反应液中添加磷酸三钾(52.6mg,0.25mmol)的水溶液(200μl),在用冰冷却下搅拌2小时。使用amicon ultra(ultracel 30k,merck millipore制)将
所得的反应液进行超滤,除去固体物质。将该通过液体利用凝胶过滤色谱法进行精制。装置使用purif-rp2(昭光scientific制),柱使用hiprep 26/10desalting(ge health care制),流动相使用0.03%-nh3水溶液,使流速为10ml/min,使分级容量为10ml。将包含溶出中被uv检测(220nm)出的目标物质的馏分收集为一个,添加1n氢氧化钠水溶液(33μl,0.033mmol),进行冷冻干燥,得到了目标物质(34mg)。
[0939]
〔糖链重构抗体的制备〕
[0940]
实施例6:曲妥珠单抗a1或a2抗体-[msg1-n3]2[0941][0942]
工序1:(fucα1,6)glcnac-曲妥珠单抗a1抗体的制备
[0943]
在由实施例1-3制备的曲妥珠单抗a1抗体溶液ca.22.3mg/ml(50mm磷酸缓冲液(ph6.0))(2.69ml)中,添加0.156ml的7.7mg/ml野生型endos溶液(pbs),在37℃保温4小时。使用experion电泳工作站(bio-rad制)确认反应的进行程度。反应结束后,按照下述的方法,进行利用亲和色谱法的精制和利用羟基磷灰石柱的精制。
[0944]
(1)利用亲和色谱法的精制
[0945]
精制装置:akta avant(ge health care制)。
[0946]
柱:hitrap rprotein a ff(5ml)(ge health care制)。
[0947]
流速:5ml/min(充电时为1.25ml/min)。
[0948]
将由上述得到的反应液分成多次进行精制。与柱结合时,将反应液添加至柱上部,以1.25ml/min通入结合缓冲液(20mm磷酸缓冲液(ph6.0))4cv(column volume),进一步以5ml/min通过5cv。在中间洗涤时,通入洗涤溶液(20mm磷酸缓冲液(ph7.0)、0.5m氯化钠溶液)15cv。溶出时,通入溶出缓冲液(immunopure igg eution buffer,pierce制)6cv。将溶出液利用1m tris缓冲液(ph9.0)直接中和。对于包含目标物质的馏分,使用共通操作c,进行与5mm磷酸缓冲液50mm-吗啉代乙烷磺酸(mes)溶液(ph6.8)的缓冲液交换。
[0949]
(2)利用羟基磷灰石色谱法的精制
[0950]
精制装置:akta avant(ge health care制)
[0951]
柱:bio-scale mini cht type i cartridge(5ml)(bio-rad制)
[0952]
流速:5ml/min(充电时为1.25ml/min)
[0953]
将由上述(1)得到的溶液添加至柱的上部,以1.25ml/min通入a液(5mm磷酸缓冲液50mm-吗啉代乙烷磺酸(mes)溶液(ph6.8))4cv,进一步以5ml/min通入3cv。然后,使用a液和b液(5mm磷酸缓冲液50mm-吗啉代乙烷磺酸(mes)溶液(ph6.8),2m氯化钠溶液),进行溶
[0965][0966]
工序1:(fucα1,6)glcnac-hwtl05抗体的制备
[0967]
使用由实施例1-3制备的抗hwtl05抗体溶液ca.24.5mg/ml(50m磷酸缓冲溶液(ph6.0))(3.00ml),进行与上述实施例6工序1同样的操作,得到了20.39mg/ml的(fucα1,6)glcnac-hwtl05抗体溶液(50mm磷酸缓冲液(ph6.0))(2.8ml)。
[0968]
工序2:hwtl05抗体-[msg1-n3]2的制备
[0969]
使用由上述工序1得到的20.39mg/ml(fucα1,6)glcnac-hwtl05抗体溶液(50mm磷酸缓冲液(ph6.0))(2.1ml),进行与实施例6工序2同样的操作,从而得到了10.04mg/ml hwtl05抗体-[msg1-n3]2溶液(磷酸缓冲生理盐水(ph6.0))(4.0ml)。
[0970]
〔adc的合成〕
[0971]
实施例9:adc1
[0972]
adc1如下述反应式所示那样,通过将由实施例6工序2得到的抗体与由实施例2-3得到的药物连接子1(3-14)进行偶联来合成。式中,r表示实施例所使用的药物连接子。
[0973]
[0974][0975]
(由实施例9工序1得到的化合物具有三唑环的几何异构体,将由作为上述r表示的两种结构形成的药物连接子进行混合来保持。)
[0976]
工序1:抗体与药物连接子的偶联
[0977]
在室温下,在由实施例6工序2得到的抗体的磷酸缓冲生理盐水(ph6.0)溶液(10.0mg/ml,0.40ml)中,添加1,2-丙烷二醇(0.767ml)、由实施例2-3工序13得到的化合物(3-14)的10mm二甲亚砜溶液(0.033ml;相对于抗体一分子为12当量),使用管旋转器(mtr-103,as one株式会社),在室温下反应48小时。
[0978]
精制操作:对于上述溶液,使用后述共通操作d,进行精制,得到具有目标化合物的溶液7.00ml。
[0979]
特性评价:使用共通操作e、f,得到了下述特性值。
[0980]
抗体浓度:0.48mg/ml,抗体产量:3.39mg(85%),每一分子抗体的平均药物结合数(n):1.7。
[0981]
实施例10:adc2
[0982]
adc2如下述反应式所示那样,通过将由实施例7工序2得到的抗体与由实施例2-3工序13得到的药物连接子1(3-14)进行偶联来合成。式中,r表示实施例所使用的药物连接子。
[0983][0984]
(由实施例10工序1得到的化合物具有三唑环的几何异构体,将由作为上述r表示的两种结构形成的药物连接子进行混合来保持。)
[0985]
工序1:抗体与药物连接子的偶联
[0986]
在室温下,在由实施例7工序2得到的抗体的磷酸缓冲生理盐水(ph6.0)溶液(10.0mg/ml,400μl)中,添加1,2-丙烷二醇(200μl)、由实施例2-3工序13得到的化合物(3-14)的10mm n,n-二甲基甲酰胺溶液(33.1μl;相对于抗体一分子为12当量)以及1,2-丙烷二醇(167μl)的混合溶液,使用管旋转器(mtr-103,as one株式会社),在室温下,反应48小时。
[0987]
精制操作:对于上述溶液,使用共通操作d,进行精制,得到具有目标化合物的溶液2.5ml。
[0988]
特性评价:使用共通操作e、f,得到了下述特性值。
[0989]
抗体浓度:1.08mg/ml,抗体产量:2.71mg(68%),每一分子抗体的平均药物结合数(n):1.9。
[0990]
实施例11:adc3
[0991]
adc3如下述反应式所示那样,通过将由实施例8工序2得到的抗体与由实施例3工序13得到的药物连接子1(3-14)进行偶联来合成。式中,r表示实施例所使用的药物连接子。
[0992][0993]
(由实施例11工序1得到的化合物具有三唑环的几何异构体,将由作为上述r表示的两种结构形成的药物连接子进行混合来保持。)
[0994]
工序1:抗体与药物连接子的偶联
[0995]
在室温下,在由实施例8工序2得到的抗体的磷酸缓冲生理盐水(ph6.0)溶液(10.04mg/ml,0.400ml)中,添加1,2-丙烷二醇(0.367ml)、由实施例2-3工序13得到的化
合物(3-14)的10mm二甲亚砜溶液(0.033ml;相对于抗体一分子为12当量),使用管旋转器(mtr-103,as one株式会社),在室温下,反应48小时。
[0996]
精制操作:对于上述溶液,使用共通操作d,进行精制,得到具有目标化合物的溶液2.50ml。
[0997]
特性评价:使用共通操作e、f,得到了下述特性值。
[0998]
抗体浓度:0.89mg/ml,抗体产量:2.22mg(55%),每一分子抗体的平均药物结合数(n):1.8。
[0999]
实施例12:adc4和adc5
[1000]
adc4通过将由实施例6工序2得到的曲妥珠单抗a2抗体-[msg1-n3]2与由实施例2-3得到的药物连接子1(3-14)进行偶联来合成。式中,r表示实施例所使用的药物连接子。
[1001]
[1002][1003]
(由实施例12工序1得到的化合物具有三唑环的几何异构体,将由作为上述r表示的两种结构形成的药物连接子进行混合来保持。)
[1004]
工序1-1:抗体与药物连接子的偶联(adc4)
[1005]
在室温下,在由实施例6工序2得到的曲妥珠单抗a2抗体-[msg1-n3]2(重链氨基酸序列:序列号31,轻链氨基酸序列:序列号32)的磷酸缓冲生理盐水(ph6.0)溶液(10.0mg/ml,0.50ml)中,添加1,2-丙烷二醇(0.486ml)、由实施例2-3工序13得到的化合物(3-14)的10mm二甲亚砜溶液(0.014ml;相对于抗体一分子为4当量),使用管旋转器(mtr-103,as one株式会社),在室温下,反应40小时。
[1006]
精制操作:对于上述溶液,使用后述共通操作d,进行精制,得到具有目标化合物的溶液2.50ml。
[1007]
特性评价:使用共通操作e、f,得到了下述特性值。
[1008]
抗体浓度:1.12mg/ml,抗体产量:2.80mg(56%),每一分子抗体的平均药物结合数(n):1.8。
[1009]
工序1-2:抗体与药物连接子的偶联(adc5)
[1010]
在室温下,在由实施例6工序2得到的曲妥珠单抗a2抗体-[msg1-n3]2(重链氨基酸序列:序列号31,轻链氨基酸序列:序列号32)的磷酸缓冲生理盐水(ph6.0)溶液(10.0mg/ml,0.50ml)中,添加1,2-丙烷二醇(0.486ml)、由实施例2-3工序13得到的化合物(3-14)的10mm二甲亚砜溶液(0.014ml;相对于抗体一分子为12当量),使用管旋转器(mtr-103,as one株式会社),在室温下反应40小时。
[1011]
精制操作:对于上述溶液,使用后述共通操作d,进行精制,得到具有目标化合物的溶液2.50ml。
[1012]
特性评价:使用共通操作e、f,得到了下述特性值。
[1013]
抗体浓度:1.13mg/ml,抗体产量:2.82mg(56%),每一分子抗体的平均药物结合数
(n):1.8。
[1014]
实施例13:抗体-药物偶联物的细胞增殖阻碍试验(1)
[1015]
将作为her2抗原阳性细胞的人乳腺癌株的kpl-4细胞(川崎医科大学、红林淳一,british journal of cancer,(1999)79(5/6).707-717)在包含10%的胎牛血清(hyclone)的rpmi1640 medium(thermo fisher scientific;以下,rpmi培养基)中以成为6.25
×
103cells/ml的方式进行制备,在96孔细胞培养用微孔板中各添加80μl。细胞添加后,在37℃,5%co2下培养一晚。
[1016]
第二天,在rpmi培养基中将稀释成100nm、20nm、4nm、0.8nm、0.16nm、0.032nm、6.4pm、1.3pm、0.26pm的抗her2抗体-药物偶联物adc1、adc2、adc3在微孔板上各添加20μl。在抗体-药物偶联物未添加孔中添加rpmi培养基各20μl。kpl-4在37℃,5%co2下培养6天。培养后,将微孔板从培养箱中取出,在室温下静置30分钟。添加与培养液等量的celltiter-glo luminescent cell viability assay(promega),利用板混合机进行搅拌。在室温下,静置10分钟之后,利用酶标仪(perkinelmer)计测发光量。
[1017]
活细胞率由下式算出。
[1018]
活细胞率(%)=a
÷
b
×
100
[1019]
a:被验物质添加孔的发光量的平均值。
[1020]
b:培养基添加孔的发光量的平均值。
[1021]
ic
50
值由下式算出。
[1022]
ic
50
(nm)=antilog((50-d)
×
(log
10
(b)-log
10
(a))
÷
(d-c) log
10
(b))
[1023]
a:被验物质的浓度a。
[1024]
b:被验物质的浓度b。
[1025]
c:添加浓度a的被验物质时的活细胞率。
[1026]
d:添加浓度b的被验物质时的活细胞率
[1027]
a、b在夹持活细胞率50%的2点中a>b。
[1028]
相对于kpl-4细胞,抗体-药物偶联物adc1、adc2显示出0.001<ic50<0.01(nm)的抗细胞效果,adc3显示出0.01<ic
50
<0.1(nm)的抗细胞效果。
[1029]
实施例14:抗体-药物偶联物的细胞增殖阻碍试验(2)
[1030]
将作为her2抗原阳性细胞的人乳腺癌株的jimt-1细胞(deutsche sammlung von mikroorganismen und zellkulturen gmbh;dsmz acc 589))在包含10%的胎牛血清(hyclone)的dmem medium(thermo fisher scientific;以下,dmem培养基)中以成为1.3
×
104cells/ml的方式进行制备,在96孔细胞培养用微孔板中各添加80μl。细胞添加后,在37℃,5%co2下培养一晚。
[1031]
第二天,在dmem培养基中将稀释成100nm、20nm、4nm、0.8nm、0.16nm、0.032nm、6.4pm、1.3pm、0.26pm的抗her2抗体-药物偶联物adc1、adc2、adc3在微孔板上各添加20μl。在抗体-药物偶联物未添加孔中添加dmem培养基各20μl。jimt-1在37℃,5%co2下培养6天。培养后,将微孔板从培养箱中取出,在室温下静置30分钟。添加与培养液等量的celltiter-glo luminescent cell viability assay(promega),利用板混合机进行搅拌。在室温下,静置10分钟之后,利用酶标仪(perkinelmer)计测发光量。使用与实施例13相同的式子,算出活细胞率。
[1032]
相对于jimt-1细胞,抗体-药物偶联物adc1、adc2显示出0.1<ic
50
<1(nm)的抗细胞效果,adc3显示出1<ic
50
<10(nm)的抗细胞效果。
[1033]
实施例15:抗体-药物偶联物的细胞增殖阻碍试验(3)
[1034]
将作为her2抗原阳性细胞的人乳腺癌株的kpl-4细胞(川崎医科大学、红林淳一,british journal of cancer,(1999)79(5/6).707-717)在包含10%的胎牛血清(hyclone)的rpmi1640 medium(thermo fisher scientific;以下,rpmi培养基)中以成为6.25
×
103cells/ml的方式进行制备,在96孔细胞培养用微孔板中各添加80μl。细胞添加后,在37℃,5%co2下培养一晚。
[1035]
第二天,在rpmi培养基中将稀释成100nm、20nm、4nm、0.8nm、0.16nm、0.032nm、6.4pm、1.3pm、0.26pm的抗her2抗体-药物偶联物adc4在微孔板上各添加20μl。在抗体-药物偶联物未添加孔中添加rpmi培养基各20μl。kpl-4在37℃,5%co2下培养6天。培养后,将微孔板从培养箱中取出,在室温下静置30分钟。添加与培养液等量的celltiter-glo luminescent cell viability assay(promega),利用板混合机进行搅拌。在室温下,静置10分钟之后,利用酶标仪(perkinelmer)计测发光量。使用与实施例13相同的式子,算出活细胞率。
[1036]
相对于kpl-4细胞,抗体-药物偶联物adc4显示出0.001<ic
50
<0.01(nm)的抗细胞效果。
[1037]
实施例16:抗体-药物偶联物的抗肿瘤试验(1)
[1038]
将小鼠:4~5周龄的雌balb/c无胸腺裸鼠(日本charles river)在实验使用前,在spf条件下驯化4~7天。小鼠喂食灭菌的固形饲料(fr-2,funabashi farms co.,ltd),给予灭菌的自来水(添加5~15ppm次氯酸钠溶液来制备)。
[1039]
测定、计算式:在全部研究中,将肿瘤的长径和短径利用电子式数字卡尺(cd-15cx,mitutoyo corp.)一周测定2~3次,计算肿瘤体积(mm3)。计算式如下所示。
[1040]
肿瘤体积(mm3)=长径(mm)
×
[短径(mm)]2×
1/2
[1041]
抗体-药物偶联物和抗体全都用10mm-acetate buffer,5%sorbitol,ph5.5(nacalai tesque株式会社;abs缓冲液)进行稀释,将10ml/kg的液量给药至尾静脉内。此外,作为对照组(vehicle组),同样地给药abs缓冲液。
[1042]
将kpl-4细胞(川崎医科大学、红林淳一,british journal of cancer,(1999)79(5/6).707-717)悬浮于dulbecco’s phosphate buffered saline(sigma-aldrich)中,将1.5
×
107cells皮下移植至雌无胸腺裸鼠的右体侧部(day0),在day14,任选地实施分组。将抗her2抗体-药物偶联物adc1或adc2在day14,以0.33mg/kg的用量给药至尾静脉内。此外,作为对照组(vehicle组),同样地给药abs缓冲液。
[1043]
将结果示于图18中。抗her2抗体-药物偶联物adc1、adc2以0.33mg/kg给药都显示出肿瘤增殖抑制效果。此外,肿瘤增殖抑制效果的强度依次为adc2、adc1。都不能确认到抗her2抗体-药物偶联物adc1、adc2由0.33mg/kg给药带来的小鼠的体重减少。
[1044]
实施例17:抗体-药物偶联物的抗肿瘤试验(2)
[1045]
将jimt-1细胞(dsmz acc 589)悬浮于生理盐水(株式会社大塚制药工场)中,将5
×
106cells皮下移植至雌无胸腺裸鼠的右体侧部(day0),在day11,任选地实施分组。将抗her2抗体-药物偶联物adc1、或adc2在day11以0.4mg/kg的用量给药至尾静脉内。此外,作
为对照组(vehicle组),同样地给药abs缓冲液。
[1046]
将结果示于图19中。确认到抗her2抗体-药物偶联物adc1或adc2在0.4mg/kg给药时伴随肿瘤萎缩的强烈的抗肿瘤效果。此外,任一给药用量时,都不能确认到由抗her2抗体-药物偶联物adc1、或adc2给药带来的小鼠的体重减少。
[1047]
实施例18:抗体-药物偶联物的抗肿瘤试验(3)
[1048]
将cfpac-1细胞(american type culture collection;atcc crl-1918)悬浮于生理盐水(株式会社大塚制药工场)中,将5
×
106cells皮下移植至雌无胸腺裸鼠的右体侧部(day0),在day10,任选地实施分组。将抗her2抗体-药物偶联物adc1或adc2在day10以0.4mg/kg的用量给药至尾静脉内。此外,作为对照组(vehicle组),同样地给药abs缓冲液。
[1049]
将结果示于图20中。在给药了抗her2抗体-药物偶联物adc1的小鼠中,确认到伴随肿瘤萎缩的强烈的抗肿瘤效果。在给药了抗her2抗体-药物偶联物adc2的小鼠中,确认到肿瘤增殖抑制效果。不能确认到由抗her2抗体-药物偶联物adc1、或adc2给药带来的小鼠的体重减少。
[1050]
实施例19:抗体-药物偶联物的抗肿瘤试验(4)
[1051]
将kpl-4细胞(川崎医科大学、红林淳一,british journal of cancer,(1999)79(5/6).707-717)悬浮于生理盐水(株式会社大塚制药工场)中,将1.5
×
107cells皮下移植至雌无胸腺裸鼠的右体侧部(day0),在day14,任选地实施分组。将抗体-药物偶联物adc5在day14,以0.4mg/kg的用量给药至尾静脉内。此外,作为对照组(vehicle组),同样地给药abs缓冲液。
[1052]
将结果示于图23中。抗体-药物偶联物adc5以0.4mg/kg给药确认了伴随肿瘤萎缩的强烈的抗肿瘤效果。不能确认抗体-药物偶联物adc5由0.4mg/kg给药带来的小鼠的体重减少。
[1053]
产业上的可利用性
[1054]
通过使用本发明的抗her2抗体-药物偶联物、抗her2抗体和/或pbd衍生物等,从而各种癌症的治疗或预防成为可能。
[1055]
序列号1:曲妥珠单抗a1和a2的重链和hwtl05抗体重链的cdrh1的氨基酸序列。
[1056]
序列号2:曲妥珠单抗a1和a2的重链和hwtl05抗体重链的cdrh2的氨基酸序列。
[1057]
序列号3:曲妥珠单抗a1和a2的重链和hwtl05抗体重链的cdrh3的氨基酸序列。
[1058]
序列号4:h01l02抗体重链的cdrh3的氨基酸序列。
[1059]
序列号5:曲妥珠单抗a1和a2的轻链的cdrl1的氨基酸序列。
[1060]
序列号6:包含曲妥珠单抗a1和a2的轻链的cdrl2的氨基酸序列。
[1061]
序列号7:曲妥珠单抗a1和a2的轻链的cdrl3的氨基酸序列。
[1062]
序列号8:h01l02抗体和hwtl05抗体轻链的cdrl3的氨基酸序列。
[1063]
序列号9:包含编码人轻链信号序列和人κ链恒定区的dna序列的dna片段的核苷酸序列。
[1064]
序列号10:包含编码人重链信号序列和人igg1lala恒定区的氨基酸的dna序列的dna片段的核苷酸序列。
[1065]
序列号11:曲妥珠单抗a1的重链氨基酸序列。
[1066]
序列号12:编码曲妥珠单抗a1的重链的核苷酸序列。
[1067]
序列号13:曲妥珠单抗a1、a2和hwt的重链可变区氨基酸序列。
[1068]
序列号14:编码曲妥珠单抗a1、a2和hwt的重链可变区的核苷酸序列。
[1069]
序列号15:h01的氨基酸序列。
[1070]
序列号16:编码h01的核苷酸序列。
[1071]
序列号17:h01的重链可变区氨基酸序列。
[1072]
序列号18:编码h01的重链可变区的核苷酸序列。
[1073]
序列号19:曲妥珠单抗a1的轻链的氨基酸序列。
[1074]
序列号20:编码曲妥珠单抗a1的轻链的核苷酸序列。
[1075]
序列号21:曲妥珠单抗a1和a2的轻链可变区氨基酸序列。
[1076]
序列号22:编码曲妥珠单抗a1和a2的轻链可变区的核苷酸序列。
[1077]
序列号23:l02的氨基酸序列。
[1078]
序列号24:编码l02的多核苷酸序列。
[1079]
序列号25:l02的可变区氨基酸序列。
[1080]
序列号26:编码l02的可变区的核苷酸序列。
[1081]
序列号27:l05的氨基酸序列。
[1082]
序列号28:编码l05的多核苷酸序列。
[1083]
序列号29:l05的可变区氨基酸序列。
[1084]
序列号30:编码l05的可变区的核苷酸序列。
[1085]
序列号31:曲妥珠单抗a2的重链氨基酸序列。
[1086]
序列号32:曲妥珠单抗a2的轻链的氨基酸序列。
[1087]
序列号33:曲妥珠单抗的重链氨基酸序列。
[1088]
序列号34:曲妥珠单抗的轻链的氨基酸序列。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。