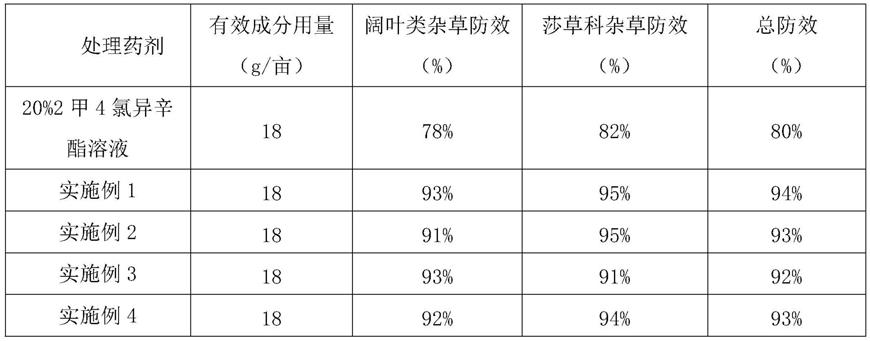
1.本发明属于植物组培技术领域,具体涉及一种高蛋白杂交构树高效组培育苗的方法。
背景技术:
2.构树(broussonetia papyrifera(l.)vent.)为桑科(moraceae)构树属(broussonetia)多年生阔叶乔木,杂交构树是我国近十年用太空搭载航天育种等综合手段培育而出,是具有突出抗逆性的速生丰产树种,广泛适种于我国大部分地区。杂交构树枝繁叶茂,根系发达,耐盐碱,耐瘠薄,是困难立地造林的先锋树种和防风固沙、水土流失治理的首选树种根和种子均可入药,树液可治皮肤病果实富含多种营养物质,具有美容、健胃、消肿和提高免疫力的作用树干可作为纤维板的原料树皮纤维洁白细长,是造纸和纺织的优质原料,市场需求量大叶片肥厚光滑、富含粗蛋白、氨基酸和微量元素,综合营养成分超过豆类植物,是一种优质的植物蛋白饲料。杂交构树全身皆可用,集生态、经济和社会效益于一体,市场开发前景广阔。
3.目前,杂交构树主要依靠种子、扦插和组培进行繁殖育苗。种子繁殖周期较长,且后代会产生性状分离,不易保持品系的良好特性扦插育苗季节性较强,繁育系数低,繁殖周期长,成活率低,苗木质量差,场地占用面积大,难以满足当前大面积栽培及推广的需要;组培快繁育苗则可在短期内大量繁育优良品种,且不受季节限制。
4.然而,现有公开报道的构树组培快繁技术中,多数先通过诱导愈伤组织再诱导分化出苗的方式,育苗周期长,增殖系数、生根率和移栽成活率偏低,苗木易褐化和玻璃化质量较差等问题,少数采用胚芽等作为外植体的材料,可选用外植体材料较少,如中国专利cn 107129365 a提出了一种构树育苗的培养基,该发明采用构树嫩枝顶端的胚芽作为外植体材料,经过消毒处理后放入培养基之后培养生根来育苗,该发明并未达到组培快繁的效果,存活率相对较低,成苗时间较长。中国专利cn 109566421 a、cn 109618935 a、cn 107125132 a、cn 105532450 a、cn 105532469 a、cn 101200704 a也提出了各种关于构树育苗组织培养的方法,但多数发明操作较为复杂,需要诱导壮苗才能获得组培苗木,育苗周期长,培育成本较高。此外,目前现有技术中,还存在组培污染率偏高,无法满足工厂化快速生产育苗的需求,严重制约了优良杂交构树品种的产业发展。因此,迫切需要一种操作过程简单,培育周期短,增殖系数稳定,生根率高,培育成本低的高效组培育苗方法。
技术实现要素:
5.本发明克服了现有技术的不足,提供了一种育苗周期短、增殖系数稳定、苗木质量好、生根率高的杂交构树高效组培育苗方法。
6.为了实现上述目的,本发明的技术方案如下:
7.一种高蛋白杂交构树高效组培育苗的方法,包括培养基制备、外植体选择及预处理、外植体灭菌、初始芽诱导培养、继代增殖培养、生根培养和炼苗移栽步骤;选择健壮、无
病虫害的高蛋白杂交构树当年生嫩枝作为外植体来源,对外植体进行预处理和灭菌修剪后接种于初始芽诱导培养基中获取初始芽,再将初始芽接种于继代增殖培养基中经过18天
‑
23天继代增殖培养,形成丛芽,将≥1cm顶芽单芽直立插入生根培养基中诱导生根,最后进行炼苗移栽获得杂交构树组培成活苗;主要操作步骤如下:
8.(1)培养基制备:按照初始芽诱导培养基、继代增殖培养基和生根培养基配方配制培养基后,煮好分装于玻璃瓶中,置于120℃高压灭菌20min后冷却备用;其中初始芽诱导培养基和生根培养基分装于240ml直口玻璃瓶,每瓶50ml培养基;继代增殖培养基分装于650ml小口玻璃瓶,每瓶100ml培养基;
9.(2)外植体选择及预处理:选择健壮、无病虫害的高蛋白杂交构树植株作为外植体来源,在采集外植体前1天
‑
3天,用0.1%多菌灵溶液喷洒植株;于晴天采集当年生嫩枝,剪去叶片和叶柄,保留6cm
‑
9cm长度的带芽茎段作为外植体材料;清水冲洗表面泥沙,用软毛毛刷刷洗外植体后,放入洗涤剂中浸泡5min
‑
10min,期间不断搅拌,自来水洗净洗涤剂;放入体积浓度为5%的84消毒液中浸泡15min
‑
20min,超声波清洗机中震荡清洗10min,流水冲洗1h
‑
2h,然后置于4℃冰箱中冷藏1h
‑
2h;
10.(3)外植体灭菌:从冰箱中取出外植体材料,放入多功能果蔬清洗机中消毒10min;在超净工作台上,将外植体放入体积浓度为75%的酒精溶液中浸泡10s
‑
30s后,无菌水冲洗3次
‑
5次,再放入体积浓度0.1%hgcl2溶液中浸泡8min
‑
12min,无菌水冲洗3次
‑
5次;将外植体材料放在灭菌的滤纸上吸干水分;
11.(4)初始芽诱导培养:用剪刀将步骤(3)得到的外植体两端分别剪掉1mm
‑
2mm,并修剪成带1芽
‑
2芽的茎段,垂直插入初始芽诱导培养基中,每瓶1株;
12.(5)继代增殖培养:待初始芽生长至3cm
‑
8cm,剪掉大叶片,保留顶芽和叶柄,保持初始芽芽体高度为2.0cm
‑
3.5cm,将修剪后的初始芽转入继代增殖培养基中,每瓶6株
‑
8株,经过19天
‑
23天培养,增殖形成丛芽,增殖系数7.9
‑
8.3;在超净台上,将丛芽底部愈伤组织剪掉,分成单芽或2
‑
3个芽的小丛芽接种在继代增殖培养基中,每瓶6株
‑
8株单芽或小丛芽,对单芽或小丛芽继续进行继代增殖培养;
13.(6)生根培养:将步骤(5)得到的高≥1cm顶芽单芽直立插入生根培养基中,8天
‑
10天后长根,15天生根率98.4%
‑
100%,根长2.0cm
‑
2.5cm,生根数5条
‑
9条;
14.(7)炼苗移栽:待步骤(6)生根培养后的单芽根系长度≥1.0cm时移到室外育苗网室炼苗,3天
‑
7天后打开培养瓶盖,开盖炼苗1天
‑
2天后将生根培养基及组培苗倒出,放入清水中洗净培养基;用木棍或其它工具在装有育苗基质的育苗容器中心钻孔,将生根苗放入孔中,压实基质,淋透水,之后进行苗木管理。
15.以上所述的初始芽诱导培养基的配方为:改良ms 6
‑
ba 0.3mg/l
‑
0.5mg/l naa 0.5mg/l kt 0.5mg/l 琼脂3.7g/l 糖30g/l,ph=5.8
‑
6.2;继代增殖培养基配方为:改良ms 2
‑
ip 0.5mg/l
‑
1.0mg/l naa 0.1mg/l
‑
0.3mg/l kt 0.5mg/l
‑
1.0mg/l 琼脂3.7g/l 糖30g/l,ph=5.8
‑
6.2;生根培养基配方为:1/2改良ms naa 0.1mg/l iba 1.0mg/l
‑
1.5mg/l iaa 1.0mg/l
‑
1.5mg/l 琼脂3.7g/l 糖15g/l,ph=5.8
‑
6.2。
16.以上所述改良ms和1/2改良ms培养基的组成为:
17.药品成分改良ms1/2改良mskno31900mg/l950mg/l
1.5mg/l 琼脂3.7g/l 糖15g/l,ph=5.8
‑
6.2。
26.相对于现有技术,本发明具有以下优点及积极效果:
27.1、本发明通过对杂交构树外植体处理及灭菌,初始芽诱导,继代增殖培养,生根培养等各项因素及培养方式的筛选,并采用适宜的炼苗、育苗措施,建立了一种高蛋白杂交构树高效组培育苗体系;本方法操作过程简单,培育周期短,增殖系数稳定,生根率高,培育成本低,为杂交构树组培工厂化育苗提供了技术指导,具有良好的经济效益、社会效益和生态效益,对于推动杂交构树产业的发展具有重要意义。
28.2、本发明以健壮的杂交构树当年生嫩枝作为外植体来源,外植体材料来源充足;对外植体灭菌前进行预处理,采用了加有茶树精油的洗涤剂配合超声波清洗机的方式进行,之后放入冰箱中冷藏,茶树精油具有抑菌的作用,超声波能够利用超声震动的方式彻底清洗茎段带芽等较难清洗的部位,能够大大降低污染率,同时经冰箱冷藏的外植体能够提高诱导率。
29.3、本发明根据杂交构树不同生长阶段的生长特性,在进行大量实验后对培养基进行了筛选和改良,同时添加不同类型的植物生长调节剂,配合使用不同规格的玻璃瓶。传统的ms培养基硝酸盐和铵盐的含量较高,而过高的铵态氮对钙、镁、钾的吸收有一定的抑制作用,硝态氮对其吸收无抑制作用,而植物缺钙在幼叶叶尖出现弯钩状,因此本发明根据大量观察试验筛选得到了改良ms培养基,即在ms培养基的基础上降低了nh4no3和cacl2·
2h2o的含量,同时添加了适量的ca(no3)2·
4h2o,提高了硝态氮和钙的含量,促进了苗木对营养的吸收,有效解决了继代增殖培养阶段苗木叶片发黄皱缩等技术问题;本发明的继代增殖阶段细胞分裂素采用2
‑
ip和kt组合方式,在提高增殖系数的同时不会引起组织愈伤化和玻璃化,苗木生长健壮。
30.4、本发明根据杂交构树叶片较大较易水肿的特点,在继代增殖阶段选用650ml小口玻璃瓶进行培养,增加了培养空间,有效解决了杂交构树在增殖阶段极易出现水肿的问题。
31.5、本发明筛选得到的培养基不需要诱导愈伤组织再分化出芽和壮苗培养,直接诱导出芽后增殖扩繁、生根成苗,节省了操作步骤,使得操作更加简便,且各个阶段苗木生长健壮,无玻璃化现象,效果理想。
32.6、本发明经过初始芽诱导后,诱导率可达80.8%
‑
85.6%,经过19天
‑
23天的继代增殖培养可形成丛芽,增殖系数高达7.9
‑
8.3,单芽接入生根培养基后8天
‑
10天后生根,15天生根率高达100%,根长2.0cm
‑
2.5cm,生根数5条
‑
9条,根系粗壮,大大缩短了育苗周期,可在短期内获得大量杂交构树组培苗。
33.7、本发明将获得的杂交构树组培苗经炼苗后增加了组培苗的环境适应性培育,有效提高了移栽成活率;本方法的移栽育苗基质采用谷壳:椰糠:蛭石的体积比为1:5:1,谷壳增加了育苗基质的透气性,蛭石能够增加营养;本育苗基质对于杂交构树的生长具有针对性强,且能提供充足的营养,从而促进组培苗生长,能够提高杂交构树组培苗的移栽成活率至94.2%
‑
96.4%。
附图说明
34.图1为实施例1杂交构树组培继代增殖培养瓶苗。
35.图2为实施例1杂交构树组培生根培养瓶苗瓶底照。
36.图3为实施例1杂交构树移栽成活组培苗。
37.图4为实施例3杂交构树组培继代增殖培养瓶苗。
38.图5为实施例3杂交构树组培生根培养瓶苗瓶底照。
39.图6为实施例4杂交构树组培继代增殖培养瓶苗。
40.图7为实施例4杂交构树组培生根培养瓶苗瓶底照。
41.图8为对比例1杂交构树组培继代增殖培养瓶苗。
42.图9为对比例1杂交构树组培生根培养瓶苗瓶底照。
43.图10为对比例2杂交构树组培继代增殖培养瓶苗。
44.图11为对比例2杂交构树组培生根培养瓶苗瓶底照。
45.图12为对比例3杂交构树组培继代增殖培养瓶苗。
46.图13为对比例3杂交构树组培生根培养瓶苗瓶底照。
具体实施方式
47.下面的实施例可以使本领域技术人员更全面地理解本发明,但不以任何方式限制本发明。但本领域技术人员应当理解,可以在形式上和细节上对其做出各种各样的改变,而不偏离本发明权利要求书所限定的范围。
48.以下各例中,ms、改良ms和1/2改良ms培养基的组成为:
49.药品成分ms改良ms1/2改良mskno31900mg/l1900mg/l950mg/lnh4no31650mg/l1650mg/l825mg/lcacl2·
2h2o440mg/l440mg/l220mg/lmgso4·
7h2o370mg/l370mg/l185mg/lca(no3)2·
4h2o0mg/l200mg/l100mg/lkh2po3170mg/l170mg/l85mg/lmnso4·
4h2o22.3mg/l22.3mg/l22.3mg/lznso4·
7h2o8.6mg/l8.6mg/l8.6mg/lcuso4·
5h2o0.025mg/l0.025mg/l0.025mg/lh3bo36.2mg/l6.2mg/l6.2mg/lna2moo4·
2h2o0.025mg/l0.025mg/l0.025mg/lki0.83mg/l0.83mg/l0.83mg/lcocl2·
6h2o0.025mg/l0.025mg/l0.025mg/l维生素b10.1mg/l0.1mg/l0.1mg/l维生素b60.5mg/l0.5mg/l0.5mg/l烟酸0.5mg/l0.5mg/l0.5mg/l甘氨酸2.0mg/l2.0mg/l2.0mg/l肌醇150mg/l150mg/l150mg/l
50.。
51.实施例1:
52.一种高蛋白杂交构树高效组培育苗的方法,操作步骤如下:
53.(1)培养基制备:按照改良ms 6
‑
ba 0.5mg/l naa 0.5mg/l kt 0.5mg/l 琼脂3.7g/l 糖30g/l,ph=5.8
‑
6.2、改良ms 2
‑
ip 1.0mg/l naa 0.1mg/l kt 1.0mg/l 琼脂3.7g/l 糖30g/l,ph=5.8
‑
6.2和1/2改良ms naa 0.1mg/l iba 1.0mg/l iaa 1.5mg/l 琼脂3.7g/l 糖15g/l,ph=5.8
‑
6.2分别配制初始芽诱导培养基、继代增殖培养基和生根培养基,煮好后分装于玻璃瓶中,置于120℃高压灭菌20min后冷却备用;其中初始芽诱导培养基和生根培养基分装于高度9.5cm、直径6.6cm、口径6.3cm的240ml直口玻璃瓶,每瓶50ml培养基;继代增殖培养基分装于高度14cm,直径9.5cm,口径5.3cm的650ml小口玻璃瓶,每瓶100ml培养基;
54.(2)外植体选择及预处理:选择健壮、无病虫害的高蛋白杂交构树植株作为外植体来源,在采集外植体前3天,用0.1%多菌灵溶液喷洒植株;于晴天采集当年生嫩枝,剪去叶片和叶柄,保留长度6cm
‑
9cm、直径为0.25cm
‑
0.5cm的带芽茎段作为外植体材料;清水冲洗表面泥沙,用软毛毛刷刷洗外植体后,放入由体积浓度为1%洗洁精和体积浓度为0.5%的茶树精油组成的洗涤剂中浸泡10min,期间不断搅拌,自来水洗净洗涤剂;放入体积浓度为5%的84消毒液中浸泡20min,超声波清洗机中震荡清洗10min,超声功率为80w,流水冲洗2h,然后置于4℃冰箱中冷藏2h;
55.(3)外植体灭菌:从冰箱中取出外植体材料,放入多功能果蔬清洗机中消毒10min;在超净工作台上,将外植体放入体积浓度为75%的酒精溶液中浸泡30s后,无菌水冲洗3次
‑
5次,再放入体积浓度0.1%hgcl2溶液中浸泡12min,无菌水冲洗3次
‑
5次,将外植体材料放在灭菌的滤纸上吸干水分;
56.(4)初始芽诱导培养:用剪刀将步骤(3)得到的外植体两端分别剪掉1mm,并修剪成带1芽的茎段,保持1cm的茎段长度,垂直插入初始芽诱导培养基中,保持带芽位置在培养基上1mm,每瓶1株;培养控制条件为:温度为25
±
3℃,光照强度3000lx
‑
9000 lx,光照时间12h/d
‑
16h/d,诱导率为85.6%;
57.(5)继代增殖培养:待初始芽生长至3cm
‑
8cm,剪掉大叶片,保留顶芽和叶柄,保持初始芽芽体高度为2.0cm,将修剪后的初始芽转入继代增殖培养基中,每瓶8株,经过19天培养,增殖形成丛芽,增殖系数为8.3;在超净台上,将丛芽底部愈伤组织剪掉,分成2
‑
3个芽的小丛芽接种在继代增殖培养基中,每瓶6株小丛芽,对小丛芽继续进行继代增殖培养;培养控制条件为:温度为25
±
3℃,光照强度3000lx
‑
9000 lx,光照时间12h/d
‑
16h/d;
58.(6)生根培养:将步骤(5)得到的高≥1cm顶芽单芽直立插入生根培养基中,8天长根,15天生根率100%,根长2.0cm,生根数5条
‑
9条;培养控制条件为:温度为25
±
3℃,光照强度3000lx
‑
9000 lx,光照时间12h/d
‑
16h/d;
59.(7)炼苗移栽:待步骤(6)生根培养后的单芽根系长度≥1.0cm时移到室外育苗网室炼苗,7天后打开培养瓶盖,开盖炼苗1天后将生根培养基及组培苗倒出,放入清水中洗净培养基;用木棍或其它工具在装有谷壳:椰糠:蛭石体积比为1:5:1的育苗基质的直径8cm,高10cm的无纺布杯的中心钻孔,将生根苗放入孔中,压实基质,淋透水,移栽前,用体积浓度为0.5%高锰酸钾溶液对育苗基质淋透消毒,1天后再用清水淋洒洗去药液,之后进行苗木管理,即将苗木置于带遮阴网的室外育苗大棚内,每日喷淋水1次
‑
2次,移栽后一周内,透光度保持在40%
‑
50%,一周后逐渐增加光照,移栽一个月后透光度增至80%
‑
90%用质量浓
度0.1%
‑
0.2%复合肥水溶液喷施叶面,施肥后立即用清水冲洗叶面,以后每月采用上述施肥方式施复合肥1次,所述的复合肥的n:p:k=15:15:15,移栽成活率为96.4%。
60.实施例2:
61.一种高蛋白杂交构树高效组培育苗的方法,操作步骤如下:
62.(1)培养基制备:按照改良ms 6
‑
ba 0.3mg/l naa 0.5mg/l kt 0.5mg/l 琼脂3.7g/l 糖30g/l,ph=5.8
‑
6.2、改良ms 2
‑
ip 0.5mg/l naa 0.3mg/l kt 0.5mg/l 琼脂3.7g/l 糖30g/l,ph=5.8
‑
6.2和1/2改良ms naa 0.1mg/l iba 1.5mg/l iaa 1.0mg/l 琼脂3.7g/l 糖15g/l,ph=5.8
‑
6.2分别配制初始芽诱导培养基、继代增殖培养基和生根培养基,煮好后分装于玻璃瓶中,置于120℃高压灭菌20min后冷却备用;其中初始芽诱导培养基和生根培养基分装于高度9.5cm、直径6.6cm、口径6.3cm的240ml直口玻璃瓶,每瓶50ml培养基;继代增殖培养基分装于高度14cm,直径9.5cm,口径5.3cm的650ml小口玻璃瓶,每瓶100ml培养基;
63.(2)外植体选择及预处理:选择健壮、无病虫害的高蛋白杂交构树植株作为外植体来源,在采集外植体前3天,用0.1%多菌灵溶液喷洒植株;于晴天采集当年生嫩枝,剪去叶片和叶柄,留长度6cm
‑
9cm、直径为0.25cm
‑
0.5cm的带芽茎段;清水冲洗表面泥沙,用软毛毛刷刷洗外植体后,放入由体积浓度为1%洗洁精和体积浓度为0.5%的茶树精油组成的洗涤剂中浸泡10min,期间不断搅拌,自来水洗净洗涤剂;放入体积浓度为5%的84消毒液中浸泡15min,超声波清洗机中震荡清洗10min,超声功率为80w,流水冲洗1h,然后置于4℃冰箱中冷藏1h;
64.(3)外植体灭菌:从冰箱中取出外植体材料,放入多功能果蔬清洗机中消毒10min;在超净工作台上,将外植体放入体积浓度为75%的酒精溶液中浸泡20s后,无菌水冲洗3次
‑
5次,再放入体积浓度0.1%hgcl2溶液中浸泡8min,无菌水冲洗3次
‑
5次,将外植体材料放在灭菌的滤纸上吸干水分;
65.(4)初始芽诱导培养:用剪刀将步骤(3)得到的外植体两端分别剪掉2mm,并修剪成带1芽的茎段,保持1.5cm的茎段长度,垂直插入初始芽诱导培养基中,保持带芽位置在培养基上2.5mm,每瓶1株;培养控制条件为:温度为25
±
3℃,光照强度3000lx
‑
9000 lx,光照时间12h/d
‑
16h/d,诱导率为80.8%;
66.(5)继代增殖培养:待初始芽生长至3cm
‑
8cm,剪掉大叶片,保留顶芽和叶柄,保持初始芽芽体高度为3.5cm,将修剪后的初始芽转入继代增殖培养基中,每瓶6株,经过23天培养,增殖形成丛芽,增殖系数为7.9;在超净台上,将丛芽底部愈伤组织剪掉,分成单芽接种在继代增殖培养基中,每瓶6株单芽,对单芽继续进行继代增殖培养;培养控制条件为:温度为25
±
3℃,光照强度3000lx
‑
9000 lx,光照时间12h/d
‑
16h/d;
67.(6)生根培养:将步骤(5)得到的高≥1cm顶芽单芽直立插入生根培养基中,10天后长根,15天生根率99.7%,根长2.5cm,生根数5条
‑
9条;培养控制条件为:温度为25
±
3℃,光照强度3000lx
‑
9000 lx,光照时间12h/d
‑
16h/d;
68.(7)炼苗移栽:待步骤(6)生根培养后的单芽根系长度≥1.0cm时移到室外育苗网室炼苗,3天后打开培养瓶盖,开盖炼苗2天后将生根培养基及组培苗倒出,放入清水中洗净培养基;用木棍或其它工具在装有谷壳:椰糠:蛭石体积比为1:5:1的育苗基质的直径8cm,高10cm的无纺布杯的中心钻孔,将生根苗放入孔中,压实基质,淋透水,移栽前,用体积浓度
为0.8%高锰酸钾溶液对育苗基质淋透消毒,1天后再用清水淋洒洗去药液,之后进行苗木管理,即将苗木置于带遮阴网的室外育苗大棚内,每日喷淋水1次
‑
2次,移栽后一周内,透光度保持在40%
‑
50%,一周后逐渐增加光照,移栽一个月后透光度增至80%
‑
90%用质量浓度0.1%
‑
0.2%复合肥水溶液喷施叶面,施肥后立即用清水冲洗叶面,以后每月采用上述施肥方式施复合肥1次,所述的复合肥的n:p:k=15:15:15,移栽成活率为94.2%。
69.实施例3:
70.一种高蛋白杂交构树高效组培育苗的方法,操作步骤如下:
71.(1)培养基制备:按照改良ms 6
‑
ba 0.8mg/l naa 0.5mg/l kt 0.5mg/l 琼脂3.7g/l 糖30g/l,ph=5.8
‑
6.2、改良ms 2
‑
ip 1.2mg/l naa 0.5mg/l kt 1.2mg/l 琼脂3.7g/l 糖30g/l,ph=5.8
‑
6.2和1/2改良ms iba 1.8mg/l iaa 1.8mg/l 琼脂3.7g/l 糖15g/l,ph=5.8
‑
6.2分别配制初始芽诱导培养基、继代增殖培养基和生根培养基,煮好后分装于玻璃瓶中,置于120℃高压灭菌20min后冷却备用;其中初始芽诱导培养基和生根培养基分装于高度9.5cm、直径6.6cm、口径6.3cm的240ml直口玻璃瓶,每瓶50ml培养基;继代增殖培养基分装于高度14cm,直径9.5cm,口径5.3cm的650ml小口玻璃瓶,每瓶100ml培养基;
72.(2)外植体选择及预处理:选择健壮、无病虫害的高蛋白杂交构树植株作为外植体来源,在采集外植体前2天,用0.1%多菌灵溶液喷洒植株;于晴天采集当年生嫩枝,剪去叶片和叶柄,留长度6cm
‑
9cm、直径为0.25cm
‑
0.5cm的带芽茎段;清水冲洗表面泥沙,用软毛毛刷刷洗外植体后,放入由体积浓度为1%洗洁精和体积浓度为0.5%的茶树精油组成的洗涤剂中浸泡8min,期间不断搅拌,自来水洗净洗涤剂;放入体积浓度为5%的84消毒液中浸泡18min,超声波清洗机中震荡清洗10min,超声功率为80w,流水冲洗1.5h,然后置于4℃冰箱中冷藏1.5h;
73.(3)外植体灭菌:从冰箱中取出外植体材料,放入多功能果蔬清洗机中消毒10min;在超净工作台上,将外植体放入体积浓度为75%的酒精溶液中浸泡30s后,无菌水冲洗3次
‑
5次,再放入体积浓度0.1%hgcl2溶液中浸泡10min,无菌水冲洗3次
‑
5次,将外植体材料放在灭菌的滤纸上吸干水分;
74.(4)初始芽诱导培养:用剪刀将步骤(3)得到的外植体两端分别剪掉1.5mm,并修剪成带1
‑
2芽的茎段,保持1.5cm的茎段长度,垂直插入初始芽诱导培养基中,保持带芽位置在培养基上2mm,每瓶1株;培养控制条件为:温度为25
±
3℃,光照强度3000lx
‑
9000 lx,光照时间12h/d
‑
16h/d,诱导率为80.1%;
75.(5)继代增殖培养:待初始芽生长至3cm
‑
8cm,剪掉大叶片,保留顶芽和叶柄,保持初始芽芽体高度为3cm,将修剪后的初始芽转入继代增殖培养基中,每瓶8株,经过25天培养,增殖形成丛芽,增殖系数为7.5;在超净台上,将丛芽底部愈伤组织剪掉,分成2
‑
3个芽的小丛接种在继代增殖培养基中,每瓶8株,对单芽或小丛继续进行继代增殖培养;培养控制条件为:温度为25
±
3℃,光照强度3000lx
‑
9000 lx,光照时间12h/d
‑
16h/d;
76.(6)生根培养:将步骤(5)得到的高≥1cm顶芽单芽直立插入生根培养基中,11天后长根,15天生根率97.8%,根长3.6cm,生根数3条
‑
10条;培养控制条件为:温度为25
±
3℃,光照强度3000lx
‑
9000 lx,光照时间12h/d
‑
16h/d;
77.(7)炼苗移栽:待步骤(6)生根培养后的单芽根系长度≥1.0cm时移到室外育苗网室炼苗,5天后打开培养瓶盖,开盖炼苗2天后将生根培养基及组培苗倒出,放入清水中洗净
培养基;用木棍或其它工具在装有谷壳:椰糠:蛭石体积比为1:5:1的育苗基质的直径8cm,高10cm的无纺布杯的中心钻孔,将生根苗放入孔中,压实基质,淋透水,移栽前,用体积浓度为0.5%
‑
0.8%高锰酸钾溶液对育苗基质淋透消毒,1天后再用清水淋洒洗去药液,之后进行苗木管理,即将苗木置于带遮阴网的室外育苗大棚内,每日喷淋水1次
‑
2次,移栽后一周内,透光度保持在40%
‑
50%,一周后逐渐增加光照,移栽一个月后透光度增至80%
‑
90%用质量浓度0.1%
‑
0.2%复合肥水溶液喷施叶面,施肥后立即用清水冲洗叶面,以后每月采用上述施肥方式施复合肥1次,所述的复合肥的n:p:k=15:15:15,移栽成活率为93.1%。
78.实施例4:
79.一种高蛋白杂交构树高效组培育苗的方法,操作步骤如下:
80.(1)培养基制备:按照改良ms 6
‑
ba 1.0mg/ naa 0.5mg/l kt 0.5mg/l 琼脂3.7g/l 糖30g/l,ph=5.8
‑
6.2、改良ms 2
‑
ip 1.5mg/l naa 0.8mg/l kt 1.2mg/l 琼脂3.7g/l 糖30g/l,ph=5.8
‑
6.2和1/2改良ms naa 0.2 iba 2.0mg/l iaa 2.0mg/l 琼脂3.7g/l 糖15g/l,ph=5.8
‑
6.2分别配制初始芽诱导培养基、继代增殖培养基和生根培养基,煮好后分装于玻璃瓶中,置于120℃高压灭菌20min后冷却备用;其中初始芽诱导培养基和生根培养基分装于高度9.5cm、直径6.6cm、口径6.3cm的240ml直口玻璃瓶,每瓶50ml培养基;继代增殖培养基分装于高度14cm,直径9.5cm,口径5.3cm的650ml小口玻璃瓶,每瓶100ml培养基;
81.(2)外植体选择及预处理:选择健壮、无病虫害的高蛋白杂交构树植株作为外植体来源,在采集外植体前2天,用0.1%多菌灵溶液喷洒植株;于晴天采集当年生嫩枝,剪去叶片和叶柄,留长度6cm
‑
9cm、直径为0.25cm
‑
0.5cm的带芽茎段;清水冲洗表面泥沙,用软毛毛刷刷洗外植体后,放入由体积浓度为1%洗洁精和体积浓度为0.5%的茶树精油组成的洗涤剂中浸泡8min,期间不断搅拌,自来水洗净洗涤剂;放入体积浓度为5%的84消毒液中浸泡18min,超声波清洗机中震荡清洗10min,超声功率为80w,流水冲洗1.5h,然后置于4℃冰箱中冷藏1.5h;
82.(3)外植体灭菌:从冰箱中取出外植体材料,放入多功能果蔬清洗机中消毒10min;在超净工作台上,将外植体放入体积浓度为75%的酒精溶液中浸泡30s后,无菌水冲洗3次
‑
5次,再放入体积浓度0.1%hgcl2溶液中浸泡10min,无菌水冲洗3次
‑
5次,将外植体材料放在灭菌的滤纸上吸干水分;
83.(4)初始芽诱导培养:用剪刀将步骤(3)得到的外植体两端分别剪掉1.5mm,并修剪成带1
‑
2芽的茎段,保持1.5cm的茎段长度,垂直插入初始芽诱导培养基中,保持带芽位置在培养基上2mm,每瓶1株;培养控制条件为:温度为25
±
3℃,光照强度3000lx
‑
9000 lx,光照时间12h/d
‑
16h/d,诱导率为80.1%;
84.(5)继代增殖培养:待初始芽生长至3cm
‑
8cm,剪掉大叶片,保留顶芽和叶柄,保持初始芽芽体高度为3cm,将修剪后的初始芽转入继代增殖培养基中,每瓶6株,经过30天培养,增殖形成丛芽,增殖系数为6.8;在超净台上,将丛芽底部愈伤组织剪掉,分成2
‑
3个芽的小丛接种在继代增殖培养基中,每瓶8株,对单芽或小丛继续进行继代增殖培养;培养控制条件为:温度为25
±
3℃,光照强度3000lx
‑
9000 lx,光照时间12h/d
‑
16h/d;
85.(6)生根培养:将步骤(5)得到的高≥1cm顶芽单芽直立插入生根培养基中,14天后长根,15天生根率93.3%,根长3.6cm,生根数3条
‑
5条;培养控制条件为:温度为25
±
3℃,光照强度3000lx
‑
9000 lx,光照时间12h/d
‑
16h/d;
86.(7)炼苗移栽:待步骤(6)生根培养后的单芽根系长度≥1.0cm时移到室外育苗网室炼苗,5天后打开培养瓶盖,开盖炼苗2天后将生根培养基及组培苗倒出,放入清水中洗净培养基;用木棍或其它工具在装有谷壳:椰糠:蛭石体积比为1:5:1的育苗基质的直径8cm,高10cm的无纺布杯的中心钻孔,将生根苗放入孔中,压实基质,淋透水,移栽前,用体积浓度为0.5%
‑
0.8%高锰酸钾溶液对育苗基质淋透消毒,1天后再用清水淋洒洗去药液,之后进行苗木管理,即将苗木置于带遮阴网的室外育苗大棚内,每日喷淋水1次
‑
2次,移栽后一周内,透光度保持在40%
‑
50%,一周后逐渐增加光照,移栽一个月后透光度增至80%
‑
90%用质量浓度0.1%
‑
0.2%复合肥水溶液喷施叶面,施肥后立即用清水冲洗叶面,以后每月采用上述施肥方式施复合肥1次,所述的复合肥的n:p:k=15:15:15,移栽成活率为88.4%。
87.对比例1:
88.与实施例1基本相同,不同的是初始诱导培养基和继代增殖培养基的基本培养基采用ms,生根培养基的基本培养基采用1/2ms,移栽成活率为89.3%。
89.对比例2:
90.与实施例1基本相同,不同的是继代增殖、生根培养基配方和移栽基质采用“cn101200704a构树的一种组织培养方法”公开的实施例1的配方,移栽成活率为92.6%。
91.对比例3:
92.与实施例1基本相同,不同的是继代增殖、生根培养基和移栽基质采用“cn 105532469 a一种杂交构树组织培养的方法”公开的配方,移栽成活率为85.5%。
93.分别采用本发明实施例1
‑
3及对比例1
‑
3的处理方式进行处理,统计试验结果,初始芽诱导率/%=(诱导初始芽的外植体数/接种外植体总数)
×
100%;增殖系数=芽生长到可供切割成高度0.5cm
‑
1cm的芽数/接种时单芽总数;生根率/%=(生根芽数/接种总芽数)
×
100%;最短组培苗成苗周期/天=最短增殖周期 最短生根时间,将处理结果进行对比,见表1。
94.表1:各处理育苗效果对比
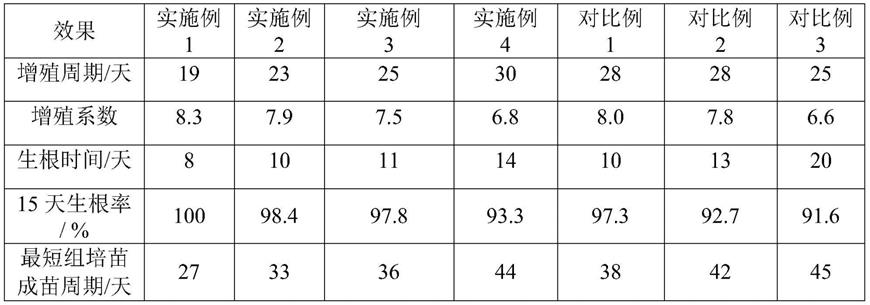
95.[0096][0097]
由表1可知,实施例1为最优实施例,增殖系数最高,生根时间最短,生根率最高,最短组培苗成苗周期最短,效果如图1(继代增殖)、图2(生根瓶底照)和图3(移栽苗木)所示;
[0098]
与实施例1对比,实施例3(效果如图4、图5)的培养基配方和实施例4(效果如图6、图7)对激素含量进行了调整,其增殖系数分别降低了0.8和1.5,增殖周期分别增加了6天和11天,生根时间分别增加了3天和6天,生根率降低了2.2%和6.7%,最短组培苗成苗周期分别增加了9天和17天,移栽成活率分别降低了3.3%和8.0%,苗木状态较差,表现为叶片出现水肿或顶芽枯黄,愈伤组织增多,根系数量少或差异大,说明适宜范围的激素含量对于苗木的生长具有重要意义,不适宜的激素含量会引起苗木水肿,生根率降低,根系质量差等技术问题,不利于苗木生长,本发明通过大量试验优化得到的培养基配方中激素含量适宜,苗木生长健壮;
[0099]
与实施例1对比,在其他条件相同的情况下,对比例1(效果如图8、图9)中,其增殖系数降低了0.3,增殖周期增加了9天,生根时间增加了2天,生根率降低了2.7%,最短组培苗成苗周期增加了11天,对比例1的苗木状态与实施例1相比叶片边缘发黄,根系较为细长,移栽成活率降低了7.1%,说明本发明在ms基本培养基的基础上对铵盐、钙盐进行了适量的修改,优化得到基本培养基筛选能够满足杂交构树的生长特性,促进植株生长,使苗木更加健壮;
[0100]
与实施例1对比,对比例2(效果如图10、图11)、对比例3(效果如图12、图13)中分别采用已公开的较佳的增殖、生根培养基和移栽基质,可以证明实施例1的增殖系数、生根时间、生根率、苗木状态、移栽率均为最优,缩短了育苗周期,由此说明本发明公开的组培育苗的方法培育周期短,增殖系数稳定,生根率高,培育成本较低,具有良好的经济效益、社会效益和生态效益,对于推动杂交构树产业的发展具有重要意义。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。