1.本发明属于环保领域,具体涉及一种加速高锰酸钾降解有机污染物的方法。
背景技术:
2.公开该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不 必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所 公知的现有技术。
3.水是一种重要的自然资源,与人类的生产、生活密切相关。与此同时,工业 废水和生活污水的大量排放,农药、化肥、激素的大量使用及流失,使得水环境 受到了严重的污染。随着环境分析技术的提高,水中检出的微量污染物的种类不 断增多,引起了人们对环境中微量有机污染物的关注,尤其是一些对生态和人体 具有威胁和潜在威胁的微量有机污染物。因此,了解和掌握微量有机污染物在水 处理过程中的迁移转化规律,研究开发高效、经济、易行的去除与控制技术,保 障饮用水安全,是水处理研究者面临的艰巨任务。
4.常规饮用水处理工艺(混凝
‑
沉淀
‑
过滤
‑
消毒)对大部分微量有机污染物去除 作用较小,特别是对于亲水性强的小分子有机物。为有效去除水中有机污染物, 保障饮用水安全,常增加饮用水预处理或深度处理工艺。化学氧化是降解水中有 机物的有效方法之一,目前研究者在化学氧化作为饮用水预处理或深度处理工艺 方面进行了大量探索研究。化学氧化技术是指通过氧化剂本身或者活性中间物质 的氧化能力,对水中污染物进行分解或转化,从而达到净化水质的目的。目前能 够用于给水处理的氧化剂主要有氯、二氧化氯、臭氧、过氧化氢、高铁酸钾和高 锰酸钾等。氯气是国内目前使用最普遍的一种水处理氧化剂,主要应用在后续的 消毒和常规工艺的预处理。氯气可有效降解水中多种有机物,而且氯气具有成本 低,使用方便的优点。但是,自上世纪七十年代以来,氯气用于水处理产生消毒 副产物的问题被发现,氯气氧化技术在饮用水处理中的不足逐渐受到人们重视。 原水中的有机物在于氯气反应的过程中,不可避免的会产生一些有毒有害的氧化 副产物,如氯仿、一溴二氯甲烷、二溴一氯甲烷、溴仿等,长期饮用含有这些有 毒副产物的水必然对人体健康有所影响。鉴于氯气在使用过程中产生氧化副产物 的问题,近年来开始逐渐用其它的氧化剂替代氯气,其中二氧化氯具有氧化作用 强,生成简单,成本较低,是一种有效的水处理氧化剂。二氧化氯对有机物的氧 化降解与氯所不同的最大特点是不会生成有机氯代物。二氧化氯可以控制三氯甲 烷的生成,减少总有机卤的生成。但是,二氧化氯在使用过程中有可能会产生亚 氯酸盐和氯酸盐,这两种物质对人体健康具有潜在的威胁。《饮用水卫生标准》 (gb5749
‑
2006)要求在使用二氧化氯或复合二氧化氯消毒时,水中亚氯酸盐和氯 酸盐的浓度不得高于0.7mg/l,因此二氧化氯在使用过程中必须考虑亚氯酸盐和 氯酸盐的残留问题。臭氧是一种强氧化剂,其用于给水处理的最初主要目的是消 毒。自20世纪70年代以来,臭氧氧化技术逐渐开始作为一种预氧化措施在水处 理中应用。臭氧极不稳定,需要在现场制备使用,但是溶解于水中的臭氧在酸性 条件比较稳定,当ph升高或者水温升高,臭氧则会发生分解。臭氧在实际应用 中还有一些不足,如投资大,电耗高;在水中的溶
解度低,尾气处理不当会形成 空气污染;当水中存在溴离子时会导致致癌物溴酸盐的产生。过氧化氢最初主要 用于处理高浓度有机废水,后来作为生物预处理技术,改善废水的可生化性。随 着天然水中有机物的污染不断加剧,近年来已有不少研究将其用于给水处理。但 是单独使用过氧化氢,其与有机物反应速率非常慢,对有机物的去除作用并不显 著,而且过氧化氢的氧化能力受ph影响明显。过氧化氢在一定的催化条件下(如 fe
2
,紫外光等)及与其它氧化剂(如臭氧)的联合作用下能产生氧化性更强的 羟基自由基,更加充分的发挥其降解水中有机污染物的能力。但是这些强氧化能 力的自由基氧化污染物选择性低,受水中共存物质干扰大,利用率较低。高铁酸 钾具有极强的氧化性,对有机物具有良好的去除能力,如酚类、醇类、有机酸、 有机氮、氨基酸、脂类含硫化合物、苯及其相关的化合物等。高铁酸钾作为一种 水处理氧化剂被长期认为是一种绿色的氧化剂,但是最近的研究显示,当水中存 在溴离子时,高铁酸盐能将其转化为次溴酸和溴酸盐。高铁酸钾在酸性和中性条 件下稳定性不高,不容易制备和存储,限制了其实际应用。高锰酸钾是一种广泛 应用的过渡金属氧化物,在较为广泛的ph范围内对污染物都具有较强的氧化能 力,其还原产物为不溶性环境友好的二氧化锰。二氧化锰可以通过吸附、氧化、 助凝等与高锰酸钾协同除污染。早在上世纪五、六十年代,国外就将高锰酸钾应 用于水的净化。高锰酸钾作为处理氧化剂具有价格低廉,使用方便,易于存储和 运顺,不产生有毒有害的氧化副产物等优点。因此,高锰酸钾氧化受到了许多水 处理研究者的关注。早在上世纪八十年代,我国学者就提出了用高锰酸钾去除饮 用水中微量有机物的方法,并结合水源普遍污染的状况,就高锰酸钾预氧化的助 凝、控制消毒副产物以及去除水中微量有机污染物方面,开展了一系列系统研究 工作。结果表明,高锰酸钾可有效降解一些有毒有害有机物。虽然高锰酸钾氧化 技术有其明显的优点,但高锰酸钾的氧化能力远远低于臭氧和羟基自由基,其氧 化污染物的速率慢,达到相同有机物去除率所需时间较长,因此大量学者针对如 何提高高锰酸钾对有机物的氧化进行了相关研究。
5.有研究公开了一种利用络合剂强化高锰酸钾氧化有机污染物的方法。该方法 通过在高锰酸钾氧化污染物的溶液中加入络合剂,通过络合配位作用使得高锰酸 钾降解有机物过程中原位生成的中间价态锰的存活时间延长、稳定性增强,氧化 能力得到有效利用,从而提高了高锰酸钾氧化降解酚类化合物的效果。但少量络 合剂的投加量催化效果不佳,为达到理想效果甚至需要投加数倍于氧化剂浓度的 络合剂,但高浓度的络合剂又会对水体造成新的污染。
6.有研究公布了一种利用亚硫酸钠活化高锰酸钾超快速降解有机污染物的技 术,其原理为利用亚硫酸钠还原高锰酸钾原位生成高活性的三价锰和硫酸根自由 基等活性氧化剂,中间态锰和自由基具有高反应活性,从而实现污染物在毫秒级 时间尺度内氧化有机物。但是由于反应速率过快,对水力混合条件要求高,否则 中间态锰和自由基的利用率低,对污染物去除效果差。此外,亚硫酸钠的投量远 高于高锰酸钾,反应产物为硫酸根,增加了水的盐度,且不可循环利用,投量较 高时导致成本增加显著。
技术实现要素:
7.为了解决高锰酸钾氧化活性不高,降解污染物速率慢的问题,本发明提供了 一种加速高锰酸钾降解水中有机污染物的方法。该方法利用n,n
‑
二乙基对苯二 胺与高锰酸钾
反应,通过产生n,n
‑
二乙基对苯二胺自由基,该自由基具有较高 的稳定性和活性,在水中可以较高的浓度存在,利用其与污染物较高的反应速率 可实现污染物的快速降解,其降解污染物的速率比单独高锰酸钾降解污染物的速 率高数倍至数十倍。
8.为实现上述技术目的,本发明采用如下技术方案:
9.本发明的第一个方面,提供了一种加速高锰酸钾降解有机污染物的方法,包 括:
10.向待处理水中加入含n,n
‑
二乙基对苯二胺或其盐的溶液;
11.再将待处理水的ph值调整至5
‑
7,加入高锰酸钾溶液进行处理,即得。
12.本发明开发了一种有效提高高锰酸钾降解污染物效率,且试剂投加量小,反 应试剂可循环参与反应,对水力混合条件要求不高的活化高锰酸钾的技术,具有 较好的应用和市场前景。
13.本发明的第二个方面,提供了一种加速高锰酸钾降解有机污染物的装置,包 括:含n,n
‑
二乙基对苯二胺或其盐的溶液的储罐、高锰酸钾溶液储罐、ph调节 剂储罐,混合器,所述含n,n
‑
二乙基对苯二胺或其盐的溶液的储罐、高锰酸钾 溶液储罐、ph调节剂储罐分别与混合器相连。
14.本发明的第三个方面,提供了n,n
‑
二乙基对苯二胺或其盐在加速高锰酸钾 降解有机污染物中的应用。
15.本发明的有益效果在于:
16.(1)本发明使用的试剂为高锰酸钾和n,n
‑
二乙基对苯二胺(或其盐类), 都是安全的固体试剂,运输方便。高锰酸钾价格便宜,n,n
‑
二乙基对苯二胺用 量少。因此,该技术具有成本低廉的优势。
17.(2)本发明使用的n,n
‑
二乙基对苯二胺的投加量远低于高锰酸钾,低投量 条件下其不会影响水质指标。
18.(3)本发明使用的高锰酸钾最终还原产物为二氧化锰和锰离子,二氧化锰 具有吸附、助凝的作用,可以增强污染物的去除。常规条件下二氧化锰表明带负 电,能够吸附带正电的二价锰离子。因此,普通的过滤、混凝或沉淀方法即可同 步去除二氧化锰和二价锰离子。
19.(4)该反应的条件温和,不需要强酸性或强碱性条件,易于实际应用;
20.(5)本发明的实施条件对水力混合要求不高,普通的机械搅拌即可满足混 合要求。采用络合剂强化高锰酸钾氧化的方法虽然降解污染物速率更快,但是对 反应器要求高,不充分的急速混合会导致体系中的氧化剂利用率低下。因此,本 发明更加适于实际操作。
21.(6)本技术的操作方法简单、成本低、易于规模化生产。
附图说明
22.构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明 的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
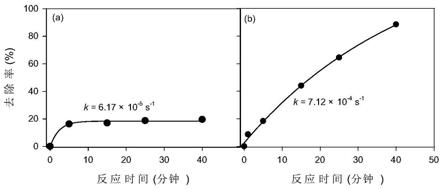
23.图1为本发明实施例1中ph=5条件下单独高锰酸钾(50微摩尔/升)处理 模拟地表水中苯酚(图a)与n,n
‑
二乙基对苯二胺(5微摩尔/升)存在条件下高 锰酸钾处理苯酚(图b)的效果对比图;
24.图2为本发明实施例2中ph=5条件下单独高锰酸钾(50微摩尔/升)处理 模拟地表水中苯酚(图a)与n,n
‑
二乙基对苯二胺(1微摩尔/升)存在条件下高 锰酸钾处理苯酚(图b)的效果对比图;
25.图3为本发明实施例3中ph=5条件下单独高锰酸钾(50微摩尔/升)处理 模拟地表水中苯酚(图a)与n,n
‑
二乙基对苯二胺(2微摩尔/升)存在条件下高 锰酸钾处理苯酚(图b)的效果对比图;
26.图4为本发明实施例4中ph=5条件下单独高锰酸钾(50微摩尔/升)处理 模拟地表水中苯酚(图a)与n,n
‑
二乙基对苯二胺(3微摩尔/升)存在条件下高 锰酸钾处理苯酚(图b)的效果对比图;
27.图5为本发明实施例6中ph=6条件下单独高锰酸钾(50微摩尔/升)处理 模拟地表水中苯酚(图a)与n,n
‑
二乙基对苯二胺(5微摩尔/升)存在条件下高 锰酸钾处理苯酚(图b)的效果对比图;
28.图6为本发明实施例7中ph=7条件下单独高锰酸钾(50微摩尔/升)处理 模拟地表水中苯酚(图a)与n,n
‑
二乙基对苯二胺(5微摩尔/升)存在条件下高 锰酸钾处理苯酚(图b)的效果对比图;
29.图7为本发明实施例8中ph=5条件下单独高锰酸钾(50微摩尔/升)处理 模拟地表水中环丙沙星(图a)与n,n
‑
二乙基对苯二胺(5微摩尔/升)存在条件 下高锰酸钾处理环丙沙星(图b)的效果对比图;
30.图8为本发明实施例9中ph=5条件下单独高锰酸钾(50微摩尔/升)处理 模拟地表水中双酚a(图a)与n,n
‑
二乙基对苯二胺(5微摩尔/升)存在条件下 高锰酸钾处理双酚a(图b)的效果对比图。
具体实施方式
31.应该指出,以下详细说明都是示例性的,旨在对本发明提供进一步的说明。 除非另有指明,本发明使用的所有技术和科学术语具有与本发明所属技术领域的 普通技术人员通常理解的相同含义。
32.需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限 制根据本发明的示例性实施方式。如在这里所使用的,除非上下文另外明确指出, 否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使 用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或 它们的组合。
33.一种加速高锰酸钾降解有机污染物的方法,包括如下步骤:
34.一、向待处理的水中加入n,n
‑
二乙基对苯二胺;
35.二、将待处理的水ph调节到5
‑
7的范围内;
36.三、向待处理的水中加入氧化剂,所述氧化剂为高锰酸钾,控制高锰酸钾 与n,n
‑
二乙基对苯二胺的摩尔比为50
‑
10。
37.本发明中,n,n
‑
二乙基对苯二胺试剂为预先溶解好的储备液,氧化剂为预先 溶解好的高锰酸钾储备液,所用溶剂为蒸馏水。
38.本发明中,加入n,n
‑
二乙基对苯二胺储备液后的待处理水必须将ph值调节 到5
‑
7,以保证n,n
‑
二乙基对苯二胺自由基氧化污染物的高活性。
39.本发明中,所述n,n
‑
二乙基对苯二胺包括n,n
‑
二乙基对苯二胺和n,n
‑
二乙 基对苯二胺的盐类。
40.本发明中,通过测定水中污染物的浓度变化,评价水中污染物的降解程度。
41.本发明中,待处理水为地表水、地下水、生活污水或工业废水中的至少一种。
42.本发明中,所述方法的关键是控制高锰酸钾和n,n
‑
二乙基对苯二胺的摩尔比。 当高锰酸钾和n,n
‑
二乙基对苯二胺的摩尔比大于50时,溶液中无法产生足量的 n,n
‑
二乙基对苯二胺自由基,虽然n,n
‑
二乙基对苯二胺的加入可以加速高锰酸 钾对污染物的降解,但是只能提高0
‑
4倍;高锰酸钾和n,n
‑
二乙基对苯二胺的 摩尔比小于10时,大量的高锰酸钾被消耗,转化为二氧化锰和二价锰离子,不 能持续实现污染物的降解,导致污染物的去除效果下降,甚至产生抑制作用。因 此,本技术选择高锰酸钾/n,n
‑
二乙基对苯二胺的摩尔比为50
‑
10。
43.本发明中n,n
‑
二乙基对苯二胺加速高锰酸钾氧化有机物的原理是:n,n
‑
二 乙基对苯二胺与高锰酸钾反应生成n,n
‑
二乙基对苯二胺自由基,n,n
‑
二乙基对 苯二胺自由基快速氧化有机污染物,本身被还原为n,n
‑
二乙基对苯二胺,还原 后的n,n
‑
二乙基对苯二胺继续与高锰酸钾反应生成n,n
‑
二乙基对苯二胺自由基。 本发明中n,n
‑
二乙基对苯二胺在体系中循环参与反应,因此投量远少于高锰酸 钾即可显著提高高锰酸钾氧化有机物的速率,并有效控制药剂成本。
44.本发明中,去除水中有机物的方式是在具有磁力搅拌或机械搅拌装置的反应 器中进行的,搅拌速度为30
‑
300转/分钟。
45.下面结合具体的实施例,对本发明做进一步的详细说明,应该指出,所述具 体实施例是对本发明的解释而不是限定。
46.以下实施例中,去除水中有机物的方式是在具有机械搅拌装置的反应器中进 行的,搅拌速度为200转/分钟。
47.实施例1:
48.在反应器中,将含有5微摩尔/升苯酚的模拟地表水调节ph=5,然后向模 拟水中加入50微摩尔/升高锰酸钾,苯酚的降解速率为6.17
×
10
‑5s
‑1。向含有5 微摩尔/升苯酚的模拟地表水中加入5微摩尔/升n,n
‑
二乙基对苯二胺,调节 ph=5,将50微摩尔/升高锰酸钾(即高锰酸钾/n,n
‑
二乙基对苯二胺摩尔比=10) 加入到上述模拟地表水中,苯酚的降解速率为7.12
×
10
‑4s
‑1。由于n,n
‑
二乙基对 苯二胺的加入,苯酚的降解速率提高了10.5倍。具体效果对比数据见图1。
49.实施例2:
50.本实施例与实施例1不同的是:n,n
‑
二乙基对苯二胺的投加量为1微摩尔/ 升,该反应条件下苯酚的降解速率比单独高锰酸钾降解苯酚的速率高4.1倍。具 体效果对比数据见图2。
51.实施例3:
52.本实施例与实施例1不同的是:n,n
‑
二乙基对苯二胺的投加量为2微摩尔/ 升,该反应条件下苯酚的降解速率比单独高锰酸钾降解苯酚的速率高5.2倍。具 体效果对比数据见图3。
53.实施例4:
54.本实施例与实施例1不同的是:n,n
‑
二乙基对苯二胺的投加量为3微摩尔/ 升,该反应条件下苯酚的降解速率比单独高锰酸钾降解苯酚的速率高6.8倍。具 体效果对比数据见图4。
55.实施例5
56.本实施例与实施例1不同的是:n,n
‑
二乙基对苯二胺的投加量为10微摩尔 /升,该反应条件下苯酚的降解速率比单独高锰酸钾降解苯酚的速率高8.7倍。
57.实施例6
58.本实施例与实施例1不同的是:反应的ph=6。由于n,n
‑
二乙基对苯二胺的 加入,苯酚的降解速率提高了5.4倍。具体效果对比数据见图5。
59.实施例7
60.本实施例与实施例1不同的是:反应的ph=7。由于n,n
‑
二乙基对苯二胺的 加入,苯酚的降解速率提高了1.0倍。具体效果对比数据见图6。
61.实施例8
62.本实施例与实施例1不同的是:所处理的水中的污染物是生活污水处理二级 出水中的环丙沙星。高锰酸钾和n,n
‑
二乙基对苯二胺联合使用处理生活污水二 级出水中环丙沙星,40分钟去除率达90%。当单独高锰酸钾氧化环丙沙星时, 40分钟仅能去除10%的环丙沙星。由于n,n
‑
二乙基对苯二胺的加入使得环丙沙 星去除的表观速率提高了17倍。具体效果对比数据见图7。
63.实施例9
64.本实施例与实施例1不同的是:所处理的水中的污染物是生活污水处理二级 出水中的双酚a。高锰酸钾和n,n
‑
二乙基对苯二胺联合使用处理生活污水二级 出水中双酚a,双酚a的降解速率为2.05
×
10
‑3s
‑1。当单独高锰酸钾氧化环丙沙 星时,双酚a的降解速率仅为6.77
×
10
‑4s
‑1。由于n,n
‑
二乙基对苯二胺的加入使 得双酚a去除的表观速率提高了3倍。具体效果对比数据见图8。
65.实施例10
66.本实施例与实施例1不同的是:高锰酸钾的投加量分别为10、20、30、40 微摩尔/升,n,n
‑
二乙基对苯二胺的投加量为1微摩尔/升,以上反应条件下苯酚 的降解速率皆比单独高锰酸钾降解苯酚的速率高。
67.实施例11
68.本实施例与实施例1不同的是:高锰酸钾的投加量分别为100、150、200 微摩尔/升,以上反应条件下苯酚的降解速率皆比单独高锰酸钾降解苯酚的速率 高。
69.由以上实施例可知,在ph 5
‑
7的范围内,选择摩尔比为50
‑
10:1的高锰酸 钾与n,n
‑
二乙基对苯二胺共同对含苯酚、环丙沙星、双酚a等有机污染物的废 水进行处理,可以有效提升污染物的降解速率。特别是,对于环丙沙星,降解速 率提升明显。
70.最后应该说明的是,以上所述仅为本发明的优选实施例而已,并不用于限制 本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人 员来说,其依然可以对前述实施例所记载的技术方案进行修改,或者对其中部分 进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改 进等,均应包含在本发明的保护范围之内。上述虽然对本发明的具体实施方式进 行了描述,但并非对本发明保护范围的限
制,所属领域技术人员应该明白,在本 发明的技术方案的基础上,本领域技术人员不需要付出创造性劳动即可做出的各 种修改或变形仍在本发明的保护范围以内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。