一种双靶点mrna疫苗及其制备方法
技术领域
1.本发明涉及一种双靶点mrna疫苗及其制备方法,属于生物医药技术领域。
背景技术:
2.肿瘤疫苗是用肿瘤细胞、肿瘤细胞裂解物或肿瘤抗原来激活机体免疫系统产生特异性抗肿瘤细胞免疫反应的一种治疗性的肿瘤治疗方法,包括全细胞疫苗、多肽类疫苗、rna/dna基因疫苗和树突状细胞疫苗。其中,mrna疫苗作为一种新型的核酸疫苗,能够表达任何蛋白质,可以从基因水平上治疗几乎所有基于蛋白质的疾病。相较于其他传统疫苗和dna疫苗技术,mrna疫苗的合成不仅生产工艺简单,且价格低廉。同时这种人为设计的核酸并不会诱发人体的免疫反应,不进入细胞核,无整合到基因组的风险,相对更安全。但mrna自身稳定性差、易被体内外的核酸酶降解、穿透细胞膜能力较差是制约其发展的瓶颈。因此,mrna疫苗需要有合适的递送载体将其递送至体内,才能有更好的免疫反应。
3.目前,肿瘤mrna疫苗使用最广泛是阳离子脂质和聚合物为基础的纳米制剂技术,可保护核酸药物免遭核酸酶的降解,成功实现包括sirna、mrna、cas9质粒等核酸药物在体内的稳定递送。阳离子脂质纳米颗粒(lnps)由阳离子脂质、聚乙二醇(peg)、胆固醇等组成,包裹着核酸药物被细胞膜内吞进入细胞内形成内体囊泡,伴随着一系列的结构变化,促使mrna从内体中解脱出来并与负责生产蛋白的核糖体结合,指导病毒蛋白的合成。lnps具有良好的生物相容性和理化性质,在体内外均展现了较高的基因转染效果,被证明是最安全的药物递送载体。已有被fda批准上市的rna药物(patisiran注射液)用于在体内递sirna或其他小寡核苷酸,但用于mrna疫苗递送的材料还非常有限。由于mrna易被降解及自身物理化学特征,现有的纳米材料对于mrna递送效率有限,以mrna为基础的肿瘤疫苗的发展与临床应用仍面临许多问题。因此,亟需开发一种新的治疗方法来实现mrna的有效递送及编码抗原的高效表达。
技术实现要素:
4.针对现有技术存在的不足,本发明提供一种双靶点mrna疫苗及其制备方法,实现以下发明目的:(1)本发明制备的mrna疫苗,包封率高;(2)本发明制备的lnp脂质体能够阻滞mrna的迁移,并保护mrna不被降解;提高细胞的转染效率;(3)本发明mrna疫苗产生的抗体蛋白高于裸露mrna;(4)本发明mrna疫苗能够有效地诱导t细胞产生免疫应答;(5)本发明mrna疫苗对肿瘤细胞的杀伤率高。
5.为解决上述技术问题,本发明采取以下技术方案:一种双靶点mrna疫苗,包括脂质体混合物和双靶点mrna;所述脂质体混合物,包括dlin
‑
mc3
‑
dma、dspc、胆固醇、peg200
‑
dmg,摩尔比为50 : 10 : 37.5 : 2.5;
所述双靶点mrna由线性化的重组质粒转录得到;所述重组质粒包含目的基因片段;所述目的基因片段由以下模块依次串联得到:5
′–
utr核酸人工序列、p53核酸人工序列、linker核酸人工序列、kras核酸人工序列、mitd核酸人工序列、3
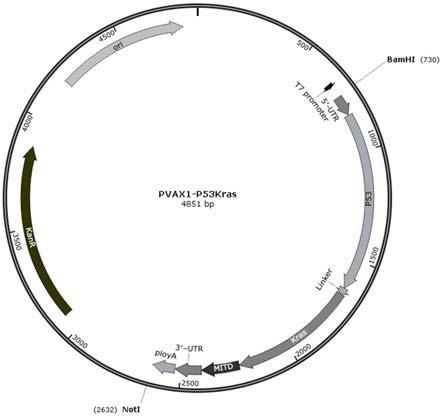
′–
utr核酸人工序列;所述5
′–
utr核酸人工序列如序列表中seq id no.1所示;所述p53核酸人工序列如序列表中seq id no.2所示;所述linker核酸人工序列如序列表中seq id no.3所示;所述kras核酸人工序列如序列表中seq id no.4所示;所述mitd核酸人工序列如序列表中seq id no.5所示;所述3
′–
utr核酸人工序列如序列表中seq id no.6所示。
6.以下是对上述技术方案的进一步改进:制备所述双靶点mrna疫苗的方法,包括目的基因片段的构建、重组质粒的构建、重组质粒线性化酶切及回收、转录获得mrna、包装mrna。
7.所述重组质粒的构建,将目的基因片段克隆到pvax1载体上,得到重组质粒;所述转录获得mrna,转录合成5
′
加帽,3
′
端加poly(a)尾的mrna。
8.所述包装mrna为采用脂质体混合物包载mrna。
9.所述包装mrna具体包括:脂质体混合物的乙醇溶液的制备、mrna水溶液的制备、合成lnp/mrna疫苗颗粒、制得疫苗。
10.所述脂质体混合物的乙醇溶液的制备:将脂质体混合物溶于乙醇中,得到脂质体混合物的乙醇溶液,所述脂质体混合物与乙醇的质量体积比为16.1
‑
16.2mg:1ml;所述mrna水溶液的制备:将转录得到的mrna,溶解在柠檬酸缓冲液中,吹打分散,加入pbs,充分混匀,得到mrna水溶液;所述mrna与柠檬酸缓冲液、pbs的质量体积比为:0.4
‑
3.2μg:1ml:2ml;所述合成lnp/mrna疫苗颗粒,使用纳米颗粒合成系统,将脂质体混合物的乙醇溶液与mrna水溶液以1:3的体积比,合成lnp/mrna疫苗颗粒;所述制得疫苗,将lnp/mrna疫苗颗粒在pbs溶液中透析24h,浓缩、过滤得到疫苗。
11.癌症是体细胞基因突变导致的一种病,p53基因和k
‑
ras基因的突变存在于一半以上的癌症中,在肿瘤中过度表达。p53基因突变失活后,影响正常的p53蛋白质的合成,抑制其功能,细胞失去对dna损伤的监控,很容易积累突变变成癌细胞;k
‑
ras基因发生突变,会使细胞持续生长,并抑制细胞自噬,使细胞内细胞转导紊乱,细胞增殖失控而发生癌变,肺癌、胰腺癌、结直肠癌等很多癌症都与k
‑
ras突变有关。
12.与现有技术相比,本发明取得以下有益效果:(1)本发明制备的mrna疫苗,靶向肿瘤细胞表达的p53和kras基因,特异性强,不易出现脱靶效应。
13.(2)本发明制备的mrna疫苗,粒径为92
‑
96 nm,包封率在98%以上,选取特定的lnp脂质体包裹mrna,能够阻滞mrna的迁移,并保护mrna不被降解,提高了mrna的递送效率,使得mrna进入细胞后直接进行翻译表达,lnp/mrna疫苗的蛋白质表达量是裸露mrna的2.3倍。
14.(3)本发明制备的mrna疫苗,能够有效地诱导t细胞产生免疫应答,提高细胞因子il
‑
2和ifn
‑
γ的分泌量。
15.(4)本发明制备的mrna疫苗,对肿瘤细胞的杀伤效果高,对肿瘤靶细胞的杀伤率达98.6%。
16.(5)本发明对体外转录的mrna模板,进行了修饰,5
′
加帽子和3
′
端加polya尾巴,保
护mrna不被降解。
17.(6)本发明构建的mrna疫苗,构建基因表达载体时,其分子结构5'加帽和3'加ploy(a)尾修饰,保护mrna在转染过程中免受核酸酶的降解,增加mrna的稳定性。
附图说明
18.图1 为实施例1制备的pvax1
‑
p53kras载体结构示意图。
19.图2为实施例1制备的 pvax1
‑
egfp载体结构示意图。
20.图3 为脂质纳米粒子结构图。
21.图4 为实施例7不同浓度的lnp/egfp转染293t细胞荧光表达图。
22.图5 为实施例8 不同的lnp纳米粒子转染细胞il
‑
2和ifn
‑
γ分泌量图。
具体实施方式
23.实施例1 目的基因的获得及重组质粒的构建本发明选取p53和k
‑
ras作为靶点,设计针对肿瘤的mrna疫苗。
24.pvax1
‑
p53kras载体各模块核酸序列如下:(1)5
′–
utr核酸人工序列(seq id no.1)(2)p53核酸人工序列(seq id no.2)(3)linker核酸人工序列(seq id no.3)(4)kras核酸人工序列(seq id no.4)(5)mitd核酸人工序列(seq id no.5)(6)3
′–
utr核酸人工序列(seq id no.6)依次将seq id no.1、seq id no.2、seq id no.3、seq id no.4、seq id no.5、seq id no.6基因序列连接,委托南京金斯瑞生物科技有限公司合成其整个表达框并插入标准载体puc57载体上,命名为puc
‑
p53kras。将puc
‑
p53kras载体和pvax1载体(seq id no.7)进行fast digest bamhi(购自thermo fisher公司)和fast digest noti(购自thermo fisher公司)双酶切,切胶回收获得线性化的dna片段,16℃进行过夜连接形成pvax1
‑
p53kras表达载体。将上述pvax1
‑
p53kras转化到e.coli(dh5α),挑取阳性克隆,进行pcr鉴定。提取质粒并送南京金斯瑞生物科技有限公司进行测序,测序鉴定正确,pvax1
‑
p53kras构建成功(载体结构见图1)。从阳性克隆中提取pvax1
‑
p53kras质粒,稀释至2μg/μl,保存于
‑
80℃待用。
25.采用同样的方法,再将egfp基因片段(seq id no.8)克隆到pvax1载体上,命名为pvax1
‑
egfp(载体结构见图2),测序鉴定正确,pvax1
‑
egfp构建成功。从阳性克隆中提取pvax1
‑
egfp质粒,稀释至2μg/μl,保存于
‑
80℃待用。
26.实施例2重组质粒线性化酶切及回收体外转录的模板要求具有rna聚合酶启动子,且要求质粒dna必须被限制性酶线性化,因为环状dna会产生很长的异构rna模板,且限制性内切酶位点必须在目的基因下游,酶切必须完全彻底,分别选用not i限制性酶来单酶切质粒(pvax1
‑
p53kras和pvax1
‑
egfp),优化后酶切体系(共50μl)如下:10xbuffer:3μl;noti酶:3μl;pvax1
‑
p53kras质粒:1μl (2μg/μl);水:43μl。
27.10xbuffer:3μl;noti酶:3μl;pvax1
‑
egfp质粒:1μl(2μg/μl);水:43μl。
28.两种质粒分别进行单酶切反应;在150μl离心管中按上述体系配好,在37℃水浴锅中酶切1h,迅速转入65℃水浴锅中5min,终止酶切反应。在1%琼脂糖凝胶电泳鉴定,所得片段大小符合预期。切下目的片段,采琼脂糖凝胶dna回收试剂盒对目的片段进行回收。
29.用分光光度计测量回收的dna浓度。测得pvax1
‑
p53kras酶切后片段浓度为1.1μg/μl,a260/280=1.83;pvax1
‑
egfp酶切后片段浓度为1.2μg/μl,a260/280=1.82,结果符合dna测定标准(a260/280=1.8
‑
2.1)。保存于
‑
20℃备用。
30.实施例3体外转录mrna(ivtmrna)以实施例2中线性化的dna为模板,使用加帽mmessagemmachinet7kit(ambion公司),体外转录合成5
′
加帽的mrna,具体操作步骤如下:表1转录反应体系1、按照说明书,在冰上配置反应体系(见表1),充分混匀后,离心到pcr管底,37℃孵育过夜。
31.2、加入1μldnasei,充分混匀,37℃孵育20min,去除产物中的dna。
32.3、采用licl沉淀法对mrna进行纯化:(1)加入25μldepc水至50μl体系;(2)加入25μllicl溶液,混匀;(3)放入
‑
20℃冰箱孵育30min;(4)4℃,12000g,离心15min,去除上清;(5)在沉淀中加入500μl70%冰乙醇,12000g,4℃,离心15min,去除上清;(6)重复步骤(5);(7)mrna用适量depc水重悬,使用微光分光光度计对mrna进行定量,测得mrna的浓度为2μg/μl。
33.4、mrna的3
′
端加poly(a)尾,冰上配置反应体系(见表2)。
34.表23
′
端加poly(a)尾反应体系
ꢀ
5、充分混匀,离心到管底,37℃孵育3h。
35.6、再次使用licl沉淀法对mrna进行纯化,方法同步骤3。纯化后的mrna用适量depc水重悬,得到mrna溶液,使用微分光光度计对mrna进行定量,测得mrna的浓度为2μg/μl,每管分装50μl,
‑
80℃冰箱保存mrna产物。
36.7、验证体外转录mrna长度:将mrna置于70℃水浴锅中10min,冰上放置3min,在尿素丙烯酰胺胶中进行电泳,100v恒压电泳30min,凝胶成像仪拍照,验证mrna的大小和完整性。
37.结果分析表明,对线性化的pvax1
‑
p53kras和pvax1
‑
egfp体外转录成的p53kras mrna和egfp mrna,在尿素丙烯酰胺胶中进行电泳,得到的mrna片段分别为1681bp和817bp,所得mrna与预期相符。
38.实施例4 包装mrna的lnp制备及其表征lnp成分包括:可电离的阳离子脂质(dlin
‑
mc3
‑
dma),带正电,与带负电的mrna静电相互作用,组装成病毒大小的颗粒,可促进mrna在细胞内递送并释放到细胞质 ;胆固醇,可以增强脂质体的流动性,稳定纳米粒子;磷脂(dspc),形成脂质双层结构;peg
‑
脂质(peg200
‑
dmg),提高纳米结构的稳定性,延长纳米药物在血液中的代谢时间。阳离子脂质体内部通过静电作用包裹mrna,peg
‑
脂质的疏水端与阳离子脂质的疏水端结合,peg
‑
脂质的亲水端(连有peg)则向外形成核酸脂质纳米粒的外壳,为了增强核酸脂质纳米粒的稳定性,添加适量的胆固醇等成分,最终得到核酸脂质纳米粒子的成品(见图3)。
39.具体操作步骤如下:p53kras mrna疫苗的制备方法:1、乙醇溶液制备称取10.4mg dlin
‑
mc3
‑
dma、2.7mg dspc、4.9mg 胆固醇和2.2mgpeg200
‑
dmg的固体(摩尔比为50 : 10 : 37.5 : 2.5)置于15ml rnase
‑
free管中,加入1.25ml乙醇,充分搅拌使其溶解,得到脂质体混合物的乙醇溶液。
40.2、水溶液制备将1μl的实施例3制备的mrna溶液(mrna的质量为2μg),溶解在1.25ml的10 mm柠檬酸缓冲液(ph=4) 中,上下吹打50次;加入2.5ml pbs,用力吹打50次,充分混匀,得到mrna水溶液。
41.3、lnp/mrna疫苗的合成
使用纳米颗粒合成系统(ignite),将脂质体混合物的乙醇溶液与mrna水溶液以1:3比例混合(体积比),合成lnp颗粒;将获得的lnp在pbs溶液(ph7.4)中透析24h,透析完得到含有lnp的溶液,使用amicon超离心过滤器浓缩至体积为1ml,过0.22um滤膜2次,保存于
‑
20℃备用,得到p53krasmrna疫苗,用lnp/p53kras表示,mrna的浓度为2μg/ml;所述浓度为最初加入的mrna的质量相对于终疫苗的质量体积比。
42.egfpmrna疫苗的制备:按照相同的方法制备egfpmrna疫苗,用lnp/egfp表示;pvax1
‑
p53kras(dna)疫苗:在p53krasmrna疫苗的制备方法的基础上,改变之处为:水溶液制备时,取等量的实施例1的pvax1
‑
p53kras质粒替代mrna溶液,pvax1
‑
p53kras(dna)疫苗用lnp/pvax1
‑
p53kras表示;空白对照:在p53krasmrna疫苗的制备方法的基础上,改变之处为:水溶液制备时,取等量的depc水替代mrna溶液,其余制备方法同p53krasmrna疫苗的制备,空白对照用lnp/空白表示。
43.实施例5lnp/mrna纳米粒子表征分析将实施例4制备的各组疫苗进行纳米颗粒的大小、所带电位、多分散性、包封率测定:1、纳米颗粒的大小、所带电位以及多分散性测定使用malvernzetasizernanozs90纳米粒径电位分析仪对制备纳米颗粒的大小、所带电位以及多分散性(pdi)情况,进行分析。具体方法如下:分别准备lnp/空白、lnp/p53kras、lnp/egfp三组样本各100μl,补加10mm柠檬酸缓冲液至1ml,滴入比色皿中;放入仪器,进行粒径、电位及pdi的测定。
44.结果表明(见表3),lnp/空白、lnp/p53kras,lnp/egfp粒子直径分别为108nm、96nm、92nm,由于lnp与mrna通过静电作用相互吸引,导致纳米粒子的直径略微缩小,并且相关研究表明,尺寸小的阳离子脂质体比尺寸大的阳离子脂质体转染效率更高;三者pdi均小于0.3,分散度较好;lnp/空白、lnp/p53kras,lnp/egfp的电位依次为32.3mv、20.2mv和21.2mv,由于核酸带负电,与脂质体结合后电位降低,此电位有助于粒子穿过细胞膜。
45.2、包封率测定采用超速离心法测量纳米粒子的包封率,具体操作步骤如下:准备lnp/空白、lnp/p53kras、lnp/egfp三组样本各1ml,浓度记为c0(2μg/ml),分别置于depc处理过的超滤管中,4℃、5000rpm,离心1h,分离未被包装的mrna和脂质体,离心后的上清液为未被包装的mrna,测得其浓度为c。以未离心前的样品计算总mrna量(c0),离心后的上清液为游离的mrna量(c),计算包封率。
46.包封率(%)=c0
‑
c/c0x100%。
47.结果表明(见表3),所得lnp/p53kras和lnp/egfp的包封率高达98%以上,mrna疫苗基本全部被包裹。
48.表3纳米颗粒表征
实施例6 凝胶阻滞实验为了评价lnp与mrna结合度,通过凝胶阻滞实验来验证。选取实施例4制备的纳米颗粒lnp/空白、lnp/p53kras,实施例3步骤6得到的mrna溶液(裸露的mrna)进行琼脂糖凝胶电泳,150v,电泳15min,置于化学发光凝胶成像仪下观察。
49.结果表明,对照组lnp/空白不发光;裸露的mrna由于部分降解,条带呈弥散状态;lnp/p53kras滞留在胶孔中,能够完全阻滞mrna的迁移。因此,本发明制备的lnp脂质体能够阻滞mrna的迁移,并保护mrna不被降解。
50.实施例7 体外细胞转染效果评价1、为了验证lnp/mrna所需剂量以及在细胞上的转染效果,选用便于观察和检测的egfp mrna作为模型。
51.将293t细胞接种于24孔板上,接种密度为5x105个细胞/孔,每孔加入1mldmem培养基(含有10% fbs)培养细胞,当细胞密度达到80%时,加入1ml不同浓度的lnp/egfp对细胞进行转染, 共设置六组实验,每组3个重复,分组如下:裸露mrna组(2μg/ml)、空白组(lnp/空白)、lnp/egfp(0.5μg/ml)组、lnp/egfp(1μg/ml)组、lnp/egfp(2μg/ml)组、lnp/egfp(4μg/ml)组,置于37℃、5%的co2条件下,共同孵育48h后,获取细胞悬液,通过流式细胞术检测egfp阳性细胞的百分比。
52.裸露mrna组:实施例3步骤6得到的mrna溶液。
53.lnp/egfp(0.5μg/ml)组、lnp/egfp(1μg/ml)组、lnp/egfp(4μg/ml)组,参照lnp/egfp(2μg/ml)组的制备方法,改变mrna的加入量。
54.结果表明(见图4),随着lnp/egfp浓度的升高,egfp阳性细胞表达率升高,当lnp/egfp浓度为2μg/ml时,egfp表达量最高,高达95%以上,表明egfp编码的mrna翻译成了荧光蛋白。裸露的mrna组绿色荧光表达较低,仅有31%,由于在转染过程中,裸露的mrna降解,影响蛋白质的表达。因此,本发明制备的脂质体能够保护mrna免被降解,提高细胞的转染效率。
55.2、elisa法检测将293t细胞接种于24孔板上,接种密度为5x105个细胞/孔,每孔加入1mldmem培养基(含有10% fbs)培养细胞,当细胞密度达到80%时,加入1ml lnp/p53kras(2μg/ml)对细胞进行转染。
56.设置三组实验,分组如下:裸露mrna组(实施例3步骤6得到的mrna溶液)、空白组(等体积dmem培养基(含有10% fbs))、实验组lnp/p53kras(2μg/ml),共孵育48h后,将293t细胞1500rpm离心5min,收集上清,弃细胞沉淀。细胞上清直接用包被液稀释10、100倍,进行elisa检测。elisa检测具体操作步骤如下:(1)取稀释液分别加入96孔酶标板中,100μl/孔,置于4℃冰箱过夜。
57.(2)用事先配置好的pbst洗板5次,每次200μl/孔,至少停留1min,甩板拍干。
58.(3)加入5% bsa封闭液,200μl/孔,将板子放于37℃培养箱中孵育2h。孵育完毕后甩掉封闭液,再次用pbst洗板5次,同上述清洗板子操作。
59.(4)加入anti
‑
p53 rabbit monoclonal antibody(按照1:600稀释),100μl/孔,将板子放于37℃培养箱中孵育2h。孵育后再次用pbst洗板5次,同上述清洗板子操作。
60.(5)加入二抗goatanti
‑
mouseigg,hrp conjugated (按照1:5000稀释),将板子放于37℃培养箱中孵育2h。孵育后再次用pbst洗板5次,同上述清洗板子操作。
61.(6)加入tmb显色液显色液100μl/孔,室温避光反应20min,加入100μl/孔终止液终止反应。置于多功能酶标仪读取450nm处的吸光值。
62.结果见表4,裸露mrna组和lnp/p53kras均产生了可与p53抗体蛋白特异性结合的抗原蛋白,与空白组形成了显著差异,elisa检测结果表明实验组lnp/p53kras纳米疫苗产生的抗体蛋白高于裸露mrna组,是其2.3倍。实验结果进一步表明,本发明提供的lnp纳米递送系统能够保护了p53kras mrna的降解,成功进入了细胞并表达p53蛋白。
63.表4 293t细胞中抗原蛋白表达情况实施例8细胞因子分泌检测il
‑
2和ifn
‑
γ是评估t细胞是否产生强烈免疫反应的关键指标,通过elsia方法检测t细胞的细胞因子分泌。
64.1、细胞培养(1)效应细胞将活化的t细胞接种于24孔板上,接种密度为5x105个细胞/孔,每孔加入1ml dmem培养基(含有10% fbs)培养细胞使其细胞密度达到80%时,分别加入1ml lnp/p53kras(2μg/ml)、1ml lnp/pvax1
‑
p53kras(2μg/ml)、1ml裸露mrna(2μg/ml)对细胞进行转染,共孵育48h,收集细胞,1500rpm离心5min,弃上清,所得细胞为三组效应细胞,对照组则不加入疫苗或者裸露mrna,其余方法同上。
65.(2)靶细胞以人肝癌细胞hep3b(购自上海信裕生物)作为靶细胞,使用dmem培养基(含有10% fbs)培养至对数生长期。
66.(3)细胞共培养用含有10% fbs的dmem培养基调整效应细胞(1
×
105/孔)与靶细胞(1
×
105/孔)的浓度并接种于96孔板,100μl/孔,分为四组,具体分组如下:实验组a:t细胞(lnp/p53kras转染)和hep3b细胞共培养;实验组b:t细胞(lnp/pvax1
‑
p53kras转染)和hep3b细胞共培养;实验组c:t细胞(裸露mrna转染)和hep3b细胞共培养;对照组 :t细胞(未转染)和hep3b细胞共培养;
每组三个重复,放入37℃,5% co2培养箱共培养72h,收集培养上清液用于细胞因子il
‑
2和ifn
‑
γ的检测。
67.2、细胞培养上清液ifn
‑
γ和il
‑
2的检测(1)取出ifn
‑
γ和il
‑
2试剂盒放置至室温,按说明书准备ifn
‑
γ和il
‑
2各5个标准品浓度梯度。抗体预包被孔中加入100μl标准品。
68.(2)样品准备,取100μl细胞培养上清直接加入孔板,同时设置空白对照组。
69.(3)每孔加入按比例稀释的生物素标记的一抗50μl,37℃孵育90min;孵育结束后弃上清,洗液清洗5次,每次1min;加入按比例稀释的酶结合二抗100μl,37℃孵育30min;孵育结束后弃上清,洗液清洗5次,每次1min。
70.(4)加入100μl底物tmb(3,3',5,5'
‑
四甲基联苯胺),37℃孵育显色5
‑
15min,显色明显后即可加入100μl终止液,置于酶标仪中od450 nm读数。
71.elisa结果显示(见图5和表5):lnp/p53kras组、dna组和裸露mrna组il
‑
2和ifn
–
r浓度均高于对照组,且lnp/p53kras组il
‑
2和ifn
–
r浓度最高。因此,本发明构建的lnp/mrna疫苗能够有效地诱导t细胞产生免疫应答。
72.表5 细胞因子分泌量(pg/ml)实施例9 lnp/mrna疫苗体外杀伤实验1、t细胞制备取50ml外周血,用tbd样本密度分离液(购自天津灏洋华科生物),分离获得pmbc。用含有1000 iu/ml重组干扰素α2a(购自沈阳三生制药)的培养基dmem(购自corning公司,88
‑
551
‑
cm)诱导培养24h后,加入1000iu/ml的重组il
‑
2(购自沈阳三生制药)、50ng/ml的okt
‑
3和5%的患者自体血浆诱导继续培养24h。每隔两天倍比加液,培养至第14天,流式细胞术检测t细胞中的cd3
、cd56
的阳性表达率(cd3
‑
fitc,cd16/cd56
‑
pe抗体购自beckman公司,a07735)。cd3
阳性率>90%,cd3
cd56
双阳性率>20%,视为t细胞诱导成功。
73.2、细胞培养(1)效应细胞将上述活化的t细胞接种于24孔板上,接种密度为5x105个/孔,每孔加入1ml dmem培养基(含有10% fbs)培养细胞使其细胞密度达到80%时,分别加入1ml lnp/p53kras(2μg/ml)、1ml lnp/pvax1
‑
p53kras(2μg/ml)、1ml裸露mrna(2μg/ml)对细胞进行转染,共孵育48h,收集细胞,1500rpm离心5min,弃上清,所得细胞为三组效应细胞。
74.对照组则不加入疫苗或者裸露mrna,其余方法同上。
75.(2)靶细胞以人肝癌细胞hep3b(购自上海信裕生物)作为靶细胞,使用dmem培养基和10% fbs培养至对数生长期。
76.(3)细胞共培养
用含有10% fbs的dmem培养基调整效应细胞(1
×
105/孔)与靶细胞(1
×
105/孔)的浓度并接种于96孔板,100μl/孔,分为三组,具体分组如下:lnp/p53kras组:t细胞(lnp/p53kras转染)和hep3b细胞共培养;lnp/pvax1
‑
p53kras组:t细胞(lnp/pvax1
‑
p53kras转染)和hep3b细胞共培养;裸露mrna组:t细胞(裸露mrna转染)和hep3b细胞共培养;对照组 :t细胞(未转染)和hep3b细胞共培养;置于5% co2、37℃培养箱培养,24 h后每孔加入20ml cck
‑
8,继续孵育2h后,酶标仪检测450nm波长,读取od值。计算细胞杀伤率:杀伤率/%=[1
‑
(空白组od值
‑
效应细胞组od值)/空白组od值]
×
100%。
[0077]
结果表明,lnp/p53kras组、lnp/pvax1
‑
p53kras组、裸露mrna组的杀伤率分别是98.6%、62.1%、41.3%,lnp/p53kras转染的t细胞杀伤率最高,显著高于lnp/pvax1
‑
p53kras组和裸露mrna组,lnp/p53kras组转染的杀伤率分别是lnp/pvax1
‑
p53kras组、mrna组的1.6倍、2.4倍。因此,本发明构建的lnp/p53kras能够保护mrna在转染时不被降解,诱导细胞产生较强的免疫反应,杀伤肿瘤细胞效果显著。
[0078]
综上所述,本发明成功构建了有效的mrna疫苗递送体系,既能保护mrna在转染过程中免受降解,又能增强机体的产生细胞免疫反应。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。