1.本发明涉及图像处理分析技术领域,具体涉及一种基于拉曼光谱的神经网络分类模型的构建方法及系统。
背景技术:
2.临床上使用最广泛的用于宫颈癌的早期筛查一种方法是巴氏涂片,巴氏涂片指宫颈脱落细胞涂片,是指从子宫颈部取少量的细胞样品,放在玻璃片上,然后在显微镜下研究是否异常。
3.尽管巴氏涂片被广泛接受为用于宫颈癌的筛查测试,但其可能不能检测出50到80%的低度癌病变及大约15%到30%的高度病变。这种方法造价低,在基层也可以应用,但是特异度不高。拉曼光谱(raman spectra),是一种散射光谱。拉曼光谱分析法是基于印度科学家c.v.拉曼(raman)所发现的拉曼散射效应,对与入射光频率不同的散射光谱进行分析以得到分子振动、转动方面信息,并应用于分子结构研究的一种分析方法。
4.目前已有通过结合光谱和图像的宫颈癌前病变筛查方法(公布号cn110946552b),需要通过对采集到的图像进行融合拼接,得到整体图像,再通过神经网络对整体图像进行特征识别、分类,该算法存在计算量大以及由此导致需要计算资源较多、计算效率较低的问题。
技术实现要素:
5.有鉴于此,本发明实施例提供了一种基于拉曼光谱的神经网络分类模型的构建方法及系统,以解决现有技术中结合光谱和图像的宫颈癌前病变筛查方法存在计算效率不够高的问题。
6.本发明实施例提供了一种基于拉曼光谱的神经网络分类模型的构建方法,应用于宫颈癌组织病变检测,包括:
7.s10,对单隐藏层神经网络的网络结构进行初始化;
8.s20,从数据库中选取将若干个训练样本,并按4:1的比例分为训练集和测试集,对单隐藏层神经网络进行训练;数据库包括宫颈各个部位的拉曼光谱图像数据;
9.s30,根据激活函数计算隐含层各神经元节点输出的训练结果;
10.s40,将训练结果与标准结果进行对比,并计算输出层偏差;
11.s50,判断输出层误差是否小于或等于预设值;
12.s601,若输出层偏差大于预设值,则对隐含层误差进行计算求解,得到输出层权值修正量、输出层阈值修正量、隐含层权值修正量和隐含层阈值修正量;
13.s602,依次对当前输出层权值、当前输出层阈值、当前隐含层权值和当前隐含层阈值进行调整,并跳转至s30;
14.s611,若输出层偏差小于或等于预设值,则停止循环计算,并保存当前输出层权值和当前隐含层权值,完成模型训练。
15.可选地,对单隐藏层神经网络的网络结构进行初始化,包括:
16.将最大迭代次数设置为1000;
17.将隐节点数设置为6;
18.将输出层初始权值、输出层初始阈值、隐含层初始权值和隐含层初始阈值设置为0~1之间的随机数;
19.将初始学习速率范围设置为0.01~0.5。
20.可选地,预设值设置的取值范围为0.00001~0.001。
21.可选地,数据库的建立包括:
22.对至少50例不同部位的宫颈组织进行拉曼光谱采集,得到至少1000个拉曼光谱图像数据;
23.筛选出所有拉曼光谱图像数据中500cm-1
~2000cm-1
波段的第一数据集;
24.对第一数据集并进行预处理,得到第二数据集;预处理包括基线修正拟合、曲线平滑以及归一化处理;
25.对第二数据集中的拉曼光谱图像数据根据dna、脂肪和蛋白质的各自对应特征峰分布以及特征峰强度变化进行特征提取,并保存到数据库中;
26.将疑似病变部位的组织病理学检查结果作为神经网络分类模型的标签来源,并保存到数据库中。
27.可选地,对隐含层误差进行计算求解,得到隐含层误差梯度,包括:
28.根据隐含层每个节点的输入、隐含层每个节点的输出、输出层每个节点的输入、输出层每个节点的输出和当前学习速率获取所有训练样本的总误差准则函数;
29.根据误差梯度下降法依次对当前输出层权值、当前输出层阈值、当前隐含层权值和当前隐含层阈值进行修正。
30.本发明实施例还提供了一种基于拉曼光谱的神经网络分类系统,采用前述的基于拉曼光谱的神经网络分类模型,应用于宫颈癌组织病变检测,包括:
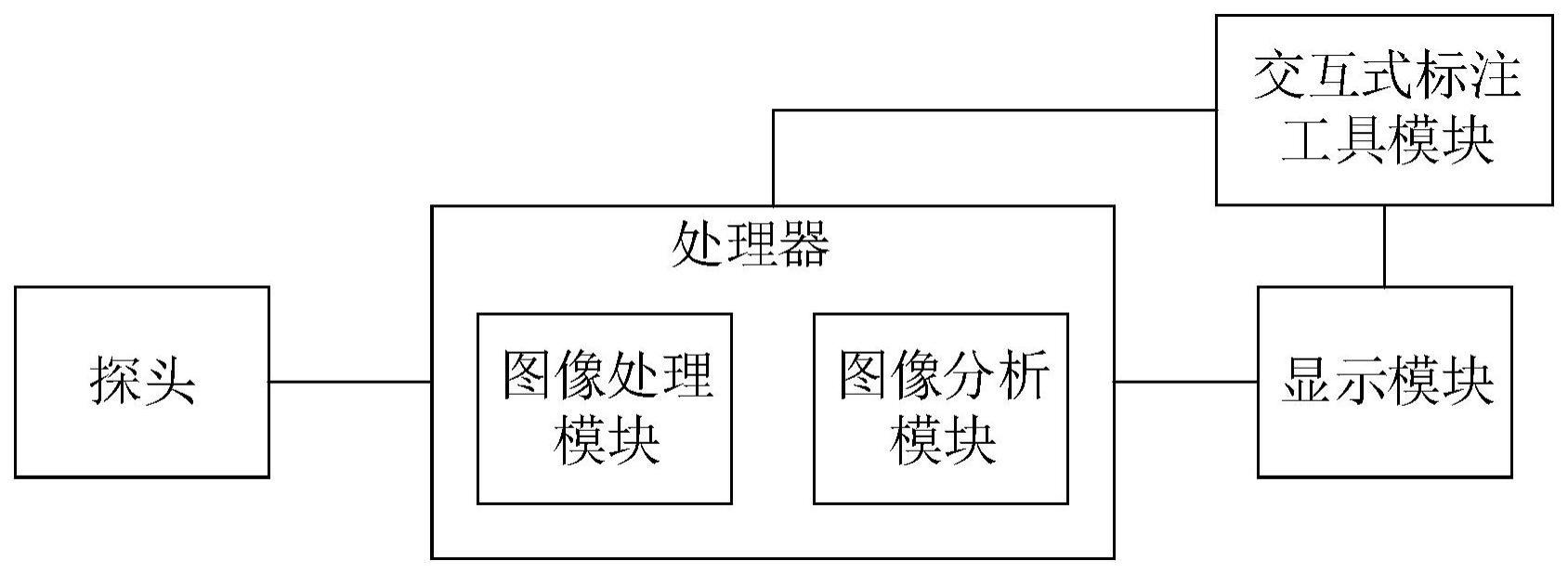
31.探头,用于进行宫颈组织图像的在体采集;
32.显示模块,用于显示宫颈组织图像;
33.交互式标注工具模块,用于在显示模块中显示的宫颈组织图像上对异常组织图像区域进行突出显示标注;
34.图像处理模块,用于对宫颈组织图像中突出显示标注的部分进行拉曼光谱采集,得到光谱图像;
35.图像分析模块,通过基于拉曼光谱的神经网络分类模型对光谱图像进行分类,并在宫颈组织图像上进行病变标记。
36.可选地,显示模块为显示器或触摸屏。
37.可选地,交互式标注工具模块为鼠标或触控笔。
38.可选地,图像处理模块还被配置为:
39.对宫颈组织图像中突出显示标注的部分进行第一次拉曼光谱采集,获取第一图像光谱;
40.对第一图像光谱的特征峰进行分析,确定特征峰的合理区间;
41.将处在合理区间内特征峰对应的图像光谱作为有效值,传输至图像分析模块。
42.可选地,对第一图像光谱的特征峰进行分析,确定特征峰的合理区间,包括:
43.将第一图像光谱的特征峰与数据库中dna、脂肪和蛋白质的各自对应特征峰分布以及特征峰强度变化进行比对,实现第一图像光谱的生物组织分类。
44.本发明实施例的有益效果:
45.对患处图像先进行异常区域选取,针对异常区域采用基于拉曼光谱特征峰差异的分类算法进行实时的无创检测,减少了计算量,提高分类算法的处理速度,能够缩短检测时间。根据建立的bp神经网络模型判断宫颈癌组织病变情况,辅助医生诊断,提高了宫颈癌筛查率和检查准确率。
附图说明
46.通过参考附图会更加清楚的理解本发明的特征和优点,附图是示意性的而不应理解为对本发明进行任何限制,在附图中:
47.图1示出了本发明实施例中一种基于拉曼光谱的神经网络分类系统的结构框图;
48.图2示出了本发明实施例中一种基于拉曼光谱的神经网络分类模型的构建方法的流程图。
具体实施方式
49.为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
50.本发明实施例提供了一种基于拉曼光谱的神经网络分类系统,应用于宫颈癌组织病变检测,如图1所示,包括探头、显示模块、交互式标注工具模块、图像处理模块和图像分析模块,图像处理模块和图像分析模块集成在处理器中。其中,探头用于进行宫颈组织图像的在体采集;显示模块用于显示宫颈组织图像;交互式标注工具模块用于在显示模块中显示的宫颈组织图像上对异常组织图像区域进行突出显示标注;图像处理模块用于对宫颈组织图像中突出显示标注的部分进行拉曼光谱采集,得到光谱图像;图像分析模块通过基于拉曼光谱的神经网络分类模型对光谱图像进行分类,并在宫颈组织图像上进行病变标记。
51.在本实施例中,将采集到的图像在显示器上显示,对异常组织图像区域利用交互式标注工具进行突出显示标注。对标注出的区域利用反射光谱成像,进行拉曼光谱采集,获取拉曼光谱采集后的图像光谱,再对图像光谱进行拉曼光谱特征峰分析,确定特征峰的合理区间,区分出图像对应的组织是dna、脂肪或蛋白质,筛除非病变组织,例如dna以及脂肪的图像光谱,再对蛋白质组织对应的图像光谱进行特征分类,并将分类结果标记在图像上。
52.对患处图像先进行异常区域选取,针对异常区域采用基于拉曼光谱特征峰差异的分类算法进行实时的无创检测,减少了计算量,提高分类算法的处理速度,能够缩短检测时间。根据建立的反向传播(back propagation,bp)神经网络模型判断宫颈癌组织病变情况,辅助医生诊断,提高了宫颈癌筛查率和检查准确率。
53.在具体实施例中,基于拉曼光谱的神经网络分类模型的构建方法包括:
54.s10,对单隐藏层神经网络的网络结构进行初始化。
55.在本实施例中,采用单隐藏层神经网络,隐藏节点数的确定利用经验公式其中α为1~10之间的常数,m为隐节点个数,n为输入个数,l为输出个数。在具体实施例中,将最大迭代次数设置为1000;将隐节点数设置为6;将输出层初始权值、输出层初始阈值、隐含层初始权值和隐含层初始阈值设置为0~1之间的随机数;将初始学习速率范围设置为0.01~0.5。
56.s20,从数据库中选取将若干个训练样本,并按4:1的比例分为训练集和测试集,对单隐藏层神经网络进行训练;数据库包括宫颈各个部位的拉曼光谱图像数据。
57.在本实施例中,数据库的建立包括:
58.对至少50例不同部位的宫颈组织进行拉曼光谱采集,得到至少1000个拉曼光谱图像数据;筛选出所有拉曼光谱图像数据中500cm-1
~2000cm-1
波段的第一数据集;对第一数据集并进行预处理,得到第二数据集;预处理包括基线修正拟合、曲线平滑以及归一化处理;对第二数据集中的拉曼光谱图像数据根据dna、脂肪和蛋白质的各自对应特征峰分布以及特征峰强度变化进行特征提取,并保存到数据库中;将疑似病变部位的组织病理学检查结果作为神经网络分类模型的标签来源,并保存到数据库中。
59.s30,根据激活函数计算隐含层各神经元节点输出的训练结果。
60.在本实施例中,根据激活函数计算各隐含层神经元节点输出,计算输出层神经元节点输出。
61.s40,将训练结果与标准结果进行对比,并计算输出层偏差。
62.在本实施例中,根据每个位点训练结果和对应位点医院tct(薄层液基细胞学)检查的标准结果进行对比,计算输出层偏差。
63.s50,判断输出层误差是否小于或等于预设值。
64.在本实施例中,预设值设置的取值范围为0.00001~0.001。在具体实施例中,根据实际需要对预设值进行选取设置。
65.s601,若输出层偏差大于预设值,则对隐含层误差进行计算求解,得到输出层权值修正量、输出层阈值修正量、隐含层权值修正量和隐含层阈值修正量。
66.在本实施例中,根据隐含层每个节点的输入、隐含层每个节点的输出、输出层每个节点的输入、输出层每个节点的输出和当前学习速率获取所有训练样本的总误差准则函数。
67.隐含层第i个节点的输入neti:
[0068][0069]
隐含层第i个节点的输出yi:
[0070][0071]
输出层第k个节点的输入netk:
[0072][0073]
输出层第k个节点的输出ok:
[0074][0075]
其中,xj表示输入层第j个节点的输入,j=1,
…
,m。w
ij
表示隐含层第i个节点到输入层第j个节点之间的权值。θi表示隐含层第i个节点的阈值。φ(x)表示隐含层的激励函数。w
ki
表示输出层第k个节点到隐含层第i个节点之间的权值,i=1,
…
,q。ak表示输出层第k个节点的阈值,k=1,
…
,l。ψ(x)表示输出层的激励函数。ok表示输出层第k个节点的输出。η为学习速率。
[0076]
对于样本p的二次型误差准则函数e
p
:
[0077][0078]
系统对p个训练样本的总误差准则函数e:
[0079][0080]
式中,tk表示第k个节点的真实值,表示在第k个节点上第p个样本的真实值,表示在第k个节点上第p个样本的输出值。
[0081]
根据误差梯度下降法,计算输出层权值的修正量δw
ki
、输出层阈值的修正量δak、隐含层权值的修正量δw
ij
和隐含层阈值的修正量δθi,并依次进行修正。
[0082][0083][0084][0085]
[0086]
s602,依次对当前输出层权值、当前输出层阈值、当前隐含层权值和当前隐含层阈值进行调整,并跳转至s30。
[0087]
输出层权值调整公式:
[0088][0089]
输出层阈值调整公式:
[0090][0091]
隐含层权值调整公式:
[0092][0093]
隐含层阈值调整公式:
[0094][0095]
又因为:
[0096]
[0097][0098][0099][0100][0101]
得到以下公式:
[0102][0103][0104][0105][0106]
s611,若输出层偏差小于或等于预设值,则停止循环计算,并保存当前输出层权值和当前隐含层权值,完成模型训练。
[0107]
在本实施例中,如图2所示,模型训练使用bp神经网络,将拉曼光谱图像数据作为训练样本,进行模型训练。
[0108]
作为可选的实施方式,显示模块为显示器或触摸屏。交互式标注工具模块为鼠标或触控笔。
[0109]
作为可选的实施方式,图像处理模块还被配置为:
[0110]
对宫颈组织图像中突出显示标注的部分进行第一次拉曼光谱采集,获取第一图像光谱;
[0111]
对第一图像光谱的特征峰进行分析,确定特征峰的合理区间;
[0112]
将处在合理区间内特征峰对应的图像光谱作为有效值,传输至图像分析模块。
[0113]
作为可选的实施方式,对第一图像光谱的特征峰进行分析,确定特征峰的合理区间,包括:
[0114]
将第一图像光谱的特征峰与数据库中dna、脂肪和蛋白质的各自对应特征峰分布以及特征峰强度变化进行比对,实现第一图像光谱的生物组织分类。
[0115]
在本实施例中,区分出图像对应的组织是dna、脂肪或蛋白质,筛除非病变组织,例如dna以及脂肪的图像光谱。
[0116]
针对现有的宫颈癌早期筛查方法存在的问题,本公开提出了一种基于拉曼光谱的
检测宫颈癌组织病变方法,通过拉曼光谱特征峰差异对患处图像进行实时的无创检测,根据建立的bp神经网络模型判断宫颈癌组织病变情况,辅助医生诊断,提高宫颈癌筛查率和检查准确率,同时减少患者在诊断中可能受到的身体创伤,有助于缓解患者在等候结果时的巨大心理压力。
[0117]
虽然结合附图描述了本发明的实施例,但是本领域技术人员可以在不脱离本发明的精神和范围的情况下作出各种修改和变型,这样的修改和变型均落入由所附权利要求所限定的范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。