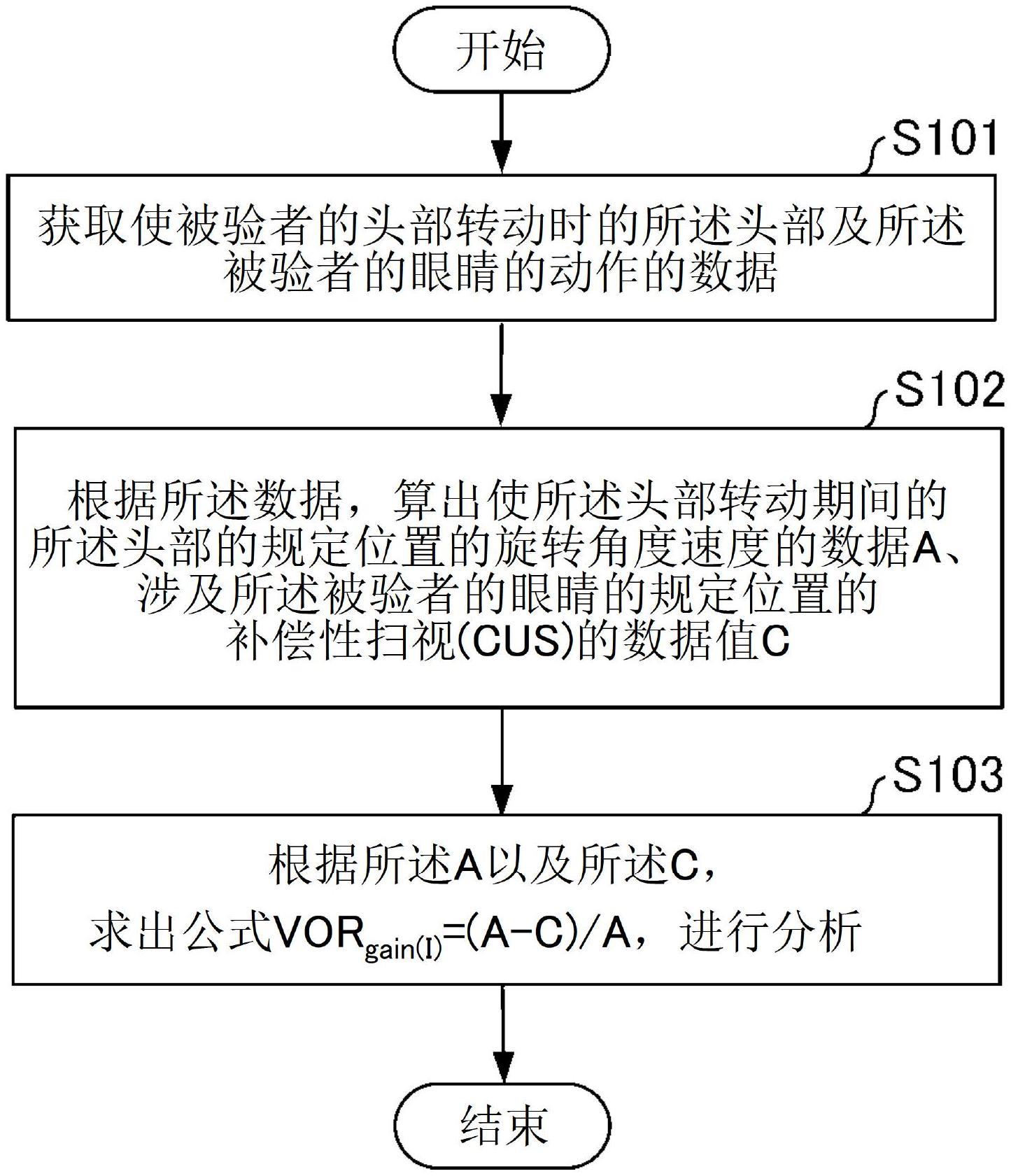
用于治疗实体瘤的组合物和方法
1.本技术要求2020年12月21日提交的美国临时申请第63/128218号、2021年8月10日提交的美国临时申请第63/231662号和2021年9月12日提交的美国临时申请第63/243147号的权益,所述美国临时申请的全部内容通过引用并入本文。
发明领域
2.本发明总体上涉及化疗剂的持续释放组合物及其用于实体瘤的局部治疗、预防切除后癌症复发和转移的用途。
3.背景
4.由于难以在肿瘤及其周围达到药物治疗水平持续足够的持续时间以有效杀死恶性肿瘤,全身疗法经常失败。剂量递增可以解决这个问题,但效力、增量毒性和相关成本之间的权衡仍有争议。
5.全身化疗剂施用的根本限制促进了开发局部药物递送平台作为增加有效性和减少副作用的解决方案。
6.局部药物递送为全身药物施用诸如口服或静脉给药提供了几个优点,这使它们成为有前景的癌症治疗方法。药物洗脱储库能够在疾病部位局部提供高浓度的药物,同时通过持续药物释放降低药物呈递的全身峰值。此外,局部持续药物递送系统提供连续的药物存在,改善疾病结果和患者依从性。又另外,局部药物递送减少并且甚至防止了全身药物给药时常见的全身副作用。这些优点使得储库在预防肿瘤复发和转移的癌症疗法中特别有前景(特别是在手术切除后的脏手术切缘(dirty surgical margins)处,在该处,持续的药物呈递可以影响留在手术切口周围的癌细胞),而有极小或没有明显的全身副作用。正在积极寻求用于局部递送的各种技术,包括微米或纳米颗粒形式的聚合物可生物降解持续释放系统和通常会出现爆发和衰减释放曲线的可植入膜或贴片。一种临床批准的疗法,使用聚酸酐载体(polifeposan),其提供卡莫司汀持续释放到脑的细胞外液中,消除了药物穿过血脑屏障的需要。基于可生物降解聚酯和聚酸酐的储库技术的限制之一是许多系统可用的药物释放时间段相对较短,以及由于剂量倾倒(爆发效应)和不一致的药物释放的潜在毒性。例如,在5-10天内释放大部分药物,并在前12h内显示出爆发释放(brudno等人,biomaterials 178(2018)373-382)。因为初始的爆发释放转化为过量的局部或全身药物浓度,爆发效应进一步限制了可以加载到储库中的药物总量。另一个重要的限制是释放的药物进入脑组织的低穿透。使用的药物穿透仅延伸到距切除的肿瘤5mm的最大距离,并且仅持续手术后1-2天的短时间段(dan bunis等人.efficacy of nanoparticle-encapsulated bcnu delivery in apcpp:sa scaffold for treatment of glioblastoma multiforme,2012)。us 9,956,172公开了药物递送多层植入物或晶片,用于邻近生物组织定位以向其递送药物,特别是用于在脑瘤切除后向脑递送化疗药物。us 9,956,172中公开的植入物包括包含药物、脂质和亲水性聚合物或孔形成剂的含药物层和包含疏水剂的疏水包衣。
7.多形性胶质母细胞瘤(gbm)是最常见和最具侵袭性的脑瘤形式之一,占人类中所
有脑癌的50%-60%,并且与低中位存活率相关联。gbm通常以高致死率、侵袭性、过度生长和预后不良为特征。目前对罹患脑瘤的患者的标准治疗包括肿瘤切除手术,随后是化疗(通常是口服替莫唑胺)和放射治疗,两者都在手术后约一个月给予。这种延迟治疗允许伤口开始愈合的过程。然而,手术切除的困难以及与辐照和化疗相关的严重副作用阻碍了这些方法。最重要的是,延迟的缺点是癌细胞在此时间段期间继续生长。
8.多西他赛是一种抗有丝分裂的紫杉烷(taxane)药物,被认为是对抗脑瘤最有效的药物之一,通常通过iv输注全身给予。然而,其高分子量和亲脂性结果限制了其抗脑瘤的活性,主要是由于穿过血脑屏障的转运受限和血脑肿瘤屏障的穿透性差。已知多西他赛会引起严重的不良事件,包括感染、中性粒细胞减少症、超敏反应、血小板减少症、神经病等等。
9.属于本发明的一个发明人和其他人的国际公布第wo 2010/007623号(其内容通过引用并入本文)公开了用于控制释放活性成分的药物递送组合物,所述药物递送组合物包含具有可生物降解的聚合物的基于脂质的基质。这些药物递送组合物能够捕获大量的一种或更多种生物活性分子,并以预编程的速率释放它们,持续从数天至数月的范围的时间段。
10.需要开发用广义地紫杉烷并且具体地多西他赛的局部化安全和强大的抗癌治疗,所述抗癌治疗具有降低的全身毒性,能够丰富其在肿瘤部位的有效载荷浓度,呈现增加的对靶肿瘤细胞的穿透,并且将促进肿瘤细胞的根除,并且同时减少肿瘤获得耐药性的机会和克服耐药性机制。
11.发明概述
12.本发明提供了持续释放抗赘生物组合物,以及利用这样的组合物用于癌症的局部治疗、防止癌症复发和抑制肿瘤转移的方法。
13.在本发明的第一方面中,提供了用于治疗实体瘤的方法,包括向患有实体瘤的受试者施用药物组合物,所述药物组合物包含包被有基于聚合物-脂质的基质的颗粒可生物降解基底,所述基质包含紫杉烷。在将其施加到肿瘤部位后,药物组合物在预定的延长时间段内,优选地高达10周内,在肿瘤部位及其周围提供紫杉烷药物的局部受控释放,从而改善药物的治疗作用。根据一些实施方案,在肿瘤切除后将药物组合物施用到肿瘤切除部位,从而杀死肿瘤切除腔处或紧密接近切除的组织的剩余癌细胞,并抑制癌症的局部复发。根据一些实施方案,实体瘤是脑瘤、结肠癌、前列腺癌、肺癌、胰腺癌、乳腺癌、食管癌、胃癌、头颈癌和软组织肉瘤中的至少一种。根据某些实施方案,实体瘤是选自以下的脑瘤:胶质母细胞瘤或多形性胶质母细胞瘤、高级别内在性脑瘤和另一种肿瘤在脑中的转移。根据具体实施方案,脑瘤是多形性胶质母细胞瘤。
14.在本发明的第二方面中,提供了局部持续释放组合物,所述组合物包含包被或浸渍有基于聚合物-脂质的基质的颗粒可生物降解基底,所述基于聚合物-脂质的基质包含嵌入其中的紫杉烷,所述组合物在储存期间并且进一步在其缓释时间段期间稳定紫杉烷并减缓紫杉烷向其7-差向异构体杂质的转换。
15.本发明部分地基于实验结果,该实验结果示出,根据本发明的一些实施方案,在对多西他赛耐药的结肠癌实体瘤的同基因小鼠模型中,与在用五个周期的全身多西他赛治疗治疗的组中仅25%的总无肿瘤存活率,以及在未治疗组中无存活相比,在肿瘤部分切除后的术中环境中单次施加包含多西他赛的持续释放组合物导致在研究结束时(手术后第39天)75%的总无肿瘤存活率。另外,与广泛全身治疗中75%复发和未治疗组中的100%复发
相比,用所述组合物治疗的小鼠在研究结束时示出25%的总肿瘤复发。此外,与全身治疗组和未治疗的对照组两者中仅9天的延迟肿瘤复发相比,用多西他赛持续释放组合物治疗的组在肿瘤切除后30天展示延迟的肿瘤复发,如通过每组中的第一个肿瘤相关死亡确定的。
16.此外,根据本发明某些实施方案的多西他赛持续释放组合物在部分切除的人类胶质母细胞瘤皮下小鼠模型中诱导了对肿瘤生长和复发的强烈抑制。所述组合物的单次局部施加,与未治疗的对照相比,诱导了98%的肿瘤生长抑制(术后第41天)(p《0.001),并且与全身化疗治疗组的多于一次注射相比,诱导了66%的肿瘤生长抑制(p=0.0165)。多西他赛持续释放组合物的第41天存活率远高于全身治疗小鼠或未治疗小鼠,存活率分别为60%、20%和10%。
17.再进一步,在大鼠模型中,在未切除的胶质母细胞瘤脑瘤旁边局部施加多西他赛组合物,与标准全身治疗组(替莫唑胺33.5mg/kg,5个治疗日)、安慰剂组(不含多西他赛的组合物)和未治疗的对照组中0%的存活率相比,在治疗开始后的第23天示出40%的存活率。
18.根据本发明的一些实施方案,用于治疗实体瘤的方法包括向患有实体瘤的受试者施用药物组合物,所述药物组合物包含:(a)颗粒可生物降解基底;(b)可生物降解聚合物;(c)具有至少12个碳原子的烃链的至少一种磷脂以及(d)紫杉烷。根据一些实施方案,药物组合物还包含固醇。根据各种实施方案,紫杉烷选自由以下组成的组:多西他赛、紫杉醇、紫杉醇衍生物和卡巴他赛。根据具体实施方案,紫杉烷是多西他赛。根据一些实施方案,实体瘤是脑瘤、前列腺癌、肺癌、胰腺癌、乳腺癌、食管癌、胃癌、头颈癌和软组织肉瘤中的至少一种。根据某些实施方案,实体瘤是选自胶质母细胞瘤或多形性胶质母细胞瘤和高级别内在性脑瘤的脑瘤。根据具体实施方案,脑瘤是多形性胶质母细胞瘤。根据一些实施方案,肿瘤是耐化疗肿瘤。根据一些实施方案,肿瘤是耐紫杉烷肿瘤。
19.根据本发明的一些实施方案,本发明提供了一种用于减少实体瘤切除部位肿瘤细胞再生长的方法,包括向实体瘤切除部位施用药物组合物,所述药物组合物包含:(a)颗粒可生物降解基底;(b)可生物降解聚合物;(c)具有至少12个碳原子的烃链的至少一种磷脂以及(d)紫杉烷。根据一些实施方案,药物组合物还包含固醇。根据各种实施方案,紫杉烷选自由以下组成的组:多西他赛、紫杉醇、紫杉醇衍生物和卡巴他赛。根据具体实施方案,紫杉烷是多西他赛。根据一些实施方案,实体瘤是脑瘤、前列腺癌、肺癌、胰腺癌、乳腺癌、食管癌、胃癌、头颈癌和软组织肉瘤中的至少一种。根据某些实施方案,实体瘤是选自胶质母细胞瘤或多形性胶质母细胞瘤和高级别内在性脑瘤的脑瘤。根据具体实施方案,脑瘤是多形性胶质母细胞瘤。根据一些实施方案,肿瘤是耐化疗肿瘤。根据一些实施方案,肿瘤是耐紫杉烷肿瘤。
20.根据一些实施方案,本发明提供了一种抑制肿瘤转移的方法,包括向患有恶性实体瘤的受试者施用药物组合物,该药物组合物包含(a)颗粒可生物降解基底;(b)可生物降解聚合物;(c)具有至少12个碳原子的烃链的至少一种磷脂以及(d)紫杉烷,从而抑制肿瘤转移。根据一些实施方案,药物组合物还包含固醇。根据各种实施方案,紫杉烷选自由以下组成的组:多西他赛、紫杉醇、紫杉醇衍生物和卡巴他赛。根据具体实施方案,紫杉烷是多西他赛。根据一些实施方案,在至少一部分恶性肿瘤已经被手术去除后,立即将药物组合物施用到恶性肿瘤切除部位。根据一些实施方案,实体瘤是脑瘤、结肠癌、前列腺癌、肺癌、胰腺
癌、乳腺癌、食管癌、胃癌、头颈癌和软组织肉瘤中的至少一种。根据某些实施方案,实体瘤是选自以下的脑瘤:胶质母细胞瘤或多形性胶质母细胞瘤、高级别内在性脑瘤和来源于其他肿瘤在脑中的转移。根据具体实施方案,脑瘤是多形性胶质母细胞瘤。根据一些实施方案,肿瘤是耐紫杉烷肿瘤。
21.根据本发明的一些实施方案的用于治疗实体瘤的方法提供了辅助癌症疗法。本文描述的药物组合物意图用于在肿瘤切除手术期间或之后不久局部施用至肿瘤切除腔,以增加癌症患者的存活率。本发明的药物组合物在术中肿瘤切除环境中提供对紫杉烷药物的延长和控制的局部暴露,允许紫杉烷药物吸收和分布到切除肿瘤部位的局部环境中,以在延长的时间段内提供治疗水平的紫杉烷,从而杀死在肿瘤切除环境处或附近未切除的肿瘤细胞,减少局部肿瘤复发和肿瘤转移扩散。紫杉烷在药物组合物施加到肿瘤切除环境后立即开始从药物组合物释放,并遵循零级或接近零级的动力学。紫杉烷持续释放2-10周的时间段,没有初始爆发(包埋在组合物中的紫杉烷的小于10%在最初24小时内释放,典型地,紫杉烷的小于8%、7%、6%、5%(w/w)在最初24小时内释放),因此避免了来源于剂量倾倒(爆发效应)的潜在毒性。
22.紫杉烷药物局部释放持续2-10周;2-8周;可选地,2-6周,可选地,2-5周;可选地,在2-4周之间的时间段,这通常是肿瘤切除手术与起始辅助放射疗法、化疗治疗和/或生物治疗(所有这些通常仅在手术伤口开始愈合过程之后才起始)之间的时间滞后。肿瘤去除手术后延迟给予辅助治疗的缺点是癌细胞在此时间段期间继续生长和扩散。本发明的方法和药物组合物克服了这一限制。
23.根据一些实施方案,本发明提供了用于治疗实体瘤的新辅助方法,包括肿瘤内注射药物组合物,该药物组合物包含(a)颗粒可生物降解基底;(b)可生物降解聚合物;(c)具有至少12个碳原子的烃链的至少一种磷脂以及(d)紫杉烷。根据一些实施方案,药物组合物还包含固醇。根据各种实施方案,紫杉烷选自由以下组成的组:多西他赛、紫杉醇、紫杉醇衍生物和卡巴他赛。根据具体实施方案,紫杉烷是多西他赛。根据一些实施方案,实体瘤是脑瘤、前列腺癌、肺癌、胰腺癌、乳腺癌、食管癌、胃癌、头颈癌和软组织肉瘤中的至少一种。新辅助治疗的目的是在用于提取肿瘤的手术程序或放射疗法之前减小肿瘤尺寸,从而简化手术程序并降低手术程序期间癌细胞扩散的风险。根据一些实施方案,可以使用适合于注射干粉的装置将药物组合物作为干粉直接注射到肿瘤中。可选地,药物组合物可以作为液体悬浮液注射。根据一些实施方案,肿瘤是耐化疗肿瘤。根据一些实施方案,肿瘤是耐紫杉烷肿瘤。
24.根据一些实施方案,本发明的药物组合物和方法中使用的颗粒可生物降解基底包含通常为球形或类似球形的颗粒。在一些实施方案中,不必是球形和/或类似球形,但优选是球形和/或类似球形的颗粒可以具有至少约30μm、至少约40μm、至少约50μm、至少约60μm、至少约70μm、至少约80μm、至少约90μm、至少约100μm、在30μm和120μm之间、在30μm和100μm之间、在50μm和100μm之间、不超过约200μm、不超过约180μm、不超过约150μm、不超过约140μm、不超过约130μm、不超过约120μm、不超过约110μm、不超过约100μm的平均直径(如通过激光衍射测量的)。每种可能性代表本发明的单独的实施方案。根据一些实施方案,本文描述的组合物和方法中使用的颗粒基底是生物相容性、生物可吸收的亲水性材料,其在水中具有低溶解度,使得其在不短于4周、5周、6周、7周、8周、9周且优选不短于10周的时间段内在
体内完全消除或溶解,并且还在环境温度具有固体形状和可成形性。具有这些特性的任何材料可以被无限制地使用。根据某些实施方案,颗粒基底包含磷酸三钙(tcp),优选地包含β-tcp。根据其他实施方案,颗粒基底由聚乙烯醇(pva),优选地具有至少88%水解度的pva组成。根据一些实施方案,颗粒可生物降解基底不是硫酸钙或相关水合物,诸如二水合钙或半水合硫酸钙。不受理论或作用机制的限制,表明包被可生物降解基底颗粒表面的聚合物-脂质基质保护基底颗粒免受溶解降解。基底颗粒的逐渐溶解仅在聚合物-脂质基质降解后其表面暴露于体液时才开始。颗粒的尺寸足够大,以确保它们不会从施用部位转移,至少直到大部分且优选所有药物已经释放。可生物降解基底的尺寸对于确保本文公开的药物组合物不会从它们的施加部位迁移是必要的。当有毒药物,诸如化疗剂被释放时,这是特别重要的。因此,重要的是颗粒的总体形状在药物释放时间段期间不会显著变化。根据一些实施方案,所使用的药物组合物在紫杉烷药物释放时间段期间损失其总重量的约10%至15%之间。包含紫杉烷的持续释放组合物被设计成锚定在组织中,防止它们随着时间意外迁移到其他区室和器官。根据一些实施方案,颗粒可生物降解基底构成药物组合物总重量的约80%-93%(w/w)之间。
25.根据本发明实施方案的药物组合物中的可生物降解聚合物是聚酯。根据一些实施方案,聚酯选自由以下组成的组:聚乳酸(pla)、聚乙醇酸(pga)、聚乳酸-共-乙醇酸(plga)和聚己内酯及其任何组合或共聚物。根据具体实施方案,聚酯是plga。根据一些实施方案,聚酯组分构成药物组合物总重量的0.5%-5%(w/w)。
26.根据一些实施方案,磷脂包含各自至少12个碳原子的脂肪酸链。在一些实施方案中,磷脂的脂肪酸链各自包含不超过18个碳原子。在一些实施方案中,磷脂的脂肪酸链是完全饱和的。在一些实施方案中,磷脂脂肪酸链的至少一个是不饱和的(例如含有至少一个双键)。在一些实施方案中,两条磷脂脂肪酸链都是不饱和的。根据一些实施方案,具有至少12个碳原子的烃链的磷脂具有小于60℃、小于55℃、小于50℃、小于45℃、小于42℃、小于40℃、小于38℃、小于35℃、小于32℃、小于30℃、小于28℃、小于25℃的相变温度。在一些实施方案中,磷脂包括选自由以下组成的组的磷脂:磷脂酰胆碱、磷脂酰胆碱的混合物、磷脂酰乙醇胺及其组合。根据一些实施方案,第二脂质包含磷脂酰胆碱或磷脂酰胆碱的混合物。在一些实施方案中,磷脂酰胆碱选自由以下组成的组:dmpc、dppc、dspc、dopc及其任何组合。在一些实施方案中,磷脂酰胆碱选自dmpc、dppc、dspc及其任何组合。在一些实施方案中,磷脂酰胆碱选自dmpc、dppc及其任何组合。在一些实施方案中,磷脂酰胆碱选自dmpc、dspc及其任何组合。根据某些实施方案,磷脂酰胆碱是dmpc。在一些实施方案中,磷脂组分构成药物组合物总重量的2%-15%(w/w)。
27.根据一些实施方案,药物组合物还包含固醇。在一些实施方案中,固醇是植物固醇。在一些实施方案中,固醇是动物固醇。根据具体的实施方案,固醇是胆固醇。在一些实施方案中,固醇构成药物组合物总重量的0-4%(w/w)。在一些优选的实施方案中,固醇是胆固醇并且构成所述药物组合物的总脂质含量的高达50%(w/w)。总脂质含量是指药物组合物中所有脂质(例如固醇、磷脂和药物组合物中包含的任何另外的脂质添加剂)的总质量。根据一些实施方案,固醇和聚合物是非共价缔合的。
28.根据一些实施方案,紫杉烷被掺入基于聚合物-脂质的基质中。根据一些实施方案,紫杉烷构成本文描述的方法中使用的药物组合物总重量的0.2%和2.6%(w/w)之间。可
选地,紫杉烷构成药物组合物总重量的0.5%和1.5%(w/w)之间。根据某些实施方案,紫杉烷构成药物组合物总重量的0.7%和1.3%(w/w)之间,可选地0.7%和1.0%(w/w)之间。根据各种实施方案,紫杉烷选自由以下组成的组:多西他赛、紫杉醇、紫杉醇衍生物和卡巴他赛。根据具体实施方案,紫杉烷是多西他赛。根据本发明方法的一些实施方案,将药物组合物施用到实体瘤的表面或在手术去除肿瘤后施用到实体瘤的切除腔的表面。根据本发明方法的一些实施方案,药物组合物以范围为每1cm2表面积20mg至260mg的量施加到实体瘤的表面或切除腔的内表面。根据可选的实施方案,组合物以范围为每1cm
2 50mg至160mg;50mg至160mg;50mg至150mg之间;50mg至120mg之间;50mg至100mg之间;50mg至100mg;75mg至160mg之间;75mg至120mg之间;75mg至100mg之间的量施加。
29.根据一些实施方案,药物组合物为粉末形式。根据一些实施方案,粉末被散布或喷洒在肿瘤的表面上,或者被施加到切除腔的内表面。另外地或可选地,粉末可以使用合适的粉末注射器进行瘤内注射。根据本发明的某些实施方案,药物组合物在其施加到肿瘤部位或切除腔的肿瘤内表面之前被配制成糊剂。根据一些实施方案,将糊剂例如用抹刀散布在肿瘤的表面上或施加到切除腔的内表面。根据其他实施方案,药物组合物可以配制成用于注射的悬浮液。
30.根据本发明的一些实施方案的用于治疗实体瘤的方法包括向患有实体瘤的受试者施用药物组合物,所述药物组合物包含:(a)磷酸三钙颗粒;(b)聚酯;(c)具有至少12个碳原子的烃链的磷脂酰胆碱和(d)紫杉烷,其中组合物意图用于局部施用到实体瘤的表面或施用到实体瘤切除腔的内表面。根据一些实施方案,组合物还包含胆固醇。根据一些实施方案,紫杉烷选自由以下组成的组:多西他赛、紫杉醇、紫杉醇衍生物和卡巴他赛。根据具体实施方案,紫杉烷是多西他赛。根据一些实施方案,聚酯是plga(聚(乳酸-共-乙醇酸)。根据一些实施方案,磷脂酰胆碱烃链是饱和的。根据一些实施方案,磷脂酰胆碱是1,2-二肉豆蔻酰-sn-甘油-3-磷酸胆碱(dmpc)。根据一些实施方案,多西他赛构成药物组合物总重量的0.2%和2.6%(w/w)之间。可选地,多西他赛构成药物组合物总重量的0.5%和1.5%(w/w)之间。根据某些实施方案,多西他赛构成药物组合物总重量的0.7%和1.3%(w/w)之间,可选地0.7%和1.0%(w/w)之间。根据一些实施方案,磷酸三钙(tcp)选自由以下组成的组:α-磷酸三钙、β-磷酸三钙及其组合。根据具体实施方案,tcp是β-磷酸三钙。根据一些实施方案,药物组合物以范围为每1cm2表面积20mg至500mg的量施加到实体瘤的表面或切除腔的表面。根据可选的实施方案,组合物以范围为每1cm
2 50mg至400mg、50mg至350mg、50mg至300mg、50mg至275mg、50mg至250mg、50mg至225mg、50mg至200mg、50mg至180mg、50mg至170mg;50mg至160mg;50mg至150mg之间;50mg至120mg之间;50mg至100mg之间;50mg至100mg;75mg至160mg之间;75mg至120mg之间;75mg至100mg之间的量施加。根据一些实施方案,实体瘤是脑瘤。根据一些实施方案,脑瘤是多形性胶质母细胞瘤。根据一些实施方案,肿瘤是耐紫杉烷肿瘤。
31.根据某些实施方案,本发明提供了用于治疗实体瘤的方法,包括向实体瘤表面或实体瘤的切除腔表面局部施用药物组合物,该药物组合物包含(a)80%-93%(w/w)的磷酸三钙颗粒;(b)1%-4.0%(w/w)聚酯;(c)0.0-2.0%(w/w)的胆固醇;(d)4.0%-15.0%(w/w)的具有至少12个碳原子的烃链的磷脂酰胆碱;(e)0.2%-2.6%(w/w)的多西他赛。根据一些实施方案,多西他赛构成药物组合物总重量的0.5%和1.5%(w/w)之间。根据某些实施方
案,多西他赛构成药物组合物总重量的0.7%和1.3%(w/w)之间,可选地0.7%和1.0%(w/w)之间。根据一些实施方案,聚酯是plga(聚(乳酸-共-乙醇酸))。根据一些实施方案,磷脂酰胆碱烃链是饱和的。根据一些实施方案,磷脂酰胆碱是1,2-二肉豆蔻酰-sn-甘油-3-磷酸胆碱(dmpc)。根据一些实施方案,磷酸三钙(tcp)选自由以下组成的组:α-磷酸三钙、β-磷酸三钙及其组合。根据具体实施方案,tcp是β-磷酸三钙。根据一些实施方案,药物组合物以范围为每1cm2表面积20mg至500mg的量施加到实体瘤的表面或切除腔的表面。根据可选的实施方案,组合物以范围为每1cm
2 50mg至400mg、50mg至350mg、50mg至300mg、50mg至275mg、50mg至250mg、50mg至225mg、50mg至200mg、50mg至180mg、50mg至170mg;50mg至160mg;50mg至150mg之间;50mg至120mg之间;50mg至100mg之间;50mg至100mg;75mg至160mg之间;75mg至120mg之间;75mg至100mg之间的量施加。根据一些实施方案,实体瘤是脑瘤。根据一些实施方案,脑瘤是多形性胶质母细胞瘤。根据一些实施方案,肿瘤是耐多西他赛肿瘤。
32.本文公开的药物组合物的ph固有地由药物组合物中存在的赋形剂提供。根据一些实施方案,药物组合物的ph在7.0和9.0之间,如通过ph电极solids go-ism测量的,优选地在7.5和8.5之间。根据一些实施方案,药物组合物还包含ph调节剂。可以向药物组合物中添加ph调节剂诸如缓冲液或酸,以将ph保持在3.5至7;3.5至6.5;4至6;4至5.5;4至5或4至4.5。每种可能性代表本发明的单独的实施方案。根据一些实施方案,保持药物组合物的ph低于7,优选地低于6,更优选地在4至5之间,稳定紫杉烷并减缓紫杉烷在储存期间向其7-差向异构体杂质的转换。根据某些实施方案,紫杉烷是多西他赛,并且药物组合物的ph在4至5.5之间。可包含在药物组合物中的合适的酸包括有机酸,诸如乙酸、丙酸、乙醇酸、丙酮酸、草酸、苹果酸、丙二酸、琥珀酸、马来酸、富马酸、酒石酸、柠檬酸、苯甲酸、肉桂酸、扁桃酸、甲磺酸、乙磺酸、对甲苯磺酸、水杨酸及其混合物,以及无机酸,诸如盐酸、磷酸、硝酸和硫酸,或其组合。乙酸是优选的ph调节剂。根据一些实施方案的药物组合物中的ph调节剂的量在药物组合物总重量的0.1%-5%(w/w);0.1%-4%(w/w);0.1%-3%(w/w);0.1%-2%(w/w);0.2%-2%(w/w);0.3%-2%(w/w);0.5%-2%(w/w);0.5%-1.8%(w/w);0.5%-1.7%(w/w);0.5%-1.6%(w/w);0.5%-1.5%(w/w);0.5%-1.4%(w/w);0.5%-1.3%(w/w);0.5%-1.2%(w/w);0.5%-1.1%(w/w)或0.5%-1.0%(w/w)之间。每种可能性代表本发明的单独的实施方案。
33.化疗药物从切除肿瘤的表面深入到癌组织的组织穿透是一个主要的挑战。尽管基于靶向剂或增强渗透性和滞留性(epr)的主动或被动靶向疗法可以改善化疗的治疗作用,但肿瘤间质中纳米医学的穿透性仍然存在挑战(xiaoqian等人biomacromolecules 2019,20:2637-48)。迄今为止,在大多数疗法中,活性剂未能有效穿透到肿瘤组织中。在治疗脑瘤时,这一挑战甚至更大。多形性胶质母细胞瘤是一种弥漫性脑瘤,其特征是高度浸润到脑实质。与局部(小胶质细胞)和浸润性免疫细胞(巨噬细胞和treg细胞)(这些细胞产生对肿瘤生长和扩展到脑中重要的细胞因子和基质降解酶)的相互作用促进了这一过程。作为结果,很难并且几乎不可能通过神经手术完全去除(切除)gbm肿瘤而不显著危及患有神经损伤的患者。因此,尽管神经手术不断取得进展,但gbm浸润行为会干扰肿瘤的完全切除,并且肯定是患者临床结果不良的主要原因。本发明提供了改善药物从切除表面穿透到组织中的三个主要因素;(1)紧邻肿瘤切除腔表面的高局部浓度,(2)长时间暴露于所述高浓度,和(3)释放的化疗剂的物理保护。延长的时间段内高局部浓度允许释放的药物的更高驱动浓度的发
展,从而不仅延长了药物的暴露,而且进一步支持其更深地穿透到组织中,从而能够根除已经渗透到离表面更远的肿瘤细胞。根据一些实施方案,使用本文公开的方法和组合物的紫杉烷穿透延伸到距切除的肿瘤的表面(例如剩余肿瘤切缘的外边界)至少0.5cm的距离,如通过定量放射自显影术测量的。根据一些实施方案,药物穿透延伸到距切除的肿瘤的表面至少0.6cm、0.7cm、0.8cm、0.9cm、1.0cm、1.2cm、1.3cm、1.4cm、1.5cm、1.6cm、1.7cm、1.8cm、1.9cm、2.0cm、2.1cm、2.2cm、2.3cm、2.4cm、2.5cm、2.6cm、2.7cm、2.8cm、2.9cm、3.0cm的距离。根据一些实施方案,药物穿透延伸至距切除的肿瘤的表面不小于2.5cm处,可选地,距切除的肿瘤的表面不小于2.4cm、2.3cm、2.2cm、2.1cm、2.0cm、1.9cm、1.8cm、1.7cm、1.6cm、1.5cm处。
34.紫杉烷相对大且高度疏水,这一特性限制了它们的组织穿透,只有很少的药物深入到组织中超过100μm(alastair h.clin cancer res 2007;13(9):2804-10)。这至少部分地是由于以下事实:游离紫杉烷广泛(》98%)与循环蛋白结合,并且这限制了它们穿透到组织中的能力。本文公开的药物组合物不仅在储存期间在基质中保护紫杉烷,而且在释放时也保护紫杉烷。当保持在水性环境中时,随着聚合物-脂质基质逐渐降解,紫杉烷从公开的药物组合物释放。已经发现,从本文公开的组合物释放的至少50%、至少60%、至少70%、至少75%、至少80%、至少85%、至少90%的紫杉烷药物与基于脂质的胶体结构缔合,该胶体结构在暴露于水性环境(例如体液)时在基于脂质聚合物的基质的外层边缘形成。这些基于脂质的胶体颗粒保护药物不与循环蛋白结合,但不损害肿瘤细胞对药物的摄取。不受理论或作用机制的限制,这表明,这些基于脂质的胶体颗粒改善了紫杉烷进入组织的穿透和浸润。
35.本发明的可适用性的另外的实施方案和全部范围将从下文给出的详细描述变得明显。然而,应当理解,详细描述和具体实例,虽然指示本发明的优选的实施方案,但仅通过说明性方式给出,因为对本领域技术人员而言,本发明的精神和范围内的各种变化和修改从该详细描述将是明显的。
36.附图简述
37.图1示出了根据本发明的几个实施方案,多西他赛从含有或不含胆固醇的包含不同磷脂的药物组合物的累积释放曲线。
38.图2示出了根据本发明的几个实施方案,含有或不含胆固醇的包含不同磷脂的多西他赛持续释放组合物中多西他赛7-差向异构体的量。
39.图3示出了根据本发明的几个实施方案,包含不同量dmpc的多西他赛持续释放组合物中多西他赛7-差向异构体的量。
40.图4a和图4b示出向根据本发明某些实施方案的包含dmpc(4a)和dppc(4b)的多西他赛持续释放组合物中添加tween-80对多西他赛累积释放曲线的作用。
41.图5示出了根据本发明的某些实施方案,包含各种量的胆固醇的多西他赛持续释放组合物中多西他赛7-差向异构体的量。
42.图6示出了根据本发明某些实施方案,紫杉醇从包含不同磷脂的紫杉醇持续释放组合物的累积释放曲线。
43.图7示出了多西他赛从包含plga或peg作为聚合物组分的多西他赛持续释放组合物的累积释放。
44.图8示出了根据本发明某些实施方案,用各种多西他赛持续释放组合物局部治疗的balb/c小鼠中ct26结肠癌的平均肿瘤体积。
45.图9示出了与多西他赛全身治疗相比,用根据本发明某些实施方案的多西他赛持续释放组合物局部治疗的balb/c小鼠中ct26结肠癌的平均肿瘤体积。
46.图10示出了对用包含0.87%(w/w)多西他赛的多西他赛持续释放组合物的局部治疗的剂量响应,这反映在裸鼠中u87多形性胶质母细胞瘤(gbm)肿瘤的平均肿瘤体积中。吉西他滨的重复全身治疗用作阳性对照。
47.本发明实施方案的详细描述
48.如以上所述,本发明提供了用于癌症的局部治疗、预防癌症复发和抑制肿瘤转移的方法和持续释放的抗赘生物组合物。
49.在本发明的一个方面,提供了治疗实体瘤的方法,包括向患有实体瘤的受试者施用有效量的药物组合物,所述药物组合物包含包被有基于聚合物-脂质的基质的颗粒可生物降解基底,所述基质包含紫杉烷,其中药物组合物在肿瘤被手术去除后直接施用到切除的肿瘤腔的肿瘤壁。可选地,可以将药物组合物直接注射到肿瘤中(例如,未切除的肿瘤,或切除后的肿瘤剩余物(tumor leftovers))。本发明的方法还可用于减少肿瘤切除手术后实体瘤切除部位的肿瘤细胞再生长。根据特定实施方案,本发明的方法可用于治疗脑瘤(例如多形性胶质母细胞瘤)。根据一些实施方案,根据本发明的方法,紫杉烷持续释放组合物意图在肿瘤切除手术期间或在闭合手术伤口之前的任何时间单次施加。
50.如本文所用,“实体瘤”(可选地称为“实体癌”)是通常不包含囊肿或液体区域的异常组织块。实体瘤可以是恶性的或良性的。恶性实体瘤可以侵犯周围组织并转移到新的身体侧。术语“实体瘤”不包括白血病(一种影响血液的癌症)。三种主要类型的实体瘤是肉瘤、上皮癌和淋巴瘤。“肉瘤”是由结缔组织或支持组织(诸如骨或肌肉)引起的癌症。“上皮癌”是由排列在身体组织中的腺细胞和上皮细胞引起的癌症。“淋巴瘤”是淋巴器官诸如淋巴结、脾脏和胸腺的癌症。示例性实体瘤包括但不限于肉瘤和上皮癌,诸如多形性胶质母细胞瘤、头颈癌、结肠癌、胰腺癌、乳腺癌、卵巢癌、前列腺癌、肺癌、小细胞肺癌、纤维肉瘤、粘液肉瘤、脂肪肉瘤、软骨肉瘤、成骨性肉瘤、脊索瘤、血管肉瘤、内皮肉瘤、淋巴管肉瘤、淋巴管内皮肉瘤、滑膜瘤、间皮瘤、胰腺癌、食管癌、胃癌、尤文氏瘤、平滑肌肉瘤、横纹肌肉瘤、鳞状细胞癌、基底细胞癌、腺癌、汗腺癌、皮脂腺癌、乳头状癌、乳头状腺癌、囊腺癌、髓样癌、支气管肺癌、肾细胞癌、肝细胞癌、胆管癌、绒毛膜癌、精原细胞瘤、胚胎癌、肾母细胞瘤、宫颈癌、睾丸肿瘤、膀胱癌、上皮癌、星形细胞瘤、髓母细胞瘤、颅咽管瘤、室管膜瘤、松果体瘤、血管母细胞瘤、听神经瘤、少突胶质细胞瘤、皮肤t细胞淋巴瘤(ctcl)、黑素瘤、神经母细胞瘤和视网膜母细胞瘤。
51.根据一些实施方案,本发明的方法可用于治疗脑瘤和用于减少脑瘤切除手术后肿瘤切除部位的脑瘤细胞再生长。可利用本文描述的组合物和方法治疗的脑瘤的代表性实例包括神经胶质瘤(诸如间变性星形细胞瘤、多形性胶质母细胞瘤、毛细胞星形细胞瘤、少突胶质细胞瘤、室管膜瘤、粘液乳头状室管膜瘤、室管膜下瘤、脉络丛乳头状瘤);神经元肿瘤(例如,神经母细胞瘤、神经节神经母细胞瘤、节细胞神经瘤和髓母细胞瘤);松果体肿瘤(例如松果体母细胞瘤和松果体细胞瘤);脑膜肿瘤(例如脑膜瘤、脑膜血管外皮细胞瘤、脑膜肉瘤);神经鞘细胞肿瘤(例如神经鞘瘤(schwannoma)(神经鞘瘤(neurolemmoma))和神经纤维
瘤);淋巴瘤(例如霍奇金淋巴瘤和非霍奇金淋巴瘤(包括许多亚型,原发性和继发性两者);畸形肿瘤(例如颅咽管瘤、表皮样囊肿、皮样囊肿和胶样囊肿);和转移性脑瘤(其可以来源于几乎任何肿瘤,最常见的是来自肺、乳腺、黑素瘤、肾和胃肠道肿瘤)。
52.如本文所用,术语“治疗(treatment)”或“治疗(treating)”是指用于获得有益或期望结果的方法,包括但不限于治疗性益处和/或预防性益处。治疗性益处意指以下至少一种:(a)减少肿瘤尺寸;(b)抑制或减少肿瘤生长;(c)减少或限制转移的发展和/或扩散;(d)增加存活或无进展存活和(e)延迟从肿瘤去除手术到肿瘤复发的时间。
53.根据一些实施方案,治疗实体瘤包括抑制肿瘤转移。“抑制”肿瘤细胞转移可以包括与不治疗相比任何量的抑制。
54.术语“肿瘤切除(tumor resection)”或“肿瘤切除(tumor excision)”涉及一种手术程序,其目标是去除整个肿瘤或尽可能多的肿瘤。虽然一些肿瘤可以被容易地切除,但其他肿瘤可能位于难以触及的位置。通常,外科医生会去除肿瘤以及周围一定量的正常健康组织(即“手术切缘”),以增加手术的成功率。本领域技术人员将会理解,通过手术去除或切除整个肿瘤并不总是能够实现的。如本文所用,术语“肿瘤切除”是指其中至少50%、至少60%、至少70%、至少80%、至少90%的肿瘤体积已经通过手术去除的状况。
55.如本文所用,术语“肿瘤切除腔”是指肿瘤切除手术后的术后缺损。由于肿瘤的完全去除并不总是通过手术可实现的,因此可以理解肿瘤切除腔可能包含肿瘤残留块。
56.如本文所用,术语“有效量”或“治疗有效量”是指本文描述的足以对预期应用(包括但不限于以上定义的癌症治疗)起作用的药物组合物的量。根据一些实施方案,“有效量”将不超过所使用的紫杉烷的最大耐受剂量,该剂量被定义为全身施用时不会引起不可接受的副作用的游离药物的最高剂量。根据一些优选实施方案,本发明方法中的“有效量”低于紫杉烷的最大耐受剂量。如本领域技术人员将理解的,最大耐受剂量是基于药物被耐受的全身毒性。然而,由于与全身施用药物时的暴露相比,局部施用药物的全身暴露显著更低,因此与全身治疗中的最大耐受剂量相比,局部递送定义的耐受剂量可能显著更高。当药物局部释放而没有爆发效应时,这一点尤其重要。根据本发明的一些实施方案,当药物组合物中的紫杉烷是多西他赛时,在根据本发明方法的治疗中向60kg成人施用的多西他赛的总量将不超过600mg,可选地,将不超过500mg、450mg、400mg、350mg、300mg、290mg、280mg、270mg、260mg、250mg、240mg、230mg、220mg、210mg、200mg、190mg、180mg、170mg、160mg、155mg、150mg、145mg、140mg、135mg、130mg、125mg、120mg、115mg、110mg、100mg。每种可能性代表本发明的单独实施方案。根据具体实施方案,在根据本发明方法的治疗中施用的多西他赛的总剂量将在20-600mg之间,可选地在20-550mg;20-500mg、20-450mg、20-400mg、20-350mg、20-300mg、20-280mg、20-260mg、20-240mg、20-220mg、20-200mg、20-190mg、20-180mg、20-170mg、20-160mg、20-150mg、20-140mg、20-130mg、20-120mg、20-110mg、20-100mg、50-600mg、50-550mg;50-500mg、50-450mg、50-400mg、50-350mg、50-300mg、50-280mg、50-260mg、50-240mg、50-220mg、50-200mg、50-190mg、50-180mg、50-175mg、50-170mg、50-165mg、50-160mg、60-160mg、65-160mg、70-160mg、75-160mg、80-160mg、85-160mg、90-160mg、95-160mg、100-160mg、80-150mg、80-140mg、80-130mg、80-120mg之间。每种可能性代表本发明的单独实施方案。
57.根据本发明的一些实施方案,当药物组合物中的紫杉烷是紫杉醇时,在根据本发
明方法的治疗中向60kg成人施用的紫杉醇的总量将不超过800mg,可选地,将不超过750mg、700mg、650mg、600mg、550mg、500mg、450mg、420mg、400mg、380mg、360mg、340mg、320mg、300mg、280mg、260mg、250mg、240mg、230mg、220mg、210mg、200mg、190mg、180mg、175mg、170mg、165mg、160mg、155mg、150mg、145mg、140mg、135mg、130mg、125mg、120mg、115mg、110mg、100mg。每种可能性代表本发明的单独实施方案。根据具体实施方案,在根据本发明方法的治疗中施用的紫杉醇的总剂量将在60-800mg之间,可选地在60-750mg、60-700mg、60-650mg、60-600mg、60-550mg、60-500mg、60-450mg、60-400mg、60-350mg、60-320mg、60-300mg、60-295mg、60-290mg、60-285mg、60-280mg、60-275mg、60-270mg、60-265mg、60-260mg、60-250mg、60-240mg、60-230mg、60-220mg、60-210mg、60-200mg、60-190mg、60-185mg、60-180mg、60-175mg、60-170mg、60-165mg、60-160mg、60-155mg、60-150mg、80-300mg、90-300mg、100-300mg、110-300mg、120-300mg、130-300mg、140-300mg、150-300mg、160-300mg、170-300mg、180-300mg、190-300mg、200-300mg、200-290mg、200-280mg之间。每种可能性代表本发明的单独实施方案。
58.根据本发明的一些实施方案,当药物组合物中的紫杉烷是卡巴他赛时,在根据本发明方法的治疗中施用的卡巴他赛的总量将不超过60mg,可选地,将不超过80mg、75mg、70mg、65mg、60mg、55mg、50mg、45mg、42mg、40mg、38mg、37mg、36mg、35mg、34mg、33mg、32mg、31mg、30mg、29mg、28mg、27mg、26mg、25mg、24mg、23mg、22mg、21mg、20mg。每种可能性代表本发明的单独实施方案。根据具体实施方案,在根据本发明方法的治疗中施用的卡巴他赛的总剂量将在10-80mg之间,可选地在10-75mg、10-70mg、10-65mg、10-60mg、10-55mg、10-50mg、10-45mg、10-42mg、10-40mg、10-38mg、10-35mg、20-50mg、20-45mg、20-42mg、20-40mg、20-38mg、20-35mg、25-50mg、25-45mg、25-40mg、30-50mg、30-45mg、30-40mg之间。每种可能性代表本发明的单独的实施方案。术语“受控释放”是指控制由本发明的药物组合物递送的紫杉烷药物的速率和/或量。术语“持续释放”指药学活性剂在延长的时间段内释放。
59.本文公开的药物组合物包含被基质组合物包被或浸渍的颗粒可生物降解基底,基质组合物包含(a)可生物降解聚合物,(b)包含具有至少12个碳原子的脂肪酸部分的至少一种磷脂的脂质组分;和(c)紫杉烷化疗剂。根据一些实施方案,基质还可以包含固醇。基质组合物在有相应需要的受试者身体内的肿瘤部位或肿瘤切除部位提供药物活性剂的持续释放。
60.在特定实施方案中,聚合物和一种或更多种脂质形成基本上不含水的、结构上有序的脂质饱和基质组合物。在一些实施方案中,基质组合物具有高度组织化的多层结构,其中聚合物和脂质以多个交替层的形式被组织。在一些实施方案中,基质包含按重量计至少约50%的总脂质。
61.根据一些实施方案,本发明的药物组合物包含药物组合物总重量的约80%-93%(w/w)的颗粒可生物降解基底和7%-20%(w/w)的基质组合物。根据可选的实施方案,颗粒可生物降解基底构成药物组合物总重量的约80%-92%(w/w)、80%-91%(w/w)、80%-90%(w/w)、80%-89%(w/w)、80%-88%(w/w)、80%-87%(w/w)、80%-86%(w/w)、80%-85%(w/w)、81%-93%(w/w)、82%-93%(w/w)、83%-93%(w/w)、84%-93%(w/w)、85%-93%(w/w)、85%-92%(w/w)、85%-91%(w/w)、85%-90%(w/w)、85%-89%(w/w)、85%-88%(w/w)、86%-89%(w/w)之间。
62.在一些实施方案中,基质组合物包含基质组合物的按重量计至少10%的可生物降解聚合物。在一些实施方案中,基质组合物包含基质组合物的按重量计在约10%-30%之间的聚合物。在一些实施方案中,基质组合物包含基质组合物的按重量计在约15%-25%之间的聚合物。在一些实施方案中,基质组合物包含基质组合物的按重量计约20%的聚合物。在一些实施方案中,生物相容性聚合物构成基质组合物重量的至少10%(w/w)、至少11%(w/w)、至少12%(w/w)、至少13%(w/w)、至少14%(w/w)、至少15%(w/w)、至少16%(w/w)、至少17%(w/w)、至少18%(w/w)、至少19%(w/w)、至少20%(w/w)、至少21%(w/w)、至少22%(w/w)、至少23%(w/w)、至少24%(w/w)、至少25%(w/w)、至少26%(w/w)、至少27%(w/w)、至少28%(w/w)、至少29%(w/w)、至少30%(w/w)。
63.根据本发明的某些实施方案,聚合物是可生物降解的聚酯。根据一些实施方案,聚酯选自由pla(聚乳酸)组成的组。“pla”指聚(l-丙交酯)、聚(d-丙交酯)和聚(dl-丙交酯)。在另一种实施方案中,聚合物是pga(聚乙醇酸)。在另一种实施方案中,聚合物是plga(聚(乳酸-乙醇酸共聚物))。包含于plga中的pla可以是本领域已知的任何pla,例如对映体或外消旋混合物。在另一种实施方案中,本发明的方法和组合物的plga具有50:50的乳酸/乙醇酸比。在另一种实施方案中,比例是60:40。在另一种实施方案中,比例是75:25。在另一种实施方案中,比例是85:15。在另一种实施方案中,比例是90:10。在另一种实施方案中,比例是95:5。在另一种实施方案中,该比例是适于获得延长或持续的体内释放曲线的另一比例。plga可以是无规或嵌段共聚物。每一种可能性代表本发明的单独的实施方案。要强调的是,聚合物可以具有任何尺寸或长度(即,具有任何分子量)。
64.在另一种实施方案中,可生物降解的聚酯可以选自由以下组成的组:聚己内酯、聚羟基烷基酸酯、聚富马酸丙二酯、聚原酸酯、聚酐和聚氰基丙烯酸烷基酯,条件是所述聚酯含有氢键受体部分。在另一种实施方案中,可生物降解的聚酯是包含选自由以下组成的组的任何两个单体的组合的嵌段共聚物:pla、pga、plga、聚己内酯、聚羟基烷基酸酯、聚富马酸丙二酯、聚原酸酯、聚酐和聚氰基丙烯酸烷基酯。在另一种实施方案中,可生物降解的聚酯是包含以上列出的任何两种单体的组合的无规共聚物。每一种可能性代表本发明的单独的实施方案。
65.术语“可生物降解”是指将在人体内通过水解作用、通过酶的作用和/或通过其它类似机制随时间而降解的物质。“可生物降解”还包括在治疗剂已经释放之后或正在释放的同时,可以在体内分解或降解成无毒成分的物质。
66.根据一些实施方案,基质组合物包含至少约30%(基质组合物总重量的w/w)的脂质组分,脂质组分包含具有至少12个碳原子的脂肪酸部分的至少一种磷脂。根据一些实施方案,基质组合物包含至少约40%(w/w)的脂质组分,脂质组分包含至少一种磷脂(具有至少12个碳原子、优选地12个和18个碳原子之间的脂肪酸部分,优选地其中烃链完全饱和)。根据一些实施方案,基质组合物包含约40%-75%(w/w)的脂质组分,脂质组分包含具有至少12个碳原子的脂肪酸部分的至少一种磷脂。根据一些实施方案,基质组合物包含约50%-70%(w/w)的脂质组分,脂质组分包含具有至少12个碳原子的脂肪酸部分的至少一种磷脂。根据某些典型实施方案,基质组合物包含约60%(w/w)的脂质组分,脂质组分包含具有至少12个碳原子的脂肪酸部分的至少一种磷脂。在一些实施方案中,包含具有至少12个碳原子的脂肪酸部分的至少一种磷脂的脂质组分构成基质组合物总重量的至少40%(w/w)、至少
45%(w/w)、至少50%(w/w)、至少55%(w/w)、至少60%(w/w)、至少65%(w/w)或至少70%(w/w)。在一些实施方案中,包含具有至少12个碳原子的脂肪酸部分的至少一种磷脂的脂质组分构成基质组合物总重量的不超过75%(w/w)、不超过70%(w/w)、不超过65%(w/w)。根据一些实施方案,脂质组分包含具有至少14个碳原子的脂肪酸部分的至少一种磷脂分子。根据一些实施方案,第二脂质组分包含具有至少14个碳原子的脂肪酸部分的至少一种磷脂酰胆碱分子。根据一些优选的实施方案,组合物的磷脂酰胆碱分子包含dmpc。根据一些实施方案,组合物的磷脂酰胆碱分子包含dppc。根据一些实施方案,组合物的磷脂酰胆碱分子包含dspc。根据一些实施方案,基质组合物包含dopc。根据一些实施方案,基质组合物包含dmpc与第二磷脂的混合物,该第二磷脂具有至少14个碳原子的脂肪酸部分。根据一些实施方案,基质组合物包含dmpc和dppc的混合物。通常,基质制剂中dmpc和dppc之间的比例在约10:1至1:10之间。根据一些实施方案,基质组合物包含约50%-70%(w/w)的dmpc或dmpc和dppc的混合物。
67.根据一些实施方案,持续释放基质组合物可以还包含固醇。根据一些实施方案,固醇构成基质组合物总重量的高达40%(w/w)。根据一些实施方案,当存在时,固醇与可生物降解聚合物非共价缔合。根据一些实施方案,固醇构成基质组合物总重量的高达约30%(w/w)。根据一些实施方案,固醇构成基质组合物总重量的约5%-40%(w/w)、约5%-30%(w/w)、约5%-20%(w/w)、约5%-15%(w/w)、约7%-13%(w/w)、约9%-11%(w/w)。根据某些典型实施方案,基质组合物包含约10%(基质组合物总重量的w/w)的固醇。在一些实施方案中,固醇构成基质的至少5%(w/w)、至少6%(w/w)、至少7%(w/w)、至少8%(w/w)、至少9%(w/w)、至少10%(w/w)、至少11%(w/w)、至少12%(w/w)、至少13%(w/w)、至少14%(w/w)、至少15%(w/w)、至少16%(w/w)、至少17%(w/w)、至少18%(w/w)或至少19%(w/w)。在一些实施方案中,固醇构成基质组合物的不超过20%(w/w)、不超过19%(w/w)、不超过18%(w/w)、不超过17%(w/w)、不超过16%(w/w)、不超过15%(w/w)、不超过14%(w/w)、不超过13%(w/w)、不超过12%(w/w)、不超过11%(w/w)、不超过10%(w/w)、不超过9%(w/w)、不超过8%(w/w)、不超过7%(w/w)、不超过6%(w/w)或不超过5%(w/w)。每一种可能性代表本发明的单独的实施方案。根据某些优选实施方案,固醇是胆固醇。
68.在一些实施方案中,本发明的药物组合物中的脂质:聚合物重量比在1:1和9:1之间,包括端点。在另一种实施方案中,该比例在2:1和9:1之间,包括端点。在另一种实施方案中,该比例在3:1和9:1之间,包括端点。在另一种实施方案中,该比例在4:1和9:1之间,包括端点。在另一种实施方案中,该比例在5:1和9:1之间,包括端点。在另一种实施方案中,该比例在6:1和9:1之间,包括端点。在另一种实施方案中,该比例在7:1和9:1之间,包括端点。在另一种实施方案中,该比例在8:1和9:1之间,包括端点。在另一种实施方案中,该比例在1.5:1和9:1之间,包括端点。每一种可能性代表本发明的单独的实施方案。
69.要强调的是,使用本发明的组合物的持续释放时间段可以考虑聚合物和脂质的生物化学和/或生物物理特性来编程。具体地,应该考虑聚合物的降解速率和脂质的流动性。例如,plga(85:15)聚合物将比plga(50:50)聚合物降解得慢。在体温,磷脂酰胆碱(12:0)(刚性更小且更无序)比磷脂酰胆碱(18:0)流动性更佳。因此,例如,掺入于包含plga(85:15)和磷脂酰胆碱(18:0)的基质组合物中的药物的释放速率将比掺入在包括plga(50:50)和磷脂酰胆碱(14:0)的基质中的药物的释放速率慢。确定释放速率的另一方面是被捕获或
浸渍的药物的物理性质。另外,药物的释放速率还可以通过将其它脂质添加到基质制剂中来控制,下文描述了其他脂质中的一些。
70.在各种实施方案中,包埋在包被颗粒基底的基质组合物中的紫杉烷化疗药物可以是任何合适的紫杉烷,包括但不限于紫杉醇、多西他赛、卡巴他赛、紫杉二烯、巴卡亭ii、taxchinin a、短叶老鹳草素(brevifoliol)、紫杉平d、其组合或其药学上可接受的盐。根据各种实施方案,紫杉烷是多西他赛。根据各种实施方案,紫杉烷是紫杉醇。根据一些实施方案,紫杉烷构成基质组合物总重量的约3%-20%(w/w)之间。根据一些实施方案,紫杉烷构成基质组合物总重量的约3%-19%(w/w)、3%-18%(w/w)、3%-17%(w/w)、3%-16%(w/w)、3%-15%(w/w)、3%-14%(w/w)、3%-13%(w/w)、3%-12%(w/w)、3%-11%(w/w)、3%-10%(w/w)、3%-9%(w/w)、3%-8%(w/w)、4%-15%(w/w)、4%-14%(w/w)、4%-13%(w/w)、4%-12%(w/w)、4%-11%(w/w)、4%-10%(w/w)、4%-9%(w/w)、4%-8%(w/w)、5%-15%(w/w)、5%-14%(w/w)、5%-13%(w/w)、5%-12%(w/w)、5%-11%(w/w)、5%-10%(w/w)、5%-9%(w/w)、5%-8%(w/w)、6%-15%(w/w)、6%-14%(w/w)、6%-13%(w/w)、6%-12%(w/w)、6%-11%(w/w)、6%-10%(w/w)、6%-9%(w/w)、6%-8%(w/w)之间。根据某些实施方案,紫杉烷构成药物组合物总重量的约0.2%和2.6%(w/w)之间。可选地,在药物组合物总重量的约0.3%-2.5%、0.3%-2.4%、0.3%-2.3%、0.3%-2.2%、0.3%-2.1%、0.3%-2.0%、0.3%-1.9%、0.3%-1.8%、0.3%-1.7%、0.3%-1.6%、0.3%-1.5%、0.3%-1.4%、0.3%-1.3%、0.3%-1.2%、0.3%-1.1%、0.3%-1.0%、0.4%-2.5%、0.4%-2.4%、0.4%-2.3%、0.4%-2.2%、0.4%-2.1%、0.4%-2.0%、0.4%-1.9%、0.4%-1.8%、0.4%-1.7%、0.4%-1.6%、0.4%-1.5%、0.4%-1.4%、0.4%-1.3%、0.4%-1.2%、0.4%-1.1%、0.4%-1.0%、0.5%-2.5%、0.5%-2.4%、0.5%-2.3%、0.5%-2.2%、0.5%-2.1%、0.5%-2.0%、0.5%-1.9%、0.5%-1.8%、0.5%-1.7%、0.5%-1.6%、0.5%-1.5%、0.5%-1.4%、0.5%-1.3%、0.5%-1.2%、0.5%-1.1%、0.5%-1.0%、0.6%-2.5%、0.6%-2.4%、0.6%-2.3%、0.6%-2.2%、0.6%-2.1%、0.6%-2.0%、0.6%-1.9%、0.6%-1.8%、0.6%-1.7%、0.6%-1.6%、0.6%-1.5%、0.6%-1.4%、0.6%-1.3%、0.6%-1.2%、0.6%-1.1%、0.6%-1.0%、0.6%-0.9%、0.7%-2.5%、0.7%-2.4%、0.7%-2.3%、0.7%-2.2%、0.7%-2.1%、0.7%-2.0%、0.7%-1.9%、0.7%-1.8%、0.7%-1.7%、0.7%-1.6%、0.7%-1.5%、0.7%-1.4%、0.7%-1.3%、0.7%-1.2%、0.7%-1.1%、0.7%-1.0%、0.7%-0.9%、0.8%-1.0%、0.8%-0.9%(w/w)之间。每种可能性代表本发明的单独的实施方案。根据一些实施方案,紫杉烷是紫杉醇。根据一些实施方案,紫杉烷是多西他赛。
71.根据一些实施方案,本发明的药物组合物和方法中使用的颗粒可生物降解基底包含通常为球形或类似球形的颗粒。在一些实施方案中,不必是球形和/或类似球形,但优选是球形和/或类似球形的颗粒可以具有至少约30μm、至少约40μm、至少约50μm、至少约60μm、至少约70μm、至少约80μm、至少约90μm、至少约100μm、在30μm和120μm之间、在30μm和100μm之间、在50μm和100μm之间、不超过约150μm、不超过约140μm、不超过约130μm、不超过约120μm、不超过约110μm、不超过约100μm的平均直径(如通过激光衍射,例如通过使用malvern的mastersizer 3000仪器的激光衍射测量的)。每种可能性代表本发明的单独的实施方案。根据一些实施方案,本文描述的组合物和方法中使用的颗粒基底是生物可吸收的亲水性材
料,其具有生物相容性(即毒性低,在活体中仅表现出低异物反应,并且可以与身体组织具有良好的亲和力)、生物可吸收性(即生物可降解性)和亲水性,但是其在水中具有低溶解度,使得其在不短于4周、不短于6周、不短于8周且优选地不短于10周的时间段内在体内完全消除或溶解,并且还在环境温度具有固体形状和可成形性。具有这些特性的任何材料可以被无限制地使用。根据一些实施方案,可生物降解基底选自由以下组成的组:羟基磷灰石、碳酸钙羟基磷灰石、α-磷酸三钙(α-tcp)、β-磷酸三钙(β-tcp)、无定形磷酸钙、磷酸四钙、无水磷酸二钙、无水磷酸二氢钙、磷酸八钙、磷酸氢二钠和其他基于磷酸盐的生物陶瓷及其组合。根据一些实施方案,颗粒基底包括磷酸三钙(tcp),优选地包含β-tcp。根据其他实施方案,颗粒基底由聚乙烯醇(pva),优选地具有至少88%水解度的pva组成。根据一些实施方案,可生物降解基底是具有范围为40%-80%、45%-80%、50%-80%、55%-80%、60%-80%、65%-80%、65%-75%的孔隙率的多孔基底。每种可能性代表本发明的单独的实施方案。
72.如本文所用,术语“平均直径尺寸”意指,至少约50%的基底颗粒具有小于如通过激光衍射测量的测量平均直径尺寸的尺寸。通过实例的方式,具有100μm平均粒径的颗粒意指,至少约50%的颗粒具有小于100μm的直径。
73.在特定实施方案中,药物组合物基本上不含水。在一种实施方案中,如本文所用,“基本上不含水”是指包含药物组合物总重量的按重量计小于2%的水的药物组合物。在另一种实施方案中,该术语是指包含药物组合物总重量的按重量计小于1.5%的水、小于1.4%的水、小于1.3%的水、小于1.2%的水、小于1.1%的水、小于1.0%的水、小于0.9%的水、小于0.8%、小于0.7%、小于0.6%、小于0.5%的水的基质组合物。在另一种实施方案中,该术语指不存在影响基质组合物的耐水特性的量的水。在另一种实施方案中,该术语指不使用任何水性溶剂而制备的药物组合物。在另一种实施方案中,如本文描述,使用基本上不含水的方法制备药物组合物使脂质饱和。脂质饱和度赋予基质组合物抵抗体内大量降解的能力;因此,基质组合物表现出在几天至几周(多达约10周)的范围内介导延长释放的能力。组合物中的水的总量可以通过本领域已知的任何方法确定,诸如karl fischer和烘干失重。
74.本发明方法中使用的药物组合物的技术平台
75.根据一些实施方案,包被颗粒可生物降解基底的持续释放基质组合物具有高度组织化的多层结构,其中聚合物形成一种类型的层,磷脂形成第二种类型的层,并且这两种类型的层以多重交替或准交替(quasi-alternating)的层的形式组织。根据一些实施方案,基质组合物包含没有内部空隙和/或自由体积的连续结构。包被基质组合物是脂质饱和的,表明聚合物层或聚合物主链之间的空间被与紫杉烷药物组合的脂质分子填充到另外的脂质部分不再能够以可察觉的程度掺入基质中的程度。
76.本文公开的包被基质组合物是脂质饱和的。如本文所用,“脂质饱和”是指基质组合物的聚合物被与基质中存在的紫杉烷药物组合的脂质组分(例如磷脂和任选地固醇)以及任何可能存在的其它脂质饱和。基质组合物被任何存在的脂质饱和。在另一种实施方案中,“脂质饱和”指对脂质基质内的由聚合物主链的外部边界所界定的内部空隙(自由体积)的填充。空隙被磷脂酰胆碱任选地与胆固醇和可能的其它类型的脂质和存在于基质中的紫杉烷药物的组合填充至另外的脂质部分不再能够以可察觉的程度被掺入基质中的程度。本
发明的脂质饱和的基质表现出另外的优点:不需要合成乳化剂或表面活性剂诸如聚乙烯醇;因此,本发明的基质组合物通常基本上不含聚乙烯醇。
77.在一些实施方案中,当基质组合物暴露于水性介质并进一步保持在水性介质中时,基质组合物能够以零级动力学释放至少40%的紫杉烷药物。在一些实施方案中,当其保持在水性介质中时,至少50%、至少55%、至少60%的紫杉烷以零级动力学从基质组合物释放。不受特定理论或作用机制的限制,认为本发明的基质组合物的有组织的结构或亚结构是基质制剂被水合后,一种或更多种药物以零级释放速率从基质制剂释放的主要原因之一。因此,零级释放速率可以归因于脂质和聚合物的高度组织化的层的水合表面层的缓慢且连续的“剥离”,伴随着紫杉烷药物作为表面层的组分从基质去除时而释放。据推测,这个过程慢慢地自身重复,在几天和几周内以稳定的速率释放紫杉烷药物,直到基质被完全降解。不希望受理论约束,认为聚合物形成第一类型的层,并且磷脂形成第二类型的层,并且这些层交替,即(聚合物)-(磷脂)-(聚合物)-(磷脂);如本文所用,术语“准交替”是指其中存在一种类型的层的多于一次出现的交替的情况,例如(聚合物)-(磷脂)-(磷脂)-(聚合物)-(磷脂)-(磷脂)-(聚合物)。
78.在一些实施方案中,基质组合物具有如以上描述的聚合物和磷脂的多个混合层,并且其不是呈微球、胶束、反向胶束或脂质体的形式。在一些实施方案中,基质组合物不包含胶束、反向胶束或脂质体。
79.根据一些实施方案,本发明的基质是耐水的(water resistant)。这样水不能容易地(如果真会发生的话)扩散到基质的内层,并且捕获在内层之间的紫杉烷药物不能容易地(如果真会发生的话)扩散出基质。更具体地,它是指这样的组合物,使其大部分(例如被外表面包围的组合物的一部分,所述外表面暴露于周围环境)不暴露于水,或者以渗透的水的量很小并且不足以引起基质大量解体或降解的程度暴露于水。不希望受理论或作用机制的约束,基质组合物的耐水特性连同其独特的多层结构赋予基质其持续释放特性,例如当组合物在生理温度保持在水性环境中时,其以零级动力学从组合物释放至少40%、优选地至少50%、60%或至少70%紫杉烷化疗药物的能力,持续范围为几天至几周和甚至几个月的时间段。
80.药物的效力通常由其局部浓度决定。这继而取决于从产品释放的药物的累积速率与其通过物理分布到周围组织以及通过中和和/或降解的消除之间的比。最佳药物递送系统应根据生物学需求释放药物,以便在靠近或紧邻靶处产生有效浓度并贯穿期望的生物学效应所需的足够的时间段。这可以通过在靶部位以一定速率释放药物来实现,该速率将导致高于最小有效浓度,并且优选地低于毒性水平的有效浓度,并持续有效治疗作用所需的期望时间段。已经令人惊讶地发现,根据本发明的一些实施方案的药物组合物能够治疗实体瘤,并在肿瘤切除手术后抑制其局部复发,即使基于药物的处方信息,施用的药物(例如多西他赛)的总量(包埋在药物组合物中)小于药物最大耐受剂量的30%。又另外,即使当肿瘤是耐紫杉烷肿瘤时,也获得了类似的结果。
81.本发明的组合物和方法的优点之一是它们通过控制向该部位的紫杉烷供应速率来控制对紫杉烷药物的局部暴露的能力。供应速率由1)紫杉烷释放曲线,2)释放速率和3)释放的持续时间决定。这些参数密切相关;而释放速度主要取决于具体制剂,持续时间随着两个因素而变化:释放速率和药物储库的尺寸。包含特定脂质和加载了紫杉烷药物(优选多
西他赛)的聚合物的组合的本发明的药物组合物不仅决定了紫杉烷的释放速率曲线,而且还允许在延长的零级动力学期期间控制释放速率。不希望受理论或作用机制的约束,建议化疗药物的最有效和最安全的释放曲线将是没有初始爆发、在足够的持续时间内的连续的零级动力学释放,例如长达14天、长达15天、长达16天、长达17天、长达18天、长达19天、长达20天、长达21天、长达22天、长达23天、长达24天、长达25天、长达26天、长达27天、长达28天、长达29天、长达30天、长达31天、长达32天、长达33天、长达34天、长达35天、长达36天、长达37天、长达38天、长达39天、长达40天、长达6周、长达7周、长达8周、长达9周、长达10周,优选地在约14-35天之间。
[0082]“零级释放速率”或“零级释放动力学”意指紫杉烷从药物组合物中的恒定的、线性的、连续的、持续的和受控的释放速率,即紫杉烷释放量对时间的图是线性的。根据一些实施方案,至少40%、优选地至少50%和更优选地至少60%的紫杉烷以零级动力学以约1%-7%、1%-6%、1%-5%、1%-4%、1%-3%、2%-7%、2%-6%、2%-5%、2%-4%、2%-3%之间的速率(每天释放的紫杉烷/最初包封在组合物中的紫杉烷的总重量的重量百分比)从组合物中释放,每种可能性代表本发明的单独实施方案。
[0083]
根据一些实施方案,当在生理温度保持在水性介质中时,截止第一天结束时,1%至10%的所述紫杉烷从组合物释放,截止第一周结束时,10%至50%的紫杉烷从组合物释放,截止前两周结束时,20%至100%的紫杉烷从组合物释放,并且截止前三周结束时,30%至100%的紫杉烷被释放。在一些实施方案中,当在生理温度保持在水性介质中时,截止第一周结束时,至少10%但不多于50%的紫杉烷被释放,截止第二周结束时,至少20%但不多于80%的紫杉烷被释放,截止第三周结束时,至少30%的紫杉烷被释放。截止第三周结束时,至少40%的紫杉烷被释放。截止第三周结束时,至少50%的紫杉烷被释放。截止第三周结束时,至少60%的紫杉烷被释放。根据当前优选的实施方案,紫杉烷是多西他赛。
[0084]
本发明方法中使用的药物组合物以可预测的、长期释放在肿瘤部位或肿瘤切除部位局部释放紫杉烷。因此,紫杉烷药物水平可在肿瘤部位局部保持,同时保持低或无全身水平。由于紫杉烷的延长的局部释放,安全剂量的局部紫杉烷(通常小于通常通过i.v.施用的单剂量)在治疗肿瘤和防止其复发中非常有效。通过实例的方式,适合于施加到具有约5cm直径的肿瘤切除腔的表面(估计约25cm2的腔表面)的本发明方法中使用的10克药物组合物中多西他赛的量(其中多西他赛构成组合物总重量的约0.7%-1%之间)为单剂量多西他赛推荐量的约50%,通常每三周i.v施用一次。
[0085]
另外,药物组合物起到储库的作用,被捕获的紫杉烷被保护在该储库中。与传统的基于聚合物的递送系统相比,该特征可以保护敏感药物储库免受生物分解剂诸如酶,以及由于体内可溶性材料和水合的化学破坏的影响。当需要延长作用时,此特征变得非常重要。
[0086]
治疗方法
[0087]
针对治疗实体瘤并防止其在肿瘤切除手术后复发的本发明的方法解决了目前缺乏有效解决方案且医疗领域非常关切的医疗需求。本发明的方法提供了局部肿瘤治疗和预防肿瘤复发,在肿瘤切除手术期间或在肿瘤切除手术之后立即直接施加到肿瘤切除部位腔,或者作为新辅助治疗通过瘤内注射直接进入到肿瘤中。本发明的方法适合于多种实体瘤的癌症治疗、预防癌症复发和癌症转移。
[0088]
根据一些实施方案,本发明提供了一种用于治疗脑瘤的方法,包括将治疗有效量
的药物组合物施用到实体脑瘤的表面或施用到实体脑瘤切除后的切除腔的表面的步骤,所述药物组合物包含:(a)颗粒可生物降解基底;(b)可生物降解聚合物;(c)具有至少12个碳原子的烃链的至少一种磷脂以及(d)紫杉烷。根据一些实施方案,脑瘤是多形性胶质母细胞瘤。根据一些实施方案,药物组合物还包含固醇。根据各种实施方案,紫杉烷选自由以下组成的组:多西他赛、紫杉醇、紫杉醇衍生物和卡巴他赛。根据具体实施方案,紫杉烷是多西他赛。根据一些实施方案,可生物降解聚合物是聚酯。根据一些实施方案,可生物降解聚合物是plga。根据一些实施方案,磷脂是具有12个和18个碳原子之间的烃链的磷脂酰胆碱。根据某些实施方案,磷脂组分包括dmpc。根据一些实施方案,用于治疗脑瘤的方法中使用的药物组合物包含(a)80%-93%(w/w)的磷酸三钙;(b)1%-4.0%(w/w)的plga;(c)0.0-2.0%(w/w)的胆固醇;(d)4.0%-15.0%(w/w)的dmpc;(e)0.2%-2.6%(w/w)的多西他赛。根据一些实施方案,多西他赛构成药物组合物总重量的0.5%和1.5%(w/w)之间。根据某些实施方案,多西他赛构成药物组合物总重量的0.7%和1.3%(w/w)之间,可选地0.7%和1.0%(w/w)之间。根据一些实施方案,磷酸三钙(tcp)选自由以下组成的组:α-磷酸三钙、β-磷酸三钙及其组合。根据具体实施方案,tcp是β-磷酸三钙。根据一些实施方案,药物组合物的ph在约7.5和8.5之间。根据一些实施方案,用于治疗脑癌的药物组合物还包含ph调节剂。根据一些实施方案,药物组合物的ph在约4至6之间。根据一些实施方案,4至6的ph稳定紫杉烷(例如多西他赛)并减少其向7-差向异构体的转化。根据某些实施方案,用于治疗脑瘤的方法包括将以上公开的药物组合物表面施用到实体脑瘤的表面或施用到实体脑瘤切除后的切除腔的表面。根据一些实施方案,如本文所用,脑瘤的切除是指其中至少50%、至少60%、至少70%、至少80%、至少90%的肿瘤体积已经通过手术被去除的状况。在脑瘤不能通过手术接近并且不能切除的情况下,或者当携带肿瘤的患者由于其医学状况而不能手术时,可以将药物组合物直接注射到肿瘤中。根据某些实施方案,药物组合物包含(a)85%-92%(w/w)的磷酸三钙;(b)2.0%-3.0%(w/w)的plga;(c)0.0-2.0%(w/w)的胆固醇;(d)4.0%-10.0%(w/w)的dmpc和(e)0.5%-1.5%(w/w)的多西他赛。根据一些示例性实施方案,药物组合物包含(a)86%-89%(w/w)的磷酸三钙;(b)2.4%-2.8%(w/w)的plga;(c)0.8%-1.5%(w/w)的胆固醇;(d)7.0%-9.0%(w/w)的dmpc;和(e)0.6%-1.3%(w/w)的多西他赛。根据一些实施方案,磷酸三钙是β-磷酸三钙。以上公开的用于治疗脑瘤的方法减少、最小化或有效地消除了通过手术去除肿瘤和起始当前实施的辅助疗法(诸如放疗和全身化疗)之间的延迟,辅助治疗通常在手术后约4周并且仅在手术伤口已经开始愈合过程之后给予。根据一些实施方案,本发明用于治疗脑瘤的方法进一步抑制肿瘤转移的形成。
[0089]
根据一些实施方案,以上公开的方法适合于原发性脑瘤的治疗。原发性脑瘤可由不同类型的脑细胞或脑周围的膜(脑膜)、神经或腺体引起。脑中最常见类型的原发性肿瘤是神经胶质瘤,它从脑的神经胶质组织中出现。根据一些实施方案,神经胶质瘤是星形细胞瘤。根据一些实施方案,星形细胞瘤选自由以下组成的组:i级(毛细胞型)星形细胞瘤、ii级(纤维性)星形细胞瘤、iii级(间变性)星形细胞瘤和iv级多形性胶质母细胞瘤(gbm)。根据其他实施方案,神经胶质瘤是少突胶质细胞瘤。根据又另一种实施方案,神经胶质瘤是室管膜瘤。根据一些实施方案,脑瘤是继发性或转移性脑瘤。继发性或转移性脑瘤是由从身体其他部位发展的肿瘤迁移而来的癌细胞产生的。最常见的脑转移起源于肺癌细胞、乳腺癌细胞、黑素瘤、结肠直肠癌和肾癌细胞。
[0090]
根据一些实施方案,本发明提供了一种用于治疗结肠癌的方法,包括将治疗有效量的药物组合物施用到实体结肠癌肿瘤的表面或施用到实体癌肿瘤切除后的切除腔的表面的步骤,所述药物组合物包含:(a)颗粒可生物降解基底;(b)可生物降解聚合物;(c)具有至少12个碳原子的烃链的至少一种磷脂以及(d)紫杉烷。根据一些实施方案,药物组合物还包含固醇。根据各种实施方案,紫杉烷选自由以下组成的组:多西他赛、紫杉醇、紫杉醇衍生物和卡巴他赛。根据具体实施方案,紫杉烷是多西他赛。根据一些实施方案,可生物降解聚合物是聚酯。根据一些实施方案,可生物降解聚合物是plga。根据一些实施方案,磷脂是具有12个和18个碳原子之间的烃链的磷脂酰胆碱。根据某些实施方案,磷脂组分包括dmpc。根据一些实施方案,用于治疗结肠癌的方法中使用的药物组合物包含(a)80%-93%(w/w)的磷酸三钙;(b)1%-4.0%(w/w)的plga;(c)0.0-2.0%(w/w)的胆固醇;(d)4.0%-15.0%(w/w)的dmpc;(e)0.2%-2.6%(w/w)的多西他赛。根据一些实施方案,多西他赛构成药物组合物总重量的0.5%和1.5%(w/w)之间。根据某些实施方案,多西他赛构成药物组合物总重量的0.7%和1.3%(w/w)之间,可选地0.7%和1.0%(w/w)之间。根据一些实施方案,磷酸三钙(tcp)选自由以下组成的组:α-磷酸三钙、β-磷酸三钙及其组合。根据具体实施方案,tcp是β-磷酸三钙。根据一些实施方案,药物组合物的ph在约7.5和8.5之间。根据一些实施方案,用于治疗结肠癌的药物组合物还包含ph调节剂。根据一些实施方案,药物组合物的ph在约4至6之间。根据一些实施方案,4至6的ph稳定紫杉烷(例如多西他赛)并减少其向7-差向异构体的转化。根据某些实施方案,用于治疗结肠癌肿瘤的方法包括将以上公开的药物组合物表面施用到实体结肠肿瘤的表面或结肠癌肿瘤切除后的切除腔的表面。根据一些实施方案,如本文所用,结肠癌肿瘤的切除是指其中至少50%、至少60%、至少70%、至少80%、至少90%的肿瘤体积已经通过手术被去除的状况。在肿瘤不能通过手术接近并且不能切除的情况下,或者当携带肿瘤的患者由于其医学状况而不能手术时,可以将药物组合物直接注射到结肠肿瘤中。根据某些实施方案,药物组合物包含(a)85%-92%(w/w)的磷酸三钙;(b)2.0%-3.0%(w/w)的plga;(c)0.0-2.0%(w/w)的胆固醇;(d)4.0%-10.0%(w/w)的dmpc和(e)0.5%-1.5%(w/w)的多西他赛。根据一些示例性实施方案,药物组合物包含(a)86%-89%(w/w)的磷酸三钙;(b)2.4%-2.8%(w/w)的plga;(c)0.8%-1.5%(w/w)的胆固醇;(d)7.0%-9.0%(w/w)的dmpc;和(e)0.6%-1.3%(w/w)的多西他赛。根据一些实施方案,磷酸三钙是β-磷酸三钙。根据一些实施方案,本发明用于治疗结肠癌的方法进一步抑制肿瘤转移的形成。根据另外的实施方案,以上公开的用于治疗结肠癌的治疗方法也适合于治疗前列腺癌、肺癌、胰腺癌、乳腺癌、食管癌、胃癌、头颈癌和软组织肉瘤。
[0091]
根据一些实施方案,本发明提供了一种抑制肿瘤转移的方法,包括向患有恶性实体瘤的受试者施用药物组合物,该药物组合物包含(a)颗粒可生物降解基底;(b)可生物降解聚合物;(c)具有至少12个碳原子的烃链的至少一种磷脂以及(d)紫杉烷,从而抑制肿瘤转移。根据一些实施方案,药物组合物还包含固醇。根据各种实施方案,紫杉烷选自由以下组成的组:多西他赛、紫杉醇、紫杉醇衍生物和卡巴他赛。根据具体实施方案,紫杉烷是多西他赛。
[0092]
本发明的方法还可用于治疗对常规化疗耐药的肿瘤细胞。肿瘤细胞对化疗的耐药性可归因于(a)药物外排泵诸如p-糖蛋白的过表达;(b)在微管蛋白药物结合位点的获得性突变;(c)微管蛋白同种型的差异表达;(d)凋亡机制改变;(e)生长因子途径的激活;或(f)
其他生化变化(deepak sampath等人clin cancer res 2006;12(11):3459-69)。这些机制中的每一个对临床耐药性的贡献仍不确定,尽管在某些肿瘤类型中已确定与p-糖蛋白表达水平的相关性。已经令人惊讶地发现,本文公开的药物组合物可以有效地杀死耐化疗肿瘤细胞。特别地,已经示出,如以上公开的多西他赛持续释放药物组合物有效地杀死对多西他赛耐药的癌细胞。不希望受理论或作用机制的约束,表明高局部浓度和延长释放的组合产生对药物的高和延长的暴露,其有效地克服基于外排(mdr)泵的耐药机制。对化疗耐药的肿瘤细胞的非限制性列表包括hct-8结肠直肠癌细胞(ic
50
多西他赛-3070nm,ic
50
紫杉醇3290nm)、gxf-209胃癌细胞、uiso bca-1乳腺癌细胞、p02胰腺细胞、3ll lewis肺癌,kb-8-5(ic
50
多西他赛-8.8nm,ic
50
紫杉醇70.2nm)、kb-p-15(ic
50
多西他赛-17.6nm,ic
50
紫杉醇117nm)、kb-d-15(ic
50
多西他赛-68.2nm,ic
50
紫杉醇565.5nm)、kb-v-1(ic
50
多西他赛-467.5nm,ic
50
紫杉醇3202nm)和kb-ptx/099(ic
50
多西他赛-8.8nm,ic
50
紫杉醇74.1nm)表皮样细胞,dld-1(ic
50
多西他赛-16.2nm,ic
50
紫杉醇32.8nm)和hct-15(ic
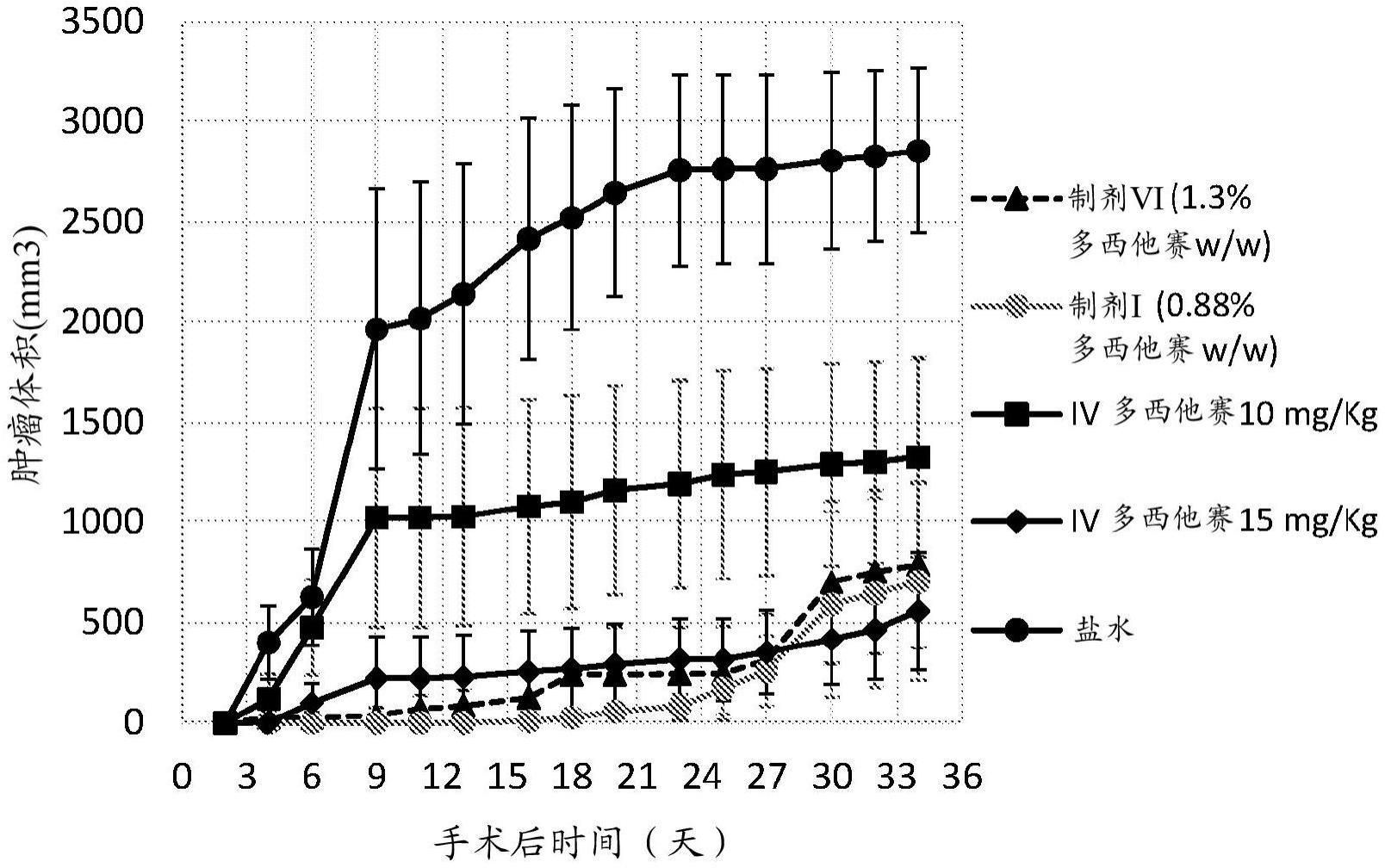
50
多西他赛-54.1nm,ic
50
紫杉醇434.6nm)结肠直肠癌细胞和a549.epob40非鳞状细胞肺癌(ic
50
多西他赛-28.5nm,ic
50
紫杉醇127.5nm)。根据一些实施方案,本发明的方法可以适合于任何其他耐化疗肿瘤,其中它们的耐药性是药物外排泵过表达的结果。
[0093]
药物的效力通常由其在肿瘤细胞周围间质液中的局部浓度决定。这继而由从药物组合物释放的药物的累积速率与其消除(例如,通过物理分布到周围组织)之间的比决定。不受理论或作用机制的限制,表明在通过手术去除肿瘤后,在肿瘤内或切除部位的内表面内持续足够的持续时间产生高局部浓度的生物可利用紫杉烷药物的能力,是本文公开的药物组合物有效杀死肿瘤细胞以及甚至对使用的药物耐药的肿瘤细胞的能力的主要因素(即,用包含多西他赛的药物组合物治疗耐多西他赛肿瘤)。更好地控制紫杉烷(例如多西他赛)的局部作用的方式之一是通过控制:1)其从药物组合物的释放曲线,2)其释放速率和3)其释放持续时间。这些参数密切相关;虽然释放速率强烈取决于特定制剂(即聚合物、脂质和紫杉烷之间的比例),但持续时间随着两个因素而变化:释放速率和药物储库的尺寸(这可以通过例如改变磷酸三钙颗粒和有机组分量之间的比例来实现)。本领域中熟知的是,通过能量依赖性外排泵增加药物从细胞内区室的外排是细胞中的自然机制。这种机制也是对化疗发展出耐药性的原因。克服耐药细胞的方式之一是在延长的时间段内用高浓度的药物压倒外排泵。因此表明,只要肿瘤部位的生物可利用紫杉烷的浓度足够,并且肿瘤细胞暴露于所述紫杉烷的持续时间足够,紫杉烷将能够杀死耐紫杉烷肿瘤细胞。
[0094]
根据一些实施方案,本发明的药物组合物为粉末形式。根据一些实施方案,粉末基本上不含水。根据其他实施方案,粉末是干粉。根据一些实施方案,粉末粒径由可生物降解矿物基底的粒径规定。包被可生物降解基底的聚合物-脂质基质部分地被包含在多孔可生物降解基底的内部空间中。根据一些实施方案,聚合物-脂质可以具有至少约30μm、至少约40μm、至少约50μm、至少约60μm、至少约70μm、至少约80μm、至少约90μm、至少约100μm、30μm和120μm之间、30μm和100μm之间、50μm和100μm之间、不大于约150μm、不大于约140μm、不大于约130μm、不大于约120μm、不大于约110μm、不大于约100μm的平均直径(如通过激光衍射测量的)。每种可能性代表本发明的单独的实施方案。根据一些实施方案,粉末被散布或喷洒在肿瘤的表面上,或者被施加到切除腔的内表面。根据一些实施方案,粉末以范围为每1cm2表面积20mg至500mg的量散布或喷洒在实体瘤的表面或切除腔的表面上。根据可选的
实施方案,组合物以范围为每1cm
2 50mg至400mg、50mg至350mg、50mg至300mg、50mg至275mg、50mg至250mg、50mg至225mg、50mg至200mg、50mg至180mg、50mg至170mg;50mg至160mg;50mg至150mg之间;50mg至120mg之间;50mg至100mg之间;50mg至100mg;75mg至160mg之间;75mg至120mg之间;75mg至100mg之间的量施加。
[0095]
根据本发明的某些实施方案,在将药物组合物施加于肿瘤部位或肿瘤切除后的切除肿瘤腔的肿瘤壁之前,将药物组合物配制成糊剂。根据一些实施方案,糊剂被散布在肿瘤的表面上或被施加到切除腔的内表面。通常,糊剂样结构通过在其施加之前用水溶液例如盐水(0.9%盐水溶液)使颗粒药物组合物水合而获得。根据一些实施方案,水合应当在将所得糊剂施加到肿瘤部位前不超过2小时进行,优选地在将所得糊剂施加到肿瘤部位前最多1小时,更优选地,在将其施加到肿瘤部位之前不超过30分钟。根据一些实施方案,当水性溶液(例如:盐水)与药物组合物混合的量相应地为0.1:1和1:1(w/w)之间;优选地相应地在0.3:1和0.6:1(w/w)之间时,将获得膏状质地。根据一些实施方案,添加到干燥药物组合物粉末中用于形成如上描述的糊剂的水性溶液不改变被水合的药物组合物粉末的总体积,因此使总体积几乎不变。根据一些实施方案,糊剂被散布在肿瘤的表面或切除腔的表面上,形成具有高达5mm;可选地,高达4mm;可选地高达3mm的厚度;优选在1mm厚至3mm厚之间的薄和均一的层。
[0096]
根据另外的实施方案,通常在手术前,本文公开的药物组合物可以通常通过注射瘤内施用,产生新辅助疗法。根据一些实施方案,可以使用适合于注射干粉的装置将药物组合物作为干粉直接注射到肿瘤中(非限制性实例公开在美国专利第8579855号,然而可以使用本领域已知的用于递送粉末的任何其他合适的医疗装置)。可选地,药物组合物可以作为液体悬浮液注射。临床上使用的标准注射器、针头、管道系统和插管可用于注射液体悬浮液。液体悬浮液可以优选地制备成使得将极小量的连续液相添加到适合于形成用于注射的悬浮液的药物组合物粉末中。根据一些实施方案,当连续液相(例如:水相)与药物组合物粉末混合的量分别在0.1:1和2:1(w/w)之间,优选地分别在0.3:1和1:1(w/w)之间,更优选地分别在0.3:1和0.6:1(w/w)之间时,将获得用于注射的悬浮液。注射的药物悬浮液的体积可以不超过实体瘤体积的50%,优选地肿瘤体积的小于45%、小于40%、小于35%、小于30%、小于25%、小于20%、小于15%。每种可能性代表本发明的单独的实施方案。悬浮液的体积可以优选地分成多于一次的注射,优选地注射到肿瘤的不同部分,以便将剂量分散到肿瘤的整个或基本上整个体积上。由于本发明的药物组合物中包含的可生物降解颗粒基底的固有特性,该组合物是辐射不透明的,并且可以用标准的临床放射检查方法观察到,因此可以在注射期间和治疗时间段期间通过例如超声成像;磁共振成像;x射线透射成像;计算机断层成像;基于同位素的成像,包括正电子发射断层扫描或γ照相机/spect;基于磁或无线电波的定位系统来监测本文公开的药物组合物的定位。
[0097]
在一些实施方案中,用于注射的悬浮液可以包含水(例如盐水)和任选的一种或更多种赋形剂,赋形剂选自由以下组成的组:缓冲剂、张力调节剂、粘度调节剂、润滑剂、渗透剂和表面活性剂。例如,悬浮液可以包含药物组合物颗粒、水、润滑剂。在一些实施方案中,悬浮液基本上由以下组成或由以下组成:水、悬浮在盐水中的药物组合物颗粒和表面活性剂。可以使用的表面活性剂的非限制性实例包括聚山梨醇酯(诸如,聚山梨醇酯20、聚山梨醇酯21、聚山梨醇酯40、聚山梨醇酯60、聚山梨醇酯61、聚山梨醇酯65、聚山梨醇酯80、聚山
梨醇酯81、聚山梨醇酯85和聚山梨醇酯120)、月桂基硫酸酯、乙酰化单甘油酯、二乙酰化单甘油酯和泊洛沙姆。悬浮液可包含一种或更多种张力调节剂。合适的张力调节剂包括通过实例的方式但不限于一种或更多种无机盐、电解质、氯化钠、氯化钾、磷酸钠、磷酸钾、硫酸钠、硫酸钾、碳酸氢钠和碳酸钾以及碱土金属盐(诸如碱土金属无机盐,例如钙盐和镁盐)、甘露醇、右旋糖、甘油、丙二醇及其混合物。悬浮液可包含一种或更多种缓和剂(demulcent)。合适的缓和剂包括纤维素衍生物,诸如羧甲基纤维素钠、羟乙基纤维素、羟丙基甲基纤维素和甲基纤维素;明胶、甘油、聚乙二醇300、聚乙二醇400和丙二醇。悬浮液可包含增加或降低悬浮液粘度的粘度调节剂。合适的粘度调节剂包括甲基纤维素、羟丙基甲基纤维素、甘露醇和聚乙烯吡咯烷酮。悬浮液可包含一种或更多种润滑剂。合适的润滑剂包括天然和合成磷脂(诸如例如dmpc)或透明质酸。
实施例
[0098]
实施例1-包含不同磷脂的多西他赛持续释放制剂
[0099]
制备了含有和不含胆固醇的包含不同磷脂酰胆碱的制剂。测试的制剂组分之间的比例如下:tcp:(dmpc、dppc、dspc或dopc):plga:dtx以1000:90:30:10的比例并且tcp:(dmpc、dppc、dspc或dopc):plga:ch:dtx以1000:90:30:15:10的比例。
[0100]
根据以下示例性方案制备制剂:
[0101]
a)向八个5ml容量瓶中添加plga(100mg)、ch(需要50mg)、多西他赛(33.3mg)和磷脂酰胆碱(300mg),随后添加ea:etoh混合物以溶解固体。
[0102]
b)需要时,将混合物加热到40℃-45℃,以帮助溶解磷脂。
[0103]
c)将1.5gβ-tcp颗粒(50-100μm)添加到8个30mm培养皿中的每一个中,并将2.25ml步骤(a)中制备的8种有机溶液添加在tcp的上方。
[0104]
d)将培养皿不盖盖子放置在设置为45℃的干加热块上约45分钟,并且然后盖上盖子并置于真空下(在室温)过夜,以使溶剂完全蒸发。
[0105]
e)将所有8种制剂转移到20ml闪烁小瓶中,并在4℃避光保存。
[0106]
多西他赛释放-将250mg每种测试制剂放入20ml小瓶中,向小瓶中缓慢添加5ml pbs,并将样品放入在37℃的培养箱。每天一次收集并分析pbs培养基。然后向小瓶中添加5ml新鲜pbs。使用hplc定量释放的药物浓度。13天后停止释放分析。将制剂剩余物在室温在真空中干燥过夜。定量制剂剩余物中的多西他赛及其7-epi杂质的量。
[0107]
图1中可以看出,与多西他赛从包含具有更长烃链和更高相变温度的磷脂(例如dppc和dspc)的类似组合物的释放相比,多西他赛从包含dmpc的组合物更快和更有效地释放。包含具有长于14个碳原子的饱和烃链的磷脂的组合物在6周内没有达到完全释放潜力,6周通常是肿瘤切除手术和进一步辅助治疗(包括通常作为肿瘤切除后预防性治疗给予的放射或全身化疗)之间的有限时间窗。此外,已经示出,包含胆固醇的组合物比不含胆固醇的类似组合物更好地保护多西他赛储库不转化为其7-差向异构体(图2)。
[0108]
实施例2-包含不同量dmpc的多西他赛持续释放制剂。
[0109]
材料
[0110]
plga(corbion,purac 7502);多西他赛(dtx)(tapi);dmpc(lipoid);tcp(cam bioceramics,50-100μm)
[0111]
制剂成分tcp:dmpc:plga:dtx之间的比例分别为1000:(0、30、60、90、135):30:10,相当于制剂总重量中0、2.8%、5.5%、8%和11.5%(w/w)的dmpc。制备制剂,并如以上实施例1中描述进行多西他赛从制剂中的释放。
[0112]
图3中可以看出,发现相对7-epi含量在不含dmpc的制剂中最高,并且其相对量在包含dmpc的制剂中大大减少。
[0113]
实施例3-包含去污剂的多西他赛持续释放制剂
[0114]
已经制备了包含去污剂tween 80的制剂,并且如以上实施例1中描述地产生了所述制剂的释放曲线。
[0115]
已经制备了包含dmpc或dppc作为脂质组分并还包含tween 80的制剂。制剂成分tcp:dmpc:plga:dtx:tween-80之间的比例分别为1000:90:30:10:(0、15、45)(图4a)。制备包含dppc作为脂质组分的制剂,其中制剂成分tcp:dmpc:plga:dtx:tween-80之间的比例分别为1000:90:30:10:(0、15、45、90)(图4b)。
[0116]
图4a和图4b示出,向持续释放组合物添加tween-80增加了释放速率,然而,它影响了总体释放曲线,在存在tween-80的情况下,总体释放曲线的特征在于不想要的爆发释放,这可能导致显著的局部和全身毒性。
[0117]
实施例4-具有不同量胆固醇的多西他赛持续释放制剂。
[0118]
已经制备了包含不同量胆固醇(ch)的制剂。
[0119]
测试的制剂组分之间的比例如下:tcp:dmpc:plga:dtx:ch以1000:90:30:10:(0、15、30)的比例,相当于含有制剂总重量中0、1.3%和2.6%(w/w)的胆固醇的制剂。
[0120]
已经发现,在包含胆固醇的制剂中,多西他赛向其7-差向异构体的转化已经减少(图1)。另外发现,添加胆固醇在在储存期间保护多西他赛中是有效的(参见表2)。
[0121]
图5示出,胆固醇浓度越高,制剂中多西他赛的7-差向异构体的百分比越低。然而,由于胆固醇在制剂混合物中有限的溶解度,应优选地使用低于制剂总重量2.6%胆固醇w/w的浓度。
[0122]
表1列出了包含各种tcp/dmpc/plga/胆固醇/dtx的另外制剂,其中比较了含有或不含胆固醇的制剂。
[0123][0124][0125]
表1-根据本发明某些实施方案的多西他赛持续释放制剂
[0126]
表2概述了用表1中列出的制剂i-iv进行的稳定性测定的结果,示出胆固醇的存在减少甚至完全停止了制剂中多西他赛的7-差向异构体的形成。
[0127][0128]
表2-根据本发明某些实施方案的各种制剂的稳定性测定
[0129]
根据本发明的实施方案,多西他赛持续释放组合物中胆固醇的存在使多西他赛化学稳定,并产生在储存9周(例如在室温)后7-表-多西他赛含量低于0.5%的组合物。特别地,在室温储存9周后,7-表-多西他赛的含量优选地低于0.4%,诸如约0.35%、约0.3%、约0.25%、约0.20%或甚至更低。
[0130]
术语“化学稳定”意指,当本发明的药物组合物在常规条件下储存时,多西他赛的化学结构是稳定的。优选地,在2-8℃储存至少24个月后,7-表-多西他赛的含量百分比小于1%,优选地小于0.5%。
[0131]
实施例5-持续释放紫杉醇制剂
[0132]
如以上实施例1描述地制备紫杉醇(ptx)持续释放组合物。测试的制剂组分之间的比例如下:tcp:(dmpc、dppc、dspc或dopc):plga:ch:ptx以1000:90:30:15:10的比例。如以上实施例1描述地追踪紫杉醇从组合物的释放,并且零级释放曲线在图6中呈现。
[0133]
实施例6-包含聚乙二醇(peg)的持续释放多西他赛制剂
[0134]
如实施例1中描述地制备包含peg 4000作为聚合物的制剂。制剂组分tcp:dmpc:peg:胆固醇:多西他赛之间的比例如下:1000:90:30:15:10。
[0135]
使用溶出度分析(usp1溶出度仪-sotax at7 smart,篮子转速为50rpm)追踪多西他赛从包含peg 4000的制剂的释放,并与多西他赛从包含plga作为聚合物的类似制剂的释放比较。
[0136]
将1g制剂溶解在pbs(磷酸盐缓冲盐水)中的0.5% sds中,在每个容器中500ml培养基。采样时间点-1h、2h、4h、6h、24h。
[0137]
如图7中示出,peg 4000的存在导致包封的多西他赛的爆发释放,超过90%的药物在5小时内被释放。相比之下,多西他赛从包含plga的制剂的释放大大延长,并展示出延长的零级动力学,90%的药物在20小时内被释放。
[0138]
实施例7-包含不同量的多西他赛(dtx)的根据本发明的一些实施方案的药物组合物在体内对小鼠同基因肿瘤模型中ct26细胞系的复发的抗肿瘤作用的评价。
[0139]
进行本研究以评估具有不同多西他赛剂量的根据本发明示例性实施方案的持续释放制剂对balb/c小鼠(7-8周龄,研究起始时重16-20 /-克)中ct26结肠癌细胞系肿瘤的
抗肿瘤作用。
[0140]
测试的制剂:
[0141]
制剂v-包含2.6%多西他赛的plex-dtx(tcp:dmpc:plga:dtx(w/w)等于1000:90:30:30)
[0142]
制剂vi-包含1.3%多西他赛的plex-dtx(tcp:dmpc:plga:dtx(w/w)等于1000:90:30:15)
[0143]
制剂i-包含0.88%多西他赛的plex-dtx(tcp:dmpc:plga:dtx(w/w)等于1000:90:30:10)
[0144]
制剂vii-包含0.27%多西他赛的plex-dtx(tcp:dmpc:plga:dtx(w/w)等于1000:90:30:3)
[0145]
对照:盐水
[0146]
疾病诱导:ct-26皮下肿瘤(一种对多西他赛(ic
50 260nm)耐药的细胞系)的移植。为了比较的目的,对多西他赛不耐药的细胞系的ic
50
在几nm的范围内,实例包括nsclc:a549细胞(1.9nm),crc:hct-116细胞(5.4nm)和表皮样kb-3-1细胞(1.1nm)[preclinical pharmacologic evaluation of mst-997,an orally active taxane with superior in vitro and in vivo efficacy in paclitaxel-and docetaxel-resistant tumor models(clin cancer res 2006,12:3459-69)]
[0147]
小鼠右髋上方sc注射50万个ct-26细胞。11天后肿瘤达到期望的体积(~400mm3),将动物分成五组,麻醉小鼠,并切除肿瘤。第1-4组在肿瘤床中sc施用测试制剂(200mg),每组施用包含不同浓度多西他赛(2.6%、1.3%、0.88%或0.27%w/w(表3))的制剂,或局部给予盐水(第5组)。然后使用无菌缝合线闭合皮肤切口。手术后将动物放回到它们的笼子进行恢复和观察。肿瘤尺寸、临床体征和体重追踪了43天。
[0148][0149]
表3-研究设计,组指定
[0150]
结果
[0151]
在研究结束时(第43天),无肿瘤动物的数量在dtx治疗组之间不同。在最高多西他赛剂量(5.2mg/小鼠),4/8的动物无肿瘤;在第2组(2.6mg/小鼠)中,5/9的动物无肿瘤;在第3组(1.73mg/小鼠)中,7/9的动物无肿瘤;并且在第4组(0.52mg/小鼠)中,3/8的动物无肿瘤。在第5组中没有观察到无肿瘤动物。平均肿瘤体积在dtx治疗组(第1组、第2组、第3组和第4组分别为548mm3、814mm3、218mm3和872mm3;图8)中比盐水治疗组(第5组;2091mm3)中显著更小(p《0.05)。组内的大标准偏差反映了组内肿瘤尺寸的大变异性。
[0152]
第1组、第2组、第3组和第4组中的存活率分别为63%(5/8)、56%(5/9)、90%(8/9)和50%(4/8),并且第5组(未治疗)中为0%(0/8)。第1组(2.6%多西他赛)中,2只动物由于严重的体重减轻而被人道地处死(第19天),并且1只动物由于肿瘤体积超过1500mm3而被处
死(第43天)。第2组(1.3%多西他赛)中,3只动物由于肿瘤体积超过1500mm3而被处死(第22天、第31天和第36天),并且发现1只动物死亡(第36天)。第3组(0.88%多西他赛)中,只有1只动物由于肿瘤体积超过1500mm3而被提前终止(第15天)。第4组(0.27%多西他赛)中,4只动物由于肿瘤体积超过1500mm3而被提前终止(第10天、第12天和第17天)。第5组(未治疗)中所有动物由于肿瘤体积超过1500mm3而到第24天被处死。虽然在盐水对照组中所有动物都到第24天终止,但根据本发明的一些实施方案,在用多西他赛制剂治疗的组中,大多数动物存活到研究终止(第43天)。
[0153]
体重-为了减少肿瘤重量对动物总体重的影响,基于切除的肿瘤制作了绘制实际肿瘤重量相比于肿瘤体积的校准曲线。该图能够基于其体积估计肿瘤重量,并且从荷瘤动物的实际体重中减去该肿瘤重量,从而能够在研究随访期间测量动物体重。在研究过程期间每周测量动物体重三次。将体重针对肿瘤切除和治疗起始当天的动物体重归一化。
[0154]
第1组和第2组(分别是2.6%多西他赛和1.3%多西他赛)中的动物在第17天罹患体重减轻,分别最大下降20%和9%。在第1组和第2组动物两者中,第17天后观察到增重;到研究终止时,这些动物的体重为它们初始体重的115%-116%。第3组(0.88%多西他赛)中的动物在施用后长达两周有轻微的体重减轻(~2%),但在第17天及之后观察到增重,到研究终止时达到其初始体重的113%。第4组(0.27%多西他赛)和未治疗组(第5组)中的动物在手术后第3天开始增重。
[0155]
讨论-与盐水治疗组相比,展示了用根据本发明的一些示例性实施方案的各种多西他赛制剂治疗的抗肿瘤作用,每种制剂具有不同的多西他赛浓度。与盐水治疗组相比,所有制剂增加了动物存活率。然而,与多西他赛毒性相关的症状在多西他赛浓度较高(1.3%多西他赛(制剂vi)和2.6%多西他赛(制剂v))的多西他赛制剂中更频繁。
[0156]
有趣的是,具有较低多西他赛浓度(0.88%(制剂i);1.76mg/小鼠)的制剂示出极小的体重减轻并且被认为更安全。该剂量在减少小鼠肿瘤复发方面也比具有最低多西他赛浓度的制剂(0.27%(制剂vii);0.54mg/小鼠)更有效。
[0157]
实施例8-根据本发明实施方案的制剂对小鼠同基因肿瘤模型的抗肿瘤作用的评价
[0158]
在当前的实验中,将根据本发明的一些实施方案的持续释放制剂的局部治疗的效力与多西他赛的全身治疗进行比较。为此,在雌性balb/c小鼠(7-8周龄,研究起始时体重
±
16-20克)中建立皮下结肠癌肿瘤,并在达到期望的体积(400-600mm3)后,将其切除,并去除其体积的~90%,随后施用测试项目。追踪肿瘤的复发率,并与未治疗的对照组进行比较。
[0159]
研究设计:
[0160]
动物右髋上方sc注射50万个ct-26细胞。当肿瘤~7天后达到期望的体积(400mm3)时,将动物分成5组,麻醉小鼠,并切除肿瘤。第1组向肿瘤床施用200mg包含1.3%多西他赛的制剂vi(2.6mg/小鼠),并且第2组向肿瘤床施用200mg包含0.88%多西他赛的制剂i(1.72mg/小鼠)。第3组和第4组通过重复i.v注射多西他赛溶液治疗。第3组用20mg/kg i.v施用,随后i.v注射5次10mg/kg,每4天一次。第4组用30mg/kg i.v施用,随后iv注射5次15mg/kg,每4天一次。第5组用作盐水治疗对照,将~100μl盐水局部施用到肿瘤床中。然后使用无菌缝合线闭合皮肤切口。手术后将动物放回到它们的笼子进行恢复和观察。肿瘤尺寸、临床体征和体重追踪了39天。完整研究设计在表4中呈现。
[0161][0162][0163]
表4-实施例8组指定
[0164]
实验程序
[0165]
研究结果
[0166]
在研究结束时(第39天),第1组中5/8的动物无肿瘤。第2组中6/8的动物无肿瘤。在第3组(i.v多西他赛)中,2/8的动物无肿瘤。在第4组(i.v多西他赛)中,3/8的动物无肿瘤。在第5组(盐水治疗)中,所有动物都有肿瘤。
[0167]
39天后,平均肿瘤体积在治疗组1-4(第1组、第2组、第3组和第4组分别为563mm3、375mm3、955mm3和485mm3,图9)中比盐水对照组(1500mm3)中显著更小(p《0.05)。组内的大标准偏差反映了组内肿瘤尺寸的大变异性。
[0168]
在第1组和第2组中,用根据本发明实施方案的持续释放制剂治疗的组中的存活率分别为63%(5/8)和75%(6/8)。iv多西他赛治疗组中,在第3组和第4组中存活率分别为50%(4/8)和63%(5/8)。第5组(盐水对照)中存活率仅为12.5%(1/8)。第1组(制剂vi,1.3%多西他赛)中,3只动物由于肿瘤体积超过1500mm3而被提前处死(第18天、第30天和第37天)。第2组(制剂i,0.88%多西他赛)中,2只动物由于肿瘤体积超过1500mm3而被提前处死(第30天和第34天)。第3组(i.v多西他赛10mg/kg)中,4只动物由于肿瘤体积超过1500mm3而被提前终止(第10天3只动物和第25天1只)。第4组(i.v多西他赛15mg/kg)中,1只动物由于严重体重减轻和不良身体状况而被提前终止(第20天)并且2只动物由于肿瘤体积超过1500mm3而被提前终止(第10天和第34天)。在盐水对照组中,8只动物由于肿瘤体积超过1500mm3而被处死(第10天4只动物以及第16天、第20天、第23天和第37天各1只)。
[0169]
在如以上实施例5中描述的研究期间,每周测量动物体重三次。第1组、第2组、第3组和第4组中的动物罹患体重减轻,分别最大下降12%(第16天)、8%(第16天)、8%(第16天)和17%(第20天)。第5组(盐水对照)中的动物由于早期肿瘤发展增加了小鼠的体重,所以没有示出体重减轻。总的来说,用本文公开的持续释放制剂治疗的组和i.v多西他赛治疗组在第18天、第18天、第20天和第23天开始增重(分别对于第1组、第2组、第3组和第4组)。
[0170]
结论:制剂i和制剂vi两者的局部施加在减少肿瘤复发和增加总存活率方面展示出高效力。两种制剂示出相似的效力。与局部治疗相比,15mg/kg(2.6mg/小鼠总剂量)的全身多西他赛治疗在无肿瘤存活率方面展示出更低的效力,表明局部治疗的优越性。另外,全身治疗引起了严重的全身毒性,反映在动物体重减轻上。第2组(制剂i,0.88%多西他赛)中
的体重减轻不太明显,尽管两组中对施用的多西他赛总剂量的暴露相似(~1.7mg)。
[0171]
实施例9-根据本发明示例性实施方案的持续释放制剂对小鼠异种移植肿瘤模型体内u87 gbm细胞系的抗肿瘤作用的评价
[0172]
进行本研究以评估根据本发明的一些示例性实施方案的不同量的持续释放组合物对裸鼠中u87人类gbm细胞系肿瘤异种移植物的抗肿瘤作用的效力。
[0173]
研究设计
[0174]
小鼠右髋上方皮下(sc)注射300万个u87细胞。当肿瘤约9天后达到约400mm3的体积,将动物分成6组(n=10/组),麻醉小鼠,并切除肿瘤。测量和记录肿瘤床尺寸。第1组、第2组和第3组分别在肿瘤床上局部施用20mg、50mg或100mg的制剂ii;0.87%多西他赛。第4组在肿瘤床上局部施用100mg制剂ii媒介物(仅赋形剂,不含dtx)。第5组用作盐水对照,其中向肿瘤床局部施用~100μl盐水。第6组用作阳性对照,并用吉西他滨治疗(300mg/kg作为腹膜内注射施用,四次,每7天一次)。然后使用无菌缝合线闭合皮肤切口。手术后将动物放回到它们的笼子进行恢复和观察。肿瘤尺寸、临床体征和体重追踪了43天。
[0175]
研究结果
[0176]
肿瘤切除后,测量肿瘤床的面积。肿瘤床的平均面积为134
±
17mm2。计算制剂ii的施加并归一化为每1cm2肿瘤床面积的量。归一化的施加率和多西他赛剂量在表5中详述。
[0177][0178]
表5:施加的制剂ii的量(mg/cm2)
[0179]
在研究结束时(第43天),无肿瘤动物的数量在制剂ii治疗组之间不同。第1组(100mg的制剂ii)中,2/10的动物无肿瘤,第2组(50mg的制剂ii)中,1/10的动物无肿瘤,并且第3组(20mg的制剂ii)中,4/10的动物无肿瘤。第4组(100mg制剂ii媒介物)和第5组(盐水对照)中,所有动物均有肿瘤。第6组(吉西他滨)中,2/10的动物无肿瘤。43天后(图10),平均肿瘤体积在所有制剂ii和吉西他滨治疗组(第1组、第2组、第3组和第6组分别为69mm3、456mm3、403mm3和780mm3)中比制剂ii媒介物和盐水治疗组(第4组和第5组分别为1898mm3和2059mm3)中显著更小(p《0.001)。
[0180]
第1组、第2组和第3组(分别施用100mg、50mg或20mg的制剂ii)中的存活率,分别为60%(6/10)、30%(3/10)和50%(5/10)。第4组(100mg制剂ii媒介物)中,仅记录了10%(1/10)的存活率。第5组(盐水对照)中,到第31天没有记录到存活的动物。第6组(吉西他滨)中存活率为20%(2/10)。第1组(100mg制剂ii)中,发现4只动物死亡(第20天和第33天各1只和第34天2只)。第2组(50mg制剂ii)中,发现6只动物死亡(第9天、第18天、第23天、第25天、第33天和第39天各1只)。一(1)只动物在第23天由于肿瘤体积超过1500mm3而被提前终止。第3组(20mg制剂ii)中,发现5只动物死亡(第9天、第18天、第23天、第25天、第33天和第39天各1只)。它们死亡的原因可能是由于全身毒性,因为所有这些动物在它们被发现死亡的前一天示出了~20%的体重减轻。第4组(100mg制剂ii媒介物)中,9只动物由于肿瘤体积超过1500mm3而被提前终止(第9天2只,第13天3只,第18天3只和第25天1只)。第5组(盐水对照)
中,发现2只动物死亡(第13天和第23天各1只)。它们死亡的原因未知。八(8)只动物由于肿瘤体积超过1500mm3而被提前终止(第9天3只,第13天2只,第17天1只,第27天1只和第30天1只)。第6组(吉西他滨)中,发现4只动物死亡(第30天和第41天各1只以及第34天2只)。四(4)只动物由于肿瘤体积超过1500mm3而被终止(第23天、第27天、第30天和第33天各1只)。治疗组(1、2、3和6)中大多数动物死亡的原因可能是由于全身毒性(所有这些动物在它们被发现死亡的前一天示出了~20%的体重减轻)。
[0181]
接受制剂ii(分别为100或50mg)的第1组和第2组中的动物罹患体重减轻,分别最大平均下降9%(第34天)和2%(第13天)。第3组(20mg制剂ii)中的动物未罹患体重减轻。第4组(制剂v媒介物)中的动物具有2%的最大平均体重减轻(第6天)。第5组(盐水对照)中的动物具有5%的最大平均体重减轻(第23天)。第6组(吉西他滨)中的动物具有13%的最大平均体重减轻(第34天)。从最大体重减轻时间点开始,所有组中的动物开始增重。在第43天,在第1组、第2组和第3组,制剂ii治疗组中的动物体重分别为研究起始时其体重的99%、100.5%和105%。在盐水对照组(第4组)、制剂ii媒介物组(第5组)和吉西他滨组(第6组)中,存活动物的数量太小,无法计算出显著的平均值。
[0182]
结论
[0183]
与盐水对照和制剂ii媒介物治疗组相比,展示了用不同制剂ii量(如以mg/cm2反映的)治疗的抗肿瘤作用。与盐水对照组相比,所有制剂ii治疗水平增加了动物存活率。分别用20mg或50mg制剂ii(15mg/cm2或37mg/cm2)治疗的组将平均肿瘤体积从盐水对照组的1898mm3分别减少到403mm3和456mm3。每只动物100mg制剂ii(75mg/cm2)治疗对手术切除后人类gbm肿瘤复发具有最大作用,如反映在存活动物的最高数量和最低的总平均肿瘤体积(69mm3)中。
[0184]
实施例10-根据本发明实施方案的持续释放制剂对fischer大鼠脑中的同基因9l gbm细胞系肿瘤的抗肿瘤作用的评价
[0185]
进行本研究以关于在fischer大鼠中诱导同基因脑内肿瘤后的动物存活期评估根据本发明一些示例性实施方案的不同量的持续释放制剂的抗肿瘤作用。
[0186]
研究设计
[0187]
七十五(75)只动物被指定用于本研究。如表6中描述,将动物分成九组。第1组用作未治疗的对照。第2组和第3组用作阳性对照并且分别以低剂量(33.5mg/kg)和高剂量(50mg/kg)用替莫唑胺(gbm患者的soc化疗治疗)通过灌胃治疗。第4组(n=10)在缺损部位用与制剂ii高量组相同量的制剂ii媒介物治疗。第5-8组(n=10/组)在切除部位以5mg、10mg、25mg或50mg/缺损部位的制剂ii进行治疗。在研究起始时,做一个切口,并暴露所有动物的颅骨并在颅骨中钻出直径5mm的缺损。切开硬脑膜并且暴露出脑。每只动物使用立体定向仪在脑中~1mm的深度处注射9l细胞(105个细胞/2μl/动物)。注射细胞后,缝合切口。将动物放回到它们的笼子进行恢复。治疗(替莫唑胺或制剂ii)设定在细胞注射后五天开始。对于制剂ii/制剂ii媒介物治疗,在第5天将第4-8组中的脑缺损重新打开,并在缺损内将测试项目施用于注射部位的上方。缺损用骨蜡封闭。将动物放回到它们的笼子进行恢复。在研究期间追踪存活期、临床体征、体重和认知行为评价。
[0188][0189]
表6-研究设计
[0190]
研究结果-所有动物在治疗后五周内死亡。第1组中,平均存活期为15.8
±
1.9天。第2组(替莫唑胺33.5mg/kg)中,平均存活期为18.8
±
2.7天。第3组(替莫唑胺50mg/kg)中,平均存活期为21.8
±
3.3天。第4组(制剂ii媒介物)中,平均存活期为17.9
±
2.2天。第5组(制剂ii 50mg/动物)中,平均存活期为22.8
±
5.8天。第6组(制剂ii 25mg/动物)中,平均存活期为20.9
±
6.5天。第7组(制剂ii 10mg/动物)中,平均存活期为20.4
±
4.9天。第8组(制剂ii 5mg/动物)中,平均存活期为20.4
±
3.2天。
[0191]
结论
[0192]
在肿瘤细胞注射到脑中后五天ic施用制剂ii改善了所有测试剂量的动物存活期。抗肿瘤作用随着制剂ii施用量的增加而增加。在每个部位50mg制剂ii(0.87%多西他赛w/w)的最高量实现最强作用(缺损直径5mm,缺损面积0.196cm2,对应于制剂ii(2.2mg/cm2多西他赛)的总量255mg/cm2)。
[0193]
实施例11-在大鼠中局部施用根据本发明示例性实施方案的多西他赛(dtx)持续释放组合物的药代动力学(pk)曲线的评价。
[0194]
本研究比较了根据本发明几个实施方案的多西他赛持续释放组合物向大鼠施用的药代动力学曲线。将从局部施用制剂释放的多西他赛的全身pk曲线与i.v施用的多西他赛的pk曲线进行比较。
[0195]
动物:30只sprague-dawley雌性大鼠,重 /-200克
[0196]
实验设计-本研究包括三个研究组(n=10)。动物被麻醉,并切开右髋上方的皮肤(1cm长)并提起,产生sc口袋。通过制作这个口袋,下面的肌肉被轻微损伤,模仿大鼠模型中sc肿瘤移植物切除的情况。每只动物接受如表7中详述的治疗。在第1组和第2组中,制剂vi和i分别在受损肌肉上方的sc口袋中施用。然后缝合皮肤。在i.v治疗组(第3组)中,在伤口闭合后立即给予一次治疗的施用。施用后,在指定的时间点收集血液样品。每个治疗组分为两个亚组(n=5/亚组)并且每个亚组在不同时间点取样。在施用后0.5小时、1小时、2小时、4小时、8小时、12小时和24小时以及2天、3天、4天、5天、6天、7天、14天、21天和30天收集血液。在研究期间追踪临床体征和动物体重。通过液相色谱串联质谱(lc-ms/ms)方法(定量下限[lloq]=3ng/ml)评价血浆样品中释放的多西他赛的浓度。
[0197]
结果用于确定多西他赛的pk曲线。
[0198][0199]
表7-研究设计
[0200]
研究结果
[0201]
血浆样品的pk分析示出,制剂vi和i的总暴露比单次i.v施用时间长(制剂vi、制剂i和i.v的t
last
分别为168小时、120小时和72小时;表6)。释放的多西他赛暴露时间与持续释放制剂(vi和i)中多西他赛的剂量相关。较高多西他赛剂量(1.3%)比较低多西他赛剂量(0.88%)具有更长的血浆暴露。在auc、c
max
和t
1/2
中观察到相同的趋势。i.v制剂的c
max
比制剂vi的最大暴露高10倍以上(第3组和第1组分别为881ng/ml相比于80.4ng/ml;表4)。由于制剂i和i.v施用中多西他赛的总剂量相似(分别为1.76mg/动物和2mg/动物),两组的auc值也相似(分别为2351hr*mg/ml和2276hr*mg/ml;表8)。这一观察结果支持了这两组中体重变化的相似趋势。
[0202][0203]
表8-pk研究结果
[0204]
结论
[0205]
大鼠中来自多西他赛的持续释放制剂(制剂i和vi)和i.v施用的多西他赛的全身pk曲线之间的比较显示了总暴露时间和峰值暴露的差异。与单次i.v施用相比,持续释放制剂(两种dtx浓度)中的总暴露持续时间更长。多西他赛的i.v施用后峰值血浆水平更高。这些差异是由于多西他赛从持续释放制剂缓慢且逐渐释放。虽然制剂i和vi通过逐渐释放多西他赛延长了暴露时间,但它也降低了峰值血浆水平,限制了对细胞毒性浓度的潜在暴露。t
last
随着持续释放制剂中多西他赛剂量的增加而增加。对于auc、c
max
和t
1/2
观察到相同的关系。本研究显示,根据本发明示例性实施方案的延长释放制剂在延长的时间段内释放多西他赛,同时保持与i.v治疗的暴露相似的全身暴露(auc),但具有大大降低的c
max
。
[0206]
实施例12-根据本发明示例性实施方案的持续释放制剂在sd大鼠中颅内(ic)施用后的局部安全性的评价
[0207]
进行本研究以评估根据本发明示例性实施方案的不同量的持续释放制剂在sprague-dawley大鼠中ic施用后的局部和全身安全性。
[0208]
研究设计-将动物分为7组(n=20/组)。在研究起始时,暴露动物的颅骨,并在颅骨中钻出5mm直径的缺损,暴露脑。在第1-3组中,将制剂ii(50mg、25mg和10mg;分别对应于0.435mg、0.218mg和0.087mg多西他赛,进一步对应于255mg/cm2、127mg/cm2和51mg/cm2的制
剂ii(基于具有0.196cm2的表面积、直径为0.5cm的缺损尺寸计算))施用在动物脑上。在第4-6组中,将制剂ii媒介物(不含多西他赛)(50mg、25mg和10mg)施用在动物脑上。第7组用作假对照组。施用测试项目后,用骨蜡密封缺损并缝合切口。将动物放回到它们的笼子进行恢复。在研究期间追踪临床体征、体重和认知行为评价(运动、震颤、头部倾斜和毛发旋转)。在每个指定的时间点(1周、4周、8周或16周),来自每组的5只动物被处死,随后进行肉眼尸检,并收集施用部位和重要器官,以盲法进行组织病理学评价。
[0209]
在研究期间,仅发现一只动物(来自25mg治疗组)在第89天死亡。一只动物(来自50mg治疗组)由于严重的体重减轻而在第90天提前终止。在动物提前终止或死亡前几天,两只动物都示出评分为轻度至中度的行为变化。被发现死亡的动物没有进行肉眼尸检或组织学评估,因为从死亡到被发现的时间很长(~24小时)。提前终止的动物(pre-terminated animal)的肉眼尸检和组织学评价未揭示制剂ii施用和动物情况之间的任何相关性,因此得出结论,体重减轻与测试项目不相关。
[0210]
除了罹患严重体重减轻的单只动物(如上),所有组中的所有其他动物在研究期间都体重增加。
[0211]
制剂ii施用后一周处死的动物的颅骨和脑的组织病理学分析示出了,在所有组的所有动物中,颅骨和皮质中存在炎症(1.4-2.4)和坏死(1.2-3.2)的相似平均等级。在治疗组中,不同剂量的制剂ii和制剂ii媒介物(不含多西他赛)之间没有观察到平均评分的差异。
[0212]
施用后四周,相对于假手术组和所有制剂ii媒介物组的第1周评分,颅骨和皮质中的平均坏死和炎症评分降低。在第4周来自用50mg和25mg制剂ii治疗的组的动物中,平均坏死和炎症评分相对于第1周的终止点普遍增加。10mg制剂ii组中的评分在第1周和第4周之间保持不变。
[0213]
在第8周终止时间点,在施用25mg和50mg制剂ii的组中,颅骨和皮质坏死的平均评分相对于第4周终止时间点严重降低。皮质炎症评分为轻度至中度。在所有其他组中,炎症和坏死评分为零至极小。
[0214]
在第16周终止时间点,所有制剂ii治疗组中的坏死和炎症的平均评分为极小,除了25mg治疗组,其颅骨坏死的评分为极小-轻度。在假手术组和制剂ii媒介物治疗组中,坏死评分为零,并且炎症评分为极小。
[0215]
结论
[0216]
制剂ii的施用未引起任何可见的全身副作用。制剂ii中施用的多西他赛的总剂量(即高达50mg制剂ii,相当于1-2mg/kg多西他赛)低于报告的最大耐受剂量(mtd)和非致死剂量(nld)(泰索帝(10mg/kg iv);nda 020449)以及多西他赛(nda 205924)。
[0217]
细胞毒性药物的局部释放引起局部副作用;然而,这些作用随着时间的推移而消失。本研究支持在大鼠中施用高达50mg/19.6mm2总剂量的制剂ii的安全性。
[0218]
实施例13-根据本发明示例性实施方案的持续释放制剂对小鼠同基因肿瘤模型体内llc1细胞系的抗肿瘤和抗转移作用的评价
[0219]
本研究的目的是评估不同量的制剂ii对c57bl小鼠中小鼠同基因路易肺癌(llc1)细胞系肿瘤的抗肿瘤和抗转移作用的效力。已知所选择的细胞系(llc1)在肺中自发形成来源于原发性肿瘤的转移。
[0220]
为此,在雌性balb/c小鼠(7-8周龄,研究起始时体重
±
16-20克)中建立皮下结肠癌肿瘤,并在达到期望的体积(400-600mm3)后,将其切除,并去除其体积的~90%,随后施用测试项目。追踪肿瘤的复发率,并与未治疗的对照组进行比较。
[0221]
本研究指定雄性c57bl小鼠,7-8周龄,重18-21克。将llc1肿瘤细胞sc注射到小鼠背部。当肿瘤达到约400mm3的体积时,将它们切除(至少90%的肿瘤体积被切除;平均面积为0.7cm2)。将动物分为6组(n=10)。研究设计细节在表9中列出。第1-4组直接向肿瘤床施用不同量的制剂ii。未治疗组(第5组)用作阴性对照,并且全身治疗组(第6组)用作阳性对照。五(5)只动物用作假处理组(sham group),它们没有注射肿瘤细胞,而是经历手术程序(第7组)。治疗后,缝合手术部位,并将动物放回笼子进行恢复。具有大于1500mm3的肿瘤的动物被人道地终止。在终止时,计数每只动物中肺中转移的数量。
[0222][0223]
表9-研究设计
[0224]
研究结果
[0225]
在第1组中,只有一只动物在第21天被提前终止。尽管肿瘤没有达到提前终止所定义的最大体积,但动物被处死以验证该组中荷瘤动物中是否发展转移。在第2组中,发现一只动物在第14天死亡。三只动物被提前终止,一只在第18天并且两只在第21天。其中一只动物在第21天终止,以验证该组中荷瘤动物中是否发展转移,尽管肿瘤没有达到提前终止所定义的最大体积。第二个由于其肿瘤尺寸而终止。在第3组中,发现四只动物死亡(第11天、第18天,并且第23天两只)。四只动物由于其肿瘤尺寸而在第21天提前终止。在第4组中,发现6只动物死亡(第14天、第16天、第21天3只和第23天)。两只动物在第23天由于肿瘤超过为提前终止确定的最大体积值而被提前终止。在第5组(未治疗)中,发现一只动物在第16天死亡。六只动物由于肿瘤尺寸而被提前终止,第14天3只,第16天2只,和第23天1只。在第6组中,发现一只动物在第25天死亡。一只动物在第23天由于肿瘤超过为提前终止确定的最大体积值而被提前终止。
[0226]
在所有组中,记录了平均体重(%)的轻微变化。这些变化通常极小(~3%),并在第5组(未治疗)和第6组(紫杉醇)中最明显,其中终止时的平均体重分别比它们在t=0时的体重低6.5%和4%。
[0227]
在第1组中,6/10的动物具有平均肿瘤体积为150mm3的肿瘤。在第2组中,8/10的动物具有平均肿瘤体积为1363mm3的肿瘤。在第3组中,9/10具有平均肿瘤体积为2097mm3的肿
瘤。在第4组中,6/10具有平均肿瘤体积为1559mm3的肿瘤。在第5组(未治疗)中,7/10具有平均肿瘤体积为2463mm3的肿瘤。在第6组中,4/10具有平均肿瘤体积为490mm3的肿瘤。
[0228]
终止/死亡后计数转移的数量。在一些情况下,肺部状况不允许评价转移。这些肺被过度分解,并且因此没有评价这些肺中转移的数量。计数区分小转移(0.1-0.5mm)和大转移(》0.5mm)。在大量的转移(》100)的情况下,定义为太多而无法计数(tntc)。
[0229]
在第1组中,5/10的动物无转移。三只动物具有小(0.1-0.5mm)转移(2个、6个和7个转移),并且在另外两只动物中肺被过度分解,并且无法计数。平均肺重量198
±
55mg。在第2组中,4/10的动物无转移。五只动物具有转移。两只动物具有小转移(3个和5个转移),一只动物具有小(0.1-0.5mm)和大(》0.5mm)转移(分别为11个和6个)两者,并且两只动物具有太多而无法计数(tntc)的转移(》100个)。在一只动物中,肺被过度分解无法计数。平均肺重量252
±
87mg。在第3组中,3/10的动物无转移。三只动物具有小转移(5个、5个和4个转移),三只动物具有小转移和大转移(分别为6个、10个和22个小转移;1个、4个和4个大转移)两者并且一只动物具有tntc转移。平均肺重量323
±
115mg。在第4组中,2/10的动物无转移。五只动物具有转移。3只动物具有小转移(4个、7个和9个转移),并且2只动物具有tntc转移。三(3)只动物中,肺被过度分解,无法计数。平均肺重量为587
±
481mg。在第5组(未治疗)中,所有动物都具有转移。八(8)只动物具有小转移(在2个到20个之间变化),一只动物具有小转移和大转移(分别为5个和3个)两者,并且一只动物具有tntc转移。平均肺重量330
±
64mg。在第6组中,5/10的动物无转移。四只动物具有转移。2只动物具有小转移(3个和4个转移),1只动物具有小转移和大转移(分别为7个和2个)两者,并且1只动物具有tntc转移。在一只动物中,肺被过度分解无法计数。平均肺重量为226
±
114mg。
[0230]
结论:在这项研究中,通过追踪肿瘤体积和原发性肿瘤手术切除后肺中转移的数量来评价治疗效力。研究结果示出,施用100mg剂量的制剂ii在防止肿瘤手术切除后的肿瘤复发,以及防止肿瘤细胞迁移,从而减少携带转移的动物数量和肺中转移的总数量中是有效的。这些结果指出了用根据本发明实施方案的药物组合物在肿瘤床处进行局部治疗以防止肿瘤复发和转移两者的优点。
[0231]
实施例14-从根据本发明一些实施方案的药物组合物释放的紫杉烷穿透进入大鼠脑的评价。
[0232]
将根据本发明某些实施方案的紫杉烷持续释放组合物(例如制剂ii)施用到大鼠脑右半球的5-mm孔中。在不同的时间点,处死用紫杉烷持续释放组合物治疗的一组动物,并取出它们的脑和分析紫杉烷的存在。具体地,收集的脑被水平和垂直切割以形成从制剂ii施用部位开始的2mm2立方体。使用大鼠脑组织中多西他赛的验证生物分析方法来确定每个切片立方体中多西他赛的量。确定脑暴露于多西他赛的百分比、暴露于药物的区域的直径和该区域内药物的平均浓度。
[0233]
方法-[0234]
使用环钻钻头在右半球上方的颅骨中部深钻一个5mm的孔(19.6mm2),并持续用盐水冲洗至硬脑膜水平。极其小心以避免损伤硬脑膜物质。将升降器刀片放入缺损边缘并绕缺损周向移动,直到钻出的颅骨片被抬起并去除。然后切开硬脑膜,暴露脑。然后将配制成糊剂的制剂ii施加到脑表面上。
[0235]
本文公开的和要求保护的所有方法鉴于本公开内容均可被制备和执行而无需过
度实验。虽然本发明的组合物和方法已依据优选的实施方案进行描述,变化可应用至在本文描述的方法以及步骤中或在方法的步骤的顺序中,而不偏离本发明的概念、精神和范围,这将对本领域技术人员是明显的。更特别地,化学上和生理上均相关的某些剂可替代本文描述的剂而会达到相同或相似的结果,这将是明显的。对于本领域技术人员明显的所有这样类似的替代和修改被认为是在本发明的精神、范围和概念之内,本发明的精神、范围和概念如由所附权利要求所限定的。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。