1.本发明属于医药技术领域,涉及一种基于疏水标签的酰基硫脲类化合物及其制备方法与抗甲型流感病毒的应用。
背景技术:
2.流行性感冒(简称流感)是由流感病毒引起的严重上呼吸道感染疾病。流感病毒是负链rna病毒,属于正黏病毒科家族。截至目前,流感病毒已经鉴定出甲、乙、丙、丁四型,导致季节性人类流感的主要亚型是甲型流感病毒(influenza a virus,iav)和乙型流感病毒(influenza b virus,ibv)。其中甲型流感病毒(influenza a virus,iav)具有更强的抗原变异性,因此对人类健康具有更严重的威胁。基于跨膜糖蛋白血细胞凝集素(ha)和神经氨酸苷酶(na)的抗原特异性,迄今已鉴定出18种ha亚型(h1-h18)和11种na亚型(n1-n18),可将流感病毒再分为多种亚型,如h1n1、h2n2和h3n2等。
3.当下,美国fda批准的抗流感病毒药物阵容依然为6个药物:2个m2质子通道抑制剂(金刚烷胺和金刚烷乙胺)、3个神经氨酸苷酶抑制剂(扎那米韦、奥司他韦和帕拉米韦)和1个rna依赖rna聚合酶抑制剂(索夫鲁扎)。由于近年来m2质子通道抑制剂以及神经氨酸苷酶抑制剂造成的严重副作用,以及耐药株、变异株的产生,使得研发新颖骨架、新型机制与低毒高效的抗流感病毒小分子抑制剂显得尤为迫切。rna依赖rna聚合酶(rdrp)是由聚合酶酸性蛋白(pa)、聚合酶碱性蛋白1(pb1)、聚合酶碱性蛋白2(pb2)构成的异源三聚体,三者之间联系紧密,共同维持病毒rna聚合酶的重要功能,在病毒基因组转录及复制过程中至关重要。rdrp在所有流感病毒中均高度保守,是一个值得探索开发的靶点。当下,靶向蛋白降解技术有潜力应对耐药与变异这两大挑战,随着蛋白水解靶向嵌合体(proteolysis targeting chimeras,protac)技术的研究在抗病毒领域扩土开疆,不断深耕,同为靶向蛋白降解技术之一的疏水标签(hydrophobic tagging,hyt)策略也极具开发空间。
4.本发明利用前期研究基础所得到的适合改造的酰基硫脲小分子,基于前景广阔的疏水标签技术,开发了一类具有酰基硫脲基本骨架的甲型流感病毒h1n1抑制剂和pa降解剂。
技术实现要素:
5.本发明的首要目的在于克服现有技术存在的不足,提供一种下述通式(i)所示的基于疏水标签的酰基硫脲类化合物,所述的酰基硫脲类化合物具有抗甲型流感病毒的活性。其中,绝大多数化合物对甲型流感病毒均有较好的抑制活性,部分化合物对甲型流感病毒蛋白有良好的降解活性,可以作为新的抗流感病毒药物进行开发,具有广泛的应用前景。
6.本发明的另一目的是提供下述通式(i)所示的酰基硫脲类化合物的制备方法。
7.本发明的再一目的在于提供下述通式(i)所示的酰基硫脲类化合物在制备抗甲型流感病毒药物中的应用。
8.为了实现上述目的,本发明所采取的技术方案如下:
9.第一方面,本发明提供一种通式(i)所示的基于疏水标签的酰基硫脲类化合物或其药理或生理上可接受的盐,
[0010][0011]
根据linker和hyt的选择,将酰基硫脲类化合物分为系列i疏水标签酰基硫脲类化合物和系列ii疏水标签酰基硫脲类化合物。
[0012]
对于系列i,hyt1的linker为的linker为
[0013]
hyt1为
[0014]
对于系列ii,hyt2的linker为的linker为
[0015]
hyt2为
[0016]
优选地,本发明提供了如下表1所示的化合物:
[0017]
表1
[0018]
[0019]
[0020]
[0021]
[0022][0023]
[0024]
第二方面,本发明提供上述任意一种基于疏水标签的酰基硫脲类化合物或其药理或生理上可接受的盐在制备抗甲型流感病毒的药物中的应用。
[0025]
第三方面,本发明提供一种抗甲型流感病毒的药用组合物,包含上述基于疏水标签的酰基硫脲类化合物中的至少一种或其药理或生理上可接受的盐,以及药学上可接受的载体或赋形剂。
[0026]
第四方面,本发明提供通式(i)所示基于疏水标签的酰基硫脲类化合物的制备方法,将上述通式(i)所示的基于疏水标签的酰基硫脲类化合物分为系列i疏水标签酰基硫脲类化合物和系列ii疏水标签酰基硫脲类化合物。
[0027]
系列i、系列ii疏水标签酰基硫脲类化合物的小分子配体的制备,包括如下步骤:以取代的对叔丁基苯甲酰氯与硫氰酸铵在乙腈溶剂中于冰浴下反应1小时,过滤,加入取代的n-boc-对苯二胺,于20-35℃下反应4-5小时得到酰基硫脲小分子配体:n-((4-氨基苯基)氨基甲酰基)-4-(叔丁基)苯甲酰胺(该化合物是基于申请人前期研究基础所得,经构效关系研究后选定其作为疏水标签化合物的小分子配体)。
[0028][0029]
特别地,根据氨基的反应特性,制备了n-((金刚烷-1-基)氨基甲酰基)-4-(叔丁基)苯甲酰胺(v-1)(合成步骤类似于硫脲小分子配体)。
[0030][0031]
系列i疏水标签酰基硫脲类化合物的制备,包括如下步骤:取代的疏水标签化合物(hyt1)与单甲酯或单乙酯取代的二酸类化合物溶解于n,n-二甲基甲酰胺(dmf)或二氯甲烷(dcm)溶剂中,加入一定量的n,n,n
′
,n
′‑
四甲基-o-(7-氮杂苯并三唑-1-基)六氟磷酸脲(hatu)和n,n-二异丙基乙胺(dipea)于20-35℃下反应1-5小时。处理后,将化合物溶解于thf:h2o(3:1或2:1)的混合溶剂中,在冰浴条件下,加入2mol/l的naoh水溶液后,于20-35℃下反应1-2小时。反萃取处理后,与酰基硫脲小分子配体5溶解在dmf或dcm中,加入一定量的
hatu和dipea于20-35℃下反应1-5小时,得到系列i疏水标签酰基硫脲类化合物;
[0032][0033]
系列ii疏水标签酰基硫脲类化合物的制备,包括如下步骤:以酰基硫脲小分子配体5为原料,与叔丁氧羰基取代的氨基酸类化合物(链为烷基链或醚链)、hatu、dipea在dmf或dcm溶剂中于20-35℃下反应2-4小时。经处理后溶解于乙酸乙酯(ea)溶剂,在冰浴条件下,加入一定体积的盐酸-乙酸乙酯溶液,后于20-35℃下反应1-2小时。处理后的化合物与取代的疏水标签化合物(hyt2)、hatu、dipea在dmf或dcm溶剂中于20-35℃下反应1-5小时,得到系列ii疏水标签酰基硫脲类化合物。
[0034][0035]
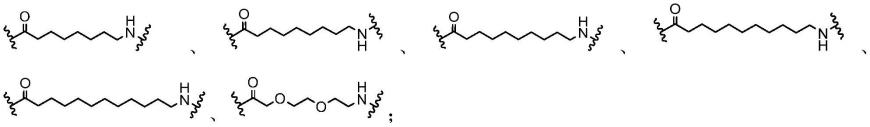
hyt1为取代的金刚烷胺(amantadine)、二苯甲胺(diphenylmethylamine)、9-氨基芴(9-aminofluorene);hyt2为(叔丁氧羰基)-l-色氨酸(以下简写为boc
1-trp)、n2,n6二(叔丁氧羰基)-l-赖氨酸(以下简写为boc
2-lys)、(e)-n2,nw,nw'-三(叔丁氧羰基)-l-精氨酸(以下简写为boc
3-arg);在系列i疏水标签酰基硫脲类化合物的合成路线中,单甲酯或单乙酯取代的二酸类化合物的r1为氢原子或甲基取代基。
[0036]
优选的,上述疏水标签酰基硫脲小分子的制备方法中,取代的对叔丁基苯甲酰氯化合物、硫氰酸铵和取代的n-boc-对苯二胺或金刚烷胺的物质的量之比为1:1:1;酸、胺和hatu、dipea的物质的量之比为1.2:1:1.1:4。
[0037]
本发明涉及的通式(i)所示疏水标签酰基硫脲类化合物,可以有效抑制甲型流感病毒的活性,其对细胞的毒性小,可用于制备抗甲型流感病毒的药物。
附图说明
[0038]
图1是化合物v-21和v-22在不同给药浓度下对pa的降解效果。
具体实施方式
[0039]
通过以下详细说明可以进一步理解本发明的特点和优点。所提供的实施例仅是对本发明方法的说明,而不以任何方式限制本发明揭示的其余内容。
[0040]
【实施例1】n-((4-氨基苯基)氨基甲酰基)-4-(叔丁基)苯甲酰胺的制备
[0041]
通过下式i、ii、iii所示反应合成得到n-((4-氨基苯基)氨基甲酰基)-4-(叔丁基)苯甲酰胺。
[0042][0043]
步骤如下:称取硫氰酸铵(1248.0mg,16.4mmol),置于100ml单口瓶中,加入乙腈溶剂溶解,用注射器吸取对叔丁基苯甲酰氯1(3.2ml,16.4mmol),于冰浴条件下加入体系,后于20-35℃下反应1小时。过滤,取液体。加入n-boc-对苯二胺3(2844.0mg,13.7mmol),于20-35℃下反应4-5h。tlc确认反应完全后,过滤,取固体,干燥。用流动相比例为石油醚和乙酸乙酯(v/v=10/1)过硅胶柱纯化,然后,用二氯甲烷溶解纯化的化合物4,并在0℃下加入一定比例的三氟乙酸。反应进行1小时,后处理后得到n-((4-氨基苯基)氨基甲酰基)-4-(叔丁基)苯甲酰胺5。
[0044]
4-(3-甲基-1h-1,2,4-三唑-1-基)苯胺v-1的制备方法类似。
[0045]
【实施例2】系列i疏水标签酰基硫脲类化合物的制备
[0046]
通过下式iv、v、vi所示反应合成得到系列i疏水标签酰基硫脲类化合物。
[0047][0048]
7amonoethylmalonate,n=1,r1=ch38a-8fn=1,2,4,6,7,8
[0049]
内二酸单乙酯,n=1,r1=ch3hyt1=amantadine
[0050]
7bmono-methylhydrogensuccinate,n=2,r1=h9a,9b,9en=1,2,7
[0051]
琥珀酸单甲酯(丁二酸单甲酯),n=2,r1=hhyt1=diphenylmethylamine
[0052]
7cmonoethyladipate,n=4,r1=ch310an=1
[0053]
己二酸单乙酯,n=4,r1=ch3hyt1=9-aminofluorene
[0054]
7dmonomethylsuberate,n=6,r1=h
[0055]
辛二酸单甲酯,n=6,r1=h
[0056]
7e methyl hydrogen azelate,n=7,r1=h
[0057]
壬二酸氢甲酯,n=7,r1=h
[0058]
7f monomethyl sebacate,n=8,r1=h
[0059]
癸二酸单甲酯,n=8,r1=h
[0060][0061]
v2
ꢀꢀ
n=1,hyt1=amantadine
[0062]
v3
ꢀꢀ
n=2,hyt1=amantadine
[0063]
v4
ꢀꢀ
n=4,hyt1=amantadine
[0064]
v5
ꢀꢀ
n=6,hyt1=amantadine
[0065]
v6
ꢀꢀ
n=7,hyt1=amantadine
[0066]
v7
ꢀꢀ
n=8,hyt1=amantadine
[0067]
v8
ꢀꢀ
n=1,hyt1=diphenylmethylamine
[0068]
v9
ꢀꢀ
n=2,hyt1=diphenylmethylamine
[0069]
v10 n=7,hyt1=diphenylmethylamine
[0070]
v11 n=1,hyt1=9-aminofluorene
[0071]
以n
1-(金刚烷-1-基)-n
6-(4-(3-(4-(叔丁基)苯甲酰基)硫脲基)苯基)己二酰胺v-4的合成为例,步骤如下:取一50ml的单口瓶,加入己二酸单乙酯7c(414.6mg,2.4mmol),用5ml的dmf溶解后,加入hatu(827.6mg,2.2mmol)和dipea(1.5ml,8mmol),再加入金刚烷胺5(300.0mg,2.0mmol),20-35℃下反应1-5h。tlc确认反应完全后,浓缩后用流动相比例为石油醚和乙酸乙酯(v/v=6/1)过硅胶柱纯化,将中间体溶解于thf:h2o(3∶1)的混合溶剂中,在冰浴条件下,加入2mol/l的naoh水溶液(naoh固体与中间体的物质的量之比为6∶1),于20-35℃下反应1-2小时。tlc确认反应完全后,ea萃取一次,取水相,1mol/l hcl溶液调ph=7,有白色固体8c析出,再用ea萃取三次,饱和氯化钠溶液洗涤,无水硫酸钠干燥,随后与酰基硫脲小分子配体5溶解在dmf中,加入一定量的hatu和dipea于20-35℃下反应1-5小时,后处理纯化得到n
1-(金刚烷-1-基)-n
6-(4-(3-(4-(叔丁基)苯甲酰基)硫脲基)苯基)己二酰胺v-4。
[0072]
其他系列i疏水标签酰基硫脲类化合物的制备方法同上。
[0073]
【实施例3】系列ii酰基硫脲类化合物的制备
[0074]
通过下式vii、viii、ix和x、xi、xii所示反应合成得到系列ii酰基硫脲类化合物。
[0075][0076]
以叔丁基(s)-(1-((7-((4-(3-(4-(叔丁基)苯甲酰基)硫脲基)苯基)氨基)-7-氧代庚基)氨基)-3-(1h-吲哚-3-基)-1-氧代丙烷-2-基)氨基甲酸叔丁酯v-15的制备为例,步骤如下:称取7-((叔丁氧羰基)氨基)庚酸11d(269.7mg,1.1mmol)置于25ml单口瓶中,加入dmf使其溶解。随后加入hatu(383.2mg,1.0mmol)和dipea(0.7ml,3.7mmol),酰基硫脲小分子配体5(300mg,0.9mmol),20-35℃反应1-5h。tlc确认反应完全后,浓缩经流动相比例为石油醚和乙酸乙酯(v/v=3/1)过硅胶柱纯化,随后将中间体12d溶解于ea中,冰浴条件下加入盐酸-乙酸乙酯溶液4ml(盐酸-乙酸乙酯与乙酸乙酯的体积比为v/v=2/1),于20-35℃下反应1-2小时。tlc确认反应完全后,旋干,与boc
1-trp溶解在dmf中,加入一定量的hatu和dipea(13d、boc
1-trp、hatu、dipea的物质的量之比为1:1.2:1.1:4)于20-35℃下反应1-5小时。tlc确认反应完全,浓缩后用流动相比例为石油醚和乙酸乙酯(v/v=1/1)过硅胶柱纯化,得到叔丁基(s)-(1-((7-((4-(3-(4-(叔丁基)苯甲酰基)硫脲基)苯基)氨基)-7-氧代庚基)氨基)-3-(1h-吲哚-3-基)-1-氧代丙烷-2-基)氨基甲酸叔丁酯v-15。
[0077]
其他系列ii酰基硫脲类化合物的制备方法同上。
[0078]
(1)n-((金刚烷-1-基)氨基甲酰基)-4-(叔丁基)苯甲酰胺(v-1)的制备
[0079]
称取硫氰酸铵(151.0mg,1.98mmol),置于50ml单口瓶中,加入乙腈溶剂溶解,于冰浴条件下加入对叔丁基苯甲酰氯1(0.39ml,1.98mmol),后于20-35℃下反应1小时。过滤,取液体。加入金刚烷胺6(250mg,1.65mmol),于20-35℃下反应4-5小时。tlc确认反应完全后,过滤,取固体,干燥白色固体v-1,产率为50%。
[0080]1h nmr(400mhz,dmso-d6)δ11.13(s,1h),10.56(s,1h),7.86(d,j=8.5hz,2h),7.53(d,j=8.5hz,2h),2.29(d,j=2.9hz,6h),2.10(s,3h),1.67(s,6h),1.31(s,9h).
13
c nmr(101mhz,dmso-d6)δ178.07,168.71,156.51,129.85,128.86,125.75,54.73,36.25,35.30,31.28,29.30.
[0081]
(2)n
1-(金刚烷-1-基)-n
3-(4-(3-(4-(叔丁基)苯甲酰基)硫脲基)苯基)丙二酰胺(v-2)
[0082]
取一50ml的单口瓶,加入丙二酸单乙酯7a(414.6mg,2.38mmol),用5ml的dmf溶解后,加入hatu(829.6mg,2.18mmol)和dipea(1.5ml,8.92mmol),再加入金刚烷胺5(300.0mg,1.98mmol),20-35℃下反应1-5h。tlc确认反应完全后,浓缩后用流动相比例为石油醚和乙酸乙酯(v/v=6/1)过硅胶柱纯化,将纯化的中间体溶解于thf:h2o(3:1)的混合溶剂中,在冰浴条件下,加入2mol/l的naoh水溶液(naoh固体与中间体的物质的量之比为6:1),于20-35℃下反应1-2小时。tlc确认反应完全后,ea萃取一次,取水相,1mol/l hcl溶液调ph=7,有白色固体8a析出,再用ea萃取三次,饱和氯化钠溶液洗涤,无水硫酸钠干燥,随后与酰基硫脲小分子配体5溶解在dmf中,加入一定量的hatu和dipea(5、8a、hatu、dipea的物质的量之比为1:1.2:1.1:4)于20-35℃下反应1-5小时。tlc确认反应完全,浓缩后用流动相比例为石油醚和乙酸乙酯(v/v=3/1)过硅胶柱纯化,得到白色固体v-2,产率为40%。
[0083]1h nmr(400mhz,cdcl3)δ12.63(s,1h),9.95(s,1h),9.24(s,1h),7.85(d,j=8.5hz,2h),7.67(s,4h),7.56(d,j=8.6hz,2h),6.62(s,1h),3.34(s,2h),2.11(s,3h),2.05(d,j=2.9hz,6h),1.70(s,6h),1.37(s,9h).
13
c nmr(101mhz,cdcl3)δ178.49,167.05,166.70,165.96,157.76,136.50,133.68,128.65,127.57,126.20,124.85,124.81,120.29,120.07,52.62,44.76,41.34,36.61,36.27,35.26,31.94,31.06,29.72,29.36.
[0084]
(3)(n
1-(金刚烷-1-基)-n
4-(4-(3-(4-叔丁基)苯甲酰基)硫脲基)苯基)丁二酰胺(v-3)的制备
[0085]
r1取代的酸类化合物为丁二酸单甲酯7b,hyt1为金刚烷胺,参照(2)中的方法制备目标化合物,产物为白色固体,产率为20%。
[0086]1h nmr(400mhz,dmso-d6)δ12.62(s,1h),11.45(s,1h),10.08(s,1h),7.95(d,j=8.6hz,2h),7.63
–
7.55(m,6h),7.39(s,1h),2.38(t,j=7.0hz,2h),2.00(s,5h),1.91(d,j=2.9hz,6h),1.61(s,6h),1.32(s,9h).
13
c nmr(101mhz,dmso-d6)δ179.41,171.19,170.97,168.56,156.77,137.97,133.18,129.71,129.09,125.83,125.29,119.36,60.27,51.02,41.47,36.50,35.34,32.40,31.55,31.28,29.25,21.31,14.55.
[0087]
(4)n
1-(金刚烷-1-基)-n
6-(4-(3-(4-(叔丁基)苯甲酰基)硫脲基)苯基)己二酰胺(v-4)
[0088]
r1取代的酸类化合物为己二酸单乙酯7c,hyt1为金刚烷胺,参照(2)中的方法制备目标化合物,产物为白色固体,产率为16%。
[0089]1h nmr(400mhz,dmso-d6)δ12.63(s,1h),11.47(s,1h),10.02(s,1h),7.96(d,j=
8.5hz,2h),7.66
–
7.59(m,4h),7.57(d,j=8.6hz,2h),7.29(s,1h),2.32(t,j=7.1hz,2h),2.05(t,j=6.9hz,2h),2.00(s,3h),1.92(d,j=3.1hz,6h),1.63
–
1.53(m,10h),1.33(s,9h).
13
c nmr(101mhz,dmso-d6)δ179.38,171.86,171.68,168.56,156.74,137.92,133.26,129.74,129.10,125.80,125.25,119.44,50.95,41.49,36.82,36.54,36.48,35.34,31.28,29.27,25.71,25.30,22.58.
[0090]
(5)n
1-(金刚烷-1-基)-n
8-(4-(3-(4-(叔丁基)苯甲酰基)硫脲基)苯基)辛二酰胺(v-5)
[0091]
r1取代的酸类化合物为辛二酸单甲酯7d,hyt1为金刚烷胺,参照(2)中的方法制备目标化合物,产物为白色固体,产率为42%。
[0092]1h nmr(400mhz,dmso-d6)δ12.62(s,1h),11.45(s,1h),10.03(s,1h),7.95(d,j=8.4hz,2h),7.67
–
7.53(m,6h),7.26(s,1h),2.31(t,j=7.5hz,2h),2.00
–
1.97(m,5h),1.90(d,j=3.0hz,6h),1.60(s,6h),1.49
–
1.43(m,2h),1.32(s,9h),1.31
–
1.23(m,6h).
13
c nmr(101mhz,dmso-d6)δ179.44,172.19,171.87,168.57,162.89,156.80,137.43,132.93,129.70,129.07,125.84,125.29,119.51,50.94,41.45,36.82,36.57,36.50,36.29,35.33,31.27,29.25,28.94,28.85,25.84,25.54.
[0093]
(6)n
1-(金刚烷-1-基)-n
9-(4-(3-(4-(叔丁基)苯甲酰基)硫脲基)苯基)壬胺(v-6)
[0094]
r1取代的酸类化合物为壬二酸氢甲酯7e,hyt1为金刚烷胺,参照(2)中的方法制备目标化合物,产物为白色固体,产率为35%。
[0095]1h nmr(400mhz,dmso-d6)δ12.63(s,1h),11.47(s,1h),10.01(s,1h),7.96(d,j=8.6hz,2h),7.66
–
7.53(m,6h),7.24(s,1h),2.31(t,j=7.5hz,2h),2.03
–
1.96(m,5h),1.92
–
1.89(m,6h),1.61
–
1.59(m,6h),1.48
–
1.41(m,2h),1.33(s,9h),1.31
–
1.21(m,8h).
13
c nmr(101mhz,dmso-d6)δ179.39,172.05,171.79,168.56,156.75,137.94,133.24,129.73,129.11,127.01,125.81,125.26,119.45,50.90,41.49,36.53,35.35,31.29,29.26,29.07,28.92,25.91,25.59.
[0096]
(7)n
1-(金刚烷-1-基)-n
10-(4-(3-(4-(叔丁基)苯甲酰基)硫脲基)苯基)癸酰胺(v-7)
[0097]
r1取代的酸类化合物为癸二酸单甲酯7f,hyt1为金刚烷胺,参照(2)中的方法制备目标化合物,产物为白色固体,产率为31%。
[0098]1h nmr(400mhz,dmso-d6)δ12.63(s,1h),11.45(s,1h),10.03(s,1h),7.95(d,j=8.6hz,2h),7.64
–
7.55(m,6h),7.25(s,1h),2.31(t,j=7.4hz,2h),2.02
–
1.96(m,5h),1.90(d,j=2.9hz,6h),1.60(s,6h),1.48
–
1.40(m,2h),1.32(s,9h),1.31
–
1.21(m,10h).
13
c nmr(101mhz,dmso-d6)δ179.41,172.19,171.86,168.57,156.78,137.91,133.24,129.70,129.08,125.83,125.27,119.48,50.93,41.46,38.70,36.86,36.52,35.33,31.27,29.25,29.18,29.11,28.99,25.91,25.60.
[0099]
(8)n
1-苄基-n
3-(4-(3-(4-(叔丁基)苯甲酰基)硫脲基)苯基)丙二酰胺(v-8)
[0100]
r1取代的酸类化合物为丙二酸单乙酯7a,hyt1为二苯甲胺,参照(2)中的方法制备目标化合物,产物为白色固体,产率为31%。
[0101]1h nmr(400mhz,dmso-d6)δ12.66(s,1h),11.48(s,1h),10.27(s,1h),9.07(d,j=8.5hz,1h),7.97(d,j=8.4hz,2h),7.65(s,4h),7.58(d,j=8.5hz,2h),7.32
–
7.39(m,8h),
7.25
–
7.29(m,2h),6.16(d,j=8.4hz,1h),3.44(s,2h),1.33(s,9h).
13
c nmr(101mhz,dmso-d6)δ179.42,168.55,166.28,166.21,156.75,142.78,137.53,133.64,129.75,129.13,128.88,127.79,127.49,125.81,125.35,119.54,56.66,45.11,35.35,31.30.
[0102]
(9)n
1-苄基-n
4-(4-(3-(4-(叔丁基)苯甲酰基)硫脲基)苯基)丁二酰胺(v-9)
[0103]
r1取代的酸类化合物为丁二酸单甲酯7b,hyt1为二苯甲胺,参照(2)中的方法制备目标化合物,产物为白色固体,产率为15%。
[0104]1h nmr(400mhz,dmso-d6)δ12.62(s,1h),11.44(s,1h),10.11(s,1h),8.89(d,j=8.6hz,1h),7.95(d,j=7.9hz,2h),7.64
–
7.55(m,6h),7.35
–
7.27(m,8h),7.27
–
7.21(m,2h),6.13(d,j=8.6hz,1h),2.60(s,2h),2.52(s,2h),1.32(s,9h).
13
c nmr(101mhz,dmso-d6)δ179.42,171.19,171.04,168.57,156.82,143.02,137.91,129.70,129.07,128.84,127.73,127.40,125.86,125.33,119.42,56.41,35.33,32.18,31.27,30.80.
[0105]
(10)n
1-苄基-n
9-(4-(3-(4-(叔丁基)苯甲酰基)硫脲基)苯基)壬酰胺(v-10)
[0106]
r1取代的酸类化合物为壬二酸氢甲酯7e,hyt1为二苯甲胺,参照(2)中的方法制备目标化合物,产物为白色固体,产率为28%。
[0107]1h nmr(400mhz,dmso-d6)δ12.62(s,1h),11.46(s,1h),10.02(s,1h),8.77(d,j=8.7hz,1h),7.97
–
7.94(m,2h),7.66
–
7.55(m,6h),7.35
–
7.31(m,4h),7.29
–
7.23(m,6h),6.13(d,j=8.7hz,1h),2.31(t,j=7.4hz,2h),2.22(t,j=7.3hz,2h),1.61
–
1.50(m,4h),1.33(s,9h),1.30
–
1.27(m,4h),1.25
–
1.23(m,2h).
13
c nmr(101mhz,dmso-d6)δ172.06,171.84,168.47,162.84,156.84,143.11,129.10,128.80,127.72,127.36,125.83,125.31,119.48,56.18,37.05,36.35,35.67,35.35,31.28,29.10,29.00,25.84,25.58.
[0108]
(11)n
1-(4-(3-(4-(叔丁基)苯甲酰基)硫脲基)苯基)-n
3-(9h-芴-9-基)丙二酰胺(v-11)
[0109]
r1取代的酸类化合物为丙二酸单乙酯7a,hyt1为9-氨基芴,参照(2)中的方法制备目标化合物,产物为白色固体,产率为20%。
[0110]1h nmr(400mhz,dmso-d6)δ12.65(s,1h),11.47(s,1h),10.31(s,1h),8.74(d,j=8.4hz,1h),7.96(d,j=8.4hz,2h),7.88(d,j=7.5hz,2h),7.78
–
7.61(m,4h),7.57(t,j=8.3hz,4h),7.45(t,j=7.4hz,2h),7.37(t,j=7.5hz,2h),6.07(d,j=8.3hz,1h),3.42(s,2h),1.33(s,9h).
13
c nmr(101mhz,dmso-d6)δ168.88,167.23,165.62,165.31,163.09,148.04,147.60,147.18,146.25,145.63,143.63,138.62,137.19,131.54,130.36,126.95,126.20,126.09,125.97,124.78,124.07,121.72,118.63,113.45,111.07,110.00,107.88,107.54,100.10,72.68,72.36,72.05,65.08,63.42,62.15,53.98,53.17,52.84,52.30,50.94,48.18,45.02,44.11,42.93,33.95,31.29,30.61,30.06,29.47,28.38,27.20,26.93,25.59,24.97,24.64,24.18,21.83,20.40,19.82,18.26,17.97,17.57,11.35,9.43,6.24,5.76,3.21.
[0111]
(12)叔丁基(r)-(1-(4-(3-(4-(叔丁基)苯甲酰基)硫脲基)苯基)氨基)-3-(1h-吲哚-3-基)-1-氧代丙烷-2-基)氨基甲酸酯(v-12)
[0112]
与酰基硫脲小分子配体5缩合的是hyt2,为boc
1-trp。参照(15)中的方法制备目标化合物,产物为白色固体,产率为48%。
[0113]1h nmr(400mhz,dmso-d6)δ12.66(s,1h),11.48(s,1h),10.86(s,1h),10.22(s,
1h),7.97(d,j=6.4hz,2h),7.72
–
7.62(m,5h),7.58(d,j=8.6hz,2h),7.35(d,j=8.0hz,1h),7.21(s,1h),7.10
–
7.00(m,3h),4.46
–
4.35(m,1h),3.16(dd,j=14.5,5.2hz,1h),3.03(dd,j=14.5,9.0hz,1h),1.36(s,9h),1.33(s,9h).
13
c nmr(101mhz,dmso-d6)δ179.44,171.74,168.57,156.76,155.40,137.59,136.49,133.57,129.75,129.13,125.82,125.29,124.32,121.37,119.85,119.11,118.68,112.19,110.39,78.57,60.25,56.28,35.36,31.30,28.65,27.97,21.25,14.56.
[0114]
(13)叔丁基(s)-(1-((4-((4-(3-(4-(叔丁基)苯甲酰基)硫脲基)苯基)氨基)-4-氧代丁基)氨基)-3-(1h-吲哚-3-基)-1-氧代丙烷-2-基)氨基甲酸酯(v-13)
[0115]
与酰基硫脲小分子配体5缩合的酸是4-((叔丁氧羰基)氨基)丁酸11b,hyt2为boc
1-trp。参照(15)中的方法制备目标化合物,产物为白色固体,产率为71%。
[0116]1h nmr(400mhz,dmso-d6)δ12.64(s,1h),11.47(s,1h),10.83(s,1h),10.08(s,1h),8.05
–
8.00(m,1h),7.96(d,j=8.2hz,2h),7.65
–
7.56(m,6h),7.39(d,j=8.8hz,1h),7.33(d,j=8.0hz,1h),7.14(s,1h),7.06(d,j=7.7hz,1h),7.00(d,j=7.6hz,1h),6.78(d,j=8.1hz,1h),4.17(s,1h),3.18
–
3.03(m,4h),2.33(t,j=7.7hz,2h),1.72(d,j=7.2hz,2h),1.33(d,j=2.8hz,18h).
13
c nmr(101mhz,dmso-d6)δ204.03,179.40,172.47,168.56,156.75,155.65,137.90,136.50,133.29,129.75,129.11,127.82,127.02,125.81,125.26,124.10,121.28,120.24,119.51,118.99,118.60,111.72,110.74,78.41,55.69,38.66,35.35,34.19,31.45,31.29,28.62,28.40,25.61,22.61.
[0117]
(14)叔丁基(s)-(1-((6-((4-(3-(4-(叔丁基)苯甲酰基)硫脲基)苯基)氨基)-6-氧代己基)氨基)-3-(1h-吲哚-3-基)-1-氧代丙烷-2-基)氨基甲酸酯(v-14)
[0118]
与酰基硫脲小分子配体5缩合的酸是6-((叔丁氧羰基)氨基)己酸11c,hyt2为boc
1-trp。参照(15)中的方法制备目标化合物,产物为白色固体,产率为71%。
[0119]1h nmr(400mhz,dmso-d6)δ12.64(s,1h),11.47(s,1h),10.83(s,1h),10.01(s,1h),7.96(d,j=8.2hz,2h),7.89(d,j=5.0hz,1h),7.65
–
7.55(m,6h),7.35(t,j=8.5hz,2h),7.13(s,1h),7.07(t,j=7.5hz,1h),7.00(d,j=7.8hz,1h),6.75(d,j=8.3hz,1h),4.16(dq,j=8.4,4.7hz,1h),3.05(dd,j=14.2,5.5hz,4h),2.34
–
2.29(m,2h),1.62
–
1.58(m,2h),1.40(d,j=7.9hz,2h),1.33(s,18h),1.17(s,2h).
13
c nmr(101mhz,dmso-d6)δ179.38,172.58,171.66,168.75,156.81,155.60,136.02,129.94,129.11,126.32,125.27,121.27,120.21,119.48,118.99,118.60,111.73,110.74,78.38,56.21,38.91,38.67,36.82,35.35,31.29,29.30,26.47,25.33.
[0120]
(15)叔丁基(s)-(1-((7-((4-(3-(4-(叔丁基)苯甲酰基)硫脲基)苯基)氨基)-7-氧代庚基)氨基)-3-(1h-吲哚-3-基)-1-氧代丙烷-2-基)氨基甲酸叔丁酯(v-15)
[0121]
称取7-((叔丁氧羰基)氨基)庚酸11d(269.7mg,1.1mmol)置于25ml单口瓶中,加入dmf使其溶解。随后加入hatu(383.2mg,1.0mmol)和dipea(0.7ml,3.7mmol),酰基硫脲小分子配体5(300mg,0.9mmol),20-35℃反应1-5h。tlc确认反应完全后,浓缩经流动相比例为石油醚和乙酸乙酯(v/v=3/1)过硅胶柱纯化,随后将中间体12d溶解于ea中,冰浴条件下加入盐酸-乙酸乙酯溶液4ml(盐酸-乙酸乙酯与乙酸乙酯的体积比为v/v=2/1),于20-35℃下反应1-2小时。tlc确认反应完全后,旋干,与boc
1-trp溶解在dmf中,加入一定量的hatu和dipea(13d、boc
1-trp、hatu、dipea的物质的量之比为1:1.2:1.1:4)于20-35℃下反应1-5小
时。tlc确认反应完全,浓缩后用流动相比例为石油醚和乙酸乙酯(v/v=1/1)过硅胶柱纯化,得到白色固体,产率为47%。
[0122]1h nmr(400mhz,dmso-d6)δ12.64(s,1h),11.46(s,1h),10.82(s,1h),10.01(s,1h),7.96(d,j=8.4hz,2h),7.85(d,j=5.7hz,1h),7.67
–
7.56(m,6h),7.38(d,j=8.9hz,1h),7.33(d,j=8.0hz,1h),7.13(s,1h),7.06(t,j=7.6hz,1h),6.98(t,j=7.3hz,1h),6.75(d,j=8.3hz,1h),4.16(q,j=8.3hz,1h),3.13
–
2.93(m,4h),2.32(t,j=7.6hz,2h),1.59(t,j=6.9hz,2h),1.42
–
1.36(m,2h),1.33(s,18h),1.19(t,j=7.1hz,4h).
13
c nmr(101mhz,dmso-d6)δ172.20,171.78,168.36,156.76,155.59,139.42,137.96,136.49,133.27,129.74,129.11,127.83,127.01,125.81,125.28,124.06,121.27,120.22,119.47,118.97,118.59,111.71,110.71,110.00,78.39,55.66,38.95,38.71,36.89,35.35,31.29,29.34,28.90,28.61,26.53,25.59.
[0123]
(16)叔丁基(s)-(1-((8-((4-(3-(4-(叔丁基)苯甲酰基)硫脲基)苯基)氨基)-8-氧辛基)氨基)-3-(1h-吲哚-3-基)-1-氧丙烷-2-基)氨基甲酸酯(v-16)
[0124]
与酰基硫脲小分子配体5缩合的酸是8-((叔丁氧羰基)氨基)辛酸11e,hyt2为boc
1-trp。参照(15)中的方法制备目标化合物,产物为白色固体,产率为52%。
[0125]1h nmr(400mhz,dmso-d6)δ12.63(s,1h),11.46(s,1h),10.82(s,1h),10.00(s,1h),7.96(d,j=8.3hz,2h),7.83(d,j=5.8hz,1h),7.64
–
7.56(m,6h),7.37(d,j=8.9hz,1h),7.33(d,j=8.0hz,1h),7.13(s,1h),7.06(t,j=7.5hz,1h),6.98(t,j=7.5hz,1h),6.75(d,j=8.2hz,1h),4.15(q,j=8.6hz,1h),3.18
–
2.95(m,4h),2.32(t,j=7.6hz,2h),1.60(d,j=7.3hz,2h),1.37(s,2h),1.33(d,j=3.6hz,18h),1.28(s,4h),1.24(s,2h).
13
c nmr(101mhz,dmso-d6)δ179.76,172.20,171.77,168.56,156.71,155.15,138.08,136.47,133.22,129.11,127.81,126.91,125.81,125.28,124.06,121.27,120.09,119.44,118.59,111.70,110.72,78.37,38.71,36.87,35.35,31.29,29.46,29.10,28.61,26.67,25.60.
[0126]
(17)叔丁基(s)-(1-((10-((4-(3-(4-(叔丁基)苯甲酰基)硫脲基)苯基)氨基)-10-氧代十二烷基)氨基)-3-(1h-吲哚-3-基)-1-氧代丙烷-2-基)氨基甲酸酯(v-17)
[0127]
与酰基硫脲小分子配体5缩合的酸是10-((叔丁氧羰基)氨基)癸酸11g,hyt2为boc
1-trp。参照(15)中的方法制备目标化合物,产物为白色固体,产率为55%。
[0128]1h nmr(400mhz,dmso-d6)δ12.65(s,1h),11.47(s,1h),10.83(s,1h),10.01(s,1h),7.97(d,j=8.1hz,2h),7.85(s,1h),7.66
–
7.54(m,7h),7.33(d,j=8.0hz,1h),7.13(s,1h),7.06(d,j=7.7hz,1h),6.98(t,j=7.5hz,1h),6.77(d,j=8.3hz,1h),4.16(q,j=8.7hz,1h),3.18
–
2.95(m,4h),2.32(t,j=7.5hz,2h),1.61(t,j=7.5hz,2h),1.41(s,2h),1.33(s,18h),1.21(d,j=23.0hz,10h).
13
c nmr(101mhz,dmso-d6)δ179.40,172.19,171.77,168.56,156.74,155.59,137.96,136.49,133.24,129.74,129.11,127.82,125.80,125.25,124.05,121.26,119.45,118.97,118.58,111.70,110.72,78.36,55.65,38.96,36.90,35.34,31.29,29.41,29.31,29.26,29.19,28.61,28.37,26.73,25.62.
[0129]
(18)叔丁基(s)-(1-((11-((4-(3-(4-(叔丁基)苯甲酰基)硫脲基)苯基)氨基)-11-氧代十二烷基)氨基)-3-(1h-吲哚-3-基)-1-氧代丙烷-2-基)氨基甲酸酯(v-18)
[0130]
与酰基硫脲小分子配体5缩合的酸是11-((叔丁氧羰基)氨基)十一烷酸11h,hyt2为boc
1-trp。参照(15)中的方法制备目标化合物,产物为白色固体,产率为59%。
[0131]1h nmr(400mhz,dmso-d6)δ12.83(s,1h),11.65(s,1h),11.01(s,1h),10.18(s,1h),8.15(d,j=8.1hz,2h),8.03(s,1h),7.84
–
7.72(m,6h),7.56(d,j=8.7hz,1h),7.51(d,j=8.0hz,1h),7.31(s,1h),7.25(t,j=7.5hz,1h),7.16(t,j=7.4hz,1h),6.94(d,j=8.3hz,1h),4.34(q,j=8.7hz,1h),3.38
–
3.11(m,4h),1.79(t,j=7.7hz,2h),1.51(s,18h),1.39(d,j=20.4hz,16h).
13
c nmr(101mhz,dmso-d6)δ179.39,172.21,171.77,168.56,156.74,155.59,139.45,137.97,136.49,133.24,129.74,129.12,127.82,127.00,125.80,125.25,124.06,121.25,120.18,119.44,118.97,118.58,111.70,110.73,78.35,55.65,38.96,36.89,35.34,31.28,29.51,29.48,29.43,29.36,29.28,29.19,28.61,28.38,26.75,25.63,25.48.
[0132]
(19)叔丁基(s)-(1-((12-((4-(3-(4-(叔丁基)苯甲酰基)硫脲基)苯基)氨基)-12氧代十二烷基)氨基)-3-(1h-吲哚-3-基)-1-氧代丙烷-2-基)氨基甲酸酯(v-19)
[0133]
与酰基硫脲小分子配体5缩合的酸是11-((叔丁氧羰基)氨基)十二烷酸11i,hyt2为boc
1-trp。参照(15)中的方法制备目标化合物,产物为白色固体,产率为53%。
[0134]1h nmr(400mhz,dmso-d6)δ12.64(s,1h),11.48(s,1h),10.83(s,1h),10.01(s,1h),7.96(d,j=8.5hz,2h),7.85(t,j=5.6hz,1h),7.64
–
7.56(m,6h),7.38(d,j=8.9hz,1h),7.33(d,j=8.0hz,1h),7.13(d,j=2.3hz,1h),7.07(d,j=7.3hz,1h),6.97(d,j=7.4hz,1h),6.77(d,j=8.3hz,1h),4.18
–
4.12(m,1h),3.03(dd,j=12.7,6.4hz,4h),1.59(d,j=7.4hz,2h),1.33(s,18h),1.29
–
1.20(m,18h).
13
c nmr(101mhz,dmso-d6)δ172.20,171.78,168.56,156.75,155.58,136.49,129.74,129.11,127.82,125.80,125.24,124.04,121.25,120.20,119.45,118.96,118.57,111.70,110.72,78.36,55.65,38.96,38.71,36.89,35.34,31.29,29.50,29.47,29.28,29.18,28.61,28.39,26.74,25.62.
[0135]
(20)二叔丁基(6-((7-((4-(3-(4-(叔丁基)苯甲酰基)硫脲基)苯基)氨基)-7-氧代庚基)氨基)-6-氧代己烷-1,5-二基)(s)-二氨基甲酸酯(v-20)
[0136]
与酰基硫脲小分子配体5缩合的酸是7-((叔丁氧羰基)氨基)庚酸11d,hyt2为boc
2-lys。参照(15)中的方法制备目标化合物,产物为白色固体,产率为46%。
[0137]1h nmr(400mhz,dmso-d6)δ12.62(s,1h),11.46(s,1h),10.12(s,1h),7.96(d,j=8.4hz,2h),7.80(d,j=5.7hz,1h),7.66(d,j=9.0hz,2h),7.58(t,j=8.6hz,4h),6.81
–
6.76(m,2h),3.85
–
3.80(m,1h),3.08
–
3.02(m,2h),2.88(d,j=6.8hz,2h),2.32(d,j=7.6hz,2h),1.60
–
1.57(m,2h),1.40
–
1.36(m,26h),1.33(s,9h),1.31
–
1.28(m,4h).
13
c nmr(101mhz,dmso-d6)δ156.04,155.73,129.10,126.96,125.81,125.22,119.46,78.36,77.79,38.81,36.83,35.35,32.25,31.29,29.69,29.40,28.74,28.66,25.47,23.30.
[0138]
(21)二叔丁基(6-((8-((4-(3-(4-(叔丁基)苯甲酰基)硫脲基)苯基)氨基)-8-氧辛基)氨基)-6-氧己烷-1,5-二基)(s)-二氨基甲酸酯(v-21)
[0139]
与酰基硫脲小分子配体5缩合的酸是8-((叔丁氧羰基)氨基)辛酸11e,hyt2为boc
2-lys。参照(15)中的方法制备目标化合物,产物为白色固体,产率为52%。
[0140]1h nmr(400mhz,dmso-d6)δ12.63(s,1h),11.45(s,1h),9.99(s,1h),7.96(d,j=8.5hz,2h),7.75(d,j=5.8hz,1h),7.66
–
7.56(m,6h),6.78
–
6.72(m,2h),3.84
–
3.78(m,1h),3.08
–
3.00(m,2h),2.90
–
2.86(m,2h),2.70(s,2h),2.31(t,j=7.6hz,2h),1.61
–
1.57(m,2h),1.53
–
1.45(m,2h),1.37(s,18h),1.33(s,9h),1.31
–
1.25(m,10h).
13
c nmr(101mhz,
dmso-d6)δ180.32,172.46,170.85,168.75,157.07,156.03,155.73,137.81,133.35,129.11,127.14,125.81,125.26,119.43,78.35,77.79,54.78,36.76,35.35,32.20,31.29,29.55,29.14,29.05,28.73,28.64,26.57,25.58,23.31.
[0141]
(22)二叔丁基(6-((9-((4-(3-(4-(叔丁基)苯甲酰基)硫脲基)苯基)氨基)-9-氧代壬基)氨基)-6-氧代己烷-1,5-二基)(s)-二氨基甲酸酯(v-22)
[0142]
与酰基硫脲小分子配体5缩合的酸是9-((叔丁氧羰基)氨基)壬酸11f,hyt2为boc
2-lys。参照(15)中的方法制备目标化合物,产物为白色固体,产率为85%。
[0143]1h nmr(400mhz,dmso-d6)δ12.64(s,1h),11.44(s,1h),10.00(s,1h),7.96(d,j=8.5hz,2h),7.75(t,j=5.4hz,1h),7.69
–
7.52(m,6h),6.88
–
6.59(m,2h),3.89
–
3.75(m,1h),3.10
–
2.98(m,2h),2.90
–
2.83(m,2h),2.72(d,j=17.7hz,2h),2.31(t,j=7.5hz,2h),1.62-1.56(m,2h),1.55
–
1.46(m,2h),1.38(d,j=2.4hz,18h),1.33(s,9h),1.31
–
1.17(m,12h).
13
c nmr(101mhz,dmso-d6)δ204.04,179.39,172.43,171.78,168.56,162.79,156.75,156.04,155.72,137.95,133.24,129.73,129.10,125.80,125.23,119.45,78.37,77.80,54.84,38.82,36.89,36.25,35.33,32.24,31.28,29.67,29.50,29.30,29.14,28.73,28.64,26.73,25.62,23.28.
[0144]
(23)二叔丁基(6-((10-((4-(3-(4-(叔丁基)苯甲酰基)硫脲基)苯基)氨基)-10-氧代十二烷基)氨基)-6-氧代己烷-1,5-二基)(s)-二氨基甲酸酯(v-23)
[0145]
与酰基硫脲小分子配体5缩合的酸是10-((叔丁氧羰基)氨基)癸酸11g,hyt2为boc
2-lys。参照(15)中的方法制备目标化合物,产物为白色固体,产率为55%。
[0146]1h nmr(400mhz,dmso-d6)δ12.64(s,1h),11.47(s,1h),10.01(s,1h),7.96(d,j=8.1hz,2h),7.75(s,1h),7.70
–
7.51m,6h),6.87
–
6.67(m,2h),3.91
–
3.73(m,1h),3.11
–
2.97(m,2h),2.94
–
2.84(m,2h),2.70(s,2h),2.52(s,2h),2.32(s,2h),1.64
–
1.56(m,2h),1.43
–
1.35(m,20h),1.34(s,9h),1.30
–
1.19(m,12h).
13
c nmr(101mhz,dmso-d6)δ179.39,172.40,171.76,168.55,156.47,156.02,155.58,138.01,132.94,129.11,125.80,125.25,119.44,78.34,77.78,38.81,36.83,36.25,35.35,32.22,31.29,29.52,29.41,29.28,29.16,28.74,28.64,26.73,25.60,23.29.
[0147]
(24)二叔丁基(6-((11-((4-(3-(4-(叔丁基)苯甲酰基)硫脲基)苯基)氨基)-11-氧代十二烷基)氨基)-6-氧代己烷-1,5-二基)(s)-二氨基甲酸酯(v-24)
[0148]
与酰基硫脲小分子配体5缩合的酸是11-((叔丁氧羰基)氨基)十一烷酸11h,hyt2为boc
2-lys。参照(15)中的方法制备目标化合物,产物为白色固体,产率为50%。
[0149]1h nmr(400mhz,dmso-d6)δ12.64(s,1h),11.46(s,1h),10.00(s,1h),7.96(d,j=8.1hz,2h),7.74(s,1h),7.68
–
7.56(m,6h),6.79-6.73(m,2h),3.84
–
3.79(m,1h),3.09
–
2.22(m,2h),2.90
–
2.87(m,2h),2.70(s,8h),2.30(d,j=7.6hz,2h),1.61
–
1.57(m,2h),1.38(s,18h),1.33(s,9h),1.27
–
1.23(m,12h).
13
c nmr(101mhz,dmso-d6)δ179.39,172.41,172.02,171.76,168.56,156.74,156.02,155.72,139.45,137.95,129.73,129.11,126.99,125.80,125.23,124.40,120.18,119.43,78.33,77.77,54.83,38.81,38.70,36.88,35.34,32.23,31.28,29.69,29.51,29.41,29.33,29.25,29.17,28.73,28.64,26.74,25.62,25.47,23.30.
[0150]
(25)二叔丁基(6-((12-((4-(3-(4-(叔丁基)苯甲酰基)硫脲基)苯基)氨基)-12氧
代十二烷基)氨基)-6-氧代己烷-1,5-二基)(s)-二氨基甲酸酯(v-25)
[0151]
与酰基硫脲小分子配体5缩合的酸是12-((叔丁氧羰基)氨基)十二烷酸11i,hyt2为boc
2-lys。参照(15)中的方法制备目标化合物,产物为白色固体,产率为49%。
[0152]1h nmr(400mhz,dmso-d6)δ12.63(s,1h),11.47(s,1h),10.00(s,1h),7.96(d,j=8.2hz,2h),7.75(s,1h),7.66
–
7.56(m,6h),6.79
–
6.74(m,2h),3.83
–
3.79(m,1h),3.07
–
3.00(m,2h),2.89
–
2.85(m,2h),2.70(s,2h),2.52(s,2h),2.31(s,2h),1.60
–
1.57(m,2h),1.38
–
1.37(m,18h),1.33(s,9h),1.25(m,18h).
13
c nmr(101mhz,dmso-d6)δ172.48,171.78,156.03,155.72,129.10,125.80,125.24,120.20,119.45,78.35,77.79,54.99,38.56,36.92,35.35,32.35,31.29,29.69,29.48,29.25,28.73,28.64,26.74,25.60,25.48,23.29.
[0153]
(26)n-((4-(7-氨基庚酰胺基)苯基)氨基甲酰基)-4-(叔丁基)苯甲酰胺(v-26)
[0154]
7-((叔丁氧羰基)氨基)庚酸11d与酰基硫脲小分子配体5缩合后得到的中间体13d,用于活性对照,白色固体,产率68%。
[0155]1h nmr(400mhz,dmso-d6)δ12.62(s,1h),11.47(s,1h),10.23(s,1h),8.02(s,2h),7.96(d,j=8.2hz,2h),7.68(d,j=8.6hz,2h),7.58(t,j=8.9hz,4h),2.76(s,2h),2.36(t,j=7.3hz,2h),1.65
–
1.54(m,4h),1.39(s,2h),1.32(s,9h),1.30(s,2h).
[0156]
(27)n-((4-(8-氨基辛酰胺基)苯基)氨基甲酰基)-4-(叔丁基)苯甲酰胺(v-27)
[0157]
8-((叔丁氧羰基)氨基)辛酸11e与酰基硫脲小分子配体5缩合后得到的中间体13e,用于活性对照,白色固体,产率55%。
[0158]1h nmr(400mhz,dmso-d6)δ2.62(s,1h),11.46(s,1h),10.21(s,1h),7.95(d,j=8.5hz,2h),7.68(d,j=9.0hz,2h),7.58(t,j=8.5hz,4h),2.76(t,j=7.7hz,2h),2.69(s,2h),2.35(t,j=7.3hz,2h),1.64
–
1.53(m,4h),1.32(s,9h),1.32(s,4h).
[0159]
(28)n-((4-(9-氨基壬胺基)苯基)氨基甲酰基)-4-(叔丁基)苯甲酰胺(v-28)
[0160]
9-((叔丁氧羰基)氨基)壬酸11f与酰基硫脲小分子配体5缩合后得到的中间体13f,用于活性对照,白色固体,产率50%。
[0161]1h nmr(400mhz,dmso-d6)δ12.62(s,1h),11.47(s,1h),10.18(s,1h),7.95(s,2h),7.67(d,j=8.7hz,2h),7.62
–
7.55(m,4h),2.76(d,j=7.7hz,2h),2.34(t,j=7.4hz,2h),1.62
–
1.53(m,4h),1.33(s,9h),1.30(s,8h).
[0162]
(29)n-((4-(10-氨基癸酰胺)苯基)氨基甲酰)-4-(叔丁基)苯甲酰胺(v-29)
[0163]
10-((叔丁氧羰基)氨基)癸酸11g与酰基硫脲小分子配体5缩合后得到的中间体13g,用于活性对照,白色固体,产率44%。
[0164]1h nmr(400mhz,dmso-d6)δ12.62(s,1h),11.47(s,1h),10.15(s,1h),7.96(d,j=8.3hz,4h),7.67(d,j=8.7hz,2h),7.59(t,j=8.1hz,4h),2.75(d,j=6.7hz,2h),2.34(t,j=7.4hz,2h),1.62
–
1.53(m,4h)1.33(s,9h),1.31
–
1.28(m,10h).
[0165]
(30)二叔丁基(6-((2-(2-(2-((4-(3-(4-(叔丁基)苯甲酰基)硫脲基)苯基)氨基)-2-氧代乙氧基)乙氧基)乙基)氨基)-6-氧代己烷-1,5-二基)(s)-二氨基甲酸酯(v-30)
[0166]
与酰基硫脲小分子配体5缩合的酸是2-(2-(叔丁氧羰基氨基)乙氧基)乙氧基乙酸16,hyt2为boc
2-lys。参照(15)中的方法制备目标化合物,产物为黄色固体,产率为38%。
[0167]1h nmr(400mhz,cdcl3)δ12.65(s,1h),9.23(s,1h),8.78(s,1h),7.85(d,j=
8.2hz,2h),7.68(d,j=3.4hz,4h),7.55(d,j=8.5hz,2h),6.69(d,j=6.0hz,1h),5.29(d,j=7.9hz,1h),4.74(s,1h),4.14(d,j=6.9hz,2h),4.04(s,1h),3.79
–
3.76(m,2h),3.70(t,j=4.0hz,2h),3.61(d,j=5.1hz,2h),3.49(d,j=6.1hz,2h),3.11
–
3.06(m,2h),1.83
–
1.78(m,1h),1.60
–
1.55(m,1h),1.43(s,18h),1.36(s,9h),1.26(s,4h).
13
c nmr(101mhz,cdcl3)δ178.46,172.48,168.23,167.08,157.76,156.23,155.83,136.47,135.86,133.89,128.63,127.56,126.44,126.19,124.87,120.74,120.13,79.97,79.09,71.07,70.66,70.09,69.92,54.51,39.91,39.07,35.25,31.92,31.59,31.05,29.70,29.61,29.05,28.45,28.32,22.66,14.16.
[0168]
(31)n-((4-(8-(叔丁氧基羰基取代的(l)-精氨酸氨基)癸酰胺基)苯基)氨基甲酰基)-4-(叔丁基)苯甲酰胺(v-31)
[0169]
与酰基硫脲小分子配体5缩合的酸是8-((叔丁氧羰基)氨基)辛酸11e,hyt2为boc
3-arg。参照(15)中的方法制备目标化合物,产物为白色固体,产率为36%。
[0170]1h nmr(400mhz,cdcl3)δ12.61(s,1h),9.18(s,1h),8.23(s,1h),7.84(d,j=8.5hz,2h),7.65(s,4h),7.55(d,j=8.6hz,2h),7.00(s,1h),6.00(d,j=8.7hz,1h),4.28(d,j=7.2hz,1h),3.95(s,1h),3.71(q,j=9.2,7.5hz,1h),3.41
–
3.26(m,1h),3.16(q,j=6.6hz,1h),2.81(s,5h),2.35(t,j=7.5hz,2h),1.80
–
1.65(m,5h),1.51(d,j=3.5hz,18h),1.45(s,9h),1.36(s,9h),1.34
–
1.27(m,6h).
13
c nmr(101mhz,cdcl3)δ178.32,172.15,171.87,166.99,163.24,160.92,157.74,155.64,154.84,137.13,133.19,128.63,127.51,126.20,124.69,119.88,84.20,79.65,79.33,53.92,43.99,39.35,38.64,37.42,35.25,31.04,29.42,28.91,28.73,28.58,28.44,28.27,28.01,26.47,25.33,24.63.
[0171]
以上合成的本发明的目标化合物v1-v31的化学结构见表1。
[0172]
【实施例4】酰基硫脲类化合物生物活性测试
[0173]
(1)酰基硫脲类化合物细胞毒性测定:
[0174]
黄色的噻唑兰,简称mtt,可透过细胞膜进入细胞内,活细胞线粒体中的琥珀脱氢酶能使外源性mtt还原为难溶于水的蓝紫色的针状formazan结晶并沉积在细胞中,结晶物可被20%(质量比体积)sds溶解,用酶联免疫检测仪在595nm波长处测定其光吸收值,可间接反映细胞数量。
[0175]
实验时,将mdck细胞以每孔2
×
104的密度传至96孔板中,在37℃培养24小时后,吸走培养基,将含有各种浓度梯度化合物的细胞培养基加到每个孔。24小时后,每孔加入5mg/ml的mtt溶液,细胞板在37℃的co2孵化器中培养4h。接着将助溶液加入到溶血细胞,在37℃孵化3h,酶标仪测定595nm波长下的od值。化合物的抑制率(%)=[1-(e-n)/(p-n)]
×
100,其中“e”代表给药组的od值,“p”代表未给药组的od值,“n”代表空白组od值。化合物的半数抑制浓度(cc
50
)作为该化合物细胞毒性的指标。
[0176]
(2)酰基硫脲类化合物体外抗甲型流感病毒h1n1(a/pr/8/34)活性:
[0177]
通过病毒蚀斑数减少分析来评估化合物的抗病活性。铺满mdck细胞的6孔板按照70pfu/孔接入h1n1流感病毒,40分钟后除去含病毒的培养基并加入含有特定浓度待测药物的培养基,培养基含有终浓度为2μg/ml tpck-trypsin和0.5%agarose。在37℃、5% co2条件下培养48-72小时后,用3%的福尔马林固定细胞,用0.5%结晶紫对细胞进行染色并计算病毒蚀斑数。ec
50
是指特定药物有效抑制病毒产生蚀斑数至对照孔的50%所需的浓度。
[0178]
(3)酰基硫脲类化合物对甲型流感病毒h1n1的核酸内切酶蛋白pa的降解活性测试:
[0179]
293t细胞铺板,待细胞长至密度约为60%时,换液为无血清培养基,用pei(聚乙烯亚胺)按质量体积比为1:2转染表达流感病毒pa蛋白的质粒2μg/孔,10h后除去含转染试剂的培养基,并加入含有梯度浓度待测药物的培养基,在37℃、5% co2条件下培养24h后弃去上清,收集细胞,加入含1%pmsf(苯甲基磺酰氯)和10%cocktail的裂解液rapi裂解后,用蛋白免疫印迹(western blot,wb)的方法检测pa蛋白的含量。
[0180]
本发明以金刚烷胺和法匹拉韦对照,对合成的31个化合物进行细胞毒性和抗甲型流感病毒活性检查,并计算了化合物的选择性指数si,结果见表2。
[0181]
表2本发明合成的目标化合物v1-31抗甲型流感病毒活性和细胞毒性的结果
[0182][0183][0184]
上述实验结果表明:合成的大多数酰基硫脲类化合物都具有很好抗流感病毒活性,例如化合物v-5(ec
50
=0.044μm,si》2272.7)、v-6(ec
50
=0.071μm,si》1408.5)、v-7(ec
50
=0.016μm,si》6250)、v-16(ec
50
=0.043μm,si》2325.6)、v-17(ec
50
=0.064μm,si》
1562.5)、v-20(ec
50
=0.075μm,si》1333.3)、v-21(ec
50
=0.045μm,si=2222.2)、v-22(ec
50
=0.022μm,si》4545.5)、v-23(ec
50
=0.045μm,si》2222.2)。尤其是化合物v-5、v-7、v-16、v-21、v-22、v-23均显示了低纳摩尔水平的抗甲型流感病毒活性和高的选择性。
[0185]
另一方面,采用wb实验来测试所合成的基于疏水标签的酰基硫脲类化合物对于靶标蛋白pa的降解效果。在体外rna依赖的rna聚合酶降解实验中看到了化合物v-17与v20-24对于聚合酶酸性蛋白pa的降解,是一类活性良好的流感病毒聚合酶酸性蛋白pa抑制剂,可用于制备抗流感病毒药物。部分代表性化合物v-21和v-22的降解效果如图1所示,v-21表现出剂量依赖性方式降解pa蛋白,且效果优于v-22。
[0186]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。