用于癌症治疗的bcl-2家族蛋白调节化合物
技术领域
1.本发明涉及用于治疗癌症和细胞增殖疾病的化合物、组合物和方法,更具体地说,涉及制备和使用调节选自bcl-2、mcl-1、bcl-x
l
、bcl-w、bfl-1和bcl-b中的至少一种蛋白质,特别是bcl-2蛋白或bcl-x
l
和/或mcl-1蛋白的化合物的方法;所述化合物可包含在药物组合物中并用作治疗剂。
背景技术:
2.癌症是世界范围内的主要死亡原因。细胞凋亡,也称为程序性细胞死亡,是多细胞生物用来消除衰老或受损细胞的自然过程,也涉及各种生理过程,如形态发生和组织稳态。细胞凋亡是一个复杂的、高度调节的过程,涉及许多蛋白质。这些蛋白质中有些促进细胞死亡(“促凋亡”蛋白质),有些阻止细胞死亡(“抗凋亡”蛋白质)。癌细胞倾向于过度表达抗凋亡基因。抗凋亡基因的过度表达与肿瘤形成、转移性生长和化疗抗性有关,因此持续需要选择性杀死癌细胞的治疗策略。
3.更具体地说,细胞凋亡控制缺陷经常与血液系统恶性肿瘤和实体瘤中的癌细胞的化学抗性有关,而bcl-2家族成员表达失调是最常见和最重要的事件之一。这些蛋白质共享bcl-2同源结构域(命名为bh结构域)。抗凋亡蛋白(bcl-2、bcl-x
l
……
)包含bh1至bh4结构域,而促凋亡蛋白要么包含bh1至bh3结构域(多结构域成员如bax和bak),要么仅包含bh3结构域(仅bh3的组如bim、puma、bid、bad、noxa和hrk)。在细胞应激下,仅bh3蛋白通过阻断抗凋亡成员的活性或直接激活多结构域促凋亡成员来启动细胞凋亡,这通过一种蛋白质的bh3结构域与另一种蛋白质的疏水袋的相互作用来介导。
4.人们一直在努力阻止抗凋亡成员如bcl-2或bcl-x
l
的活性,其中,开发高效的bh3模拟分子是一条有希望的途径。这些分子与bcl-2家族的抗凋亡蛋白中的bh3结合槽结合,并通过释放促凋亡的bcl-2家族成员促进细胞死亡。
5.在卵巢癌中,发明者先前证明bcl-x
l
和mcl-1配合保护肿瘤细胞免于凋亡,并且它们的伴随抑制会导致大量细胞凋亡,即使在没有化疗的情况下,也是如此,而bcl-x
l
或者mcl-1的下调在某些情况下可能仍然无效。在这种情况下,他们还表明需要mcl-1下调或失活来使卵巢癌细胞对bcl-x
l-靶向bh3-模拟分子(如abt-737)敏感。
6.在包括淋巴瘤在内的血液恶性肿瘤中,对靶向bcl-2家族抗凋亡蛋白的兴趣已被广泛记录。例如,由美国fda批准的bcl-2抑制剂venetoclax(或venclaxta,由abbvie开发)已经成功地在体外以及在体内靶向bcl-2,已发现bcl-2抑制剂对包括多发性骨髓瘤、急性髓细胞白血病、骨髓增生异常综合征、急性淋巴细胞白血病、小淋巴细胞淋巴瘤等的各种血液系统恶性肿瘤有临床活性。
7.其他研究也表明mcl-1的抑制提高了bcl-2或bcl-x
l
靶向bh3模拟物在血液系统恶性肿瘤中的治疗功效。在其他淋巴恶性肿瘤,如侵袭性套细胞淋巴瘤(mcl)中,细胞存活可能或也只能依赖于bcl-2相关的mcl-1。
8.mcl-1包含三个bh结构域(bh1-bh3),但在nh2末端缺乏明确界定的bh4结构域。
mcl-1通过其cooh末端的跨膜结构域定位于各种细胞内膜,尤其是线粒体外膜。像bcl-2和bcl-x
l
,mcl-l可与bak相互作用来抑制线粒体介导的细胞凋亡。不像bcl-2和bcl-x
l
,在细胞因子或生长因子的作用下,mcl-l的表达被迅速诱导。增加的mcl-1表达促进包括白血病、肝癌、黑色素瘤、前列腺癌和乳腺癌细胞的多种肿瘤细胞类型的细胞活力。此外,mcl-1通过体细胞拷贝数的扩增,在多种癌症的细胞永生化和肿瘤发生中发挥作用。携带mcl-1扩增的癌细胞经常依靠mcl-1生存。
9.mcl-1在包括卵巢癌、血液系统恶性肿瘤、乳腺癌、结肠癌和肺癌的多种肿瘤细胞中过度表达,并且其表达也与化疗抗性有关。重要的是,mcl-1基因座是人类癌症中最常扩增的基因座之一,进一步表明其在致癌作用中的中心地位,并增加了其作为高优先级治疗靶点的重要性。
10.然而,由于心脏毒性的原因,最近放弃了几种抑制mcl-1途径的分子的开发。
11.在其他有希望的治疗靶点中,抗凋亡bcl-x
l
蛋白质构成选择的目标。这在某些实体瘤的治疗中尤其如此,这些实体瘤会过度表达这种蛋白质(包括卵巢肿瘤),并且其表达与耐药性密切相关。尽管目前靶向这种蛋白质的药理学益处没有受到质疑,但抑制这种蛋白质的分子的开发目前受到患者血小板减少症的出现的阻碍。
12.因此,本发明的目的是提供可用于调节mcl-1活性和/或bcl-x
l
,尤其是降解mcl-1和/或bcl-x
l
蛋白质,同时对心脏和血小板无毒性或低毒性的替代化合物。
13.本发明的另一个目的是提供治疗癌症,特别是血液系统恶性肿瘤如淋巴瘤和/或实体瘤如卵巢癌,同时对心脏和血小板无毒性或低毒性的替代化合物。
技术实现要素:
14.因此,本发明在一方面涉及下式(i)的化合物:
[0015][0016]
其中:
[0017]
y1、y2、y3和y4各自独立地是c或n,y1和y2例如一个是n,另一个是c,y3和y4例如一个是n,另一个是c;
[0018]
ar1、ar2各自独立地选自(c
6-c
10
)芳基、(5至7元)杂芳基、-o-(c
6-c
10
)芳基、-o-(5至7元)杂芳基、-s-(c
6-c
10
)芳基、-s-(5至7元)杂芳基、-(c
1-c6)烷基-(c
6-c
10
)芳基、-(c
1-c6)烷基-(5至7元)杂芳基和卤素,该卤素特别是cl,所述芳基和杂芳基任选被1至3个r3基团取代,
[0019]
i和j独立地为0或1,
[0020]
和
[0021]
r1、r2在每次出现时,独立地选自(c
1-c6)烷基、(c
6-c
10
)芳基、-(c
1-c6)烷基-(c
6-c
10
)芳基、-(c
2-c6)烯基-(c
6-c
10
)芳基、-羰基-(c
6-c
10
)芳基、-羰基-(c
1-c6)烷基-(c
6-c
10
)芳基、c(=o)h、cooh、oh,所述烷基任选地被oh取代,所述芳基任选地被1-3个r4基团取代;
[0022]
k和l独立地为0或1;
[0023]
(r1)k和(r2)
l
中的至少一个是例如:
[0024]
r1选自(c
6-c
10
)芳基、-(c
1-c6)烷基-(c
6-c
10
)芳基、-(c
2-c6)烯基-(c
6-c
10
)芳基、-羰基-(c
6-c
10
)芳基、-羰基-(c
1-c6)烷基-(c
6-c
10
)芳基,且k为1;或
[0025]
r2选自(c
6-c
10
)芳基、-(c
1-c6)烷基-(c
6-c
10
)芳基、-(c
2-c6)烯基-(c
6-c
10
)芳基、-羰基-(c
6-c
10
)芳基、-羰基-(c
1-c6)烷基-(c
6-c
10
)芳基,且l为1;
[0026]
r3在每次出现时,独立地选自(c
1-c6)烷基、(c
1-c6)烷氧基、oh、c(=o)h、(ch2)mconrarb、c(=o)rc、(ch2)nco2h、(ch2)nco2rc、(ch2)
p
cn、(ch2)qc(=n(oh))nh2、-so2nrarb、i、cl、br、f、(c
6-c
10
)芳基、(5至7元)杂芳基、-(c
1-c6)烷基-(c
6-c
10
)芳基、-(c
2-c6)烯基-(c6-c10)芳基,所述烷基任选地被oh、(c
1-c6)烷氧基和/或-o-(c
6-c
10
)芳基取代;
[0027]
r4在每次出现时,独立地选自(c
1-c6)烷基、(ch2)nco2h、(ch2)nco2rc、i、cl、br、f,或者有两个r4与它们所连接的芳基形成萘基;
[0028]
ra和rb独立地选自h和(c
1-c6)烷基;
[0029]
rc选自从h和(c
1-c6)烷基;
[0030]
m是0、1、2、3;
[0031]
n是0、1、2、3;
[0032]
p是0、1、2、3;
[0033]
q是0、1、2、3;
[0034]
r为0或1;
[0035]
w和y各自独立地选自单键、-ch=ch-、-c≡c-、
–
nh-、
–
nr
5-、
–
o-、
–
s-、-c(=o)nh-、-nhc(=o)-、-c(=o)o-、-oc(=o)-;
[0036]
r5在每次出现时,独立地选自(c
1-c6)烷基,
[0037]
l1和l2各自独立地选自(c
1-c
18
)烷基、(c
2-c
18
)烯基和(c
2-c
18
)炔基,所述基团任选地被一个或多个选自
–
o-、
–
s-、
–
nr6-的基团中断;
[0038]
r6在每次出现时,独立地选自h和(c
1-c6)烷基,
[0039]
x选自(5至7元)杂芳基(特别是三唑)、-nh-、-nr
7-、-o-、-s-、-c(=o)nh-、-nhc(=o)-、-c(=o)o-、-oc(=o)-;
[0040]
r7选自(c
1-c6)烷基,
[0041]
z为e3泛素连接酶配体;
[0042]
及其药学上可接受的盐。
[0043]
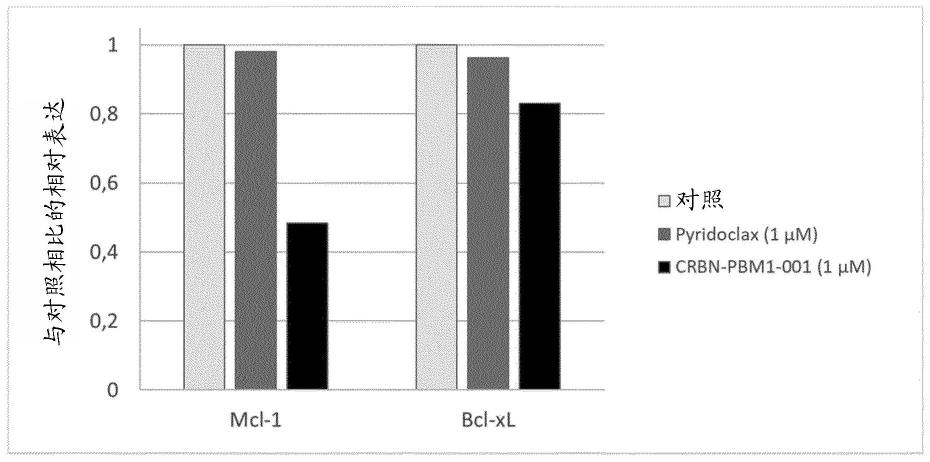
根据一实施方式,y1和y3是n,且y2和y4是c。
[0044]
根据一实施方式,y1和y3是c,且y2和y4是n。
[0045]
根据一实施方式,y1和y4是n,且y2和y34是c。
[0046]
根据一实施方式,当j为0时,则y4是n。
[0047]
根据一实施方式,以上限定的式(i)的化合物为以下式(ii):
[0048][0049]
根据一实施方式,以上限定的化合物具有下式(iiia)或(iiib):
[0050][0051]
所述化合物具体为下式(iiia1)或(iiia2)、(iiib1)或(iiib2):
[0052][0053][0054]
在特定方面,包括如上限定的化合物,其中ar1、ar2中的至少一个是(5至7元)杂芳基、-o-(c
6-c
10
)芳基、-o-(5至7元)杂芳基、-s-(c
6-c
10
)芳基、-s-(5至7元)杂芳基、-(c
1-c6)烷基-(c
6-c
10
)芳基或-(c
1-c6)烷基-(5至7元)杂芳基,特别是含有氮原子的5至7元杂芳基,优选吡啶基,尤其是3-吡啶基。
[0055]
在特定方面,包括如上限定的化合物,其中ar1和ar2中的至少一个是(c
6-c
10
)芳基,特别是苯基。
[0056]
根据一种实施方式,ar1和/或ar2选自苯基、吡啶基、嘧啶基、咪唑基、吡唑基、苯硫
resolutions;wiley:new york,1981中描述的拆分和回收特定的立体异构体的有用方法均通过参考全部并入本文。
[0074]
根据一实施方式,以上限定的化合物为下式(iva)或(ivb):
[0075][0076]
特别是为下列式(iva1)、(iva2)、(ivb1)或(ivb2):
[0077]
[0078][0079]
或为式:
[0080][0081]
其中:
[0082]
x1、x2在每次出现时,独立地选自c或n;
[0083]
r1、r2、r3在每次出现时,都独立地如上文所限定。
[0084]
根据一实施方式,如上限定的化合物为下列的式之一:
[0085]
[0086]
[0087]
[0088][0089]
或其立体异构体形式,立体异构体形式的混合物及药学上可接受的盐形式,特别是钠盐或富马酸盐,
[0090]
其中:
[0091]
r3和r4在每次出现时,都独立地如上文所限定。
[0092]
根据一实施方式,w是-nh-,l1是(c
1-c
18
)烷基,r是1,x是(5-7元)杂芳基,特别是三唑,l2是被一个或多个-o-原子中断的(c
1-c
18
)烷基,特别是式-ch
2-(o-ch
2-ch2)
1-6-,且y是单键、-nh-或-c(=o)nh-。
[0093]
根据另一实施方式,w是-nh-,l1是被一个或多个-o-原子中断的(c
1-c
18
)烷基,特别是为式-ch
2-ch
2-(o-ch
2-ch2)
1-6-,r为0,且y为单键或-c(=o)nh-。
[0094]
根据另一实施方式,w是-c≡c-,l1是被一个或多个-o-原子中断的(c
1-c
18
)烷基,特别是为式-ch
2-(o-ch
2-ch2)
1-6-,r为0,且y为单键或-c(=o)nh-。
[0095]
根据一实施方式,z是vhl(von hippel-lindau)、crbn(cereblon)、ciap(细胞凋亡抑制剂)或mdm2(鼠双微体(mouse double minute)2)e3泛素连接酶配体,z特别是vhl e3泛素连接酶配体。
[0096]
根据特定的实施方式,z选自:
[0097][0098][0099]
在其他方面,包括式(i)的化合物,其选自以下:
[0100]
[0101]
[0102]
[0103]
[0104]
[0105]
[0106]
[0107]
[0108]
[0109]
[0110]
[0111]
[0112][0113]
其中:
[0114]
r3是h或如上限定,特别是cl;
[0115]
r8是(c
1-c6)烷基,特别是丙基。
[0116]
式(i)化合物的制备方法
[0117]
本发明的化合物可以用本领域技术人员公知的许多方法,包括但不限于下面描述的那些方法来制备,或者通过应用有机合成领域技术人员已知的标准技术对这些方法进行修改来制备。所述试剂和起始原料是市售的,或通过本领域普通技术人员的公知技术容易合成的。除非另有说明,所有取代基如先前限定。与本发明相关的所有公开的方法可以设想
以任何规模实施,包括毫克、克、多克或商业工业规模。
[0118]
如将容易理解的,式i的化合物上存在的官能团可以含有保护基团。保护基团本身作为可以选择性地附加到诸如羟基和羧基的官能团上或从该官能团上除去的化学官能团已知。这些基团存在于化合物中,以使该官能团对化合物暴露于其中的化学反应条件是惰性的。本发明可采用各种保护基团中的任何一种。根据本发明的其他优选保护基团可以在greene,t.w.and wuts,p.g.m.,“protective groups in organic synthesis”2d.ed.,wiley&sons,1991,or p.j.kocienski,“protecting groups”,3rd.ed.,thieme,stuttgart,ny,2004中找到。
[0119]
这样制备的化合物可以通过常规方法从反应混合物中回收。例如,化合物可以在萃取后从溶剂混合物中蒸馏出,或者如果必要,在从溶剂混合物中蒸馏出后,将残留物倒入水中,然后用与水不混溶的有机溶剂萃取,并从溶剂混合物中蒸馏出。此外,如果需要,该产物可以通过各种众所周知的技术,如重结晶、沉淀或各种色谱技术,尤其是柱色谱或制备薄层色谱,特别是高效液相色谱(hplc)来进一步纯化。
[0120]
在另一个目的中,本发明涉及一种制备如本文所限定的式(i)化合物的方法,其中r为1,该方法包括以下步骤:
[0121][0122]
其中,xa和xb是化学反应后形成如上限定的基团x的化学基团。
[0123]
xa和xb是本领域技术人员公知的,并且例如分别是-n3和-≡(炔基),-n3和-≡(炔基)通过铜(i)催化的叠氮炔huisgen环加成形成三唑。
[0124]
化合物(b)是市售的,如下所述,或可通过以下方式获得:
[0125][0126]
其中,ya和yb是化学反应后形成如上限定的基团y的化学基团。
[0127]
ya和yb是本领域技术人员所熟知的,并且分别为例如-cooh或活化酯和-nh2,-cooh或活化酯和-nh2通过肽偶联形成-conh-;或为-nh2和-f(-f特别是结合在芳基上),-nh2和-f通过亲核芳香族取代形成-nh-。
[0128]
化合物(b1)和(b2)是市售的,如下所述,或通过本领域技术人员公知的方法获得。
[0129]
在一实施方式中,化合物(a)如下获得:
[0130][0131]
其中,wa和wb是化学反应后形成如上限定的基团w的化学基团。
[0132]
wa和wb是本领域技术人员公知的,并且分别为例如-f或-cl和-nh2,-f或-cl和-nh2通过亲核芳香取代形成-nh-;或为-cooh或活化酯和-nh2,-cooh或活化酯和-nh2通过肽偶联形成-conh-。
[0133]
d是市售的或通过本领域技术人员公知的方法获得。
[0134]
在一实施方式中,化合物(c)如下得到,ar1特别选自(c
6-c
10
)芳基和(5-7元)杂芳基:
[0135]
当j为1,且i为0或1时:
[0136][0137]
其中,hal2是卤素,特别是br,
[0138]
或
[0139]
当j为1,且i为1时:
[0140][0141]
其中,hal1是卤素,特别是br,
[0142]
或
[0143]
当j=0,且i为1时:
[0144][0145]
其中,hal1是卤素,特别是br。
[0146]
当j=0且i=0时,则化合物(c)可通过本领域技术人员公知的方法,特别是wo2015132727中描述的方法获得。
[0147]
当ar1是hal,化合物(c)可类似于如下所述的化合物(g)获得。
[0148]
当ar1选自-o-(c
6-c
10
)芳基、-o-(5至7元)杂芳基、-s-(c
6-c
10
)芳基、-s-(5至7元)杂芳基、-(c
1-c6)烷基-(c
6-c
10
)芳基、-(c
1-c6)烷基-(5至7元)杂芳基时,化合物(c)可如下获得:
[0149]
对于ar1=-o-(c
6-c
10
)芳基、-o-(5-7元)杂芳基、-s-(c
6-c
10
)芳基或-s-(5-7元)杂芳基,由化合物(g)(例如其中hal1=br)通过亲核芳香取代与ar-sh或ar-oh化合物接触;
[0150]
对于ar1=-(c
1-c6)烷基-(c
6-c
10
)芳基、-(c
1-c6)烷基-(5-7元)杂芳基,由化合物(g)(例如其中hal1=br),在ar-烷基-mgbr化合物存在下,特别是通过negishi偶联。
[0151]
在一实施方式中,当i为1时,化合物(e)如下获得:
[0152][0153]
其中hal1和hal2是卤素,例如分别为i和br。
[0154]
j可通过本领域技术人员公知的方法,特别是wo2015132727中描述的方法获得。
[0155]
当i为0时,(e)可通过本领域技术人员公知的方法,特别是wo2015132727中描述的方法获得。
[0156]
替代性地,化合物(e)可以如下获得:
[0157][0158]
其中hal5是卤素,特别是i,hal2例如是br。
[0159]
在一实施方式中,化合物(g)如下获得:
[0160][0161]
其中hal3是卤素,特别是i,hal1例如是br。
[0162]
替代性地,化合物(g)可以如下获得:
[0163][0164]
其中hal4是卤素,特别是i,hal1例如是br。
[0165]
(l)是市售的或通过本领域技术人员公知的方法获得。
[0166]
(m)可通过本领域技术人员公知的方法,特别是wo2015132727中描述的方法获得。
[0167]
(n)可通过本领域技术人员公知的方法,特别是wo2015132727中描述的方法获得。
[0168]
在另一个目的中,本发明涉及一种制备如本文所限定的式(i)的化合物的方法,其中r为0,该方法包括以下步骤:
[0169][0170]
化合物(b2)如上所述。
[0171]
化合物(a')如上化合物(a)所限定。ya和yb是本领域技术人员所熟知的,并且例如分别为-cooh或活化酯和-nh2,-cooh或活化酯和-nh2通过肽偶联形成-conh-,或为-nh2和-f(-f特别是结合在芳香基上),-nh2和-f通过亲核芳香取代形成-nh-。
[0172]
所有取代基,例如基团r3可以在上述步骤之前、之间或之后进行修饰。例如,基团r3=oh可以通过sn2反应修饰成r3=o-丙基。
[0173]
当w是c≡c时,可以例如通过本领域技术人员公知的sonogashira偶联将含w的片段引入芳香骨架。
[0174]
在另一个目的中,本发明涉及一种药物组合物,包括如上限定的式(i)的化合物,该式(i)的化合物与至少一种药学上可接受的赋形剂或载体混合。
[0175]
上述针对式(i)的化合物的所有实施方式单独地或组合地适用于此。
[0176]
在一实施方式中,上面限定的药物组合物还包括附加的抗癌剂,特别是选自抗
egfr、抗map激酶和抗akt化合物。其他示例性附加抗癌剂包括卡铂、紫杉醇、阿霉素(doxorubicin)、拓扑替康(topotecan)和上述的功能性衍生物。
[0177]
对于本领域普通技术人员来说显而易见的是,所述药物组合物的具体制剂可以基于所治疗的癌症类型来选择。本发明的组合物可以配制有提高其稳定性和/或提供在体内受控或持续的释放的材料,以给药于患者。
[0178]
这些药物组合物可以以制药领域中的众所周知的方式制备,并且,根据是否需要局部治疗或全身治疗以及要治疗的区域,可以通过多种途径给药。
[0179]
给药可以是表面的(包括皮肤、眼(ophthalmic)和黏膜,包括鼻内、阴道和直肠递送)、肺部的(例如,通过吸入或吹入粉末或气溶胶,包括通过喷雾器;气管内、鼻内、表皮和透皮)、眼部的(ocular)、口服的或肠胃外的。
[0180]
特别地,本发明的化合物和组合物通过口服给药或静脉注射给药。
[0181]
本发明的化合物和药物组合物可以任何口服可接受的剂型,包括但不限于胶囊、片剂、水悬浮液或溶液口服给药。在口服用的片剂的情况下,常用的载体包括乳糖和玉米淀粉。还通常添加润滑剂,如硬脂酸镁。对于胶囊形式的口服给药,有用的稀释剂包括乳糖和干玉米淀粉。当需要口服用水悬浮液时,将活性成分与乳化剂和悬浮剂结合。如果需要,还可以添加某些甜味剂、调味剂或着色剂。
[0182]
眼部递送的方法可以包括表面给药(滴眼液)、结膜下、眼周或玻璃体内注射或通过球囊导管或通过手术放置在结膜囊内的眼部插入物导入。肠胃外给药包括静脉、动脉、皮下、腹腔或肌肉注射或输注;或颅内,如鞘内或脑室内给药。
[0183]
可以配制药物组合物,以便在通过使用本领域已知的方法给药于患者后提供活性成分的受控、快速、持续或延迟的释放。
[0184]
药物组合物也可以通过本领域技术人员公知的技术配制,例如通过纳米矢量化或通过使用微粉化形式配制。
[0185]
药物组合物通常包括药学上可接受的无机或有机载体、防腐剂、增溶剂、稳定剂、润湿剂、乳化剂、甜味剂、着色剂、调味剂、用于改变渗透压的盐、缓冲剂、掩蔽剂或抗氧化剂。它们还可以含有其他有治疗价值的物质。这些成分基于给药方式和途径来选择。在remington's pharmaceutical sciences(e.w.martin)中描述了用于药物制剂中的合适的药物成分以及药物必需品。
[0186]
可用于这些药物组合物中的药学上可接受的载体包括但不限于离子交换剂,氧化铝,硬脂酸铝,卵磷脂,血清蛋白质如人血清白蛋白,缓冲物质如磷酸盐,甘氨酸、山梨酸、山梨酸钾、饱和植物脂肪酸的偏甘油酯混合物,水,盐或电解质如醇溶谷蛋白硫酸盐、磷酸氢二钠、磷酸氢钾、氯化钠、锌盐,胶体二氧化硅,三硅酸镁,聚乙烯吡咯烷酮,纤维素基物质,聚乙二醇,羧甲基纤维素钠,聚丙烯酸酯,蜡,聚乙烯-聚氧丙烯嵌段聚合物,聚乙二醇和羊毛脂肪。本发明化合物的治疗剂量可以根据例如治疗用于的特定用途、化合物的给药方式、患者的健康和状况以及主治医师的判断而变化。本发明化合物在药物组合物中的比例或浓度可以根据包括剂量、化学特性(例如疏水性)和给药途径的许多因素而变化。
[0187]
在另一个目的中,本发明因此涉及如上限定的式(i)的化合物用于治疗癌症,尤其是血液系统恶性肿瘤如淋巴瘤、白血病、多发性骨髓瘤,和/或实体肿瘤如卵巢癌、间皮瘤、黑色素瘤、胰腺癌、肺癌、乳腺癌、肾癌和肝癌。
[0188]
上述针对式(i)的化合物的所有实施方式单独地或组合地适用于此。
[0189]
在特定的实施方式中,本发明因此涉及如上限定的式(i)的化合物用于通过诱导由选自bcl-2、mcl-1、bcl-x
l
、bcl-w、bfl-1和bcl-b中的至少一种蛋白质,特别是bcl-2蛋白、或bcl-x
l
和/或mcl-1蛋白,更具特别是bcl-2蛋白、或bcl-x
l
和mcl-1蛋白介导的凋亡来治疗癌症。
[0190]
适用于本发明治疗方法的癌症可以是对选自bcl-2、mcl-1、bcl-x
l
、bcl-w、bfl-1和bcl-b中的至少一种蛋白质,特别是bcl-2蛋白、或bcl-x
l
和/或mcl-1蛋白的调节有响应的癌症;因此,任何与选自bcl-2、mcl-1、bcl-x
l
、bcl-w、bfl-1和bcl-b中至少一种蛋白质特别是bcl-2蛋白、或bcl-x
l
和/或mcl-1蛋白的失调(例如,过度表达或改变的结合或活性)有关的癌症都在本发明的范围内。
[0191]
癌症或肿瘤性疾病包括例如但不限于乳腺癌,血液癌如骨髓瘤、白血病和淋巴瘤(例如,burkitt淋巴瘤、非霍奇金淋巴瘤、霍奇金淋巴瘤和急性t细胞白血病),神经肿瘤如脑肿瘤(例如胶质瘤,包括星形细胞瘤或胶质母细胞瘤),黑色素瘤,肺癌,头颈癌,甲状腺癌,胃肠道肿瘤(诸如胃、结肠或直肠癌等),肝癌,胰腺癌,泌尿生殖肿瘤(诸如卵巢癌、阴道癌、外阴癌、子宫内膜癌、膀胱癌、肾癌、睾丸癌、前列腺癌或阴茎癌),骨肿瘤,血管肿瘤、以及皮肤癌(诸如基底细胞癌、鳞状细胞癌和黑色素瘤)。
[0192]
另一方面,包括式(i)的化合物,用作选自bcl-2、mcl-1、bcl-x
l
、bcl-w、bfl-1和bcl-b中的至少一种蛋白质,特别是bcl-2蛋白、或bcl-x
l
和/或mcl-1蛋白,更特别是bcl-2蛋白、或bcl-x
l
和mcl-1蛋白的配体。
[0193]
另一方面,包括式(i)的化合物,用于诱导由选自bcl-2、mcl-1、bcl-x
l
、bcl-w、bfl-1和bcl-b中的至少一种蛋白质,特别是bcl-2蛋白、或bcl-x
l
和/或mcl-1蛋白,更特别是bcl-2蛋白、或bcl-x
l
和mcl-1蛋白介导的凋亡。
[0194]
只要出现临床上有益的结果,患者就会得到有效的治疗。这可能意味着例如疾病症状的完全解决、疾病症状的严重程度的减轻,或疾病进展的减缓。
[0195]
本文提供的有效量的任何组合物可以对需要治疗的个人给药。本文使用的术语“有效”是指在患者中诱导出期望的应答,而不诱导显著毒性的任何量。这样的量可以通过在给药已知量的特定组合物后评估患者的应答来确定。
[0196]
另一方面,本发明涉及一种治疗癌症的方法,该方法包括向有需要的患者给药有效量的包括如上限定的式(i)的化合物的药物组合物。
[0197]
在另一方面,本发明涉及降解选自bcl-2、mcl-1、bcl-x
l
、bcl-w、bfl-1和bcl-b中的至少一种蛋白质,特别是bcl-2蛋白、或bcl-x
l
和/或mcl-1蛋白,更特别是bcl-2蛋白、或bcl-x
l
和mcl-1蛋白质的方法,该方法包括使所述蛋白质与如上限定的式(i)的化合物接触。
[0198]
在另一方面,本发明涉及在体内降解选自bcl-2、mcl-1、bcl-x
l
、bcl-w、bfl-1和bcl-b中的至少一种蛋白质,特别是bcl-2蛋白或bcl-x
l
和/或mcl-1蛋白,更特别是bcl-2蛋白、或bcl-x
l
和mcl-1蛋白质的方法,该方法包括将该蛋白质与上述式(i)化合物接触,以通过所述式(i)的化合物靶向的泛素化来降解所述蛋白质。
[0199]
本发明还涉及杀死癌细胞的方法和调节细胞中选自bcl-2、mcl-1、bcl-x
l
、bcl-w、bfl-1和bcl-b中的至少一种蛋白质,特别是bcl-2蛋白、或bcl-x
l
和/或mcl-1蛋白的水平的
方法。本文所述的治疗方法可以与其他细胞毒性治疗(例如,化疗、激素治疗、放疗、基于抗体的治疗或针对细胞信号通路的靶向治疗)结合进行。
[0200]
在优选的实施方式中,本发明的化合物和组合物可用于防止或减少患有bcl-2、mcl-1、bcl-x
l
、bcl-w、bfl-1和bcl-b,特别是bcl-2、或bcl-x
l
和/或mcl-1表达癌的患者的转移或进一步扩散;更具体地说,它们可用于增加此类患者的生存期、增加此类患者的无进展生存期、增加应答持续期,从而使得经治疗患者的统计上显著和临床上有意义的改善,如通过生存期、无进展生存期、应答率或应答持续期来衡量的。在优选的实施方式中,该药物有助于提高一组患者的应答率。
[0201]
如本文所用,术语“烷基”是指具有1至8个碳原子的直链或支链烷基,如甲基、乙基、丙基、异丙基、丁基、异丁基、仲丁基、叔丁基、戊基、异戊基、新戊基、1-乙基丙基、3-甲基戊基、2,2-二甲基丁基、2,3-二甲基丁基、己基、辛基等。含烷基的基团(如烷氧基和烷氧基羰基)的烷基部分具有与如上限定的烷基相同的含义。优选的低级烷基是如上限定的含有1-4个碳的烷基。诸如“c
1-c6烷基”的名称是指含有1至6个碳原子的烷基。如本文所用,术语“烯基”是指具有至少一个碳-碳双键的2至6个碳原子的直链或支链烃链。诸如“c
2-c6烷基”的名称是指含有2至6个碳原子的烯基。烯基的实例包括乙烯基、丙烯基、异丙烯基、2,4-戊二烯基。“c
2-c4烯基”是特别优选的。
[0202]
如本文所用,术语“烷氧基”是指烷基-o-基团,其中烷基如本文所述。示例性的烷氧基包括甲氧基、乙氧基、正丙氧基、异丙氧基和正丁氧基。
[0203]
如本文所用,术语“芳基”是指具有6至10个环碳原子的取代或未取代的单或双环烃芳环体系。实例包括苯基和萘基。
[0204]
如本文所用,术语“芳烷基”是指被芳基取代的烷基。芳烷基的实例包括但不限于苄基、溴苄基、苯乙基、二苯甲基(benzhydryl)、二苯基甲基、三苯基甲基、二苯基乙基、萘甲基。
[0205]
如本文所用,术语“芳基烯基”是指被芳基取代的烯基。芳基烯基的实例包括但不限于苯乙烯基。
[0206]
如本文所用,术语“芳基羰基”是指芳基-c(=o)-基团,其中芳基如本文所述。
[0207]
如本文所用,术语“芳烷基羰基”是指芳烷基-c(=o)-基团,其中芳烷基如本文所述。
[0208]
如本文所用,术语“杂芳基”是指含有5至10个,优选5至7个环碳原子的芳族基团,其中一个或多个环碳原子被至少一个如-o-、-n-或-s-的杂原子取代。杂芳基的实例包括吡咯基、呋喃基、噻吩基、吡唑基、咪唑基、噻唑基、异噻唑基、异噁唑基、噁唑基、噁硫醇基、噁二唑基、三唑基、噁三唑基、呋喃基、四唑基、吡啶基、吡嗪基、嘧啶基、哒嗪基、三嗪基、吲哚基、异吲哚基、吲唑基、苯并呋喃基、异苯并呋喃基、嘌呤基、喹唑啉基、喹啉基、异喹啉基、苯并咪唑基、苯并噻唑基、苯并苯硫基、硫茚基(thianaphthenyl)、苯并噁唑基、苯并异噁唑基、噌嗪基(cinnolinyl)、酞嗪基、萘啶基和喹喔啉基。在“杂芳基”的定义中包括稠环体系,包括例如芳香环与杂环烷基环稠合的环体系。这种稠环体系的实例包括例如邻苯二甲酰胺、邻苯二甲酸酐、吲哚啉、异吲哚啉、四氢异喹啉、苯并二氢吡喃(chroman)、异苯并二氢吡喃、色烯(chromene)和异色烯。
[0209]
如本文所用,术语“受试者”是指患有或可能患有本文所述的一种或多种疾病和病症的温血动物,如哺乳动物,优选人类或人类儿童。
[0210]
如本文所用,“治疗有效量”是指有效预防或治疗特定疾病的本发明化合物的量。此类疾病包括但不限于与本文所述受体的异常活性相关的那些病理和神经疾病,其中治疗或预防包括通过将受体与本发明的化合物接触来抑制、诱导或增强其活性。
[0211]
如本文所用,术语“药学上可接受的”是指那些化合物、材料、组合物和/或剂型,这些化合物、材料、组合物和/或剂型在合理的医学判断范围内,适合于与人和动物的组织接触,而没有过量的毒性、刺激性、过敏反应,或其他与合理的益处/风险比相称的问题并发症。
[0212]
在本发明的描述中使用的所有其他术语的含义在本领域中是众所周知的。
[0213]
另一方面,本发明涉及上述化合物的药学上可接受的盐。如本文所用,“药学上可接受的盐”包括本发明化合物的盐,其得自这些化合物与无毒酸或碱加成盐的组合。
[0214]
酸加成盐包括无机酸(如盐酸、氢溴酸、氢碘酸、硫酸、硝酸和磷酸),以及有机酸(如乙酸、柠檬酸、丙酸、富马酸、马来酸、酒石酸、谷氨酸、水杨酸、草酸、甲磺酸、对甲苯磺酸、琥珀酸和苯甲酸),以及相关的无机和有机酸。
[0215]
碱加成盐包括得自无机碱(如铵和碱金属和碱土金属氢氧化物、碳酸盐、碳酸氢盐等)的那些,以及得自碱性有机胺(如脂肪族和芳香族胺、脂肪族二胺、羟基烷胺等)的那些。用于制备本发明盐的这类碱因此包括氢氧化铵、碳酸钾、碳酸氢钠、氢氧化钙、甲胺、二乙胺、乙二胺、环己胺、乙醇胺等。
[0216]
除了药学上可接受的盐之外,本发明还包括其他盐。它们可以作为化合物的纯化、其他盐的制备、或化合物或中间体的鉴定和表征中的中间体。
附图说明
[0217]
图1显示了根据实施例4,igrov1-r10卵巢癌细胞系上的crbn表达。
[0218]
图2示出了根据实施例4,igrov1-r10细胞暴露于1μm的pyridoclax或1μm的crbn-pbm1-001 24h后,mcl-1和bcl-xl的表达,该表达通过western blot信号的密度分析来定量。
具体实施方式
[0219]
实施例
[0220]
实施例1:式(i)化合物的合成
[0221]
下面描述材料和方法。
[0222]
材料
[0223]
商业试剂按收到的使用,没有额外的纯化。熔点在kofler加热台上测定。ir光谱在perkin elmer bx ft-ir分光光度计上记录。频带位置以倒数厘米(cm-1
)给出。在jeol lambda 400谱仪上记录1h nmr(400mhz)和
13
c nmr(100mhz)谱。化学位移以四甲基硅烷作为内标的低场百万分之一表示,并且耦合常数用赫兹表示。相对于溶剂共振,化学位移以百万分之几(ppm)的形式报告。在使用快速硅胶60merck(0.063-0.200mm)作为固定相的柱上进行色谱。通过在0.2mm预涂硅胶60f-264(merck)板上进行的薄层色谱(tlc)来确定每次纯化所需的洗脱溶剂,并用紫外光灯观察斑点。对新化合物进行元素分析,并且c、h、n的数据在所有最终化合物的理论值的
±
0.4以内。
[0224]
方法
[0225]
本发明化合物的合成如下。反应根据下面提到的一般程序按括号中所示的顺序进行:
[0226]
[0227]
[0228]
[0229]
[0230]
[0231]
[0232][0233]
suzuki-miyaura交叉偶联反应的一般程序:在惰性气氛下,向容纳适当的溴或碘吡啶衍生物在1,4-二氧六环(0.2m)中的溶液的反应容器中,加入硼酸反应物(1.1当量)、四
(三苯基膦)钯(0)(5mol%)和饱和k3po4水溶液(2.5当量)。将混合物回流至完成反应(由tlc监测)。将混合物冷却至室温,用水淬灭,并用乙酸乙酯萃取。收集有机层,用盐水洗涤,用无水硫酸镁干燥,过滤,减压浓缩,得到粗残余物,将其通过柱色谱进行纯化。
[0234]
亲核芳香取代sn
ar
的一般程序:
[0235]
将该胺溶解于干燥的dmso和dipea(n,n-二异丙基乙胺)(2-4当量)中。加入氟或氯(吡啶基)或(苄基)化合物(1.0当量),并将混合物在90℃搅拌直到完成反应(由tlc监测)。冷却至室温后,将混合物倒入半饱和盐水中,并用etoac萃取。合并的有机层用饱和nh4cl溶液、5%licl溶液和盐水进一步洗涤。有机层用na2so4干燥,过滤并在真空中浓缩。
[0236]
亲核取代sn2的一般程序:向容纳在dmf中的苯酚化合物(1.0当量)的反应容器中,在0℃下加入碘烷烃(2.0当量)和k2co3(4.0当量)。将反应混合物在室温下搅拌直到完成反应(由tlc监测)。混合物用乙酸乙酯萃取。合并的有机层用盐水洗涤,用无水硫酸镁干燥,过滤并减压浓缩,得到粗残余物,将其通过柱色谱进行纯化。
[0237]
铜(i)催化的叠氮-炔烃环加成cuacc的一般程序:
[0238]
在惰性气氛下,向在
t
buoh-thf(1:1,v/v)中的叠氮化合物(1.0当量)和炔烃化合物(1.33当量)的混合物中,加入在水中的cuso4·
5h2o(2.2当量)和l-抗坏血酸钠(2.2当量)。在55℃搅拌混合物直到完成反应(由tlc监测)并冷却到室温。然后将其倒入水中,用dcm提取。有机相用盐水洗涤,用na2so4干燥,过滤并蒸发至干。粗产物以dcm和meoh为洗脱剂,通过硅胶快速柱色谱进行纯化。
[0239]
腈水解的一般程序:
[0240]
将苯甲腈化合物(1.0当量)在naoh(2n)和meoh的混合物中,在100℃搅拌直到完成反应(由tlc监测)。反应混合物在室温下冷却。反应混合物用acoh酸化,直到出现沉淀。将沉淀过滤。
[0241]
肽偶联反应的一般程序:
[0242]
将羧酸化合物(1.0当量)溶解在干燥dmf中,并在惰性气氛下加入dipea(3.0当量)和hatu(1.1当量)。搅拌5min后,加入溶解在干燥dmf中的胺衍生物(1.1当量)。在室温下搅拌合并的混合物直到完成反应(由tlc监测)。加入半饱和盐水,并用etoac萃取。合并的有机层用饱和nh4cl溶液、5%licl溶液和盐水进一步洗涤。有机层用na2so4干燥,过滤并在真空中浓缩。
[0243]
boc-脱保护与hatu耦联的一般程序:
[0244]
将boc保护的接头偶联物(1.0当量)溶解于干燥ch2cl2中,并用三氟乙酸处理。在室温下搅拌混合物直到完成反应。除去溶剂并与干燥ch2cl2共蒸发。将油状残余物在高真空中进一步干燥。将脱保护酸衍生物(1.0当量)溶解于干燥dmf中,并加入dipea(3.0当量)和hatu(1.1当量)。搅拌5min后,加入溶解在干燥dmf中的胺衍生物(1.1当量)。在室温下搅拌合并的混合物直到完成反应(由tlc监测)。加入半饱和盐水,并用etoac萃取。合并的有机层用饱和nh4cl溶液、5%licl溶液和盐水进一步洗涤。有机层用na2so4干燥,过滤并在真空中浓缩。
[0245]
上述起始化合物如下获得:
[0246][0247]
类似于wo2015132727中描述的。
[0248]
当ar1选自由-o-(c
6-c
10
)芳基、-o-(5-7元)杂芳基、-s-(c
6-c
10
)芳基、-s-(5-7元)杂芳基、-(c
1-c6)烷基-(c
6-c
10
)芳基、-(c
1-c6)烷基-(5-7元)杂芳基,ar1基团可按如下所示类似地引入:
[0249][0250]
亲核芳香取代sn
ar
的一般程序:向容纳在dmso中的(e)-6-溴-5-甲基-3'-苯乙烯基-3,2':5',3'-三联吡啶(1.0当量)的反应容器中,加入苯硫醇(1.0当量)和k2co3(2.0当量)。将反应混合物在110℃下搅拌48h,原料转化率仅为50%。向反应混合物中再充入苯硫醇(1.0当量)和k2co3(2.0当量),24h后反应完成。将混合物冷却至室温,用水淬灭,并用dcm萃取。合并的有机层用盐水洗涤,无水硫酸镁干燥,过滤,并减压浓缩,得到粗残余物,将其通过柱色谱(dcm/meoh 95/5至9/1)进行纯化。
[0251]
乌尔曼型(ullman-type)偶联反应的一般程序:向容纳在dmf中的(e)-6-溴-5-甲基-3'-苯乙烯基-3,2':5',3'-三联吡啶(1.0当量)的反应容器中,加入苯酚(1.0当量)、铜(0)粉(10%)和cs2co3(3.0当量)。将反应混合物在100℃下搅拌24h。将混合物冷却至室温,用naoh 1m溶液淬灭,并用dcm萃取。合并的有机层用盐水洗涤,用无水硫酸镁干燥,过滤,并在减压下浓缩,得到粗残余物,将其通过柱色谱(dcm/meoh 98/2)进行纯化。
[0252]
钯催化的negishi交叉偶联反应的一般程序:在氮气气氛下,向容纳在干燥thf中的(e)-6-溴-5-甲基-3'-苯乙烯基-3,2':5',3'-三联吡啶(1.0当量)的反应容器中,加入0.5m的苄基溴化锌(ⅱ)(1.0当量)和四(三苯基膦)钯(0)(10%)。将反应混合物在室温下搅拌48h。将混合物减压浓缩得到粗残余物,将其通过柱色谱(dcm/meoh 99/1至9/1)进行纯化。
[0253]
实施例2:式(i)的化合物的生物活性
[0254]
细胞核的形态学观察
[0255]
处理后,将分离的和贴壁的细胞在胰蛋白酶消化后汇集,通过细胞离心作用施加到聚赖氨酸包被的载玻片上,并用乙醇/氯仿/乙酸(6:3:1)溶液固定。然后将制剂用1溶液固定。然dapi溶液(boehringer mannheim-roche,mannheim,德国)在室温下孵育15min,在蒸馏水中洗涤,安装在mowiol(calbiochem)的盖板下,并在荧光显微镜(bx51,olympus,rungis,法国)下分析。浓缩和碎裂的细胞核表明细胞凋亡的诱导。
[0256]
靶表达及通过western blot的凋亡诱导分析
[0257]
将细胞用冰冷的pbs漂洗,悬浮在裂解缓冲液[ripa:nacl 150mm,tris(ph 8)50mm,triton x100 1%,pmsf 4mm,edta 5mm,naf 10mm,nappi 10mm,na3ov4 1mm,抑肽酶0.5μl/ml和4.6ml超纯水]中,在冰上孵育30min。离心(13200g,10min,4℃)后收集裂解物,并使用bradford测定(bio-rad,hercules,美国)测定蛋白质浓度。在4-15%梯度聚丙烯酰胺tgx
tm
预制凝胶(bio-rad)上,通过sds-page分离等量的蛋白质(20μg),然后转移到pdvf膜(bio-rad)上。室温下,用在含有0.05%(v/v)tween20的tbs(t-tbs)中的5%(v/v)脱脂奶粉,将膜封闭1h。然后将膜与上面列出的适当抗体在4℃下孵育过夜。然后用t-tbs洗涤膜,并与适当的二次抗体孵育1h。使用增强化学发光底物(ecl)prime western blot检测试剂(ge healthcare life sciences)和las4000series(ge healthcare life sciences)显示信号,然后使用软件通过像素密度测定法进行量化。
[0258]
使用的抗体:抗-mcl-1(#5453)、抗-bcl-x
l
(#2764)、抗-caspase 3(#9662)、抗-parp(#9542)、(细胞信号技术),抗-actin(#mab1501)(merck millipore)和抗-vhl(#gtx101087)(genetex)。
[0259]
使用流式细胞术的凋亡事件定量
[0260]
将贴壁和漂浮细胞汇集,用磷化缓冲盐水(pbs)洗涤,并用70%乙醇固定。然后将细胞在2000r.p.m下离心5min,并在37℃下于pbs中孵育30min,以允许低分子量dna的释放。使用dna prep coulter试剂盒(beckman coulter),用碘化丙啶对细胞团块进行染色。用gallios流式细胞仪(beckman coulter)分析样品,并且用gallios软件(beckman-coulter)测定细胞周期分布。
[0261]
实时细胞活性分析(阻抗测量法、xcelligence技术)
[0262]
用实时细胞分析仪多板仪器,使用xcelligence系统(acea,ozyme,saint quentin en yvelines,法国)进行实时生长曲线监测。该系统通过测量集成在96孔e板view底面的交错微电极上的电阻抗来实时监测细胞事件。这些电极基于阻抗测量ci(细胞指数)。ci与附着在板底的细胞的面积相关。ci值显示在图中。简而言之,将细胞镀在96孔e板view上,并放置在组织培养箱内的rtca mp上。在治疗前使细胞生长24h,并连续测量阻抗,直到治疗结束。使用rtca2.1.0软件分析一式三份孔的标准偏差。
[0263]
实时细胞成像
[0264]
将细胞接种在培养基中的96孔板中。将细胞维持在37℃和5%co2下,并使用s3(essen bioscience)进行监测。治疗后第二天加入caspase-3/7绿色细胞凋亡检测试剂(essen bioscience),并用10倍物镜拍摄基线图像。每1小时从每个孔的2个独立区域实时获取荧光和相差图像。caspase 3/7试剂标记产生绿色荧光的死细胞。活细胞相差图像用于使用软件来计算融合度,并提供形态信息。每个实验一式三份进行,将caspase 3/7的随着时间推移的积累归一化为细胞的融合度。
[0265]
通过免疫组织化学法的e3连接酶表达表征
[0266]
在4μ动厚的石蜡切片上进行用ventana discovery xt自动染色机的免疫组织化学法。载玻片用ezprep缓冲液脱蜡,表位通过在cc1 edta缓冲液中高温处理15min后揭开。切片在37℃下用针对各种e3连接酶的抗体孵育40min,其中抗vhl(gtx101087)(genetex)。二次抗体(omnimap兔;ventana medical system inc.,tucson,az,美国)在室温下孵育16min。在没有一次抗体的情况下进行的免疫检测用作对照。洗涤后,用dab进行染色,并根据制造商的方案使用ventana试剂用苏木精对切片进行复染。然后使用aperio scanscope载玻片扫描仪(aperio technologies,vista,ca,美国)对染色的载玻片进行数字化。
[0267]
通过elisa进行蛋白质定量
[0268]
比色elisa测定可以定量分析靶蛋白表达。一次抗体靶向感兴趣的蛋白质。二次抗体识别一次抗体,并且偶联到hrp允许比色检测。用于elisa测定的试剂盒可以是用于bcl-x
l
的okag00550和用于mcl-1的okag00858,并且根据制造商的建议应用程序。
[0269]
结果
[0270]
本发明化合物诱导bcl-2、mcl-1、bcl-x
l
、bcl-w、bfl-1或bcl-b蛋白,特别是bcl-2蛋白,或bcl-xl和/或mcl-1蛋白的蛋白水解。
[0271]
不受任何特定理论的束缚,据信它们募集了针对所述靶蛋白的e3连接酶,这使得能够泛素化以及随后通过蛋白酶体对靶蛋白降解。
[0272]
实施例3:本发明其它化合物的合成
[0273]
如下所示,在某些示例性实施方式中,根据以下一般程序制备化合物。应当理解,尽管一般方法描述了本发明某些化合物的合成,但以下一般方法和本领域普通技术人员已知的其他方法可以应用于所有化合物和这些化合物中的每一个的亚类和物种,如本文所述。
[0274]
一般合成方法
[0275]
以下实施例旨在说明本发明,而不应被解释为对本发明的限制。温度以摄氏度表示。如果没有另外提到,所有蒸发都在减压下,优选在大约15毫米汞柱和100毫米汞柱之间(=20-133mbar)进行。最终产物、中间体和起始原料的结构由标准分析方法如显微分析和
光谱特征如ms、ir、nmr确认。所使用的缩写是本领域中的那些常规缩写。
[0276]
用于合成本发明化合物的所有起始原料、构建块、试剂、酸、碱、脱水剂、溶剂和催化剂要么是市售的,要么可以通过本领域普通技术人员已知的有机合成方法生产。此外,本发明的化合物可以通过本领域普通技术人员已知的有机合成方法生产,如以下实施例所示。
[0277]
除非另有说明,所有反应都在氮气或氩气下进行。
[0278]
分析仪器
[0279][0280]
除另有说明外,所有溶剂和化学品均按买来直接使用。所有的nmr谱都在bruker avance iii 400mhz或avance iii hd 500mhz光谱仪上记录。1h-和
13
c nmr光谱以百万分之一(ppm)为单位的化学位移(δ)来报告。耦合常数(j)以赫兹(hz)为单位报告,精确到小数点后一位。以下缩写用于描述多重态:s(单重态)、d(双重态)、t(三重态)、q(四重态)、m(多重态)、br(宽峰)。使用perkin elmer ft-ir光谱仪将红外光谱记录为纯化合物。吸收以波数(cm-1
)报告,并且只报告感兴趣的峰。用griffin仪器测量固体的熔点。lc-ms采用waters sq探测器作为质谱仪以及waters alliance 2695作为分离模块(色谱柱xbridge c18 2.5mm/4.6 50mm),采用以下梯度进行:在4.00min内,a(h2o,含0.1%的hco2h)/b(ch3cn,含0.1%的hco2h)95/5至a/b 5/95。保持该比值1.50min,然后返回初始条件0.50min,然后保持初始条件2.00min,所分析的分子的保留时间(tr)以min表示。除非另有说明,所有试剂都是从商业供应商那里获得。以60merck(0.063-0.200mm)快速硅胶为固定相进行色谱。采用biotage isolera one快速色谱进行快速色谱。通过用merck 0.2mm硅胶预涂板和kieselgel 60f264进行的薄层色谱(tlc)确定每次纯化所需要的洗脱溶剂。使用uv荧光(254nm)将产物进行可视化。
[0281]
构建块的合成方法
[0282][0283]
5-溴-3-碘吡啶-2-醇1。向容纳在乙腈(120ml)中的5-溴吡啶-2-醇(5.0g,28.7mmol)的圆底烧瓶中,加入n-碘代丁二酰亚胺(7.1g,31.6mmol,1.1当量)。将溶液回流4h,反应后进行tlc。将悬浮液冷却至室温,过滤固体并用meoh洗涤,得到7.1g的粉红色固体1(83%产率)。
[0284]
化学式:c5h3brino;分子量:299.89g/mol;熔点:63℃。
[0285]
ir(kbr压片):3490,1630,1607,1522,1457,1309,863,683,628cm-1
。
[0286]1h nmr(cdcl3)δ8.14(d,j=2.5hz,1h),7.59(d,j=2.5hz,1h),4.20(br s,1h,oh)。
[0287]
13
c nmr(cdcl3)δ171.5,146.8,145.9,100.7,92.9。
[0288]
ms(esi ):m/z 300.25[m h
],302.26[m
2]。
[0289]
5-溴-2-氯-3-碘吡啶2。将5-溴-3-碘吡啶-2-醇1(9.0g,30.0mmol)溶于90%二氯苯基膦(100ml)中。将混合物搅拌并在160℃下加热4h,然后进行tlc。将混合物冷却至室温,通过缓慢加入1升装有冰和28%氨水(200ml)的烧瓶中进行淬灭。混合物用乙酸乙酯萃取,收集有机层,用盐水洗涤,用无水硫酸镁干燥,过滤,减压浓缩,得到粗残余物,将其通过柱色谱(环己烷/乙酸乙酯9/1)进行纯化,得到7.8g的白色固体2(82%产率)。
[0290]
化学式:c5h2brclin;分子量:318.34g/mol;熔点:67℃。
[0291]
ir(kbr压片):3081,3038,1525,1391,1352,1136,1012,890,711,515cm-1
。
[0292]1h-nmr(cdcl3)δ8.40(d,j=2.3hz,1h),8.29(d,j=2.3hz,1h)。
[0293]
13
c-nmr(cdcl3)δ153.2,150.2,149.6,118.4,95.3。
[0294]
ms(esi ):m/z 318.17[m h
],320.14[m
2],322.15[m
4]。
[0295]
(e)-5-溴-2-氯-3-苯乙烯基吡啶3。在氮气气氛下,向容纳在正丁醇(300ml)中的5-溴-2-氯-3-碘吡啶2(13.0g,40.8mmol)的反应容器中,加入(e)-苯乙烯基硼酸(9.0g,61.2mmol,1.5当量)、pd(dppf)cl
2-dcm(166mg,0.21mmol,0.5mol%)和k2co3(11.3g,81.6mmol,2.0当量)。将混合物回流搅拌过夜。将混合物冷却至室温,用水淬灭,用乙酸乙酯萃取。收集有机层,用盐水洗涤,用无水硫酸镁干燥,过滤,然后减压浓缩,得到粗残余物,将其通过柱色谱进行(环己烷/乙酸乙酯99/1,然后98/2)纯化,得到9.6g的白色固体3(80%产率)。
[0296]
化学式:c
13
h9brcln;分子量:294.58g/mol;熔点:104℃。
[0297]
ir(kbr压片):3036,1627,1530,1494,1447,1389,1152,1116,1063,956,897,755,719,687,491cm-1
。
[0298]1h-nmr(cdcl3)δ8.35(d,j=2.5hz,1h,h
pyr
),8.11(d,j=2.5hz,1h,h
pyr
),7.57(d,j=7.4hz,2h,h
ar
),7.42(t,j=7.4hz,2h,h
ar
),7.38
–
7.34(m,1h,h
ar
),7.27(d,j=16.3hz,1h,ar-ch=ch-pyr),7.12(d,j=16.3hz,1h,ar-ch=ch-pyr)。
[0299]
13
c-nmr(cdcl3)δ148.6,148.5,136.7,135.9,134.6(ar-ch=ch-pyr),133.7,129.1,128.9(2c
ar
h),127.1(2c
ar
h),121.9(ar-ch=ch-pyr),119.3。
[0300]
ms(esi ):m/z 294.33[m h
],296.30[m
2],298.30[m
4]。
[0301][0302]
(e)-6-氯-5-苯乙烯基-3,3'-联吡啶4。在氮气气氛下,向容纳在1,4-二氧六环中的(e)-5-溴-2-氯-3-苯乙烯基吡啶3(3.8g,12.7mmol)的反应容器中,加入吡啶-3-基硼酸(1.7g,14.0mmol,1.1当量)、四(三苯基膦)钯(0)(734mg,0.64mmol,5mol%)和k3po4(6.7g,31.8mmol,2.5当量)。将混合物回流2h,然后进行tlc。将粗残余物通过柱色谱(环己烷/乙酸乙酯4/1至1/1)进行纯化,得到3.0g的白色固体4(80%产率)。
[0303]
化学式:c
18h13
cln2;分子量:292.77g/mol;熔点:159℃。
[0304]
ir(kbr压片):3045,3019,2924,2853,1638,1578,1446,1427,1385,1166,1087,1057,1023,951,921,804,729,714,687cm-1
。
[0305]1h-nmr(cdcl3)δ8.90(d,j=2.4hz,1h,h
pyr
),8.72(dd,j=4.9,1.6hz,1h,h
pyr
),8.51(d,j=2.4hz,1h,h
pyr
),8.16(d,j=2.4hz,1h,h
pyr
),7.95(ddd,j=7.9,2.4,1.6hz,1h,h
pyr
),7.61
–
7.59(m,2h,h
ar
),7.49
–
7.41(m,4h,h
pyr
,3h
ar
,ar-ch=ch-pyr),7.38
–
7.34(m,1h,h
ar
),7.21(d,j=16.3hz,1h,ar-ch=ch-pyr)。
[0306]
13
c-nmr3)δ150.0,149.5,147.9,146.1,136.2,136.1,134.7,134.0(ar-ch=ch-pyr),132.9,132.9,132.5,132.3,128.9(2c
ar
h),127.1(2c
ar
h),123.9,122.7(ar-ch=ch-pyr)。
[0307]
ms(esi ):m/z 293.35[m h
],295.34[m
2]。
[0308]
(e)-6-碘-5-苯乙烯基-3,3'-联吡啶5。向(e)-6-氯-5-苯乙烯基-3,3'-联吡啶4(3.5g,12.1mmol)的在乙腈中的溶液中,加入nai(4.5g,4.8mmol,2.5当量)和乙酰氯(1.4g,18.1mmol,1.5当量)。将反应混合物回流16h,得到4.3g粗残余物(80%的5,由1h-nmr确认),为黄色固体,用于下一反应,而无需进一步纯化。
[0309]
化学式:c
18h13
in2;分子量:384.22g/mol;熔点:160℃。
[0310]
ir(kbr压片):3079,3045,3023,2924,1634,1574,1544,1495,1453,1420,1381,1163,1087,1060,1023,959,914,805,729,712,680cm-1
。
216
[0311]1h-nmr(cdcl3)δ8.89(dd,j=2.4,0.9hz,1h,h
pyr
),8.71(dd,j=4.8,1.7hz,1h,h
pyr
),8.46(d,j=2.4hz,1h,h
pyr
),7.95(d,j=2.4hz,1h,h
pyr
),7.93(ddd,j=7.9,2.4,1.7hz,1h,h
pyr
),7.61
–
7.59(m,2h,h
ar
),7.48
–
7.41(m,3h,2h
ar
,pyr-h),7.38
–
7.34(m,2h,h
ar
),7.29(d,j=16.1hz,1h,ar-ch=ch-pyr),7.11(d,j=16.1hz,1h,ar-ch=ch-pyr)。
[0312]
13
c-nmr3)δ149.1、148.0、144.8、140.7、135.4、135.2、134.1、133.4、133.2、132.9、128.7(2c
ar
h),128.0,127.4,126.4(2c
ar
h),124.0,115.9。
[0313]
ms(esi ):m/z 385.41[m h
],386.40[m
1]。
[0314]
(e)-6-溴-5-甲基-3'-苯乙烯基-3,2':5',3'-三联吡啶6。在氮气气氛下,向容纳在1,4-二氧六环中的(e)-6-碘-5-苯乙烯基-3,3'-联吡啶5(1.5g,3.9mmol)的反应容器中,加入(6-溴-5-甲基吡啶-3-基)硼酸(930mg,4.3mmol,1.1当量)、四(三苯基膦)钯(0)(225mg,0.19mmol,5mol%)和k3po4(2.0g,9.8mmol,2.5当量)。将混合物回流4h,然后进行tlc。粗残余物通过柱色谱(环己烷/乙酸乙酯95/5至4/1)进行纯化,得到751mg的黄色固体6(45%产率)。
[0315]
化学式:c
24h18
brn3;分子量:428.33g/mol;熔点:149℃。
[0316]
ir(kbr压片):3039,1588,1557,1490,1438,1379,1190,1120,1053,1023,970,907,804,746,708,721,686,540cm-1
。
[0317]1h-nmr(cdcl3)δ8.96(dd,j=2.4,0.8hz,1h,h
pyr
),8.83(d,j=2.2hz,1h,h
pyr
),8.72(dd,j=4.8,1.6hz,1h,h
pyr
),8.50(d,j=2.4hz,1h,h
pyr
),8.21(d,j=2.2hz,1h,h
pyr
),8.00(dt,j=7.9,2.0hz,1h,h
pyr
),7.92(d,j=2.4hz,1h,h
pyr
),7.50
–
7.44(m,3h,2h
ar
,h
pyr
),7.40
–
7.29(m,3h,h
ar
),7.22(d,j=16.2hz,1h,ar-ch=ch-pyr),7.14(d,j=16.2hz,1h,ar-ch=ch-pyr),2.49(s,3h,ch3)。
[0318]
13
c-nmr(cdcl3)δ152.8,149.8,148.4,148.1,147.0,145.0,139.9,136.4,135.3,134.7,134.6,133.5,133.2,133.1,132.8,132.2,129.0(2c
ar
h),128.8,127.0(2c
ar
h),124.5,124.0,22.2(ch3)。
[0319]
ms(esi ):m/z 428.24[m h
],430.29[m
2]。
[0320][0321]
(e)-5-溴-2-碘-3-苯乙烯基吡啶7。向容纳在乙腈中的(e)-5-溴-2-氯-3-苯乙烯基吡啶3的反应容器中,加入nai(6.1g,40.8mmol,2.5当量)和乙酰氯(2.0g,24.5mmol,1.5当量)。反应混合物回流12h,得到5.22g粗残余物(80%的7,由1h-nmr确认),为黄色固体,无需进一步纯化即可用于下一反应。
[0322]
化学式:c
13
h9brin;分子量:386.03g/mol;熔点:78℃。
[0323]
ir(kbr压片):3054,3023,1629,1492,1446,1377,1269,1109,1026,952,889,
751cm-1
。
[0324]1h-nmr(cdcl3)δ8.29(d,j=2.0hz,1h,h
pyr
),7.83(d,j=2.0hz,1h,h
pyr
),7.52(d,j=7.8hz,2h,h
ar
),7.38(t,j=7.8hz,2h,h
ar
),7.32(d,j=7.8hz,1h,h
ar
),7.09(d,1h,j=16.1hz,ar-ch=ch-pyr),6.94(d,j=16.1hz,1h,ar-ch=ch-pyr)。
[0325]
13
c-nmr(cdcl3)δ149.6,139.6,135.9,135.1,134.7,129.0,128.9(2c
ar
h),128.1,127.1(2c
ar
h),121.1,120.8。
[0326]
ms(esi ):m/z 386.31[m h
],388.24[m
2]。
[0327]
(e)-5,6'-二溴-5'-甲基-3-苯乙烯基-2,3'-联吡啶8。在氮气气氛下,向容纳在1,4-二氧六环中的(e)-5-溴-2-碘-3-苯乙烯基吡啶7(3.0g,7.7mmol)的反应容器中,加入(6-溴-5-甲基吡啶-3-基)硼酸(1.8g,8.4mmol,1.1当量)、四(三苯基膦)钯(0)(445mg,0.38mmol,5mol%)和k3po4(4.1g,19.3mmol,2.5当量)。将混合物回流4h,然后进行tlc。粗残余物通过柱色谱(环己烷/乙酸乙酯99/1至95/5)进行纯化,得到1.8g的黄色固体8(55%产率)。
[0328]
化学式:c
19h14
br2n2;分子量:430.14g/mol;熔点:143℃。
[0329]
ir(kbr压片):3031,1393,1111,1050,968,898,740,685,499cm-1
。
[0330]1h-nmr(cdcl3)δ8.65(d,j=1.9hz,1h,h
pyr
),8,41(d,j=1.9hz,1h,h
pyr
),8.17(d,j=1.9hz,1h,h
pyr
),7.83(d,j=1.9hz,1h,h
pyr
),7.42(d,j=7.8hz,2h,h
ar
),7.36(t,j=7.8hz,2h,h
ar
),7.31(d,j=7.8hz,1h,h
ar
),7.12(d,j=16.6hz,1h,ar-ch=ch-pyr),6,99(d,j=16.6hz,1h,ar-ch=ch-pyr),2.46(s,3h,ch3)。
[0331]
13
c-nmr(cdcl3)δ151.4,149.4,147.8,144.9,139.6,136.5,136.0,135.2,134.0,133.9,133.3,128.9(2c
ar
h 128.8,126.9(2c
ar
h),123.4,120.4,22.0(ch3)。
[0332]
ms(esi ):m/z 431.51[m h
],433.53[m
2]。
[0333]
(e)-5-溴-6'-碘-5'-甲基-3-苯乙烯基-2,3'-联吡啶9。向(e)-5,6'-二溴-5'-甲基-3-苯乙烯基-2,3'-联吡啶8(3.8g,8.9mmol)在乙腈中的溶液中,加入nai(3.3g,22.3mmol,2.5当量)和乙酰氯(1.0g,13.4mmol,1.5当量)。将反应混合物回流8h,得到4.0g粗残余物(90%的9,由1h-nmr确认),为黄色固体,无需进一步纯化即可用于下一反应。
[0334]
化学式:c
19h14
brin2;分子量:477.14g/mol;熔点:147℃。
[0335]
ir(kbr压片):3029,1576,1449,1428,1389,1112,1089,968,900,686,498cm-1
。
[0336]1h-nmr(cdcl3)δ8.66(d,j=2.3hz,1h,h
pyr
),8.38(d,j=2.3hz,1h,h
pyr
),8.16(d,j=2.3hz,1h,h
pyr
),7.73(d,j=2.3hz,1h,h
pyr
),7.44(d,j=7.4hz,2h,h
ar
),7.38(t,j=7.4hz,2h,h
ar
),7.34
–
7.30(m,1h,h
ar
),7.14(d,j=16.2hz,1h,ar-ch=ch-pyr),6.98(d,j=16.2hz,1h,ar-ch=ch-pyr),2.48(s,3h,ch3)。
[0337]
13
c-nmr(cdcl3)δ151.4,149.5,148.1,139.2,137.5,136.5,135.9,134.0,133.9,133.3,128.9(2c
ar
h),128.8,126.9(2c
ar
h),125.6,123.4,120.4,26.2(ch3)。
[0338]
ms(esi ):m/z 477.48[m h
],479.54[m
2]。
[0339]
(e)-5-溴-5'-甲基-3-苯乙烯基-2,3':6',3
”‑
三联吡啶10。在氮气气氛下,向容纳在1,4-二氧六环中的(e)-5-溴-6'-碘-5'-甲基-3-苯乙烯基-2,3'-联吡啶9(2.0g,4.2mmol)的反应容器中,加入吡啶-3-基硼酸(570mg,4.6mmol,1.1当量)、四(三苯基膦)钯(0)(243mg,0.2mmol,5mol%)和k3po4(2.3g,10.5mmol,2.5当量)。将混合物回流3h,然后进
行tlc。粗残余物通过柱色谱(环己烷/乙酸乙酯8/2至1/1)进行纯化,得到1.1g的类白色固体10(60%产率)。
[0340]
化学式:c
24h18
brn3;分子量:428.33g/mol;熔点:136-138℃。
[0341]
ir(kbr压片):3032,2917,1635,1414,1384,1118,950,740,541cm-1
。
[0342]1h-nmr(cdcl3)δ8.88(dd,j=2.3,0.9hz,1h,h
pyr
),8.78(dd,j=2.1,0.7hz,1h,h
pyr
),8.69(d,j=2.2hz,1h,h
pyr
),8.68(dd,j=4.9,1.7hz,1h,h
pyr
),8.21(d,j=2.1hz,1h,h
pyr
),7.97(ddd,j=7.8,2.3,1.7hz,1h,h
pyr
),7.95(dd,j=2.2,0.8hz,1h,h
pyr
),7.45(m,3h,2h
ar
,h
pyr
),7.38
–
7.28(m,3h,h
ar
),7.16(d,j=16.2hz,1h,ar-ch=ch-pyr),7.11(d,j=16.2hz,1h,ar-ch=ch-pyr),2.48(s,3h,ch3)。
[0343]
13
c-nmr(cdcl3)δ155.5,152.4,149.9,149.6,149.3,148.1,139.9,136.9,136.6,136.3,133.9,133.8(ar-ch=ch-pyr),133.6,132.3,131.4,129.0(2c
ar
h),128.9,127.1(2c
ar
h),123.8(ar-ch=ch-pyr),123.5,120.4,20.2(ch3)。
[0344]
ms(esi ):m/z 428.74[m h
],430.62[m
2]。
[0345]
hrms(esi):m/z计算值,对[m h]
:428.0762;发现值:428.0772。
[0346][0347]
(e)-5-溴-6'-(2-羟基苯基)-5'-甲基-3-苯乙烯基-2,3'-联吡啶11。在氮气气氛下,向容纳在1,4-二氧六环(20ml)中的(e)-5-溴-6'-碘-5'-甲基-3-苯乙烯基-2,3'-联吡啶9(356mg,0.75mmol,1.0当量)的反应容器中,加入2-羟基苯基硼酸(120mg,0.83mmol,1.1当量)、四(三苯基膦)钯(0)(43mg,0.04mmol,5mol%)和k3po4(398mg,1.88mmol,2.5当量)。将混合物回流24h,然后进行tlc。粗残余物通过柱色谱(环己烷/乙酸乙酯100/0~90/10)进行纯化,得到183mg的类白色固体11(55%产率)。
[0348]
化学式:c
25h19
brn2o;分子量:443.34g/mol。
[0349]
nmr 1
h(400mhz,cdcl3):δ(ppm)=12.15(s,1h),8.61(dd,j=9.6,2.2hz,2h),8.13(d,j=2.2hz,1h),7.96(d,j=2.2hz,1h),7.56(dd,j=7.9,1.7hz,1h),7.38(d,j=6.9hz,1h),7.29(t,j=7.4hz,1h),7.25(d,j=7.0hz,1h),7.09(d,j=16.2hz,1h),7.05
–
6.97(m,4h),6.88(td,j=7.6,1.3hz,1h),2.59(s,3h)。
[0350]
nmr 13
c(75mhz,cdcl3):δ(ppm)=157.98,156.42,151.84,149.55,144.98,141.95,136.62,136.10,133.78,133.43,132.61,131.61,130.89,129.80,128.99,128.84,126.93,123.59,121.24,120.36,118.56,118.17,21.94。
[0351]
(e)-5-溴-6'-(2-丙氧基苯基)-5'-甲基-3-苯乙烯基-2,3'-联吡啶12。向容纳在dmf(10ml)中的(e)-5-溴-6'-(2-羟基苯基)-5'-甲基-3-苯乙烯基-2,3'-联吡啶11(163mg,0.37mmol,1.0当量)的反应容器中,加入1-碘丙烷(54μl,0.55mmol,1.5当量)和k2co3(102mg,0.74mmol,2当量)。将反应混合物在50℃下搅拌17h。混合物用乙酸乙酯萃取。合并的有机层用盐水洗涤,用无水硫酸镁干燥,过滤并减压浓缩,得到粗残余物,将其通过柱色
谱(环己烷/乙酸乙酯100/0至90/10)纯化,得到147mg的黄色固体12(82%产率)。
[0352]
化学式:c
28h25
brn2o;分子量:485.43g/mol。
[0353]
nmr 1
h(400mhz,cdcl3):δ(ppm)=8.65(d,j=2.1hz,1h),8.62(d,j=2.2hz,1h),8.14(d,j=2.2hz,1h),7.77(dd,j=2.2,0.9hz,1h),7.39
–
7.35(m,2h),7.34
–
7.21(m,5h),7.07(s,2h),7.00(td,j=7.5,1.0hz,1h),6.91(dd,j=8.2,1.0hz,1h),3.86(t,j=6.5hz,2h),2.19(s,1h),1.61(h,j=7.3hz,2h),0.81(t,j=7.4hz,3h)。
[0354]
nmr 13
c(75mhz,cdcl3):δ(ppm)=157.47,156.16,149.35,147.06,138.04,136.33,136.29,133.37,133.19,132.86,132.74,130.59,129.86,129.66,128.84,128.60,126.91,124.10,120.76,112.06,69.86,22.59,19.10,10.59。
[0355][0356]
(e)-6'-(2-丙氧基苯基)-5'-甲基-5-(6-氟吡啶-3-基)-3-苯乙烯基-2,3':6',3
”‑
三联吡啶13。在氮气气氛下,向容纳在1,4-二氧六环(20ml)中的(e)-5-溴-6'-(2-丙氧基苯基)-5'-甲基-3-苯乙烯基-2,3'-联吡啶12(147mg,0.303mmol)的反应容器中,加入商购的6-氟吡啶-3-基硼酸(47mg,0.333mmol,1.1当量)、四(三苯基膦)钯(0)(35mg,0.03mmol,10mol%)和k3po4(225mg,1.06mmol,3.5当量)。将混合物回流26h,然后进行tlc。粗残余物通过柱色谱(二氯甲烷/乙酸乙酯100/0~50/50)纯化,得到17mg的黄色油13(13%产率)。
[0357]
化学式:c
33h28
fn3o;分子量:501.61g/mol。
[0358]1h-nmr(cdcl3):8.76(d,j=2.2hz,1h),8.73(dd,j=2.1,0.7hz,1h),8.50(dt,j=2.7,0.9hz,1h),8.13(d,j=2.3hz,1h),8.04(ddd,j=8.5,7.5,2.7hz,1h),7.85(dd,j=2.2,0.8hz,1h),7.44
–
7.35(m,2h),7.22(s,6h),7.14(d,j=16.2hz,1h),7.06(ddd,j=8.4,3.0,0.7hz,1h),7.01(td,j=7.4,1.0hz,1h),6.92(d,j=8.1hz,1h),3.88(t,j=6.5hz,2h),2.21(s,3h),1.63(dtd,j=13.9,7.4,6.5hz,2h),0.83(t,j=7.4hz,3h)。
[0359]
13
c-nmr(cdcl3)163.7(d,j=240.9hz),157.5,156.2,154.4,147.2,146.6,146.1(d,j=15.1hz),139.9(d,j=8.1hz),138.2,136.5,133.2,132.8,132.4,131.9,131.6,131.4(d,j=4.7hz),130.6,129.9,129.7,128.9,128.5,126.9,124.9,120.8,112.1,110.1(d,j=37.5hz),69.9,22.6,19.1,10.6。
[0360]
19
f nmr(376mhz,cdcl3)δ(ppm)-68.49。
[0361]
最终化合物从化合物12如下获得:
[0362][0363][0364]
(e)-5'-甲基-5-(6-氟吡啶-3-基)-3-苯乙烯基-2,3':6',3
”‑
三联吡啶14。在氮气气氛下,向容纳在1,4-二氧六环中的(e)-5-溴-5'-甲基-3-苯乙烯基-2,3':6',3
”‑
三联吡啶10(214mg,0.5mmol)的反应容器中,加入商购的6-氟吡啶-3-基硼酸(82mg,0.55mmol,1.1当量)、四(三苯基膦)钯(0)(58mg,0.05mmol,10mol%)和k3po4(371mg,1.75mmol,3.5当量)。将混合物回流12h,然后进行tlc分析。粗残余物通过柱色谱(二氯甲烷/乙酸乙酯100/0~20/80)纯化,得到113mg的类白色固体14(51%产率)。
[0365]
化学式:c
29h21
fn4;分子量:444.51g/mol;熔点:212℃。
[0366]
nmr 1
h(400mhz,cdcl3):δ(ppm)=8.85
–
8.83(m,1h),8.79(d,j=2.1hz,1h),8.77(d,j=2.2hz,1h),8.62(dd,j=4.9,1.7hz,1h),8.53
–
8.48(m,1h),8.13(d,j=2.2hz,1h),8.05(ddd,j=8.5,7.5,2.6hz,1h),7.96(dd,j=2.2,0.8hz,1h),7.92(dt,j=7.9,1.9hz,1h),7.44
–
7.35(m,3h),7.33
–
7.27(m,2h),7.27
–
7.21(m,1h),7.18(d,j=2.2hz,1h),7.06(ddd,j=8.5,3.1,0.7hz,1h),2.44(s,3h)。
[0367]
nmr 13
c(75mhz,cdcl3):δ(ppm)=163.75(d,j=241.2hz),155.41,153.59,149.92,149.26,148.10,146.76,146.14(d,j=15.1hz),139.99
–
139.75(m),136.53(d,j=35.2hz),134.09,133.32,132.59,132.15,131.90,131.29,131.23,128.92,128.67,126.91,124.60,110.13(d,j=37.5hz),20.07。
[0368]
nmr 19
f(376mhz,cdcl3):δ(ppm)=-68.28。
[0369][0370]
(e)-5'-甲基-5-(6-(氨基-丙-1-醇)吡啶-3-基)-3-苯乙烯基-2,3':6',3
”‑
三联吡啶15。3-氨基丙-1-醇(19μ1,0.24mmol,2当量)溶解于干燥dmf和dipea(n,n-二异丙基乙胺)(52μ2,0.3mmol,2.5当量)中。加入(e)-5'-甲基-5-(6-氟吡啶-3-基)-3-苯乙烯基-2,
3':6',3
”‑
三联吡啶14(53mg,0.12mmol,1.0当量),并在微波照射下于120℃搅拌混合物5h。冷却至室温后,混合物用etoac稀释,并用水和盐水洗涤。有机层用mgso4干燥,过滤,并真空浓缩。粗残余物通过柱色谱(etoac/meoh 100/0-90/10)进行纯化,得到36mg的淡黄色固体15(61%产率)。
[0371]
外观:黄色粉末
[0372]
化学式:c
32h29
n5o;分子量:499.62g/mol。
[0373]
nmr 1
h(400mhz,cdcl3):δ(ppm)=8.83(d,j=2.3hz,1h),8.77(d,j=2.1hz,1h),8.72(d,j=2.2hz,1h),8.60(dd,j=4.9,1.7hz,1h),8.36(d,j=2.5hz,1h),8.07(d,j=2.3hz,1h),7.94(d,j=2.1hz,1h),7.91(dt,j=7.9,2.1hz,1h),7.67(dd,j=8.6,2.5hz,1h),7.44
–
7.33(m,3h),7.32
–
7.26(m,2h),7.25
–
7.21(m,1h),7.18(d,j=15.9hz,1h),7.15(d,j=16.5hz,1h),6.49(d,j=8.6hz,1h),4.87(t,j=6.4hz,1h),3.64(t,j=5.5hz,2h),3.61
–
3.50(m,2h),2.42(s,3h),1.75(p,j=5.8hz,2h)。
[0374]
nmr 13
c(75mhz,cdcl3):δ(ppm)=158.94,150.00,149.24,148.14,146.20,146.07,139.85,136.69,136.60,136.06,133.42,132.71,131.22,131.17,128.86,128.43,126.86,125.05,123.28,108.72,58.84,38.09,33.34,20.05。
[0375][0376]
2-(2,6-二氧哌啶-3-基)-4-氟-2,3-二氢-1h-异吲哚-1,3-二酮16。在圆底烧瓶中,将商购的3-氟邻苯二甲酸酐(171mg,1mmol)、商购的3-氨基哌啶-2,6-二酮盐酸盐(169mg,1mmol)和乙酸钠(121mg,1.2mmol)在acoh(30ml)中混合。所得反应混合物加热,在90℃回流16h。冷却至室温后,大部分acoh蒸发,并将紫色残留物溶于水(20ml),然后用乙酸乙酯(3
×
50ml)萃取。将合并的有机层干燥(盐水,然后mgso4),然后在真空下浓缩。残余物用环己烷/乙酸乙酯(50/50)通过快速柱色谱进行纯化,得到淡蓝色固体产物(产率:68%)。
[0377]
化学式:c
13
h9fn2o4;分子量:276.22g/mol。
[0378]
nmr 1
h(400mhz,dmso-d6):δ(ppm)=11.15(s,1h,nh),7.99
–
7.92(m,1h,h6),7.80(d,3j=7.2hz,1h,h7),7.77-7.72(m,1h,h5),5.16(dd,3j
ax-ax
=12.8,3j
ax-eq
=5.4hz,1h,h3’
),2.96
–
2.84(m,1h,h4’
),2.65
–
2.52(m,2h,h4’
,h5’
),2.11
–
2.02(m,1h,h5’
)。
[0379]
nmr 13
c(75mhz,dmso-d6):δ(ppm)=173.2(c6’
),170.2(c2’
),166.6(d,3j
cf
=2.9hz,c3),164.4(c1),157.3(d,1j
cf
=262.4hz,c4),138.5(d,3j
cf
=7.9hz,c6),133.9(d,3j
cf
=1.2hz,c
7a
),123.5(d,2j
cf
=19.6hz,c5),120.5(d,4j
cf
=3.2hz,c7),117.5(d,2j
cf
=12.7hz,c
3a
),49.5(c3’
),31.4(c4’
),22.3(c5’
)。
[0380]
nmr 19
f(mhz,dmso-d6):δ(ppm)=-114.7。
[0381]
ms(esi ):m/z:308.90[m meoh h]
,638.52[m 2mecn 2h]
2
,552.59[2m h]
。
[0382]
2-(2,6-二氧哌啶-3-基)-4-((2-(2-丙-2-炔-1-基氧基)乙氧基)乙基)氨基)异吲哚啉-1,3-二酮17。在圆底烧瓶中,将在干燥的dmf(5ml)中的4-氟-沙利度胺16(120mg,
0.44mmol)、胺接头(75μ5,0.53mmol,1.2当量)和diea(150am,0.87mmol,3当量)在90℃下搅拌16h。反应混合物用20ml乙酸乙酯稀释,有机相用水(5
×
10ml)洗涤,然后干燥(盐水,然后mgso4),并在减压下蒸发。残留物使用乙酸乙酯在环己烷中的梯度(0%-70%)通过柱色谱进行纯化,得到绿色固体产物(产率:32%)。
[0383]
化学式:c
20h21
n3o6;分子量:399.40g/mol。
[0384]
nmr 1
h(400mhz,dmso-d6):δ(ppm)=11.16(s,1h,nha),7.64(dd,3j=8.5,3j=7.2hz,1h,h6),7.20(d,j=8.6hz,1h,h5),7.09(d,j=7.2hz,1h,h7),6.66(t,3j=5.6hz,1h,nhb),5.11(dd,3j
ax-ax
=12.9,3j
ax-eq
=5.5hz,1h,h3’
),4.19(d,4j=2.4hz,2h,h
5”),3.69
–
3.65(m,2h,h
2”),3.65
–
3.60(m,4h,h
3”,h
4”),3.53(q,3j=5.6hz,2h,h
1”),3.46(t,4j=2.4hz,1h,h
7”),2.99
–
2.88(m,1h,h4’
),2.69
–
2.58(m,2h,h4’,h5’
),2.13
–
2.04(m,1h,h5’
)。
[0385]
nmr 13
c(75mhz,dmso-d6):δ(ppm)=172.9(c6’
),170.2(c2’
),169.0(c3),167.3(c1),146.4(c4),136.3(c6),132.1(c7a),117.5(c5),110.7(c7),109.3(c
3a
),80.4(c
6”),77.2(c
7”),69.5(c
3”),68.9(c
2”),68.6(c4’
),57.6(c
5”),48.6(c3’
),41.7(c
1”),31.0(c4’
),22.2(c5’
)。
[0386][0387]
3-溴-4-羟基苯甲酸甲酯18。在室温下,向4-羟基苯甲酸甲酯(1g,6.57mmol,1.0当量)在干燥ch2cl2(75ml)中的溶液中,小心地加入二溴化物(0.33ml,65.7mmol,10.0当量)。将混合物在室温下搅拌18h。然后加入乙酸(1ml),并将反应搅拌3h以上。混合物用饱和na2s2o3水溶液、盐水洗涤,干燥(mgso4)并真空浓缩。所得粗残余物通过柱色谱(ch2cl2/meoh 100/0至99/1)进行纯化,得到592mg的白色固体18(39%)。
[0388]
化学式:c8h7bro3;分子量:231.05g/mol;熔点:109℃。
[0389]
nmr 1
h(400mhz,cdcl3):δ(ppm)=8.12(d,j=2.1hz,1h),7.85(dd,j=8.5,2.0hz,1h),6.98(d,j=8.5hz,1h),5.90(s,1h),3.83(s,3h)。
[0390]
nmr 13
c(75mhz,cdcl3):δ(ppm)=165.6,156.2,134.0,131.1,124.1,115.8,110.1,52.2。
[0391]
3-溴-4-丙氧基苯甲酸甲酯19。在室温下,向3-溴-4-羟基苯甲酸甲酯18(462mg,2mmol,1.0当量)在干燥丙酮(20ml)中的溶液中,加入1-碘丙烷(0.29ml,3mmol,1.5当量)和k2co3(553mg,4mmol,2当量)。冷却至室温后,将混合物用etoac稀释,用水、盐水洗涤,干燥(mgso4)并真空浓缩,得到492mg的淡黄色油19(90%)。
[0392]
化学式:c
11h13
bro3;分子量:273.13g/mol。
[0393]
nmr 1
h(400mhz,cdcl3):δ(ppm)=8.14(d,j=2.1hz,1h),7.86(dd,j=8.6,2.1hz,1h),6.79(d,j=8.7hz,1h),3.96(t,j=6.4hz,2h),3.81(s,3h),1.80(h,j=7.3hz,3h),1.01(t,j=7.4hz,3h)。
[0394]
nmr 13
c(75mhz,cdcl3):δ(ppm)=165.80,159.09,134.76,130.51,123.38,111.83,111.81,70.76,52.11,22.38,10.51。
[0395]
3-(4,4,5,5-四甲基-1,3,2-二氧硼烷-2-基)-4-(丙氧基)苯甲酸甲酯20。在氮气气氛下,向容纳在1,4-二氧六环(3.5ml)中的3-溴-4-丙氧基苯甲酸甲酯19(492mg,1.74mmol,1.0当量)的反应容器中,加入商购的双(频哪醇)二硼(664mg,2.62mmol,1.5当量)、双(三苯基膦)二氯化钯(ii)(250mg,0.35mmol,2mol%)和koac(514mg,5.23mmol,3.0当量)。将混合物回流24h,然后进行tlc。粗残余物通过柱色谱(环己烷/乙酸乙酯100/0-80/20)进行纯化,得到285mg的白色固体20(51%产率)。
[0396]
化学式:c
17h25
bo5;分子量:320.19g/mol;熔点:87℃。
[0397]
nmr 1
h(400mhz,cdcl3):δ(ppm)=8.22(d,j=2.4hz,1h),7.99(dd,j=8.7,2.4hz,1h),6.77(d,j=8.8hz,1h),3.91(t,j=6.2hz,2h),3.80(s,3h),1.83
–
1.71(m,2h),1.19(s,12h),1.01(t,j=7.4hz,3h)。
[0398]
nmr 13
c(75mhz,cdcl3):δ(ppm)=167.2,166.9,138.1,134.4,121.8,110.6,83.5,69.8,51.8,25.0,22.6,10.5。
[0399]
11
b nmr(128mhz,cdcl3)δ(ppm):30.73。
[0400][0401]
(e)-5'-甲基-5-(4-(丙氧基)苯甲酸甲酯)-3-苯乙烯基-2,3':6',3
”‑
三联吡啶21。在氮气气氛下,向容纳在1,4-二氧六环(20ml)中的(e)-5-溴-5'-甲基-3-苯乙烯基-2,3':6',3
”‑
三联吡啶10(209mg,0.49mmol,1.0当量)的反应容器中,加入3-(4,4,5,5-四甲基-1,3,2-二氧硼烷-2-基)-4-(丙氧基)苯甲酸甲酯20(235mg,0.73mmol,1.5当量)、四(三苯基膦)钯(0)(5.48mg,0.025mmol,5mol%)和k3po4(363mg,1.71mmol,3.5当量)。将混合物回流19h,然后进行tlc。粗残余物通过柱色谱(环己烷/乙酸乙酯8/2至1/1)进行纯化,得到45mg的白色固体21(产率17%)。
[0402]
化学式:c
35h31
n3o3;分子量:541.24g/mol。
[0403]
nmr 1
h(400mhz,cdcl3):δ(ppm)=8.85
–
8.83(m,1h),8.81
–
8.77(m,2h),8.64
–
8.59(m,1h),8.20(d,j=2.1hz,1h),8.09(d,j=2.2hz,1h),8.04(dd,j=8.7,2.2hz,1h),7.97(dd,j=2.2,0.8hz,1h),7.92(dt,j=7.8,1.9hz,1h),7.42
–
7.35(m,3h),7.32
–
7.26(m,2h),7.25
–
7.22(m,1h),7.20(d,j=15.8hz,1h),7.12(d,j=16.2hz,1h),7.00(d,j=8.6hz,1h),4.03(t,j=6.4hz,2h),3.87(s,3h),2.43(s,3h),1.87
–
1.71(m,2h),0.99(t,j=7.4hz,3h)。
[0404][0405]
亲核取代:
[0406]
1,3-二叠氮丙烷21a和1,4-二叠氮丁烷22b。按照下列步骤,在适当的烷基二卤化物和叠氮化钠之间,通过简单的亲核置换反应获得烷基二叠氮化物。在氮气下,将适当的二溴烃基化物(10.0mmol,即2.02g1,3-二溴丙烷)溶解于干燥dmf(10ml)中,并加入nan3(1.30g,20.0mmol)。该混合物在60℃下于磁力搅拌下保持24h。然后将反应混合物倒入水(50ml)中并用乙醚萃取五次(每次50ml)。有机提取物用水(5ml)洗涤,然后干燥(盐水,然后mgso4)。减压蒸发反应混合物,得到粗油状产物。
[0407]
22a、化学式:c3h6n6;分子量:126.12g/mol;外观:无色油。
[0408]
产量:55%。
[0409]
nmr 1
h(400mhz,dmso-d6):δ(ppm)=3.42(t,3j=6.7hz,4h,h1,h3),1.77(p,3j=6.7hz,2h,h2)。
[0410]
nmr 13
c(75mhz,dmso-d6):δ(ppm)=48.5(c1,c3),28.1(c2)。
[0411]
22b、化学式:c4h8n6;分子量:140.15g/mol;外观:无色油。
[0412]
产量:77%。
[0413]
nmr 1
h(400mhz,dmso-d6):δ(ppm)=3.40
–
3.28(m,4h,h1,h4),1.76
–
1.66(m,4h,h2,h3)。
[0414]
nmr 13
c(75mhz,dmso-d6):δ(ppm)=50.9(c1,c4),26.2(c2,c3)。
[0415]
3-叠氮丙胺23a和4-叠氮丁胺23b。通过将二叠氮化合物22作区域选择性的staudinger还原,得到叠氮烷基胺。向冷却至0℃的二叠氮烷基化合物22(10mmol)的混合物中,加入1m hcl水溶液(20ml)、乙醚(7ml)和乙酸乙酯(7ml)。将三苯基膦在30min内分批加入。将混合物温热至室温,再搅拌20h,然后将有机层与水层分离。水相用乙醚(2
×
50ml)洗涤,去除三苯基氧化膦残留物。水相用naoh水溶液碱化至ph=13,然后用二氯甲烷(3
×
100ml)萃取。合并的二氯甲烷层用mgso4干燥,并浓缩得到4-叠氮烷基胺的衍生物,为油状物。
[0416]
23a、化学式:c3h8n4;分子量:100.12g/mol;外观:黄色油。
[0417]
产量:52%。
[0418]
nmr 1
h(400mhz,dmso-d6):δ(ppm)=3.38(t,3j=6.7hz,2h,h1),2.59(t,3j=6.7hz,2h,h3),1.59(p,3j=6.7hz,2h,h2)。
[0419]
nmr 13
c(75mhz,dmso-d6):δ(ppm)=48.9(c3),39.2(c1),32.6(c2)。
[0420]
23b、化学式:c4h
10
n4;分子量:114.15g/mol;外观:黄色油。
[0421]
产量:54%。
[0422]
nmr 1
h(400mhz,dmso-d6):δ(ppm)=3.23(t,3j=6.8hz,2h,h1),2.67(t,3j=6.9hz,2h,h3),1.65
–
1.53(m,2h,h2),1.51
–
1.44(m,2h,h4)。
[0423]
nmr 13
c(75mhz,dmso-d6):δ(ppm)=51.4(c4),41.7(c1),30.8(c2),26.3(c3)。
[0424]
优选化合物之一的合成:crbn-pbm1-001
[0425]
[0426]
crbn-pbm1-001通过sonogashira交叉偶联反应得到。在惰性气氛下,将三乙胺(42μl,0.3mmol,3.0当量)、碘化铜(i)(2mg,0.01mmol,10%mol)、2-(2,6-二氧杂哌啶-3-基)-4-((2-(2-(丙-2-基-1-基氧基)乙氧基)乙基)氨基)异吲哚啉-1,3-二酮17(44mg,0.11mmol,1.1当量)和四(三苯基膦)钯(0)(8mg,0.005mmol,5%mol)加入到10(42.8mg,0.10mmol,1.0当量)干燥dmf(2ml)中的溶液中。反应混合物在50℃下搅拌6h。混合物用乙酸乙酯稀释。用4ml的nahco3饱和溶液还有盐水洗涤水层。将合并的有机层用无水硫酸镁干燥,过滤并减压浓缩。粗残余物通过硅胶柱快速色谱(水/乙腈100/0至0/100)进行纯化,得到41mg的黄色固体crbn-pbm1-001(55%的产率)。
[0427]
化学式:c
44h38
n6o6;分子量:746.82g/mol。
[0428]
nmr 1
h(400mhz,cdcl3):δ(ppm)=8.82(s,1h),8.75
–
8.66(m,2h),8.64
–
8.58(m,3h),8.14(d,j=2.2hz,1h),8.03(d,j=1.9hz,1h),7.94
–
7.84(m,3h),7.69
–
7.60(m,1h),7.43
–
7.33(m,4h),7.31
–
7.20(m,3h),7.09
–
6.99(m,3h),6.85(d,j=8.5hz,1h),6.45(t,j=5.5hz,1h),4.83(dd,j=12.1,5.4hz,1h),4.44(s,1h),3.81
–
3.64(m,4h),3.43(q,j=5.5hz,1h),2.82
–
2.57(m,2h),2.40(s,3h),2.06
–
1.97(m,1h)。
[0429]
nmr 13
c(75mhz,cdcl3):δ(ppm)=171.2,169.3,168.5,167.6,155.4,150.8,149.9,149.9,149.5,149.3,149.3,148.0,147.9,146.8,139.9,139.8,136.9,136.69,136.65,136.5,136.4,136.2,136.1,135.8,133.9,133.7,133.3,132.5,131.4,131.3,128.9,128.9,128.8,128.6,126.9,126.9,124.2,123.7,123.3,119.2,116.8,111.7,89.3,82.9,70.6,69.6,69.5,59.3,48.9,42.4,31.5,22.8,20.0,20.0。
[0430]
ms(esi ):m/z:373.93[m 2h]
2
,748.36[m h]
。
[0431]
实施例4:本发明化合物的进一步生物活性
[0432]
材料和方法
[0433]
细胞培养与药物试验
[0434]
使用人铂抗性卵巢癌细胞igrov1-r10。该细胞系在补充有2mm glutamax tm、25mm hepes、10%胎牛血清和33mm碳酸氢钠(fisher scientific,illkirch,法国)的rpmi 1640培养基中生长。将细胞在具有5%co2的潮湿气氛中,于37℃下保持。将细胞接种在25cm2的烧瓶中。24h后,呈指数增长的细胞暴露于1,呈的化合物中24h。靶向mcl-1和crbn的crbn-pbm1-001与pyridoclax由cermn(centre d'etudes et de recherche sur le m
é
dicament de normandie)设计和合成,并溶解在二甲基亚砜(dmso,sigma-aldrich)中。
[0435]
通过western blot的靶表达分析
[0436]
细胞用冰冷的pbs冲洗,悬浮在裂解缓冲液[ripa:nacl 150mm、tris(ph=8)50mm、triton x1001%、pmsf 4mm、edta 5mm、naf 10mm、nappi 10mm、na3vo41mm、抑肽酶0.5μl/ml和4.6ml超纯水]中并在冰上孵育30min。离心(13200g,10min,4℃)后收集裂解物,并用bradford测定(bio-rad,hercules,美国)测定蛋白质浓度。在4-15%梯度聚丙烯酰胺tgx
tm
预制凝胶(bio-rad)上,通过sds-page分离等量蛋白质(25μg)。pvdf膜通过100%乙醇浴中活化1min,然后用转移缓冲液(3:1:1超纯水,100%乙醇,5x转移缓冲液[bio-rad])平衡。然后将蛋白质转移到活化的pdvf膜(bio-rad)。室温下,用在含有0.05%(v/v)tween20 tbs(t-tbs)中的5%(v/v)脱脂奶粉,将膜封闭1h。然后将膜与下面列出的适当抗体在4℃下孵育一夜。然后用t-tbs洗涤膜,并与适当的二次抗体孵育1h。用增强化学发
光底物(ecl prime)western blot检测试剂(ge healthcare life sciences)和las4000series(ge healthcare life sciences)显示信号。使用imagej软件量化蛋白质条带的相对强度,并将值归一化为各个肌动蛋白(actin)信号的强度。
[0437]
使用了以下抗体:anti-actin(1/2000,#mab1501,merck millipore)、anti-crbn(1/1000,ab230411,abcam)、anti-mcl-1(1/1000,#5453)、anti-bcl-x
l
(1/1000,#2764)、抗兔多克隆二次抗体(1/2000,#7074s)(细胞信号转导技术)和抗小鼠多克隆二次抗体(1/2000,#na931v-ml,amersham)。
[0438]
结果
[0439]
在igrov1-r10细胞中通过western blot证实crbn的存在,如图1所示。
[0440]
对crbn-pbm1-001分子同时靶向mcl-1和crbn的效果进行表征,以证明其靶向和降解mcl-1的能力。western blot实验表明,24h暴露于作为单一试剂的pyridoclax(1μm),不会调节igrov1-r10细胞中mcl-1的表达。相比之下,在1μm的crbn-pbm1-001浓度下暴露24h后,crbn-pbm1-001能够诱导mcl-1表达下降52%,如密度分析显示(图2)。此外,在这些实验条件下,观察到的效应只对mcl-1起作用,因为bcl-x
l
表达不受暴露于crbn-pbm1-001的影响,而bcl-2在这些细胞中不表达。因此,这些结果表明crbn-pbm1-001能够与mcl-1结合并启动其降解。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。