1.本发明属于药物评价与筛选的技术领域,具体涉及一种简便、经济、高通量的斑马鱼缺血性脑卒中模型的建立方法及其应用,尤其是用该模型筛选或评价脑卒中治疗剂的方法。
背景技术:
2.脑卒中又称脑血管意外或脑中风,是一种急性脑血管疾病,它是由于脑血管突然破裂或血管阻塞导致血液循环障碍,使受累血管的血供区域脑组织发生损害的一种疾病,具有高发病率、高死亡率和高致残率的特点,素有第三大致死性疾病之称。脑卒中包括缺血性和出血性卒中两种,缺血性卒中的发病率高于出血性卒中,占脑卒中总数的80%~85%。缺血性卒中是由血栓栓塞导致脑灌注减少而引起的。全球脑卒中的疾病负担大多来自于发展中国家。全球疾病负担(gbd)2013年研究显示:发展中国家的脑卒中死亡率占全球75%,脑卒中所导致的伤残调整寿命(daly)占全球81%
1.。作为发展中国家和世界第一人口大国,中国脑卒中的疾病负担尤为严重。2013年全球脑卒中所导致的daly占所有疾病4.62%,而中国占 9.71%,中国脑卒中的疾病负担占比是全球平均水平的2倍多
2.。
3.脑卒中造成神经功能损伤的机制复杂,涉及血液流变学、病灶局部微循环、组织电生理及代谢奈乱、神经递质、细胞异常和调亡等多方面的病理过程。当脑血管发生梗死或出血,相应的局部脑组织失去正常血供,出现缺血缺氧及压迫引发相关的炎症反应、功能抑制等,并在随后几分钟之内开始逐渐出现神经元和局部胶质细胞的结构损伤和细胞坏死,最终导致神经功能联系失能,出现局灶性的神经功能缺损症状。有研究表明,在脑卒中人群之中,只有三分之一的患者在卒中后没有留下任何后遗症或是仅留下轻微后遗症,绝大多数的患者都留有中至重度的后遗症
3.,严重影响患者的生活质量,为社会带来重大的经济负担。因此,在治疗脑卒中药物的研发过程中,筛选或评价药物的功效,以便于开发出更优化的治疗药物,选择合适的脑卒中药物筛选模型是研究基础。
4.现有的脑卒中药物筛选模型,大多采用啮齿类动物(如鼠、兔、犬类)作为模式动物,常用的缺血性脑卒中模型及其原理包括:四动脉阻断法致全脑缺血模型
4.、兔颈外动脉逆向颈内动脉插管方法致脑卒中模型
5.、心脏骤停致全脑缺血模型
[6,7]
、线栓法大脑中动脉阻塞模型
[8]
、光化学栓塞法建立缺血性脑卒中动物模型
[9]
等。
[0005]
由于临床上大脑中动脉(middle cerebral artery,mca)区域梗死是大多缺血性卒中的主要原因,因此研究者多采用经由mca血管外或血管内闭塞制作局灶脑缺血模型。血管内线栓法模型是局灶脑缺血模型中较为常用的一种,但是由于此种模型制作不稳定,动物长期存活率较低,导致实验重复性差
[10,11]
;大脑中动脉近端主干电凝闭塞脑缺血模型是一种经颅 mcao模型
[12]
,实验效果相对较好,但是制作该模型后动物损伤很大,且模型动物的死亡率较高,需要消耗较多动物。根据实验需求,有研究者通过相对简单的开颅结扎术闭塞位于浅表大脑皮层的大脑中动脉远端主干制备模型(distal mcao)
[13]
,然而在wistar大鼠脑部产生的缺血性梗死损伤不稳定,实验重复性较差。后来,学者们为了减少模型制作过
程对实验动物脑部侧枝循环的影响,研究出开颅后夹闭大脑中动脉(而非电凝)联合双侧颈总动脉夹闭的大鼠三血管模型(3vo)
[14]
,3vo模型效果相对较好,实验重复性好,可用于缺血再灌注研究,但是短暂夹闭mca的精细显微外科操作难于应用于小鼠
[15]
。
[0006]
可见,传统的啮齿类动物构建脑卒中模型的实验方法,存在实验设计的不合理性、实验动物模型的不稳定性、实验观察手段的局限性等技术缺陷,难以优化。因此,如何选择一种合适的实验动物,并基于该模式动物建立有效的脑卒中模型,能够以直观的活体动态观察手段进行实时监测,以便于更好的研究脑卒中的病因与筛选脑卒中治疗剂,是本领域技术人员在构建脑卒中动物模型研究中亟待解决的技术难题。
[0007]
斑马鱼与人类基因同源性高达85%,由于基因组与蛋白质组与人类具有很高的相似性,因此疾病的发病机制和信号传导通路等方面与人类基本近似,且生物结构和生理功能与哺乳动物高度相似。与其他实验动物相比,斑马鱼还具有胚胎及幼鱼身体透明(可在体直接用肉眼和解剖显微镜观察各器官的发育过程)、体积小(可用微孔板分析)、发育周期短、体外受精、繁殖能力强、单次产卵数较高等特点
[16]
。模式生物斑马鱼近年来已成为研究人类疾病模型之一,既具有体外实验快速、高效、低廉、用药量小等优势,又具有哺乳类动物实验预测性强、可比度高、可观察多个器官等优点,在化合物药效、毒性评价中得到广泛应用
[17,18]
。
[0008]
斑马鱼作为新型的模式生物,是否可用于构建缺血性脑卒中模型来筛选治疗药物?斑马鱼作为一个新的模型系统具有如下优势:
①
首先,斑马鱼的循环是一个单一的回路:心脏
‑ꢀ
鱼鳃-身体-心脏。化学物质通常被添加到它们生活的水生环境中,便于实验操作和观察。由于化学物质被直接吸收到循环系统中,而不需要进行痛感和耗时的注射或侵入性手术,因此没有与啮齿动物中风模型相关的压力或组织损伤。
②
其次,斑马鱼与高等脊椎动物类似,其神经系统包含有端脑、间脑、中脑、小脑、后脑和脊髓等基本结构,而且斑马鱼神经递质系统在进化中是保守的,含有几乎与人类一致的谷氨酸、γ氨基丁酸(gaba)、多巴胺、5-羟色胺(5-ht)、乙酰胆碱(ach)等神经递质传导通路。
③
再者,斑马鱼有一个很好的研究基因库和全序列基因组。由于具有良好特征的突变体,所以在需要的时候使用基因敲除和敲入来进行进一步的研究是极为方便的。
④
斑马鱼作为一种完整的活体模型,可用于高通量筛选药物,尤其是化学药物的筛选
[19-22]
。
⑤
与传统的啮齿类动物模型相比,斑马鱼模型的成本与效益优势显著。
[0009]
目前,用斑马鱼研究缺血性脑卒中的方法主要有如下两者技术思路:
[0010]
方法一:是将光敏染料孟加拉玫瑰红注射到成年斑马鱼腹腔,光照后,释放单氧损伤血管内皮细胞,引发凝血通路的激活,最后检测斑马鱼运动行为和脑梗死面积。该方法的缺点是:成鱼实验操作复杂,解剖后取脑对斑马鱼损伤比较大,实验手段残忍,造模成功率低,实验周期较长,通量低,不适合药物筛选
[23]
。公开号为cn 108739556a中国发明专利所涉及的“一种光化学诱导斑马鱼缺血性脑卒中模型的应用”技术,也具有类似的缺点。
[0011]
方法二:是往鱼水里通入氮气,造成缺氧环境,斑马鱼脑组织缺氧后诱导脑梗死,最后检测斑马鱼运动行为和脑梗死面积。该方法的缺点是:低氧诱导后斑马鱼快速死亡,且死亡率很高,造模成功率很低,且成鱼实验操作复杂,解剖后取脑对斑马鱼损伤比较大,实验手段残忍,实验周期较长,通量低,不适合药物筛选
[24]
。
[0012]
上述方法但均未涉及采用化学药物诱导建立斑马鱼缺血性脑卒中模型的技术思
路,综上所述,如何选择合适的化学药物诱发斑马鱼缺血性脑卒中,来构建斑马鱼模型,并用该模型筛选或评价脑卒中治疗剂,是本领域技术人员尚未解决的技术难题。
技术实现要素:
[0013]
本发明的目的在于:提供一种斑马鱼缺血性脑卒中模型的建立方法,该方法的诱导剂选择普纳替尼,并提供一种利用该斑马鱼模型来筛选或评价治疗脑卒中药物的方法,解决了上述现有技术中存在的技术缺陷。
[0014]
必须说明的是,普纳替尼是一种多靶点小分子酪氨酸激酶抑制剂,适应症是急慢性淋巴细胞白血病,但在临床应用后发现患者出现严重的血栓和血管狭窄等副作用而受监控。近年来有新的研究发现:普纳替尼导致血栓形成与抑制血管内皮细胞增殖、迁移和血管形成,影响no合成,导致血管内皮损伤,诱发血栓形成有关
[25]
。还有学者发现普纳替尼有血管内皮生长因子受体(vegfr)
[26]
,可阻断pi3k/akt/enos通路的传递。但是,前述的研究都是基于细胞水平的体外实验研究,目前尚未有文献报道普纳替尼可作为诱导剂在动物体内诱发缺血性脑中风,由于体外研究缺少了生物整体的循环转换和药物在体内的循环分布,不能真正反映药物在体内的真实情况,而且啮齿类动物与斑马鱼所构建的体内研究模型,亦因动物种类的差异性使得建模方法上不具有参考性。所以,仅凭体外实验来筛选或评价药物过于片面化,缺乏了经体内实验验证的药物筛选也不具有科学客观性。因此,申请人用普纳替尼作为诱导剂构建斑马鱼缺血性脑卒中模型,并以此来筛选或评价药物的功效,属于创新性研究。
[0015]
为实现上述发明目的,本发明采取了以下技术方案:
[0016]
内容一:本发明提供了一种斑马鱼缺血性脑卒中模型的建立方法,包括如下步骤:
[0017]
(1)斑马鱼最佳发育阶段的确定
[0018]
取基因突变型albino品系斑马鱼亲本交配、孵化,选择不同发育阶段的斑马鱼分别移入微孔板;
[0019]
根据不同的发育阶段将对应的微孔板设置如下实验组:诱导剂处理组,该组中对斑马鱼水溶给药单浓度的诱导剂;正常对照组,该组中对斑马鱼不进行任何处理;然后,各实验组均加入相同体积的养鱼用水,在相同温度下恒温培养;
[0020]
当诱导剂处理斑马鱼至实验终点后,将实验组的斑马鱼置于心跳血流分析系统,分析斑马鱼脑部供血量和血流速度,判断并确定斑马鱼的最佳发育阶段;
[0021]
所述不同发育阶段的斑马鱼为2~4dpf的斑马鱼;所述最佳发育阶段的斑马鱼为2dpf的斑马鱼;
[0022]
(2)诱导剂最佳给药浓度的确定
[0023]
将步骤(1)确定的2dpf斑马鱼移入微孔板中,设置如下实验组:正常对照组和不同给药浓度的诱导剂处理组;正常对照组中对斑马鱼不进行任何处理,诱导剂处理组中对斑马鱼水溶给药不同浓度的诱导剂;然后,各实验组均加入相同体积的养殖用水,在相同温度下恒温培养;
[0024]
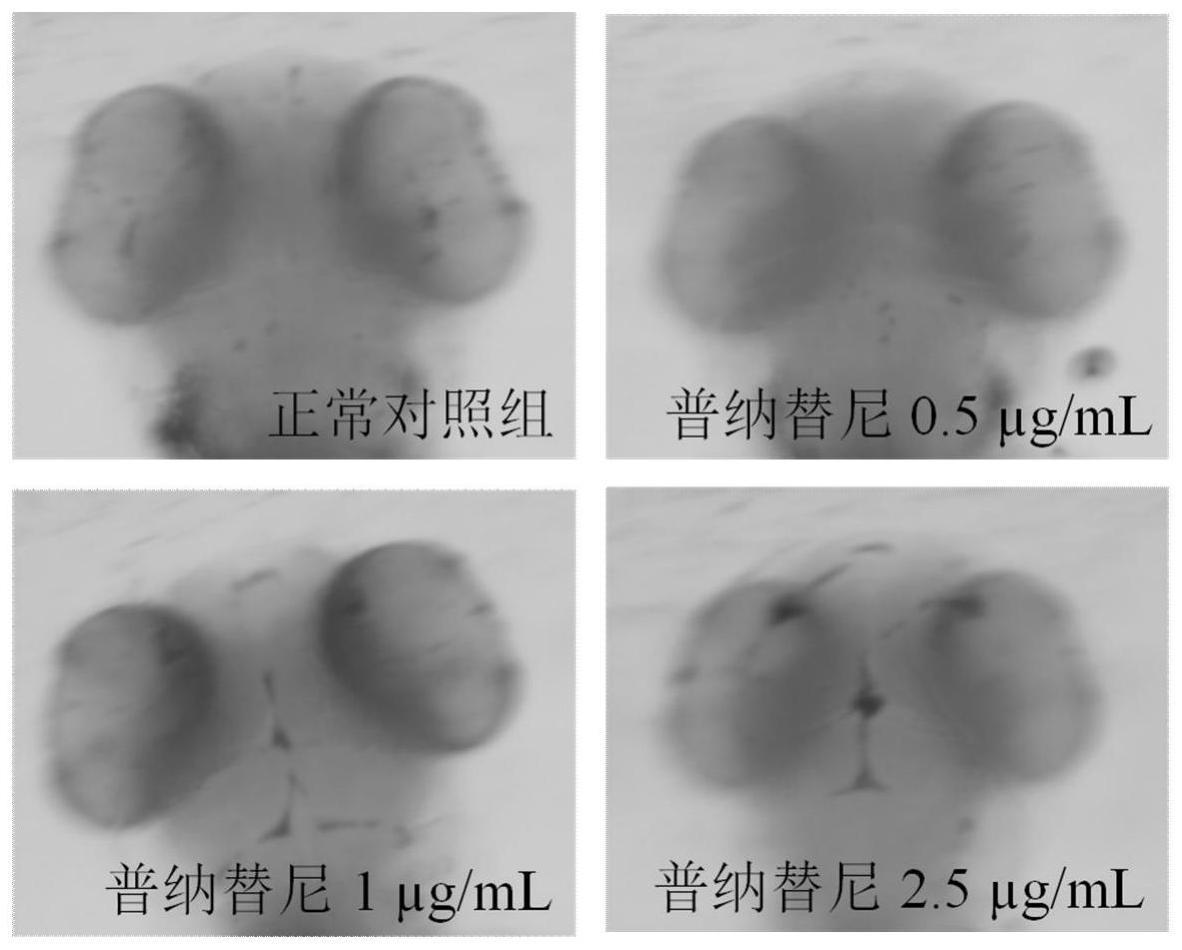
当诱导剂处理斑马鱼至实验终点后,各实验组中加入邻联茴香胺染色液,对染色处理后的斑马鱼脑部位置拍照并保存,统计脑卒中发生率,判断并确定诱导剂的最佳给药浓度;
[0025]
所述诱导剂的给药浓度为0.5~10μg/ml,所述诱导剂的最佳给药浓度为2.5μg/ml;
[0026]
所述步骤(1)、步骤(2)中的诱导剂,为普纳替尼。
[0027]
优选的,前述建模方法中养鱼用水条件为:溶解氧质量浓度为6~8mg/l;水温为28℃; ph为7.2~7.6;总硬度为200~250mg/l。
[0028]
优选的,前述建模方法中恒温培养条件为:微孔板置于恒温培养箱中,在28℃下培养 4~6h。
[0029]
内容二:本发明还提供了一种前述的斑马鱼缺血性脑卒中模型的用途,用于筛选或评价已知或未知的脑卒中治疗剂。
[0030]
优选的,前述脑卒中治疗剂包括但不限于阿司匹林、氯吡格雷。
[0031]
内容三:本发明还提供了一种用前述的斑马鱼缺血性脑卒中模型筛选或评价脑卒中治疗剂的方法,包括如下步骤:
[0032]
选取处于2dpf的斑马鱼移入微孔板中,设置如下实验组:正常对照组,该组中对斑马鱼不进行任何处理;模型处理组,该组中对斑马鱼水溶给药2.5μg/ml的普纳替尼;治疗剂处理组,该组中对斑马鱼水溶给药2.5μg/ml的普纳替尼和不同浓度的治疗剂;各实验组均加入相同体积的养殖用水,在相同温度下恒温培养;
[0033]
当普纳替尼处理斑马鱼至实验终点后,在各实验组中加入邻联茴香胺染色液,对染色处理后的斑马鱼脑部位置拍照并保存,统计脑卒中发生率,以评价该治疗剂对脑卒中的保护作用。
[0034]
本发明中,对治疗剂的筛选或评价指标,除前述的脑卒中发生率外,还可以为脑部供血量改善作用和血流速度改善作用,具体方法为:当普纳替尼处理斑马鱼至实验终点后,或将实验组斑马鱼置于心跳血流分析系统,分析斑马鱼脑部供血量和血流速度,计算脑部供血量 (o)改善作用和血流速度(v)改善作用,以评价该治疗剂对脑卒中的保护作用,计算公式如下:
[0035][0036][0037]
本发明中,对治疗剂的筛选或评价指标,除前述的脑卒中发生率外,还可以为运动功能改善作用,具体方法为:当普纳替尼处理斑马鱼至实验终点后,或将实验组斑马鱼移至带溶液的微孔板中,用运动功能分析仪分析斑马鱼运动距离(d),计算运动功能改善作用,以评价该治疗剂对脑卒中的保护作用,计算公式如下:
[0038][0039]
本发明中,对治疗剂的筛选或评价指标,除前述的脑卒中发生率外,还可以为抗炎作用,具体方法为:当普纳替尼处理斑马鱼至实验终点后,或将实验组斑马鱼置于荧光显微镜下观察拍照,统计斑马鱼卵黄囊中的中性粒细胞数目(n),计算抗炎作用,以评价该治疗剂对脑卒中的保护作用,计算公式如下:
[0040][0041]
综上所述,本发明构建的斑马鱼缺血性脑卒中模型及其用途,具有如下优点:
[0042]
(1)选择合适用量的化学药物普纳替尼作为诱导剂来构建斑马鱼模型,目前对普纳替尼诱发血栓的研究仅在体外细胞实验上证明,公开号为cn 107648235 a的中国发明专利则通过大鼠实验(体内)证明普纳替尼可作为治疗剂对缺血性脑卒中具有保护作用;在斑马鱼体内用普纳替尼诱发缺血性脑卒中的建模方法系本发明原创。
[0043]
(2)选择特定发育阶段(2dpf)的斑马鱼来构建斑马鱼模型,从实施例1中可知选择 2~4dpf的斑马鱼造模时,仅2dpf造模成功。
[0044]
(3)本发明构建的斑马鱼缺血性脑卒中模型,既可用于评价已知药物(如结构公开、药效明确的诱导剂、治疗剂)的毒性或功效,还可用于筛选具有未知药物(如结构全新、药效不明的化合物,常用于first、me-better、me-too等等的新药开发)的毒性或功效,应用广泛,意义重大。
[0045]
(4)本发明中,发明人在建立了斑马鱼缺血性脑卒中模型的基础上,又提供了一种利用该模型筛选或评价脑卒中治疗剂的方法,这是一种全新的药物评价模型与评价方法,能准确反映药物在体内的真实情况,可实现在体内高通量筛选或评价药物对缺血性脑卒中的治疗功效,具有可靠、快速、高效、低廉、高性价比等优点。
附图说明
[0046]
图1:用脑部供血量指标判断斑马鱼的最佳发育阶段。
[0047]
图2:用血流速度指标判断斑马鱼的最佳发育阶段。
[0048]
图3:解剖显微镜观察并判断诱导剂的最佳给药浓度。
[0049]
图4:用脑卒中发生率指标判断诱导剂的最佳给药浓度。
[0050]
图5:用脑部供血量指标判断诱导剂的最佳给药浓度。
[0051]
图6:用血流速度指标判断诱导剂的最佳给药浓度。
[0052]
图7:解剖显微镜观察阿司匹林的治疗功效。
[0053]
图8:用脑卒中发生率指标评价阿司匹林的治疗功效。
[0054]
图9:用脑部供血量指标评价阿司匹林的治疗功效。
[0055]
图10:用血流速度指标评价阿司匹林的治疗功效。
[0056]
图11:解剖显微镜观察氯吡格雷的治疗功效。
[0057]
图12:用脑卒中发生率指标评价氯吡格雷的治疗功效。
[0058]
图13:用运动距离改善作用指标评价氯吡格雷的治疗功效。
[0059]
图14:用抗炎作用指标评价氯吡格雷的治疗功效。
具体实施方式
[0060]
以下是本发明的具体实施例,对本发明的技术方案做进一步的描述,但是本发明的保护范围并不限于这些实施例。凡是不背离本发明构思的改变或等同替代均包括在本发明的保护范围之内。
[0061]
实施例1:确定斑马鱼的最佳发育阶段
[0062]
1、斑马鱼选取
[0063]
取基因突变型albino品系斑马鱼亲本交配、孵化胚胎,将处于2dpf、3dpf、4dpf的斑马鱼置于解剖显微镜下观察,挑取发育正常的斑马鱼分别移入三个6孔板中,每孔30尾。
[0064]
(注:本发明中的dpf=day post fertilization,中文是指斑马鱼受精后天数,如2dpf是指斑马鱼受精后两天。)
[0065]
2、诱导剂处理
[0066]
设置6个实验组(每组分别为2dpf、3dpf、4dpf的斑马鱼),每个实验组包括1个诱导剂处理组和1个正常对照组。诱导剂处理组中对斑马鱼水溶给予2.5μg/ml普纳替尼(诱导剂)处理;正常对照组中对斑马鱼不做任何处理;每个实验组按照微孔板的规格均加入相等体积的养殖用水,并将微孔板置于28℃恒温培养箱中培养4~6h。
[0067]
3、脑部供血量检测
[0068]
诱导剂处理斑马鱼至实验终点后,将实验组斑马鱼置于心跳血流分析系统下录制斑马鱼血流视频,分析斑马鱼脑部供血量和血流速度。通过统计分析各实验组脑部供血减少和血流速度减慢程度,判断并确定斑马鱼的最佳发育阶段。
[0069]
2dpf阶段:正常对照组斑马鱼脑部供血量为0.20μl/s,血流速度为991mm/s,诱导剂处理组斑马鱼脑部供血量为0.12μl/s,血流速度为542mm/s,脑部供血量减少率为41%,血流速度减少率为45%,与正常对照组相比p均《0.001,证明模型建立成功,因此模型可行(见图1和图2)。
[0070]
3dpf阶段:正常对照组斑马鱼脑部供血量为0.38μl/s,血流速度为1211mm/s,诱导剂处理组斑马鱼脑部供血量为0.36μl/s,血流速度为1104mm/s,脑部供血量减少率为8%,血流速度减少率为9%,与正常对照组相比p均》0.05,证明模型建立不成功,因此模型不可行。
[0071]
4dpf阶段:正常对照组斑马鱼因血流速度太快和心跳血流分析仪检测灵敏度的原因,检测不出脑部供血量和血流速度数据,无法建模,因此模型不可行。
[0072]
综上,确定斑马鱼的最佳发育阶段为2dpf。
[0073]
实施例2:确定诱导剂的最佳给药浓度
[0074]
1、斑马鱼选取
[0075]
根据实施例1的筛选结果,选择2dpf的斑马鱼置于解剖显微镜下观察,挑取发育正常的斑马鱼分别移入6孔板中,每孔30尾。
[0076]
2、诱导剂处理
[0077]
设置6个实验组:5个诱导剂处理组、1个正常对照组。诱导剂处理组中对斑马鱼分别水溶给予不同浓度的普纳替尼(诱导剂),浓度分别为0.5、1、2.5、5和10μg/ml;正常对照组中对斑马鱼不做任何处理。各实验组按照微孔板规格均加入相同体积的养殖用水,并将微孔板置于28℃恒温培养箱中培养4~6h。
[0078]
3、脑卒中发生率统计
[0079]
诱导剂处理斑马鱼至实验终点后,移除微孔板中的液体,各个实验组中均加入邻联茴香胺染色液,置于28℃恒温培养箱中染色15min后,用dmso清洗2次,利用解剖显微镜对斑马鱼脑部位置拍照并保存(见图3),统计脑卒中发生率。
[0080]
结果显示:浓度为10μg/ml的诱导剂处理组斑马鱼全部死亡,浓度为5μg/ml的诱导
剂处理组斑马鱼8尾死亡。
[0081]
浓度为0.5、1、2.5μg/ml的普纳替尼诱发的斑马鱼脑卒中发生率分别为10%(2/20)、 25%(5/20)和90%(18/20),与正常对照组0%(0/20)比较,0.5μg/ml浓度组p》0.05,1 μg/ml浓度组p《0.05,2.5μg/ml浓度组p《0.001(见图4)。
[0082]
(或)4、脑部供血量和血流速度统计
[0083]
诱导剂处理斑马鱼至实验终点后,将实验组斑马鱼置于心跳血流分析系统下录制斑马鱼血流视频,分析斑马鱼脑部供血量和血流速度。通过统计分析各实验组脑部供血量下降和血流速度减慢程度确定普纳替尼的最佳给药浓度。
[0084]
结果显示:浓度为10μg/ml的诱导剂处理组斑马鱼全部死亡,浓度为5μg/ml的诱导剂处理组斑马鱼8尾死亡。
[0085]
正常对照组斑马鱼脑部供血量为0.20μl/s,浓度为0.5、1和2.5μg/ml的诱导剂处理组斑马鱼脑部供血量分别为0.19、0.18和0.12μl/s,脑部供血量减少率分别为3%、7%和35%,与正常对照组比较,0.5μg/ml浓度组p》0.05,1μg/ml浓度组p《0.05,2.5μg/ml浓度组p 《0.001(见图5)。
[0086]
正常对照组斑马鱼血流速度为994mm/s,浓度为0.5、1和2.5μg/ml的诱导剂处理组斑马鱼血流速度分别为924、873和514mm/s,血流速度减少率分别为5%、4%和43%,0.5μg/ml 和1μg/ml浓度组p》0.05,2.5μg/ml浓度组p《0.001(见图6)。
[0087]
综上,确定普纳替尼的最佳给药浓度为2.5μg/ml。
[0088]
实施例3:评价治疗剂阿司匹林对脑卒中的保护作用
[0089]
根据实施例1和实施2的筛选结果,本实施例用普纳替尼诱发斑马鱼缺血性脑卒中模型评价已知的脑卒中治疗剂阿司匹林的治疗效果,以此来验证普纳替尼诱导方法的灵敏度与可靠性。
[0090]
1、斑马鱼选取
[0091]
选择2dpf的斑马鱼置于解剖显微镜下观察,挑取发育正常的斑马鱼分别移入6孔板中,每孔30尾。
[0092]
2、阿司匹林处理
[0093]
设置7个实验组:1个正常对照组、1个模型对照组、5个治疗剂处理组。治疗剂处理组中对斑马鱼水溶给予2.5μg/ml的普纳替尼和不同浓度的治疗剂阿司匹林,阿司匹林的给药浓度为6.25、12.5、25、50和100μg/ml;模型对照组对斑马鱼水溶给予2.5μg/ml的普纳替尼;正常对照组对斑马鱼不做任何处理。各实验组按照微孔板规格均加入相同体积的养殖用水,并将微孔板置于28℃恒温培养箱中培养。
[0094]
3、脑卒中发生率统计
[0095]
普纳替尼处理斑马鱼至实验终点后,移除微孔板中的液体,各个实验组中均加入邻联茴香胺染色液,置于28℃恒温培养箱中染色15min后,用dmso清洗2次,利用解剖显微镜对斑马鱼脑部位置拍照并保存(见图7),统计脑卒中发生率,评价阿司匹林对普纳替尼诱导的脑卒中的保护作用。
[0096]
结果显示:100μg/ml阿司匹林处理组斑马鱼10尾死亡。
[0097]
模型对照组斑马鱼脑卒中发生率为95%(19/20),与正常对照组0%(0/20)比较p《0.001。浓度为6.25、12.5、25和50μg/ml的阿司匹林处理组斑马鱼脑卒中发生率分别为80%
(16/20)、 65%(13/20)、55%(11/20)和25%(5/20),与模型对照组比较,6.25、12.5、25和50μg/ml 浓度组p》0.05&p《0.05&p《0.01&p《0.001,脑卒中预防作用分别为16%、32%、42%和74%(见图8)。
[0098]
(或)4、脑部供血改善作用评价
[0099]
普纳替尼处理斑马鱼至实验终点后,将实验组斑马鱼置于心跳血流分析系统下录制斑马鱼血流视频,分析斑马鱼脑部供血量和血流速度,计算不同浓度阿司匹林的脑部供血量(o) 增加率和血流速度(v)增加率,以及脑部供血量(o)改善作用和血流速度(v)改善作用,评价阿司匹林对普纳替尼诱导的斑马鱼脑卒中的保护作用。计算公式如下:
[0100][0101][0102]
结果显示:模型对照组斑马鱼脑部供血量为0.20μl/s,与正常对照组(0.31μl/s)比较p 《0.001。浓度为6.25、12.5、25和50μg/ml的阿司匹林处理组斑马鱼脑部供血量分别为0.22、 0.23、0.25和0.28μl/s,与模型对照组比较,6.25、12.5、25和50μg/ml浓度组p》0.05&p》 0.05&p《0.05&p《0.001,脑部供血量改善作用分别为18%、27%、45%和73%(见图9)。
[0103]
模型对照组斑马鱼血流速度为587mm/s,与正常对照组(982mm/s)比较p《0.001。浓度为6.25、12.5、25和50μg/ml的阿司匹林处理组斑马鱼血流速度分别为670、685、713和 886mm/s,与模型对照组比较,6.25、12.5、25和50μg/ml浓度组p》0.05&p》0.05&p《0.05 &p《0.001,血流速度改善作用分别为21%、25%、32%和75%(见图10)。
[0104]
实施例4:评价治疗剂氯吡格雷对脑卒中的保护作用
[0105]
1、斑马鱼选取
[0106]
选择2dpf的斑马鱼置于解剖显微镜下观察,挑取发育正常的斑马鱼分别移入6孔板中,每孔30尾。
[0107]
2、氯吡格雷处理
[0108]
设置7个实验组:1个正常对照组、1个模型对照组、5个治疗剂处理组。治疗剂处理组中对斑马鱼水溶给予2.5μg/ml的普纳替尼和不同浓度的治疗剂氯吡格雷,氯吡格雷的给药浓度为6.25、12.5、25、50和100μg/ml;模型对照组对斑马鱼水溶给予2.5μg/ml的普纳替尼;正常对照组对斑马鱼不做任何处理。各实验组按照微孔板规格均加入相同体积的养殖用水,并将微孔板置于28℃恒温培养箱中培养。
[0109]
3、脑卒中发生率统计
[0110]
普纳替尼处理斑马鱼至实验终点后,移除微孔板中的液体,各个实验组中均加入邻联茴香胺染色液,置于28℃恒温培养箱中染色15min后,用dmso清洗2次,利用解剖显微镜对斑马鱼脑部位置拍照并保存(见图11),统计脑卒中发生率,评价氯吡格雷对普纳替尼诱导的脑卒中的保护作用。
[0111]
结果显示:100μg/ml氯吡格雷处理组斑马鱼15尾死亡。
[0112]
模型对照组斑马鱼脑卒中发生率为95%(19/20),与正常对照组0%(0/20)比较p《
0.001。浓度为6.25、12.5、25和50μg/ml的氯吡格雷处理组斑马鱼脑卒中发生率分别为95%(19/20)、80%(16/20)、50%(10/20)和20%(4/20),与模型对照组比较,6.25、12.5、25和50μg/mlμg/ml浓度组p》0.05&p《0.05&p《0.01&p《0.001,脑卒中预防作用分别为0%、16%、47%和80%(见图12)。
[0113]
(或)4、运动功能改善作用评价
[0114]
普纳替尼处理斑马鱼至实验终点后,将实验组斑马鱼置于转移至96孔板中,1尾/孔,每孔200μl溶液,运动功能分析仪录制斑马鱼运动功能,分析斑马鱼的运动距离(d),计算运动功能改善作用,评价氯吡格雷对普纳替尼诱导的斑马鱼脑卒中的保护作用。计算公式如下:
[0115][0116]
结果显示:模型对照组斑马鱼运动功能距离为6073mm,与正常对照组(8734mm)比较p《0.001。浓度为6.25、12.5、25和50μg/ml的氯吡格雷处理组斑马鱼运动功能距离分别为6439、6754、7079和7692mm,与模型对照组比较,6.25、12.5、25和50μg/ml浓度组p》0.05&p》0.05&p《0.01&p《0.001运动功能改善作用分别为14%、26%、38%和61%(见图13)。
[0117]
(或)5、抗炎作用评价
[0118]
普纳替尼处理斑马鱼至实验终点后,将实验组斑马鱼置于荧光显微镜下观察拍照,统计分析斑马鱼中性粒细胞数目(n),计算抗炎作用,评价氯吡格雷对普纳替尼诱导的斑马鱼脑卒中的保护作用。计算公式如下:
[0119][0120]
结果显示:模型对照组斑马鱼中性粒细胞个数为17个,与正常对照组(2个)比较p《0.001。浓度为6.25、12.5、25和50μg/ml的氯吡格雷处理组斑马鱼中性粒细胞个数分别为16、15、12和7个,与模型对照组比较,6.25、12.5、25和50μg/ml浓度组p》0.05&p《0.05&p《0.001&p《0.001,炎症消退作用分别为6%、12%、29%和59%(见图14)。
[0121]
参考文献:
[0122]
[1]feiginvl,krishnamurthirv,parmarp,etal.updateontheglobalburdenofischemicandhemorrhagicstrokein1990-2013:thegbd2013study[j].neuroepidemiology,2015,45(3):161-176.
[0123]
[2]globalburdenofdiseasestudy2013.globalburdenofdiseasestudy2013(gbd2013)resultsbylocation,cause,andriskfactor.seattle,unitedstates:instituteforhealthmetricsandevaluation(ihme),2016.
[0124]
[3]slotkb,bergee,dormanp,eral.impactoffuncationstatusatsixmonthsonlongtermsurvivalinpatientswithischaemicstroke:prospectivecohortstudy[j].bmi2008,336:376-379.
[0125]
[4]pulsinelliwa,brierleyjb.anewmodelofbilateralhemisphericischemiaintheunanesthetizedrat[m].microorganismsinenvironmentalmanagement,1979:113-134.
[0126]
[5]郝春华,徐向伟,马寅仲,等.99tcm示踪血栓技术在家兔脑卒中模型的应用
[j].药物评价研究,2017,40(5):648-651.
[0127]
[6]suns,tangw,songf,etal.theeffectsofepinephrineonoutcomesofnormothermicandtherapeutichypothermiccardiopulmonaryresuscitation[j].criticalcaremedicine,2010,38(11):2175-2180.
[0128]
[7]davekr,sauli,prador,etal.remoteorganischemicpreconditioningprotectbrainfromischemicdamagefollowingasphyxialcardiacarrest[j].neuroscienceletters,2006,404(1
–
2):170-175.
[0129]
[8]longaez,weinsteinpr,carlsons,etal.reversiblemiddlecerebralarteryocclusionwithoutcraniectomyinrats[j].stroke;ajournalofcerebralcirculation,1989,20(1):84.
[0130]
[9]马浚宁,高俊玮,侯博儒,等.光化学栓塞法建立缺血性脑卒中动物模型[j].中国组织工程研究,2015,19(49):7951-7957.
[0131]
[10]bouleyj,fisherm,henningern.comparisonbetweencoatedvs.uncoatedsuturemiddlecerebralarteryocclusionintheratasassessedbyperfusion/diffusionweightedimaging[j].neuroscienceletters,2007,412(3):185-190.
[0132]
[11]flurif,schuhmannmk,kleinschnitzc.animalmodelsofischemicstrokeandtheirapplicationinclinicalresearch[j].drugdesigndevelopment&therapy,2014,9:3445-3454.
[0133]
[12]tamuraa,grahamdi,mccullochj,etal.focalcerebralischaemiaintherat:1.descriptionoftechniqueandearlyneuropathologicalconsequencesfollowingmiddlecerebralarteryocclusion[j].journalofcerebralbloodflow&metabolismofficialjournaloftheinternationalsocietyofcerebralbloodflow&metabolism,1981,1(1):53-60.
[0134]
[13]coylep.middlecerebralarteryocclusionintheyoungrat[j].stroke,1982,13(6):855-859.
[0135]
[14]buchanam,xued,slivkaa.anewmodeloftemporaryfocalneocorticalischemiaintherat[j].stroke,1992,23(2):273.
[0136]
[15]yanamotoh,nagatai,hashimoton,etal.three-vesselocclusionusingamicro-clipfortheproximalleftmiddlecerebralarteryproducesareliableneocorticalinfarctinrats[j].brainresearchprotocols,1998,3(2):209-220.
[0137]
[16]zonli,petersonrt.invivodrugdiscoveryinthezebrafish[j].drugdiscovery.2005,4:35-44.
[0138]
[17]mcgrathp,licq.zebrafish:apredictivemodelforassessingdrug-inducedtoxicity[j].drugdiscoverytoday.2008,13:394-401.
[0139]
[18]barrostp,aldertonwk,reynoldshm,etal.zebrafish:anemergingtechnologyforinvivopharmacologicalassessmenttoidentifypotentialsafetyliabilitiesinearlydrugdiscovery.britishjournalofpharmacology
[j].2008,154:1400-1413.
[0140]
[19]zonli,petersonr.thenewageofchemicalscreeninginzebrafish[j].zebrafish,2010,7(1):1.
[0141]
[20]ouhc,santosf,raibledw,etal.drugscreeningforhearingloss:usingthezebrafishlaterallinetoscreenfordrugsthatpreventandcausehearingloss[j].drugdiscoverytoday,2010,15(7-8):265-271.
[0142]
[21]haoj,williamsch,webbme,etal.largescalezebrafish-basedinvivosmallmoleculescreen[j].jvisexp,2010,46(46):e2243-e2243.
[0143]
[22]georges,xiat,rallor,etal.useofahigh-throughputscreeningapproachcoupledwithinvivozebrafishembryoscreeningtodevelophazardrankingforengineerednanomaterials[j].acsnano,2011,5(3):1805-1817.
[0144]
[23]yux,liyv.zebrafish(daniorerio)developedasanalternativeanimalmodelforfocalischemicstroke[j].brainedemaxvi.springerinternationalpublishing,2016,121:115-119.
[0145]
[24]yux,liyv.zebrafishasanalternativemodelforhypoxic-ischemicbraindamage[j].intjphysiolpathophysiolpharmacol,2011,3(2):88-96.
[0146]
[25]张亚楠,孙继红,黄新益,等.普纳替尼对人血管内皮细胞功能的影响[j].药物评价研究,2015,38(2):156-160.
[0147]
[26]ain,chongcm,chenwetal.ponatinibexertsanti-angiogeniceffectsinthezebrafishandhumanumbilicalveinendothelialcellsviablockingvegfrsignalingpathway[j].oncotarget,9(62):31958-31970。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。