盐酸决奈达隆注射组合物、其制备方法及应用
1.本技术要求享有2021年8月16日向中国国家知识产权局提交的,专利申请号为202110936257.8,发明名称为“盐酸决奈达隆注射组合物、其制备方法及应用”的在先申请的优先权权益。所述在先申请的全文通过引用的方式结合于本技术中。
技术领域
2.本发明属于药物组合物领域,具体涉及一种盐酸决奈达隆注射组合物、其制备方法及应用。
背景技术:
3.心律失常(cardiac arrhythmia)是一种常见的疾病,且发病率极高,心律失常的出现,严重危害着患者的身体健康,同时对患者的心理造成一定程度的影响。心律失常是由于窦房结激动异常或激动产生于窦房结以外,激动的传导缓慢、阻滞或经异常通道传导,即心脏活动的起源和(或)传导障碍导致心脏搏动的频率和(或)节律异常。心律失常是心血管疾病中重要的一组疾病。它可单独发病亦可与心血管病伴发。可突然发作而致猝死,亦可持续累及心脏而衰竭。根据心律失常发作时的心室率,可将心律失常大致分为快速性心律失常和缓慢性心律失常。由于心律失常的多发性和不定性,当不宜口服给药时常选用胺碘酮注射液进行治疗。然而胺碘酮注射液中碘离子导致的不良反应,另外胺碘酮的超长半衰期且同时为肝酶抑制剂,也限制了其在临床中的应用,因此亟待开发一种适用于不宜口服给药患者的抗心律失常注射剂。
4.盐酸决奈达隆是由赛诺菲公司研发,2009年7月1日于fda首次上市,商品名为multaq(迈达龙),上市剂型为片剂,规格为400mg,用于治疗心律不齐,可降低阵发性或持续性房颤(af)或房扑(afl),最近发作的af/afl和相关的心血管危险因素(例如,年龄》70岁)的患者发生心血管疾病的风险,有窦性心律或将进行心脏复律的,高血压,糖尿病,先前的脑血管意外,左心房直径≥50mm或左心室射血分数[lvef]《40%)。
[0005]
盐酸决奈达隆(dronedarone hydrochloride),化学名为n-(2-丁基-3-(4-(3-二丁基氨基丙氧基)苯甲酰基)苯并呋喃-5-基)甲磺酰胺盐酸盐,分子式c
31h44
n2o
5 s
·
hcl,分子量593.2;决奈达隆的化学结构式如下:
[0006][0007]
盐酸决奈达隆在水中几乎不溶,易溶于二氯甲烷和甲醇。盐酸决奈达隆在水性溶
液中的溶解度呈现ph依赖性,在ph值为3-5有最大的溶解度,约为1-2mg/ml;在ph值为6-7溶解度显著降低;当ph=7时其溶解度约为10μg/ml。由于其较差的水溶性,目前没有开发出注射剂。
技术实现要素:
[0008]
本发明提供了一种盐酸决奈达隆包合物,其包括盐酸决奈达隆和环糊精,所述的环糊精不包括未带取代基的β-环糊精。
[0009]
根据本发明的实施方案,所述的环糊精可以选自α-环糊精、γ环糊精、羟丙基-β-环糊精和磺丁基-β-环糊精中的一种或多种。
[0010]
根据本发明的实施方案,所述的环糊精优选为羟丙基-β-环糊精和/或磺丁基-β-环糊精。
[0011]
根据本发明的实施方案,所述的环糊精与所述的盐酸决奈达隆的摩尔比值优选为0.1~100,进一步优选0.2~10,再进一步优选0.3~5,例如1、1.25、2、2.5、3、3.8、4、5、10、20。
[0012]
根据本发明的实施方案,所述的盐酸决奈达隆包合物优选由盐酸决奈达隆和环糊精组成,所述的环糊精不包括未带取代基的β-环糊精。所述的环糊精优选α-环糊精、γ环糊精、羟丙基-β-环糊精和磺丁基-β-环糊精中的一种或多种。
[0013]
本发明还提供了一种盐酸决奈达隆注射组合物,其包括盐酸决奈达隆、环糊精、等渗调节剂和注射用水,以及任选含有或不含有的ph调节剂、抗氧化剂,所述的环糊精不包括未带取代基的β-环糊精。
[0014]
根据本发明的一种实施方案,所述盐酸决奈达隆注射组合物包括盐酸决奈达隆、环糊精、等渗调节剂、ph调节剂、抗氧化剂和注射用水,所述的环糊精不包括未带取代基的β-环糊精。
[0015]
根据本发明的一种实施方案,所述的盐酸决奈达隆注射组合物优选其由盐酸决奈达隆、环糊精、等渗调节剂、ph调节剂、抗氧化剂和注射用水组成,所述的环糊精不包括未带取代基的β-环糊精。
[0016]
本发明中,所述的环糊精可以选自α-环糊精、γ环糊精、羟丙基-β-环糊精和磺丁基-β-环糊精中的一种或多种;优选羟丙基-β-环糊精和/或磺丁基-β-环糊精。
[0017]
根据本发明的实施方案,所述的环糊精与所述的盐酸决奈达隆与的摩尔比值优选0.1~100,进一步优选0.2~10,再进一步优选0.3~5,例如1、1.25、2、2.5、3、3.8、4、5、10、20。
[0018]
根据本发明的实施方案,所述的等渗调节剂为能够调节渗透压的物质,例如为氯化钠和/或葡萄糖。
[0019]
根据本发明的实施方案,所述的等渗调节剂的浓度可以为0.1mg/ml~10mg/ml,例如1mg/ml~10mg/ml,比如0.2mg/ml、0.95mg/ml、1mg/ml、1.0005mg/ml、1.5mg/ml、2mg/ml、4mg/ml或10mg/ml,所述的浓度是指等渗调节剂的质量与盐酸决奈达隆注射组合物体积的比值。
[0020]
根据本发明的实施方案,所述的ph调节剂为能够调节溶液ph的物质,例如醋酸、枸橼酸、枸橼酸钠、磷酸、氢氧化钠、碳酸钠、碳酸氢钠、磷酸氢二钠和磷酸二氢钠中的一种或
多种。
[0021]
根据本发明的实施方案,所述的ph调节剂的浓度可以为0~10.0mg/ml。
[0022]
在一种实施方案中,所述的ph调节剂的浓度可以为1.0~10.0mg/ml。
[0023]
例如,所述的ph调节剂的浓度为0.005mg/ml、0.06mg/ml、0.0075mg/ml、0.11mg/ml、3.0mg/ml、3.2mg/ml、2.8mg/ml或2.0mg/ml,所述的浓度是指ph调节剂的质量与盐酸决奈达隆注射组合物体积的比值。
[0024]
根据本发明的实施方案,所述的抗氧化剂例如可以选自l-半胱氨酸盐酸盐、亚硫酸钠、亚硫酸氢钠、没食子酸丙酯、谷胱甘肽、硫代硫酸钠、硫脲、巯基乙酸、焦亚硫酸钠、焦亚硫酸钾、维生素c和维生素e中的一种或多种。
[0025]
根据本发明的实施方案,所述的抗氧化剂的浓度可以为0.001mg/ml-0.002mg/ml,例如0.001mg/ml或0.002mg/ml,所述的浓度是指抗氧化剂的质量与盐酸决奈达隆注射组合物体积的比值。
[0026]
本发明中,所述的水优选为注射用水。
[0027]
根据本发明的实施方案,所述的盐酸决奈达隆注射组合物可以为以下任一处方:
[0028]
处方1:12mg/ml盐酸决奈达隆、28.8mg/ml羟丙基-β环糊精、2mg/ml枸橼酸、1mg/ml枸橼酸钠、1mg/ml氯化钠、0.001mg/ml亚硫酸氢钠和5ml水,其中各组分的占比为其质量与盐酸决奈达隆注射组合物总体积的比值;
[0029]
处方2:12mg/ml盐酸决奈达隆、57.6mg/ml羟丙基-β环糊精、1.6mg/ml枸橼酸、1.6mg/ml枸橼酸钠、2mg/ml葡萄糖、0.002mg/ml亚硫酸氢钠和5ml水,其中各组分的占比为其质量与盐酸决奈达隆注射组合物总体积的比值;
[0030]
处方3:12mg/ml盐酸决奈达隆、43.4mg/ml璜丁基-β环糊精、1.2mg/ml枸橼酸、1.6mg/ml枸橼酸钠、4mg/ml氯化钠、0.001mg/ml维生素c和5ml水,其中各组分的占比为其质量与盐酸决奈达隆注射组合物总体积的比值;
[0031]
处方4:12mg/ml盐酸决奈达隆、86.8mg/ml璜丁基-β环糊精、0.6mg/ml枸橼酸、1.4mg/ml枸橼酸钠、10mg/ml葡萄糖、0.002mg/ml维生素c和5ml水,其中各组分的占比为其质量与盐酸决奈达隆注射组合物总体积的比值;
[0032]
处方5:8mg/ml盐酸决奈达隆、30mg/ml羟丙基-β环糊精、2mg/ml氯化钠、和10ml水,其中各组分的占比为其质量与盐酸决奈达隆注射组合物总体积的比值;
[0033]
处方6:8mg/ml盐酸决奈达隆、90mg/ml璜丁基-β环糊精、1.0mg/ml氯化钠和10ml水,其中各组分的占比为其质量与盐酸决奈达隆注射组合物总体积的比值;
[0034]
处方7:8mg/ml盐酸决奈达隆、90mg/ml璜丁基-β环糊精、0.005mg/ml枸橼酸、1.0mg/ml氯化钠和10ml水,其中各组分的占比为其质量与盐酸决奈达隆注射组合物总体积的比值;
[0035]
处方8:8mg/ml盐酸决奈达隆、30mg/ml璜丁基-β环糊精、0.005mg/ml枸橼酸、1.5mg/ml葡萄糖、0.001mg/ml亚硫酸氢钠和10ml水,其中各组分的占比为其质量与盐酸决奈达隆注射组合物总体积的比值;
[0036]
处方9:8mg/ml盐酸决奈达隆、60mg/ml璜丁基-β环糊精、0.01mg/ml枸橼酸、0.05mg/ml枸橼酸钠、1mg/ml氯化钠、0.0005mg/ml葡萄糖和10ml水,其中各组分的占比为其质量与盐酸决奈达隆注射组合物总体积的比值;
[0037]
处方10:8mg/ml盐酸决奈达隆、120mg/ml璜丁基-β环糊精、0.01mg/ml枸橼酸、0.1mg/ml枸橼酸钠、0.2mg/ml葡萄糖、0.001mg/ml维生素c和10ml水,其中各组分的占比为其质量与盐酸决奈达隆注射组合物总体积的比值。
[0038]
根据本发明的实施方案,所述盐酸决奈达隆注射组合物的ph为3.0~7.0。
[0039]
在一种实施方案中,所述盐酸决奈达隆注射组合物的ph为3.0~6.0,例如3.0、4.0、5.0、6.0或7.0。
[0040]
本发明还提供了所述的盐酸决奈达隆注射组合物的制备方法,其包括以下步骤:
[0041]
步骤1:将环糊精水溶液与盐酸决奈达隆进行包合,得到盐酸决奈达隆环糊精包合物;
[0042]
步骤2:将步骤1得到的盐酸决奈达隆包合物与等渗调节剂及水,以及任选加入或不加入的ph调节剂、抗氧化剂混合,得到所述的盐酸决奈达隆注射组合物;
[0043]
或者,步骤2:将步骤1得到的盐酸决奈达隆包合物与等渗调节剂、以及任选加入或不加入的ph调节剂、抗氧化剂混合,得到所述的盐酸决奈达隆注射组合物。
[0044]
在一种实施方式中,步骤2:将步骤1得到的盐酸决奈达隆包合物与等渗调节剂、抗氧化剂及水混合,得到所述的盐酸决奈达隆注射组合物。
[0045]
在一种实施方式中,步骤2:将步骤1得到的盐酸决奈达隆包合物与等渗调节剂、抗氧化剂混合,得到所述的盐酸决奈达隆注射组合物。
[0046]
根据本发明的实施方案,步骤1所述的盐酸决奈达隆包合物可以采用本领域中的常规包合条件进行,本发明中优选采用以下包合条件:
[0047]
步骤1中,所述的环糊精水溶液的质量浓度优选1%~50%,进一步优选5%~30%,例如9%、15%、20%或30%,所述的质量浓度是指环糊精的质量与环糊精水溶液总质量的百分比。
[0048]
根据本发明的实施方案,步骤1中,所述的包合的温度优选为20℃~80℃,进一步优选为40℃~70℃,例如60℃。
[0049]
根据本发明的实施方案,步骤1中,所述的包合的时间优选为0.5小时~20小时,进一步优选为1小时~10小时,例如7小时。
[0050]
根据本发明的实施方案,在所述的盐酸决奈达隆包合物的制备方法中,所述的混合优选为搅拌混合。
[0051]
根据本发明的一种实施方案,步骤1优选采用以下后处理步骤:盐酸决奈达隆溶于环糊精水溶液中,进行包合,包合结束后,冷却、过滤、干燥,得到所述的盐酸决奈达隆包合物。
[0052]
根据本发明的实施方案,步骤1的后处理步骤中,所述的冷却的温度优选为10℃~30℃,进一步优选为20℃~25℃。
[0053]
根据本发明的实施方案,步骤1的后处理步骤中,所述的过滤优选采用滤芯进行。所述的滤芯的孔径优选为0.22微米~0.8微米。
[0054]
根据本发明的实施方案,步骤1的后处理步骤中,所述的干燥方式优选选自冷冻干燥、减压干燥、常压干燥和喷雾干燥中的一种或多种,进一步优选为冷冻干燥和/或喷雾干燥。所述的冷冻干燥可以为真空冷冻干燥。
[0055]
根据本发明的实施方案,制得的盐酸决奈达隆注射组合物的ph为3.0~7.0。
[0056]
在一种实施方案中,制得的盐酸决奈达隆注射组合物的ph为3.0~6.0,例如3.0、4.0、5.0、6.0或7.0。
[0057]
本发明还提供了所述的盐酸决奈达隆注射组合物在制备制剂中的应用。
[0058]
根据本发明的实施方案,所述的制剂可以为注射剂。
[0059]
根据本发明的实施方案,所述的注射剂的规格可以为8ml。
[0060]
根据本发明的一种实施方案,所述的注射剂的浓度可以为5~12mg/ml,例如为10mg/ml;以盐酸决奈达隆在注射剂中的浓度计;优选地,所述盐酸决奈达隆在注射剂中至少以盐酸决奈达隆包合物形式存在。
[0061]
本发明还提供一种注射剂,含有所述的盐酸决奈达隆注射组合物。
[0062]
本发明还提供了所述盐酸决奈达隆注射剂的制备方法,包括由所述的盐酸决奈达隆注射组合物优选用微孔滤膜精滤,灌装、灭菌后,得到盐酸决奈达隆注射剂。
[0063]
本发明还提供了所述的盐酸决奈达隆注射组合物在制备治疗和/或预防心律失常的药物中的应用。
[0064]
本发明还提供了治疗和/或预防心律失常的方法,其为给患者施用有效剂量的所述的盐酸决奈达隆注射组合物或制剂。
[0065]
在不违背本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
[0066]
本发明所用试剂和原料均市售可得。
[0067]
本发明中,所述的室温是指环境温度为10℃~35℃。
[0068]
本发明的有益效果:本发明克服了现有技术中盐酸决奈达隆溶解度小、体外溶出速度低、生物利用度低、给药剂量大等缺陷,而提供了一种盐酸决奈达隆注射组合物、其制备方法及应用。
[0069]
本发明盐酸决奈达隆-环糊精包合物稳定性好、在水中的溶解度大大提高、比盐酸决奈达隆的溶解度提高了90倍左右(原料药在水中的溶解度仅为0.69mg/ml),生物利用度高,适合于工业化生产。本发明的盐酸决奈达隆包合物制备操作简单,制得的盐酸决奈达隆包合物易于制备制剂。本发明所制备的盐酸决奈达隆组合物、注射剂,稳定性好,适用于不宜口服给药的心律失常患者。
具体实施方式
[0070]
下文将结合具体实施例对本发明的技术方案做更进一步的详细说明。应当理解,下列实施例仅为示例性地说明和解释本发明,而不应被解释为对本发明保护范围的限制。凡基于本发明上述内容所实现的技术均涵盖在本发明旨在保护的范围内。
[0071]
除非另有说明,以下实施例中使用的原料和试剂均为市售商品,或者可以通过已知方法制备。
[0072]
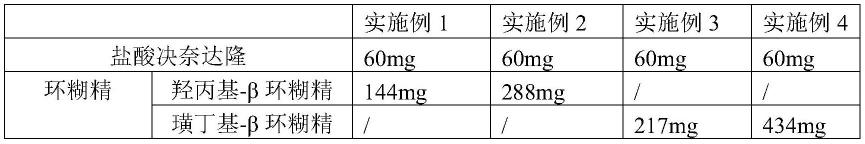
实施例1-4
[0073]
实施例1-4盐酸决奈达隆组合物的处方如表1所示:
[0074]
表1
[0075][0076][0077]
实施例5-10
[0078]
实施例5-10盐酸决奈达隆组合物的处方如表2所示:
[0079]
表2
[0080][0081]
实施例1-10的制备工艺:将环糊精配成30%浓度的水溶液,加入处方量盐酸决奈达隆,60℃条件下搅拌7小时,放至室温,过滤,冷冻干燥,即得盐酸决奈达隆环糊精包合物。
[0082]
将等渗调节剂、ph调节剂、抗氧化剂加入适量注射用水溶解,加入盐酸决奈达隆包合物,溶解,用ph调节剂调节ph至3~7。加水至配制量,所得溶液用微孔滤膜精滤,灌装,灭菌(121℃,15分钟),即得盐酸决奈达隆注射剂成品。
[0083]
分别将上述实施例5-10样品放置于高温(60℃)和加速条件(40℃
±
2℃,75%rh
±
5%rh),相应时间点取样检测,对盐酸决奈达隆含量、注射剂的ph值及有关物质进行测试。其中,盐酸决奈达隆含量及有关物质的检测方法如下:
[0084]
盐酸决奈达隆的含量:按照高效液相色谱法(通则0512)测定;
[0085]
溶剂:乙腈-水(体积比,60:40);
[0086]
供试品溶液:取本品适量,用溶剂稀释制成每1ml中约含决奈达隆0.08mg的溶液。
[0087]
对照溶液:取盐酸决奈达隆对照品适量,精密称定,用溶剂溶解并定量稀释制成每
1ml中约含决奈达隆0.08mg的溶液。
[0088]
色谱条件:用十八烷基硅烷键合硅胶为填充剂;以0.2%三乙胺溶液(精密量取三乙胺2ml置1000ml水中,混匀,用磷酸调节ph值至9.0)-乙腈(10:90)为流动相;流速为每分钟1.0ml;柱温30℃;检测波长为288nm;进样体积为10μl;运行时间为10min。
[0089]
有关物质:按照高效液相色谱法(通则0512)测定;
[0090]
溶剂:乙腈-水(体积比,60:40);
[0091]
供试品溶液:取本品适量,用溶剂稀释制成每1ml中约含决奈达隆0.8mg的溶液。
[0092]
对照溶液:精密量取供试品溶液适量,用溶剂定量稀释制成每1ml中约含决奈达隆1.6μg的溶液。
[0093]
色谱条件:用十八烷基硅烷键合硅胶为填充剂(推荐使用waters xbridge shield rp18,4.6mm
×
250mm,5μm或效能相当的色谱柱);以0.2%三乙胺溶液(精密量取三乙胺2ml置1000ml水中,混匀,用磷酸调节ph值至9.0)为流动相a,以乙腈为流动相b;流速为每分钟0.8ml;柱温30℃;检测波长为246nm;进样体积为25μl;运行时间为50min。
[0094]
稳定性结果如下表3-5所示:
[0095]
表3高温60℃的含量结果
[1]
[0096]
实施例0天5天10天实施例5101.3101.7101.0实施例6103.2102.1101.9实施例7100.9101.0100.4实施例8100.399.8100.5实施例9100.9100.7100.8实施例10
*
100.199.399.8
[0097]
[1]含量结果指的是澄清溶液中的盐酸决奈达隆的测试含量与理论值的百分比,理论值指的是处方量盐酸决奈达隆在处方量注射用水中的浓度;
[0098]
*
:实施例10在放置过程中会析出,因此后续不继续考察稳定性。
[0099]
由表3可知,高温5天、10天条件下,盐酸决奈达隆的含量结果较初始值几乎无变化。进一步进行高温30天和加速30天的测试,盐酸决奈达隆的含量结果较初始值相比也无明显变化,二者差值在0~5.0%范围内。说明,实施例5-10制备的盐酸决奈达隆注射剂具有良好的稳定性。
[0100]
表4高温60℃的ph结果
[0101]
实施例0天5天10天实施例56.05.86.1实施例65.75.35.1实施例74.94.94.9实施例83.03.03.0实施例95.55.55.5
[0102]
由表4可知,高温5天、10天条件下,盐酸决奈达隆的ph结果较初始值几乎无变化。进一步进行高温30天和加速30天的测试,盐酸决奈达隆的ph结果较初始值相比也无明显变化,二者差值在0~1.0范围内。说明,实施例5-9制备的盐酸决奈达隆注射剂具有良好的稳
定性。
[0103]
表5高温60℃的有关物质结果
*
[0104][0105]
*低于0.05%的杂质不计入总杂。
[0106]
由表5可知,高温5天、10天条件下,盐酸决奈达隆的有关物质结果较初始值几乎无变化。进一步进行高温30天和加速30天的测试,盐酸决奈达隆的有关物质结果较初始值相比也无明显变化。说明,实施例5-9制备的盐酸决奈达隆注射剂具有良好的稳定性。
[0107]
其中,已知杂质im-a的结构如下:
[0108][0109]
分子式为:c
27h36
n2o5s
[0110]
分子量为:500.65
[0111]
化学名为:n-[2-丁基-3-[4-[3-(丁基氨基)丙氧基]苯甲酰基]-5-苯并呋喃基]甲磺酰胺。
[0112]
实施例11
[0113]
本实施例处方与实施例7相同,制备工艺如下:将环糊精配成约9%浓度的水溶液,加入处方量盐酸决奈达隆,60℃条件下搅拌7小时,放至室温,过滤,冷冻干燥,即得盐酸决奈达隆环糊精包合物。
[0114]
将等渗调节剂、ph调节剂、抗氧化剂加入适量注射用水溶解,加入盐酸决奈达隆包合物,溶解,用ph调节剂调节ph至3~7。加水至配制量,所得溶液用微孔滤膜精滤,灌装,灭菌(121℃,15分钟),即得盐酸决奈达隆注射剂成品。
[0115]
得到的成品为澄清溶液,经上述含量测试,盐酸决奈达隆的测试含量与理论值之比近乎100%,说明盐酸决奈达隆的注射剂中的浓度约为8mg/ml。同时,本实施例注射剂的稳定性至少能够达到实施例5-9的稳定性。
[0116]
以上,对本发明的实施方式进行了说明。但是,本发明不限定于上述实施方式。凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。