1.本发明涉及生物技术领域,具体涉及一种黄酮苷在水稻抗草中的作用。
背景技术:
2.水稻田中杂草的生长严重危害水稻产量及其品质(amb and ahluwalia,2016;chung et al.,2018)。目前,施用除草剂是主要的控草方式,但大量施用除草剂存在诸多危害,如造成环境污染(annett et al.,2014),危害人体健康,并使抗性杂草数量增加(jabran et al.,2015)。因此发掘一种环境友好型的杂草治理技术,尤其是基于化感作用的控草策略越来越受到重视(cheng and cheng,2015)。植物化感作用指生物间的相生相克现象,即某种植物(或微生物)通过向环境中释放一种或多种化学物质(化感物质)从而对另一种植物(或微生物)的生长产生直接或间接影响的作用(rice,1984)。”目前在水稻中发现的化感物质主要可分为吲哚类、酚酸类、萜类、黄酮类、脂肪酸类和生物碱类等(khanh et al.,2007;kato-noguchi et al.,2011;chung et al.,2018),其中具有化感作用的黄酮类物质主要为麦黄酮(tricin,5,7,4'-trihydroxy-3',5'-dimethoxyflavone),而关于其他黄酮类物质是否具有化感作用,以及水稻化感作用的遗传机制和抑草机制却不是很清楚。
技术实现要素:
3.本发明要求保护一种黄酮苷在水稻抗草中的作用。
4.第一方面,本发明要求保护异荭草素在如下任一中的应用:
5.p1、抑制杂草生长;
6.p2、调控植物化感作用;
7.p3、调控植物对杂草抗性。
8.所述调控植物化感作用可体现为提高所述植物体内异荭草素的含量,则所述植物的化感作用增强。
9.所述调控植物对杂草抗性可体现为提高所述植物体内异荭草素的含量,则所述植物对杂草抗性增强。
10.第二方面,本发明要求保护一种抑制杂草生长的方法。
11.本发明要求保护的抑制杂草生长的方法,可包括如下步骤:向杂草外施异荭草素。
12.其中,所述异荭草素的工作浓度可为500mg/l以上。
13.在本发明的具体实施方式中,所述异荭草素的工作浓度为500mg/l。
14.在本发明的具体实施方式中,所述抑制杂草生长具体体现为抑制杂草的根(胚根)生长。
15.第三方面,本发明要求保护如下任一方法:
16.方法i:一种培育化感作用增强的植物品种的方法,包括如下步骤:使受体植物中异荭草素的含量提高,得到化感作用增强的植物品种。
17.方法ii:一种培育化感作用减弱的植物品种的方法,包括如下步骤:使受体植物中
异荭草素的含量降低,得到化感作用减弱的植物品种。
18.方法iii:一种培育对杂草抗性增强的植物品种的方法,包括如下步骤:使受体植物中异荭草素的含量提高,得到对杂草抗性增强的植物品种。
19.方法iv:一种培育对杂草抗性减弱的植物品种的方法,包括如下步骤:使受体植物中异荭草素的含量降低,得到对杂草抗性减弱的植物品种。
20.在所述方法中,使所述受体植物中异荭草素的含量提高可通过如下实现:
21.(a1)降低所述受体植物中能够催化异荭草素转化为其他物质的蛋白质的活性和/或表达量;和/或
22.(a2)提高所述受体植物中能够催化其他物质转化为异荭草素的蛋白质的活性和/或表达量。
23.在所述方法中,使所述受体植物中异荭草素的含量降低可通过如下实现:
24.(b1)提高所述受体植物中能够催化异荭草素转化为其他物质的蛋白质的活性和/或表达量;和/或
25.(b2)降低所述受体植物中能够催化其他物质转化为异荭草素的蛋白质的活性和/或表达量。
26.进一步地,所述(a1)可通过如下(a1)实现;所述(a2)可通过如下(a2)实现:
27.(a1)对所述受体植物中能够催化异荭草素转化为其他物质的蛋白质的编码基因进行抑制表达;
28.(a2)向所述受体植物中导入能够催化其他物质转化为异荭草素的蛋白质的编码基因。
29.进一步地,所述(b1)可通过如下(b1)实现;所述(b2)可通过如下(b2)实现:
30.(b1)向所述受体植物中导入能够催化异荭草素转化为其他物质的蛋白质的编码基因;
31.(b2)对所述受体植物中能够催化其他物质转化为异荭草素的蛋白质的编码基因进行抑制表达。
32.其中,所述其他物质为不能增强所述受体植物的化感作用的物质,或者为对所述受体植物化感作用的增强程度弱于异荭草素的物质。或者,所述其他物质为不能增强所述受体植物对杂草抗性的物质,或者为对所述受体植物对杂草抗性的增强程度弱于异荭草素的物质。
33.在本发明的具体实施方式中,所述(a1)、所述(a1)、所述(b1)和所述(b1)中,所述其他物质具体为异荭草素-2
”‑
o-吡喃葡萄糖苷。
34.在上述各方面中,所述植物可为水稻;所述杂草可为稗草。
35.第四方面,本发明要求保护os02g0589400蛋白或其相关生物材料在如下任一中的应用:
36.q1、催化异荭草素发生糖基化反应;
37.q2、制备异荭草素-2
”‑
o-吡喃葡萄糖苷;
38.q3、调控植物中异荭草素含量。
39.所述相关生物材料为能够表达所述os02g0589400蛋白的核酸分子或含有所述核酸分子的表达盒、重组载体、重组菌或转基因细胞系。
40.所述os02g0589400蛋白可为如下任一所示蛋白质:
41.(d1)氨基酸序列为seq id no.1的蛋白质;
42.(d2)将seq id no.1所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加且具有相同功能的蛋白质;
43.(d3)与(d1)-(d2)中任一所限定的氨基酸序列具有99%以上、95%以上、90%以上、85%以上或者80%以上同源性且具有相同功能的蛋白质;
44.(d4)在(d1)-(d3)中任一所限定的蛋白质的n端和/或c端连接标签后得到的融合蛋白。
45.上述蛋白质中,所述标签是指利用dna体外重组技术,与目的蛋白一起融合表达的一种多肽或者蛋白,以便于目的蛋白的表达、检测、示踪和/或纯化。所述标签可为flag标签、his标签、mbp标签、ha标签、myc标签、gst标签和/或sumo标签等。
46.能够表达所述os02g0589400蛋白的核酸分子可为如下任一所述的dna分子:
47.(e1)seq id no.2所示的dna分子;
48.(e2)在严格条件下与(e1)限定的dna分子杂交且编码所述os02g0589400蛋白的dna分子;
49.(e3)与(e1)或(e2)限定的dna序列具有99%以上、95%以上、90%以上、85%以上或者80%以上同源性且编码所述os02g0589400蛋白的dna分子。
50.上述核酸分子中,所述严格条件可为如下:50℃,在7%十二烷基硫酸钠(sds)、0.5m na3po4和1mm edta的混合溶液中杂交,在50℃,2
×
ssc,0.1%sds中漂洗;还可为:50℃,在7%sds、0.5m na3po4和1mm edta的混合溶液中杂交,在50℃,1
×
ssc,0.1%sds中漂洗;还可为:50℃,在7%sds、0.5m na3po4和1mm edta的混合溶液中杂交,在50℃,0.5
×
ssc,0.1%sds中漂洗;还可为:50℃,在7%sds、0.5m na3po4和1mm edta的混合溶液中杂交,在50℃,0.1
×
ssc,0.1%sds中漂洗;还可为:50℃,在7%sds、0.5m na3po4和1mm edta的混合溶液中杂交,在65℃,0.1
×
ssc,0.1%sds中漂洗;也可为:在6
×
ssc,0.5%sds的溶液中,在65℃下杂交,然后用2
×
ssc,0.1%sds和1
×
ssc,0.1%sds各洗膜一次。
51.所述重组表达载体可用现有的植物表达载体构建。所述植物表达载体包括双元农杆菌载体和可用于植物微弹轰击的载体等,如pcambia-1300-221、pgreen0029、pcambia3301、pcambia1300、pbi121、pbin19、pcambia2301、pcambia1301-ubin或其它衍生植物表达载体。所述植物表达载体还可包含外源基因的3’端非翻译区域,即包含聚腺苷酸信号和任何其它参与mrna加工或基因表达的dna片段。所述聚腺苷酸信号可引导聚腺苷酸加入到mrna前体的3’端。使用所述基因构建重组表达载体时,在其转录起始核苷酸前可加上任何一种增强型、组成型、组织特异型或诱导型启动子,例如花椰菜花叶病毒(camv)35s启动子、泛素基因ubiquitin启动子(pubi)、胁迫诱导型启动子rd29a等,它们可单独使用或与其它的植物启动子结合使用;此外,使用本发明的基因构建重组表达载体时,还可使用增强子,包括翻译增强子或转录增强子,这些增强子区域可以是atg起始密码子或邻接区域起始密码子等,但必需与编码序列的阅读框相同,以保证整个序列的正确翻译。所述翻译控制信号和起始密码子的来源是广泛的,可以是天然的,也可以是合成的。翻译起始区域可以来自转录起始区域或结构基因。为了便于对转基因植物细胞或植物进行鉴定及筛选,可对所用重组表达载体进行加工,如加入可在植物中表达的编码可产生颜色变化的酶或发光化合
物的基因、具有抗性的抗生素标记物或是抗化学试剂标记基因等。也可不加任何选择性标记基因,直接以逆境筛选转化植株。
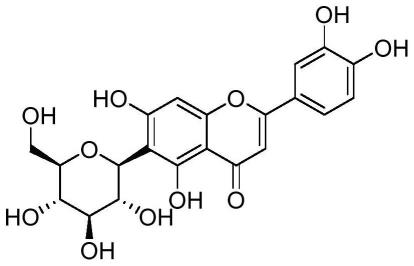
52.在上述各方面中,所述异荭草素(isoorientin)的结构式如图1所示。所述异荭草素-2
”‑
o-吡喃葡萄糖苷(isoorientin-2
”‑
o-glucopyranoside)的结构式如图2所示。
53.本发明提供的与化感有关的黄酮苷类物质为异荭草素(isoorientin)。化合物外施实验表明异荭草素具有显著抑制稗草胚根生长的作用。本发明提供的参与异荭草素(isoorientin)化合物形成的基因为os02g0589400。体外酶活实验表明os02g0589400能够催化isoorientin形成一种糖基化的产物异荭草素-2
”‑
o-吡喃葡萄糖苷(isoorientin-2
”‑
o-glucopyranoside)。当化合物外施浓度为500mg/l时,与产物isoorientin-2
”‑
o-glucopyranoside相比,isoorientin具有更显著的抑制稗草胚根生长的作用。可见,异荭草素(isoorientin)能够调控植物的化感作用,可用于抑制杂草生长。本发明对于开发一种对环境友好型的绿色农药具有重要意义,同时为水稻田中杂草的控制提供了理论指导。
附图说明
54.图1为isoorientin结构式。
55.图2为isoorientin-2
”‑
o-glucopyranoside结构式。
56.图3为os02g0589400蛋白纯化。其中箭头为蛋白纯化后重组蛋白的大小。
57.图4为os02g0589400体外酶活产物检测的色谱图。
58.图5为化合物isoorientin和isoorientin-2
”‑
o-glucopyranoside的抑草效果比较。a为isoorientin和isoorientin-2
”‑
o-glucopyranoside对稗草胚根生长的影响;b为isoorientin和isoorientin-2
”‑
o-glucopyranoside对稗草胚芽生长的影响。
具体实施方式
59.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
60.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
61.实施例1、化合物纯化
62.(1)收集播种后约55天目标化合物含量较高的籼稻品种的新鲜叶片,用冷冻干燥机干燥后研磨为粉末状。加入8倍体积75%的乙醇,超声提取3次,每次20min。
63.(2)过滤提取液,并用旋转蒸发仪浓缩至无醇味,加入等体积的石油醚萃取3次,收集石油醚相的萃取液后像剩余水相中加入等体积的二氯甲烷萃取3次,收集二氯甲烷相的萃取液后像剩余水相中加入等体积的正丁醇萃取3次,收集正丁醇相的萃取液。
64.(3)分别取(2)中各相萃取液1ml,干燥后用甲醇溶解,离心、吸取上清于agilent进样瓶中,利用uplc-qtof/ms检测各相中的化合物。色谱柱:rrhd sb-c18(agilent),填料粒径:1.8μm,规格:2.1mm(内径)
×
100mm(长度)。柱温:40℃,进样量:5μl。流动相a相:h2o(含0.1%甲酸,%表示体积百分含量);b相:乙腈。洗脱梯度:0-2min:5%b-10%b,2-12min:
10%b-25%b,12-18min:25%b-70%b,18-23min:70%b-90%b,23-25min:90%b-100%b,25-30min:100%b,后运行5min。流速0.3ml/min,质谱系统采用电喷雾离子源(esi),正离子检测模式,载气为高纯度氮气,压力:40psi,温度:325℃。经检测,目标化合物主要存在于正丁醇相。
65.(4)将获得的正丁醇相用旋转蒸发仪浓缩后利用中低压快速制备液相色谱仪(biotageisolera
tm prime)采用湿法上样进行粗分。硅胶柱填料:ymc*gel c18球形填料,填料粒径:50μm,孔径:12nm。流动相:水(含0.1%的甲酸,%表示体积百分含量)、甲醇。流动相比例为甲醇10%-90%10柱体积,90%-100%2柱体积,%表示体积百分含量。流速:50ml/min。
66.(5)用uplc-qtof/ms检测各个组分中目标化合物含量,检测方法同(3)。然后合并含有目的化合物的组分并用旋转蒸发仪浓缩。
67.(6)将浓缩物用ods色谱柱进行初分,依次用18:82,24:76,30:70,35:65,40:60,50:50,60:40,70:30,80:20,100:00(体积比)的甲醇:h2o溶液进行洗脱。共获得8个组分,然后用uplc-qtof/ms检测各个组分中目标化合物含量。经检测,组分2(fr2)、组分3(fr3)中含有目标化合物。
68.(7)将fr2浓缩后称重。然后将203mg fr2用反相半制备高效液相色谱进行分离。流动相:乙腈-h2o(15:85,v/v),流速:2.5ml/min。共获得13个组分(fr2.1-fr2.13)。经检测fr2.10中含有目标化合物。将其浓缩后,获得43mg浓缩物,然后用反相半制备高效液相色谱进一步进行分离。流动相:甲醇-h2o(40:60,v/v),流速:2.5ml/min,获得异荭草素-2
”‑
o-吡喃葡萄糖苷(isoorientin-2
”‑
o-glucopyranoside)(13.0mg,rt=18.3min)。
69.(8)fr 3浓缩后获得108mg浓缩物。然后将其用sephadex lh-20色谱柱进行初分,洗脱液为甲醇。共获得8个组分,其中组分2(fr3.2)含有目标化合物。浓缩后,用反相半制备高效液相色谱对fr 3.2(54mg)进行纯化。流动相:乙腈-h2o(20:80,v/v),流速:2.5ml/min,获得异荭草素(isoorientin)(16.9mg,rt=16.3min)。
70.(9)将得到的化合物单体利用nmr(bruker aviii 400spectrometer)进行结构鉴定。isoorientin的结构见图1,具体核磁结果为如下:1h-nmr(400mhz,methanol-d4)δ:6.53(1h,s,h-3),6.47(1h,s,h-8),7.35(1h,s,h-2
′
),6.89(1h,brs h-5
′
),7.35(1h,s,h-6
′
),4.89(1h,d,j=8.0hz,h-1
″
),4.18(1h,m,h-2
″
),3.48(1h,m,h-3
″
),3.50(1h,m,h-4
″
),3.43(1h,m,h-5
″
),3.91(1h,d,j=12.4hz,h-6a
″
),3.75(1h,dd,j=12.4,5.2hz,h-6b
″
),;
13
c-nmr(100mhz,methanol-d4)δ:166.2(c-2),103.9(c-3),184.0(c-4),162.0(c-5),109.1(c-6),164.8(c-7),95.2(c-8),158.7(c-9),105.2(c-10),123.5(c-1
′
),114.1(c-2
′
),147.0(c-3
′
),151.0(c-4
′
),116.8(c-5
′
),120.3(c-6
′
),75.3(c-1
″
),72.6(c-2
″
),80.1(c-3
″
),71.8(c-4
″
),82.6(c-5
″
),62.9(c-6
″
)。
71.isoorientin-2
”‑
o-glucopyranoside的结构见图2,具体核磁结果为如下:1h-nmr(400mhz,dmso-d6)δ:13.65(1h,s,5-oh),7.35(1h,s,h-6
′
),7.35(1h,s,h-2
′
),6.84(1h,brs h-5
′
),6.54(1h,s,h-3),6.40(1h,s,h-8),4.65(1h,d,j=8.0hz,h-1
″
),4.52(1h,m,h-2
″
),3.41(1h,m,h-3
″
),3.18(1h,m,h-4
″
),3.18(1h,m,h-5
″
),3.19(1h,m,h-6
″
),4.22(1h,d,j=8.5hz,h-1
″′
),2.85(1h,m,h-2
″′
),3.04(1h,m,h-3
″′
),3.04(1h,m,h-4
″′
),3.04(1h,m,h-5
″′
),3.66(1h,m,h-6
″′
);
13
c-nmr(100mhz,dmso-d6)δ:163.3.2(c-2),102.3(c-3),
181.6(c-4),160.5(c-5),108.2(c-6),161.5(c-7),93.2(c-8),156.9(c-9),104.7(c-10),121.1(c-1
′
),112.8(c-2
′
),146.0(c-3
′
),150.6(c-4
′
),116.11(c-5
′
),118.9(c-6
′
),71.6(c-1
″
),81.3(c-2
″
),78.6(c-3
″
),70.5(c-4
″
),81.6(c-5
″
),60.7(c-6
″
),105.6(c-1
″′
),74.6(c-2
″′
),76.6(c-3
″′
),69.8(c-4
″′
),76.6(c-5
″′
),61.7(c-6
″′
)。
72.实施例2、os02g0589400基因的应用
73.(1)基因克隆
74.以水稻品种中花11(oryza sativa l.ssp.japonica cv.zhonghua11,zh11)幼苗期叶片的基因组dna为模板克隆os02g0589400基因。通过酶切连接方法将目的基因连入peasy-t3载体(transgen biotech,cloning kit)。然后将连接产物转化dh5α感受态细胞,利用蓝白斑筛选阳性克隆,将获得的重组载体质粒命名为peasy-t3-os02g0589400。
75.重组载体peasy-t
3-os02g0589400的结构描述为:将peasy-t3载体的酶切位点bamhi和hindш之间的小片段替换为seq id no.2所示dna片段后的重组质粒。seq id no.2为os02g0589400基因的cds序列,编码seq id no.1所示蛋白质。
76.(2)os02g0589400原核表达
77.用限制性内切酶bamhi和hindш将重组载体peasy-t
3-os02g0589400完全酶切,同时酶切表达载体pmal-c2x(华越洋,vect-570)。跑胶后回收大小约为1.3kb包含os02g0589400的片段,以及6.6kb左右的pmal-c2x载体片段并进行连接,得到的重组质粒经测序验证正确后命名为pmal-os02g0589400。pmal-os02g0589400的结构描述为:将pmal-c2x载体bamhi和hindш两个酶切位点之间的序列替换为os02g0589400基因(seq id no.2)得到的载体。
78.将获得的重组原核表达载体pmal-os02g0589400转入大肠杆菌novablue(华越洋,wr4478)感受态细胞中。并转入pmal-c2x空载体作为对照。用含有ampicillin抗生素的lb平板筛选阳性克隆,并用pcr扩增法鉴定阳性克隆,引物为f1/r1,扩增片段大小414bp。
79.将阳性克隆接种于20ml含有ampicillin抗性的lb液体培养基,37℃,220rpm振荡培养12-14h。然后按1:1000的比例(体积比)将菌液转接至400ml lb液体培养基(含100μg/ml ampicillin),37℃,220rpm,培养至od 600
=0.6-0.8。将菌液取出置于冰上制冷后加入160μl浓度为500mm的iptg,使iptg的终浓度为0.2mm。16℃,100rpm振荡培养24h,以诱导蛋白表达。4℃,10,000rpm离心10min收集菌体。然后用柱缓冲液重悬菌体,置于-20℃冷冻过夜。柱缓冲液(1l)配方如下:nacl11.7g;dtt 154mg;0.5m edta 2ml;1m tris-hcl(ph=7.4)40ml;余量为水。次日待样品融化后,用超声破碎仪破碎细胞,然后10,000rpm离心10min。利用直链淀粉柱纯化目的蛋白。具体纯化过程如下:
80.a、利用柱缓冲液(配方见上)活化亲和柱填料(流速为1ml/min)。
81.b、将获得的粗蛋白上清液缓慢加入已活化的直链淀粉柱中,将流速调至约0.5ml/min,以使目的蛋白与亲和柱填料充分结合。
82.c、待样品都流过填料后,加入柱缓冲液冲洗多次,以去除未结合的杂蛋白。
83.d、加入15ml含有麦芽糖的柱缓冲液(1l柱缓冲液中含有3.6g麦芽糖)洗脱目的蛋白,重复该步骤一次。
84.e、将洗脱液分次加入超滤管中,每次4℃,5000rpm离心15min。
85.f、加入1ml 100mm tris-hcl,4℃,5000rpm离心15min,倒掉废液。将目的蛋白溶液转入1.5ml eppendorf离心管中。
86.g、吸取获得的目的蛋白溶液2μl,加入1ml bradford(quick start
tm bradford 1
×
dye reagent,biorad,cas 67-56-1),利用分光光度计测量待测蛋白在595nm(od
595
)处的吸收峰。并将目的蛋白的吸收值换算为蛋白浓度,得出纯化获得的os02g0589400重组蛋白的浓度为2.03μg/μl。
87.h、经sds-page电泳后,用考马斯亮蓝染色确认重组蛋白os02g0589400大小约为90kd(图3)。
88.引物f1:5
′‑
ggcgacacagctctcatgtcctcgt-3
′
;
89.引物r1:5
′‑
ccctctcgccccttccaagtagctc-3
′
。
90.(3)os02g0589400的体外酶活
91.酶活反应体系为:tris-hcl(ph 7.0,50mm,含有10mm dtt)38μl,10mm糖基受体(os02g0589400的糖基受体为isoorientin)1μl,100mm糖基供体(udpg)1μl,(2)中获得的os02g0589400重组蛋白10μl(os02g0589400蛋白浓度为2.03μg/μl)。30℃水浴反应1h,然后用等体积甲醇中止反应。以加入从转入pmal-c2x空载体的大肠杆菌中按照上述步骤(2)操作所得蛋白的样品为阴性对照。4℃,12,000rpm离心10min,取上清30μl用uplc-qtof/ms检测,检测方法同实施例1中所示uplc-qtof/ms检测方法。
92.检测结果表明,与空载体对照组相比,加入os02g0589400重组蛋白的反应体系中,os02g0589400能够催化isoorientin生成isoorientin-2
”‑
o-glucopyranoside。说明os02g0589400在催化isoorientin生成isoorientin-2
”‑
o-glucopyranoside的过程中发挥着重要作用(如图4所示)。
93.实施例3、化合物外施生菜和稗草
94.一、化合物外施生菜和稗草实验流程
95.供试化合物:isoorientin和isoorientin-2
”‑
o-glucopyranoside。
96.(1)将供试化合物用离心浓缩仪干燥至粉末状并称重,加入适量无菌水,使其终浓度为10mg/ml。
97.(2)配制0.8%琼脂500ml,并将其置于高压灭菌锅中灭菌。
98.(3)将灭好菌的琼脂置于超净台冷却至室温(注意:不要使培养基凝固),然后准确吸取4.75ml培养基于已灭菌的10ml离心管中。加入250μl 10mg/ml供试化合物溶液,使化合物的终浓度为500mg/l。将含有供试化合物的培养基快速倒于10cm
×
10cm的方形皿中,迅速摇晃方形皿,使培养基均匀的平铺于方形皿中。以加入等量无菌水的培养基作为对照。
99.(4)将稗草种子用蒸馏水洗数次,然后置于无菌滤纸上干燥。
100.(5)待培养基凝固后,用无菌镊子放入稗草种子,每个培养皿中放入26粒种子(分为两行,每行13粒种子)。每个处理包含3个生物学重复。
101.(6)将培养皿置于28℃培养箱中黑暗培养3天。
102.(7)表型统计:3天后统计每个处理材料的胚根和胚芽长度。
103.二、化合物外施稗草和生菜表型
104.如图5所示,按照500mg/l的浓度将isoorientin和isoorientin-2
”‑
o-glucopyranoside分别外施稗草,与对照相比,isoorientin处理后稗草的胚根长度显著变
短(p=1.539
×
10-3
);而isoorientin-2
”‑
o-glucopyranoside处理后稗草的胚根长度与对照相比并无显著差异(p=0.321)。此外,isoorientin和isoorientin-2
”‑
o-glucopyranoside处理后稗草的胚芽长度与对照相比均无显著差异(p=0.297,p=0.902)。说明外施化合物isoorientin主要影响稗草胚根的生长,且与产物isoorientin-2
”‑
o-glucopyranoside相比,isoorientin具有更显著的抑制稗草胚根生长的作用。
105.以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。