使用精氨酸消耗剂治疗aml亚型的方法
技术领域
1.本发明总体涉及生物学和医学领域,并且更具体地涉及用于治疗急性髓系白血病(acute myeloid leukemia,aml)的方法。仍更具体地,本发明涉及使用精氨酸消耗剂治疗aml亚型的方法,以及精氨酸消耗剂在制造用于治疗aml的药剂中的用途。
背景技术:
2.本发明的背景的以下讨论仅被提供以协助读者理解本发明,并且不被允许描述或构成本发明的背景技术。
3.急性髓系白血病(acute myeloid leukemia,aml),也称为急性骨髓细胞性白血病(acute myelogenous leukemia),其为遗传上异质的侵袭性癌症,其中基因改变的积累导致骨髓祖细胞在骨髓和血液中的不受控制的复制增生。更严重的情况涉及异常细胞浸润器官。aml是成人和儿童中最常见的急性白血病之一,白血病诊断占约成人病例的80%和儿童病例的20%。aml的大多数病例都发生在成人中,平均诊断年龄为68岁。被诊断患有aml的20岁以上人群的五年存活率仅为25%。
4.aml是一种异质性疾病,其被分类为几种亚型。aml亚型有两种主要的分类系统-法国-美国-英国(fab)系统和世界卫生组织(who)分类系统。fab分类系统是最常用的一种,也是本文中提到的一种。大多数被诊断患有aml的人都有9种不同的fab aml亚型之一(m0、m1、m2、m3、m4、m4 eos、m5、m6和m7)。尤其aml病例的预后通常取决于fab aml亚型。
5.尽管技术进步和对该疾病的新了解,但是被诊断患有aml的患者的总存活率已经趋于停滞,并且人们继续大量死于该疾病。化学疗法是目前治疗aml的主要模型,并且包括两个主要阶段:诱导和巩固(consolidation)。诱导疗法旨在完全缓解癌症。巩固是给予缓解后疗法的术语。在治疗开始的几日内,患者可能会因与治疗相关的死亡率而死亡。患者无法治愈的主要原因是对治疗的抗性,其通常表现为缓解后的复发。然而,目前没有针对成人复发或难治性aml的护理标准,并且此类患者的预后一般而言较差。
6.aml仍然是具有挑战性的疾病,并且存在用于治疗这种侵袭性癌症的新的治疗方法的需求。
技术实现要素:
7.本发明提供了使用精氨酸消耗剂来治疗急性髓系白血病(aml)的方法,以及精氨酸消耗剂在制造用于治疗aml的药剂中的用途。
8.本发明的发明人惊奇地发现,特定fab aml亚型对精氨酸消除的反应明显优于其他。因此,本文所述的方法和用途可用于基于fab aml亚型的aml标靶治疗。
9.在第一方面,本发明提供了一种用于治疗有需求的对象的急性髓系白血病(aml)的方法,所述方法包括向对象施用治疗有效量的精氨酸消耗剂,其中aml是法国-美国-英国(fab)亚型m0(未分化急性髓细胞白血病)、m2(急性成熟髓细胞白血病)、m4(急性成熟髓细胞白血病)、m4 eos(急性骨髓单核细胞白血病伴嗜酸细胞增多症)、m5(急性单核细胞白血
病)、m6(急性红白血病)或m7(急性巨核细胞白血病)。
10.在第一方面的一个实施方案中,精氨酸消耗剂包含精氨酸分解代谢酶。
11.在第一方面的一个实施方案中,精氨酸分解代谢酶是精氨酸脱亚氨酶、精氨酸酶,精氨酸脱羧酶或精氨酸2-单加氧酶。
12.在第一方面的一个实施方案中,精氨酸消耗剂是合成精氨酸消耗剂。
13.在第一方面的一个实施方案中,精氨酸消耗剂包含人血清白蛋白、白蛋白结合结构域、免疫球蛋白的fe区域、聚乙二醇(peg)基团、人转铁蛋白、xten、脯氨酸-丙氨酸-丝氨酸聚合物(proline-alanine-serine polymer,pas)、弹性蛋白样多肽(elastin-like polypeptide,elp)、同氨基酸聚合物(homo-amino-acid polymer,hap)、人造明胶样蛋白(artificial gelatin-like protein,glk)、羧基末端肽(carboxy-terminal peptide,ctp)或其组合。
14.在第一方面的一个实施方案中,精氨酸消耗剂包含人血清白蛋白、白蛋白结合结构域或其组合。
15.在第一方面的一个实施方案中,精氨酸消耗剂包含与seq id no:1具有至少95%、96%、97%、98%或99%的序列同一性的氨基酸序列或由其组成。
16.在第一方面的一个实施方案中,精氨酸消耗剂包含在seq id no:1中定义的氨基酸序列或由其组成。
17.在第一方面的一个实施方案中,aml是fab亚型m4或m7。
18.在第一方面的一个实施方案中,aml是fab亚型m7,并且精氨酸消耗剂包含与seq id no:1具有至少95%、96%、97%、98%或99%的序列同一性的氨基酸序列或由其组成。
19.在第一方面的一个实施方案中,aml是fab亚型m7,并且精氨酸消耗剂包含在seq id no:1中定义的氨基酸序列或由其组成。
20.在第一方面的一个实施方案中,aml是精氨酸营养缺陷的。
21.在第一方面的一个实施方案中,精氨酸消耗剂肌内、静脉内、皮下或口服施用。
22.在第一方面的一个实施方案中,精氨酸消耗剂是静脉内施用的。
23.在第一方面的一个实施方案中,对象是人类。
24.在第二方面,本发明提供了精氨酸消耗剂用于制造治疗有需求对象的aml的药剂的用途,其中aml是法国-美国-英国(fab)亚型m0(未分化急性髓细胞白血病)、m2(急性成熟骨髓母细胞白血病)、m4(急性成熟髓细胞白血病)、m4 eos(急性粒单核细胞白血病伴嗜酸细胞增多症)、m5(急性单核细胞白血病)、m6(急性红白血病)或m7(急性巨核细胞白血病)。
25.在第三方面,本发明提供了用于治疗有需求的对象的aml的精氨酸消耗剂,其中aml是法国-美国-英国(fab)亚型m0(未分化急性髓细胞白血病)、m2(急性成熟髓细胞白血病)、m4(急性成熟髓细胞白血病)、m4 eos(急性粒单核细胞白血病伴嗜酸细胞增多症)、m5(急性单核细胞白血病)、m6(急性红白血病)或m7(急性巨核细胞白血病)。
26.在第二方面或第三方面的一个实施方案中,精氨酸消耗剂包含精氨酸分解代谢酶。
27.在第二方面或第三方面的一个实施方案中,精氨酸分解代谢酶是精氨酸脱亚氨酶、精氨酸酶,精氨酸脱羧酶或精氨酸2-单加氧酶。
28.在第二方面或第三方面的一个实施方案中,精氨酸消耗剂是合成精氨酸消耗剂。
29.在第二方面或第三方面的一个实施方案中,精氨酸消耗剂包含人血清白蛋白、白蛋白结合结构域、免疫球蛋白的fe区域、聚乙二醇(peg)基团、人转铁蛋白、xten、脯氨酸-丙氨酸-丝氨酸聚合物(proline-alanine-serine polymer,pas)、弹性蛋白样多肽(elastin-like polypeptide,elp)、高氨基酸聚合物(homo-amino-acid polymer,hap)、人造明胶样蛋白(artificial gelatin-like protein,glk)、羧基末端肽(carboxy-terminal peptide,ctp)或其组合。
30.在第二方面或第三方面的一个实施方案中,精氨酸消耗剂包含人血清白蛋白、白蛋白结合结构域或其组合。
31.在第二方面的一个实施方案中,aml是精氨酸营养缺陷的。
32.在第二方面的一个实施方案中,该药剂被配制用于肌内、静脉内、皮下或口服施用。
33.在第二方面的一个实施方案中,该药剂被配制用于静脉内施用。
34.在第三方面的一个实施方案中,将精氨酸消耗剂以肌内、静脉内、皮下或口服方式施用至对象。
35.在第三方面的一个实施方案中,将精氨酸消耗剂以静脉内方式施用至对象。
36.在第二方面或第三方面的一个实施方案中,对象是人类。
附图说明
37.当结合附图,从以下本公开内容的描述中,本公开内容的上述和其他方面以及实施方案将变得显而易见,其中:
38.图1提供了精氨基琥珀酸合成酶(argininosuccinate synthetase,ass)与尿素循环之间关系的示意图。
39.图2示出在经nei-01处理后的胰腺细胞株(mia paca-2)中自噬(lc3-ii,beclin-1和磷酸-ampkα)和凋亡(parp-1)标志物的表达水平的凝胶图。
40.图3示出在经nei-01处理后的aml细胞系(hl-60)中自噬(lc3-ii,p62,磷酸-ampk-α,ampk-α)和凋亡(caspase-9)标志物的表达水平的凝胶图。
41.图4提供了在c1498(m4)同源aml模型中患有aml的小鼠的kaplan-meier存活曲线。
42.图5提供了在c1498(m4)同源aml模型中使用体内生物发光成像进行监测和定量的肿瘤负荷的图a-d。
43.图6提供了在c1498(m4)同源aml模型中使用体内生物发光成像进行监测和定量的肿瘤负荷的图。
44.图7提供了示出在kg-1来源的急性髓系白血病(fab aml m0)异种移植模型中重复nei-01处理后对肿瘤生长的抑制图。图7a示出了四周内平均肿瘤体积的变化。图7b示出了经过四周平均t/c%的变化。每3日测量肿瘤体积。到第28日,在处理组中观察到减少了39%。使用rm双因子变异数分析(two-way anova)计算统计数据,随后使用sidak的多重比较用于进行事后分析。**表示p值小于0.01。***表示p值小于0.001。
45.图8提供了示出移植有hl-60-gfphi-luc aml细胞的小鼠中的生物发光信号图。每周进行两次体内bli,并绘制bli强度的变化。数据表示为平均值
±
sem。
46.图9提供了示出在p31/fuj来源的急性髓系白血病(fab aml m5)异种移植模型中
重复nei-01处理后对肿瘤生长的抑制图。图9a示出了四周内平均肿瘤体积的变化。图9b示出了经过四周平均t/c%的变化。使用rm双因子变异数分析(two-way anova)计算统计数据,随后使用sidak的多重比较用于进行事后分析。*表示p值小于0.05。**表示p值小于0.01。***表示p值小于0.001。图9c示出了对照组和处理组之间的肿瘤重量差异。
47.图10提供了示出在mkpl-1来源的急性髓系白血病(fab aml m7)异种移植模型中重复nei-01处理后对肿瘤生长的抑制图。图10a示出了三周内平均肿瘤体积的变化。图10b提供了经过三周平均t/c%的变化。图10c示出了研究结束后的肿瘤重量。使用rm双因子变异数分析(two-way anova)计算统计数据,随后使用sidak的多重比较用于进行事后分析。*表示p值小于0.05。***表示p值小于0.001。
48.图11提供了外周血液中肿瘤负荷(由hcd45 细胞的百分比呈现)的生长曲线图。数据表示为平均值
±
sem。
49.图12是am8096模型中小鼠的kaplan-meirer存活曲线图。
50.图13提供了示出jurkat细胞对nei-01的体内反应图。图13a示出了四周内肿瘤体积的变化(%)。图13b示出了四周内平均t/c%的变化。每周两次测量肿瘤体积。数据表示为平均值
±
sem。使用双尾学生t检验。*表示p值等于或小于0.05。
51.图14提供了在第1日和第22日进行重复剂量研究的(a)雄性小鼠和(b)雌性小鼠中nei-01的平均血浆浓度图。
具体实施方式
52.定义
53.在本文中使用的特定术语应具有如下所阐明的含义。
54.如在本技术案中使用的,单数形式的“一个”、“一个”和“该”包括复数引用,除非上下文另外明确指出。
55.如本文所使用的,术语“包含”在非穷举意义上意思是“包括”。“词语”包含(comprising)“的变体,诸如”包含有(comprise)“和”含有(comprises)”,其具有对应变化的意义。
56.如本文所使用的,术语“多个”意思是多于一个。在特定的具体方面或实施方案中,多个可以意思是2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51或更多,以及其中可导出的任何数值,以及其中可导出的任何范围。
57.如本文所使用的,术语“在...之间“在参照数值范围时涵盖在该范围的每个端点处的数值。
58.如本文所使用的,术语“合成的”当用于描述产品时,是指与自然产生的产品相反,由人类代理生产的产品。例如,“合成的”精氨酸消耗剂是指已经透过人工化学反应生产的精氨酸消耗剂。
59.如本文所使用的,术语“治疗(”treat“,”treating“,”治疗“)”及类似术语是指减轻或改善与其相关的病症/疾病和/或症状。将可以理解,尽管不排除,治疗病症或状况不需要完全消除与之相关的病症、状况或症状。
60.如本文所使用的,术语“分解代谢”或“分解代谢的”是指化学反应,其中分子分解
成其他分子,例如较小的分子。例如,术语“精氨酸分解代谢酶”包括能够与精氨酸反应借此将其转化成其他分子(诸如鸟氨酸、瓜氨酸和胍丁胺(agmatine))的任何酶。
61.如本文所使用的,术语“对象”是指任何动物(例如,哺乳动物),包括但不限于人类、非人类灵长类、犬科动物、猫科动物和啮齿动物。
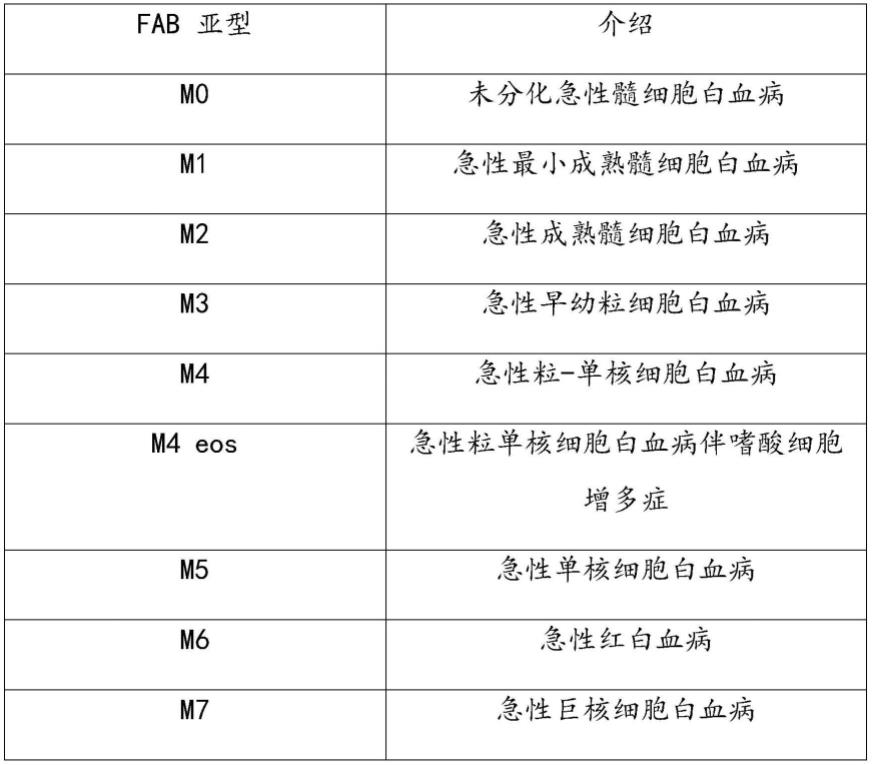
62.如本文中所使用的,术语“fab亚型”、“fab aml亚型”和“fab aml”是指由法国-美国-英国(fab)分类系统分类的aml的亚型。fab系统基于白血病由此发展成的细胞类型以及细胞的成熟程度,将aml分为9个亚型,m0、m1、m2、m3、m4、m4 eos、m5、m6和m7。
63.如本文所使用的,“序列同一性”的百分比将被理解为来自两个序列的比较,其中它们被比对以给出序列之间的最大相关性。这可以包括在一个或两个序列中插入“间隙”以增强比对程度。然后可以在所比较的每个序列的长度上确定序列同一性的百分比。例如,核苷酸序列(“对象序列”)具有与另一核苷酸序列(“查询序列”)至少95%的”序列同一性“旨在意指对象序列与查询序列相同,除了对象序列相对于查询序列的每100个核苷酸最多可以包括五个核苷酸变异。换言之,为了获得相对于查询序列具有至少95%的序列同一性的核苷酸序列,可以将对象序列中最多5%(即100个中的5个)的核苷酸插入或替换为另一个核苷酸或删除。
64.如本文所使用的,术语“营养缺陷的”当用于描述癌症时,是指不能合成生长和/或代谢所需的一种或更多种具体物质的癌症。例如,“对于精氨酸营养缺陷”的aml是指不能合成精氨酸的aml。
65.急性髓系白血病(aml)是成人和儿童中最常见的急性白血病之一。前用于治疗aml的方法有时会导致与治疗相关的死亡率。在治疗实现初步成功的情况下,缓解后的复发很常见。针对这种侵袭性癌症开发新的治疗方法非常重要。
66.本发明提供了使用精氨酸消耗剂治疗aml的方法。本文提供的方法可以减少或改善与其相关的疾病和/或症状。该方法可以消除所述疾病和/或症状或可以不完全消除所述疾病和/或症状。本文所述的精氨酸消耗剂也可以用于制造用于治疗aml的药剂,其可以减少或改善与其相关的疾病和/或症状,并且可以消除所述疾病和/或症状或可以不完全消除所述疾病和/或症状。
67.fab aml亚型
68.aml是一种异质性疾病,其被分类为几种亚型。aml亚型有两种主要的分类系统-法国-美国-英国(fab)系统和世界卫生组织(who)分类系统。fab分类系统是最常用的一种,也是本文中提到的一种。大多数被诊断患有aml的人都有9种不同的fab aml亚型之一(m0、m1、m2、m3、m4、m4 eos、m5、m6和m7)。尤其aml病例的预后通常取决于aml亚型。
69.fab分类系统基于白血病由此发展成的细胞类型以及细胞的成熟程度将aml分为m0至m7亚型,如表1所示:
70.表1:fab aml子类型和描述
[0071][0072]
本发明提供了用于治疗aml的方法以及精氨酸消耗剂在制造用于治疗任何亚型的aml的药剂中的用途。在一些实施方案中,本发明提供了用于治疗fab aml m0的方法以及精氨酸消耗剂在制造用于治疗fab aml m0的药剂中的用途。本发明的方法和药剂也可以用于治疗fab aml m2。在其他实施方案中,本发明提供了用于治疗fab aml m4的方法和药剂。在进一步的实施方案中,本发明提供了用于治疗fab aml m4 eos的方法和药剂。在又进一步的实施方案中,本发明提供了用于治疗fab aml m5的方法和药剂。用于治疗fab aml m6的方法和药剂也在本文中提供。本发明也提供了用于治疗fab aml m7的方法和药剂。尽管本文提供的方法和药剂是在治疗由fab分类系统定义的aml亚型的语境中呈现的,但通常技术人员将理解,它们可用于治疗使用任何其他分类系统或方法所分类的aml病例。
[0073]
fab aml分类系统建立于1976年,在本领域中是众所周知的。本发明所属技术领域中普通技术人员可以使用例如组织化学染色和显微术容易地识别样本的fab aml亚型。所使用的aml样本可以例如从外周血液、骨髓抽出液或活体组织切片获得。医学博士charles a.schiffer和医学博士richard m.stone(2003)在“holland-frei cancer medicine,第6版”中提供了各种fab aml亚型的详细描述,包括有助于识别的图,kufe dw,pollock re,weichselbaum rr,et al.(eds.)hamilton(on),1983。
[0074]
各种代谢途径都需要精氨酸。由于精氨酸合成所需的低程度或不存在精氨基琥珀酸合成酶(ass)和/或鸟氨酸氨甲酰基转移酶(otc),许多肿瘤是精氨酸营养缺陷的。在大多数aml病例中,细胞中缺少ass1
‑‑
人类中编码ass的基因。对于本发明所属技术领域中普通
通常技术人员而言,使用诸如蛋白质印迹法、elisa、sds-page或免疫沉淀的众所周知的方法,将容易地确定来自aml样本的细胞是否缺乏前述酶中的一种或两种。
[0075]
本发明的一些实施方案提供了用于治疗对象的aml的方法,其包含向对象施用治疗有效量的精氨酸消耗剂。进一步的实施方案提供了精氨酸消耗剂用于制造治疗有需求对象的aml的药剂的用途。对象可以是任何动物(例如哺乳动物),包括但不限于人类、非人类灵长类、犬科动物、猫科动物和啮齿动物。
[0076]
精氨酸消耗剂
[0077]
用于本文所述的治疗方法和药剂中的精氨酸消耗剂可以是本领域已知的能够降低对象的血浆和/或细胞中精氨酸程度的任何精氨酸消耗剂。精氨酸消耗剂可以是例如小分子或蛋白质。
[0078]
在一些实施方案中,精氨酸消耗剂包含精氨酸分解代谢酶。精氨酸分解代谢酶的非限制性实施例包括精氨酸酶、精氨酸脱亚氨酶、精氨酸脱羧酶和精氨酸2-单加氧酶。
[0079]
精氨酸酶可以是本领域已知的任何精氨酸酶,诸如由细菌、真菌、鱼、人、牛、猪、兔、啮齿动物、灵长类、绵羊和山羊产生的那些精氨酸酶。精氨酸酶的非限制性实施例包括热芽孢杆菌精氨酸酶(bacillus caldovelox arginase)、嗜热栖热菌精氨酸酶(thermus thermophilus arginase)、山羊精氨酸酶i(capra hircus arginase i)、裸鼹鼠精氨酸酶i(heterocephalus glaber arginase i)、牛精氨酸酶i(bos taurus arginase i)、猪精氨酸酶i(sus scrofa arginase i)、香鱼精氨酸酶i(plecoglossus altivelis arginase i)、大西洋鲑精氨酸酶i(salmo salar arginase i)、虹鳟精氨酸酶i(oncorhynchus mykiss arginase i)、美洲胡瓜鱼精氨酸酶i(osmerus mordax arginase i)、三角帆蚌精氨酸酶i(hyriopsis cumingii arginase i)、褐家鼠精氨酸酶i(rattus norvegicus arginase i)、小鼠精氨酸酶i(mus musculus arginase i)、智人(人)精氨酸酶i(homo sapiens(human)arginase i)、黑猩猩精氨酸酶i(pan troglodytes arginase i)、穴兔精氨酸酶i(oryctolagus cuniculus arginase i)、褐家鼠精氨酸酶ii(rattus norvegicus arginase ii)、小鼠精氨酸酶ii(mus musculus arginase ii)、智人(人)精氨酸酶ii(homo sapiens(human)arginase ii)、牛精氨酸酶ii(bos taurus arginase ii)、裸鼹鼠精氨酸酶ii(heterocephalus glaber arginase ii)、黑猩猩精氨酸酶ii(pan troglodytes arginase ii)、穴兔精氨酸酶ii(oryctolagus cuniculus arginase ii)、代夫特菌精氨酸酶(delftia arginase)、凝结芽孢杆菌精氨酸酶(bacillus coagulans arginase)、光能营养赫夫勒氏菌精氨酸酶(hoeflea phototrophica arginase)和光合玫瑰弯菌精氨酸酶(roseiflexus castenholzii arginase)。其他实施例包括来自嗜甲醇芽孢杆菌(bacillus methanolicus)、nrrl b-14911芽孢杆菌(bacillus sp.nrrl b-14911)、东海游动球菌(planococcus donghaensis)、树形类芽孢杆菌(paenibacillus dendritiformis)、链孢子菌(desmospora sp)、苔原草甸甲基杆状菌(methylobacter tundripaludum)、窄食单胞菌(stenotrophomonas sp)、产国聚糖微杆菌(microbacterium laevaniformans)、维氏卟啉单胞菌(porphyromonas uenonis)、农杆菌(agrobacterium sp)、北极十八杆菌(octadecabacter arcticus)、根癌农杆菌(agrobacterium tumefaciens)、好热黄无氧芽孢菌(anoxybacillus flavithermus)、短小芽孢杆菌(bacillus pumilus)、嗜热葡糖糖苷地芽孢杆菌(geobacillus thermoglucosidasius)、geobacillus thermoglucosidans、侧
孢短芽孢杆菌(brevibacillus laterosporus)、瘤胃脱硫肠状菌(desulfotomaculum ruminis)、嗜热地芽孢杆菌(geobacillus kaustophilus)、嗜热噬油地芽胞杆菌(geobacillus thermoleovorans)、嗜热脱氮地芽胞杆菌(geobacillus thermodenitrificans)、金黄色葡萄球菌(staphylococcus aureus)、嗜盐古菌dl31(halophilic archaeon dl31)、盐惰菌(halopigerxanaduensis)、马加蒂湖无色需碱菌(natrialba magadii)、恶性疟原虫(plasmodium falciparum)、幽门螺旋杆菌(helicobacter pylori)及其类似物种。
[0080]
在本发明的方法和药剂中使用的精氨酸脱亚氨酶可以是本领域已知的任何精氨酸去亚胺酶,诸如由霉浆菌(mycoplasma)、乳酸球菌(lactococcus)、假单胞菌(pseudomonas)、链球菌(steptococcus)、埃希氏菌(escherichia)、分枝杆菌(mycobacterium)或芽孢杆菌属微生物(bacillus microorganisms)产生的精氨酸去亚胺酶。实施例性的精氨酸脱亚氨酶包括但不限于由人源分枝杆菌(mycoplasma hominis)、精氨酸霉浆菌(mycoplasma arginini)、关节炎霉浆菌(mycoplasma arthritidis)、产气荚膜梭状芽孢杆菌(clostridium perfringens)、地衣芽孢杆菌(bacillus licheniformis)、伯氏疏螺旋体(borrelia burgdorferi)、borrelia afzellii、粪肠球菌(enterococcus faecalis)、乳酸乳球菌(lactococcus lactis)、仙人掌杆菌(bacillus cereus)、化脓性链球菌(streptococcus pyogenes)、肺炎链球菌(steptococcus pneumoniae)、清酒乳酸杆菌(lactobacillus sake)、贾第鞭毛虫(giardia intestinalis)、结核分枝杆菌(mycobacterium tuberculosis)、pseudomonas plecoglossicida、恶臭假单胞菌(pseudomonas putida)、绿脓杆菌(pseudomonas aeruginosa)及其类似物种产生。
[0081]
精氨酸脱羧酶可以是本领域已知的任何精氨酸脱羧酶,诸如由大肠杆菌(escherichia coli)、鼠伤寒沙门氏杆菌(salmonella typhimurium)、肺炎披衣菌(chlamydophila pneumoniae)、詹氏甲烷球菌(methanocaldococcus jannaschii)、绿草履虫绿球藻病毒i(paramecium bursaria chlorella virus 1)、创伤弧菌yj016(vibrio vulnificus yj016)、空肠弯曲杆菌(campylobacter jejuni subsp)、克氏锥虫(trypanosoma cruzi)、硫磺矿硫化叶菌(sulfolobus solfataricus)、地衣芽孢杆菌(bacillus licheniformis)、仙人掌杆菌(bacillus cereus)、番木瓜(carica papaya)、红花烟草(nicotianatobacum)、大豆(glycine max)、百脉根(lotus coniculata)、创伤弧菌(vibrio vulnificus)、霍乱弧菌(vibrio cholerae)、小鼠(mus musculus)、热袍菌(thermotoga)、褐家鼠(rattus norvegzcus)、智人(homo sapiens)、野牛(bos taurus)、猪(sus scrofa)、嗜热栖热菌(thermus thermophiles)、thermus parvatiensis、水生栖热菌(thermus aquaticus)、嗜热栖热菌(thermus thermophilus)、thermus islandicus、阿拉伯芥(arabidopsis thaliana)、燕麦(avena sativa)及其类似物种产生。
[0082]
在本发明的方法和药剂中使用的精氨酸2-单加氧酶可以是本领域已知的任何精氨酸2-单加氧酶,诸如从球形节杆菌ifo 12137(arthrobacter globiformis ifo 12137)、简单节杆菌ifo 12069(arthrobacter simplex ifo 12069)、黄色短杆菌ifo 12073(brevibacterium helvolum ifo 12073)、同性恋螺杆菌ccug 18818(helicobacter cinaedi ccug 18818)、灰色链霉菌(streptomyces griseus)及其类似物种产生。
[0083]
本发明的精氨酸消耗剂可以包含天然出现和/或合成产物。在本发明的一些实施
方案中,精氨酸消耗剂包含自然出现的精氨酸分解代谢酶。在其他实施方案中,精氨酸消耗剂包含合成的精氨酸分解代谢酶。
[0084]
精氨酸消耗剂可包含完整蛋白质和/或其功能片段和/或其变体。在方法和用途中使用的精氨酸脱羧酶、精氨酸脱亚氨酶、精氨酸2-单加氧酶、精氨酸酶和其他精氨酸消耗剂可以被修饰,以改善其药物代谢动力学性质,诸如透过将蛋白质和/或其功能片段和/或其变体与人血清白蛋白、白蛋白结合结构域、免疫球蛋白的fe区域、聚乙二醇(peg)基团或其组合融合。在本发明的一些实施方案中,一种或更多种前述修饰延长了精氨酸消耗剂的半衰期。在进一步的实施方案中,半衰期的增加导致实现相同结果所需之精氨酸消耗剂的施用频率降低。对精氨酸消耗剂的一种或更多种前述修饰可降低免疫原性,这可有助于避免不良作用。
[0085]
在本发明的一些实施方案中,精氨酸分解代谢酶可以被工程化以包括酶上的具体位点,例如,可以选择性地附接peg。所选择的peg化位点可以位于从酶的活性位点去除的位点,和/或一般可以暴露于溶剂中以允许与peg化试剂反应。
[0086]
本领域已知的任何peg化试剂可被用于将peg共价附接于本文所述的精氨酸分解代谢酶。示例性的peg化试剂包括但不限于mpeg-ald(甲氧基聚乙二醇-丙醛)、mpeg-mal(甲氧基聚乙二醇-马来酰亚胺)、mpeg-nhs(甲氧基聚乙二醇-n-羟基丁二酰亚胺)、mpeg-spa(甲氧基聚乙二醇-丁二酰亚胺基丙酸酯)和mpeg-cn(甲氧基聚乙二醇-氰尿酰氯)。
[0087]
在一些实施方案中,peg基团的分子量为约5,000至约20,000amu,约5,000至约15,000amu,约5,000至约12,000amu,约7,000至约12,000amu或约7,000至约10,000amu。在特定实施方案中,peg基团的分子量为约2,000amu至10,000amu。在一些实施方案中,peg基团是peg4,000、peg5,000、peg6,000或peg7,000。
[0088]
peg基团可以共价地直接附接至酶或透过接头附接。在特定实施方案中,酶经由丙酸接头共价附接至peg。
[0089]
精氨酸分解代谢酶可以与具有固有长血清半衰期的蛋白质融合,这可以导致更为所需的药物代谢动力学谱。本发明的精氨酸消耗剂可以包含抗体fc结构域和/或血清白蛋白。精氨酸消耗剂可以包含遗传上与抗体fc结构域和/或血清白蛋白融合的精氨酸分解代谢酶。在一些实施方案中,免疫球蛋白的fe区域来自人免疫球蛋白,例如人igg。在一些实施方案中,酶可以与白蛋白结构域融合。在进一步的实施方案中,酶可以与人转铁蛋白融合。
[0090]
在本发明的进一步实施方案中,精氨酸消耗剂包含与非结构化多肽融合的精氨酸分解代谢酶。酶与非结构化多肽的融合可增加试剂的总体大小和/或流体动力学半径。在本发明的一些实施方案中,精氨酸分解代谢酶与xten(其为重组peg模拟物(xtenylation)、pas(脯氨酸-丙氨酸-丝氨酸聚合物(pasylation))、elp(其为弹性蛋白样多肽(elpylation))、hap(其为高氨基酸聚合物(hapylation))和人造明胶样蛋白(glk)中的任何一种或更多种融合。
[0091]
在本发明的一些实施方案中使用的精氨酸分解代谢酶可以与阴离子多肽融合,这可以增加试剂的负电荷。酶可以与羧基末端肽(ctp)融合。一个合适的ctp融合非限制性实施方案是来自人绒毛膜促性腺激素(chorionic gonadotropin,cg)β链的ctp的基因融合。
[0092]
精氨酸分解代谢酶可以经由与血清白蛋白的非共价相互作用与血清白蛋白连接,这也可以延长试剂的半衰期。在本发明实施方案的一个非限制性实例中,白蛋白结合部分
与治疗酶缀合或与治疗酶遗传融合。可以使用许多类型的部分,包含但不限于(i)对白蛋白具有内部亲和力的分子;(ii)被产生并被选择以展现白蛋白结合活性的胜肽、抗体片段、替代架构和小化学物质。
[0093]
重组融合蛋白在1980年代首次使用,并且是透过两个或更多个基因的融合而产生的,每个基因编码一个单独的蛋白质。各种融合蛋白的合成方法是本领域众所周知的。参见例如yu et al.,biotechnology advances,2015;33:155-164,其提供目前用于设计和构建合成融合蛋白的最常用方法的回顾。strohl,biodrugs,2015;29(4):215-239,其提供了融合蛋白的另一种详细回顾,并概述了融合方法和不同类型融合蛋白的优缺点。
[0094]
在本发明的一些实施方案中,精氨酸消耗剂包含氨基酸序列或由其组成,该氨基酸序列具有与seq id no:1至少75%、80%、85%、87%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性。
[0095]
在进一步的实施方案中,精氨酸消耗剂包含氨基酸序列或由其组成,该氨基酸序列具有与seq id no:1至少95%、96%、97%、98%、99%或100%的序列同一性。在又进一步的实施方案中,精氨酸消耗剂包含由seq id no:1定义的氨基酸序列或由其组成。
[0096]
用于评估序列之间的同源性和同一性程度的方法是本领域众所周知的。例如,可以使用数学算法来计算两个序列之间的序列同一性的百分比。合适的数学算法的非限制性实施例在karlin及其同事的出版物(1993,pnas usa,90:5873-5877)中描述。此算法被整合到blast(基本局部比对搜寻工具)程式家族中(也见altschul et al.(1990),j.mol.biol.215,403-410,或altschul et al.(1997),nucleic acids res,25:3389-3402),blast可经由国家生物技术信息中心(ncbi)网站主页(https://www.ncbi.nlm.nih.gov)取得。blast程序可在https://blast.ncbi.nlm.nih.gov/blast.cgi免费取得。其他非限制性实施例包括clustal(http://www.clustal.org/)和fasta(pearson(1990),methods enzymol.83,63-98;pearson and lipman(1988),proc.natl.acad.sci.u.s.a 85,2444-2448.)程序。这些程序和其他程序可被用于识别至少在某种程度上与给定的输入序列相同的序列。另外地或可替代地,可以使用威斯康辛州序列分析包(wisconsin sequence analysis package)版本9.1中可用的程序devereux et al.1984,nucleic acids res.,387-395),例如程式gap和bestfit,来确定在两个多肽序列之间的序列同一性的百分比。bestfit使用smith和waterman(1981,j.mol.biol.147,195-197)的局部同源性演算法,并识别两个序列之间相似性的最佳单个区域。在本文中参照与参考氨基酸序列共享指定百分比的序列同一性的氨基酸序列时,序列之间的差异可以部分或完全由保留氨基酸取代引起。在这种情况下,用一个或多个保留氨基酸取代识别的序列可以实质上或完全保留与参考序列相同的生物学活性。
[0097]
精氨酸消耗剂的施用
[0098]
为了治疗用途,可以将本文所述的精氨酸消耗剂制备为医药组合物,该医药组合物含有本文所述的治疗有效量的精氨酸消耗剂,其作为在药学上可接受的载体中的活性成分。术语“载体”是指携带所施用的活性化合物的稀释剂、佐剂、赋形剂或媒介物。此种媒介物可以是液体,诸如水和油,包括石油、动物、植物或合成来源的那些液体,诸如花生油、大豆油、矿物油、芝麻油及其类似物。作为非限制性实例,可以使用0.9%的生理食盐水和0.3%的甘胺酸。这些溶液可以是无菌的,并且一般不含微粒物质。它们可以透过传统的众
所周知的灭菌技术(例如过滤)进行灭菌。该组合物可以含有接近生理条件所需的药学上可接受的辅助物质,诸如ph调节剂和缓冲剂、稳定剂、增稠剂、润滑剂和着色剂等。在这种医药制剂中精氨酸消耗剂的浓度基于所需的剂量、液体体积、粘度等,根据所选择的特定施用模型,可以被广泛地改变并且可以被选择。合适的媒介物和制剂描述于,例如在remington:the science and practice of pharmacy,21st edition,troy,d.b.ed.,lipincott williams and wilkins,philadelphia,pa.2006,part 5,pharmaceutical manufacturing pp 691-1092,尤其见pp.958-989。
[0099]
需要观察其治疗作用的对象中血浆精氨酸的浓度可以基于许多因素而改变,该等因素包括对象的条件和/或aml的类型和严重性和/或饮食组成。目标血浆精氨酸程度的选择相当在本发明所属技术领域中具有通常技术人员的技术范围内。
[0100]
治疗持续时间的确定,例如在对象中的血浆精氨酸浓度维持在耗尽状态的持续时间,相当在本发明所属技术领域中具有通常技术人员的技术范围内。在特定实施方案中,治疗的持续时间多于1周、多于2周、多于3周、多于4周、多于5周、多于6周、多于7周、多于8周、多于9周、多于10周、多于11周、多于12周、多于24周、多于28周、多于32周、多于36周、多于40周、多于4四周、多于48周、多于52周或多于56周。
[0101]
在本发明的方法和用途中,关于精氨酸消耗剂的施用模型的应用没有限制。在本发明的一些实施方案中,精氨酸消耗剂的施用模型是静脉内的。用于本文所述的精氨酸消耗剂的治疗用途的施用模型可以是将试剂递送给对象的任何合适途径,诸如肠胃外施用,例如皮内、肌内、腹膜内、静脉内和/或皮下施用;经肺施用;粘膜间(transmucosal)施用(例如口、鼻内、阴道内和/或直肠);使用片剂、胶囊、溶液、悬浮液、粉末、凝胶和/或颗粒的剂型;并且在注射器、植入装置、渗透泵、注射管和/或微型泵中;或本发明所属技术领域中具有通常技术人员所熟知的其他装置。
[0102]
本发明所属技术领域中具有通常技术人员将认识到,在不脱离如广泛描述的本发明的精神或范围的情况下,可以对在具体实施方案中揭示的本发明进行多种变化和/或修改。因此,本实施方案在所有方面中将被认为是说明性的而不是限制性的。
[0103]
实施例
[0104]
现在将参考以下具体实施例描述本发明,该等具体实施例不应被解释为以任何方式进行限制。
[0105]
实施例1:nei-01在一范围内的癌细胞系中的细胞毒性。
[0106]
外源性精氨酸对于某些精氨基琥珀酸合成酶(ass)缺陷型癌症的生长是必需的。nei-01是一种重组白蛋白结合精氨酸脱亚氨酶,其可以将精氨酸转化为瓜氨酸和氨气,并透过消耗精氨酸来抑制各种ass缺陷型癌症的生长(图1)。细胞毒性试验结果证明,nei-01在一定范围内的不同癌细胞系中均消耗精氨酸并抑制癌细胞的生长(尤其是在ass1缺陷型癌细胞系中)(表2)。
[0107]
表2.针对以nei-01处理后的不同癌细胞系的细胞毒性试验结果。
[0108][0109][0110]
表3中提供了针对以nei-01处理后的不同aml细胞系的细胞毒性试验的结果。
[0111]
表3.针对以nei-01处理后的不同癌细胞系的细胞毒性试验结果。
[0112][0113]
实施例2:细胞凋亡和自噬。
[0114]
nei-01处理胰腺癌细胞系mia paca-2。
[0115]
为了证实由自噬细胞死亡引起的细胞存活率的精氨酸剥夺介导下降,以指定浓度的nei-01并以或不以氯喹(cq)处理mia paca-2细胞。在指定的时间点,收获细胞并使用针对数种自噬和细胞凋亡标志物的抗体对其进行免疫印迹法。
[0116]
如图2所示,当进行nei-01处理时,自噬标志物lc3-ii,beclin-1和磷酸化ampkα的表达水平增加,暗示自噬在nei-01诱导的细胞死亡中产生作用。相反地,当进行nei-01处理时,细胞凋亡标志物parp-1的表达水平降低,证明细胞凋亡途径的活化。这些结果显示细胞凋亡和自噬在精氨酸剥夺介导的细胞死亡机制中产生作用。
[0117]
实施例3.aml细胞系hl-60的nei-01处理。
[0118]
为了进一步证实由自噬细胞死亡引起的细胞存活率的精氨酸剥夺介导下降,以nei-01及cq处理ass1缺陷型的hl-60aml细胞。如图3所示,当进行nei-01处理时,自噬标志物lc3-ii、p62、磷酸-ampkα和ampkα的表达水平增加,暗示自噬在nei-01诱导的细胞死亡中产生作用。相反地,在进行nei-01处理之后,细胞凋亡标志物caspase-9的表达水平降低,证明细胞凋亡途径的活化。这些结果示出细胞凋亡和自噬在精氨酸剥夺介导的细胞死亡机制中产生作用。
[0119]
实施例4至10:nei-01在aml亚型上的作用
[0120]
存在用于识别aml亚型的两种主要分类系统-法国-美国-英国(fab)系统和世界卫生组织(who)分类系统。fab系统是最常用的一种,也是本文中提到的一种。根据fab系统,大多数被诊断患有aml的人都有9种不同的aml类型(亚型)之一:m0、m1、m2、m3、m4、m4 eos、m5、m6和m7。
[0121]
实施例4:nei-01在c1498同源急性髓系白血病(fab aml m4)模型中的抗癌活性。
[0122]
此研究目的在于评估在c1498同源aml(fab aml m4)模型中,精氨酸剥夺酶nei-01的抗癌活性。
[0123]
将与萤光素酶和绿色萤光蛋白(gfp)共同标记的鼠精氨基琥珀酸合成酶(ass1)缺陷型c1498细胞被静脉内(i.v.)移植到c57bl/6小鼠中以建立同源aml模型。将小鼠随机分
为4组。表4提供了4组的详细信息及其对应的处理方案。
[0124]
表4:针对c1498同源急性髓系白血病(fab aml m4)模型研究的组别和处理方案。
[0125][0126]
结果示出,与pbs处理的对照组相比,以nei-01处理显著延长了患有aml亚型m4的小鼠的总体存活(图4)。中位存活日(msd)从组别1(对照组)中的24日延长到组别2中的29日(一周一次以nei-01 140u/kg处理,与对照组对照,p=0.0058)。
[0127]
此外,组别3中多于60%的小鼠(一周一次以nei-01 280u/kg处理)和组别4中所有小鼠(一周两次以nei-01 280u/kg处理)存活到实验结束。组别3和组别4的中位存活率》31日(组别3与对照组对照,p=0.0003;组别4与对照组对照,p《0.0001)。与观察到的总体存活结果一致,以nei-01的处理除了减慢疾病进程外,还显著减少总体白血病负荷(图5和图6)。nei-01的此抗癌活性以剂量依赖性方式呈现。
[0128]
此研究证明了在c1498同源aml m4模型中nei-01的潜在抗癌活性。
[0129]
实施例5:在kg-1来源的急性髓系白血病(fab aml m0)异种移植模型中nei-01的抗癌活性。
[0130]
在此研究中,在鼠异种移植模型中评估了nei-01的抗癌作用。
[0131]
将人精氨基琥珀酸合成酶(ass1)缺陷型的m0亚型急性髓系白血病kg-1细胞皮下注射到免疫缺陷的balb/c裸小鼠中。当肿瘤体积达到180mm3时,一周一次以缓冲液mht或nei-01(280u/kg)对小鼠进行静脉内(i.v.)处理。表5提供了研究组别及其对应处理方案的详细信息。
[0132]
表5:针对kg-1来源的急性髓系白血病(fab aml m0)异种移植模型的研究组别和处理方案。
[0133][0134]
每3日测量肿瘤体积。四周后,处死小鼠(n=9)。然后解剖异种移植肿瘤并分别称重。
[0135]
结果示出,nei-01处理显著减少肿瘤体积(图7)。到第28日,观察到减少了39%。最终的t/c比达到了60.6%。在研究结束时,对照组中的肿瘤重量为3.41
±
0.53g,并且nei-01(280u/kg一周一次)处理组中的肿瘤重量为2.03
±
0.47g。肿瘤重量减少了40.38%。
[0136]
此研究证明了在鼠aml m0 kg-1异种移植中nei-01的有效抗癌活性。
[0137]
实施例6:在hl-60来源的急性髓系白血病(fab aml m2)原位模型中nei-01的抗癌活性。
[0138]
在此研究中,在鼠原位aml模型中评估了nei-01的抗癌活性。
[0139]
将与萤光素酶和绿色萤光蛋白(gfp)共同标记的人精氨基琥珀酸合成酶(ass1)缺陷型的m2亚型急性髓系白血病hl-60细胞被静脉内(iv)移植到非肥胖型糖尿病/严重复合型免疫缺乏症(nod/scid)小鼠中,以建立原位aml模型。将小鼠随机分为3组。表6提供了研究组别及其对应处理方案的详细信息。
[0140]
表6:针对hl-60来源的急性髓系白血病(fab aml m2)原位模型研究的组别和处理方案。
[0141][0142]
追踪白血病细胞(hl-60-gfphi-luc 细胞),并透过体内bli定量总体白血病负荷。疾病进展由bli强度的变化确定。结果示出于图8中。由整个aml小鼠的强信号证据,发现侵袭性疾病进展。当一周一次(p《0.05,从第4日至第25日)或一周两次(p《0.01,整个处理期间)以nei-01对小鼠进行处理时,此进展被显著抑制。
[0143]
结果证明,以nei-01处理有效地从小鼠血浆中消耗了精氨酸,导致疾病进展的抑制以及造血组织(包含骨髓和脾脏)中肿瘤负荷的减少。当一周一次(p《0.05,从第4日至第25日)或一周两次(p《0.01,整个处理期间)以nei-01对小鼠进行处理时,疾病进展被显著抑制。在骨髓和脾脏中观察到特别有效的活性;当一周两次以280u/kg nei-01处理小鼠时,骨髓(p《0.0001)和脾脏(p《0.005)中的肿瘤负荷显著减少。
[0144]
此研究证明了在hl-60原位aml m2模型中nei-01的潜在抗癌活性。
[0145]
实施例7:在p31/fuj来源的急性髓系白血病(fab aml m5)异种移植模型中nei-01的抗癌活性。
[0146]
在此研究中,在鼠异种移植模型中评估了nei-01的抗癌活性。
[0147]
将人精氨基琥珀酸合成酶(ass1)缺陷型的m5亚型急性髓系白血病p31/fuj细胞皮下接种到非肥胖型糖尿病/严重复合型免疫缺乏症(nod/scid)小鼠中。当肿瘤体积达到200mm3时,一周一次以缓冲液mht或nei-01(280u/kg)对小鼠进行静脉内(i.v.)处理。每3-4日测量肿瘤体积。四周后,处死小鼠(n=10),并且解剖异种移植肿瘤以及分别称重。表7提供了研究组别及其对应处理方案的详细信息。
[0148]
表7:针对p31/fuj来源的急性髓系白血病(fab aml m5)异种移植模型研究的组别和处理方案。
[0149]
[0150][0151]
图9示出nei-01处理显著减少肿瘤体积以及肿瘤重量,导致到第28日肿瘤体积减少了51.27%。最终的t/c比率达到了51.14%。在研究结束时,对照组中的肿瘤重量为1.08
±
0.98g,并且nei-01(280u/kg一周一次)处理组中的肿瘤重量为0.78
±
0.08g(p《0.05)。
[0152]
此研究证明了在鼠aml m5 p31/fuj异种移植中nei-01的有效抗癌活性。
[0153]
实施例8:在mkpl-1来源的急性髓系白血病(fab aml m7)异种移植模型中nei-01的抗癌活性。
[0154]
在此研究中,在鼠异种移植模型中评估了nei-01的抗癌作用。
[0155]
将人精氨基琥珀酸合成酶(ass1)缺陷型的m7亚型急性髓系白血病mkpl-1细胞皮下接种到到非肥胖型糖尿病/严重复合型免疫缺乏症(nod/scid)小鼠中。当肿瘤体积达到120mm3时,一周一次以缓冲液mht或nei-01(280u/kg)对小鼠进行静脉内(i.v.)处理。每2-3日测量一次肿瘤体积。三周后,处死小鼠(n=9),并且解剖异种移植肿瘤以及分别称重。表8提供了研究组别及其对应处理方案的详细信息。
[0156]
表8:针对mkpl-1来源的急性髓系白血病(fab aml m7)异种移植模型研究的组别和处理方案。
[0157][0158]
图10示出nei-01处理显著减少肿瘤体积以及肿瘤重量,导致到第22日肿瘤体积减少了99%。肿瘤重量在对照组中为8.05
±
0.056g,并且在nei-01(280u/kg一周一次)处理组中为0.15
±
0.05g。最终的t/c比率达到了99%。
[0159]
此研究证明了在鼠aml m7 mkpl-1异种移植中nei-01的有效抗癌活性。
[0160]
实施例9:在患者来源的am5512急性髓系白血病(fab aml m7)模型的处理中nei-01的体内功效研究。
[0161]
患者来源的异种移植(patient-derived xenograft,pdx)提供了用于癌症药物开发中的功效筛选的最有转移性的临床前模型。pdx模型直接来自患者肿瘤,并且从未适应于体外生长,pdx模型反映了人类患者群体的异质性和多样性。在此研究中,在患者来源的am5512(fab aml m7)急性髓系白血病模型中评估了nei-01的抗癌作用。
[0162]
将人am5512细胞被静脉内(i.v.)接种到非肥胖型糖尿病/严重复合型免疫缺乏症(nod/scid)小鼠中。当外周血液中肿瘤负荷约为1.33%时,将小鼠随机分为3组:组别1(媒介物)、组别2(nei-01,140u/kg)和组别3(nei-01,280u/kg),如表9所述。
[0163]
表9.针对患者来源的am5512急性髓系白血病(fab aml m7)模型研究的组别和处理方案。
[0164][0165]
在第3次nei-01剂量后,以nei-01(280u/kg或140u/kg一周一次)的处理显著抑制了外周血液中肿瘤负荷的成长(图11)。在研究结束时(第4次nei-01剂量后一周),以nei-01处理之后(280u/kg或140u/kg一周一次),在外周血液和造血组织(包括脾脏、肝脏和骨髓)中观察到肿瘤负荷显著减少(与媒介物组相比,p《0.05)。这些抗白血病作用以剂量依赖性方式呈现。
[0166]
此研究提供强力的证据支持nei-01在am5512(m7)pdx模型中具有潜在的抗白血病作用。
[0167]
实施例10:在患者来源的am8096急性髓系白血病(fab aml m2)模型的处理中nei-01的体内功效研究。
[0168]
在此研究中,在患者来源的am8096急性髓系白血病模型中评估了nei-01的抗癌作用。
[0169]
将人am8096细胞被静脉内(i.v.)接种到非肥胖型糖尿病/严重复合型免疫缺乏症(nod/scid)小鼠中。当外周血液中肿瘤负荷约为1.5%时,将小鼠随机分为3组:组别1(媒介物)、组别2(nei-01,140u/kg)和组别3(nei-01,280u/kg),如表10所述。
[0170]
表10:针对患者来源的am8096急性髓系白血病(fab aml m2)模型研究的组别和处理方案。
[0171][0172]
结果示出,一周一次以nei-01处理将存活日数的中位数从媒介物对照组中的12日略微延长到nei-01(140u/kg)处理组中的14.5日和nei-01(280u/kg)处理组中的16.5日(图12和表11)。
[0173]
当与媒介物对照组相比,nei-01处理的小鼠(140u/kg或280u/kg)的寿命(ils)增
加分别为20.8%和37.5%(表11)。令人兴奋的是,nei-01(280u/kg)处理组中的一只小鼠存活到初始处理后41日。这些数据暗示,nei-01至少在一些am8096模型群体中具有抗白血病作用。
[0174]
表11:在am8096模型中每个组别的中位存活日和寿命(ils)。
[0175][0176]
实施例11:在jurkat来源的白血病癌症异种移植模型中nei-01的抗癌活性。
[0177]
急性淋巴细胞白血病(t-all)的t细胞免疫表型在成人和儿童中约占急性白血病的15%至25%。受益于快速的技术进步和新出现的了解,t-all的治疗得到了显著进展。然而,显著数量的患者仍然处于复发的高风险中,并且当疾病复发时,很少有患者存活。由此,迫切需要新的治疗方法。
[0178]
药物诱导的氨基酸剥夺是已成功用于急性淋巴细胞白血病治疗的一种策略,其中天冬酰胺酶是诱导化学疗法的重要部分。精氨酸,作为引发各种代谢途径的前驱物,其已被证实对肿瘤形成具有调节作用。精氨酸剥夺已被证明是一种针对缺乏精氨基琥珀酸合成酶(ass1)的精氨酸营养缺陷型肿瘤的有前景治疗方法,精氨基琥珀酸合成酶是一种从瓜氨酸合成精氨酸的限制酶。此研究目的在于评估在t-all jurkat异种移植模型中精氨酸剥夺酶nei-01的抗癌活性。
[0179]
将人ass1缺陷型t-all jurkat细胞皮下接种到免疫缺陷的balb/c裸小鼠中。当肿瘤体积达到40mm3附近时,将小鼠随机分为两组:对照组和nei-01处理组,如表12所述。对小鼠腹膜内(i.p.)施用pbs或nei-01(每只小鼠5u,约280u/kg),一周两次,持续四周。测量肿瘤体积,一周两次。
[0180]
表12:针对jurkat衍生的白血病癌症异种移植模型研究的组别和处理方案。
[0181][0182]
结果示出,当与第28日的对照组相比,一周两次以nei-01(每只小鼠5u,约280u/kg)处理显著抑制(p≤0.05)肿瘤生长(图13)。
[0183]
这些数据提供针对在jurkat衍生的白血病皮下异种移植模型中nei-01的潜在抗癌活性的支持。
[0184]
实施例12:从重复剂量研究确定小鼠血浆中的nei-01。
[0185]
将nei-01透过每周一次持续四周以160、280和560u/kg的剂量静脉内施用至icr小鼠。在第1日和第22日,在给药前(-1h)、给药后0.25、6、24、48和72h,针对所有组别采集血液样本;在第8日(第二周),针对所有组别在给药前(-1h)采集血液样本;在第15日(第三周),针对所有组别在给药前(-1h)采集血液样本;在第22日(第四周),在给药前(-1h)、给药后0.25、6、24、48和72h采集血液样本;并且在第29日(第5周)处死小鼠之前采集血液样本。对5只动物/组别/性别/时间点和血浆浓度进行定量(图14)。
[0186]
在表13(第1日)和表14(第22日)中呈现用于针对处理组的nei-01的药物代谢动力学评估的参数和获得的结果。媒介物对照组中所有nei-01的血浆浓度低于定量极限。由此,表中未呈现媒介物对照组数据。
[0187]
表13:针对nei-01处理组的第1日小鼠的药物代谢动力学参数和测量值。
[0188][0189][0190]ac
max
:最大nei-01浓度
[0191]bt
max
:c
max
发生的时间
[0192]ct
1/2
:半衰期,c
max
下降一半所需的时间
[0193]dauc
0-72h
:从药物施用时间(时间“0”至时间“72”),药物浓度对照时间图中曲线下的面积
[0194]
表14.针对nei-01处理组的第22日小鼠的药物代谢动力学参数和测量值。
[0195][0196]ac
max
:最大nei-01浓度
[0197]bt
max
:c
max
发生的时间
[0198]ct
1/2
:半衰期,c
max
下降一半所需的时间
[0199]dauc
0-72h
:从药物施用时间(时间“0”至时间“72”),药物浓度对照时间图中曲线下的面积
[0200]
将nei-01静脉内施用至小鼠后,观察到全身暴露于nei-01,在第1日,在雄性和雌性中,t
max
的平均值为给药后0.25h。t1/2在21.04小时至36.58小时之间。
[0201]
在第1日和第22日,在雄性和雌性中,对nei-01的全身暴露(透过auc0-72测量)随剂量以正比方式增加。于560u/kg处,在第1日(5.82x106ng.h/ml~6.04x106ng.h/ml)和第22日(5.97x106ng.h/ml~6.27x106ng.h/ml),在雄性和雌性中,auc0-72为相似的。同样地,cmax结果与auc0-72相似,在其中,在第1日和第22日,雄性和雌性的结果相似。雄性和雌性处理组之间的体重也没有显著差异。
[0202]
工业实用性
[0203]
当前请求保护的发明的目的是提供治疗aml的替代方法。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。