1.本发明涉及再生医学技术领域,特别涉及一种多肽和双生长因子梯度分布的含细胞骨软骨支架及其制备方法和应用。
背景技术:
2.由于急性创伤、慢性劳损、肥胖、肿瘤、关节先天性异常,以及老年退化性骨关节病等造成的关节骨软骨缺损严重影响了患者的健康和生活质量。目前,全球有数百万人遭受骨软骨缺损的困扰,人们对关节骨-软骨界面组织缺损修复和替换的需求也日益迫切。同时,由于关节骨软骨在损伤后的自愈能力非常有限(骨软骨组织的硬度以及矿化程度呈梯度变化、血管数量较少),使得骨软骨缺损修复成为长期困扰临床的一大难题。
3.目前,微骨折(mf)手术、自体或同种异体骨软骨移植、自体软骨细胞植入(aci)和基质诱导自体软骨细胞植入(maci)等是修复软骨缺损最常用的方法。尽管以上方法在临床上取得了一定的治疗效果,但其成功率也受到了纤维软骨形成和组织/软骨细胞来源不足的限制,并且存在潜在的感染、免疫排斥等风险。
4.近年来,骨组织工程技术已成为骨软骨缺损修复的潜在选择之一,基于该技术制备的组织工程骨支架具有良好的生物降解性、生物相容性和骨诱导能力,因此用于骨软骨组织缺损修复的骨支架成为了国内外相关学者的研究热点。例如专利cn201910378353.8公开了一种用于修复膝关节软骨缺损的仿生补缺材料的制备方法,此法将关节软骨组织的主要成分作为生物墨水,利用3d模型重构技术、3d打印技术和仿生学原理,制备出类似于膝关节透明软骨层、钙化软骨层和软骨下骨层三层结构和三种组分的膝关节软骨的一种仿生补缺材料。然而,此法并不能实现软骨中功能成分的梯度分布,使得软骨支架定向成骨分化和成软骨分化的效果不佳。
技术实现要素:
5.有鉴于此,本发明目的在于提供一种多肽和双生长因子梯度分布的含细胞骨软骨支架及其制备方法和应用,本发明提供的多肽和双生长因子梯度分布的含细胞骨软骨支架能实现多肽和双生长因子梯度分布,有效刺激人骨髓间充质干细胞定向成骨分化和成软骨分化。
6.为了实现上述发明目的,本发明提供以下技术方案:
7.本发明提供了一种多肽和双生长因子梯度分布的含细胞骨软骨支架的制备方法,包括以下步骤:
8.(1)将甲基丙烯酸酐化明胶、光引发剂、人骨髓间充质干细胞、转化生长因子、精氨酸-甘氨酸-天冬氨酸多肽与缓冲溶液混合,得到第一生物墨水;
9.将甲基丙烯酸酐化明胶、光引发剂、人骨髓间充质干细胞与缓冲溶液混合,得到第二生物墨水;
10.将甲基丙烯酸酐化明胶、光引发剂、人骨髓间充质干细胞、精氨酸-甘氨酸-天冬氨酸多肽、人骨形态发生蛋白、纳米羟基磷石灰与缓冲溶液混合,得到第三生物墨水;
11.(2)将所述第一生物墨水、第二生物墨水和第三生物墨水注入微流控芯片中进行混合,在所述微流控芯片的末端得到多肽和双生长因子梯度分布的水凝胶片材,对所述多肽和双生长因子梯度分布的水凝胶片材进行光固化,得到固化水凝胶片材;
12.所述微流控芯片包括第一总路,所述第一总路依次排列有第一生物墨水注入口、第二生物墨水注入口和第三生物墨水注入口;所述第一总路连通有多条第一支路,所述多条第一支路的入口均匀分布于第一总路上,所述多条第一支路具有“几”字型弯曲状,所述多条第一支路相互不交叉;
13.所述多条第一支路的末端汇聚于第二总路上,所述第二总路连通有多条第二支路,所述多条第二支路的入口均匀分布于第二总路上,所述多条第二支路具有“几”字型弯曲状,所述多条第二支路相互不交叉;
14.所述多条第二支路的出口与矩形容器连通;
15.(3)以多肽和双生长因子梯度分布方向为轴向,对所述固化水凝胶片材进行卷叠,得到多肽和双生长因子梯度分布的含细胞骨软骨支架。
16.优选的,所述人骨髓间充质干细胞的制备方法,包括以下步骤:
17.将取自成人骨髓的人骨髓间充质干细胞在含有动物血清和抗生素的培养基中培养,取传代3~5代的细胞作为培养细胞。
18.优选的,所述人骨形态发生蛋白为bmp-2、bmp-4、bmp-6、bmp-7和bmp-9中的一种或几种;
19.所述转化生长因子为tgf-β1、tgf-β2和tgf-β3中的一种或几种。
20.优选的,所述第一生物墨水中,所述生长转化因子的浓度为0.004~0.006wt%;所述精氨酸-甘氨酸-天冬氨酸多肽的浓度为0.008~0.012wt%;
21.所述第三生物墨水中,所述人骨形态发生蛋白的浓度为0.004~0.006wt%;所述纳米羟基磷石灰的浓度为1~3wt%;所述精氨酸-甘氨酸-天冬氨酸多肽的浓度为0.008~0.012wt%。
22.优选的,所述第一生物墨水、第二生物墨水和第三生物墨水中,所述甲基丙烯酸酐化明胶的浓度为5~15wt%;所述人骨髓间充质干细胞的浓度为1
×
105~5
×
105个/ml。
23.优选的,所述光引发剂为苯基-2,4,6-三甲基苯甲酰基亚磷酸锂、2-羟基-2-甲基-1-[4-(2-羟基乙氧基)苯基]-1-丙酮)和偶氮二甲基n-2-羟丁基丙烯酰胺中的一种或几种;
[0024]
所述甲基丙烯酸酐化明胶与光引发剂的质量比为1:0.01~0.06。
[0025]
优选的,所述第一生物墨水、第二生物墨水和第三生物墨水注入微流控芯片的速率为250~300μl/h。
[0026]
优选的,所述光固化的波长为365~405nm,时间为20~40s。
[0027]
本发明提供了上述制备方法制备得到的多肽和双生长因子梯度分布的含细胞骨软骨支架,成分包括光固化水凝胶以及分散于所述光固化水凝胶中的转化生长因子、人骨形态发生蛋白、精氨酸-甘氨酸-天冬氨酸多肽、纳米羟基磷石灰和人骨髓间充质干细胞;
[0028]
以纳米羟基磷灰石浓度最高的一端作为软骨下骨层,以转化生长因子浓度最高的一端作为关节软骨层,所述多肽和双生长因子梯度分布的含细胞骨软骨支架自关节软骨层
至软骨下骨层,所述人骨形态发生蛋白和纳米羟基磷石灰的浓度依次升高、所述转化生长因子的浓度依次降低、所述精氨酸-甘氨酸-天冬氨酸多肽的浓度先降低后升高。
[0029]
本发明提供了上述多肽和双生长因子梯度分布的含细胞骨软骨支架在制备治疗骨软骨缺损修复材料中的应用。
[0030]
本发明提供了上述制备方法制备得到的多肽和双生长因子梯度分布的含细胞骨软骨支架,成分包括光固化水凝胶以及分散于所述光固化水凝胶中的转化生长因子、人骨形态发生蛋白、精氨酸-甘氨酸-天冬氨酸多肽、纳米羟基磷石灰和人骨髓间充质干细胞;
[0031]
以纳米羟基磷灰石浓度最高的一端作为软骨下骨层,以转化生长因子浓度最高的一端作为关节软骨层,所述多肽和双生长因子梯度分布的含细胞骨软骨支架自关节软骨层至软骨下骨层,所述人骨形态发生蛋白和纳米羟基磷石灰的浓度依次升高、所述转化生长因子的浓度依次降低、所述精氨酸-甘氨酸-天冬氨酸多肽的浓度先降低后升高。
[0032]
本发明提供了上述多肽和双生长因子梯度分布的含细胞骨软骨支架在制备治疗骨软骨缺损修复材料中的应用。
[0033]
本发明提供了一种多肽和双生长因子梯度分布的含细胞骨软骨支架(简称为梯度细胞骨软骨支架)的制备方法,包括以下步骤:(1)将甲基丙烯酸酐化明胶、光引发剂、人骨髓间充质干细胞、转化生长因子、精氨酸-甘氨酸-天冬氨酸多肽与缓冲溶液混合,得到第一生物墨水;将甲基丙烯酸酐化明胶、光引发剂、人骨髓间充质干细胞与缓冲溶液混合,得到第二生物墨水;将甲基丙烯酸酐化明胶、光引发剂、人骨髓间充质干细胞、精氨酸-甘氨酸-天冬氨酸多肽、人骨形态发生蛋白、纳米羟基磷石灰与缓冲溶液混合,得到第三生物墨水;(2)将所述第一生物墨水、第二生物墨水和第三生物墨水注入微流控芯片中进行混合,在所述微流控芯片的末端得到多肽和双生长因子梯度分布的水凝胶片材,对所述多肽和双生长因子梯度分布的水凝胶片材进行光固化,得到固化水凝胶片材;(3)以多肽和双生长因子梯度分布方向为轴向,对所述固化水凝胶片材进行卷叠,得到多肽和双生长因子梯度分布的含细胞骨软骨支架。本发明通过控制第一生物墨水、第二生物墨水和第三生物墨水的成分,利用微流控技术和光交联的方法,制备梯度细胞骨软骨支架。本发明利用微流控通道对第一生物墨水、第二生物墨水和第三生物墨水的分散和汇聚过程,其中,沿软骨下骨层方向,纳米羟基磷石灰(nhap)浓度呈梯度逐渐变大,在本发明中,纳米羟基磷石灰作为人体骨骼的主要无机成分,具有良好的生物活性,可参与体内代谢,具有促进骨生成和成骨诱导分化的功能,纳米羟基磷石灰浓度呈梯度逐渐变大可模拟天然骨无机成分的分布,并可促进人骨髓间充质干细胞(hmscs)的矿化和诱导其分化为成骨细胞;在本发明中,梯度细胞骨软骨支架中转化生长因子和人骨形态发生蛋白沿骨-软骨界面的垂直方向呈相反方向的浓度梯度分布,以梯度方式刺激hmscs的定向成骨分化和成软骨分化,更好地模拟了天然骨软骨组织的细胞种类和数量组成,有利于缺损骨软骨组织地修复;梯度细胞骨软骨支架中含有可促进细胞定向迁移的细胞粘附性精氨酸-甘氨酸-天冬氨酸多肽(rgd),该多肽分别沿着软骨下骨层和关节软骨层呈反向的梯度浓度分布,以调控hmscs沿着软骨下骨层和关节软骨层定向迁移,并在相应区域转化生长因子的刺激下,实现hmscs在骨软骨界面的定向成骨分化和成软骨分化,以便更好地对缺损的骨软骨组织进行修复。
[0034]
同时,本发明制备方法使用的原料无毒,能很好地模拟细胞外基质,具有良好的生物降解性和生物相容性,且与人体骨组织细胞的粘附性较好。本发明采用微流控技术和光
交联的方法制备梯度骨软骨支架,具有较高的精度和可控性,工艺流程简单,对设备的要求较低,制备周期短,成本低。
[0035]
进一步的,本发明可以根据实际需要灵活调整第一生物墨水、第二生物墨水和第三生物墨水中各材料的浓度和含量,进而调整梯度骨软骨支架中各成分梯度斜率的大小,满足不同骨软骨缺损修复使用情况,普适性较高。
附图说明
[0036]
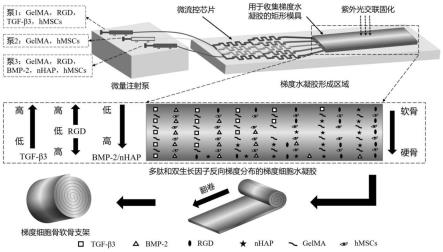
图1为微流控芯片的结构示意图;
[0037]
图2为多肽和双生长因子梯度分布的含细胞骨软骨支架的制备过程;
[0038]
图3为多肽和双生长因子梯度分布的含细胞骨软骨支架治疗缺损骨软骨组织的机理图;
[0039]
图4为多肽和双生长因子梯度分布的含细胞骨软骨支架梯度多肽和双生长因子对细胞的作用机理图。
具体实施方式
[0040]
本发明提供了一种多肽和双生长因子梯度分布的含细胞骨软骨支架的制备方法,包括以下步骤:
[0041]
(1)将甲基丙烯酸酐化明胶、光引发剂、人骨髓间充质干细胞、转化生长因子、精氨酸-甘氨酸-天冬氨酸多肽与缓冲溶液混合,得到第一生物墨水;
[0042]
将甲基丙烯酸酐化明胶、光引发剂、人骨髓间充质干细胞与缓冲溶液混合,得到第二生物墨水;
[0043]
将甲基丙烯酸酐化明胶、光引发剂、人骨髓间充质干细胞、精氨酸-甘氨酸-天冬氨酸多肽、人骨形态发生蛋白、纳米羟基磷石灰与缓冲溶液混合,得到第三生物墨水;
[0044]
(2)将所述第一生物墨水、第二生物墨水和第三生物墨水注入微流控芯片中进行混合,在所述微流控芯片的末端得到多肽和双生长因子梯度分布的水凝胶片材,对所述多肽和双生长因子梯度分布的水凝胶片材进行光固化,得到固化水凝胶片材;
[0045]
所述微流控芯片包括第一总路,所述第一总路依次排列有第一生物墨水注入口、第二生物墨水注入口和第三生物墨水注入口;所述第一总路连通有多条第一支路,所述多条第一支路的入口均匀分布于第一总路上,所述多条第一支路具有“几”字型弯曲状,所述多条第一支路相互不交叉;
[0046]
所述多条第一支路的末端汇聚于第二总路上,所述第二总路连通有多条第二支路,所述多条第二支路的入口均匀分布于第二总路上,所述多条第二支路具有“几”字型弯曲状,所述多条第二支路相互不交叉;
[0047]
所述多条第二支路的出口与矩形容器连通;
[0048]
(3)以多肽和双生长因子梯度分布方向为轴向,对所述固化水凝胶片材进行卷叠,得到多肽和双生长因子梯度分布的含细胞骨软骨支架。
[0049]
在本发明中,所述人骨髓间充质干细胞的制备方法,优选包括以下步骤:
[0050]
将取自成人骨髓的人骨髓间充质干细胞在含有动物血清和抗生素的培养基中培养,取传代3~5代的细胞作为培养细胞。
[0051]
在本发明中,所述培养基优选为dmem/f12培养基。在本发明中,所述血清优选为胎牛血清、新生牛血清、小牛血清、成牛血清、马血清、猪血清、供体马血清和兔血清中的一种或几种。在本发明中,所述抗生素优选为青霉素-链霉素、青霉素-链霉素-两性霉素b、庆大霉素、卡那霉素和氨苄青霉素中的一种或几种。在本发明中,所述培养基中胎牛血清的浓度优选为8~12wt%,更优选为10wt%,所述青霉素-链霉素的浓度优选为0.8~1.2wt%,更优选为1wt%。
[0052]
在本发明中,所述培养的温度优选为37℃;所述培养优选在5%co2环境下进行所述培养。本发明优选每3天更换一次培养基,待细胞生长达到90%融合后收获细胞并传代。
[0053]
本发明将甲基丙烯酸酐化明胶、光引发剂、人骨髓间充质干细胞、转化生长因子、精氨酸-甘氨酸-天冬氨酸多肽与缓冲溶液混合,得到第一生物墨水。在本发明中,所述光引发剂优选为苯基-2,4,6-三甲基苯甲酰基亚磷酸锂、2-羟基-2-甲基-1-[4-(2-羟基乙氧基)苯基]-1-丙酮)和偶氮二甲基n-2-羟丁基丙烯酰胺中的一种或几种。在本发明中,所述转化生长因子优选为tgf-β1、tgf-β2和tgf-β3中的一种或几种。在本发明中,所述缓冲溶液优选为磷酸缓冲盐溶液。
[0054]
在本发明中,所述混合的方式优选为:先将甲基丙烯酸酐化明胶、光引发剂和缓冲溶液加热混合,灭菌后再加入人骨髓间充质干细胞、转化生长因子、精氨酸-甘氨酸-天冬氨酸多肽。
[0055]
在本发明中,所述加热混合的温度优选为37℃,时间优选为0.8~1.2h,更优选为1h。本发明优选使用0.22μm过滤器进行所述灭菌处理。
[0056]
在本发明中,所述第一生物墨水中,所述甲基丙烯酸酐化明胶的含量优选为5~15wt%,更优选为8~12wt%,更优选为10wt%;所述人骨髓间充质干细胞的浓度优选为1
×
105~5
×
105个/ml;所述生长转化因子的浓度优选为0.004~0.006wt%,更优选为0.005wt%;所述精氨酸-甘氨酸-天冬氨酸多肽的浓度优选为0.008~0.012wt%,更优选为0.009~0.01wt%。
[0057]
本发明将甲基丙烯酸酐化明胶、光引发剂、人骨髓间充质干细胞与缓冲溶液混合,得到第二生物墨水。在本发明中,所述光引发剂与缓冲溶液的可选种类与第一生物墨水相同,在此不再赘述。
[0058]
在本发明中,所述第二生物墨水的混合方式与第一生物墨水的混合方式的区别在于不加入转化生长因子、精氨酸-甘氨酸-天冬氨酸多肽,其余操作均相同,在此不再赘述。
[0059]
在本发明中,所述第二生物墨水中,所述甲基丙烯酸酐化明胶的含量优选为5~15wt%,更优选为8~12wt%,更优选为10wt%;所述人骨髓间充质干细胞的浓度优选为1
×
105~5
×
105个/ml。
[0060]
本发明将甲基丙烯酸酐化明胶、光引发剂、人骨髓间充质干细胞、精氨酸-甘氨酸-天冬氨酸多肽、人骨形态发生蛋白、纳米羟基磷石灰与缓冲溶液混合,得到第三生物墨水。在本发明中,所述光引发剂与缓冲溶液的可选种类与第一生物墨水相同,在此不再赘述。
[0061]
在本发明中,所述人骨形态发生蛋白优选为bmp-2、bmp-4、bmp-6、bmp-7和bmp-9中的一种或几种。在本发明中,所述纳米羟基磷石灰的形貌优选为针状,所述纳米羟基磷石灰的粒径优选为20~50nm,更优选为30~40nm。
[0062]
在本发明中,所述混合的方式优选为:先将甲基丙烯酸酐化明胶、光引发剂和缓冲
溶液加热混合,灭菌后再加入精氨酸-甘氨酸-天冬氨酸多肽、人骨形态发生蛋白、纳米羟基磷石灰。
[0063]
在本发明中,所述加热混合的温度优选为37℃,时间优选为0.8~1.2h,更优选为1h。本发明优选使用0.22μm过滤器进行所述灭菌处理。
[0064]
在本发明中,所述第三生物墨水中,所述甲基丙烯酸酐化明胶的含量优选为5~15wt%,更优选为8~12wt%,更优选为10wt%;所述人骨髓间充质干细胞的浓度优选为1
×
105~5
×
105个/ml;所述人骨形态发生蛋白的浓度优选为0.004~0.006wt%,更优选为0.005wt%;所述纳米羟基磷石灰的浓度优选为1~3wt%,更优选为1.2~2wt%;所述精氨酸-甘氨酸-天冬氨酸多肽的浓度优选为0.008~0.012wt%,更优选为0.009~0.01wt%。
[0065]
本发明将所述第一生物墨水、第二生物墨水和第三生物墨水注入微流控芯片中进行混合,在所述微流控芯片的末端得到多肽和双生长因子梯度分布的水凝胶片材,对所述多肽和双生长因子梯度分布的水凝胶片材进行光固化,得到固化水凝胶片材。
[0066]
在本发明中,所述微流控芯片包括第一总路,所述第一总路依次排列有第一生物墨水注入口、第二生物墨水注入口和第三生物墨水注入口;所述第一总路连通有多条第一支路,所述多条第一支路的入口均匀分布于第一总路上,所述多条第一支路具有“几”字型弯曲状,所述多条第一支路相互不交叉。在本发明中,所述第一支路的条数优选为四条。在本发明中,所述多条第一支路优选对称分布。
[0067]
在本发明中,所述多条第一支路的末端汇聚于第二总路上,所述第二总路连通有多条第二支路,所述多条第二支路的入口均匀分布于第二总路上,所述多条第二支路具有“几”字型弯曲状,所述多条第二支路相互不交叉。在本发明中,所述第二支路的条数优选为五条。在本发明中,所述多条第二支路优选对称分布。
[0068]
在本发明中,所述第一总路、第一支路、第二总路、第二支路宽度独立地优选为400~600μm,更优选为500μm;深度独立地优选为400~600μm,更优选为500μm。
[0069]
在本发明中,所述多条第二支路的出口与矩形容器连通。在本发明中,所述矩形容器的长度优选为70~90mm,宽度优选为8~12mm,高度优选为1mm。
[0070]
在本发明中,所述微流控芯片优选通过聚二甲基硅氧烷-聚二甲基硅氧烷(pdms-pdms)键合的方法制备得到。
[0071]
作为本发明的一个具体实施例,所述微流控芯片的结构示意图如图1所示。
[0072]
在本发明中,所述第一生物墨水、第二生物墨水和第三生物墨水注入微流控芯片的速率优选为250~300μl/h,更优选为260~280μl/h。
[0073]
在本发明中,所述光固化的波长优选为365~405nm,进一步优选为365nm、385nm或405nm;在本发明中,所述光固化的时间优选为20~40s,更优选为25~30s。
[0074]
本发明以多肽和双生长因子梯度分布方向为轴向,对所述固化水凝胶片材进行卷叠,得到多肽和双生长因子梯度分布的含细胞骨软骨支架。本发明对所述卷叠的方式没有特殊的要求,使用本领域技术人员熟知的卷叠方式即可。在本发明中,所述多肽和双生长因子梯度分布的含细胞骨软骨支架的形状优选为圆柱形,所述多肽和双生长因子梯度分布的含细胞骨软骨支架的高度优选为8~12mm,更优选为10mm,直径优选为8~12mm,更优选为10mm。
[0075]
作为本发明的一个具体实施例,所述多肽和双生长因子梯度分布的含细胞骨软骨
支架的制备过程如图2所示。
[0076]
本发明提供了上述制备方法制备得到的多肽和双生长因子梯度分布的含细胞骨软骨支架,成分包括光固化水凝胶以及分散于所述光固化水凝胶中的转化生长因子、人骨形态发生蛋白、精氨酸-甘氨酸-天冬氨酸多肽、纳米羟基磷石灰和人骨髓间充质干细胞。
[0077]
在本发明中,以纳米羟基磷灰石浓度最高的一端作为软骨下骨层,以转化生长因子浓度最高的一端作为关节软骨层,所述多肽和双生长因子梯度分布的含细胞骨软骨支架自关节软骨层至软骨下骨层,所述人骨形态发生蛋白和纳米羟基磷石灰的浓度依次升高、所述转化生长因子的浓度依次降低、所述精氨酸-甘氨酸-天冬氨酸多肽的浓度先降低后升高。
[0078]
本发明提供了上述多肽和双生长因子梯度分布的含细胞骨软骨支架在制备治疗骨软骨缺损修复材料中的应用。
[0079]
在本发明中,所述多肽和双生长因子梯度分布的含细胞骨软骨支架用作治疗骨软骨缺损修复材料时,软骨下骨层一端与骨组织接触,关节软骨层一端与软骨组织一端接触。
[0080]
在本发明中,所述多肽和双生长因子梯度分布的含细胞骨软骨支架治疗缺损骨软骨组织的机理图如图3所示。
[0081]
多肽和双生长因子梯度分布的含细胞骨软骨支架梯度多肽和双生长因子对细胞的作用机理图如图4所示。
[0082]
下面结合实施例对本发明提供的多肽和双生长因子梯度分布的含细胞骨软骨支架及其制备方法和应用进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
[0083]
实施例1
[0084]
多肽和双生长因子梯度分布的含细胞骨软骨支架的制备方法,包括以下步骤:
[0085]
(1)提取和培养hmscs:
[0086]
利用密度梯度离心法从成人骨髓中分离提取hmscs,将提取的hmscs在含有10%的胎牛血清(fbs)和1%青霉素-链霉素(双抗)溶液的dmem/f12培养基中,在37℃、5%co2的培养箱中进行培养;于3天后首次更换新鲜培养基,弃去悬浮细胞后,每2~3天更换一次培养基,等细胞生长达80~90%融合时,按1:2比例对细胞进行传代培养,对来自第3~5代的细胞进行实验。
[0087]
(2)含hmscs的gelma水凝胶(图1中泵2材料)的制备方法,包括如下步骤:
[0088]
a.将1g冻干的gelma,0.025g苯基-2,4,6-三甲基苯甲酰基亚磷酸锂(lap)加至8~12ml磷酸缓冲盐溶液(pbs)中,在37℃水浴中加热1h直至完全溶解,形成10wt%gelma浓度的水凝胶溶液;对上述gelma水凝胶溶液用0.22μm过滤器进行灭菌处理,得到灭菌的gelma水凝胶;将hmscs细胞以2
×
105个/ml的密度均匀悬浮在灭菌后的gelma水凝胶中,形成含hmscs的gelma水凝胶,即为第二生物墨水。
[0089]
b.按照第二生物墨水的制备方法分别将0.5mg的tgf-β3和1mg的rgd添加到上述水凝胶中,得到第一生物墨水;
[0090]
c.按照第二生物墨水的制备方法,分别将0.5mg的bmp-2、1mg的rgd和0.2g的nhap添加到上述水凝胶中,得到第三生物墨水。
[0091]
(3)将第一生物墨水、第二生物墨水、第三生物墨水的液体流速调整为270μl/h,通
过图1所示的微流控芯片的微通道在水凝胶中形成rgd、tgf-β3、bmp-2和nhap的浓度梯度结构;
[0092]
所述微流控芯片的进液口和弯曲通道的宽度均为500μm,深度为500μm,出口处通道宽度均为500μm;矩形槽的长为80mm,宽为10mm,高为1mm;
[0093]
然后,用波长为405nm的紫外光对上述梯度水凝胶溶液光照30s进行光交联,以形成光固化水凝胶;
[0094]
(4)将所述光固化水凝胶沿着梯度的垂直方向卷成高度为10mm,底部直径为10mm的圆柱形梯度细胞骨软骨支架。
[0095]
本实施例制备的载有多肽和生长因子的含hmscs的gelma水凝胶的制备方法,有助于治疗骨软骨组织的缺损。该支架的生物相容性和与人体骨组织细胞的粘附性较好,便于细胞的黏附生长及增殖,从而促进骨组织再生;由于支架中含rgd这一粘附性多肽,可促进hmscs向关节软骨层和软骨下骨层的定向迁移,结合关节软骨层梯度分布的高浓度的tgf-β3和软骨下骨层梯度分布的高浓度的bmp-2及nhap,在空间上诱导hmscs的成骨/软骨分化和促进软骨下骨层细胞的钙化成骨,模拟体内骨软骨组织界面的细胞组成,从而实现个性化的骨软骨组织再生。
[0096]
对比例1
[0097]
按照实施例1的方法制备梯度细胞骨软骨支架,不同之处在于,10ml的第二生物墨水材料中也含有1mg的rgd多肽。
[0098]
对比例2
[0099]
按照实施例1的方法制备梯度细胞骨软骨支架,不同之处在于,10ml的第一生物墨水,第二生物墨水和第三生物墨水材料都含有0.5mg的tgf-β3、bmp-2和0.2g的nhap。
[0100]
①
为了分析rgd的梯度分布对细胞迁移行为和和沿梯度方向排列的影响。用细胞培养基对实施例1、对比例1和对比例2制备的梯度细胞骨软骨支架培养6h后,用倒置相差显微镜观察hmscs的细胞迁移和沿梯度方向排列的细胞占比情况,测试结果如表1所示。
[0101]
②
为了分析tgf-β3、bmp-2、nhap的梯度分布对hmscs的成软骨/骨分化的影响,用细胞培养基对实施例1、对比例1和对比例2制备的梯度细胞骨软骨支架培养14d后,分别对关节软骨层和软骨下骨层的hmscs成软骨/骨分化情况进行了测试,测试结果如表1所示。
[0102]
相关测试方法如下:
[0103]
(1)为了评估hmscs在支架关节软骨层中的体外成软骨分化情况,在培养骨软骨支架14天时,采用实时定量聚合酶链反应(qrt-pcr),检测关节软骨层hmscs的软骨细胞特异性ii型胶原(col2)、聚集蛋白聚糖(aggrecan)和转录因子sox9的表达水平;
[0104]
(2)为了评估hmscs在支架软骨下骨层中的体外成骨分化情况,在培养骨软骨支架14天时,通过碱性磷酸酶(alp,成熟成骨细胞的标志性酶)测定试剂盒来检测alp的活性,用酶标仪在405nm处测量结果;此外,还通过qrt-pcr来测量成骨相关基因的mrna表达,其中包括runt相关转录因子2(runx2)、骨桥蛋白(opn)、成骨细胞分泌蛋白(ocn)的表达水平。
[0105]
软骨/骨分化标志物的表达测试实验中,以实施例1的测试数据为参考标准值。
[0106]
表1实施例1、对比例1和对比例2的各项测试结果
[0107][0108]
由表1可以看出,对比例1和对比例2中制备的梯度细胞骨软骨支架中沿梯度排列的hmscs占比从实施例1的90%降至10%。这可能是因为实施例1中梯度分布的rgd多肽促进了hmscs向受损的骨软骨组织发生明显的定向细胞迁移和伸展,从而使绝大多数的hmscs沿梯度方向排列,而对比例1和对比例2中,由于rgd多肽的梯度分布被打乱,从而导致hmscs在梯度细胞骨软骨支架中随机分布。
[0109]
此外,相较实施例1,对比例1和对比例2中关节软骨层hmscs成软骨分化相关标志物,比如col2、aggrecan、sox9的表达水平较低;软骨下骨层hmscs成骨分化相关标志物,比如runx2、opn、ocn的表达水平和alp的活性也较低。
[0110]
以上结果表明,相较实施例1,对比例1和对比例2中hmscs沿梯度方向的细胞定向迁移能力较差,绝大多数细胞未呈现沿梯度排列的效果,这导致梯度细胞骨软骨支架软骨下骨层和关节软骨层的hmscs数量较低;同时,由于tgf-β3、bmp-2和nhap也未呈现梯度分布,使得对比例1和对比例2制备的梯度细胞骨软骨支架在特定区域的成软骨/骨分化效果较差,不能较好地实现对骨软骨界面的模拟和定向缺损修复。
[0111]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。