1.本发明涉及医用植入物技术领域,尤其涉及一种医用植入物及其制备方法和应用。
背景技术:
2.从材料性能上看,钛合金、不锈钢、形状记忆合金等常用医用金属材料在人体内具有生物惰性,无法降解。常见的生物可降解材料有聚合物材料(如聚乳酸)、某些陶瓷材料(如磷酸钙)等,其中聚合物材料的强度较低,而陶瓷材料的韧性较差。
3.原则上,生物可降解的金属材料具有比聚合物材料更好的性能,如机械强度。生物可降解支架应用中考虑的可生物降解金属包括镁合金,锌合金和铁合金等。对比锌合金和铁合金,镁合金具有明显的优势,镁是人体必须的微量元素,在体内可吸收,镁的降解产物无毒,在体内不引起炎症和过敏反应,过量的镁离子也由肾脏代谢并排出体外的。所以生物可降解镁合金为代表的新一代医用可降解金属材料的研究受到人们的关注。
4.但镁金属的缺点,通常纯镁在人体内极易发生腐蚀,被吸收的速度快于骨骼愈合的速度,若腐蚀速度过快,在机体完全恢复前,植入体的消失将导致治疗失败。镁合金腐蚀后的产物产生氢气,由于中后期腐蚀速度的加快,加速氢气的产生,无法及时排除的氢气对周围组织无疑是再一次的伤害。
5.为了延长镁在人体内被吸收的时间,一方面,科学家另外添加了铝,锌或稀土金属制成镁合金,添加元素可能引起机体的不适应。另一方面,在镁合金植入外部涂覆一层涂层,用于减缓镁合金前期降解速度,待涂层被体液侵蚀后,腐蚀速度过快,无法避免中后期腐蚀速度的加快,加速氢气的产生,从而导致对周围组织的伤害。镁植入物降解产物氢氧化镁溶解性差、碱性强,组织适配性差。较低的塑性变形能力。上述缺陷限制镁金属在医疗器械中的应用和扩展。
6.一维和二维生物活性材料,尤其是纳米生物活性活性材料具有出色生物活性。各向异性生物材料垂直取向结构的构筑是制备具有电、热、生物特异性和机械功能的先进复合材料的关键途径。切割堆叠、3d打印和外场(电场、磁场)取向等方法往往具有工艺复杂、填料填充上限低、低生产效率、纳米颗粒无法取向等问题。
7.综上所述,开发一种耐腐蚀性好、降解速率均匀、高生物活性和安全性高的医用植入物是至关重要的。
技术实现要素:
8.针对现有技术的不足,本发明的目的在于提供一种医用植入物及其制备方法和应用,所述医用植入物具有优异的机械性能,降解过程中析氢速率可控而且相对均匀,其中定向排布聚合物和生物活性陶瓷,对组织的具有较好的亲和性,具有促进细胞生长繁殖的作用。
9.为达此目的,本发明采用以下技术方案:
10.第一方面,本发明提供一种医用植入物,所述医用植入物包括金属丝以及由内至外依次设置于所述金属丝外表面的第一复合层和充当基质的第二复合层;
11.所述第一复合层包括第一可降解聚合物和第一活性材料的组合;
12.所述第二复合层包括第二可降解聚合物和第二活性材料的组合。
13.本发明中,在镁丝外层设置了第一复合层和第二复合层,在外部侵蚀时,第二复合层先被腐蚀,再依次是第一复合层和金属丝,如此设置避免金属降解速率由原先的太慢,中期后后期变成太快,无法满足前期和中期的支撑作用。而金属前期腐蚀慢,中后期快速腐蚀导致大量氢气生产,会导致植入部位出现炎症,因此,所述医用植入物具在降解过程中析氢速率可控而且相对均匀的特点,除此之外,聚合物降解避免了生成碱,降低了对组织的损伤,而且所述医用植入物相对于纯金属,还具有机械性能优异的特点。
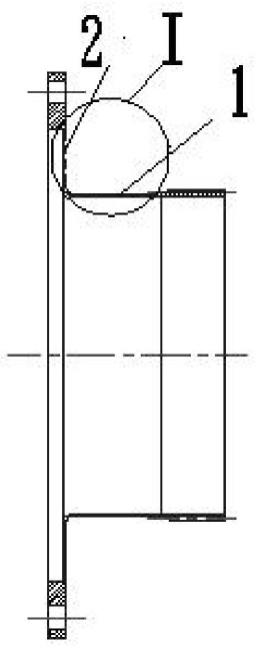
14.示例性地,图1-图2给出了第一复合层的结构示意图,图3-图4给出了医用植入物的结构示意图;本发明提供一种医用植入物,所述医用植入物包括金属丝以及由内至外依次设置于所述金属丝2外表面的第一复合层1和充当基质的第二复合层3;
15.所述第一复合层包括第一可降解聚合物11和第一活性材料12的组合;
16.所述第二复合层包括第二可降解聚合物31和第二活性材料32的组合。
17.优选地,所述金属丝包括镁单质、镁合金、铁单质、铁合金、锌单质或镁锌合金外的其他锌合金中的任意一种或至少两种的组合,其中典型但非限制性的组合包括:镁单质、镁合金和铁单质的组合,铁单质、铁合金、锌单质和镁锌合金外的其他锌合金的组合,镁单质、镁合金、铁单质、铁合金、锌单质和镁锌合金外的其他锌合金的组合等。
18.优选地,所述镁合金包括镁镁锌合金、镁锂合金、镁锶合金、镁钙合金或镁银合金中的任意一种或至少两种的组合,其中典型但非限制性的组合包括:镁锌合金、镁锂合金、镁锶合金和镁钙合金的组合等。
19.优选地,所述金属丝直径为10-500μm,例如50μm、100μm、150μm、200μm、250μm、300μm、35μm、400μm、450μm等,进一步优选30-100μm。
20.优选地,所述第一可降解聚合物的熔融温度<金属丝的熔融温度。
21.优选地,所述第一可降解聚合物包括乳酸和乙醇酸共聚物、聚羟基丁酸酯戊酸酯共聚物、聚乳酸、聚二氧六环酮聚酯、聚β-羟基丁酸、聚3-羟基丁酸酯、聚羟基戊酸酯、聚3-羟基丁酸酯和聚羟基戊酸酯的共聚物或聚β-羟基丁酸和聚羟基戊酸酯的共聚物中的任意一种或至少两种的组合,其中典型但非限制性的组合包括:乳酸和乙醇酸共聚物与聚羟基丁酸酯戊酸酯共聚物的组合,聚乳酸、聚二氧六环酮聚酯、聚β-羟基丁酸、聚3-羟基丁酸酯和聚羟基戊酸酯的组合,乳酸和乙醇酸共聚物、聚羟基丁酸酯戊酸酯共聚物、聚乳酸、聚二氧六环酮聚酯、聚β-羟基丁酸、聚3-羟基丁酸酯、聚羟基戊酸酯、聚3-羟基丁酸酯和聚羟基戊酸酯的共聚物、聚β-羟基丁酸和聚羟基戊酸酯的共聚物的组合等。
22.优选地,所述第一活性材料包括羟基磷灰石、玻璃纤维、硅酸钙、碳酸钙、磷酸钙、植物型纳米晶或细菌纤维素中的任意一种或至少两种的组合,其中典型但非限制性的组合包括:羟基磷灰石和玻璃纤维的组合,碳酸钙、磷酸钙、植物型纳米晶和细菌纤维素的组合,羟基磷灰石、玻璃纤维、硅酸钙、碳酸钙、磷酸钙、植物型纳米晶和细菌纤维素的组合等。
23.优选地,所述羟基磷灰石由水热合成、化学沉淀法、溶胶凝胶法,微乳液法、生物模板法等制备低结晶度高活性物质。
24.优选地,所述羟基磷灰石的形状为棒状或片状。
25.优选地,所述羟基磷灰石的形状为棒状时,所述羟基磷灰石的长径比>4,例如4.5、5、5.5、6、6.5等。
26.优选地,所述玻璃纤维为生物玻璃纤维。
27.优选地,所述细菌纤维素的粒径为10-100nm,例如20nm、30nm、40nm、50nm、60nm、70nm、80nm、90nm等。
28.优选地,第一活性材料沿金属丝拉伸方向取向。
29.优选地,所述第一复合层还包括药物。
30.优选地,所述药物包括抗生素和/或生长因子。
31.优选地,所述第二可降解聚合物的熔融温度<第一可降解聚合物的熔融温度。
32.优选地,所述第一可降解聚合物的熔融温度和第二可降解聚合物的熔融温度的差值>10℃,例如15℃、20℃、25℃、30℃、35℃、40℃、45℃等,进一步优选>20℃,更进一步优选>30℃。
33.本发明中,所述第一可降解聚合物的熔融温度和第二可降解聚合物的熔融温度的差值>10℃的原因在于:第一可降解聚合物熔融温度高于第二聚可降解聚合物至少10℃,当作为内层的第一可降解聚合物经过含有第二可降解聚合物的拉挤模具进行加工时,第一聚合物不会软化或熔融,依然保持第一聚合物的固体形态和第一可降解聚合物的分子排布状态。
34.优选地,所述第二可降解聚合物包括聚己内酯、聚戊内酯、聚丁内酯、聚丁二酸丁二醇酯、聚己二酸丁二醇酯、聚己二酸乙二醇酯和对苯二甲酸丁二醇酯的共聚物、聚外消旋聚乳酸、聚酯型聚氨酯、柠檬酸聚酯、聚乙二醇-聚葵二酸甘油酯、壳聚糖、明胶、胶原、海藻酸钠或无机粘结材料中的任意一种或至少两种的组合,其中典型但非限制性的组合包括:聚戊内酯、聚丁内酯、聚丁二酸丁二醇酯和聚己二酸丁二醇酯的组合,聚外消旋聚乳酸、聚酯型聚氨酯、柠檬酸聚酯、聚乙二醇-聚葵二酸甘油酯、壳聚糖、明胶和胶原的组合,柠檬酸聚酯、聚乙二醇-聚葵二酸甘油酯、壳聚糖、明胶、胶原、海藻酸钠和无机粘结材料的组合等。
35.优选地,所述无机粘结材料包括玻璃酸钠。
36.优选地,所述第二活性材料包括羟基磷灰石、玻璃纤维、硅酸钙、碳酸钙、磷酸钙、植物型纳米晶、细胞外基质或细菌纤维素中的任意一种或至少两种的组合,其中典型但非限制性的组合包括:羟基磷灰石、玻璃纤维和硅酸钙的组合,硅酸钙、碳酸钙、磷酸钙和植物型纳米晶的组合,碳酸钙、磷酸钙、植物型纳米晶和细菌纤维素的组合,硅酸钙、碳酸钙、磷酸钙和细胞外基质的组合等。
37.优选地,所述羟基磷灰石的形状为棒状或片状。
38.本发明中,所述羟基磷灰石的形状为棒状或片状,沿着金属丝长度方向取向排布,在应用时,能够进一步促进组织生长,使所述医用植入物具有更好生物组织适配性。
39.优选地,所述羟基磷灰石的形状为棒状时,所述羟基磷灰石的长径比>4,例如4.5、5、5.5、6、6.5等。
40.优选地,所述玻璃纤维为生物玻璃纤维。
41.优选地,所述细菌纤维素的粒径为10-100nm,例如20nm、30nm、40nm、50nm、60nm、70nm、80nm、90nm等。
42.优选地,第二活性材料沿金属丝或金属丝编制的拉伸方向取向。
43.优选地,所述第二复合层还包括药物。
44.优选地,所述药物包括抗生素和/或生长因子。
45.优选地,以所述医用植入物的总质量为100%计,所述金属丝的质量百分数为20%-60%,例如25%、30%、35%、40%、45%、50%、55%等。
46.优选地,以所述医用植入物的总质量为100%计,所述第一复合层的质量百分数为10%-70%,例如20%、30%、40%、50%、60%等。
47.优选地,以所述医用植入物的总质量为100%计,所述第二复合层的质量百分数为20%-70%,例如25%、30%、35%、40%、45%、50%、55%、60%、65%等。
48.优选地,以所述第一复合层的总质量为100%计,所述第一可降解聚合物的质量百分数为10%-70%,例如15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%等。
49.优选地,以所述第二复合层的总质量为100%计,所述第二可降解聚合物的质量百分数为10%-70%,例如10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%等。
50.优选地,所述金属丝的直径为0.01-10mm,例如0.05mm、0.5mm、1mm、2mm、4mm、6mm、8mm等。
51.优选地,所述第一可降解聚合物和第二可降解聚合物的分子链段各自独立地沿着金属丝长度方向排布。
52.本发明中,将第一可降解聚合物和第二可降解聚合物的分子链沿着金属丝长度方向取向排布,能够提高所述医用植入物的纵向力学强度和韧性,使所述医用植入物兼具强度、塑性和降解性能。
53.优选地,所述第二复合层包覆于所述第一复合层表面,或,所述第一复合层和第二复合层相互粘结。
54.优选地,所述第一复合层和金属丝之间还包括过渡层,过渡层可以包括金属铁、金属锌、氧化电弧、陶瓷涂层或聚合物涂层中的任意一种或至少两种的组合,其中典型但非限制性的组合包括:金属铁、金属锌和氧化电弧的组合,金属锌、氧化电弧和陶瓷涂层的组合,金属锌、氧化电弧、陶瓷涂层和聚合物涂层的组合等。
55.优选地,所述第二复合层内,包括至少一束(例如2束、3束、4束、5束、6束等)含有第一复合层的金属丝。
56.本发明中,可以将一束或多束含有第一复合层的金属丝表面设置第二复合层,当选择有多束含有第一复合层的金属丝,可以将多束含有第一复合层的金属丝先进行编织,再设置第二复合层,也可以直接将多束含有第一复合层的金属丝作为一个整体,设置第二复合层。
57.优选地,所述含有第一复合层的金属丝的表面还设置有金属丝。
58.本发明中,所述第二复合层内,可以先将含有第一复合层的金属丝直接设置第二复合层,也可以先将含有第一复合层的金属丝与金属丝编织作为一个整体,设置第二复合层。
59.优选地,所述第一复合层内,包括至少一根(例如2根、3根、4根、5根等)金属丝。
60.本发明中,可以先将多根金属丝编织成束,或者不编织但是作为一个整体,再设置
第一复合层。
61.第二方面,本发明提供一种第一方面所述的医用植入物的制备方法,所述制备方法包括如下步骤:
62.(1)将第一可降解聚合物和第一活性材料混合,然后将混合料包覆于金属丝表面,形成第一复合层;
63.(2)将第二可降解聚合物和第二活性材料混合,然后在第一复合层表面设置混合料,形成第二复合层外侧,得到所述医用植入物。
64.优选地,步骤(1)中,所述包覆前,还包括对金属丝设置过渡层。
65.优选地,所述过渡层的设置方式包括:浸入聚合物溶液中后干燥、微弧氧化或真空溅射中的任意一种或至少两种的组合。
66.优选地,所述包覆的方式包括:将熔融的混合料设置于金属丝表面,剪切拉伸。
67.优选地,所述第一复合层和第二复合层的制备方法各自独立地包括微流控膨胀流辅助取向。
68.本发明中,采用微流控膨胀流辅助取向的方法,可用于第一活性材料、第二活性材料在复合材料中水平取向(平行于流动方向)结构的构筑,有序的第一活性材料、第二活性材料颗粒有序排布不仅有利于复合材料韧性和强度提高,而且具有良好的生物活性,减少无序分布纳米活性陶瓷的细胞毒性,有利细胞粘附和促进细胞生长。
69.本发明中,通过金属丝中在微流控装置中的牵引拉伸作用,使高分子聚合物的微观分子结构链段发生取向,提高高分子聚合物的强度。
70.优选地,所述微流控膨胀流辅助取向的过程在微流控锥形装置和/或微流控楔形装置中进行,所述微流控的锥形装置和/或微流控的楔形装置各自独立地包括第一微流控通道和第二微流控通道。
71.优选地,所述第一微流控通道的宽度为50μm-5000μm,例如100μm、500μm、1000μm、1500μm、2000μm、2500μm、3000μm、3500μm、4000μm、4500μm等,进一步优选200μm-500μm。
72.优选地,所述第二微孔通道的宽度200μm-6000μm,例如500μm、1000μm、1500μm、2000μm、2500μm、3000μm、3500μm、4000μm、4500μm、5000μm、5500μm等,进一步优选500μm-3000μm。
73.优选地,步骤(2)中,所述设置混合料的方式包括:将包覆有第一复合层的金属丝牵引至熔融的混合料中,或,将熔融的混合料注入包覆有第一复合层的金属丝上,剪切拉伸。
74.优选地,所述设置混合料前,还包括先将步骤(1)所得的至少一根(例如2根、3根、4根、5根等)包覆有第一复合层的金属丝,和/或,至少一根金属丝(例如2根、3根、4根、5根等)作为一束,再进行第二复合层的设置。
75.优选地,所述包覆有第一复合层的金属丝各自独立地在表面设置或不设置金属丝。
76.优选地,所述设置金属丝的方式包括将包覆有第一复合层的金属丝与金属丝编织成束。
77.作为优选的技术方案,所述制备方法包括如下步骤:
78.(1)将第一可降解聚合物和第一活性材料混合,然后将熔融的混合料设置于含有
过渡层的金属丝表面,通过微流控膨胀流辅助取向,剪切拉伸,形成第一复合层;
79.(2)将包覆有第一复合层的金属丝牵引至熔融的混合料中,或,将熔融的混合料注入包覆有第一复合层的金属丝上,通过微流控膨胀流辅助取向,剪切拉伸,形成第二复合层,得到所述医用植入物。
80.第三方面,本发明提供一种第一方面所述的医用植入物在骨板、缝合线、椎间融合器、胃肠吻合钉、螺钉、髓内钉、接骨板、脊柱骨折脱位固定器材或骨针中的任意一种或至少两种的组合。
81.相对于现有技术,本发明具有以下有益效果:
82.(1)本发明所述的医用植入物具有优异的机械性能,降解过程中析氢速率可控而且相对均匀,还具备高生物活性的特点。又由于聚酯降解产物可以中和金属降解产生的碱,降低碱对组织的损伤。
83.(2)本发明所述的医用植入物,在优选的技术方案中,通过微流控膨胀流辅助取向制备第一复合层和第二复合层,聚合物的高分子微观分子结构和活性材料经过微流控的装置在牵引方向上拉伸取向,不仅提升聚合物材料拉伸性能和韧性,还使取向的活性材料具有良好的促进细胞分化与生长性能。
84.(2)本发明所述的医用植入物的拉伸强度在183-210mpa之间,断裂伸长率在10.3%以上,弹性模量在28.4-40.2gpa之间,弯曲强度635-689mpa之间,力学性能优异;
85.本发明所述的医用植入物,通过调节第一复合层和第二复合层量,可以调节析氢的速率。在析氢的量随着时间的变化中,析氢的量(析氢占总量比例)变化可控,在第12个月时在25.5%以上,降解速度可控而且均匀;
86.本发明所述的医用植入物在细胞繁殖过程中,具有高活性。
附图说明
87.图1是本发明所述的第一复合层的轴向截面结构示意图;
88.图2是本发明所述的第一复合层的平面截面结构示意图;
89.图3本发明所述医用植入物的轴向截面结构示意图;
90.图4本发明所述医用植入物的平面截面结构示意图;
91.图5是本发明所述微流控锥形装置的结构示意图;
92.其中,1-第一复合层;2-金属丝;3-第二复合层;11-第一可降解聚合物;12-第一活性材料;31-第二可降解聚合物;32-第二活性材料。
具体实施方式
93.为便于理解本发明,本发明列举实施例如下。本领域技术人员应该明了,所述实施例仅仅是帮助理解本发明,不应视为对本发明的具体限制。
94.本发明中,各实施方式中涉及的部分原料的购置信息如下:
95.mg100镁丝:购于国立大学熊本大学,牌号为kumadai。
96.铁丝:直径规格0.05mm,购于南通普创医疗科技有限公司。
97.聚羟基脂肪酸酯:pha,购于宁波天安生物材料有限公司;
98.聚己内酯:pcl,购于purasorb pc科碧恩贸易(上海)有限公司
99.棒状羟基磷灰石:ha,按照rheologica acta volume 50,pages65
–
74(2011)文献公开的方法制备获得平均长度:220纳米,平均直径:26,长径比:8.1。
100.实施例1
101.本实施例提供一种医用植入物,所述医用植入物由如下方法制备,所述方法包括如下步骤:
102.(1)将直径为30μm的mg
100
镁丝浸入质量百分数为40%的pha丙酮溶液,浸泡5分钟,烘干除去溶剂,形成过渡层;
103.(2)将烘干后的1根mg
100
镁丝通过微流控锥形装置(其结构示意图如图5所示),经过高度、宽度为50μm、长度为2m的第一微流控通道,牵引速度0.05m/min。微流控锥形装置中为第一复合层熔体:pha与ha熔体,熔融温度为180℃,其中,pha与ha的质量比为90:10,传送出微流控锥形装置,空气冷却至常温,收卷,形成第一复合层,直径为50μm;
104.(3)将步骤(2)所得的包覆有第一复合层的mg
100
镁丝,交错编织,经过高度、宽度为2000μm、长度为2m的第二微流控通道,拉伸速度0.1m/min,第二微流控锥形装置为第二复合层熔体:pcl与ha质量比70:30,熔融温度为80℃,传送出微流控锥形装置,空气冷却至室温,得到直径为2000μm的医用植入物。其中:镁丝:30%,第一复合层:30%,第二复合层:40%。
105.实施例2
106.本实施例与实施例1的不同之处在于,镁丝:40%,第一复合层:30%,第二复合层:30%。。
107.实施例3
108.本实施例与实施例1的不同之处在于,镁丝:50%,第一复合层:30%,第二复合层:20%。
109.实施例4
110.本实施例与实施例1的不同之处在于,镁丝:70%,第一复合层:10%,第二复合层:20%。
111.实施例5
112.本实施例与实施例1的不同之处在于,镁丝:20%,第一复合层:10%,第二复合层:70%。
113.实施例6
114.本实施例与实施例1的不同之处在于,镁丝:30%,第一复合层:50%,第二复合层:20%。
115.实施例7
116.本实施例与实施例1的不同之处在于,第一复合层:pha与ha的质量比为75:25。
117.实施例8
118.本实施例与实施例1的不同之处在于,第二复合层:pcl与ha的质量比为50:50。
119.实施例9
120.本实施例与实施例1的不同之处在于,镁丝等距平行排布经过第二微流控装置。
121.对比例1
122.本对比例中,所述医用植入物为mg
100
镁丝。
123.对比例2
124.将第一复合熔体、第二复合熔体依次与ha、至镁金属棒表面,冷却后,将pcl与ha熔体喷涂至镁金属表面,产品直径控制在2000μm。镁金属棒:30%,第一复合层:30%,第二复合层:40%。
125.对比例3
126.本对比例与对比例2不同之处,镁金属棒:50%,第一复合层:30%,第二复合层:20%。
127.对比例4
128.本对比例与对比例2不同之处,镁金属棒:70%,第一复合层:10%,第二复合层:20%。
129.对比例5
130.将第一复合层熔体,pha与ha比例为90:10,喷涂直径为30μm镁丝表面。交错编制放置直径为2000μm的模量中。将第二复合层加入模具中,盖上模具。第二聚合物pcl与ha比例为70:30。金属镁丝:30%,第一复合层:30%,第二复合层:40%。初始5mpa压力,逐步升温至120℃,压力提升至10mpa,保温2小时,冷却。
131.对比例6
132.将实施例1的制备的医用植入物放置在0.1mol/l稀盐酸溶液中,反应去除金属镁丝。反应结束,取出,清洗,烘干。
133.对比例7
134.将对比例5的制备的医用植入物放置在0.1mol/l稀盐酸溶液中,反应去除金属镁丝。反应结束,取出,清洗,烘干。
135.性能测试
136.将实施例1-9和对比例1-7所述的医用植入物进行如下测试:
137.(1)拉伸强度和断裂伸长率:按照gb/t1447-2005玻纤增强塑料拉伸性能试验方法测试拉伸强度,拉伸的样品尺寸为90mm
×
2mm,加载速率为5mm/min,测试拉伸强度。
138.(2)弯曲强度和外观:按照gb/t3356-2014,试样的跨距与直径比为16:1,样品尺寸为60mm
×
2mm,跨距32mm,测试的加载速率为2mm/min,测试弯曲强度和弯曲模量。
139.(3)析氢性能:参考16886.1标准,将尺寸为60mm
×
2mm样品浸泡在0.1mol/l,ph为:7.4
±
0.1的tris-hcl的缓冲液中12月,质量比为1:30,用0.1mol氢氧化钠或盐酸调节ph。
140.(4)降解速度:将尺寸为60mm
×
2mm样品浸泡ph为:7.0
±
0.2的蒸馏水中12个月,质量比为1:30,用0.1mol氢氧化钠或盐酸调节ph。
141.(5)细胞增殖试验:将实施例1-7与对比例1-3采用细胞直接接触培养,各个阶段加入cck-8后,测试od值。
142.测试结果汇总于表1-3中。
143.表1
[0144][0145]
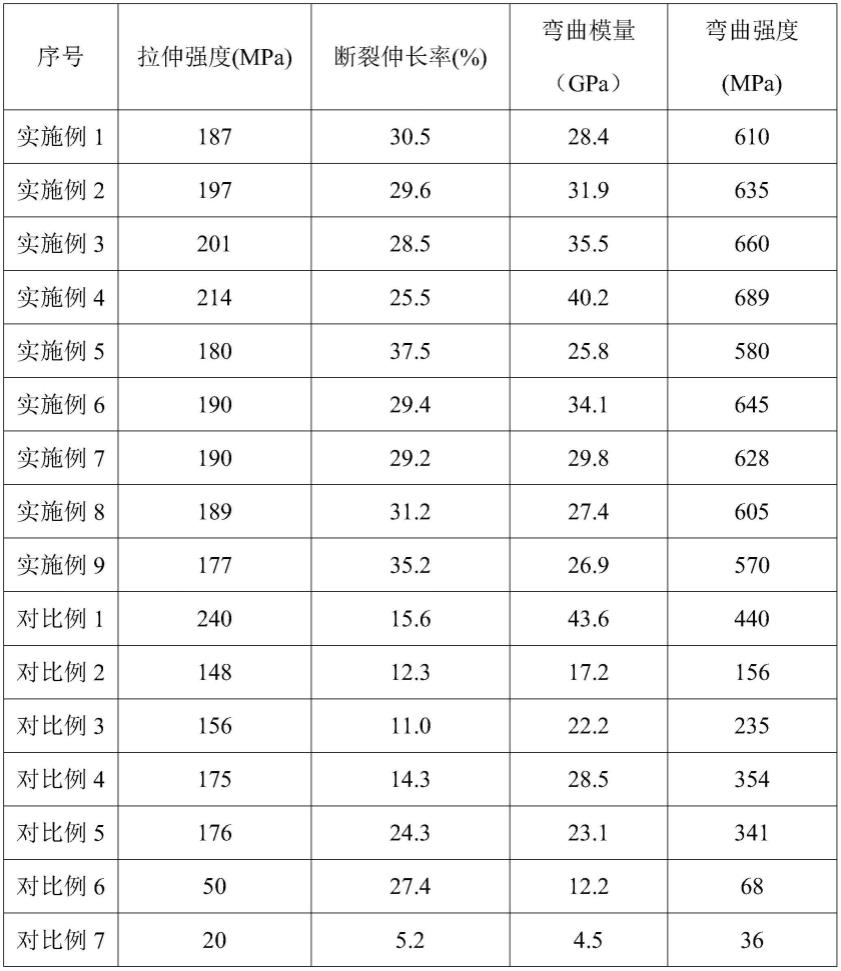
分析表1可知,本发明所述的医用植入物的拉伸强度在177-214mpa之间,断裂伸长率在25.5%以上,弯曲模量在25.8-40.2gpa之间,弯曲强度570-689mpa之间,本发明所述的医用植入物相比对比例2-5复合金属镁具有优异的力学性能。
[0146]
分析实施例1-5实施例4可知,随着金属镁含量的增加拉伸强度、弯曲模量和弯曲强度逐步提高,断裂伸长率降低。
[0147]
分析实施例6-8可知,第一复合层、第一复合层中的羟基磷灰石、第二复合层羟基磷灰石含量增加有利于医用植入物弯曲强度和模量提高。
[0148]
分析实施例9可知,镁丝编制有利于医用植入物拉伸强度、弯曲强度和模量提高。
[0149]
分析对比例1-5与实施例1-9可知,相同含量金属镁,证明本发明所述的医用植入物力学性能性能更佳。
[0150]
分析对比例6-7可知,只有同时设置第一复合层和第二复合层,而且第一复合层和第二复合层中均含有活性材料并且取向,形成的医用植入物具有更好的拉伸强度和韧性采
用微流控的方式制备形成的医用植入物性能更佳。
[0151]
表2
[0152][0153][0154]
分析表2的析氢相关数据可知,本发明所述的医用植入物,在析氢的量随着时间的变化中,析氢的(析氢实际量占总量比例)降解速率,在第12个月时在25.5%以上,降解速度缓慢而且均匀。通过调整第一复合层、第二复合层含量可以调节析氢量速率,有效控制镁丝金属在缓冲液腐蚀的速率。
[0155]
将实施例1-7和对比例1-5的析氢结果进行对比,结果显示,在析氢的量随着时间的变化中,对比例1-5前期因为复合材料涂层保护作用,前期降解非常缓慢,随着时间的变化,复合涂层降解后,镁金属开始逐步快速的降解,后期降解速率快速增加,氢气速率大幅增加。
[0156]
将实施例1-7和对比例3析氢结果进行对比,结果显示,取向的聚合物和陶瓷对析氢的控制优于没有取向的聚合物和陶瓷复合材料。实施例1-7析氢趋势可以看到,通过调节pha聚合物的含量可以调节医用植入物析氢速度。
[0157]
综上,本发明实现减缓生物医用植入物的降解速度,可有效地调控生物医用植入物在体内的降解时间。
[0158]
表3
[0159][0160][0161]
分析表3可知,将实施例1-9与对比例1-7对比表明,对比例1-7性能不如实施例1-9,证明本发明所述的医用植入物聚合物链段的取向和活性材料的取向,促进细胞增殖。
[0162]
申请人声明,本发明通过上述实施例来说明本发明的详细方法,但本发明并不局限于上述详细方法,即不意味着本发明必须依赖上述详细方法才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明产品各原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。