1.本发明属于废水处理技术领域,具体涉及酵母菌在处理右旋糖酐工业废水中的应用。
背景技术:
2.低分子右旋糖酐,系蔗糖经肠膜状明串珠菌发酵后生成的高分子葡萄糖聚合物,经处理精制而得;属于血浆代用品,在医药、食品和工业等方面都有广泛的应用。但是,生产右旋糖酐中,每吨右旋糖酐生产同时产生约52吨工业废水,右旋糖酐被提取后的废液中含有高浓度的有机废水,某厂右旋糖酐工业废水经测定,其cod值达5.20*104mg/l;目前,在利用右旋糖酐工业废水方面的研究,主要方向有:一、从发酵废液中提取果糖;二、用于发酵生产饲用复合酶制剂;三、用于发酵生产衣康酸或丁二酸。
3.右旋糖酐工业废水属于高浓废水(cod(化学需氧量)>10000mg/l,tds(溶解性固体总量)>1%);该类废水有机负荷浓度高,含盐量大;针对该类废水的传统处理工艺为稀释或蒸发除盐后进行生化,但是由于废水整体有机负荷较高,蒸发势必产生母液,且蒸发能耗高,成本大;稀释法则会导致整体处理水量增大,处理成本翻倍增加。而芬顿氧化、铁碳微电解、萃取、树脂吸附等物化方法虽对有机废水有较好的处理效果,但其适用范围有限,且投资成本和运行费用也极大的限制该类方法的工程化。因此,高效低成本的处理方法成为高浓废水处理的关键。
4.公开号cn 114317382 a中国专利公开了一种应用于河道水体cod去除的厌氧菌种及其应用,提供了一种高效去除cod菌株(副地衣芽孢杆菌,保藏编号为cctcc no:m 2022018),但是,副地衣芽孢杆菌cod浓度超过1000mg/l的水体中难以生长良好,难以去除高浓度cod,对右旋糖酐工业废水cod去除不足;同时,同一个菌株对于不同废水cod去除率不一样,这和菌株对这种废水利用率有密切关系,因此,针对右旋糖酐工业废水cod去除研究对环保有极大价值。
技术实现要素:
5.本发明提供酵母菌在处理右旋糖酐工业废水中的应用,能够高效去除右旋糖酐工业废水cod,实现高效低成本处理高浓废水,还能够高效利用右旋糖酐工业废水生产单细胞蛋白,实现资源再利用。
6.为实现上述目的,本发明提供了酵母菌在处理右旋糖酐工业废水中的应用,所述酵母菌为热带假丝酵母ccic 32826,所述右旋糖酐工业废水的cod为25000-55000mg/l。热带假丝酵母(candida tropicalis)购自广东省微生物菌种保藏中心,编号ccic 32826。通过筛选菌株,得到能够高效处理右旋糖酐工业废水的热带假丝酵母ccic 32826,能够去除右旋糖酐工业废水cod,高效利用右旋糖酐工业废水生产单细胞蛋白并高效去除右旋糖酐工业废水中cod。
7.优选的,上述应用中,所述处理右旋糖酐工业废水包括:以右旋糖酐工业废水或右
旋糖酐工业废水经过适当补加营养成分及盐调制后的发酵培养液,加入所述热带假丝酵母发酵培养,去除右旋糖酐工业废水的cod,收获单细胞蛋白。
8.优选的,上述应用中,所述发酵培养液包括以下组分:右旋糖酐工业废水100-975ml/l、酵母浸粉2-20g/l、磷酸二氢钾0.2-4g/l、七水合硫酸镁0.02-1g/l,所述发酵培养液的ph为4.0~6.5。
9.优选的,上述应用中,所述发酵培养液包括以下组分:所述发酵培养液包括以下组分:右旋糖酐工业废水600ml/l、酵母浸粉4.18g/l、磷酸二氢钾1g/l、七水合硫酸镁0.1g/l,所述发酵培养液的ph为5.5。
10.优选的,上述应用中,采用氢氧化钠调节ph。
11.优选的,上述应用中,所述处理右旋糖酐工业废水包括以下步骤:
12.(1)取右旋糖酐工业废水100-975ml、酵母浸粉2-20g、磷酸二氢钾0.2-4g、七水合硫酸镁0.02-1g进行混合,加入蒸馏水稀释至1000ml,采用氢氧化钠调节ph为4.0~6.5,116℃灭菌30min后冷却至室温;得到发酵培养液;
13.(2)将所述热带假丝酵母接种于步骤(1)得到的发酵培养液进行培养,培养条件:发酵温度25~35℃、摇床转速200~250r/min、培养时间24~48小时;
14.(3)步骤(2)得到的发酵培养液进行离心、洗涤、干燥,得到单细胞蛋白。
15.优选的,上述应用中,所述热带假丝酵母经过驯化培养。
16.优选的,上述应用中,所述热带假丝酵母驯化具体包括:
17.①
将所述热带假丝酵母菌种接种到固体培养基i中,恒温培养箱30℃培养48h活化菌种;所述固体培养基i为:麦芽汁40ml、硫酸铵5g、蛋白胨10g、酵母浸粉5g、磷酸二氢钾2g、七水合硫酸镁0.1g,葡萄糖20g,蒸馏水稀释至1000ml,测得ph为5.5,加入琼脂粉20g,灭菌,加热溶解、冷却得到固体培养基i;
18.②
将步骤
①
活化得到的菌种转接到种子培养基中进行扩大培养,在30℃、220r/min条件下培养48h,得到菌液;所述种子培养基为:麦芽汁40ml、硫酸铵5g、蛋白胨10g、酵母浸粉5g、磷酸二氢钾2g、七水合硫酸镁0.1g,葡萄糖20g,蒸馏水稀释至1000ml,测得ph为5.5,灭菌,得到种子培养基;
19.③
将步骤
②
得到的菌液转接到发酵培养基中,在30℃、220r/min条件下培养72h;移取100μl发酵培养基中菌液,用无菌水稀释至1.0*107倍,移取25μl至固体培养基ii中,刮均匀,置恒温培养箱30℃培养48h;选取固体培养基ii上长势最优的单菌落菌种接到平面培养皿内固体培养基ii上,进行传代培养,传代4次后选取固体培养基ii上长势最优的单菌落菌种接到固体培养基i上,置恒温培养箱30℃培养48h,即得;在固体培养基ii上完成传代后,传代至固体培养基i上保存;
20.发酵培养基为:右旋糖酐工业废水400ml、硫酸铵5g、蛋白胨10g、酵母浸粉5g、磷酸二氢钾2g、七水合硫酸镁0.1g,蒸馏水稀释至1000ml,测得ph为4.9,灭菌;
21.所述固体培养基ii为:右旋糖酐工业废水400ml、硫酸铵5g、蛋白胨10g、酵母浸粉5g、磷酸二氢钾2g、七水合硫酸镁0.1g,蒸馏水稀释至1000ml,测得ph为4.9,加入琼脂粉20g,灭菌,加热溶解、冷却得到固体培养基ii。
22.与现有的技术相比,本发明具有如下有益效果:
23.本发明中,通过筛选菌株,得到能够高效处理右旋糖酐工业废水的热带假丝酵母
ccic 32826。将热带假丝酵母ccic 32826应用于右旋糖酐工业废水,能够有效去除右旋糖酐工业废水的cod,右旋糖酐工业废水cod去除率可达70%以上,实现低成本处理右旋糖酐工业废水,减少废水排放量。还能够利用右旋糖酐工业废水生产经济价值较高的单细胞蛋白,通过优化发酵培养液的组分及含量,单细胞蛋白产量最高可达8.32g/l,粗蛋白含量最高可达50.3%,实现废弃资源再利用。本发明的处理右旋糖酐工业废水的步骤简单,成本低,具有好的经济和环境效益。
附图说明
24.图1为本发明试验例3中响应为od
600
plackett-burman试验标准化效应的pareto图。
25.图2为本发明试验例3中响应为cod去除率plackett-burman试验标准化效应的pareto图。
26.图3为本发明试验例3中box-behnken实验中保持ph为5时od
600
与酵母浸粉、废水的等值线图。
27.图4为本发明试验例3中box-behnken实验中保持酵母浸粉为0.4g/100ml时od
600
与ph、废水的等值线图。
28.图5为本发明试验例3中box-behnken实验中保持废水为50ml/100ml时od
600
与ph、酵母浸粉的等值线图。
29.图6为本发明试验例3中box-behnken实验中保持ph为5时cod去除率与酵母浸粉、废水的等值线图。
30.图7为本发明试验例3中box-behnken实验中保持酵母浸粉为0.4g/100ml时cod去除率与ph、废水的等值线图。
31.图8为本发明试验例3中box-behnken实验中保持废水为50ml/100ml时cod去除率与ph、酵母浸粉的等值线图。
32.图9为本发明试验例3中优化响应图。
具体实施方式
33.下面对本发明的具体实施方式进行详细描述,但应当理解本发明的保护范围并不受具体实施方式的限制。
34.实施例1
35.本实施例酵母菌在处理右旋糖酐工业废水中的应用,酵母菌为热带假丝酵母菌candida tropicalis,购于中国工业微生物菌种保藏管理中心,菌株编号为cicc no.32826,保藏地址为北京市朝阳区酒仙桥中路24号院6号楼。右旋糖酐工业废水的cod为52000mg/l。
36.利用热带假丝酵母菌处理右旋糖酐工业废水包括以下步骤:
37.(1)取右旋糖酐工业废水600ml、酵母浸粉4.18g、磷酸二氢钾1g、七水合硫酸镁0.1g进行混合,加入蒸馏水稀释至1000ml,采用氢氧化钠调节ph为5.5,116℃灭菌30min后冷却至室温,得到发酵培养液;
38.(2)将热带假丝酵母接种于步骤(1)得到的发酵培养液,于摇床上进行培养,接种
量为20ml,培养条件:发酵温度30℃、摇床转速220r/min、培养时间48h;
39.(3)步骤(2)得到的发酵培养液进行在10000r/min转速下离心10min,检测上清液cod去除率,收集沉淀、用水洗涤3次、在105℃进行干燥至恒重,得到单细胞蛋白。
40.本实施例中右旋糖酐工业废水cod去除率为73.1%,单细胞蛋白产量为8.32g/l,粗蛋白含量50.3%。
41.步骤(2)中的热带假丝酵母购于中国工业微生物菌种保藏管理中心,菌株编号为cicc no.32826,将菌株进行活化、驯化后用于接种。
42.热带假丝酵母cicc32826活化、驯化具体包括:
43.①
菌种活化:在无菌操作环境下,分别接1环32826保藏菌种到固体培养基i中,恒温培养箱30℃培养48h复苏菌种;
44.②
菌种扩大培养:用接种环取1环活化后的固体培养基i上菌种转接到装液量为50ml/250ml的种子培养基中,在30℃、220r/min条件下培养48h;
45.③
驯化:量取20ml种子培养基中菌液转接到装液量为250ml/1000ml的发酵培养基中,在30℃、220r/min条件下培养72h;移取100μl发酵培养基中菌液,用无菌水稀释至1.0*107倍,移取25μl至固体培养基ii中,刮均匀,置恒温培养箱30℃培养48h;选取固体培养基ii上长势最优的单菌落菌种接1环平面培养皿内固体培养基ii上,进行传代培养,传代4次后选取固体培养基ii上长势最优的单菌落菌种接1环到固体培养基i上,置恒温培养箱30℃培养48h,即得。
46.固体培养基i为:麦芽汁40ml、硫酸铵5g、蛋白胨10g、酵母浸粉5g、磷酸二氢钾2g、七水合硫酸镁0.1g,葡萄糖20g,蒸馏水稀释至1000ml,测得ph为5.5,加入琼脂粉20g,灭菌,加热溶解、冷却得到固体培养基i;
47.种子培养基为:麦芽汁40ml、硫酸铵5g、蛋白胨10g、酵母浸粉5g、磷酸二氢钾2g、七水合硫酸镁0.1g,葡萄糖20g,蒸馏水稀释至1000ml,测得ph为5.5,灭菌,得到种子培养基;
48.发酵培养基为:右旋糖酐工业废水400ml、硫酸铵5g、蛋白胨10g、酵母浸粉5g、磷酸二氢钾2g、七水合硫酸镁0.1g,蒸馏水稀释至1000ml,测得ph为4.9,灭菌;
49.固体培养基ii为:右旋糖酐工业废水400ml、硫酸铵5g、蛋白胨10g、酵母浸粉5g、磷酸二氢钾2g、七水合硫酸镁0.1g,蒸馏水稀释至1000ml,测得ph为4.9,加入琼脂粉20g,灭菌,加热溶解、冷却得到固体培养基ii。
50.将驯化得到的热带假丝酵母接种到种子培养基1中进行扩大培养,接种量20ml,于30℃、转速220r/min的摇床上培养48h;种子培养基1的成分包括一水合葡萄糖25g、蛋白胨2g、酵母浸粉0.6g、磷酸二氢钾1g、七水合硫酸镁0.1g,蒸馏水稀释至1000ml,测得ph值=5.5,分装:200ml/1000ml三角瓶,封口膜封口,116℃灭菌30min后冷却至室温。将培养得到的热带假丝酵母菌液用于接种到发酵培养液中。
51.实施例2
52.本实施例的利用右旋糖酐工业废水生产单细胞蛋白的方法同实施例1,不同之处在于:本实施例的发酵培养液以下组分:右旋糖酐工业废水600ml/l、酵母浸粉6g/l、磷酸二氢钾1g/l、七水合硫酸镁0.1g/l。
53.试验例1高效利用右旋糖酐工业废水菌株筛选试验
54.右旋糖酐工业废水浓度为cod为52000mg/l。
55.试验方法:分别采用一水合葡萄糖、右旋糖酐工业废水作为碳源进行培养,一水合葡萄糖作为碳源时具体为:将表1中不同菌株接种至种子培养基1培养后,再接种至发酵培养基1;右旋糖酐工业废水作为碳源时具体为:将表1中不同菌株接种至种子培养基2,培养后,接种至发酵培养基2中,培养条件:接种量20ml、发酵温度30℃、摇床转速220r/min、培养时间48h。
56.发酵培养基1(种子培养基1)的成分包括:一水合葡萄糖25g、蛋白胨2g、酵母浸粉0.6g、磷酸二氢钾1g、七水合硫酸镁0.1g,蒸馏水稀释至1000ml,氢氧化钠调ph值=5.5。分装:200ml/1000ml三角瓶,封口膜封口,116℃灭菌30min后冷却至室温。
57.发酵培养基2(种子培养基2)的成分包括:右旋糖酐工业废水600ml、蛋白胨2g、酵母浸粉0.6g、磷酸二氢钾1g、七水合硫酸镁0.1g,蒸馏水稀释至1000ml,氢氧化钠调ph值=5.5。分装:200ml/1000ml三角瓶,封口膜封口,116℃灭菌30min后冷却至室温。
58.表1菌株信息
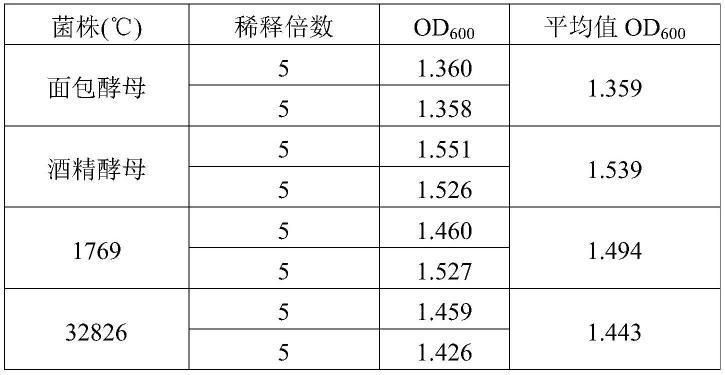
59.菌株名称来源32826(热带假丝酵母)采购于中国工业微生物菌种保藏管理中心,活化、驯化得到1769(产朊假丝酵母)采购于中国工业微生物菌种保藏管理中心,活化、驯化得到酒精酵母某酒厂的酒精酵母中分离、纯化得到面包酵母某面包酵母中分离、纯化得到高糖酵母安琪高糖酵母中分离、纯化得到葡萄酒酵母安琪葡萄酒酵母中分离、纯化得到
60.取发酵培养基培养结束后菌液进行菌密度检测,采用uv检测,接种前培养基作为空白对照,检测波长600nm,检测结果如表2、表3所示。由表2和表3可知,配方中使用一水合葡萄糖作为碳源时,od
600
从大到小的顺序为:酒精酵母》1769》32826》面包酵母,但是,配方中使用右旋糖酐工业废水作为碳源时,od
600
从大到小的顺序为:32826》1769》酒精酵母》高糖酵母》葡萄酒酵母》面包酵母;结果表明32826菌株对于右旋糖酐工业废水能够高效利用。
61.表2不同菌株利用一水合葡萄糖培养后检测菌密度结果表
[0062][0063]
表3不同菌株利用右旋糖酐工业废水培养后检测菌密度结果表
[0064][0065]
试验例2发酵培养液组分初筛
[0066]
2.1右旋糖酐工业废水最适含量
[0067]
试验方法:将经过驯化的热带假丝酵母32826接种到种子培养基培养,培养条件:接种量20ml、发酵温度30℃、摇床转速220r/min、培养时间48h。然后再将种子培养基培养的菌液接种到不同发酵培养基(见表4)中进行培养,培养条件为:接种量20ml、发酵温度30℃、摇床转速220r/min、培养时间48h。
[0068]
种子培养基的成分包括:一水合葡萄糖25g、蛋白胨2g、酵母浸粉0.6g、磷酸二氢钾1g、七水合硫酸镁0.1g,蒸馏水稀释至1000ml,氢氧化钠调ph值=5.5。分装:100ml/500ml三角瓶,封口膜封口,116℃灭菌30min后冷却至室温。
[0069]
取发酵培养基培养结束后菌液进行菌密度检测,采用uv检测,接种前培养基作为空白对照,检测波长600nm,检测结果如表5。由表5可知,32826菌株随着右旋糖酐工业废水含量增加菌密度越高,32826菌株菌密度与右旋糖酐工业废水含量表现出正相关性。配方中右旋糖酐工业废水含量小于60%(v/v)时增加菌密度最快,大于60%(v/v)时增加菌密度缓慢,因此,配方中最适右旋糖酐工业废水含量约为60%(v/v)。
[0070]
表4不同右旋糖酐工业废水含量发酵培养基配方表
[0071][0072]
表5不同发酵培养基配方培养后的菌液检测菌密度结果表
[0073][0074][0075]
2.2氮源最适含量
[0076]
(1)硫酸铵作为氮源时最适含量
[0077]
试验方法同2.1,发酵培养基的成分如表6所示。检测方法同2.1,检测结果如表7所示。由表7可知,32826菌株随着硫酸铵含量增加菌密度结果越低,从而得知,32826菌株菌密度与硫酸铵含量表现出负相关性。配方中硫酸铵含量0时菌密度最高,硫酸铵不适合作氮源。
[0078]
表6不同硫酸铵含量发酵培养基配方表
[0079][0080]
表7不同硫酸铵含量发酵培养基配方培养后的菌液检测菌密度结果表
[0081]
发酵培养基编号稀释倍数od
600
1111.7682111.7303111.7184111.6995111.6726111.638
[0082]
(2)尿素作为氮源时最适含量
[0083]
试验方法同2.1,发酵培养基的成分如表8所示。检测方法同2.1,检测结果如表9所示。由表9可知,32826菌株随着尿素含量增加菌密度越低,从而得知,32826菌株菌密度与尿素含量表现出负相关性。配方中尿素含量0时菌密度最高,因此,尿素不适合作氮源。
[0084]
表8不同尿素含量发酵培养基配方表
[0085][0086]
表9不同尿素含量发酵培养基配方培养后的菌液检测菌密度结果表
[0087]
发酵培养基编号稀释倍数od
600
1111.6852111.6243111.5334111.367
[0088]
(3)酵母浸粉作为氮源时最适含量
[0089]
试验方法同2.1,发酵培养基的成分如表10所示。检测方法同2.1,检测结果如表11所示。
[0090]
表10不同酵母浸粉含量发酵培养基配方表
[0091][0092]
表11不同酵母浸粉含量发酵培养基配方培养后的菌液检测菌密度结果表
[0093][0094][0095]
取发酵培养基培养结束后菌液进行离心(10000r/min、20min)后上清液检测cod去除率,采用重铬酸盐法检测,检测结果如表12所示。
[0096]
根据测定数据及以下计算公式(1)计算cod去除率:
[0097]
cod去除率=[cod(0)-cod(x)]/cod(0)
×
100%公式(1)
[0098]
cod(0)为刚接种菌株的右旋糖酐工业废水培养液水体初始的cod,cod(x)为在x时间点所取培养液样本的cod。
[0099]
由表11、表12可知,32826菌株随着酵母浸粉含量增加菌密度越高,32826菌株菌密度与酵母浸粉含量表现出正相关性;随着酵母浸粉含量增加cod去除率结果先增高后降低。配方3中酵母浸粉含量时cod去除率最高,因此,配方中最适酵母浸粉含量约为6g/l。
[0100]
表12不同酵母浸粉含量发酵培养基配方培养后cod去除率
[0101]
发酵培养基编号cod去除率(%)166.3268.8369.2468.4567.2
[0102]
以上氮源实验仅是部分实验,还进行了(有机氮)蛋白胨、(硝基氮)硝酸钾、氨水(氨基氮)等试验对于32826菌株生长效果均不理想。
[0103]
综上,32826菌株对氮源利用是分种类的,采用氮源-酵母浸粉培养32826菌株能够促进菌体生长、对去除cod有显著作用。
[0104]
2.3磷酸二氢钾最适含量
[0105]
试验方法同2.1,发酵培养基的成分如表13所示。检测方法同2.1,检测结果如表14所示。由表14可知,32826菌株随着磷酸二氢钾含量增加菌密度先增高后降低,配方中最适磷酸二氢钾含量约为1g/l。
[0106]
表13不同磷酸二氢钾含量发酵培养基配方表
[0107][0108]
表14不同磷酸二氢钾含量发酵培养基配方培养后的菌液检测菌密度
[0109][0110]
2.4七水合硫酸镁最适含量
[0111]
试验方法同2.1,发酵培养基的成分如表15所示。检测方法同2.1,检测结果如表16所示。由表16可知,32826菌株随着七水合硫酸镁含量增加菌密度结果先增高后降低。因此,配方中最适七水合硫酸镁含量约为0.1g/l。
[0112]
表15不同七水合硫酸镁含量发酵培养基配方表
[0113][0114]
表16不同七水合硫酸镁含量发酵培养基配方培养后的菌液检测菌密度
[0115][0116]
2.5ph最适值
[0117]
试验方法同2.1,发酵培养基的成分如表17所示。检测方法同2.1,检测结果如表18所示。由表18可知,32826菌株随着ph增大菌密度结果先增高后降低,配方中最适ph值约为5.5。
[0118]
表17不同ph发酵培养基配方表
[0119][0120]
表18不同ph值发酵培养基配方培养后的菌液检测菌密度
[0121][0122]
由以上可知,依据配方中各组分最适含量得基础配方为:右旋糖酐工业废水600ml/l、酵母浸粉6g/l、磷酸二氢钾1g/l、七水合硫酸镁0.1g/l,ph为5.5。
[0123]
试验例3发酵培养液成分含量优化
[0124]
种子培养基的成分包括一水合葡萄糖25g、蛋白胨2g、酵母浸粉0.6g、磷酸二氢钾1g、七水合硫酸镁0.1g,蒸馏水稀释至1000ml,氢氧化钠调ph值=5.5。分装:100ml/500ml三角瓶,封口膜封口,116℃灭菌30min后冷却至室温。培养条件:接种量20ml、发酵温度30℃、
摇床转速220r/min、培养时间48小时。
[0125]
采取minitab软件进行plackett-burman设计和box-behnken设计对初代配方(试验例1中得到的基础配方)进行优化。
[0126]
3.1plackett-burman设计试验
[0127]
筛选初对菌株生长或cod去除比较明显因素,plackett-burman设计发酵培养基配方如表19。
[0128]
表19采取minitab软件进行plackett-burman设计发酵培养基配方表
[0129][0130]
按上述设计试验配方进行制备,接种、培养试验,试验方法同试验例2中2.1中试验方法。取发酵培养基培养结束后菌液进行菌密度检测,检测结果如表20、表21、图1。
[0131]
表20设计发酵培养基配方培养后的菌液检测菌密度
[0132][0133]
表21响应为od
600 plackett-burman实验因素水平及其主效应分析表
[0134][0135]
取发酵培养基培养结束后菌液进行离心(10000r/min、20min)后上清液检测cod去除率,采用重铬酸盐法检测,检测结果如表22、表23、图2。
[0136]
表22设计发酵培养基配方培养后菌液进行离心后的上清液检测cod去除率
[0137]
[0138][0139]
表23响应为cod plackett-burman实验因素水平及其主效应分析表
[0140][0141]
由表20~23可知,32826菌株在采取minitab软件进行plackett-burman设计发酵培养基配方运行序号为1-12时候,菌密度结果中右旋糖酐工业废水、酵母浸粉这2个因素的可信度都在90%以上,cod去除率果中右旋糖酐工业废水1个因素的可信度都在90%以上;由于菌密度和cod去除率满足可信度90%以上的不足3个,为了进行box-behnken设计,选取了可信度最高的3个因素进行试验设计,分别为:右旋糖酐工业废水(a)、酵母浸粉(b)、ph值(e)。
[0142]
3.2box-behnken设计试验
[0143]
对配方中菌株生长或cod去除比较明显3个因素进行优化
[0144]
box-behnken设计发酵培养基配方如表22,按设计试验配方进行制备,接种、培养试验。取发酵培养基培养结束后菌液进行菌密度检测,检测结果如表25~27、图3~5所示。
[0145]
表24采取minitab软件进行box-behnken设计发酵培养基配方表
[0146]
[0147][0148]
表25设计发酵培养基配方培养后的菌液检测菌密度
[0149]
[0150][0151]
表26 box-behnken实验响应为od
600
的估计回归系数表
[0152][0153]
表27 box-behnken实验响应为od
600
的方差分析表
[0154]
[0155]
取发酵培养基培养结束后菌液进行离心(10 000r/min、20min)后上清液检测cod去除率,采用重铬酸盐法检测,检测结果如表28~30、图6~8所示。
[0156]
表28采取设计发酵培养基配方培养后cod去除率
[0157]
发酵培养基运行序cod去除率(%)169.9269.2378.1475.7571.9684.5782.5884.0982.91078.11178.41261.81380.71476.41570.9
[0158]
表29 box-behnken实验响应为cod的估计回归系数表
[0159][0160]
表30 box-behnken实验响应为cod的方差分析表
[0161]
[0162][0163]
结果中,a为右旋糖酐工业废水、b为酵母浸粉、e为ph值。由表25~27、图3~5可知,32826菌株在采取minitab软件进行box-behnken设计发酵培养基配方运行序号为1-15时候,rsm分析筛选重要因素的最优水平,进行rsm分析采用的重要因素水平见表24;实验结果分别见表25。以od600水平为响应值,根据表25中box-behnken设计的实验结果,进行二次回归分析,回归方程为:
[0164]
od600=0.74-0.0020*a 0.366*b-0.137*c 0.000046*a*a 0.071*b*b 0.0129*c*c 0.00256*a*b 0.00105*a*c-0.0500*b*c。od600的估计回归系数和回归方程的方差分析结果见表26、27。根据回归分析结果,该模型的决定系数r2=98.10%,说明模型可以解释98.10%实验所得菌密度的变化,表明方程拟合较好。表27中,失拟项f=5.69,表明失拟不显著,回归显著。进一步绘制等值线图,见图3~5。
[0165]
结果中,a为右旋糖酐工业废水、b为酵母浸粉、e为ph值。由表28~30、图6~8可知,32826菌株在采取minitab软件进行box-behnken设计发酵培养基配方运行序号为1-15时候,rsm分析筛选重要因素的最优水平,进行rsm分析采用的重要因素水平见表24;实验结果分别见表28。以cod去除率水平为响应值,根据表28中box-behnken设计的实验结果,进行二次回归分析,回归方程为:
[0166]
od600=490-4.70*a 75*b-134*c 0.0419*a*a 4.1*b*b 14.4*c*c-0.07*a*b 0.115*a*c-18.5*b*c。cod去除率的估计回归系数和回归方程的方差分析结果见表29、30。根据回归分析结果,该模型的决定系数r2=61.63%,说明模型可以解释61.63%实验所得菌密度的变化,表明方程拟合较好。表30中,失拟项f=0.27,表明失拟不显著,回归显著。进一步绘制等值线图,见图6~8。
[0167]
通过优化响应分析得到主要因素(a、b、e)的未编码值(60.0、0.4182、5.50)及右旋糖酐工业废水、酵母浸粉、ph值最佳水平(分别为60.0g/100ml、0.4182g/100ml、5.50),发酵液(稀释倍数为21倍)的od600为0.8859、cod去除率84.44%,见图9。
[0168]
试验例4
[0169]
菌株:32826
[0170]
种子培养基的成分包括一水合葡萄糖25g、蛋白胨2g、酵母浸粉0.6g、磷酸二氢钾1g、七水合硫酸镁0.1g,蒸馏水稀释至1000ml,氢氧化钠调ph值=5.5。分装:100ml/500ml三角瓶,封口膜封口,116℃灭菌30min后冷却至室温。
[0171]
初始发酵培养液配方为:右旋糖酐工业废水400ml、硫酸铵5g、蛋白胨10g、酵母浸
粉5g、磷酸二氢钾2g、七水合硫酸镁0.1g,蒸馏水稀释至1000ml,ph为4.9。
[0172]
优化的发酵培养液的成分包括右旋糖酐工业废水600ml、4.18g、磷酸二氢钾1.0g、七水合硫酸镁0.1g,蒸馏水稀释至1000ml,氢氧化钠调ph值=5.5。分装:100ml/500ml三角瓶,封口膜封口,116℃灭菌30min后冷却至室温。
[0173]
试验方法:将经过驯化的热带假丝酵母32826接种到种子培养基培养,培养条件:接种量20ml、发酵温度30℃、摇床转速220r/min、培养时间48h。然后再将种子培养基培养的菌液分贝接种到初始的发酵培养基和优化的发酵培养基中进行培养,培养条件为:接种量20ml、发酵温度30℃、摇床转速220r/min、培养时间48h;检测cod去除率,离心收集微生物生物质,用水冲洗,干燥,得到单细胞蛋白。结果如表31。
[0174]
由表31可知,优化后的发酵培养液进行发酵培养,生物量、粗蛋白含量、cod去除率分别为:8.18g/l、50.3g/100g、73.1%,已达到优化目标水平;相比初始的发酵培养液,优化后的培养基其所得生物量的水平提高了约9.7%;粗蛋白含量的水平提高了约13.5%;cod去除率的水平提高了约38.7%;提高幅度明显。
[0175]
表31生物量、粗蛋白、cod去除率
[0176]
培养基生物量(g/l)粗蛋白含量(g/100g)cod去除率(%)优化的发酵培养液8.3250.373.1初始的发酵培养液7.5844.352.7
[0177]
前述对本发明的具体示例性实施方案的描述是为了说明和例证的目的。这些描述并非想将本发明限定为所公开的精确形式,并且很显然,根据上述教导,可以进行很多改变和变化。对示例性实施例进行选择和描述的目的在于解释本发明的特定原理及其实际应用,从而使得本领域的技术人员能够实现并利用本发明的各种不同的示例性实施方案以及各种不同的选择和改变。本发明的范围意在由权利要求书及其等同形式所限定。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。