1.本发明属于海洋农业中贝类遗传育种技术领域,具体涉及一种制备异源三倍体扇贝的方法。
背景技术:
2.扇贝养殖是我国海水养殖产业的重要组成部分,2017
–
2020年我国扇贝年产量182.8
–
200.8万吨(中国渔业统计年鉴,2018
–
2021),稳居世界第一。培育生长快、产量高的优良品种一直是贝类育种的中心目标,也是推动贝类产业健康、可持续发展的迫切需求。
3.三倍体贝类往往具生长快、个体大、育性差、品质好、繁殖季节死亡率低等生产优势,因此多倍体育种技术备受重视并成为贝类遗传育种研究的热点。目前,诱导贝类多倍体的方法多以化学诱导剂细胞松弛素b(cb)(stanley等,1980;guo等,1994;李永仁,2006)、6-二甲基氨基嘌呤(6-dmap)(田传远等,1998;董迎辉等,2007)、盐度调节(王昭平等,2009;张晨晨等,2010)、冷热休克(quillet e和panelay p j,1986)等方法抑制二倍体受精卵的极体释放获取三倍体子代。虽然cb、6-dmap诱导效果较好,但诱导剂价格昂贵且毒性较大,从而降低了受精卵的孵化率和幼虫的成活率,而且诱导剂的安全性也有待验证;而盐度调节和冷热休克等物理诱导方法也大都存在孵化率低或倍化率不稳定等缺陷,大规模应用比较困难。因此,贝类产业上急需一种清洁、高效、适于大规模操作的三倍体直接诱导方法。
4.贝类多倍体诱导育种技术发展至今,获取全三倍体贝类往往需要通过诱导二倍体成为四倍体,再与二倍体杂交的间接方法(piferrer等,2009)。而且,传统的诱导方法仍存在着倍化率不高,操作稳定性较差等问题。
5.参考文献:
6.guo x,allen s k jr.viable tetraploids in the pacific oyster,crasostrea gigas(thunberg),produced by inhibiting polar bogy i in eggs from triploids.mol mar biol biotechnol,1994,3:42
–
50.
7.piferrer f,beaumont a,jean-claude falgui
è
re,et al.polyploid fish and shellfish:production,biology and applications to aquaculture for performance improvement and genetic containment.aquaculture,2009,293(3
–
4):125
–
156.
8.quillet e,panelay p j.triploidy induction by thermal shocks in the pacific oyster crasostrea gigas.aquaculture,1986,57:271
–
279.
9.stanley j g,allen s k jr,hidu h.polyploidy induced in the american oyster crasostrea virginica with cytochalasin b.aquaculture,1981,23:1
–
10.
10.董迎辉,杨爱国,刘志鸿,周丽青.6-dmap诱导栉孔扇贝三倍体的细胞学观察.海洋水产研究,2007,28(2):71
–
75.
11.李永仁,栉孔扇贝二倍体以及cb诱导的三倍体组与四倍体组d型幼虫生长的比较.天津农学院学报,2006,13(3):1
–
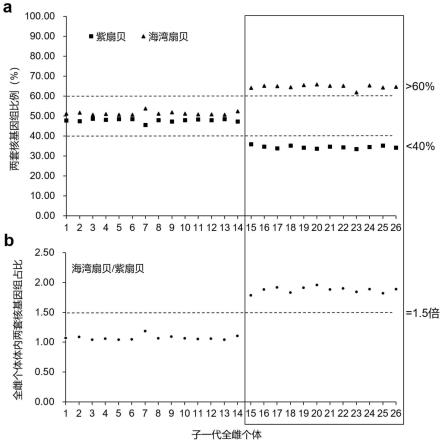
4.
12.田传远,梁英,王如才,等.6-dmap诱导太平洋牡蛎三倍体孵化率和d幼畸形率与三
倍体诱导率的关系.青岛海洋大学学报,1998,28(3):421
–
425.
13.王昭萍,赵婷,于瑞海,等.一种新方法-低渗诱导虾夷扇贝三倍体的研究.中国海洋大学学报:自然科学版,2009,39(2):193
–
196.
14.张晨晨,王昭萍,于瑞海,等.低渗诱导栉孔扇贝三倍体及与其他方法的比较.
15.中国海洋大学学报:自然科学版,2010,40(增刊):71
–
75.
16.中国渔业统计年鉴.中国农业出版社,2018.
17.中国渔业统计年鉴.中国农业出版社,2019.
18.中国渔业统计年鉴.中国农业出版社,2020.
19.中国渔业统计年鉴.中国农业出版社,2021.
技术实现要素:
20.本发明的目的是提供一种制备异源三倍体扇贝的方法,能够解决现阶段三倍体贝类制备过程中存在的化学诱导剂价格昂贵、毒性较大,物理诱导方法操作繁琐、三倍体贝类孵化率低和倍化率不稳定等缺陷。
21.本发明所提供的制备异源三倍体扇贝的方法,是筛选海湾扇贝(
♀
)与紫扇贝杂交子代中的全雌个体,将全雌个体的卵子与海湾扇贝的精子受精,培育受精卵获得异源三倍体扇贝;
22.所述的筛选,是筛选基因组中海湾扇贝来源的核基因组与紫扇贝来源的核基因组比例高于1.5的全雌个体;
23.更进一步的,所述的全雌个体的卵子,是通过积温促熟方法促进卵子成熟,所述的积温促熟方法,是将筛选的全雌个体于8℃恒温培育至性腺开始膨大,然后每天升温0.5℃,促熟水温升至21℃性腺接近成熟时恒温5
–
8天,逐渐增加饵料投喂直到亲贝性腺饱满;
24.作为实施例的具体记载,所述的将全雌个体的卵子与海湾扇贝的精子进行受精,其中海水温度为24℃;
25.所述的培育受精卵,其一种条件是,海水温度控制在24
±
1℃,盐度控制在25
–
35ppt,大约24h后即可获得的异源三倍体扇贝d形幼虫。
26.本发明不同传统扇贝三倍体诱导方法,存在着以下创新点:
27.1)方法不同:传统方法多采用cb、6-dmap等化学诱导剂,低渗、冷热温度休克和静水压等物理方法处理受精卵抑制极体的排放,间接获得三倍体子代;而本发明筛选海湾扇贝(
♀
)
×
紫扇贝子代全雌个体(二倍体)产卵,并与海湾扇贝(二倍体)的精子自然受精,
28.2)环境安全性和操作可行性不同:传统的化学诱导剂价格昂贵且毒性较大,诱导剂的环境安全性也有待验证;盐度调节和冷热休克等物理诱导方法操作繁琐,大规模应用比较困难。而本发明的方法清洁、高效、操作简单,适于产业规模化制种。
29.3)三倍体诱导率不同:传统方法诱导三倍体率为40
–
90%,且经常出现非整倍体;而本发明三倍体率稳定在100%,且无二倍体、四倍体及非整倍体出现。
30.4)三倍体子代的染色体组成不同:传统方法获得的三倍体为同一物种的同源三倍体。而本发明获得的三倍体为含有海湾扇贝染色体组和紫扇贝染色体组的异源三倍体。
31.5)在传统回交育种的基础上,优化海湾扇贝(
♀
)
×
紫扇贝杂交子代积温促熟温度条件,同时根据杂交子代中全雌个体体内海湾扇贝来源与紫扇贝来源的核基因组的比例(海湾扇贝/紫扇贝》1.5倍)筛选雌性亲本。
32.本发明通过挑选海湾扇贝(
♀
)
×
紫扇贝子代全雌个体(二倍体)产卵,并与海湾扇贝(二倍体)的精子自然受精等技术环节,创造了一种制备异源三倍体扇贝的育种新方法。本发明利用海湾扇贝(
♀
)
×
紫扇贝子代中的全雌个体可以形成二倍体卵子的特性,不同于目前主流使用的通过化学试剂(细胞松弛素b、6-二甲基氨基嘌呤等)、盐度调节、冷热休克等方法抑制二倍体受精卵极体的释放,以及四倍体和二倍体亲贝杂交获取三倍体子代的方法,开辟了一项全新的异源三倍体扇贝育种技术。本发明方法为今后采用清洁、高效、大规模操生产100%扇贝三倍体提供了可行性,也为我国扇贝产业的可持续健康发展、良种产业化提供了一定的技术支撑。
附图说明
33.图1:海湾扇贝(
♀
)
×
紫扇贝子代全雌个体(二倍体)体内两套核基因组的比例(a)和占比图(b);黑色矩形框内(个体15
–
26)为筛选用于制备三倍体子代的全雌亲本;
34.图2:普通二倍体海湾扇贝(a)和异源三倍体扇贝(b)d形幼虫流式细胞仪检测结果图;
35.图3:海湾扇贝(a)、海湾扇贝(
♀
)
×
紫扇贝子代全雌个体(b)和回交三倍体扇贝成体(c-l)流式细胞仪检测结果图;
36.图4:本方法和传统回交方法获得子代的三倍体检出率柱状图。
具体实施方式
37.海湾扇贝和紫扇贝均为雌雄同体,性腺仅局限于腹部,雄区(精巢)位于腹部外周缘,成熟时为乳白色;雌区(卵巢)位于雄区内侧,成熟时呈现粉红色/橘红色;性腺部位表面通常具有一层黑膜,在性腺逐渐成熟过程中,黑膜逐渐褪去,雄区和雌区即可区分明显。而海湾扇贝(
♀
)
×
紫扇贝子代大部分个体为滞育类型(性腺呈现透明或者不发育),但存在小部分全雌个体(整个性腺均呈现粉红色/橘红色)。
38.其中海湾扇贝(
♀
)
×
紫扇贝子代全雌个体(二倍体)的鉴定方法如下:
39.在海湾扇贝(
♀
)
×
紫扇贝子代中挑选性腺均为雌区的雌性个体,在活体状态下取少量组织样品,通过流式细胞仪确定其倍性,具体操作如下:用灭菌处理的镊子夹取其2~3根鳃丝,在1ml 1
×
pbs中用灭菌处理的手术剪将其充分剪碎,然后用孔径50μm的细胞筛过滤,过滤后的细胞液中加入冰乙醇(-20℃)对细胞进行固定;对固定后的细胞进行离心(300g,5分钟),离心获得的细胞在1ml 1
×
pbs中进行重悬,再经过rnase(50μg/ml,20μl)处理和pi(1mg/ml,50μl)避光染色30分钟。上述操作处理的细胞便可通过流式细胞仪进行倍性测定(以普通二倍体海湾扇贝为对照组)。
40.为了提高三倍体子代的得率,对海湾扇贝(
♀
)
×
紫扇贝子代全雌亲本个体
(二倍体)进行筛选,选择其基因组中海湾扇贝来源的核基因组与紫扇贝来源的核基因组比例高于1.5的全雌个体,具体方法如下:
41.通过非致死性方法提取已通过流式细胞仪倍性鉴定的子代雌性亲本的dna,构建重测序文库并通过illunima hiseq测序平台进行高通量测序;获得测序数据以后,对每一枚待筛选的杂交子代全雌个体基因组中海湾扇贝和紫扇贝来源的核基因组reads比例进行统计,筛选出海湾扇贝(reads比例》60%)和紫扇贝(reads比例《40%)两套核基因组的reads比例高于1.5倍的杂交子代全雌个体作为后续回交的母本。
42.作为优选,采用人工积温促熟方法来促进筛选的杂交子代全雌个体性腺发育。
43.对筛选的全雌个体和普通海湾扇贝进行性腺发育促熟后刺激其产卵/排精,其一种方法是采用阴干变温刺激的方法来刺激亲贝产卵/排精:催产前将亲贝阴干30~40分钟,然后置于升温3~6℃的海水中。亲贝经阴干刺激后复入24℃海水中,在最初的20~30分钟内,活动频繁,以排精为主;而后相继排卵,15~20分钟内可产卵4~5次,即将雌区内成熟的卵子排放殆尽。可用500目(孔径20微米)筛绢滤除卵子/受精卵,获得亲贝的精子。
44.杂交子代亲贝在8℃恒温培育15天至性腺开始膨大,然后每天升温0.5℃,促熟水温升至21℃性腺接近成熟时恒温5
–
8天,逐渐增加饵料投喂直到亲贝性腺饱满,有效积温达到290.5
–
333.7℃
·
d;
45.再从排精池中过滤得到的精子加入到盛有24℃海水的产卵池中,控制每个卵子周围3
–
5个精子,卵子密度控制在50-80个/ml;受精后,受精卵在24℃的海水中孵化获得的异源三倍体扇贝d形幼虫。
46.对获得的三倍体扇贝子代采用流式细胞仪进行倍性检测。
47.在本发明方法中,对于刺激海湾扇贝产卵、排精、受精和早期孵化的海水温度为24
±
1℃;d型和壳顶幼虫的培育方法可以采用常规的方法,而不仅限于实施例的具体记载。
48.本发明的方法不使用cb、6-dmap等化学诱导剂,以及低渗、冷热温度休克和静水压等物理方法处理受精卵。
49.下面结合实施例和附图对本发明进行描述。
50.实施例1
51.1)获取经过鉴定和筛选的海湾扇贝(
♀
)
×
紫扇贝子代中全雌个体(二倍体)的卵子
52.于2021年3月上旬,在山东省烟台海益苗业有限公司积温促熟的海湾扇贝(
♀
)
×
紫扇贝子代群体中,挑选性腺类型为全雌、性腺形态规则且发育饱满、颜色为粉红色/橘红色的全雌个体52枚;经流式细胞仪鉴定上述52枚海紫杂交子代个体均为二倍体;然后通过非致死性方法,即用灭菌处理的镊子夹取随机选取的26枚个体的2~3根鳃丝并提取其基因组dna,构建26个重测序文库并通过illunima hiseq测序平台进行高通量测序;获得测序数据以后,对每一枚待筛选的杂交子代全雌个体基因组中海湾扇贝和紫扇贝来源的核基因组reads比例进行统计,结果显示:筛选组中有12枚全雌个体的海湾扇贝(reads比例64.08~65.81%)和紫扇贝(reads比例33.57~35.80%)两套核基因组reads比例为1.79~1.96(》1.5倍),显著高于其他14枚全雌个体基因组中海湾扇贝和紫扇贝来源的核基因组reads比例为1.04~1.18(《1.5倍)。
53.将筛选的12枚杂交子代全雌个体作为后续回交的母本(图1)。利用阴干(30分钟)升温(升温3
–
6℃)刺激的方法,使上述雌性个体在24℃海水(产卵池,1m3)中正常产卵。卵子卵质饱满、形态为圆形,镜检确认其未受精。
54.2)获取海湾扇贝(二倍体)的精子
55.挑选与雌性亲本同步积温促熟的海湾扇贝(二倍体)50枚,其性腺类型为雌雄同体,性腺形态规则且发育饱满,雌区颜色为粉红色/橘红色,雄区颜色为乳白色;利用与步骤1)中相同的阴干升温刺激的方法,使上述海湾扇贝个体在24℃海水(排精池)中正常产卵和排精。使用500目筛绢滤除上述海湾扇贝的卵子/受精卵,获取其精子;再次镜检,保证≥90%精子活动且无海湾扇贝的卵子污染。
56.3)受精:
57.将从排精池中过滤得到的精子加入到产卵池中,控制每个卵子周围3-5个精子,卵子密度为53
±
3个/ml;受精后,受精卵在正常的海水中孵化,在此期间,海水温度为24.2℃,盐度为27.2ppt,24h后即可获得的异源三倍体扇贝的d形幼虫。
58.4)子代培育:异源三倍体扇贝受精卵可以正常孵化,孵化率为17.84%,按照海湾扇贝的常规培育方法即可获得全三倍体扇贝子代。
59.检测子代倍性:2021年3月,对于3)步骤中获得三倍体扇贝子代d形幼虫(n》1000),通过流式细胞仪进行倍性检测,发现所有检测个体为三倍体(图2)。
60.从图2可以看出,相较于普通二倍体海湾扇贝d形幼虫,采用本发明方法获得的异源三倍体扇贝的d形幼虫为三倍体,无二倍体及非整倍体产生。
61.实施例2
62.1)获取海湾扇贝(
♀
)
×
紫扇贝子代中的全雌个体(二倍体)的卵子:
63.于2021年3月下旬,在山东省烟台莱州乐平水产积温促熟的在海湾扇贝(
♀
)
×
紫扇贝子代群体中,挑选性腺类型为全雌、性腺形态规则且发育饱满、颜色为粉红色/橘红色的个体作为雌性个体61枚;经流式细胞仪鉴定上述61枚海紫杂交子代个体均为二倍体,将其随机分为两组:筛选组(n=31)和未筛选组(n=30);然后通过非致死性方法,即用灭菌处理的镊子夹取筛选组31枚个体活体状态下的2~3根鳃丝并提取其基因组dna,构建31个重测序文库并通过illunima hiseq测序平台进行高通量测序;获得测序数据以后,对每一枚待筛选的杂交子代全雌个体基因组中海湾扇贝和紫扇贝来源的核基因组reads比例进行统计,结果显示:筛选组中有15枚全雌个体的海湾扇贝(reads比例64.12~65.91%)和紫扇贝(reads比例33.52~35.73%)两套核基因组reads比例为1.79~1.97(》1.5倍),显著高于其他16枚全雌个体基因组中海湾扇贝和紫扇贝来源的核基因组reads比例为1.02~1.16(《1.5倍),即筛选上述15枚杂交子代全雌个体作为后续回交的母本。未筛选组的30枚全雌个体作为对照,也同时进行回交实验。利用阴干(30分钟)升温(升温3
–
6℃)刺激的方法,使上述雌性个体在24℃海水(产卵池,1m3)中正常产卵。卵子卵质饱满、形态为圆形,镜检确认其未受精。
64.2)获取海湾扇贝(二倍体)的精子:
65.挑选与雌性亲本同步积温促熟的海湾扇贝(二倍体)38枚,其性腺类型为雌雄同体,性腺形态规则且发育饱满,雌区颜色为粉红色/橘红色,雄区颜色为乳白色;利用与步骤
1)中相同的阴干升温刺激的方法,使上述海湾扇贝个体在24℃海水(排精池)中正常产卵和排精。使用500目筛绢滤除上述海湾扇贝的卵子,获取其精子;再次镜检,保证≥90%精子活动且无海湾扇贝的卵子污染。
66.3)受精:
67.将排精池中过滤得到的精子加入到产卵池中,控制每个卵子周围3
–
5个精子,卵子密度为在65
±
4个/ml;受精后,受精卵在正常的海水中孵化,在此期间,海水温度为24.5℃,盐度为27.3ppt,24h后即可获得异源三倍体扇贝的d形幼虫。
68.4)子代培育:异源三倍体扇贝受精卵可以正常孵化,孵化率为15.67%,按照海湾扇贝的常规培育方法即可获得全三倍体扇贝子代。
69.检测子代倍性:2021年8月,对于3)步骤中获得三倍体扇贝子代,随机采样10枚个体通过流式细胞仪对其进行倍性检测,发现所有检测个体为三倍体,无二倍体及非整倍体产生(图3)。
70.从图3可以看出,相较于海湾扇贝(
♀
)
×
紫扇贝子代全雌个体(二倍体)和普通二倍体海湾扇贝(二倍体),采用本发明方法获得的扇贝成体均为三倍体(三倍体率100%),无二倍体及非整倍体产生。相比而言,未经过本方法筛选的杂交子代中全雌个体的卵子,与海湾扇贝精子受精以后,回交子代成体的三倍体检出率仅为12.38
±
3.97%,极显著(p《0.01)本方法中的100%(图4)。
71.综上,本发明提供了一种制备异源三倍体扇贝的新方法,具有可实施、可重复、可应用等优点。为今后采用清洁、高效、适于大规模操作的回交技术生产100%扇贝三倍体提供了可行性,也为我国扇贝产业的可持续健康发展、良种产业化提供了一定的技术支撑。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。