含胶原蛋白与透明质酸的细胞组织胶体
1.本发明是申请号为201510454326.6、申请日为2015年07月29日、发明名称为“含胶原蛋白与透明质酸的细胞组织胶体”的分案申请。
技术领域
2.本发明是关于一种含胶原蛋白与透明质酸的细胞组织胶体。
背景技术:
3.在治疗退化性疾病中,干细胞疗法被视为是一种相当有希望的方法。然而,将干细胞保留在病患体内的植入位置(implantation site)并且维持其存活度以实现组织修复仍具有一定的挑战性。因此,研发一种介质(例如细胞组织胶体)使干细胞伴随着高存活度地移植于特定位置为目前相关产学界亟需达到的重要目标之一。
4.伤口愈合是一种对组织损伤的自然修复反应。愈合是由细胞一连串复杂的交互作用而产生,使受伤皮肤的抗拉强度能重铺(resurfacing)、重建(reconstitution)和修复(restoration)。与非糖尿病患者相比,糖尿病患者的伤口需要更长的时间进行愈合。
技术实现要素:
5.本发明提供一种含胶原蛋白与透明质酸的细胞组织胶体,其中以整体重量为基础,该胶原蛋白与该透明质酸的比例介于0.01:1-100:1之间,例如0.05-100:1、1-50:1、100:1、75:1、50:1、30:1、25:1、15:1、10:1、5:1、1:1、0.5:1、0.2:1或0.1:1。该透明质酸的浓度可为0.001-100mg/ml(例如:0.01至lmg/ml、0.5至100mg/ml、0.5mg/ml、1mg/ml、1.5mg/ml、3mg/ml、5mg/ml、10mg/ml、15mg/ml、20mg/ml、25mg/ml、30mg/ml、50mg/ml、75mg/ml或100mg/ml),而该胶原蛋白的浓度可为0.001mg/ml至100mg/ml(例如,1-100mg/ml、10-100mg/ml、100mg/ml、75mg/ml、50mg/ml、30mg/ml、25mg/ml、15mg/ml、10mg/ml或5mg/ml)。举例来说,胶原蛋白的浓度介于0.1-100mg/ml,而透明质酸的浓度为0.01-35mg/ml。在一实施例中,胶原蛋白的浓度介于3-40mg/ml(例如6mg/ml或9mg/ml),而透明质酸的浓度为0.2-20mg/ml。在另一实施例中,透明质酸的浓度为0.5-100mg/ml,而胶原蛋白的浓度为5-50mg/ml。
6.本发明的细胞组织胶体可进一步包含可供细胞生长的营养素(例如:细胞培养基或维他命)、生物活性剂、一个或多个基质要素以及/或干细胞。该生物活性剂可为生长因子,例如上皮生长因子(epidermal growth factor)、纤维母细胞生长因子(fibroblast growth factor,fgf)、血管内皮生长因子(vascular endothelial growth factor,vegf)、结缔组织生长因子(connective tissue growth factor)、血小板衍生性生长因子(platelet-derived growth factor,f1dgf)、类胰岛素生长因子(insulin-like growth factor)、神经生长因子(nerve growth factor)、肝细胞生长因子(hepatocyte growth factor,hgf)、细胞聚落刺激因子(colony-stimulating factor)、干细胞因子(stem call factor)、角质细胞生长因子(keratinocyte growth factor)、颗粒球细胞聚落刺激因子
(granulocyte colony-stimulating factor)、颗粒球巨噬细胞聚落刺激因子(granulocyte macrophage colony-stimulating factor)、胶质衍生神经营养因子(glial-derived neurotropic factor)、睫状神经营养因子(ciliary neurotrophic factor)、内皮单核细胞活化多肽(endothelial-monocyte activating polypeptide)、上皮中性粒细胞活化肽(epithelial neutrophil activating peptide)、红血球生成素(erythropoietin)、骨形成蛋白(bone morphogenetic protein)、大脑衍生神经营养因子(brain-derived neurotrophic factor)、brak、转化生长因子-β(transforming growth factor beta)或肿瘤坏死因子(tumor necrosis factor)中的一种或多种。所述基质要素包括,但不限于:明胶(gelatin)、纤维连接蛋白(fibronectin)、弹性蛋白(elastin)、细胞黏合素(tenacin)、层黏蛋白(laminin)、玻璃连接蛋白(vitronectin)、多肽(polypeptides)、硫酸肝素(heparan sulfate)、软骨素(chondroitin)、硫酸软骨素(chondroitin sulfate)、角质素(keratan)、硫酸角质素(keratan sulfate)、硫酸皮肤素(dermatan sulfate)、鹿角菜胶(carrageenan)、肝素(heparin)、几丁质(chitin)、几丁聚糖(chitosan)、褐藻胶(alginate)、琼脂糖(agarose)、琼脂(agar)、纤维素(cellulose)、甲基纤维素(methyl cellulose)、羧基甲基纤维素(carboxyl methyl cellulose)或肝糖(glycogen)中的一种或多种。当所述细胞组织胶体含有明胶时,明胶的浓度可介于0.0l-100mg/ml之间(例如lmg/ml)。较佳的,于所述含有明胶的细胞组织胶体中,胶原蛋白以及透明质酸的浓度分别介于6-40mg/ml之间以及0.2-20mg/ml之间。
7.本发明亦提供一种输送细胞(例如干细胞)至一受体的方法,包含(i)提供一含有上述细胞组织胶体的细胞植入体,使细胞生长于所述细胞组织胶体中;以及(ii)将所述细胞植入体置于受体内的某一位置。此外,使用所述细胞组织胶体制备一种用于细胞输送的细胞植入体的方法也属于本发明的范畴。
8.本发明的细胞组织胶体可用于一个体的伤口中,以治疗或促进伤口愈合。
9.下文特举一些实施例作本发明的详细说明。本发明的其他目的或特征将呈现于下述实施例及申请专利范围中。
附图说明
10.图1a至图1c显示不同配比的细胞组织胶体对细胞增生的影响。图1a为各种细胞组织胶体对于活化的hl-60细胞的增生效果。图1b为各种细胞组织胶体对于raw264.7细胞的增生效果。图1c为各种细胞组织胶体对于nih3t3细胞的增生效果。
11.图2a至图2b显示不同配比的细胞组织胶体对发炎细胞的影响。图2a为各种细胞组织胶体对于活化的hl-60细胞的影响。图2b为各种细胞组织胶体对于u937细胞的影响。
12.图3a至图3b显示不同分子量的透明质酸对细胞趋化作用的影响。图3a为各透明质酸对于活化的hl-60细胞的趋化作用结果。图3b为各透明质酸对于raw264.7细胞的趋化作用结果。
13.图4显示不同浓度及不同分子量的透明质酸(ha)对tgf-β1、tgf-β2与tgf-β3表现的影响。
14.图5a至图5b显示各种细胞组织胶体对伤口愈合的影响。图5a为不同的处理天数下,伤口愈合的状况。图5b为不同的处理天数下,伤口大小的改变。
15.图6a至图6b显示在伤口植入各细胞组织胶体后1个月(图6a)及2个月(图6b)的组织切片。
16.图7a至图7b显示各细胞组织胶体对糖尿病患者伤口愈合的影响。图7a为不同的处理天数下,伤口愈合的状况。图7b为不同的处理天数下,伤口大小的改变。
17.图8显示猪伤口的矩阵模式,图片a为2个月大的兰屿猪侧面伤口示意图;图片b为猪伤口矩阵放大图。
18.图9显示在各细胞组织胶体处理下,猪伤口的愈合情况。
19.图10a至图10b显示猪的伤口在细胞组织胶体处理后2个月(图10a)及6个月(图10b)的结果。
20.图11显示在不同处理下,猪伤口愈合情况。
21.图12a至图12b显示胶原蛋白(图12a)与透明质酸(图12b)对干细胞增生的影响。
具体实施方式
22.本发明是关于一种含有胶原蛋白与透明质酸的细胞组织胶体,所述胶原蛋白与所述透明质酸的重量比为0.01:1-100:1(例如:0.05-100:1、1-50:1、100:1、75:1、50:1、30:1、25:1、15:1、10:1、5:1、1:1、0.5:1、0.2:1或0.1:1),且所述细胞组织胶体可选择性地包括一个或多个其他成分,例如基质要素、生物活性剂以及可供细胞生长的营养素。
23.胶原蛋白
24.任何自然产生的胶原蛋白或具有其功能性的胶原蛋白变异体均可被用来制备本发明的细胞组织胶体。目前已经发现至少有28种带有不同遗传讯息的胶原蛋白。胶原蛋白可以从富含胶原蛋白的组织(例如皮肤、肌腱、韧带及人类或动物的骨头)中单独分离或纯化出来。分离及纯化胶原蛋白的方法为本领域技术人员皆知的方法,亦可参见所附的文献:美国第5,512,291号专利、美国第2004/0138695号专利、methods in enzymology,vol.82,pp.33-64,1982、the preparation of highly purified insoluble collagen,oneson,i.,et al.,am.leather chemists assoc.,vol.lxv,pp.440-450,1970以及美国第6,090,996号专利。胶原蛋白也可通过重组技术,如advanced tissue sciences(la jolla,calif.)所述的重组技术制备而成,或市售购得,例如fibergen或south san francisco,calif.。
25.以下利用实例进行说明。将小牛的深屈肌腱移除脂肪与筋膜(fascia)后,用水清洗并冷冻,之后切成数个厚度均为0.5毫米的肌腱薄片。取适量的肌腱薄片置入50毫升的水中,于室温下进行第一次萃取,所需时间为24小时。将水溶性部份去除后,将肌腱薄片置入酸性溶液(例如0.2n盐酸溶液)中,于适当温度下(例如室温下)进行一段时间(例如12-24小时)的萃取,随后将酸性溶液去除,并以水冲洗肌腱薄片以去除残留的酸。经冲洗后的肌腱薄片再置入碱性溶液中(例如0.75m氢氧化钠溶液)于适当温度下(例如室温下)进行一段时间(例如12-24小时)的萃取,然后将碱性溶液去除后,再以水清洗肌腱薄片直至残留的碱完全去除。之后,此肌腱薄片以酸性溶液(例如0.1n盐酸溶液)调整其ph值为4至7(例如ph值为5)。随后将肌腱薄片以醇类溶剂(例如异丙醇)于室温下进行脱脂一段时间(例如16小时),轻轻将萃取剂倒出,然后再以醇类溶剂(例如异丙醇)于适当温度下(例如室温下)进一步进行萃取一段时间(例如12-24小时),以形成一含胶原蛋白的溶液,该含胶原蛋白的溶液置于
干净的无菌操作台中风干而形成胶原蛋白粉末。该胶原蛋白粉末可分散于酸性溶液(例如0.5m或0.25m醋酸水溶液)中形成混合物,且存在一蛋白质水解酶(例如胰蛋白酶或胃蛋白酶),并于4℃下培养一段时间。所述混合物经由100目的不锈钢筛网过滤后,于5%氯化钠溶液中沉淀;胶原蛋白沉淀物可再度溶解于前述的酸性溶液中而形成胶原蛋白溶液,并且经由100目的不锈钢筛网过滤以去除其中的不溶物,而后将该胶原蛋白溶液于蒸馏水中进行透析以去除其中的酸类。
26.透明质酸
27.本发明所述“透明质酸(hyaluronan)”是指存在于自然界中、具有阴离子且未经硫酸化的葡萄糖胺聚糖(glycosaminoglycan),其包含n-乙酰葡萄糖胺(n-acetylglucosamine)、d-葡萄糖醛酸(d-glucuronic acid)及其衍生物的双糖分子重复单元。自然存在的透明质酸(也可称之为玻尿酸)可以利用现有的技术从天然的物质中分离出来,例如链球菌的荚膜、鸡冠、软骨、关节液、脐带、皮肤组织以及眼睛的玻璃体,可参考如guillermo lago et al.carbohydrate polymers 62(4):321-326,2005以及ichika amagai et al.fisheries science 75(3):805-810,2009等文献。除此之外,透明质酸亦可为市售产品,例如genzyme corporation、lifecore biomedical llc以及hyaluron contract manufacturing。
28.天然透明质酸的衍生物包括,但不限于:透明质酸酯(hyaluronan esters)、经己二酸二酰肼修饰的透明质酸(adipic dihydrazide-modified hyaluronan)、透明质酸胺产物(hyaluronan amide products)、交联透明质酸(cross-linked hyaluronic acid)、琥珀酸半酯(hemiesters of succinic acid)或其重金属盐类的透明质酸、部分或整体的透明质酸酯、硫化透明质酸(sulphated hyaluronic acid)、n-硫化透明质酸(n-sulphated hyaluronic acid)、以及经胺基或二胺基修饰的透明质酸。上述物质可通过对一个或多个以上的官能基(例如:羧基、氢氧基、还原端基团、n-乙酰基)进行化学修饰而获得。其中,对羧基进行修饰的方式可通过酯化反应或经过碳二亚胺(carbodiimide)及双酰肼(bishydrazide)等中间物的反应达成;氢氧基的修饰包括,但不限于:硫酸化反应、酯化反应、异脲偶合(isourea coupling)反应、溴化氰活化(cyanogen bromide)反应、过碘酸盐氧化(periodate oxidation)反应;对还原端基团进行修饰可通过还原胺化反应(reductive amination)达成,亦可连结磷脂(phospholipid)、染料(例如:荧光基团或发色基团)或一适用于制备亲和性基质的试剂。天然透明质酸的衍生物可通过使用交联剂进行交联反应,或者可通过内酯化(internal esterification)、光交联反应(photo cross-linking)或表面电浆处理(surface plasma treatment)。所述交联剂例如:双环氧化物(bisepoxide)、二乙烯基砜(divinyl sulfone)、碳二亚胺(biscarbodiimide)、小型同质双功能链接剂(small homobifunctional linker)、甲醒、环己基异氰化物(cyclohexyl isocyanide)以及赖氨酸醚酯、金属阳离子、酰肼交联反应或其混合物。
29.用于细胞生长的营养素
30.所述“营养素(nutrient)”是指细胞生长的必要营养来源,其可以是氨基酸、维生素、矿物质、碳源(如葡萄糖)、脂肪酸或其混合物。于实例中,本发明的细胞组织胶体中所使用的营养素为细胞培养基,该细胞培养基例如:mem培养基(minimum essential medium)、bme培养基(basal medium eagle)、dmem培养基(dulbecco’s modified eagle’s medium),
ham’s f-10培养基(ham’s nutrient mixtures f-10)、ham’s f-12培养基(ham’s nutrient mixtures f-12)、m199培养基(medium 199)、rpmi培养基、ames培养基、bgjb培养基(修改fitton-jackson)、click培养基、cmrl-1066培养基、fischer培养基、gmem培养基(glascow minimum essential medium)、imdm培养基(iscove’s modified dulbecco’s medium)、l-15培养基、mccoy’s 5a培养基(mccoy’s 5a modified medium)、nctc培养基、swim’s s-77培养基、waymouth培养基或william’s medium e培养基。
31.生物活性剂
32.任何增进细胞存活力、促进细胞增生或诱导细胞分化的试剂(例如:肽(peptide)、多肽、寡糖、多糖或小分子)均可用于制备本发明的细胞组织胶体。于实例中,生物活性剂为生长因子,如上皮生长因子(epidermal growth factor)、纤维母细胞生长因子(fibroblast growth factor)、血管内皮生长因子(vascular endothelial growth factor)、结缔组织生长因子(connective tissue growth factor)、血小板衍生性生长因子(platelet-derived growth factor)、类胰岛素生长因子(insulin-like growth factor)、神经生长因子(nerve growth factor)、肝细胞生长因子(hepatocyte growth factor)、细胞菌落刺激因子(colony-stimulating factors)、干细胞因子(stem cell factor)、血清素(serotonin)、温韦伯式因子(von willebrand factor)、转化生长因子(transforming growth factor)、角质细胞生长因子(keratinocyte growth factor)、颗粒球细胞菌落刺激因子(granulocyte colony-stimulating factor)、颗粒球/巨噬细胞菌落刺激因子(granulocyte/macrophage colony-stimulating factor)、胶质衍生神经营养因子(glial derived neurotrophic factor)、睫状神经营养因子(ciliary neurotrophic factor)、内皮单核细胞活化多肽(endothelial monocyte activating polypeptide)、上皮中性粒细胞活化肽(epithelial neutrophil activating peptide)、红血球生成素(erythropoietin)、骨形成蛋白(bone morphogenetic proteins)、大脑衍生神经营养因子(brain-derived neurotrophic factor)。在另一实例中,该生物活性剂可为细胞激素(cytokine)或趋化激素(chemokine),其包含但不限于:介白素-2(il-2)、胸表达趋化素(breast-expressed chemokine,如brak)、肾表达趋化素(kidney-expressed chemokine,如cxcl14)。该生物活性剂亦可为细胞分化因子,如甲氟烯素(dexamethasone)、丙酮酸钠(sodium pyruvate)、抗坏血酸-2-磷酸(ascorbic acid-2-phosphate)、维生素a酸(retinoic acid)、脯氨酸(proline)、胰岛素(insulin)、运铁蛋白(transferrin)、亚硒酸(selenous acid)、亚麻油酸(linoleic acid)、小牛血清蛋白(bovine serum albumin)或转化生长因子-β3(tgf-β3)中的一种或多种。于较佳的实施例中,细胞分化因子为化合物。其中,可参见美国第5,908,784号专利,该化合物可促进间叶干细胞(mesenchymal stem cell)的软骨生成作用(chondrogenesis);而所述化合物若为甲氟烯索(dexamethasone)、维生素c(ascorbic acid)及β-甘油磷酸酯(β-glycerol phosphate)时,则可促进骨生成作用(osteogenesis);所述化合物若为胰岛素、异丁基-甲基黄嘌呤(isobutyl-methyl xanthine)、甲氟烯索(dexamethasone)或吲哚美洒辛(indomethacin)时,则可促进脂肪生成作用(adipogenesis);所述化合物为活化素a(activin-a)、骨形成蛋白-4(bmp-4)时,则可促进心肌分化作用(cardiomyogenic differentiation);所述化合物为内皮细胞基础培养基(ebm-2)、甲氟烯素(dexamethasone)、血管内皮生长因子(vegf)时,则可促进内皮细胞
分化作用(endothelial cell differentiation);所述化合物为血小板衍生性生长因子-bb(pdgf-bb)时,则可促进平滑肌细胞分化作用(smooth muscle cell differentiation);所述化合物为碱性纤维母细胞生长因子(bfgf)、上皮细胞生长因子(epithelial growth factor,egf)、b27营养补给物、二甲基亚砜(dmso)、丁基羟基甲氧苯(butylated hydroxyanisole)、氟斯柯林(forskolin)、丙戊酸(valproic acid)、氯化钾、k252a蛋白、n2营养补给物(n2supplement),则可促进神经诱导机制(neural induction);所述化合物为甲氟烯素(dexamethasone)、肝细胞生长因子(hgf)、纤维母细胞生长因子-4(fgf-4)时,则可促进内胚层品系分化作用(endodermal lineage differentiation)。所述生物活性剂亦可是一种中草药或是中草药内部的活性成分。
33.基质要素
34.基质要素为一种辅助细胞维持在植入位置的化合物,其可以是一种于细胞外基质中发现的胞外因子(extracellular factor)。该基质要素例如,但不限于:明胶(gelatin)、纤维连接蛋白(fibronectin)、弹性蛋白(elastin)、细胞黏合素(tenacin)、层黏蛋白(laminin)、玻璃连接蛋白(vitronectin)、多肽(polypeptide)、硫酸肝素(heparan sulfate)、软骨素(chondroitin)、硫酸软骨素(chondroitin sulfate)、角质素(keratan)、硫酸角质素(keratan sulfate)、硫酸皮肤素(dermatan sulfate)、鹿角菜胶(carrageenan)、肝素(heparin)、几丁质(chitin)、几丁聚糖(chitosan)、褐藻胶(alginate)、琼脂糖(agarose)、琼脂(agar)、纤维素(cellulose)、甲基纤维素(methyl cellulose)、羧甲基纤维素(carboxyl methyl cellulose)、肝糖(glycogen)及其衍生物。此外,该基质要素可以是纤维蛋白(fibrin)、纤维蛋白原(fibrinogen)、凝血酶(thrombin)、多聚谷氨酸(polyglutamic acid)、合成聚合物(如丙烯酸酯、聚乳酸、聚乙醇酸或聚乳酸-乙醇酸)或交联剂(如京尼平(genipin)、戊二醛、甲醛、环氧化合物)。较佳地,本发明细胞组织胶体中,基质要素具有较高的分子量,使胶体的黏度增加。
35.赋形剂
36.本发明的细胞组织胶体可包括一个或多个药学上可接受的赋形剂,以提供润滑和保湿。本发明的赋形剂也可作为乳液,可结合并平顺上皮层,有助于浅层的伤口愈合愈合。
37.卵磷脂、凡士林及甘油为示例性的赋形剂,皆可被包含在本发明的细胞组织胶体中。其它习知的赋形剂亦可添加于本发明的细胞组织胶体中。
38.内嵌细胞的组织胶体的制备
39.本发明所述组织胶体可通过将前述各成分以一理想的重量比例混合,并将该混合物置于适当的环境中以形成胶体。为了制备内部嵌埋有细胞的胶体,可先将细胞与上述成分混合,再进一步形成胶体,其中细胞可为哺乳类动物(例如:牛、猪、老鼠、马、狗、猫、绵羊、猴子及人类)体内获得的细胞。该细胞包括,但不限于:胎盘干细胞(placenta-derived stem cells)、骨髓干细胞(bone marrow-derived stem cells)、基质细胞(stromal cells,如脂肪衍生基质细胞(adipose-derived stromal cells))、间叶干细胞、组织先驱细胞(tissue progenitor cells)、胚细胞(blast cells)或纤维母细胞(fibroblasts)。
40.藉此,该细胞组织胶体则可制备完成且其内部嵌埋有细胞,所述细胞组织胶体可植入在理想的位置以实现组织修复及其他医疗上的用途。
41.伤口愈合
42.本发明的细胞组织胶体,无论是否有内嵌细胞,皆可用于治疗或促进伤口愈合(例如:皮肤伤口)。细胞组织胶体可应用于伤口,例如部分地、基本地或完全地覆盖伤口。特别是,细胞组织胶体可用于治疗糖尿病患者的伤口。所述伤口可为浅伤口(shallow wound)、局部伤口(partial wound)或全层伤口(full-thickness wound)。
43.所有说明书中所揭示的发明技术特点可以任意方式组合。说明书中所揭示的每一技术特点可以相同、等同或相似目的的其他方式替换。因此,除非另有特别说明,文中所有揭示的特点均只是等同或相似特点的一般实例。
44.相信本技术领域的人员可根据以上描述,使本发明充分的利用,而无需进一步详尽说明。以下所举实施例仅作为范例,并非用于限制本发明。本文所引用的公开数据,皆以文献方式并入于本发明中。
45.【实施例】
46.1.含有胶原蛋白及透明质酸的组织胶体中的干细胞存活度
47.从人类足月胎盘(full-term human placentas)获得的绒毛膜绒毛(chorionic villi),经由机械方式切碎后,以胶原蛋白酶处理,而得到含有胎盘间叶干细胞的材料。该含有胎盘间叶干细胞的材料分别依序由孔径为300μm、100μm、37μm的筛网过筛,然后以percoll密度梯度离心法(percoll density gradient centrifugation)收集干细胞。将该干细胞悬浮于内含有2倍低量葡萄糖且添加有20%胎牛血清以及200u/ml紫菌素(gentamycin)的dmem培养基(购自gibco brl,life technologies)中,使其浓度为10
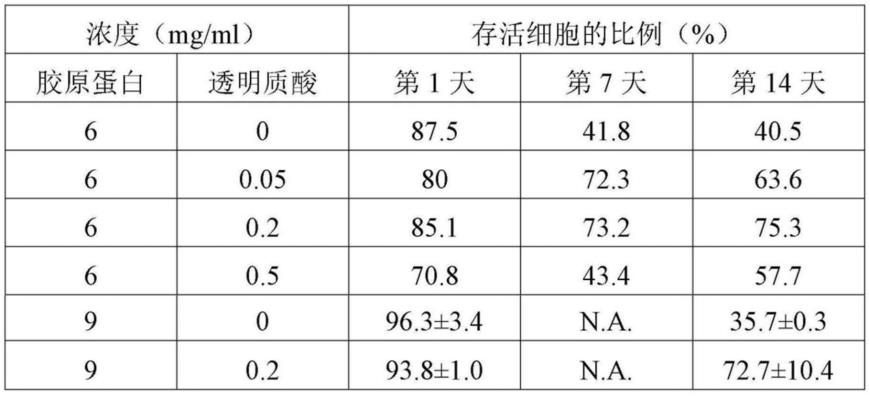
5-107细胞/每毫升,并以不同量的透明质酸混合以形成悬浮液。将自猪皮中取得的胶原蛋白溶解于0.0ln盐酸溶液中形成具有ph4-7的胶原蛋白溶液。该胶原蛋白溶液与该干细胞悬浮液以相等体积混合形成混合溶液,该混合溶液可含有6mg/ml的胶原蛋白以及0.05mg/ml、0.2mg/ml或0.5mg/ml的透明质酸,或者含有9mg/ml胶原蛋白以及0.2mg/ml透明质酸。实验过程中使用具有等量干细胞数目且分别含有6mg/ml以及9mg/ml胶原蛋白的混合溶液作为对照组。上述混合溶液均置于37℃的培养箱培养30min,使其内部的胶原蛋白开始进行固化,以形成内嵌干细胞的组织胶体。该组织胶体于37℃下且流通有5%二氧化碳的环境中进行培养,所需培养天数最多14天。通过锥蓝染色法(trypan blue staining)于不同时间(如培养第1、7、14天)测量其细胞存活度,测试结果如下表一所示。
48.表一、在含有胶原蛋白及透明质酸的组织胶体中,干细胞存活度的结果比较表
49.50.由表一可知,对于维持干细胞于该组织胶体中生长时的存活度,胶原蛋白与透明质酸在该组织胶体的重量比例是极为重要的。
51.2.含有胶原蛋白、透明质酸及明胶的组织胶体中的干细胞存活度
52.将实施例1所述的干细胞悬浮液及胶原蛋白溶液以等体积比例混合,并于混合液中加入2mg/ml或10mg/ml的明胶以形成内嵌干细胞的组织胶体,其中胶原蛋白、透明质酸及明胶的最终浓度如表二所示。
53.该组织胶体于37℃下且流通有5%二氧化碳的环境中进行培养,所需培养天数最多14天。接着采用锥蓝染色法(trypan blue staining)于不同时间(如培养第1、7及14天)测量其细胞存活度,测试结果如下表二所示。
54.表二、含胶原蛋白、透明质酸及明胶的组织胶体中干细胞存活度的结果比较表
[0055][0056]
3.含胶原蛋白及透明质酸的组织胶体对细胞生长的影响
[0057]
已知以1.3%的二甲基亚砜(dmso)活化hl-60细胞7天,会使该细胞类似于活化的人类嗜中性球,具有cd11b及cd32的表现。因此在本实施例中,使用活化的hl-60细胞来研究细胞组织胶体对嗜中性球生长的影响。在96孔盘中,将每孔加入1
×
104活化的hl-60细胞,并培养于含有各种细胞组织胶体的rpmi1640培养基中。培养不同时间的细胞生长状况如图1a,其中实验组1为含有50mg/ml胶原蛋白及0.5mg/ml透明质酸(即胶原蛋白与透明质酸比为100:1),实验组2为含有50mg/ml胶原蛋白及1mg/ml透明质酸(即胶原蛋白与透明质酸比为50:1),实验组3为含有50mg/ml胶原蛋白及5mg/ml透明质酸(即胶原蛋白与透明质酸比为10:1),实验组4为含有50mg/ml胶原蛋白及10mg/ml透明质酸(即胶原蛋白与透明质酸比为5:1),实验组5为含有50mg/ml胶原蛋白及50mg/ml透明质酸(即胶原蛋白与透明质酸比为1:1),实验组6为含有10mg/ml胶原蛋白及1mg/ml透明质酸(即胶原蛋白与透明质酸比为10:1),实验组7为含有10mg/ml胶原蛋白及10mg/ml透明质酸(即胶原蛋白与透明质酸比为1:1),实验组8为含有10mg/ml胶原蛋白及50mg/ml透明质酸(即胶原蛋白与透明质酸比为0.2:1),实验组9为含有10mg/ml胶原蛋白及100mg/ml透明质酸(即胶原蛋白与透明质酸比为0.1:1)。
[0058]
已知小鼠巨噬细胞株raw264.7会表现巨噬细胞f4/80,因此可用来研究细胞组织胶体对巨噬细胞生长的影响。在96孔盘中,将每孔加入3
×
103raw 264.7细胞,并培养于含有各种细胞组织胶体的dmem-10%fbs培养基,培养不同时间细胞生长状况如图1b,图1b中实验组1-9细胞组织胶体的胶原蛋白与透明质酸的含量与图1a中各组细胞组织胶体中胶原蛋白与透明质酸的含量相同。
[0059]
nih-3t3纤维母细胞可代表组织基质层的细胞,因此使用nih-3t3纤维母细胞研究细胞组织胶体对纤维母细胞生长的影响。在96孔盘中,将每孔加入2
×
103nih-3t3纤维母细胞,并培养于含有各种细胞组织胶体的dmem-10%fbs培养基,培养不同时间细胞生长状况如图1c,图中实验组1-9细胞组织胶体的胶原蛋白与透明质酸的含量与图1a中各组细胞组织胶体中胶原蛋白与透明质酸的含量相同。上述细胞在含有5%co2的37℃培养箱中培养3至5天后,将细胞离心、破碎以露出细胞核,并以hoechst 33258进行染色。接着在365nm及460nm下,用spectramax m2e multi-mode microplate侦测仪侦测荧光强度,该荧光强度与细胞数量成正比。
[0060]
试验结果显示,在长时间下,即第5天以后,细胞胶体中的透明质酸会稍微地抑制嗜中性球的增生,然而对巨噬细胞皆没有显著影响。此外,含不同比例的胶原蛋白与透明质酸的细胞组织胶体,皆可在第3天及第5天促进纤维母细胞的增生。此结果表明细胞组织胶体对于偒口愈合的过程中具有正向影响。
[0061]
4.含胶原蛋白及透明质酸的组织胶体对发炎细胞生长的影响
[0062]
为了分析组织胶体中的透明质酸对于人类嗜中性球及巨噬细胞的生长影响,因此分别使用活化的hl-60细胞及u937细胞进行分析。其中人类前骨髓性hl-60细胞(human promyelocytic hl-60cells)在dmso处理7天后具有嗜中性球的特征,而u937细胞经一些可溶性物质的刺激而成熟及分化,使其具有巨噬细胞的形态和特征。
[0063]
在24孔盘中,将含有不同比例的胶原蛋白及透明质酸的细胞组织胶体分别添加至1mm硅环的中间。然后将活化的hl-60细胞及u937细胞分别置于硅环的外侧。当细胞组织胶体凝胶化且细胞贴附后,将硅环移除,使细胞能穿过1mm的直径,朝向细胞组织胶体移动。在第1、3、5天,将细胞组织胶体以4%三聚甲醛进行固定,接着使用dapi以免疫荧光法进行细胞核染色,再利用全景扫描显微镜计算细胞数。
[0064]
如图2a与图2b,其中控制组为含50mg/ml胶原蛋白的细胞组织胶体,实验组10为含50mg/ml胶原蛋白和5mg/ml phorbol myristate acetate(pma)的细胞组织胶体,实验组11为含50mg/ml胶原蛋白和5mg/ml透明质酸的细胞组织胶体。实验结果证明含有透明质酸的细胞组织胶体在早期可促进嗜中性球和巨噬细胞移动。由此可知,含透明质酸的细胞组织胶体对于促进偒口愈合的过程具有正向影响。
[0065]
5.透明质酸的趋化作用
[0066]
在本实施例中,使用3μm膜孔的boyden腔室来分析透明质酸对人类嗜中性球的趋化作用。将每孔含有1
×
105活化的hl-60细胞置于上腔,并将10nm fmlp(formyl-meth ionyl-leucyl-phenylalanine;f-met-leu-phe)或1mg/ml不同分子量的透明质酸置于下腔。
[0067]
另外,使用5μm膜孔的boyden腔室来分析透明质酸对巨噬细胞的趋化作用。将每孔含有5
×
105raw 264.7细胞置于上腔,并将1μg/ml脂多糖(lipopolysaccharide,lps)或
1mg/ml不同分子量的透明质酸置于下腔。
[0068]
细胞培养4或6小时后,以4%三聚甲醛(paraformaldehyde)将细胞固定于膜上,并以棉花棒分离之。利用dapi将细胞进行染色,并以光学显微镜进行定量。
[0069]
如图3a、图3b,实验结果显示不同分子量的透明质酸对于活化的嗜中性球具有显著的趋化作用。分子量大于780kda的透明质酸可吸引细胞移动。由于嗜中性球在清洁伤口上扮演很重要的角色,这些实验结果显示含有透明质酸的细胞组织胶体对于伤口愈合具有正向效果。
[0070]
6.透明质酸对tgf-β1、tgf-β2及tgf-β3的影响
[0071]
活化的hl-60细胞培养于含有不同分子量及浓度的透明质酸(ha)的rpmi培养基中。在培养3天后,使用适当的引子(primer)及探针(probe)以实时聚合酶链锁反应(quantitative real time polymerase chain reaction)分析tgf-β1、tgf-β2及tgf-β3的mrna表现(表达),其中mrna的相对表现量(表达量)是以gapdh(glyceraldehyde 3-phosphate dehydrogenase))的表现来进行标准化。roche universal probe library system用于专一性的侦测每个基因的表现,而t-test用来进行显著性分析。
[0072]
如图4,与控制组的表现(表达)量相比,向下调控以#表示,向上调控则以*表示,其中#为p《0.05、##为p《0.005、###为p《0.001,*为p《0.05、**为p《0.005、***为p《0.001。实验结果显示在透明质酸的存在下,会抑制嗜中性球表达tgf-β1,并促进tgf-β3的表现。已有文献(shah m,foreman d,ferguson m.,j cell sci 1995;108:985-1002)指出,在皮肤伤口中,中和tgf-β1与tgf-β2的表现或增加tgf-β3的表现,不仅可促进新皮(neodermis)建构,且可减少疤痕的生成。实验结果显示本发明含透明质酸的细胞组织胶体具有较佳的愈合效果并能降低疤痕的产生。
[0073]
7.细胞组织胶体对伤口愈合的影响
[0074]
建立老鼠皮肤创伤模型,其中将直径8mm的o型环缝于厚度6mm的环状伤口外,以避免伤口缩合。此模型的优点是,再上皮化(re-epithelialization)及肉芽组织的形成会参与其中,使伤口愈合形式较接近于人类皮肤的伤口愈合,而不仅是囓齿类动物在伤口愈合过程中具有高度收缩。
[0075]
在fvb老鼠的背部皮肤上产生4个伤口。除了控制组(开放式伤口)外,在各伤口处植入不同配方的细胞组织胶体,其中胶原蛋白组为含39.5mg/ml的胶原蛋白,透明质酸组为含35mg/ml的透明质酸,实验组12为含39.5mg/ml的胶原蛋白及3mg/ml的透明质酸,实验组13为含39.5mg/ml的胶原蛋白及20mg/ml的透明质酸,本实施例中所使用的透明质酸皆为1500kda。所有伤口均贴上医疗用敷料以防止感染。每2至3天观察伤口愈合情形,并描绘伤口边缘,结果如图5a。在伤口愈合过程中,各时间点的伤口大小用image j软件计算之,结果如图5b。
[0076]
如图5b所示,在第6天时,未处理的伤口(即控制组),有78%的面积仍未愈合,而伤口在经由含有胶原蛋白及透明质酸的细胞组织胶体处理后(即实验组12和实验组13),仅小于40%的面积未愈合。此结果显示细胞组织胶体可加速小鼠全层伤口的愈合(full-thickness skin wounds)。
[0077]
伤口处理后的第1个月及第2个月结束时,从中取出新的组织进行组织学分析,如图6a、图6b,其中控制组为未经任何处理的开放式伤口,胶原蛋白组为含39.5mg/ml的胶原
蛋白,透明质酸组为含35mg/ml的透明质酸,实验组12为含39.5mg/ml的胶原蛋白及3mg/ml的透明质酸。实验结果证实,经细胞组织胶体处理后的伤口,在第1个月(图6a)结束前可恢复成全厚度基质层,且在第2月(图6b)结束时所增生的组织与周边正常皮肤非常类似,含胶原蛋白与透明质酸的细胞组织胶体对于伤口的基质层(stromal layer)恢复结果与仅含透明质酸的细胞组织胶体或含胶原蛋白的细胞组织胶体非常不同。
[0078]
8.细胞组织胶体对糖尿病患者伤口愈合的影响
[0079]
将fvb老鼠连续5天于腹腔中注射低剂量(50mg/kg)的链脲佐菌素(streptozotocin,stz),用以诱发小鼠发生糖尿病。于一周后,若连续2天皆能侦测到小鼠的血糖高于250mg/dl,即定义为糖尿病小鼠。
[0080]
所有的动物试验皆已获得实验动物照护及使用委员会(institutional animal care and use committee)的同意。于小鼠背部皮肤产生直径6mm的全层伤口,并将直径8mm的o型环缝于伤口外,以避免伤口过度收缩。将伤口用不同组成的细胞组织胶体处理后,贴上医疗用敷料以防止伤口感染。在伤口愈合过程中,各时间点的伤口大小用imagej软件计算,结果如图7a、图7b,其中控制组为未经任何处理的开放式伤口,实验组13为含50mg/ml胶原蛋白、5mg/ml透明质酸与4mg/ml新霉素(neomycin),实验组14为含37.4mg/ml胶原蛋白与35mg/ml透明质酸。
[0081]
由实验结果显示,控制组的正常皮肤需13天的愈合时间,而在糖尿病小鼠的6mm伤口,其愈合时间需要1个月。在糖尿病小鼠的伤口植入不同组成的细胞组织胶体(含20mg/ml或50mg/ml胶原蛋白及1、5、10、20、30或50mg/ml透明质酸)后,于第18天至第25天可观察愈合情形。此外,若植入进一步含有维生物b及维生素c的细胞组织胶体,糖尿病小鼠的伤口在第12天至第20天有愈合现象,显示具有加快伤口愈合的功效。
[0082]
9.细胞组织胶体对于猪伤口愈合的影响
[0083]
猪伤口以矩阵模式显示,用以观察细胞组织胶体对猪伤口愈合的影响。在此实施例中,使用2个月大的兰屿猪,且所有的研究皆已获得实验动物照护及使用委员会的同意。
[0084]
请如图8所示,在猪的侧面或背部产生至少20个全层伤口并于伤口中分别加入各种不同组成的细胞组织胶体,用于分析细胞组织胶体对猪伤口愈合的影响。所有的伤口皆贴上医疗用敷料以防止伤口感染。于每2至3天观察猪伤口愈合情形,并描绘伤口边缘。在伤口愈合过程中,各时间点的伤口大小用image j软件计算。
[0085]
在产生伤口后第3天,可在皮下脂肪层观察到纤维母细胞,但其细胞数目并不多,且在各伤口之间并无明显差异。在产生伤口后第5天,纤维母细胞增生并朝向肉芽组织移动。尽管在第5天,纤维母细胞与各伤口的上皮层距离仍很远,但纤维母细胞的数量与其移动距离皆与细胞组织胶体的透明质酸含量成正比,结果如表三。
[0086]
表三、含不同组成的细胞组织胶体的伤口中纤维母细胞的数量及其与肉芽组织的距离
[0087][0088]
在猪伤口植入表三中各组别的细胞组织胶体后,于第18天可观察到皮肤增生的现象,如图9,图中所有的伤口皆被新生的上皮细胞所包覆,为了后续伤口愈合,在各矩形伤口中的肉芽组织被移除,即为图中黑色区域。相较于控制组,各种组成的细胞组织胶体皆可促进猪伤口愈合形成。
[0089]
如图10a,其中实验组20是含40mg/ml胶原蛋白、4mg/ml新霉素,以及加入作为赋形剂的卵磷脂和甘油,实验组21是含40mg/ml胶原蛋白、5mg/ml透明质酸、4mg/ml新霉素,以及加入作为赋形剂的卵磷脂和甘油,在植入细胞组织胶体后第2个月,与控制组(具有开放式伤口)相比,实验组21具有良好的愈合效果,其与正常组的皮肤相似。值得注意的是,在植入细胞组织胶体后第6个月,伤口的上皮细胞层,其厚度及组织学特征皆与正常皮肤相似,如图10b。细胞外基质的结构,包括胶原纤维和弹力蛋白,以及在基质层内细胞的数量及分布皆与正常皮肤类似。
[0090]
此外,各种组成的细胞组织胶体对于伤口愈合的效果亦藉由在猪伤口的矩阵模式中进行分析。各种细胞组织胶体的组成包括:实验组22为含68mg/ml胶原蛋白、5mg/ml透明质酸及4mg/ml新霉素;实验组23为含35mg/ml胶原蛋白、3mg/ml透明质酸及4mg/ml新霉素,
以及加入作为赋形剂的卵磷脂和甘油;实验组24为含35mg/ml胶原蛋白、20mg/ml透明质酸及4mg/ml新霉素,以及加入作为赋形剂的卵磷脂和甘油;实验组25为含35mg/ml胶原蛋白、10mg/ml透明质酸及4mg/ml新霉素,以及加入作为赋形剂的卵磷脂和甘油;实验组26为含35mg/ml胶原蛋白与5mg/ml透明质酸及4mg/ml新霉素,以及加入作为赋形剂的卵磷脂和甘油。
[0091]
从伤口的中心切开,以获得伤口的横切片,该横切片包括相邻未受伤害的皮肤和深层的肌肉组织,接着以福尔马林缓冲溶液固定并以石蜡包埋。接着以苏木精-伊红(hematoxylin and eosin)将切片进行染色,并透过光学显微镜观察。进一步以masson's and verhoff's进行染色,用来分析新基质(neomtrix)的再生、组织结构和弹性纤维的形成,以评估愈合的效果。
[0092]
请参考图11,其中含卵磷脂和甘油的细胞组织胶体为实验组23-26的代表示意图。在植入细胞组织胶体后6个月,实验组23-26的新基质结构与正常组的皮肤没有显著的差异,然而控制组(开放式伤口)有较细的胶原纤维,此与正常组的皮肤比较有明显差异。
[0093]
若伤口为浅层的皮肤伤口,所添加的赋形剂,能让细胞组织胶体像乳液一样,使肌肤平滑。而在实验组22-26中,其伤口愈合结果在组织学上没有显著的差异。
[0094]
10.浅层皮肤伤口
[0095]
为了分析细胞组织胶体对于浅层皮肤伤口的愈合效果,将以下成分与赋形剂混合,成分包括:30mg/ml胶原蛋白、1500kda不同浓度(5、10、20、30mg/ml)的透明质酸、含有或不含有维生素、含有或不含有生长因子的(5、10、20、30mg/ml),以及抗生素(如4mg/ml新霉素),或抗微生物肽(如pexiganan或其衍生物),以制备含不同成分的细胞组织胶体。举例来说,将上述细胞组织胶体的成分与甘油及卵磷脂混合后,将ph值调整使其介于弱酸性至中性,持续搅拌直到均匀的胶体形成为止。当细胞组织凝胶施于皮肤上时,该凝胶能附着在皮肤表面。
[0096]
当该细胞组织胶体施用于全层伤口时,所添加的赋形剂不会促进愈合的速度,但可使伤口维持在一湿润且含油的状态。此种配方的细胞组织胶体适合局部伤口或第1期的伤口愈合,如表四。
[0097]
表四、含各种赋形剂的细胞组织胶体对伤口愈合的影响
[0098][0099]
11.干细胞的增生
[0100]
将源自胎盘的间叶干细胞(placenta derived mesenchymal stem cells)与含胶
原蛋白或含透明质酸的细胞组织胶体一起培养。如图12a、图12b所示,随着处理天数的增加,含胶原蛋白的细胞组织胶体及含透明质酸的细胞组织胶体皆有利于干细胞的增生,此外,细胞组织胶体中透明质酸的含量增加亦显示能促进干细胞的增生。由此实验结果显示,细胞组织胶体有助于细胞生长,并且可应用于再生医学领域中。
[0101]
12.其它实施例
[0102]
本发明所揭露的所有特征可以以任何结合方式实现。本发明所揭露的每一个特征可以用相同、均等或具有相似目的的取代物所取代。因此,除非有明确的指定,否则所揭露的每一个特征仅只是一个种类的均等物或具相似特征的一实施例而已。
[0103]
本领域所属技术人员,将可轻易由本发明所揭露的内容中了解到本发明的特征,且在不偏离本发明的精神与范围下,当可在此进行各种改变、取代以及修正,使其能适应各种条件及用途。因此,其他实施例亦落于本发明权利要求书所要求保护的范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。